Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Одноканальный анализ и Кальций изображений в подоцитов в Свежевыделенные клубочков
В этой статье
Резюме
Changes in the intracellular calcium levels in the podocytes are one of the most important means to control the filtration function of glomeruli. Here we explain a high-throughput approach that allows detection of real-time calcium handling and single ion channels activity in the podocytes of the freshly isolated glomeruli.
Аннотация
Podocytes (renal glomerular epithelial cells) are known to regulate glomerular permeability and maintain glomerular structure; a key role for these cells in the pathogenesis of various renal diseases has been established since podocyte injury leads to proteinuria and foot process effacement. It was previously reported that various endogenous agents may cause a dramatic overload in intracellular Ca2+ concentration in podocytes, presumably leading to albuminuria, and this likely occurs via calcium-conducting ion channels. Therefore, it appeared important to study calcium handling in the podocytes both under normal conditions and in various pathological states. However, available experimental approaches have remained somewhat limited to cultured and transfected cells. Although they represent a good basic model for such studies, they are essentially extracted from the native environment of the glomerulus. Here we describe the methodology of studying podocytes as a part of the freshly isolated whole glomerulus. This preparation retains the functional potential of the podocytes, which are still attached to the capillaries; therefore, podocytes remain in the environment that conserves the major parts of the glomeruli filtration apparatus. The present manuscript elaborates on two experimental approaches that allow 1) real-time detection of calcium concentration changes with the help of ratiometric confocal fluorescence microscopy, and 2) the recording of the single ion channels activity in the podocytes of the freshly isolated glomeruli. These methodologies utilize the advantages of the native environment of the glomerulus that enable researchers to resolve acute changes in the intracellular calcium handling in response to applications of various agents, measure basal concentration of calcium within the cells (for instance, to evaluate disease progression), and assess and manipulate calcium conductance at the level of single ion channels.
Введение
Почки поддержания гомеостаза баланс для различных веществ и регулируют объем крови таким образом, что определяет общую кровяное давление. Нарушения в почечной фильтрации, реабсорбции или секреции приводят к или сопровождают патологические состояния, начиная от гипер- или гипотензии, чтобы терминальной стадией почечной недостаточности, что в конечном итоге требует трансплантации почки. Почечная блок фильтрации (клубочек) состоит из трех слоев - капиллярный эндотелий, базальной мембраны и одного слоя клеток эпителиальных клеток - подоцитов, которые играют важную роль в поддержании щелевой диафрагмой целостности и функции 1. Дисфункция в полупроницаемую клубочковой фильтра вызывает недержание потери макромолекул, таких как протеинурия. Различные агенты могут повлиять на структуру подоцитов и их процессов стопы, которые определяют целостность клубочки фильтрационного барьера.
Подоцитов участвуют в поддержании гломеeruli функция фильтрации. Было установлено, что неправильное обращение кальция в подоцита приводит к повреждения клеток и играет важную роль в прогрессировании различных форм нефропатии 2,3. Таким образом, разработка модели, которая позволяет для прямого измерения внутриклеточных изменений концентрации кальция будет способствовать для изучения функции подоцитов. Изолированные клубочки ранее использовались в течение многих исследований, включая измерения альбумина коэффициента отражения изменения 4 и оценку интегральных клеточных токов в электрофизиологических измерений 5,6 патч-зажим цельноклеточных. В настоящей работе мы описываем протокол, который позволяет исследователю измерять внутриклеточные изменения концентрации кальция в ответ на применения фармакологических агентов, оценить уровень базальной кальция внутри клеток, а также оценить деятельность индивидуального кальциевых каналов. Ratometric измерения концентрации кальция и патч-зажим electrophysiology были использованы для определения изменения внутриклеточной концентрации кальция внутри подоцита и канала активности, соответственно.
протокол
Использование и благосостояния животных следует придерживаться в Руководстве NIH по уходу и использованию лабораторных животных после протоколов, рассмотренных и утвержденных по уходу и использованию комитета Институциональная животных (IACUC) по.
1. Почки Флеш
- Использование 8 до 12 недельных самцов крыс (предложенный является штамм Sprague Dawley, однако другие штаммы разного возраста и пола можно использовать с соответствующими изменениями).
- Обезболить животное в соответствии с процедурой, разрешенной протоколом IACUC; контролировать глубину анестезии и осмотрите животное. Подробное описание операции должны быть выполнены в 1,3 - 1,8, можно найти в Ilatovskaya др 7.
- После надлежащего анестезии, поместите животное на контролируемой температурой хирургическом столе, сделать срединный разрез брюшной полости (до 3 дюймов в длину), и раскрыть полую вену и аорту.
- Вставьте лигатуры вокруг целиакией и верхней брыжеечной артерий и брюшнойаорты выше тех,; не перевязывать.
- Блант рассекать брюшной аорты ниже почечных артерий, и поместите две лигатуры вокруг него, но не перевязывать, то зажать выше лигатур аорты и связать нижнюю нить.
- Катетер в аорту с трубки из полиэтилена PE50 (прилагается к шприцевой насос, заполненный PBS) ниже зажима и закрепить катетер со второй лигатуры; снять хомут, включить насос и перевязывать аорты и мезентериальные с целиакией артерии. Быстро сделать разрез в почечной вене, чтобы облегчить давление.
- Настаивать аорты с заранее охлажденным PBS в течение 2 или 3 мин со скоростью 6 мл / мин.
- Стоп перфузии, акциз и decapsulate 7 почки, и положить их на льду в решении PBS. Эвтаназии животное в соответствии с протоколом, утвержденным IACUC.
2. Выделение Крыса клубочков
- Подготовка 30 мл свежего раствора 5% BSA в среде RPMI 1640.
- Использование лезвие бритвы и ножницы,изолировать кору обеих почек, а затем пропустить через мясорубку не до однородной консистенции. Эта процедура была описана ранее 7.
- Нажмите ткани фарш на предыдущем этапе через 100 меш из нержавеющей стали (предварительно вымоченные в 5% БСА / раствор RPMI) с помощью шпателя. Соберите проточный и силы тяжести позволяет проточный, чтобы пройти через 140 меш.
- Фильтр проточные полученная от 140 меш, используя предварительно пропитанной 200 меш, отбросить фильтрата, и мыть верхнюю часть сито с 10 - 15 мл приготовленного раствора БСА / RPMI для сбора клубочков, что осадка на сито.
- Поместите раствор БСА / RPMI, содержащей клубочков на льду в 15 мл пробирку и пусть клубочков осадок на дне пробирки в течение 20 мин. Клубочки концентрат на дне пробирки будет хорошо видно. Удалить избыток раствора, оставляя приблизительно 2 мл в трубке.
3. Одноканальный патч-зажим Эльectrophysiology
- Подготовьте 5 х 5 мм покрытие стеклянных осколков путем нанесения их с МВт 70,000 - 150,000 поли-ʟ-лизина, и дайте высохнуть. Используйте примерно 30 мкл 0,01% стерильной отфильтрованной раствор в воде за покровного стекла.
- Разминка экспериментальные решения РТ и заполнить патч-зажим камеру и пипетки. Для мониторинга TRPC каналов, использовать раствор ванны, мм: 126 NaCl, CaCl 2 1, 10 HEPES, 2 MgCl 2, 10 глюкозы, рН 7,4; Пипетка: 126 NaCl, CaCl 2, 1,5, 10 HEPES, 10 глюкозы; рН 7,4.
- Добавить ингибиторы пипетки раствор, чтобы блокировать активность эндогенных каналов, которые не имеют отношение к исследований (рекомендуются: 100 мкМ нифлумовую кислоты или DIDS (блокировать Са 2+ -активированную Cl - каналов), 10 мМ TEA (ингибировать большой проводимостью Са 2 + - зависимой К + каналов), 10 нМ iberiotoxin (блокировать Са 2+ -активированную К + каналы), 10 мкМ никардипин (блокировать N-типа Ca2+ каналы)) непосредственно перед экспериментом патч-зажим.
- Аккуратно перемешайте клубочков раствор, содержащий, а затем применить примерно 50 мкл этом поли-ʟ-лизин покрытием крышки стеклянных осколков. Пусть клубочки приложить примерно 5 мин.
- Перемещение стеклянных осколков с клубочков к патч-зажим камеры предварительно заполнены раствор бани; заливать в камеру со скоростью 3 мл / мин в течение 1 мин, чтобы обеспечить удаление неприкрепленной клубочков.
- Провести эксперимент обычный патч-зажим в режиме клеточной прилагается 7. Со стеклянной пипетки (7 - 10 МОм сопротивления пипетки) образуют с высоким сопротивлением уплотнение между пипеткой и подоцитов мембраны путем легкого всасывания (пипетки, прикрепленный к подоцита на поверхности изолированного клубочка показано на рисунке 2, на слева).
- Для измерений клеточных-присоединены, нижних частот токов на частоте 300 Гц с помощью фильтра восемь полюсов Бесселя.
- USE изолированы клубочки в патч-зажим для экспериментов до 4 - 6 часов. Держите фондового клубочков фракции на льду.
4. Логометрический конфокальной флуоресцентной Измерения внутриклеточной концентрации кальция в подоцитов
- Поместите 500 мкл клубочков фракции (описано в 2.5) в 0,5 мл коническую трубку и добавить кальция красители Фура красный, AM и Fluo-4, AM. Использование 1 мМ исходный концентрации Fura Red, AM и Fluo-4, AM, соответственно (хранить при -20 ° C, растворенного в ДМСО) 2 мм и и использовать 2,5 мкл каждого красителя в течение 500 мкл фракции клубочков. Сразу же после добавления красителей охватывает трубу с алюминиевой фольгой.
- Место труб на вращающемся шейкере в течение по крайней мере 20 мин до 1 ч при комнатной температуре.
Примечание: Фармакологические агенты могут быть добавлены на этой стадии. - Подготовьте покровные стекла, покрывают их поли-ʟ-лизина и дать высохнуть при помощи нагретой пластины набор до 70 ° С.
- После того, как загрузка красителей кальция завершенае, применять 100 мкл клубочков, содержащих решение покровные покрытием поли-ʟ-лизин и пусть прилипает к поверхности примерно на 5 мин. Установите клубочков-прикреплен покровные в камере формирования изображения, и заливать раствором ванны (содержащий (в мМ): 145 NaCl, 4,5 KCl, 2 MgCl 2, 10 HEPES, рН 7,35) со скоростью 3 мл / мин для удаления незакрепленные клубочки и остальные красители.
- Установка конфокальной лазерной сканирующей микроскопии на длине волны возбуждения 488 нм и эмиссии фильтров (525/25 и 650/25 нм для Fluo-4 и Fura Red, соответственно). Установите программное обеспечение визуализации на нужную частоту и разрешение.
- Найти клубочков в светлое, а затем включите обнаружения сигнала флуоресценции. Регулировка интенсивности лазера для каждого красителя, чтобы избежать насыщения сигнала. Выбрать фокальной плоскости с подоцитах которые непосредственно присоединенными к стеклу. Это сводит к минимуму эффект, вызванный сжатием клубочка в ответ на лекарстваприменение. Дважды проверьте, что клубочек выбора правильно приложен к стеклу;
- Начните визуализации фокальной плоскости выбора (принимать 512 х 512 изображений с частотой, установленной на 4 сек для визуализации быстрый Ca 2+ переходные изменения. Используйте 60X / NA 1.4 или аналогичный объектив для изображения высокого разрешения), применяются препараты, представляющие интерес, и записать ответ.
- Выбирают желаемую фокальной плоскости (как можно ближе к поверхности стекла, как это возможно, чтобы обеспечить визуализацию подоцитах на поверхности клубочка). Проверьте интенсивность флуоресценции на Fluo4 и FuraRed каналов, и убедитесь, что клубочек четко видно в светлое.
- Начните изображений. Перед применением любых лекарственных средств, запись по крайней мере, 1 мин базовой флуоресценции, чтобы убедиться, что сигнал является стабильным (нет резких пиков или угасание сигнала).
- Применение желаемых препаратов с помощью микропипетки; будьте осторожны и убедитесь, препарат был в состоянии диффузного хорошо и достичь glomerулус. Смешайте раствор ванны осторожно, при необходимости, контролировать выбранный фокальной плоскости и убедитесь, что он не двигался в фокусе из-за применения препарата.
- Запишите изменения в интенсивности флуоресценции для сигналов Fluo4 и FuraRed. Убедитесь, что записи достаточно долго, по дожидаясь сигнала не достигнет уровня плато или достигает пика, а затем возвращается к исходному. Выполнение изменения решение или добавление каких-либо других лекарственных средств, если это необходимо.
- Остановить запись и сохранить файл в родном формате программного обеспечения.
5. Анализ изображения для измерения кальция
- Выполнить анализ изображения с ImageJ программного обеспечения с открытым оснащенный технический модуль Н.Д., что позволяет импортировать изображения в родном формате ND2.
- Импорт последовательность изображений; убедитесь, что разделить каналы и использовать режим HyperStack в оттенках серого.
- Следуйте Analyze → Инструменты → ROI менеджер путь в программном обеспечении ImageJ к оручка окно менеджера ROI. Выберите несколько регионов интереса (подоцитов), используя овальную инструмент отбора и "Добавить (T)" функцию в диспетчере ROI. В качестве последнего ROI, выберите область в фоновом режиме; сохранить выбранные трансформирования (Подробнее → Сохранить).
- Выделите окно, содержащее выбранный канал для анализов. Используйте Подробнее → Многофункциональный Мера в диспетчере ROI, отметьте "одна строка за кусочком" окно в диалоге, который появляется, а затем нажмите кнопку ОК. Результаты будут показаны в формате, который может быть установлен в окне результатов: войти в меню опций результатов измерений → Установить, выберите "Mean серый значение" и вычислить значения интенсивности пикселей для каждого ROI, который будет отображаться в Окно результатов в отдельных столбцах для каждого ROI.
- Скопируйте измеренные значения интенсивности ROI для каждого канала (Fluo-4 и Фура красный) в предпочтительном программного обеспечения для анализа данных; вычитать значения интенсивности фона от каждой DATточка.
- Для каждого момента времени рассчитать отношение интенсивностей Fluo-4 Фура Red каналов. Участок разброс / линии точка времени изменения Са 2+ переходного для каждого ROI. Рассчитать значения Среднее / SE для выбранных клубочков.
Примечание: колонка Время должно быть установлено в соответствии с частотой изображения, выбранного в 4,5.
6. Концентрация внутриклеточного кальция Расчеты Использование Fluo-4 флуоресценции сигнал
- Возьмите образец клубочков и выполнять экспериментальный протокол до шага 4.7. После записи фоновой флуоресценции добавить Ionomycin (конечная концентрация в ванне камеры должен быть не менее 10 мкМ) в растворе ванны, и увеличение интенсивности флуоресценции записи. После того, как интенсивность достигает своего максимума и спада начинается, добавить MnCl 2 (конечная концентрация должна быть 5 мм), чтобы погасить флуоресценции 8.
- Анализ полученных в 6.1 данные. Скопируйте значения интенсивности ROI Fluo-4 сигнал, полученный попротоколу, описанному в 5.1 - 5.5 от предпочтительного программного обеспечения для анализа.
- Рассчитать внутриклеточной концентрации кальция (в нМ) в подоцита соответствующей ROI, используя формулу:
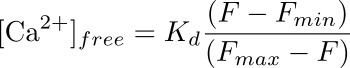
где К д является предварительно определяется константа диссоциации Fluo-4 (345 нМ), F является интенсивность в временной точки, что вы расчета концентрации кальция для (базового) и F мин и макс F являются значения интенсивности на точка максимальной нагрузки кальция (после Ionomycin приложения) и после тушения флуоресценции (с MnCl 2), соответственно (рисунок 3).
Результаты
Здесь мы обращались к проблеме измерения острых изменений в уровнях кальция в подоцитов. Рисунок 1 показывает схематическое представление экспериментальной протокол, предназначенный для того, чтобы выполнить высокое разрешение жить конфокальной микроскопии флуоресценции ?...
Обсуждение
Описанный здесь подход позволяет проводить анализ обработки кальция подоцитов грызуна клубочков. Этот метод позволяет применение патч-зажим электрофизиологии одного канала и флуоресценции пропорциональный конфокальной микроскопии. Тем не менее, оба подхода могут быть использованы...
Раскрытие информации
Авторы не имеют ничего раскрывать.
Благодарности
Авторы хотели бы поблагодарить Глена Slocum (Медицинский колледж штата Висконсин) и Колин А. Lavin (Nikon Instruments, Inc.) за отличную техническую помощь с микроскопии экспериментов. Григорий Бласс признается критического корректуры рукописи. Это исследование было поддержано Национальными Институтами Здоровья грантов HL108880 и Американской Диабетической Ассоциации предоставить 1-15-BS-172 (как), и Бен J. Липс исследовательский грант от Американского общества нефрологии (для DVI).
Материалы
| Name | Company | Catalog Number | Comments |
| Fluo4 AM | Life Technologies | F14217 | 500 µl in DMSO |
| FuraRed AM | Life Technologies | F-3020 | |
| Poly-ʟ-lysine | Sigma-Aldrich | P4707 | |
| Pluronic acid | Sigma-Aldrich | F-68 | solution |
| Ionomycin | Sigma-Aldrich | I3909-1ML | |
| Tube rotator | Miltenyi Biotec GmbH | 130-090-753 | Germany |
| Nikon confocal microscope (inverted) | Nikon | Nikon A1R | Laser exitation 488 nm. Emission filters 500-550 nm and 570-620 nm |
| Objective | Nikon | Plan Apo 60x/NA 1.4 Oil | |
| Cover Glass | Thermo Scientific | 6661B52 | |
| High vacuum grease | Dow Corning | Silicone Compound | |
| Software | Nikon | Nikon NIS-Elements | |
| Recording/perfusion chamber | Warner Instruments | RC-26 | |
| Patch clamp amplifier | Molecular Devices | MultiClamp 700B | |
| Data acquisition system | Molecular Devices | Digidata 1440A | Axon Digidata® System |
| Low pass filter | Warner Instruments | LPF-8 | 8 pole Bessel |
| Borosilicate glass capillaries | World Precision Instruments | 1B150F-4 | |
| Micropipette puller | Sutter Instrument Co | P-97 | Flaming/Brown type micropipette puller |
| Microforge | Narishige | MF-830 | Japan |
| Motorized micromanipulator | Sutter Instrument Co | MP-225 | |
| Inverted microscope | Nikon | Eclipse Ti | |
| Microvibration isolation table | TMC | equipped with Faraday cage | |
| Multichannel valve perfusion system | AutoMake Scientific | Valve Bank II | |
| Recording/perfusion chamber | Warner Instruments | RC-26 | |
| Software | Molecular Devices | pClamp 10.2 | |
| Nicardipine | Sigma-Aldrich | N7510 | |
| Iberiotoxin | Sigma | I5904-5UG | |
| Niflumic acid | Sigma-Aldrich | N0630 | |
| DIDS | Sigma-Aldrich | D3514-25MG | |
| TEA chloride | Tocris | T2265 | |
| RPMI 1640 | Life Technologies | 11835030 | without antibiotics |
| BSA | Sigma-Aldrich | A8327 | 30% albumin solution |
| Temperature controlled surgical table | MCW core | for rodents | |
| Steel sieves: | #100 (150 μm), 140 (106 μm) | ||
| Gilson, Inc SIEVE 3 SS FH NO200 | Fisher Sci | 50-871-316 | |
| Gilson, Inc SIEVE 3 SS FH NO270 | Fisher Sci | 50-871-318 | |
| Gilson, Inc SIEVE 3 SS FH NO400 | Fisher Sci | 50-871-320 | |
| mesh 200 | Sigma-Aldrich | s4145 | screen for CD-1 |
| Binocular microscope | Nikon | Eclipse TS100 | |
| Binocular microscope | Nikon | SMZ745 | |
| Syringe pump-based perfusion system | Harvard Apparatus | ||
| Polyethylene tubing | Sigma-Aldrich | PE50 | |
| Isofluorane anesthesia |  VetEquip, Inc. VetEquip, Inc. | 911103 | |
| Other basic reagents | Sigma-Aldrich |
Ссылки
- Machuca, E., Benoit, G., Antignac, C. Genetics of nephrotic syndrome: connecting molecular genetics to podocyte physiology. Hum. Mol. Genet. 18, R185-R194 (2009).
- Haraldsson, B., Nystrom, J., Deen, W. M. Properties of the glomerular barrier and mechanisms of proteinuria. Physiol. Rev. 88, 451-487 (2008).
- Patrakka, J., Tryggvason, K. New insights into the role of podocytes in proteinuria. Nat. Rev. Nephrol. 5, 463-468 (2009).
- Savin, V. J., Sharma, R., Lovell, H. B., Welling, D. J. Measurement of albumin reflection coefficient with isolated rat glomeruli. J. Am. Soc. Nephrol. 3, 1260-1269 (1992).
- Gloy, J., et al. Angiotensin II depolarizes podocytes in the intact glomerulus of the Rat. J. Clin. Invest. 99, 2772-2781 (1997).
- Nitschke, R., et al. Angiotensin II increases the intracellular calcium activity in podocytes of the intact glomerulus. Kidney Int. 57, 41-49 (2000).
- Ilatovskaya, D., Staruschenko, A. Single-channel analysis of TRPC channels in the podocytes of freshly isolated glomeruli. Methods Mol Biol. 998, 355-369 (2013).
- Snitsarev, V. A., McNulty, T. J., Taylor, C. W. Endogenous heavy metal ions perturb fura-2 measurements of basal and hormone-evoked Ca2+ signals. Biophys. J. 71, 1048-1056 (1996).
- Fukuda, A., Fujimoto, S., Iwatsubo, S., Kawachi, H., Kitamura, K. Effects of mineralocorticoid and angiotensin II receptor blockers on proteinuria and glomerular podocyte protein expression in a model of minimal change nephrotic syndrome. Nephrology (Carlton). 15, 321-326 (2010).
- Abramowitz, J., Birnbaumer, L. Physiology and pathophysiology of canonical transient receptor potential channels). FASEB J. 23, 297-328 (2009).
- Heeringa, S. F., et al. A novel TRPC6 mutation that causes childhood FSGS. PLoS ONE. 4, e7771 (2009).
- Zhang, X., Song, Z., Guo, Y., Zhou, M. The novel role of TRPC6 in vitamin D ameliorating podocyte injury in STZ-induced diabetic rats. Mol. Cell. Biochem. 399, 155-165 (2015).
- Bohrer, M. P., et al. Mechanisms of the puromycin-induced defects in the transglomerular passage of water and macromolecules. J. Clin. Invest. 60, 152-161 (1977).
- Olson, J. L., Rennke, H. G., Venkatachalam, M. A. Alterations in the charge and size selectivity barrier of the glomerular filter in aminonucleoside nephrosis in rats. Lab. Invest. 44, 271-279 (1981).
- Schiessl, I. M., Castrop, H. Angiotensin II AT2 receptor activation attenuates AT1 receptor-induced increases in the glomerular filtration of albumin: a multiphoton microscopy study. Am J Physiol Renal Physiol. 305, F1189-F1200 (2013).
- Ilatovskaya, D. V., Levchenko, V., Ryan, R. P., Cowley, A. W., Staruschenko, A. NSAIDs acutely inhibit TRPC channels in freshly isolated rat glomeruli. Biochem. Biophys. Res. Commun. 408, 242-247 (2011).
- Peti-Peterdi, J. Calcium wave of tubuloglomerular feedback. Am. J. Physiol. Renal Physiol. 291, F473-F480 (2006).
- Peti-Peterdi, J., Warnock, D. G., Bell, P. D. Angiotensin II directly stimulates ENaC activity in the cortical collecting duct via AT(1) receptors. J. Am. Soc. Nephrol. 13, 1131-1135 (2002).
- Ilatovskaya, D. V., Palygin, O., Levchenko, V., Staruschenko, A. Pharmacological characterization of the P2 receptors profile in the podocytes of the freshly isolated rat glomeruli. Am. J. Physiol. Cell Physiol. 305, C1050-C1059 (2013).
- Ilatovskaya, D. V., et al. Angiotensin II has acute effects on TRPC6 channels in podocytes of freshly isolated glomeruli. Kidney Int. 305, C1050-C1059 (2014).
- Schaldecker, T., et al. Inhibition of the TRPC5 ion channel protects the kidney filter. J. Clin. Invest. 123, 5298-5309 (2013).
- Roshanravan, H., Dryer, S. E. ATP acting through P2Y receptors causes activation of podocyte TRPC6 channels: role of podocin and reactive oxygen species. Am. J. Physiol. Renal Physiol. 306, F1088-F1097 (2014).
- Anderson, M., Roshanravan, H., Khine, J., Dryer, S. E. Angiotensin II activation of TRPC6 channels in rat podocytes requires generation of reactive oxygen species. J. Cell. Physiol. 229, 434-442 (2014).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены