Method Article
Методы Именно локализованного передачи ячеек или ДНК в начале постимплантационных эмбрионов мыши
В этой статье
Резюме
We demonstrate a method for grafting cultured cells into defined sites of early mouse embryos to determine their in vivo potential. We also introduce an optimized electroporation method that uses glass capillaries of known diameter, allowing the precise delivery of exogenous DNA into a few cells in the embryos.
Аннотация
Манипуляция и культура ранних эмбрионов мыши является мощным еще в значительной степени малоиспользуемых технологии повышения стоимости данной модели системы. С другой стороны, культура клеток была широко используется в развитии исследований биологии. Тем не менее, важно, чтобы определить, является ли действительно в пробирке культивируемые клетки представляют в естественных типов клеток. Прививка клетки в эмбрионы, а затем в соответствии с оценкой их вклада в процессе разработки является полезным методом для определения потенциала в пробирке, культивируемых клеток. В этом исследовании мы опишем метод пересадки клеток в определенной сайте эмбрионов мыши в начале постимплантационных, а затем экс естественных условиях культуры. Введем также оптимизированную методом электропорации, который использует стеклянные капилляры известного диаметра, что позволяет точную локализацию и регулировку количества клеток, получающих экзогенной ДНК с обоих высокой эффективности трансфекции и низкой клеточной смерти. Эти методы, которые не требуют каких-либо зрecialized оборудование, оказывают экспериментальные манипуляции с гаструляцией и раннего органогенеза стадии эмбриона мыши возможного, позволяя анализ обязательств в культивируемых клеточных субпопуляций и эффект генетических манипуляций на месте на клеточную дифференциацию.
Введение
Клеточные культуры были широко использованы в развитии исследований биологии. Эмбриональные стволовые клетки мыши (ЭСК) и эпибласта стволовые клетки (EpiSCs) могут дифференцироваться во все три зародышевых листка в пробирке и являются полезной моделью для дифференцировки клеток в раннем эмбриогенезе млекопитающих. Вывод из этих клеточных линий открыло возможность для манипуляций в пробирке и детального исследования локализованы сигнализации событий и транскрипционных сетей, работающих в начале эмбрионального паттерна. Тем не менее, он по-прежнему важно определить актуальность в естественных условиях любых манипуляций, выполняемых в культуре. Потенциал в естественных условиях из эмбриональных предимплантационных полученных ЭСК мыши была оценена путем введения их обратно в эмбрионы предимплантационных (морул или бластоцисты) 1. Тем не менее, EpiSCs, которые представляют эпибласта клеток в эмбрионы постимплантационных не могут интегрироваться эффективно предимплантационных эмбрионов 2,3. Наша Previoнам данные показали, что EpiSCs может эффективно генерировать химер и способствовать всем зародышевых листков, при прививке в постимплантационных эмбрионов 4. Таким образом, лучший способ оценить в пробирке культивируемые клетки, чтобы ввести их в соответствующей среде в естественных условиях.
Электропорация является широко используемым методом, чтобы доставить экзогенных молекул в клетках-мишенях в как в естественных условиях и в пробирке эксперименты. Электрическая энергия может генерировать большое количество пор в клеточной мембране, которая позволяет экзогенный дезоксирибонуклеиновой кислоты (ДНК) или рибонуклеиновой кислоты (РНК), чтобы проникать в клетки. Один из самых больших проблем для этой техники заключается в объединении оптимальную жизнеспособность клеток с высоким КПД electrotransfection 5,6. Для электропорации нуклеиновых кислот в эмбриональных тканях, позолоченный электроды обычно используются, позволяя нацеливание клеток в широком диапазоне пространственных 7-9. Для достижения более Locaванный перенос генов, игольчатой формы электродов была использована для достижения фокусное электрическое поле 10,11. С помощью этого метода, авторы показали, что после электропорации, около 30-60 клетки заняли ДНК-конструкции 11. Тем не менее, кажется, что точно регулируя количество электропорации клеток остается сложной с фиксированной шириной электрода. Методика капиллярной электропорации был использован для доставки плазмид одиночных клеток 12-14. Однако этот метод не применялся для электропорации плазмиды эмбрионов исключая виво. Совсем недавно, Микроприбор, как сообщается, на месте электропорации несколько дистальных висцеральных клеток энтодермы (менее 4 клеток) в начале постимплантационных мышиных эмбрионов 15. Тем не менее, он по-прежнему неизвестно, будет ли это устройство может эффективно целевых эктодермы и мезодермы экс естественных условиях.
В этом исследовании мы описываем два новых методов для оценки клеточного и генной функции в начале постаимплантация эмбрионов. Сначала показывают, как привить в пробирке культивируемые клетки в определенных участках в ранних эмбрионов мыши, чтобы оценить их потенциал в естественных условиях. Интеграция трансплантированных клеток и их потомков, все помечены генетической метки (например, зеленый флуоресцентный белок (GFP), могут быть дополнительно рассмотрены иммунным тканей специфических белков 4. Во-вторых, мы опишем усовершенствованный способ точно поставить ДНК чтобы локализованных в эмбрионе через электропорации. Вместо того чтобы использовать игольчатую электрод, мы вставили тонкую проволоку внутри остроконечного стеклянного капилляра, а также продемонстрировать, что эта модификация может предоставлять ДНК в небольшом количестве клеток с высокой эффективностью и ограниченным гибель клеток. Кроме того, мы показываем, что с помощью стеклянных капилляров с различными размерами открытия, мы можем контролировать количество электропорации клеток. Таким образом, мы считаем, этот метод может быть очень полезным для изучения раннего эмбрионального паттерна с участием небольшого числа оF клеток.
протокол
Все эксперименты на животных были проведены в соответствии с МВД Великобритании правил, как указано в животных (научные процедуры) Закон (1986) в рамках проекта Лицензия числа 60/4435. Для сбора эмбрионов на определенных этапах развития, приуроченные вязки были созданы O / N. Полдень на день нахождения вагинального вилку был назначен день эмбрионального (E) 0.5.
1. Пройдя E7.5 E8.5 или постимплантационных эмбрионов для Ex Vivo культуры
- Жертвоприношение беременных самок мышей путем смещения шейных позвонков.
- Изолировать матку с помощью ножниц, держа его щипцами, и поместить в 30 мм блюдо, наполненный M2 среды.
- Осторожно разорвать миометрия, используя две пары тонких щипцов.
- Очистите от децидуальной, будучи осторожны, чтобы не проколоть внеэмбриональной полостей.
- Удалить мембрану REICHERT путем щипать ее щипцами и медленно отделяя ее от эмбриона.
- Проверьте эмбрионов при вскрытииСтереомикроскоп чтобы убедиться, что желточный мешок, амнион и ectoplacental конус целы.
- Трансфер эмбрионов в чистую чашку М2 с помощью пипетки и место на 30 мм пластиковой чашке Петри крышкой на льду в (в 'фразу платформу "), чтобы частично охлажденные эмбрионов.
- При необходимости, магазин эмбрионов в М2 на ледяной платформы для до 1,5 ч., Например, во время подготовки медиа или манипуляции небольших партий ~ 3-4 эмбрионов при комнатной температуре.
Примечание: Восстановление и рассечение эмбрионов грызунов была подробно описана ранее 7,8,16.
2. Подготовка эмбриона культуральной среде
- Свежий оттаивать либо коммерчески доступный крысиной сыворотки (см Гланвилл-Джонс и др. 13 по характеристикам), или крысиной сыворотки готовили в доме в соответствии с Copp и Кокрофтом 16, который был прогретой инактивированной в течение 30 мин при 56 ° С и замораживали в 1 мл аликвоты при -80 ° С
Примечание: Коммерчески доступный крыс сыворотка является приемлемым для культурно периоды 24-36 часов, хотя в сыворотке, полученных в доме есть, по нашему опыту, превосходный для культуры периоды до 48 часов. - Свежий подготовить избыток (например., 10 мл), определенных добавок, состоящих из Глазго минимальная поддерживающая среда (GMEM), 1% заменимых аминокислот (NEAA), 2 мМ L-глутамина и 1 мМ пирувата натрия.
- Рассчитать объем культуральной среды, необходимой в соответствии с количеством эмбрионов каждой стадии, которые будут культивировать (см раздел 3). Смешайте крысиной сыворотки с определенными добавками, чтобы составить 50% культуральной среды (1: 1 (объем / объем) сыворотки крыс: определенные добавки) и / или 75% культуральной среды (3: 1 (объем / объем) сыворотки крыс: определяется добавки).
- Пропускают эмбриона культуральной среды через фильтр 0,45 мкм и добавить 10000 МЕ / мл пенициллина и 10 мкг / мл стрептомицина.
Примечание: Только что оттаивают L-глутамина и пирувата натрия имеет решающее значение для развития эмбриона во время экс естественных условиях культуры.
- Для E7.5 эмбрионов: статического культуры с использованием 4-луночные планшеты в инкубаторе с 5 подаваемой% CO 2 в воздухе при 37 ° С в течение 24 ч. Культура до двух эмбрионов на лунку в 1 мл 50% культуральной среды.
- Для E8.5 эмбрионов: использовать устройство 8 культуры вращения валика на 35 об / мин включающий непрерывную газовыделение с 5% CO 2 в воздухе при 37 ° С в течение 24 ч (1 мл 50% культуральной среды на эмбрион).
- Для эмбрионов Е9.5: использовать устройство роликового культуры вращается 35 об / мин включающий газы, поставляемые с 5% CO 2, 40% O 2 55% N 2 при 37 ° С в течение 24 ч (1 мл 75% культуральной среды на эмбрион).
Примечание: эмбрионы культуры в 3 ч после эвтаназии мышей, как длительных периодов М2 негативно влияют на развитие. См Копп и Кокрофту 16 для метода экс естественных условиях культивирования эмбрионов.
4. Graftinг культивируемых клеток в E7.5 E8.5 или эмбрионов мыши
- Физически очистить EpiSCs, которые повсеместно выражают GFP, из культуры пластины 6-а, используя пипетки с 20-200 мкл и поместите их в 30 мм блюдо с эмбрионов
Примечание: Для вставки скопления клеток в эмбрионы, клетки должны быть физически слом, а не трипсином. - Приложите руку вытащил прививки капилляр для аспиратора трубки, чтобы сделать рот пипеткой.
- Аккуратно сосать рот пипеткой, чтобы привлечь одного или нескольких скопления клеток размером> 20 клеток в прививки капилляра.
- Осторожно продуть клетки, частично разогнать большие сгустки.
- Выберите один сотовый комок, содержащий ~ 10-20 клеток и сосать в прививки капилляра снова, держа его близко к открытию капилляра. Будьте осторожны, чтобы не переместить клеток комок и из капилляра неоднократно, чтобы избежать распада на более мелкие куски.
- Держите эмбриона свободно в месте с парой щипцов и вставьте прививкикапиллярная в области, представляющей интерес, чтобы создать отверстие.
- Аккуратно изгнать комок из пластики капилляра, оставив короткую строку 10-20 клеток поданных в зародыше.
- Повторите процедуру прививки нужного количества эмбрионов. Используйте командные размеры 3-4 эмбрионов для удобства.
- Оставив эмбрионов в то же блюдо М2 среды, образа привитые эмбрионов с использованием флуоресцентного микроскопа рассекает соединение с камерой, сохраняя время визуализации к минимуму, чтобы избежать воздействия эмбрионов чрезмерного света и тепла.
Примечание: Определить раз изображений эмпирически, поскольку они будут зависеть от характеристик камеры и микроскопа, а также интенсивности флуоресценции природы и флуорофора. - Передача эмбриона в pastette с минимальным объемом M2 среде с предварительно уравновешенную культуральной среды (раздел 3) сразу же после визуализации.
Примечание: Внимательно изучить морфологию зародышей после прививки. Только Культура INTACт эмбрионов.
5. Ручная Электропорация Материалы и устройство установки (подготовить следующие заранее экспериментах электропорации):
- Для ДНК пипеток инъекций: потяните пипетки ДНК инъекции с использованием горизонтального микропипетки съемник. Инъекционные пипетки должны иметь тонкий наконечник с отверстием менее 10 мкм, чтобы избежать повреждения ткани при инъекции ДНК в эмбриональных полостей.
- Для стеклянной капиллярной электропорации: использовать microforge сократить открытие инъекции ДНК пипеток с внутренним диаметром 20 или 30 мкм. Чтобы избежать повреждения клеток, когда капиллярная находится в контакте с зародыша для электропорации, верхушка стеклянного капилляра должна быть чисто разрезано и не содержат острых, сломанные ребра.
- Для ручной капиллярной электрода (анода) (рисунок 1): вставьте 0,2 мм Диаметр проволоки платины в качестве электропорации стеклянного капилляра с фиксированным отверстием 20 или 30 мкм диаметром сосредоточиться избранныхRIC тока и доставить ДНК плазмиды в небольшой области интереса в зародыше.
- Для ручной L-образный электрода (катода) (рисунок 1): согнуть 0,2 мм Диаметр платиновой проволоки Создание "L" форму, с горизонтальной части "L" около 1 мм в длину.
- Прикрепите каждый платинового электрода с тонкой изолированного провода и вставьте его в держатель иглы микроинъекции, покрытой изоляционной лентой.
- Установите держатели игл на стандартных держателей микроманипуляция прибора.
- Подключите цепь, как показано на рисунке 1: подключение капилляров электрод к аноду источника питания; подключить L-образный электрод к аноду мультиметра; подключения катод mulimeter к катоду источника питания.
6. Электропорация E7.5 E8.5 или эмбрионов мыши
- Заполните электропорации стеклянный капилляр с PBS в пределах 1-2 мм в верхней и вставьте ес'иGHT платиновый электрод (анод) в стеклянного капилляра, пока он не достигнет дна капилляра.
- Якорь Г-образный электрода (катода) на поверхности 30 мм чашки Петри, заполненную PBS.
- Передача эмбриона от М2 среды в PBS, заполненной электропорации блюдо.
- Вставьте иглу от боковой эпибласта в амниотической полости эмбриона. Использование пневматического пико насос, вводят раствор ДНК (pCAG-Cre: GFP или pCAG-GFP 1-1,5 мкг / мл с 0,01% зеленый пищевой краситель краситель) в полость, пока он не будет полностью заполнен. Для эмбрионов E7.5 E8.5-, ДНК-раствор менее чем 5 мкл требуется для одного эмбриона. Использование зеленого красителя в качестве индикатора, будьте осторожны, чтобы не лопнуть эмбрион.
- Осторожно установите эмбриона между электродами и перемещать капиллярную электрод к точному положению, где ДНК должны быть доставлены.
Примечание: Ориентация эмбриона зависит от региона, где ДНК должна быть электропорации. - Electropoоценивают с помощью эмбрион 200 вольт (В) в 6 импульсов, каждый из 50 мс с интервалом в 1 сек между импульсами.
- Передача эмбриона немедленно, предварительно уравновешенную культуральную среду после электропорации. При желании, повторить процесс для следующего эмбриона.
Примечание: Добавить культуральной среды в стерильный контейнер и поместить его в инкубатор культуры предварительно равновесие среды. - Для обнаружения электропорации клетки 2 ч после культивирования, трансфер эмбрионов на чистую 30 мм чашки Петри М2 среды с использованием pastette. Изображение эмбрионы как в шаге 5,9 использованием флуоресцентного микроскопа рассекает соединение.
- Трансфер эмбрионов обратно в культуре с использованием pastette сразу после съемки.
- Для обнаружения мертвых клеток, вызванных электропорации, окрасить эмбрионов с дальним красным клеточной мембраны, непроницаемый ядерного красителя (1: 200 в среде для культивирования эмбрионов) при 37 ° С в течение 10 мин 2 ч после электропорации (необязательно)
- Для подсчета клеток электропорации, исправить ЭмбриОС в 4% параформальдегида (PFA) в течение 2-4 ч при 4 ° С, окрашивать ядро с ультрафиолетовой или дальнего красного флуоресцентного ядерной контрастирующая и изображения эмбрионов с использованием конфокальной микроскопии (опционально).
Примечание: эмбрионального развития негативно влияет, если не слишком долго в PBS. Поэтому убедитесь, что время, необходимое для электропорации каждого эмбриона минимизируется (<5 мин на эмбрион).
Результаты
Прививка
EpiSCs, что повсеместно выражают EGFP (R04-GFP, полученный из E6.5 эпибласта и C2, полученный в пробирке из mESCs) 4 вручную соскабливают с чашки для культивирования и привиты к различным местам эмбрионов E7.5 (фиг.2А). Эмбрионы культивируют исключая виво и анализировали после 24 часов. Распределение донорских клеток оценивали с помощью флуоресцентной микроскопии. Если донорские клетки включены, они распространились и их производные разошлись в принимающих эмбрионов (Рисунок 2В). Было замечено, что трансплантаты, содержащие 10-16 клеток, включенные эффективно в принимающих эмбрионов (фиг.2А, 2В) и, тем не менее, прививки больше клеток не приводит к улучшению chimaerism. Вместо этого, привитые клетки производятся некорпоративные сгустки (рис 2С и 2D).
Электропорация
До Аssess эффективность нашей системы электропорации, мы поставили GFP-экспрессирующих плазмид (pCAG-GFP и pCAG-CRE: GFP), на определенные сайты в эмбрионе. В соответствии с предыдущим исследованием 11, GFP + клетки были обнаружены в эмбрионах 1-2 ч после электропорации (рис 2Е и 2G). При дистальных эпибласта клетки в конце первобытной стадии полоса эмбриона электропорации, меченые клетки способствовали нервной эктодермы после 24 часов в культуре (рис 2Е и 2F). Этот результат хорошо соответствует известным судьба карт эпибласта клеток в стадии гаструляции эмбрионов 17. Точно так же, когда выражение GFP плазмида была электропорации в первичной полоски на E8.5 (2-5 сомитов), GFP + клеток вклад в приосевой мезодермы (рис 2G и 2H), в соответствии с известными судьбы карт конце первичной полоски 18 , Кроме того, мы наблюдали вклад в всех трех зародышевых листков из электропорации клеток (рис 2I-K),предполагая, что процедура электропорации не ставит под угрозу поведение клеток в естественных условиях. Тем не менее, мы также заметили, что в то время эпибласта (E7.5) или первичной полоски клетки (E8.5) были направлены, некоторые клетки энтодермы также электропорации (3С и таблица 1).
Одним из основных преимуществ использования капиллярного электрода является то, что количество клеток электропорации можно контролировать, просто путем изменения диаметра его открытия. Чтобы определить количество электропорации клетки, эмбрионы были зафиксированы 2 часа после электропорации и отображается в Wholemount на конфокальной микроскопии. Количество GFP + клеток вручную пересчитать в конфокальной Z-стеки. Таблица 1 показывает, что при данном этапе, увеличение размера открытия стеклянного капилляра от 20 до 30 мкм приводит к поглощению ДНК по более ячеек. Когда один размер отверстия сравнивали между этапами (E7.5 E8.5 сравнению), больше клеток, оказались электропорации в последней стадии, Этот эффект может быть обусловлен более высокой концентрацией ДНК, присутствующей в амниотической полости в E8.5. Поскольку раствор ДНК смешивали с зеленой пищевой краситель, мы можем использовать зеленый цвет, чтобы оценить концентрацию ДНК в амниотической полости. В микроскопом, становится ясно, что, по сравнению с эмбрионами E8.5, зеленый цвет после инъекции ДНК гораздо легче в полости эмбрионов E7.5. Хотя тот же концентрации раствора ДНК вводили в E7.5 и E8.5 эмбрионов, более ДНК-раствор в амниотической полости эмбрионов E8.5, чтобы заполнить его полностью, потому что они имеют больший размер. После удаления инъекционную иглу, всегда есть некоторая степень утечки раствора ДНК из амниотической полости, а так как отверстие прокола больше по сравнению с размером полости амниона в более ранних эмбрионов, вполне вероятно, что было пропорционально больше утечка от E7.5 эмбрионов, чем E8.5, что приводит к более низкой концентрации ДНК. Различное число трансфицировалиКлетки также могут быть из-за различных диаметров или индуцированное напряжение трансмембранный (ОТВ) порогов клеток на различных стадиях.
Недостатком электропорации является ассоциированным гибель клеток. Подобно традиционным золотым покрытием или игольчатые электроды, электропорация помощью капиллярной электрод также вызывает гибель клеток. После электропорации целевой области появился более темный цвет по сравнению с соседними областями (рис 3а и 3b), указывая, что в некоторой степени гибели клеток должно иметь место в этой области. Для дальнейшего определения количества погибших клеток, вызванных процедуры электропорации, эмбрионы были окрашены флуоресцентным клеточной мембраны, непроницаемый ядерного красителя. Ядра мертвых клеток были помечены с мембраной непроницаемой дальним красным флуоресцентным красителем. Окрашивание подтвердил, что этот метод электропорации капиллярной приводит только к небольшому числу мертвых клеток вблизи электропорации месте (рис 3D и TaBLE 1).
Мы заметили, что, хотя мертвые клетки появляются в электропорации сайта, GFP + клеток и мертвых клеток также самый эксклюзивный друг от друга (рис 3е и 3f). Кроме того, когда хвостовой боковое эпибласта на E8.5 электропорации с pCAG-GFP и стеклянного капилляра открытия 20 мкм, большое количество GFP + клеток был обнаружен после 48 ч в культуре (рис 3G и 3H). Взятые вместе, эти результаты свидетельствуют о том большинство GFP + клетки обнаружены 2 ч после электропорации все еще живы в течение дальнейшего культивирования.
Мы забили количество GFP + клеток после 24 ч экс естественных условиях культуры. Шесть эмбрионов электропорации с pCAG-GFP в E7.5, с использованием капилл отверстие диаметром 20 мкм. 107 ± 31 (среднее ± SD) GFP + клеток / эмбрионов были обнаружены. Так в начале культуры (2 ч), 9 клеток подвергали электропорации в среднем за эмбриона ( Тронг> Таблица 1), это означает, что клетки прошли электропорации 3-4 раскол в 2 ч. Средняя ячейка время удвоения от E7.5 эмбрионов E8.5 около 6-7 ч во всех клетках, кроме тех, в вентральной части узелка 19,20. Это говорит о том, что процедура электропорации не мешает нормальному росту клеток.
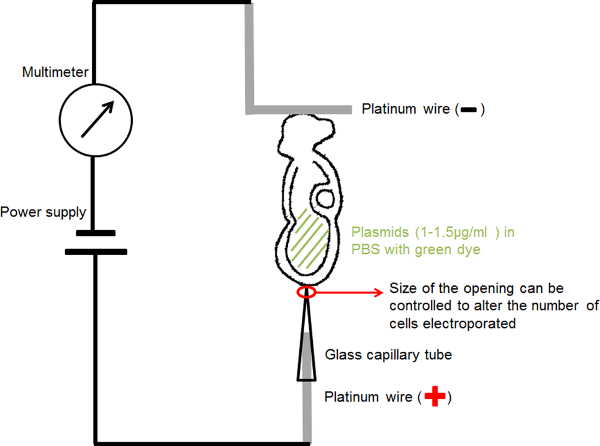
Рисунок 1. схема, показывающая настройку электропорации. Эмбрион, содержащий раствор ДНК в амниотической полости была расположена между двумя электродами. Ток при выбранных параметрах была предоставлена генератора импульсов прямоугольной формы (источника питания). Мультиметр был связан в серии, чтобы обнаружить электрический ток, проходящий эмбрион. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
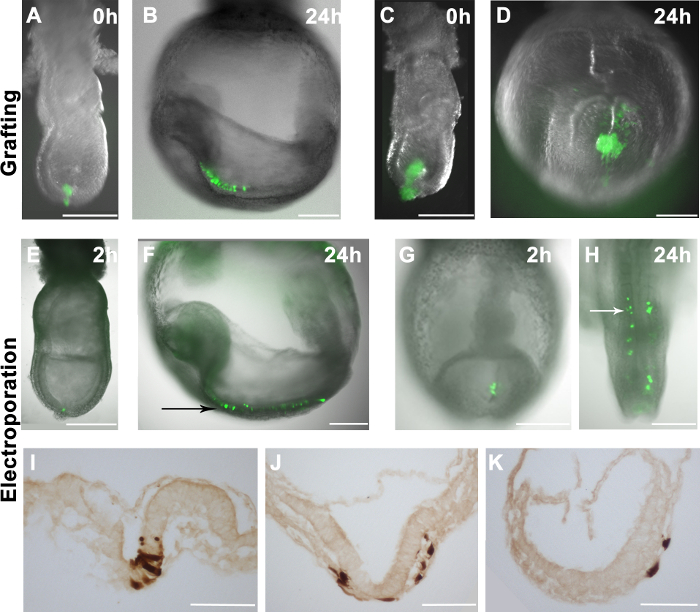
Рисунок 2. Распределение привитых или электропорации клеток в эмбрионы принимающих. (AH) флуоресценции GFP накладки (зеленый) на Светлое изображений Wholemount эмбрионов (в градациях серого) (а) 10-16 GFP + EpiSCs были привиты в дистальной области поздно -streak стадии эмбриона. (C) больше скопление GFP + EpiSCs был привит в дистальной области сценического середине полоса эмбриона. (В и D) распределение EpiSCs клеток, полученных (зеленый) в принимающих эмбрионов (как показано на А и С), после 24 ч в культуре. (B) GFP + клетки, диспергированные в принимающей эмбриона, предполагая правильный интеграции донорских клеток. (D) Прививка крупные скопления клеток в результате формирования комков некорпоративной в принимающей эмбриона. (ЕК) pCAG-Cre: GFP плазмиды эле ctroporated в конкретных областях эмбрионов дикого типа. Электропорации дистальной части раннего эмбриона почек стадии (E) или примитивной полосой 2-5 сомитов стадии эмбриона (G) в результате GFP + клеток в этих регионах 2 ч после процедуры. (F и Н) Распределение GFP + клеток в принимающих эмбрионов через 24 часа в культуре, показывают, что электропорации клетки способствуют нейроэктодерме (черная стрелка) (F) и приосевой мезодерма (белые стрелки) (Н). (ИК) иммунное окрашивание DAB для GFP + клеток, показывающих, что электропорации клетки могут привести к нейроэктодерме (I), мезодермы (J) и эндодермы (J и К), после 24 ч в культуре. Масштабная линейка (АГ) = 250 мкм; Шкала бар (ИК) = 100 мкм. Примечание: На рисунке 1А и 1В перепечатаны с нашей предыдущей публикации 4.HREF = "https://www.jove.com/files/ftp_upload/53295/53295fig2large.jpg" целевых = "_blank"> Нажмите здесь, чтобы посмотреть большую версию этой фигуры.
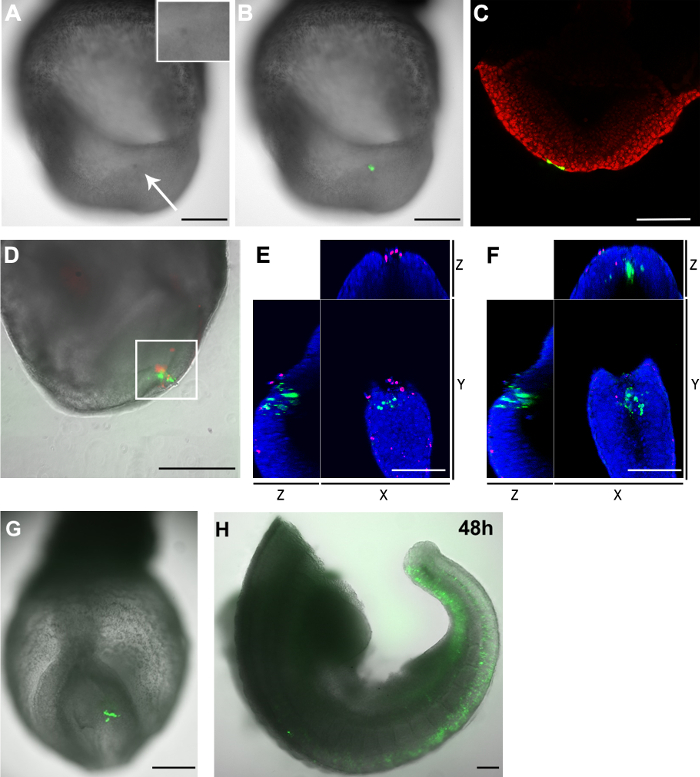
Рисунок 3. Распределение GFP + клеток и мертвых клеток у зародышей после электропорации (АС) pCAG-Cre:. GFP плазмида, электропорации в каудальных боковых эпибласта клеток с E8.5 (2-5 сомитов) эмбриона (размер отверстий капиллярной :. 20 мкм) (А) 2 ч после процедуры, целевой области показали, темный цвет (белая стрелка) по сравнению с другими частями зародыша. Вставка показывает в увеличенном масштабе электропорации области. (Б) Светлое изображение (полутоновое) покрывали зеленого флуоресцентного канала показывает электропорации клетки (зеленый). (C) конфокальной Z-среза показывают, чтодва энтодерма клетки (зеленый) и взял плазмиды, когда хвостовой боковые эпибласта клетки были направлены. Ядра клеток показаны красным (DF) pCAG-Cre:. GFP плазмиды электропорации в каудальной узла в E8.5 эмбриона (капиллярная размера открытия: 30 мкм). Эмбрион культивировали в течение 2 ч. Электропорации клетки показано на зеленый и мертвых клеток в красный цвет. (D) электропорации область содержит как GFP + клеток, а также мертвые клетки. Область, в белой коробке дополнительно анализируют в конфокальной микроскопии. Руководство подсчета Z-стека, показали, что было 33 GFP + клеток и 23 мертвых клеток в этой области. Только два клетки как положительные, так и для флуорофоров. (Е и F), XYZ вид конфокальной г-среза с белой коробочной области в D показывает GFP + клетки отдельно от мертвых клеток. Ядра показаны синим цветом (G и Н) pCAG-Cre:. GFP плазмиды электропорации в нескольких челLs в хвостовой боковой эпибласта в качестве E8.5 эмбриона (капиллярная размер открытия: 20 мкм) и отображаемого после двух (G) и 48 (H) часов экс естественных условиях культуры Примечание: (Н) Эмбрион были разорваны в двух после культуры. Регионы голова и сердце были удалены. Шкала бар (A, B, D, G и Н) = 250 мкм; Шкалы (С, Е и F) = 100 мкм. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
| Диаметр отверстия капиллярной трубки | Стадии эмбриона | Эффективность Электропорация: нет. эмбрионы, содержащие клетки GFP + через 2 часа / Всего. из электропорированные эмбрионы (нет. GFP + эмбрионы, которые развивались нормально после 24 или 48-культуры) | Среднесписочная численность GFP + клеток на эмбрион ± SD (п = нет. Обследованных эмбрионов) | КоличествоGFP + клеток на энтодермальные каждого эмбриона ± SD (п = нет. Обследованных эмбрионов) |
| 20 мкм | E7.5 (LS-LB) | 7/9 (7) | 9 ± 3 (N = 4) | 4 ± 2 (N = 4) |
| 30 мкм | E7.5 (LS-LB) | 13/15 (12) | 17 ± 2 (N = 4) | 6 ± 1 (п = 4) |
| 20 мкм | E8.5 (2-5 сомитов) | 12/13 (10) | 21 ± 4 (N = 4) | 11 ± 4 (N = 4) |
| 30 мкм | E8.5 (2-5 сомитов) | 2/2 (2) | 33 и 26 (N = 2) | 14 и 16 (N = 2) |
Таблица 1. Электропорация эффективность pCAG-Cre: GFP плазмиды в мышиных эмбрионов.
Аббревиатура: Л.С., поздняя стадия первичной полоски; LB: поздней стадии бутона. Эмбрионы устроили в соответствии сДаунс и Дэвис 12
Обсуждение
Прививка
Критический шаг для сотового прививки экспериментов является введение согласованной строки клеток в идеале в одном действии, чтобы избежать распада сгустка. Этот метод требует некоторой практики в контроле рот пипеткой. Если донорские клетки включают также в хозяине, их производные разойдутся в зародыше. Для дальнейшего определения дифференцируются дисперсной доноры производного клетки надлежащим образом в хосте, иммунное окрашивание может быть выполнено на участках эмбриона. Если донорские клетки не совместимы с принимающей среды, они либо не могут быть обнаружены (так как они исключили из эмбриона) или образовывать комки некорпоративные в эмбрионах после культуре. Если были обнаружены оба диспергированные клетки и клеточные скопления, это может означать, что слишком много клетки были привиты и чрезмерные донорские клетки, которые не могут взаимодействовать с окружающими клетками-хозяевами в результате комков формирования. В этом случае дополнительные трансплантаты, содержащиеменьшее число клеток может быть выполнена.
Основным недостатком метода клеточной прививки, что это не возможно, чтобы определить потенциал в естественных условиях клетках, поскольку мыши экс естественных условиях культуры в течение периодов дольше, чем 48 часа не были достигнуты. Однако, если в сочетании с ультразвуковым контролем инъекции клеток, то можно передать культивируемые клетки с эмбрионами в утробе. Подводя итог, эксперименты сотовые прививки были широко используется в нашей группе, и дали нам ценные подсказки о потенциале в естественных условиях различных типов клеток 4,21,22. Это методика общей полезности для оценки потенциала в естественных условиях в пробирке культуре клеток эмбрионов на ранних постимплантационных.
Электропорация
Хотя в этом исследовании мы показали только, что это эффективно использовать технику капиллярной электропорации целевой эпибласта, ят также можно преднамеренно отношении других зародышевых листков эндодермы, такие как клетки. Критический шаг для техники капиллярной электропорации является сведение к минимуму время, необходимое для электропорации каждого эмбриона (<5 мин за эмбриона), так как PBS, очень неоптимальным для ранних эмбрионов мыши. Наши данные выше, показал, что в большинстве районов эмбрионов электропорации не влияет на рост эмбриона. Тем не менее, электропорации в узле вызвало аномальное развитие и привело к преждевременной смерти эмбриона. Это, вероятно, из-за повреждения или гибели клеток, которые образуют важные центры сигнализации 23. Следовательно, эта область будет иметь, чтобы избежать с этой техникой. Еще нюанс в том, что, как указано в разделе результатов, в то время эпибласта или первичной полоски клетки были направлены, некоторые клетки энтодермы также электропорации. Это может быть потому, что ДНК достигает эндодермы через зазоры под эпибласта эпителия. Энтодермы состоит из эпителиальных клеток и в нашем опыте йESE клетки имеют более высокую склонность к поглощать ДНК. Таким образом, при применении этого метода для отображения судьба, важно оценить, какие клетки изначально взять ДНК.
Следует также отметить, что хотя pCAG-GFP и pCAG-Cre: GFP плазмиды могут быть эффективно доставлены при помощи параметров электропорации, показанные в этом исследовании, эффективность других конструкций ДНК могут различаться и должны индивидуальный оптимизации. Изменения в концентрации ДНК, электропорации напряжения или числа импульсов может быть сделано, если плазмиды оказалась трудно трансфекции.
Подводя итог, наша оптимизированная система электропорации капиллярной может эффективно и воспроизводимо доставить GFP или Cre: GFP плазмиды в очень немногих клеток в эмбрионе с ограниченной гибели клеток. Поскольку этот метод не требует дорогостоящего или узкоспециализированные оборудование, это может быть весьма полезным для отслеживания клеток исследований или в тестировании эффект эктопической экспрессии или условного удаления Oгены F в ранних эмбрионов, если электропорации выполняется в эмбрионов, несущих floxed условные мутантные аллели. Таким образом, эта методика электропорации обеспечивает полезную функциональный инструмент для понимания на основе ячейка за ячейкой роли клеточных внутренних факторов в контексте локализованы дикого типа эмбриональных средах.
Раскрытие информации
The authors have no conflicts of financial or other interest to declare.
Благодарности
We thank Filip Wymeersch and Anestis Tsakiridis for comments on the manuscript, staff in the SCRM animal unit for help with animal maintenance and Prof. Stuart Forbes for immunohistochemistry reagents. This work was supported by MRC grant Mr/K011200/1 and the China Scholarship Council
Материалы
| Name | Company | Catalog Number | Comments |
| Forceps | Dumostar | T5390 | |
| Dissecting stereomicroscope | Zeiss | Stemi 2000-C | |
| Stereomicroscope system with fluorescence | Nikon | AZ100 | |
| Inverted microscope with a digital camera | Olympus | Olympus BX61 | |
| Inverted confocal microscope | Leica Microsystems | Leica TCS SP8 | |
| Low melting point agarose | Life Technologies | 16520-050 | |
| Pasteur pipettes | Fisher Scientific | 11397863 | |
| 30mm Petri dishes | Fisher Scientific | 121V | |
| 4-well plates | Thermo scientific | 179820 | |
| M2 medium | Sigma-Aldrich | M7167 | |
| Phosphate Buffered Saline (PBS) | Life Technologies | 10010015 | |
| Paraformaldehyde (PFA) | Sigma-Aldrich | P6148 | |
| Pipettes | NICHIRYO | Nichipet | |
| tips | Greiner Bio One | 685280 | |
| Cell culture incubator | SANYO | MCO-17AIC | |
| Roller culture apparatus | BTC Engineering | ||
| Syringe filters 0.45µm, sterile | Sigma-Aldrich | 10462100 | |
| Glasgow Minimum Essential Medium (GMEM) | Sigma-Aldrich | G5154 | |
| non-essential amino acids (NEAA) | Life Technologies | 11140050 | |
| L-glutamine | Fisher Scientific | SH30549.01 | |
| Sodium pyruvate solution | Fisher Scientific | SH30239.01 | |
| Penicillin and Streptomycin 10.000UI/ml | Lonza | DE17-602E | |
| Gas Cartridge for Portable Meker Burner | COLEMAN | COLEMAN 250 | |
| Thin Wall Borosilicate Capillary Glass with Fillament, OD 1.0 mm, ID 0.78 mm | Harvard Apparatus | 640798 | |
| Aspirator tube assemblies for calibrated microcapillary pipettes | Sigma-Aldrich | A5177-5EA | |
| Flaming/Brown micropipette puller | Sutter Instrument Company | P-97 | |
| Microforge | De Fonbrune | BS030301 | |
| Pneumatic pico pump | World Precision Instruments | PV830 | |
| Microloader tips | Eppendorf | 5242956.003 | |
| ECM 830 square wave pulse generator | BTX | 45-0002 | |
| Green food coloring dye | Sigma-Aldrich | C.I. 42053 | |
| A far-red cell membrane-impermeable nuclear dye | Biotium | 40060-T | |
| pCAG-Cre:GFP | Addgene | #13776 | |
| pCAG-GFP | Addgene | #16664 | |
| Multimeter | Excel | XL830L | |
| Micromanipulators | Leitz | ||
| 0.2mm diameter platinum wire | Agar Scientific | E404-2 | |
| Anti-GFP antibody | Abcam | ab13970 | |
| Goat anti-Chicken IgY, HRP | Santa Cruz | sc-2428 | |
| Liquid DAB+ Substrate Chromogen System | Dako | K3467 | |
| 4',6-diamidino-2-phenylindole (DAPI) | Life Technologies | D21490 | |
| A far-red fluorescence nuclear counterstain | Life Technologies | T3605 |
Ссылки
- O'Hagan, A. R., Morton, R., Eid, N. Loss of asthma control in pediatric patients after discontinuation of long-acting Beta-agonists. Pulmonary med. , 894063 (2012).
- Brons, I. G., et al. Derivation of pluripotent epiblast stem cells from mammalian embryos. Nature. 448, 191-195 (2007).
- Tesar, P. J., et al. New cell lines from mouse epiblast share defining features with human embryonic stem cells. Nature. 448, 196-199 (2007).
- Huang, Y., Osorno, R., Tsakiridis, A., Wilson, V. In Vivo differentiation potential of epiblast stem cells revealed by chimeric embryo formation. Cell rep. 2, 1571-1578 (2012).
- Sadik, M. M., et al. Scaling relationship and optimization of double-pulse electroporation. Biophys. J. 106, 801-812 (2014).
- Kaestner, L., Scholz, A., Lipp, P. Conceptual and technical aspects of transfection and gene delivery. Bioorg. Med. Chem. Lett. , (2015).
- Soares, M. L., Torres-Padilla, M. E., Zernicka-Goetz, M. Bone morphogenetic protein 4 signaling regulates development of the anterior visceral endoderm in the mouse embryo. Dev. Growth Differ. 50, 615-621 (2008).
- Pierreux, C. E., Poll, A. V., Jacquemin, P., Lemaigre, F. P., Rousseau, G. G. Gene transfer into mouse prepancreatic endoderm by whole embryo electroporation. JOP. 6, 128-135 (2005).
- Falk, J., et al. Electroporation of cDNA/Morpholinos to targeted areas of embryonic CNS in Xenopus. BMC Dev. Biol. 7, 107 (2007).
- Davidson, B. P., Tsang, T. E., Khoo, P. L., Gad, J. M., Tam, P. P. Introduction of cell markers into germ layer tissues of the mouse gastrula by whole embryo electroporation. Genesis. 35, 57-62 (2003).
- Khoo, P. L., Franklin, V. J., Tam, P. P. Fate-Mapping Technique: Targeted Whole-Embryo Electroporation of DNA Constructs into the Germ Layers of Mouse Embryos 7-7.5 Days Post-coitum. CSH protocols. 2007. , pdb.prot4893 (2007).
- Tawk, M., Bianco, I. H., Clarke, J. D. Focal electroporation in zebrafish embryos and larvae. Methods Mol Biol. 546, 145-151 (2009).
- Haas, K., Jensen, K., Sin, W. C., Foa, L., Cline, H. T. Targeted electroporation in Xenopus tadpoles in vivo--from single cells to the entire brain. Differentiation. 70, 148-154 (2002).
- Nolkrantz, K., et al. Electroporation of single cells and tissues with an electrolyte-filled capillary. Anal. Chem. 73, 4469-4477 (2001).
- Mazari, E., et al. A microdevice to locally electroporate embryos with high efficiency and reduced cell damage. Development. 141, 2349-2359 (2014).
- Copp, A. J., Cockroft, D. L. . Postimplantation mammalian embryos : a practical approach. , (1990).
- Tam, P. P., Behringer, R. R. Mouse gastrulation: the formation of a mammalian body plan. Mech. Dev. 68, 3-25 (1997).
- Wilson, V., Beddington, R. S. Cell fate and morphogenetic movement in the late mouse primitive streak. Mech. Dev. 55, 79-89 (1996).
- Tzouanacou, E., Wegener, A., Wymeersch, F. J., Wilson, V., Nicolas, J. F. Redefining the progression of lineage segregations during mammalian embryogenesis by clonal analysis. Dev Cell. 17, 365-376 (2009).
- Bellomo, D., Lander, A., Harragan, I., Brown, N. A. Cell proliferation in mammalian gastrulation: the ventral node and notochord are relatively quiescent. Dev. Dynam. 205, 471-485 (1996).
- Tsakiridis, A., et al. Distinct Wnt-driven primitive streak-like populations reflect in vivo lineage precursors. Development. 141, 1209-1221 (2014).
- Gouti, M., et al. In vitro generation of neuromesodermal progenitors reveals distinct roles for wnt signalling in the specification of spinal cord and paraxial mesoderm identity. PLoS biology. 12, e1001937 (2014).
- Beddington, R. S. Induction of a second neural axis by the mouse node. Development. 120, 613-620 (1994).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены