Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Логометрический визуализации внеклеточного рН в зубных биопленок
В этой статье
Резюме
РН-чувствительный ратиометрический краситель используется в сочетании с конфокальной лазерной сканирующей микроскопии и анализа цифровых изображений для мониторинга внеклеточный рН в зубных биопленок в реальном времени.
Аннотация
РН в бактериальных биопленок на зубах имеет центральное значение для кариеса, болезни с высоким во всем мире распространенности. Питательные вещества и метаболиты не распределены равномерно в зубных биопленок. Сложное взаимодействие сорбции и реакции с органическими веществами в биопленки снижает диффузионные пути растворенных веществ и создает крутые градиенты реактивных молекул, в том числе органических кислот, через биопленку. Количественные флуоресцентные микроскопические методы, такие как флуоресценция жизни времени изображений или рН ratiometry, могут быть использованы для визуализации рН в различных микросреды зубных биопленок. рН ratiometry использует рН-зависимого сдвига в флуоресцентного излучения рН-чувствительных красителей. Расчет коэффициента эмиссии на двух различных длинах волн позволяет определить локальные значения рН в микроскопических изображений, независимо от концентрации красителя. В отличие от микроэлектродов метод позволяет осуществлять мониторинг как вертикальные, так и горизонтальные градиенты рН в реальном времени смеханически нарушая биопленки. Тем не менее, следует соблюдать осторожность, чтобы дифференцировать точно между вне- и внутриклеточным биопленки. Здесь Логометрический краситель, seminaphthorhodafluor-4F 5- (а-6) карбоновой кислоты (С-Snarf-4) используется для мониторинга внеклеточный рН в естественных условиях , выращенных в зубных биопленок неизвестного видового состава. При воздействии на глюкозу краситель вверх сосредоточено внутри всех бактериальных клеток в биопленки; она, таким образом, используется как в качестве универсального бактериального окрашивания и в качестве маркера внеклеточного рН. После того, как конфокальной микроскопического захвата изображений, бактериальная биомасса удаляется из всех изображений с помощью программного обеспечения цифрового анализа изображений, который позволяет исключительно рассчитать внеклеточного рН. рН ratiometry с логометрической красителя хорошо подходит для изучения внеклеточный рН в тонких биопленок толщиной до 75 мкм, но ограничена диапазоном рН от 4,5 до 7,0.
Введение
Описанный здесь метод позволяет осуществлять мониторинг внеклеточный рН в зубных биопленок в диапазоне от 4,5 до 7, с использованием Логометрический краситель seminaphthorhodafluor-4F 5- (а-6) карбоновой кислоты (С-Snarf-4) в сочетании с конфокальной лазерной сканирующей микроскопии и цифрового анализа изображений. Примененный флуоресцентный краситель рН-чувствительный и отображает сдвиг в его флуоресцентного излучения в зависимости от состояния протонирования. Флуоресцентное излучение протонированных пиков молекул при 580 нм, а излучение депротонированным молекулы при 640 нм 1. Отношение флуоресцентных интенсивностей излучения в двух окнах обнаружения содержит два пика излучения (576 - 608 нм и 629 - 661 нм), таким образом, отражает значение рН в жидкой фазе, независимо от концентрации красителя. С рК а ~ 6,4 краситель подходит для визуализации рН в умеренно кислой среде.
PH в бактериальных биопленок имеет центральное значение для всех метаболических процессов.В случае зубных биопленок, рН во внеклеточной матрице является ключевым фактором вирулентности для развития кариеса зубов. Длительные периоды с низким рН на границе раздела свинца биопленки зуба , чтобы замедлить деминерализации эмали подстилающей 2. Из-за сложной трехмерной архитектурой биопленок, метаболитов, в том числе органические кислоты, не распределены равномерно по всему биопленки. Высоко и менее кислотопродуцирующий микросреды могут быть найдены в непосредственной пространственной близости 3.
В течение многих десятилетий, вертикальные градиенты рН в биопленки были записаны с помощью микроэлектродов 4-6. Несмотря на то, что они предлагают хорошее пространственное разрешение из-за их небольшого размера наконечника, они не очень хорошо подходят для контроля горизонтальных градиентов. Кроме того, введение электрода нарушает биопленку механически. Количественные флуоресцентные методы микроскопии обеспечивают преимущество визуализации изменений рН в различных областях биопленки без механического интерферироватьсть. Различные микроскопические поля зрения могут быть выбраны свободно и повторно отображены в течение длительных периодов 1,7-9. Тем не менее, при интерпретации микроскопических биопленки изображений, важно проводить различие между флуоресценцией, вытекающей из микробной биомассы и флуоресценции, вытекающей из внеклеточного пространства. В кислой среде, рН внутри бактериальных клеток отличается от рН в внеклеточного матрикса, так как бактерии активно транспортируют протонов через их клеточную мембрану за счет аденозинтрифосфата 10. В контексте кариеса, внутриклеточная бактериальная рН не оказывают непосредственное влияние на нижележащих эмали, тогда как низкий внеклеточного рН приводит к деминерализации. Усреднение рН в микроскопических изображений, которые содержат как бактерии участков, свободных и бактерий приводит к ошибочным результатам. Использование других пятен наряду с рН-чувствительного красителя для визуализации бактериальной биомассы и различия между вне- и внутриклеточных областей приносит абиз - за риска флуоресцентного загрязнения внеклеточного пространства и ложных измерений 11.
Поэтому в настоящем рукопись описывает использование Логометрический красителя в двойной функции; как в качестве рН-маркера и в качестве универсального бактериального окрашивания. По мере того как краска повышающего концентрируется в бактериальных клетках, сочетание конфокальной микроскопических изображений и точная процедура анализа цифровых изображений позволяет определить внеклеточный рН в интервале между 4,5 и 7,0 в тонких зубных биопленок.
протокол
Экспериментальный протокол был рассмотрен и одобрен Комитетом по этике Орхусе County (M-20100032) путем.
1. конфокальной Микроскопические Калибровка Логометрический Dye
- Для получения изображения, используйте перевернутую конфокальной микроскопии, оснащенный инкубатор, 63X / 1.2-цифровой иммерсионный объектив апертуры воды, лазерной линии на 543 нм и META детектор.
- Подготовка HEPES буфера растворы (50 мМ, рН доводили до 4.5-8.5 с шагом 0,1 единиц рН). Пипетировать 100 мкл каждого раствора в лунки убедительную дна 96-луночный планшет для флуоресцентной микроскопии.
- Надеть нитриловые перчатки при работе с логометрические красителя C-Snarf-4. Приготовьте 1 мМ маточного раствора красителя в диметилсульфоксиде. Добавьте 5 мкл исходного раствора в каждую лунку с буфером HEPES. Поместите 96-луночного планшета на микроскопе.
- Включите микроскоп. Откройте программное обеспечение микроскопа. Нажмите на следующие панели: Приобретать → Laser; Приобретать → MICRO; Приобретать → Config; Приобретать → Scan; Приобретать → Stage. Прогреть инкубатор до 37 ° C.
- Включите лазерной линии 543 нм, нажав на 543 нм лазер, и кнопка "О" в окне "Laser Control". Выберите 63X / 1.2-числовой апертурой иммерсионный объектив воды в окне "Микроскоп Control".
- Установите детектор META для одновременного мониторинга флуоресценции в пределах 576- до 608 нм (зеленый) и 629- до 661 нм (красный) промежутки времени ( "Управление конфигурацией" → "ChS"). Регулировка мощности лазера ( "Управление конфигурацией" → "возбуждение»). Установите крошечное отверстие, чтобы получить оптическую толщину среза 1,6 мкм ( "Контроль сканирования" → "Пинхол").
- Приобретать изображение каждого буферного раствора Hepes, 5 мкм над стеклянным дном 96-луночного планшета. Примечание: Как только плоскость фокусировки находится под стеклянным дном, не флуоресцентный свет можно увидетьна экране. После каждого третьего изображения, установите мощность лазера до нуля и принимать изображение для вычитания фона.
- Выполните калибровку эксперимента в трех экземплярах (1,2-1,7).
- Определить среднюю интенсивность флуоресценции, и стандартное отклонение во всех красных и зеленых изображений.
- Вычислить отношение R и стандартная ошибка среднего значения, S R, для каждого изображения в соответствии с уравнениями (1) и (2)
(1)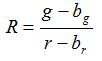
(2)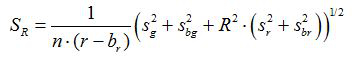
г, г, з г и s г являются средними и стандартные отклонения в соответствующих зеленых и красных изображений. б г, б г, з BG и s ш являются соответствующие значения для фоновых изображений. п 2 число пикселей отображенных. - Участок рассчитанные коэффициенты для каждого значения рН от трех калибровочных экспериментов повторности на диаграмме и построить кривую подогнанную из этой серии точек данных (т.е. с использованием программного обеспечения Sigmaplot 13). Составьте математическую функцию от подобранной кривой , которая может преобразовать отношения в значениях рН 10.
- Вычислить отношение R и стандартная ошибка среднего значения, S R, для каждого изображения в соответствии с уравнениями (1) и (2)
2. Сбор В Ситу выращены Стоматологическая биопленки Образцы
- Выберите добровольцев, которые удовлетворяют критериям включения и исключения, имеющих значение для исследования. Сделайте альгината впечатления от их верхней и нижней зубной дуги. Сделать модели, отлитые из этих впечатлений и производство акрилового щепу в нижней челюсти. Дизайн щепу с щечной акриловых фланцев , соединенных язычной ортодонтической проволоки , что позволяет доброволец вгрызаться в нормальном прикусе 12.
- Дрель спады в щечной полкам акриловой шины (Рисунок 1 ) С помощью стоматологических акриловых боров, чтобы можно было вставить стеклянных пластин для сбора биопленки. Глубина спадов должна быть не менее 1,5 мм, в то время как ширина и длина спадов может изменяться в зависимости от количества стеклянных пластин для вставки.
- Для сбора биопленки, использовать заказные нефлуоресцентной стеклянные плиты (4 х 4 х 1 мм 3) с шероховатостью поверхности зернистости 1200 для того , чтобы имитировать рисунок на колонизацию естественной эмали 11.
- Стерилизовать стеклянные плиты автоклавированием перед монтажом. Установите стеклянные плиты с липким воском в углублениях в щечной фланцах каждой стороны немного утоплена на поверхности акриловой поверхности, чтобы защитить биопленки от сдвигающих сил , оказываемого движению щеками 11.
Примечание: Количество стеклянных пластин, помещенных в рецессию может варьироваться в пределах от 3 до 14 лет, в зависимости от цели исследования. - Вставьте прибор в устье волонтера. Проинструктировать ВолынскойТир сохранить прибор интраорально в течение всего периода эксперимента. Попросите добровольца хранить прибор в ортодонтической удерживающим контейнер с куском влажной бумажной салфеткой (чтобы держать его влажным) при комнатной температуре в течение чистки зубов и приема пищи и других напитков, кроме воды. Попросите добровольца, чтобы не задеть щечной акриловые фланцы со стеклянными плитами при размещении и удалении прибора.
Примечание: Экспериментальный период может варьироваться в зависимости от цели исследования (один день до нескольких недель). - Осторожно снимите стеклянные плиты из прибора в конце экспериментального периода. Удалите липкий воск вокруг плиты с ножом и перечисляют их с пинцетом в закрытом контейнере, биопленки была обращена вверх, до микроскопического анализа. Держите контейнер влажный с влажной бумажной салфеткой. Выполните визуализацию рН в течение нескольких часов после сбора биопленки.
3. биопленки рН обработки изображений
- Подготовитьслюнной раствор путем добавления дитиотреитола к собранной слюны в соответствии с методикой де Йонга и др. 13. Титрование слюнных раствор до рН 7,0 и добавляют глюкозу в концентрации 0,4% (вес / объем). Пипетка 100 мкл на биопленки для анализа в стеклянным дном 96-луночный планшет для микроскопии. Добавьте 5 мкл Логометрический красителя на лунку.
- Поместите 96-луночного планшета на предметный столик микроскопа. Включите микроскоп и лазерной линии 543 нм. Прогреть инкубатор до 37 ° C. Используйте те же настройки микроскопа как для калибровки красителя (см шаги 1,5-1,6). Подождите в течение 30 мин, до тех пор пока 96-луночный планшет не достигнет рабочей температуры.
- Возьмите одну или несколько стеклянных пластин с тонким набором пинцетом и поместить их в слюне заполненных скважин, одну плиту на лунку, с которыми сталкивается биопленок вниз.
- Приобретать отдельных изображений ( "Control Scan" → "Single") или Z-стеки ( "Control Scan" → "Пуск") spanniнг глубину биопленок в различных областях. Для того, чтобы получить Z-стеки выбрать количество срезов, которые будут отображены ( "Контроль сканирования" → "Настройки Z" → "Num Срезы") и отметьте Z-позиции для первого и последнего среза в программном обеспечении микроскопа ( "Scan Control "→" Параметры Z "→" Марк Первый ";" Марк Last ").
Примечание: Z-стеки с глубиной до 75 мкм может быть получен с хорошим контрастом между внеклеточной и внутриклеточной областях. - Для того, чтобы следить за изменениями рН в микроскопическом поле зрения в течение долгого времени, отметьте ху-позиции в микроскоп программного обеспечения ( "Stage и фокус управления" → "Марк Pos") и взять повторные изображения в последовательные моменты времени ( "Контроль сканирования" → " Один"). Регулярно получать изображения с лазерной мощности равным нулю для вычитания фона.
4. Анализ цифрового изображения
- ЭкспоцентраР.Т. микроскопические изображения в виде TIF файлов, используйте пакетный файл экспорта микроскопа программного обеспечения ( "Macro" → "Batch File Export"). Отметьте файлы, которые нужно экспортировать и сохранить красный и зеленый канал изображения в отдельных папках как TIF-файлов ( "Start Batch Экспорт"). Переименовать файлы в обеих папках, придавая им порядковые номера.
- Импорт красный и зеленый серии изображений в программное обеспечение , такие как Daime (анализ цифровых изображений в микробной экологии) 14. Сегмент зеленые изображения каналов с индивидуально выбранными пороговыми значениями яркости (сегмент → Автоматическая сегментация → Пользовательские порогового значения). Выберите пороговые значения яркости с осторожностью (обычно между 20 и 80), так что все бактерии (ярче, чем внеклеточного матрикса), но не матрица будет признан в качестве объектов во время сегментации. Проверьте визуально, что районы, признанные как объекты хорошо соответствуют бактериальной биомассы.
- Перенести слой объекта сегментированной гReen изображения канала на соответствующие красного канала изображений (сегмент → Передача объекта слой). С помощью функции редактора объектов, чтобы отклонить и удалить все объекты красного и зеленого канала изображения. Теперь только внеклеточный матрикс остается в биопленки изображениях. Экспорт обработанного изображения в качестве серии TIF файлов.
- Импорт серии изображений в ImageJ (http://rsb.info.nih.gov/ij~~HEAD=pobj; v.1.47). Определить среднюю интенсивность флуоресценции в фоновых изображениях, полученных с помощью лазера выключен (Анализировать → Гистограмма). Вычтите соответствующий фон из красных и зеленых изображений (процесс → Math → Subtract).
- Тем не менее в ImageJ, делят зеленое изображение серии (G1) сама по себе (процесс → калькулятор изображения). Затем умножить ряд результирующего изображения (G2) с зеленой серии изображений (G1). Это приведет к серии изображений (G3), где NaN присваивается всем пикселям, принадлежащим к областям, которые были признаны в качестве объектов в Daime. Продолжайте в тон так же, как с красной серии изображений (R1 / R1 = R2; R2 х R1 = R3).
Примечание: В качестве биомассы бактерий была удалена из изображений на шаге 4.3, интенсивность флуоресценции в этих областях 0. Шаг 4.5 необходимо преобразовать значение 0 в пользу NaN, что позволяет для расчета коэффициента на этапе 4.6. - Примените фильтр "означает '(процесс → Фильтры → Среднее; радиус: 1 пиксель) для компенсации шумов детектора. Разделить зеленый серия изображения по красной серии изображений (процесс → калькулятор изображения). Это приводит к тому зеленый / красный соотношение для каждого оставшегося пикселя во внеклеточном пространстве изображений. Используйте ложную окраску для графического представления отношений в изображениях (Image → таблицы поиска). Вычислить соотношение среднего для каждого изображения (Анализировать → Гистограмма).
- Преобразование зеленый / красный отношения к значениям рН в соответствии с функцией, установленного под 1.9.2). Примечание: Пример для калибровки данных и подогнанной кривой можно увидеть в Schlafer и дрАль, 2015 11.
Результаты
Представленный метод позволяет осуществлять мониторинг внеклеточный рН падает в различных микросреды зубных биопленок в диапазоне рН от 4,5 до 7 в режиме реального времени. Если условия эксперимента выбраны, как описано выше, рН начинает падать во всех областях биопле...
Обсуждение
Микроскопический контроль биопленки рН обеспечивает ряд преимуществ, по сравнению с электродными или микроэлектродов измерений 4-6. Микроскопические методы позволяют определить рН с высоким пространственным разрешением и позволяет захватывать горизонтальные и вертикальные г?...
Раскрытие информации
Авторы не имеют ничего раскрывать.
Благодарности
Авторы хотели бы поблагодарить Хавьер Гарсиа и Е. Лене Груншер об оказании технической помощи и Мерете К. Raarup за плодотворные дискуссии. Эта работа финансировалась исследовательского фонда Университета Орхус и Simon Spies Foundation.
Материалы
| Name | Company | Catalog Number | Comments |
| Zeiss LSM 510 META | Zeiss | N/A | |
| C-Apochromat 63X water immersion objective | Zeiss | N/A | |
| XL Incubator | PeCON | N/A | |
| SNARF-4F 5-(and-6)-Carboxylic Acid | Life Technologies | S23920 | |
| Dimethyl sulfoxide | Life Technologies | D12345 | |
| HEPES | Life Technologies | 11344-041 | |
| Costar 96-well black clear-bottom plate | Fisher Scientific | 07-200-567 | |
| Custom-made glass slabs (4 x 4 x 1 mm3; 1,200 grit) | Menzel | N/A | |
| Alginate impression material | GC Corporation | N/A | |
| Acrylic Adjusting Logic Sets/set of acrylic dental burs | Axis Dental | LS-906 | |
| Orthodontic retainer containers | Spark Medical Equipment Co., Ltd | SK-WDTC01 | |
| Sticky wax | Dentsply | N/A | |
| Chewing paraffin wax | Ivoclar Vivadent AG | N/A | |
| Dithiothreitol | Sigma Aldrich | D0632 | Used during preparation of salivary solution |
| 0.45 µm and 0.2 µm syringe filters | Sigma Aldrich | CLS431220; CLS431219 | |
| daime | University of Vienna, Austria | http://dome.csb.univie.ac.at/daime | |
| ImageJ | NIH, Bethesda, Maryland, USA | http://imagej.nih.gov/ij/ |
Ссылки
- Hunter, R. C., Beveridge, T. J. Application of a pH-sensitive fluoroprobe (C-SNARF-4) for pH microenvironment analysis in Pseudomonas aeruginosa biofilms. Appl. Environ. Microbiol. 71 (5), 2501-2510 (2005).
- Takahashi, N., Nyvad, B. Caries ecology revisited: microbial dynamics and the caries process. Caries Res. 42 (6), 409-418 (2008).
- Schlafer, S., et al. pH landscapes in a novel five-species model of early dental biofilm. PLoS. One. 6 (9), e25299 (2011).
- von Ohle, O. C., et al. Real-time microsensor measurement of local metabolic activities in ex vivo dental biofilms exposed to sucrose and treated with chlorhexidine. Appl. Environ. Microbiol. 76 (7), 2326-2334 (2010).
- Revsbech, N. P. Analysis of microbial communities with electrochemical microsensors and microscale biosensors. Methods Enzymol. 397, 147-166 (2005).
- Vanhoudt, P., Lewandowski, Z., Little, B. Iridium oxide pH microelectrode. Biotechnol. Bioeng. 40 (5), 601-608 (1992).
- Franks, A. E., et al. Novel strategy for three-dimensional real-time imaging of microbial fuel cell communities: monitoring the inhibitory effects of proton accumulation within the anode biofilm. Energy & Environmental Science. 2 (1), 113-119 (2009).
- Hidalgo, G., et al. Functional tomographic fluorescence imaging of pH microenvironments in microbial biofilms by use of silica nanoparticle sensors. Appl. Environ. Microbiol. 75 (23), 7426-7435 (2009).
- Vroom, J. M., et al. Depth penetration and detection of pH gradients in biofilms by two-photon excitation microscopy. Appl. Environ. Microbiol. 65 (8), 3502-3511 (1999).
- Bender, G. R., Sutton, S. V., Marquis, R. E. Acid tolerance, proton permeabilities, and membrane ATPases of oral streptococci. Infect. Immun. 53 (2), 331-338 (1986).
- Schlafer, S., et al. Ratiometric imaging of extracellular pH in bacterial biofilms using C-SNARF-4. Appl. Environ. Microbiol. 81 (4), 1267-1273 (2015).
- Dige, I., Nilsson, H., Kilian, M., Nyvad, B. In situ identification of streptococci and other bacteria in initial dental biofilm by confocal laser scanning microscopy and fluorescence in situ hybridization. Eur. J Oral Sci. 115 (6), 459-467 (2007).
- de Jong, M. H., van der Hoeven, J. S., van OS, J. H., Olijve, J. H. Growth of oral Streptococcus species and Actinomyces viscosus in human saliva. Appl. Environ. Microbiol. 47 (5), 901-904 (1984).
- Daims, H., Lucker, S., Wagner, M. daime, a novel image analysis program for microbial ecology and biofilm research. Environ. Microbiol. 8 (2), 200-213 (2006).
- Liu, Y. L., Nascimento, M., Burne, R. A. Progress toward understanding the contribution of alkali generation in dental biofilms to inhibition of dental caries. Int. J Oral Sci. 4 (3), 135-140 (2012).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены