Method Article
Применения с одним зондом: Масс-спектрометрия и цифровой обработки изображений Single Cell Анализ в условиях окружающей среды
В этой статье
Резюме
Here, we present protocols to perform both ambient mass spectrometry imaging (MSI) of tissues and in-situ live single cell MS (SCMS) analysis using the single-probe, which is a miniaturized multifunctional device for MS analysis.
Аннотация
Mass spectrometry imaging (MSI) and in-situ single cell mass spectrometry (SCMS) analysis under ambient conditions are two emerging fields with great potential for the detailed mass spectrometry (MS) analysis of biomolecules from biological samples. The single-probe, a miniaturized device with integrated sampling and ionization capabilities, is capable of performing both ambient MSI and in-situ SCMS analysis. For ambient MSI, the single-probe uses surface micro-extraction to continually conduct MS analysis of the sample, and this technique allows the creation of MS images with high spatial resolution (8.5 µm) from biological samples such as mouse brain and kidney sections. Ambient MSI has the advantage that little to no sample preparation is needed before the analysis, which reduces the amount of potential artifacts present in data acquisition and allows a more representative analysis of the sample to be acquired. For in-situ SCMS, the single-probe tip can be directly inserted into live eukaryotic cells such as HeLa cells, due to the small sampling tip size (< 10 µm), and this technique is capable of detecting a wide range of metabolites inside individual cells at near real-time. SCMS enables a greater sensitivity and accuracy of chemical information to be acquired at the single cell level, which could improve our understanding of biological processes at a more fundamental level than previously possible. The single-probe device can be potentially coupled with a variety of mass spectrometers for broad ranges of MSI and SCMS studies.
Введение
Mass spectrometry imaging (MSI) is a relatively new molecular imaging technique to provide the spatial distribution of the compounds of interest on surfaces. During the MSI analysis, mass spectrometry (MS) measurements are recorded across the surface on an individual pixel basis to create a 2D image of the species of interest 1. MSI techniques have the ability to provide a spatially resolved feature distribution for a large range of metabolites, allowing a much greater amount of information to be obtained from a sample than from using traditional molecular imaging techniques, and they have the potential to greatly improve the analysis of biological samples for biological and pharmacology studies 2. MSI can be broadly separated into non-ambient and ambient approaches. The non-ambient MSI analysis techniques, such as matrix assisted laser desorption ionization (MALDI) MS 3 and time of flight secondary ion MS (ToF SIMS) 4, are capable of high spatial resolution (around 5 µm and 100 nm, respectively) and high sensitivity. However, these methods require extensive sample preparation, such as the application of matrix molecules to the sample surface, and a vacuum sampling environment, which could introduce artifacts to the data obtained. Ambient techniques such as desorption electrospray ionization (DESI) MS 5, laser ablation electrospray ionization (LAESI) MS 6, and nano-DESI MS 7 are capable of MSI of samples with little to no prior preparation under the ambient environment, which is able to produce MS images that potentially reflect the sample in its most native state. However, most of these techniques generally lack the high spatial resolution and detection sensitivity compared with the non-ambient techniques, with experiments typically conducted at around 150 µm per pixel 8.
Single cell analysis (SCA) is a growing field that has the ability to characterize the chemical composition of biological samples at the cellular level. SCA enables the analysis of biological systems at a more fundamental level than traditional cell analysis techniques, which produce an averaged result of a population of cells, potentially providing insights that are previously intractable 9. MS techniques have recently been applied to SCA (termed single cell mass spectrometry or SCMS) using non-ambient techniques such as MALDI MS 10 and ToF SIMS 11 in which cells are pretreated before analysis, and with ambient techniques such as LAESI MS 12 and direct extraction methods, such as live single-cell video-MS 13, 14, to analyze a wide variety of cell types such as egg, plant, and cancer. Ambient techniques have the advantage of being applied to live cells, which again minimizes the artifacts, leading to a better representation of the metabolites in the live cells. The direct extraction based methods described above, however, perform the sample extraction and analysis process at two different steps, which result in a time gap during the analysis that could potentially alter the metabolites present within the sample.
The single-probe, a miniaturized multifunctional device that is capable of conducting high spatial resolution ambient MSI on biological tissue sections 15 and near real-time in-situ SCMS on live single cells 16. The single-probe has an integrated construction that is made up of a pulled dual-bore quartz capillary coupled with a solvent providing inlet and a nano-ESI emitter made from fused silica capillaries, enabling solvent delivery and analyte extraction to be performed from a single device. In the ambient MSI mode, the single-probe is placed over the sample tissue and surface micro-extraction occurs, allowing a rastered MS image to be made at high spatial resolution. Particularly, the tapered tip of the single-probe is small enough to be inserted into live eukaryotic cells for in-situ SCMS analysis, where the metabolite detection takes less than two seconds between probe insertion and MS detection, allowing chemical information to be taken in near real-time. Here are the protocols to fabricate the single-probe device and to conduct both the ambient MSI and SCMS modes using the single-probe MS techniques.
протокол
Использование животных и благополучие должны придерживаться Руководства NIH по уходу и использованию лабораторных животных следующие протоколы были рассмотрены и одобрены уходу и использованию комитета Institutional животных (IACUC) путем. Образцы ткани мышей были предоставлены сотрудником доктором Chuanbin Мао.
1. Мышь ткани Раздел Подготовка
- Поместите весь мыши орган интерес ( головного мозга, почек, печени и т.д.) , в центре небольшого пластика хорошо (например, 12-луночный планшет для культивирования), и погружаться в ткани герметики примерно до 10 мм высотой. Убедитесь , что нет пузырьков образуется в соединении ткани вложению и что орган помещается в нужной ориентации (т.е., сагиттальной, корональной и т.д.).
- Немедленно поместите ткани в жидкий азот для флэш-замораживания. Для длительного хранения, хранить замороженные образцы в -80 ° C морозильнике.
- Возьмите замороженный орган мыши и оттепели до -15 ° С в temperatuповторно контролируемый cryomicrotome.
- Защищенная ткани на стальную базу с приблизительно 500 мкл ткани вложения соединения и поместите на cryomicrotome в секционирования смонтировать так, чтобы нужная секционирования ориентация представлена на нож.
- Раздел ткани толщиной до 12 мкм. Поместите секционного срезы ткани на поликарбонатных микроскопа и оставьте сохнуть в течение 30 мин при комнатной температуре. Для длительного хранения, хранить замороженную слайда в -80 ° C морозильнике.
2. Культура клеток
Примечание: Культура клеток проводили в биологической безопасности (уровня биологической безопасности II) в стерильных условиях. линия клеток HeLa, была использована в качестве модельной системы, и клетки культивировали в полной культуральной среде со следующими обычными протоколами:
- Теплые реагенты (то есть, трипсин, фосфатно - солевой буфер (PBS) , и среда для культивирования клеток) до 37 ° С.
Примечание: клеточная культуральная среда содержит неорганический саLTS, аминокислоты, витамины и другие. Для получения полного списка составляющих, обратитесь к составу от производителя. - Получают образец клеток (например, 1 мл суспензии клеток HeLa) и добавить его в 9 мл полной среды для культивирования клеток в стандартном 10-сантиметровом культуральный планшет. Исходное число клеток составляет около 0,5 × 10 6 клеток / мл. Хранить клеток в культуре при температуре 37 ° С с 5% CO 2 в течение 2-3 дней , пока ростовой поверхности не будет покрыта на 70-80% на культуральный планшет. Записать номер ячейки проход для каждого последующего раунда.
- Выполните клеточную пассирования (т.е. клеток расщепление) в культуре клеток пластины.
- средний рост Аспирируйте, и использовать 5 мл 1x PBS для промывания клеток. Удалить PBS с использованием стерильного аспирационной наконечник, и инкубировать клеток в объеме 2,5 мл трипсина (0,25%) в течение ~ 5 мин при 37 ° С для отделения клеток от культуральной пластины.
Примечание: нужно Фактическое время обработки трипсином быть оптимизированы в соответствии с конкретным трипсина продкт купить у производителя. Недостаточное время лечения оставляет клетки, прикрепленные к пластине, в то время как чрезмерная обработка приводит к гибели клеток. - Прекратить активности трипсина путем добавления 7,5 мл полной среды для культивирования клеток, а затем равномерно ресуспендирования клеток (общий объем 10 мл). Используйте суспензии клеток для культивирования (этап 2.2) или подготовки образцов SCMS (шаг 2.4).
- средний рост Аспирируйте, и использовать 5 мл 1x PBS для промывания клеток. Удалить PBS с использованием стерильного аспирационной наконечник, и инкубировать клеток в объеме 2,5 мл трипсина (0,25%) в течение ~ 5 мин при 37 ° С для отделения клеток от культуральной пластины.
- Подготовьте образцы клеток для экспериментов SCMS.
- Поместите отдельные слайды микро покрова в 12-луночный планшет, и добавить культуральной среды 1,8 мл клеток и 0,2 мл клеточной суспензии в скважину.
- Тщательно перемешать в клетки с осторожном перемешивании пластины, и инкубировать в среде с 5% СО 2 при 37 ° С в течение ~ 24 ч. Для выполнения медикаментозного лечения в культивируемые клетки, добавляют лекарственное соединение раствор (например, в ДМСО (диметилсульфоксид)) в 12-луночный планшет для культивирования.
Примечание: конечная концентрация лекарственного средства (например, 10 нМ, 100 нМ, 1 мкМ и 10 мкМ) и тreatment время (например, 4 часа) изменяются в зависимости от конкретной цели исследования. Клетки прикрепляются к микро- горками покровных и готовы для проведения экспериментов CSMS (этап 6).
3. Single-зонд Изготовление
- Поместите двойного отверстия кварцевую трубку (внутренний диаметр (ID) 127 мкм, наружный диаметр (OD) 500 мкм) в лазерный микропипетки съемник и тянуть двойного отверстия иглы кварца. Используйте следующие параметры в качестве отправной точки: Heat = 400, Fil = 3, Vel = 80, Del = 150, и Пуль = 250 (все единицы являются единицами производителя). Убедитесь, что вытащил двойного отверстия кварц игла имеет заостренный наконечник для оптимальных свойств зонда. Обрежьте кончик потянул так, что есть ~ 5 мм длиной из unpulled двойного ствола кварцевого капилляра левого на другом конце.
Примечание: Фактические параметры лазерного съемника должны быть оптимизированы в соответствии с конкретными условиями прибора. - Вырезать участок ~ 80 мм кварцевой капилляра (ID 40 мкм, OD, 105 мкм) в качестве растворителя при условии капилляр, и вставить его в одном отверстии на плоской конце двойного отверстия кварцевого иглы.
- Вырезать мм части кварцевого капилляра (ID 40 мкм, 105 мкм OD) ~ 40 и использовать бритву для бритья ~ 5 мм от полиимидной покрытия от средней точки. Использование пропана пламени, чтобы быстро нагреть и вытащить слитый капилляр в нано-ионизацией электрораспылением (ESI) излучателем с тонкой конусности. Вырезать излучатель нано-ESI (~ 7-10 мм длиной), и вставить его в другой отверстие на плоском конце двойного ствола кварцевой иглой. В качестве альтернативы, использовать лазерный съемник, чтобы произвести тонкую свечку.
- Нанести минимальное количество (~ 1-2 мкл) УФ-отверждения смолы на плоский конец двойного ствола кварцевой иглой, и затвердевать смолы с использованием УФ-лампы LED для ~ 20 секунд, чтобы обеспечить растворителя обеспечивая капилляра и нано- ESI эмиттера. Процедуры для сборки отдельных частей в один-зонда показаны на рисунке 1а.
- Вырезать стандартный микроскоп ГЛзадницу слайд (1 "х 3") в половину по длине. Поместите с одним зондом на один конец предметного стекла таким образом, что эмиттер нано-ЭРИ направлен наружу. Нанесите регулярное эпоксидный тело с одним зондом таким образом , что он становится закреплен на предметное стекло (рис 1b). Оставьте на ночь для закалки. Пара изготавливаемых с одним зондом с интегрированной установке с одним зондом (фиг.1С), который прикреплен к масс - спектрометра , как это показано на рисунке 1d.
4. Построить Интегрированный Single-зонд MS Setup
- Изменение интерфейса фланца ионного источника масс - спектрометра и изготовить подставку (с регулируемым положением и высоты) цифрового стереоскоп (рис 1д и 1е).
- Дрель интерфейсную фланец источника ионов с двумя отверстиями, позволяющими для крепления алюминиевой оптической платы. Сделать слайд рельса устройство и регулировки высоты стержня (прилагается кэтап XY для настройки точное положение), так , что цифровая система стереоскопе может быть прикреплен к алюминиевой оптической плате (рис 1e).
- Присоедините модифицированный цифровой стерео микроскоп, цифровой микроскоп USB, миниатюрная ручной XYZ этап перевода с гибким держателем зажима, моторизованный XYZ системы этап перевода на алюминиевой оптической плате, которая монтируется на подгонянного ионного источника интерфейса фланца масс-спектрометра (Цифры 1c и 1f). Используйте гибкий держатель зажима для фиксации предметного стекла, прикрепленный с одним зондом.
- Присоединить установку одного зонда в масс - спектрометр (рис 1f). Отрегулировать Гибкий держатель зажима и миниатюрную этап XYZ, чтобы поместить эмиттере с одним зондом перед входом в масс-спектрометре. Используйте цифровой микроскоп USB (с регулируемым углом зрения) на стороне с одним зондом, чтобы обеспечить в увеличенном масштабе изображение однофахалата наконечник или эмиттер нано-ЭРИ, а цифровой стереоскоп (с регулируемой высотой) над одним зондом для просмотра клетки и наконечник пробника.
Примечание: С помощью соответствующего источника ионов фланец, эта интегрированная система с одним зондом может быть соединен с любым другим типам масс-спектрометров, оборудованных окружающих источников ионизации.
5. Ambient MSI
- Разморозить секцию образца при комнатной температуре и поместить его на моторизованной системы сценического перевода XYZ под одностраничную зондом. Отрегулируйте положение образца путем изменения координат в программном обеспечении управления.
- С помощью шприца для закачивания растворителя отбора проб с соответствующей скоростью (например, 0,2 мкл / мин), а также применять ионизационный напряжение (например, 5 кВ). Выбор растворителя для отбора проб является гибкой, и распространенными из них включают в MeOH: вода (9: 1) и ацетонитрил. Мертвый объем излучателя нано-ESI, по оценкам, ~ 3 л N, а время между зондом-surfaв.п. контакт и наблюдение ионного сигнала, как правило , менее 1 сек 15.
Примечание: Настроенный источник интерфейса ионный фланец позволяет напряжение ионизации быть избавлены от масс-спектрометра к проводящему союза через крокодил. Напряжение ионизации затем передается через проводящую союза растворителя внутри капилляра, а каналы с одним зондом, и наносили на эмиттере нано-ESI ионизовалась выборочные аналитов. Убедитесь, что напряжение ионизации отключается при подключении крокодил клип с токопроводящей союза. - Регулировка высоты с одним зондом, так что он опирается непосредственно над поверхностью образца и способный выполнять поверхности экстракция метаболитов. Осторожно поднимите Z-сцены, а затем использовать цифровой микроскоп USB (на стороне с одним зондом) для контроля за изменением расстояния между наконечником с одним зондом и поверхностью ткани. Мониторинг изменений в масс-спектре во время этой регулировки по высоте, и остановки лифтаING Z-стадии, когда наблюдается изменение ионного сигнала от фона растворителя к метаболитов ткани.
- Повторите шаг 5.3 в три раза, чтобы установить три различные точки в рамках программы управления этапом для автоматизированной поверхности уплощение регулировки. Поместите кончик с одним зондом, в трех точках на поверхности образца на расстоянии около 10 мм друг от друга. Выполните регулировку высоты, нажав вверх и вниз, иконки, и зафиксировать три точки в положение под «метод Plan».
- Установите другие параметры для растрирования по сечению интереса в образце, используя эту программу. Для секций мыши почки, представленные здесь, используют 10,0 мкм / сек скорость растеризация и расстояние между линиями 20 мкм. Система моторизованной ступень имеет движение приращение минимального 0,1 мкм. Расстояние между наконечником и ткани с одним зондом получается из шага 5.3.
- Настройка способа автоматизированного приобретения MS спектров масс-спектрометра. Foг высокое разрешение по массе MSI на образце мыши почки, используйте следующие параметры: разрешение по массе 60000 (м / Δm), ~ 5 кВ положительный режим, 1 МикроСкан, 150 мс максимальное время впрыска, и АРУ на. Все спектры, полученные МС, представляющие индивидуальных линий изображения с MS имели одинаковое количество сканирований с равномерным шагом по времени между каждым сканированием, указывая, что размеры пикселей для изображений, полученных были равномерно распределены.
- Начать сбор данных MSI. Инициирование последовательности сбора MS для масс-спектрометра, а затем инициировать последовательность растеризация для программы управления XYZ.
- Например, в программе сбора данных MS, используемой здесь, перейдите к разделу "Установка последовательности", выберите "Создать последовательность", создать набор файлов для новой последовательности пронумерованных от 01 до Х, где Х представляет собой число линий, используемых для желательно MS изображения, которые необходимо принять, а затем нажмите кнопку "Выполнить последовательность".
- С помощью самодельного электронного устройства, чтобы позволить драйверу производить Contàкт замыкание сигнала для масс-спектрометра для сбора данных. Принципиальная схема показана на дополнительном рисунке (рис S1) в качестве эталона.
- Построить MS изображения из исходных файлов MS с использованием соответствующего программного обеспечения визуализации MSI. Например, при использовании пакета программного обеспечения , разработанного группой Ласкина по адресу PNNL 17, выполните следующие действия.
- Нажмите кнопку "Файл бровями." Выберите первый файл, полученный из эксперимента MSI. Укажите, где начинается доступа к файлам и заканчивается под "Количество линий". Выберите диапазон значений т / г для диапазона изображения MS под "Enter MZ Range".
- Нажмите кнопку "Пуск", чтобы начать процесс создания образа. После того как изображение MS сделан, нажмите кнопку "Сохранить изображение" в разделе "Панели инструментов" для хранения изображений на компьютере.
6. В месте Живая SCMS
- Настройка системы с одним зондом согласно Инструкция дляИоны для MSI. Отрегулировать растворитель (например, метанол / H 2 O , или ацетонитрил) скорость потока (например, ~ 25 л / мин).
- Вымойте культивируемые клетки, которые прикреплены на микро крышка предметные стекла с PBS для удаления культуральной среды и компонентов внеклеточного наркотиков. Поместите ячейку, содержащую предметное стекло на моторизованной системы сценического перевод XYZ для эксперимента.
Примечание: В качестве альтернативы, использовать среду для культивирования клеток свежей (не содержащей эмбриональной бычьей сыворотки), чтобы промыть культивируемые клетки. Менее подавление ионов наблюдалось. Кроме того, клетка может выжить в течение более длительного времени в ходе эксперимента, когда температура окружающей среды (~ 20 ° C), что значительно ниже, чем температура культивирования (37 ° C). Тип лекарственного средства, концентрация раствора и время обработки варьируются в различных исследованиях. - Фокус цифровой стерео микроскоп (над образцом) на наконечнике с одним зондом для контроля проникновения клеток в ходе анализа. Используйте цифровой микроскоп USB (на сязь одноленточного зонда) для контроля условий работы излучателя нано-ESI на одном-зонда.
- Используйте моторизованный программу управления этапом XYZ и цифровой стерео микроскоп (выше клеток), чтобы найти ячейку интереса, и точно позиционировать кончик одного зонда над образцом. Начало сбора данных MS до наконечника с одним зондом вставляется в ячейку.
- Используйте следующие параметры в качестве ссылки для анализа MS с использованием масс-спектрометра высокого разрешения: разрешение по массе 100000 (м / Δm), ~ 3 кВ положительный и отрицательный режим, 1 Микроскан, 150 мс Максимальное время впрыска, режим АРУ вкл. Автоматизированная приобретение MS спектров осуществляется нажатием кнопки "Пуск" в программе сбора данных MS.
- Поднимите моторизованный Z-этап, нажав на иконку, чтобы проникнуть через клеточную мембрану и сохранить запись сигнала MS сгенерированный из клетки. Время задержки на 1-2 сек обычно наблюдается между включениями зонда и обнаружения сигнала MS. В качестве другого подтвержденияпроникновение клеток наблюдалось резкое изменение сигналов МС может наблюдаться при проникновении клеточной мембраны. Сигналы MS внутриклеточных соединений, как правило, может длиться в течение ~ 15-20 сек до того, значительно уменьшится.
- Чуть ниже ячейки, содержащей пластину, чтобы вытащить наконечник с одним зондом из клетки. Обычно это занимает <15 сек для ионных сигналов сотовой соединений приблизиться к уровню шума. Пусть поток растворителя для ~ 3 мин, чтобы полностью смыть с одним зондом. В то же время, положение моторизованной системы этап XYZ, чтобы найти следующую ячейку для анализа. Каждый эксперимент клетка требует ~ 3 мин, чтобы быть достигнуто.
Результаты
Сингл-зонд был успешно использован для анализа окружающей среды MSI разборные мыши почечной ткани 15. Устройство использует механизм поверхностной жидкости микро-экстракции (Рисунок 1а), что обеспечивает высокую эффективность извлечения анализируемого вещества из небольшой площади, что приводит к обильным интенсивностей сигналов ионов в результатах MSI. Например, интенсивность сигнала от более чем 10 7 были достигнуты для некоторых распространенных метаболитов (фиг.2А). Были обнаружены большое количество метаболитов таким образом, в том числе ряд сфингомиелина (SM) и фосфатидилхолина (PC) видов , таких как [SM (34: 1) + Na] + (725,5575 м / г), [PC (32: 0) + Н] + (734,5700 м / г), [PC (34: 1) + Na] + (782,5696 м / г), и [ПК (38: 5 + Na)] + (814,5726 м / з). Эти соединения были идентифицированы с высокой разрешающей способностью и массовой массовой точности при сочетании тоа масс-спектрометр высокого разрешения. Например, идентификация была достигнута с менее чем 4 частей на миллион m / z масс - точности (то есть разность между наблюдаемыми и теоретическими значениями) для каждого метаболита (2б) в результатах , представленных здесь. Кроме того, тандем масс - спектрального анализа (т.е. МС / МС) были проведены также для более уверенной идентификации видов , представляющих интерес. 15
Из - за способности выполнять эффективную жидкость микро-экстракции на небольшом участке, устройство с одним зондом может быть использован для выполнения высоких пространственных экспериментов разрешение MSI при условиях окружающей среды 15. Например, подробные MS изображения срезов почки мыши , которые были получены , иллюстрирующую пространственное распределение отдельных метаболитов (фиг.2с). Пространственное разрешение изображения MS было определено в размере 8,5 мкм, после широко используемой метрики, имеющие transiti. на момент резкого признака , определенной в пределах изменения интенсивности 20-80% от сигнала МС 18 , в случае фосфолипид [PC (38: 5 + Na)] + на участке почки мыши, переход особенность между внутренним мозговом и наружный мозговое происходит через один цикл сканирования в хронограмме, показывающий изменение интенсивности больше 20-80% диапазона. На основании скорости образца , движущегося (10,0 мкм / сек) и МС скорость сбора данных (0,85 сек / спектр), образец перемещения расстояния в одной МС сканирования цикла (8,5 мкм), то есть пространственное разрешение MSI, может быть вычислена (рис 2d). Это пространственное разрешение одними из самых высоких пока достигнуто за окружающей методов MSI, проведенных на биологических образцах.
Для SCMS сингл-зонд смог достичь анализа отдельных живых клеток HeLa 16. Размер кончик с одним зондом , как правило , меньше , чем 10 мкм (фигЮр 3a), который достаточно мал , чтобы быть непосредственно вставлены во многие типы эукариотических клеток, диаметр составляет ~ 10 мкм, для экстракции и анализа MS. Процесс вставки наконечника с одним зондом в клетку можно визуально контролировать с помощью цифрового стерео микроскопа (рис 3b), и проникновение клеточной мембраны может быть подтверждена путем быстрого и значительного изменения масс - спектров от PBS (или свежей культуры клеток среда) к внутриклеточным соединений (рис 3С и 3D). Эксперименты могут проводиться и в положительных и отрицательных мод ионных для выявления более широких типов молекулярных видов. Например, 18 различных видов липидов были определены в положительном режиме, в том числе сфингомиелины (SM) и фосфатидилхолины (ПК), в то время как аденозинфосфатов (АМФ, АДФ и АТФ) были обнаружены в режиме отрицательных ионов (Рисунок 3в и г). Задержка времени между включениями I с одним зондомNto ячейки и обнаружения сигналов, как правило, менее чем за две секунды, что позволяет почти режиме реального времени обнаружения клеточных метаболитов. Система SCMS была также применена к экспериментам , где клетки обрабатывали противоопухолевыми препаратами (например, УВПЖ-1, паклитаксел, и доксорубицина) 19]. Соответствующие препараты могут быть обнаружены в клетках HeLa после 4-часовой обработки в серии концентраций (т.е., 10 нМ, 100 нМ, 1 мкМ, и 10 мкМ) в ДМСО (диметилсульфоксид), с использованием необработанных клеток (добавлять только ДМСО ) в качестве контрольной группы. Сигналы MS лекарств не присутствовали во внеклеточном PBS или контролем (рис 3e), но были обнаружены в одиночных камерах с использованием одного зонда MS технику (всего 100 результатов лечения нмоль показаны на рисунке 3е). Поскольку клетки промывали PBS (или свежей среды для культивирования клеток) для удаления внеклеточных соединений и загрязнений, обнаружение эндогенных метаболитов (например, клеточные липидыD аденозинфосфатов) и экзогенные соединения (например, противораковые лекарственные средства) указывает на то, что с одним зондом МС метод может быть использован для анализа внутриклеточных соединений.
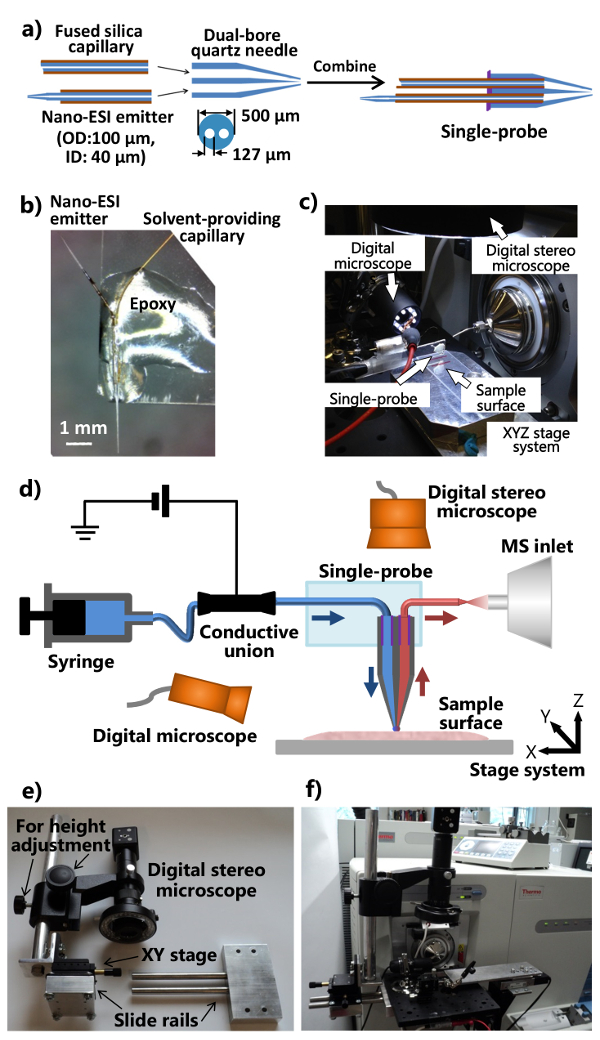
Рисунок 1. Изготовление и настройка с одним зондом для окружающей среды и MSI SCMS анализа. А) Fabrication процедуры работы с одним зондом. Б) Фотография сфабрикованному с одним зондом , прикрепленной к стеклу. С) Фотография одно- установки зонда прикреплен к масс - спектрометра. д) схема установки с одним зондом в сочетании с масс - спектрометром. В ходе эксперимента, растворитель выборки непрерывно при условии, из шприца, напряжение ионизации применяется к проводящему союза с масс-спектрометром, два цифровых микроскопов используются для контроля размещения образцов, моторизованный этап XYZСистема используется для управления движением образца, а также масс - спектрометр используется для анализа. е) Фотография заказной цифровой системы стереоскоп. ф) Фотография показывает цифровой стереоскоп , прикрепленный к интерфейсу фланца источника ионов через оптический плате. Пожалуйста , нажмите здесь , чтобы просмотреть большую версию этой фигуры.
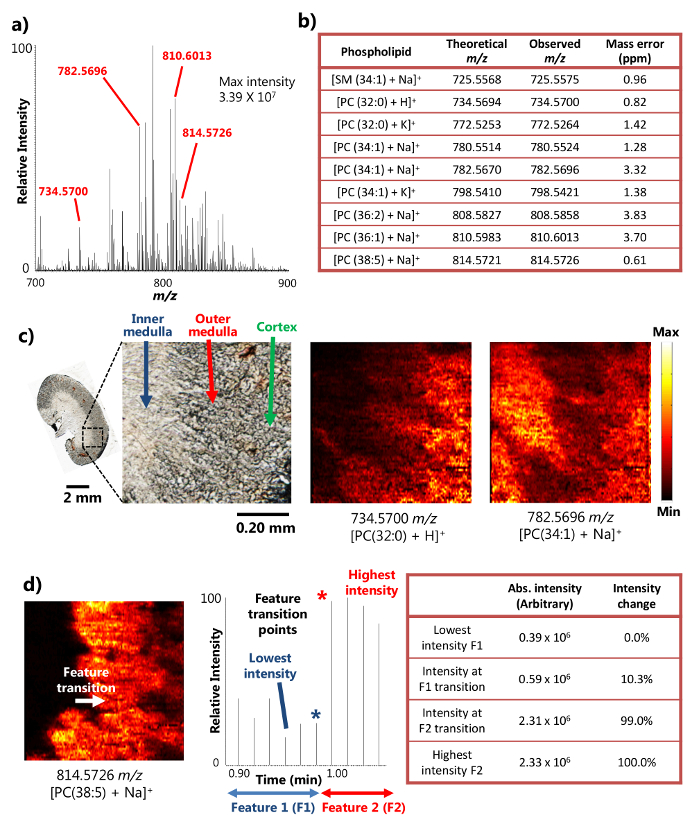
Рисунок 2. Результаты исследования окружающей среды MSI секции мыши почки с высоким пространственным и разрешением масс. А) представитель масс - спектр с одним зондом MSI. Максимальная интенсивность обнаруженных метаболитов может достигать 3,39 х 10 7 ( в произвольных единицах). Б) Выбор обнаруженных метаболитов представлены с их массовой точностью. С)MS изображения [PC (32: 0) + H] + и [PC (34: 1) + Na] + взятом из секции мыши почки с пространственным разрешением 8,5 мкм. PC: фосфатидилхолин. Шкала бар: 2 мм; 0,20 мм (вставка) d) определение пространственного разрешения изображения MS для. [PC (38: 5) + Na] + (адаптировано с разрешения автора из ссылки 15). Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.

Рисунок 3. Результаты анализа окружающей среды SCMS лекарственных клеток , обработанных HeLa с высокой разрешающей способностью масс. А) Увеличиваемую фотографии наконечника с одним зондом , показывая типичный размер <10 мкм в диаметре. Б) Фотография сделана в точке вставка одного зонда в клетку HeLa. Шкала бар: 50 мкм.в) Типичная положительная масса спектр мод ионов с идентификаторами ряда ПК (фосфатидилхолин) видов. г) репрезентативный список метаболитов , обнаруженных из SCMS анализа клеток HeLa как в положительных и отрицательных мод ионов. ФЕ) масс - спектров контроль и лечение (100 нМ OSW-1) клетки (адаптировано с разрешения автора из ссылки 16). Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Рисунок S1. Принципиальная схема электронного устройства , используемого для получения сигнала замыкания контакта для масс - спектрометр для сбора данных. Пожалуйста , нажмите сюда , чтобы просмотреть или скачать эту цифру.
Обсуждение
С одним зондом является многофункциональным устройством, которое может быть использовано как для MSI и SCMS экспериментов. Установка одного зонда ( в том числе систем стадии перевода, микроскопов, интерфейс фланцевых источника ионов и т.д.) разработан как дополнительный компонент , который может быть гибко адаптирована к существующей масс - спектрометра. Быстрый обмен между установкой с одним зондом и обычного ионного источника ESI может быть достигнуто в течение одной минуты. В принципе, с использованием соответствующего интерфейса фланца ионного источника, установка с одним зондом может быть адаптирована к любым другим масс-спектрометрами. Кроме того, растворитель отбор проб, содержащих различные реагенты могут быть использованы при установке с одним зондом для реактивных экспериментов MSI и SCMS, что значительно расширяет обнаружение широких диапазонов биомолекул. В дополнение к ткани животных и клеточных линий, то с одним зондом также способен анализировать другие биологические системы, таких как растения. Таким образом, с той же экспериментальной установке исходный обучение пользователей, различные исследования, может быть выполнена с использованием одного инструмента и теми же пользователями, что позволяет эффективно и разносторонних экспериментов, которые будут осуществляться с минимальным временем обучения и стоимости приборов.
Ключевым компонентом с одним зондом техники MS является сам зонд. Качество с одним зондом оказывает существенное влияние на его производительность, которая во многом определяет качество как MSI и SCMS экспериментов. При изготовлении одинарных зондов, убедитесь, что капилляры внутри двойного отверстия трубки надежно склеены, чтобы исключить возможность утечки растворителя во время экспериментов. Крайне важно, чтобы использовать минимальное количество УФ-отверждаемой эпоксидной смолы, таким образом, что отверстия и капилляры не закупорены в процессе изготовления зонда.
Сингл-зонд был использован для проведения высокого пространственного и масс окружающей среды разрешение MSI на биологических образцах 15. Основным преимуществом окружающего MSI надбесконтактные методы окружающей среды является то , что приготовление образца сохраняется на минимальном уровне без потребности в среде вакуума для отбора проб, что позволяет Анализируемый образец в ближайшем нативном состоянии 8. Одним из основных препятствий для большинства других окружающей среды техники MSI было отсутствие пространственного разрешения 1. По сравнению с десорбцией на основе MSI методов (таких, как ДЕЗИ и LAESI), малый размер кончик с одним зондом обеспечивает более надежный и эффективный поверхности жидкой микро-экстракция должна быть выполнена на небольшой площади, что приводит к высоким пространственным разрешением 8,5 мкм, что является одним из самых высоких, достигнутых с использованием окружающей среды методов MSI 15. Кроме того, регулировка компонентов растворителя выборки обеспечивает дополнительную гибкость для проведения экспериментов. Например, отбор проб растворители , содержащие реагенты (например, дикатионные соединения), были использованы для выполнения реактивных экспериментов MSI, что позволяет значительному увеличению количества метаболитов , определенных Peг эксперимент 20. Другим преимуществом одним зондом является интегрированная конструкция, которая обеспечивает удобство в эксплуатации в течение всего процесса сбора данных. Поскольку расстояние между зондом и поверхностью ткани очень чувствительны к интенсивности ионного сигнала и стабильность, получая плоский участок ткани и проводящей поверхности уплощение регулировки для минимизации расстояния дисперсии является ключевым для высококачественных экспериментов MSI. Из этого следует, что методы, с одним зондом MSI не подходят для получения высоких пространственных MS изображения неровных поверхностей.
В дополнение к фабрикации высокого качества зонд, тщательно настраивая инструмент имеет важное значение для успешного эксперимента MSI. Среди всех шагов настройки, регулировки высоты наконечника с одним зондом над поверхностью раздела ткани является наиболее критическим. При регулировке высоты зонда, насоса растворителя отбора проб и включите напряжение ионизации, так что только растворитель фоновых сигналов ионов могут быть Observредактор Затем следить за изменением масс-спектра в то время как тщательно уменьшение расстояния зонд-поверхность путем поднятия моторизованный Z-каскаде до могут наблюдаться сильные и стабильные ионные сигналы из секции ткани; эта высота зонда будет использоваться для сбора данных MSI в ходе эксперимента. Кроме того, оптимизированная скорость потока растворителя является существенным для экспериментов MSI. Отрегулируйте расход с оптимизированной высоты зонда. Убедитесь , что не существует распространение растворителя на поверхности ткани (то есть, скорость потока слишком высока) или образование пузырьков внутри эмиттера нано-ESI (то есть, скорость потока слишком низкая).
Сингл-зонд представляет собой многофункциональное устройство для биоанализа. Помимо экспериментов , MSI, она способна проводить почти в реальном времени на месте SCMS , чтобы выяснить подробную химическую информацию из живых клетках эукариот 16, что является важным преимуществом по сравнению с другими пылесосами , основанные SCMS (например, MALDI 10 и SIMS 21 ). Небольшой размер наконечника зонда обеспечивает возможность вставлять в живой эукариотической клетки и извлекать и ионизировать внутриклеточных соединений для немедленного анализа MS. Точно так же, растворители для отбора проб , содержащих реагенты (например, дикатионные соединения) могут быть использованы в экспериментах SCMS, и более широкий спектр клеточных составляющих можно обнаружить в живом одной клетки , чем когда - либо ранее (текущие исследования, данные не показаны). Хотя анализ в режиме реального времени обеспечат химические профили живых одиночных клеток, из-за проникновения клеточной мембраны и извлечение клеточного содержимого, клетка под следствием будут убиты после эксперимента, подразумевая, что с одним зондом SCMS метод до сих пор деструктивный метод. Кроме того, наконечник зонда и нано-ESI излучатель в одном-зонда может быть легко забиваются для неопытных пользователей. Чтобы уменьшить вероятность засорения устройства, убедитесь, чтобы они не соприкасались ядра при установке наконечника одного зонда в CELл. Если происходит засорение, то устройство можно регенерировать путем нагрева засоренного наконечника зонда или нано-ЭРИ эмиттера с использованием нагревательного змеевика самодельный 16. Другим ограничением одним зондом техники SCMS является то , что только клейкие клетки (т.е. клетки прикреплены к поверхности) могут быть проанализированы с использованием текущих настроек. Тем не менее, за счет включения системы манипулирования клеток в с одним зондом MS аппарата, более широкие типы клеток могут быть изучены в будущем.
Подобный эксперимент MSI, получение высокого качества зонда и оптимизированный расход растворителя имеет решающее значение для исследований SCMS. При настройке скорости потока растворителя, наконечник с одним зондом помещается над образцом (т.е. отсутствие контакта с клетки или культуральной среды), а также гарантировать , что нет никакого капания растворителя из наконечника зонда или образование пузырьков внутри нано-ESI эмиттер.
Раскрытие информации
We have no conflict of interest to declare with the work presented here.
Благодарности
The authors would like to thank Dr. Laskin (the Pacific Northwest National Laboratory) for sharing the motorized stage control software and MSI visualization program. We also thank Dr. Mao (the University of Oklahoma) for providing mouse organ samples and Mr. Chad E. Cunningham (the University of Oklahoma) for the assistance in machining and electronics work. This research was supported by grants from the Research Council of the University of Oklahoma Norman Campus, the American Society for Mass Spectrometry Research Award (sponsored by Waters Corporation), Oklahoma Center for the Advancement of Science and Technology (Grant HR 14-152), and National Institutes of Health (R01GM116116).
Материалы
| Name | Company | Catalog Number | Comments |
| Single-probe fabrication | |||
| Dual bore quartz tubing, 1.120’’ × 0.005” × 12” | Friedrich & Dimmock, Inc, Millville, NJ | MBT-005-020-2Q | |
| Micropipette laser puller | Sutter Instrument Co., Novato, CA | Model P-2000 | |
| Fused silica capillary, ID: 40 µm, OD: 110 µm | Molex, Lisle, IL | TSP040105 | |
| UV curing resin | Prime Dental, Prime-Dent, Chicago, IL, USA | Item No. 006.030 | |
| LED UV lamp | Foshan Liang Ya Dental Equipment, Guangdong, China | LY-C240 | |
| Epoxy resin | Devcon, Danvers, MA | Part No. 20945 | |
| Inline MicroFilter | IDEX Health & Science LLC, Lake Forest, IL | M-520 | |
| Microunion | IDEX Health & Science LLC, Lake Forest, IL | M-539 | |
| Microscope slide (glass) | C & A Scientific - Premiere, Manassas, VA | 9105 | |
| Syringe | Hamilton, Reno, NV | 1725LTN 250UL | |
| Mass spectrometer | |||
| LTQ Orbitrap Mass sprectrometer | Thermo Fisher Scientific, Inc., Waltham, MA | LTQ Orbitrap XL | |
| Xcalibur 2.1 Software | Thermo Fisher Scientific, Inc., Waltham, MA | XCALIBUR21 | |
| Fance Stage Control | Pacific Northwest National Laboratory, Richland, WA | ||
| MSI QuickView | Pacific Northwest National Laboratory, Richland, WA | ||
| Contact closure device | |||
| USB-6009 Multifunction DAQ | National Instruments, Austin, TX | 779026-01 | |
| DR-5V SDS Relay | Panasonic, Kadoma, Japan | DR-SDS-5 | |
| Logic Gates 50 Ohm Line Driver | Texas Instruments, Dallas, TX | SN74128N | |
| Single-probe setup | |||
| Motorized linear stage and controller (3 sets) | Newport, Irvine, CA | Conex-MFACC | |
| Miniature XYZ stage | Newport, Irvine, CA | MT-XYZ | |
| Translation XY stage | ThorLab, Newton, NJ | PT1 and PT102 | |
| Thermo LTQ XL ion source interface flange | New Objective, Woburn, MA | PV5500 | |
| Digital stereo microscope, 250X - 2,000X | Shenzhen D&F Co., Shenzhen, China | Supereyes T004 | |
| USB Digital Photography Microscope | DX.com, HongKong, China | S02 25~500X | |
| Syringe pump | Chemyx Inc., Stafford, TX | Nexus 3000 | |
| Solid Aluminum Optical Breadboard, 8" x 8" x 1/2" | Thorlabs, Newton, NJ | MB810 | |
| Flexible clamp holder | Siskiyou, Grants Pass, OR | MXB-3h | |
| Solvents | |||
| Methol | Sigma-Aldrich, St. Louis, MO | 34860 Chromasolv | |
| Water | Sigma-Aldrich, St. Louis, MO | W4502 | |
| Acetonitrile | Sigma-Aldrich, St. Louis, MO | 34967 Chromasolv | |
| Cell culture | |||
| Dulbecco’s Modified Eagle’s Medium (DMEM) | Cellgro, Manasas, VA | 10-013-CV | |
| 10% heat-inactivated fetal bovine serum (FBS) | Gibco/Life Technologies, Long Island, NY | 10100-139 | |
| Penicillin/Streptomycin | Cellgro, Manasas, VA | 30-002-CI | |
| 10 mM HEPES (pH 7.4) | Cellgro, Manasas, VA | 25-060-CI | |
| Phosphate Buffered Saline (PBS) | Cellgro, Manasas, VA | 46-013-CM | |
| TrypLE Express | Thermo Fisher Scientific, Waltham, MA | 12604-013 | |
| 12-well plates | Corning Inc., Corning, NY | Falcon 351143 | |
| T25 flask | Corning Inc., Corning, NY | Falcon 3055 | |
| Micro Cover Glasses, Round, No. 1 | VWR International, Radnor, PA | 48380-046 | |
| DMSO (Dimethyl Sulfoxide) | VWR International, Radnor, PA | BDH1115-1LP | |
| Tissue imaging | |||
| Cyro-Cut Microtome | American Optical Coporation | ||
| Tissue-Tek, Optimum cutting temperature (OCT) | Sakura Finetek Inc., Torrance, CA | 4583 | |
| Microscope slide (polycarbonate) | Science Supply Solutions, Elk Grove Village, IL | P11011P | |
Ссылки
- Vickerman, J. C. Molecular imaging and depth profiling by mass spectrometry-SIMS, MALDI or DESI?. Analyst. 136 (11), 2199-2217 (2011).
- Schwamborn, K. Imaging mass spectrometry in biomarker discovery and validation. J. Proteomics. 75 (16), 4990-4998 (2012).
- Schwamborn, K., Caprioli, R. M. MALDI Imaging Mass Spectrometry - Painting Molecular Pictures. Mol Oncol. 4 (6), 529-538 (2010).
- Kraft, M. L., Klitzing, H. A. Imaging lipids with secondary ion mass spectrometry. Biochim. Biophys. Acta. 1841 (8), 1108-1119 (2014).
- Wiseman, J. M., et al. Desorption electrospray ionization mass spectrometry: Imaging drugs and metabolites in tissues. Proc Natl Acad Sci U S A. 105 (47), 18120-18125 (2008).
- Nemes, P., Woods, A. S., Vertes, A. Simultaneous imaging of small metabolites and lipids in rat brain tissues at atmospheric pressure by laser ablation electrospray ionization mass spectrometry. Anal. Chem. 82 (3), 982-988 (2010).
- Laskin, J., Heath, B. S., Roach, P. J., Cazares, L., Semmes, O. J. Tissue Imaging Using Nanospray Desorption Electrospray Ionization Mass Spectrometry. Anal. Chem. 84 (1), 141-148 (2012).
- Wu, C., Dill, A. L., Eberlin, L. S., Cooks, R. G., Ifa, D. R. Mass spectrometry imaging under ambient conditions. Mass. Spectrom. Rev. 32 (3), 218-243 (2013).
- Altschuler, S. J., Wu, L. F. Cellular heterogeneity: do differences make a difference?. Cell. 141 (4), 559-563 (2010).
- Amantonico, A., Urban, P. L., Fagerer, S. R., Balabin, R. M., Zenobi, R. Single-Cell MALDI-MS as an Analytical Tool for Studying Intrapopulation Metabolic Heterogeneity of Unicellular Organisms. Anal. Chem. 82 (17), 7394-7400 (2010).
- Passarelli, M. K., Ewing, A. G., Winograd, N. Single-cell lipidomics: characterizing and imaging lipids on the surface of individual Aplysia californica neurons with cluster secondary ion mass spectrometry. Anal. Chem. 85 (4), 2231-2238 (2013).
- Shrestha, B., et al. Subcellular metabolite and lipid analysis of Xenopus laevis eggs by LAESI mass spectrometry. PLoS One. 9 (12), e115173 (2014).
- Mizuno, H., Tsuyama, N., Harada, T., Masujima, T. Live single-cell video-mass spectrometry for cellular and subcellular molecular detection and cell classification. J. Mass. Spectrom. 43 (12), 1692-1700 (2008).
- Zhang, L., et al. In Situ metabolic analysis of single plant cells by capillary microsampling and electrospray ionization mass spectrometry with ion mobility separation. Analyst. 139 (20), 5079-5085 (2014).
- Rao, W., Pan, N., Yang, Z. High Resolution Tissue Imaging Using the Single-probe Mass Spectrometry under Ambient Conditions. J. Am. Soc. Mass. Spectrom. 26 (6), 986-993 (2015).
- Pan, N., et al. The single-probe: a miniaturized multifunctional device for single cell mass spectrometry analysis. Anal. Chem. 86 (19), 9376-9380 (2014).
- Thomas, M., et al. Visualization of High Resolution Spatial Mass Spectrometric Data during Acquisition. 2012 Annual International Conference of the Ieee Engineering in Medicine and Biology Society (Embc). , 5545-5548 (2012).
- Luxembourg, S. L., Mize, T. H., McDonnell, L. A., Heeren, R. M. High-spatial resolution mass spectrometric imaging of peptide and protein distributions on a surface. Anal. Chem. 76 (18), 5339-5344 (2004).
- Zhou, Y., et al. OSW-1: a natural compound with potent anticancer activity and a novel mechanism of action. J Natl Cancer Inst. 97 (23), 1781-1785 (2005).
- Rao, W., Pan, N., Tian, X., Yang, Z. High-Resolution Ambient MS Imaging of Negative Ions in Positive Ion Mode: Using Dicationic Reagents with the Single-Probe. J. Am. Soc. Mass. Spectrom. 27 (1), 124-134 (2016).
- Ostrowski, S. G., Kurczy, M. E., Roddy, T. P., Winograd, N., Ewing, A. G. Secondary ion MS imaging to relatively quantify cholesterol in the membranes of individual cells from differentially treated populations. Anal. Chem. 79 (10), 3554-3560 (2007).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены