Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Всего тела Масс-спектрометрия обработки изображений с помощью ИК-Matrix-активированная лазерная десорбция ионизацией электрораспылением (ИК-MALDESI)
В этой статье
Резюме
A mass spectrometry imaging (MSI) source operated at atmospheric pressure was developed by coupling mid-infrared laser desorption and electrospray post-ionization. Exogenous ice matrix was used as the energy-absorbing matrix to facilitate resonant desorption of tissue-related material. This manuscript provides a step-by-step protocol for performing IR-MALDESI MSI of whole-body neonatal mouse.
Аннотация
Окружающие источники ионизации для масс-спектрометрии (МС) были предметом особого интереса в последнее десятилетие. Матрикс-лазерной десорбцией с ионизацией электрораспылением (MALDESI) является примером таких методов, где особенности матричной лазерной десорбцией / ионизацией (MALDI) (например, импульсный характер десорбции) и с ионизацией электрораспылением (ESI) (например, мягкой ионизации ) объединены. Одним из основных преимуществ MALDESI является его неотъемлемым универсальность. В экспериментах MALDESI, ультрафиолет (УФ) или инфракрасного (ИК) лазер может быть использован для резонансно возбудить эндогенной или экзогенной матрицу. Выбор матрицы не зависит аналита, и зависит только от длины волны лазера, используемого для возбуждения. В экспериментах ИК-MALDESI, тонкий слой льда осаждается на поверхности образца, в качестве матрицы, поглощающего энергию. Геометрия источника ИК-MALDESI была оптимизирована с использованием статистического дизайна экспериментов (DOE) для анализа жидких проб, а также BiolОбразцы ogical ткани. Кроме того, надежный источник формирования изображения ИК-MALDESI была разработана, где перестраиваемый среднего ИК лазер синхронизируется с компьютерным управлением XY этапе поступательной и высокой разрешающей мощности масс-спектрометра. Пользовательский графический интерфейс пользователя (GUI) позволяет пользователю выбор частоты повторения лазера, количество выстрелов в вокселе, размер шага сцены образца, а задержка между десорбцией и сканируют события для источника. ИК-MALDESI используется в различных областях применения, таких как судебно-медицинской экспертизы волокон и красителей и MSI секций биологической ткани. Распределение различных аналитов в пределах от эндогенных метаболитов экзогенных ксенобиотиков в пределах срезов ткани могут быть измерены и подсчитаны с помощью этой методики. Протокол, представленные в этой рукописи описываются основные шаги, необходимые для ИК-MALDESI MSI срезов ткани всего тела.
Введение
Масс-спектрометрия томография (MSI) в режиме микроанализа связано с десорбцией образца с поверхности пучком (лазер или ионов) в отдельных местах по поверхности образца. В каждой точке растра, массовый спектр генерируется и получаемых спектров, наряду с пространственным положением, из которого они были собраны, могут быть использованы для одновременного отображения многочисленных аналитов в образце. Эта метка свободной манере изображения в сочетании с чувствительностью и специфичностью масс - спектрометрии помогли MSI стала одной из самых быстро эволюционирующих полей в масс - спектрометрии 1,2.
Матричный с лазерной десорбцией / ионизацией (MALDI) является наиболее распространенным методом ионизации используется для MSI анализа. Тем не менее, потребность в органической матрице и требования к вакууму MALDI создают значительные ограничения на воспроизводимости, выборки пропускной способности, а также типы образцов, которые могут быть подвергнуты анализу с использованием метода. Ряд атмосферного давления (AP) И.О.Методы иммунизацией были разработаны в последние годы , чтобы обойти эти ограничения 3. Эти методы ионизации окружающего воздуха позволяют для анализа биологических образцов в среде, которая гораздо ближе к их естественном состоянии и упростить этапы подготовки проб перед анализом. Матрикс-лазерной десорбцией с ионизацией электрораспылением (MALDESI) является примером такого способа ионизации 4,5.
В экспериментах ИК-MALDESI, тонкий слой льда осаждается на поверхности ткани, как энергопоглощающего матрицы. Лазерный импульс среднего ИК диапазона поглощается матрицей со льдом, и способствует десорбции нейтральных материалов с поверхности резонансно захватывающего ОН режим воды растяжения. Десорбироваться нейтралы разбиение на заряженные капли ортогональной электроспрея и являются пост-ионизируется в ESI-как мода 4-6. Добавление экзогенных матрицы льда предпочтительнее, чем полагаться только на эндогенной воды в ткани, так как это помогает ACрассчитывать на различия в содержании воды в различных тканях организма , и было показано , что повышение десорбцию 6 и улучшить ионную обилие на ~ 15-кратно 7,8 в экспериментах формирования изображения тканей.
В этой работе мы используем ИК-MALDESI MSI, чтобы выявить распределение метаболитов в различных органах в неонатальный мыши всего тела. Обзор регулируемых параметров источника ИК-MALDESI дается, и необходимые шаги для успешной визуализации срезов тканей продемонстрированы.
протокол
Примечание: Следующий протокол описывает все необходимые шаги для выполнения экспериментов IR-MALDESI MSI. Углубленный подробности о оптимизированной геометрии источника ИК-MALDESI и его синхронизации с лазерным, стадии, и масс - спектрометр может быть найден в другом месте 5,6. Образцы тканей животных, используемые в этом протоколе были получены в соответствии с институциональной уходу и использованию животных комитета (IACUC) и нормативными актами Университета штата Северная Каролина.
1. Подготовка ткани
- Подготовьте / ванну сухой лед изопентан путем размещения ~ 200 мл изопентана в чистом стакане внутри вторичного контейнера сухого льда в вытяжном шкафу. Используйте защитные перчатки и защитные очки во всех случаях при обращении с / ванна изопентана сухого льда и ткани.
- Эвтаназии 2-дневными весь неонатального детеныша мыши передозировкой Avertin (7,5 мг / г массы тела), а затем заморозить ткань в / бане с сухим льдом изопентана, чтобы сохранить структуру ткани. Используйте предварительно чистойред пара щипцов на место и удалить щенка мыши в cryomold из / бане с сухим льдом изопентана. Храните флэш-замороженные ткани при -80 ° С до анализа.
- Используя защитные перчатки, нанесите слой оптимальной температуры резания (ОКТ) монтажной среды для криостата образца диска 40 мм. Аккуратно поместите замороженный всю мышь на держатель образца с покрытием Октябре придерживаться мыши на диске в нужной ориентации для секционирования.
Примечание: ОСТ используется исключительно для приклеивания ткани к образцу диска для секционирования. Не полностью встраивать ткани в ОСТ и избежать избытка в октябре, как известно, оказывают вредное воздействие на анализе MSI. Другие носители, такие как желатин, могут быть использованы для крио-встраивать ткани до нарезки его 9. - Поместите диск (с ОСТ и срез ткани) на держателе образца Пельтье в криостата и нажмите кнопку питания Пельтье. Подождите 10 минут для образца, чтобы прийти к тепловому равновесию.
- Поместите Образцы диска (с тканью, установленный наона) внутри держателя диска, и лицо ткани вниз до нужной плоскости для анализа. Нарезать ткань на участки желаемой толщины при -20 ° С с использованием роторного микротома размещен внутри криостата 10.
Примечание: Для всего тела анализа, ломтик ткани в 25 мкм толщиной секций для поддержания целостности тканей. Для меньших областей (например, печень, мозг, почки), срез ткани в 10 мкм толщиной секций.- Используйте стеклянную пластину стабилизирующая, чтобы предотвратить раздел нарезанную ткани от скатывания. С помощью криостата вакуумный шланг и щетки для удаления мусора нежелательной ткани. После того, как ткань разрезали, используйте защитный кожух диска, чтобы покрыть острый микротома лезвие, чтобы избежать травм.
- Orient раздел мыши на образце пластины и разморозить монтажа на предварительно очищенное предметное стекло микроскопа, принося слайд как можно ближе к секции ткани, не прикасаясь к нему 10.
Примечание: Для количественного MSI экспементы, пальто ползун с внутренним стандартом с использованием автоматического пневматического распылителя перед монтажом ткани, и оттаивать демонтирует срезы ткани на слайде с покрытием 11. - Удалите микротома лезвие, используемый для секционирования ткани с помощью эжектора лезвия, и безопасно выбросить лезвие в соответствующий контейнер "острые отходы".
- Держите предметное стекло внутри криостата до шага 3.2 для поддержания криоконсервации ткани.
2. ИК-MALDESI Подготовка / калибровки
- Включите средней ИК-лазера и запустить приложение управления лазера на компьютере. Выберите нужную длину волны с помощью приложения управления лазером, поставляемый изготовителем. Эксперименты ИК-MALDESI обычно проводят при 2940 нм.
Примечание: Недавние эксперименты исследовали зависимость среднего ИК-диапазона длин волн лазерных и матрицу льда с отмеченными различиями , которые кажутся анализируемым конкретным 8. - Включите оленеме контроллер, запустите программу пользовательского управления пользователь (RASTIR), и калибровки положения ступени с помощью кнопки домой.
- Подготовить электрораспылением решение. Как правило, используют 50:50 (об / об) метанол / вода с 0,2% муравьиной кислоты в течение электрораспылением растворителя в режиме положительных ионов. Выберите композицию электрораспылением растворитель в соответствии с экспериментом. Например, можно использовать 5 мМ гидроксид аммония в качестве модификатора электрораспылением для получения изображений в режиме отрицательных ионов.
Примечание: Для переключения полярности ИК-MALDESI MSI, используют 1 мМ уксусной кислоты в качестве модификатора. Этот модификатор был найден оптимальный для получения стабильной и воспроизводимый сигнал в обоих положительно- и отрицательно-ионных режимах 12. - Заполните 1 мл шприц с растворителем с электрораспылением, и промывать кварцевую капиллярную с новым растворителем.
- Совместите ESI излучатель на оси с MS входе с использованием параметров источника, такого как ESI-спот расстояние, спот-наливной расстояние, высоту образца, а скорость потока растворителя, которые были оптимизированы с использованием статистического DO Е для анализа срезов ткани 6. Примечание: На рисунке 1 схематическое изображение этих параметров и оптимизированных значений для MSI срезов ткани.
- Запуск электрораспылением и оценить его устойчивость (> 10 мин) путем мониторинга полного ионного тока (TIC), который, в этом пункте, состоит исключительно из внешних соединений. Как правило, TIC изменение <10% в течение 10-15 мин является хорошим показателем стабильности.
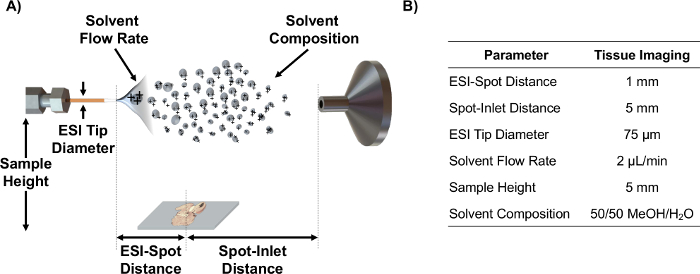
Рисунок 1. ИК-MALDESI схемы и параметры. (A) Схема установки источника ИК-MALDESI (не в масштабе) и регулируемых параметров. (B) Оптимизированные значения параметров для получения изображения срезов ткани. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
- Внимание: Выключите электрораспыление перед размещением образца на сцене.
- Поместите оттаивании монтажа ткани на образец пластины IR-MALDESI в поле зрения камеры.
- Убедитесь, что руки свободны от эмиттера ESI и перезапустить электрораспылением.
- Закройте дверцу источника и продувки корпуса ИК-MALDESI сухим азотом для предотвращения конденсации воды на поверхности ткани. После того, как относительная влажность внутри корпуса достигает <3%, включите источник питания постоянного тока (~ 12 В) к пластине Пельтье, который будет охлаждать образец пластины. Примечание: Процесс охлаждения в Пельтье-охлаждаемой стадии подробно обсуждается в другом месте 13.
- Охлаждают стадии до -9 ° C, и позволяют смонтированный ткани прийти к тепловому равновесию (~ 5-10 мин).
- Прекратить продувку азотом и подвергать ткани к относительной влажности окружающей среды, открыв дверцу доступа источника. Тонкий слой льда будет осаждаться на сотрудничествеЛД поверхности предметного столика Пельтье и смонтированный участок ткани вследствие десублимация воды из воздуха.
Примечание: Если относительная влажность в лаборатории ниже 10-15%, поместите стакан теплой воды внутри корпуса, чтобы способствовать формированию льда матричного слоя. - После того, как лед матричный слой сформирован, закрыть дверцу и возобновить поток сухого азота, чтобы уменьшить относительную влажность воздуха до 10 ± 2%. Регулировка скорости потока азота , чтобы поддерживать относительную влажность на этом уровне, эмпирически установлено, что баланс образования льда и сублимации для поддержания постоянного слоя льда в течение всего эксперимента 6.
4. Масс-спектрометрия изображений сбора данных
- Использование RASTIR GUI (рисунок 2), переместите сцену в позицию анализа, нажав на кнопку "Position" ЛАЗЕР. С помощью регулировки диод лазера, чтобы обеспечить область за пределами ткани будет абляции. Пожар лазерный выстрел в УЭ от тканейГион для калибровки лазера смещения относительно точки зрения камеры. Нажмите кнопку "Laser огневое испытание" для обновления лазерной позиции.
- Возврат в положение "CAMERA" и обновить положение лазера в RASTIR путем размещения лазерного выравнивания визира на лазерной абляции месте (Рисунок 2-1).
- Нажмите на кнопку область интереса (ROI) от и отрегулировать размер и положение ROI для участка ткани анализируется (Рисунок 2-2). Входные соответствующие экспериментальные параметры , такие как размер шага в X и Y направлениях (в мм) (рис 2-3), а также имя файла MSI в поле "Имя проекта" (Рисунок 2-4).
- При рисовании ROI, включают в себя часть отходящем ткани, которая служит в качестве контроля. Используйте этот раздел офф-ткани для пика сбора (этап 5.4).
Примечание: Диаметр десорбция (размер пятна) лазера на ткани составляет примерно 150 мкм; Тем не менее, более высокие пространственные разрешения могут быть получены с помощью USIнг метод передискретизации 14,15.
- При рисовании ROI, включают в себя часть отходящем ткани, которая служит в качестве контроля. Используйте этот раздел офф-ткани для пика сбора (этап 5.4).
- Выберите нужную частоту лазера из выпадающего списка, количество лазерных импульсов на вокселе (целые значения), а также задержки между лазерным триггером и получения сигнала масс - спектрометра (Рисунок 2-5). Обычно используют два лазерных импульсов за вокселе при частоте 20 Гц , чтобы полностью десорбироваться материал в экспериментах ИК-MALDESI MSI, со временем 10 мс задержки , чтобы ионы , генерируемые достичь масс - анализатора для измерения 5.
Примечание: Выберите самую высокую частоту повторения, что лазер может работать на. Недавно было показано , что использование более высокой частоты повторения улучшит аналита выявляемость 16.
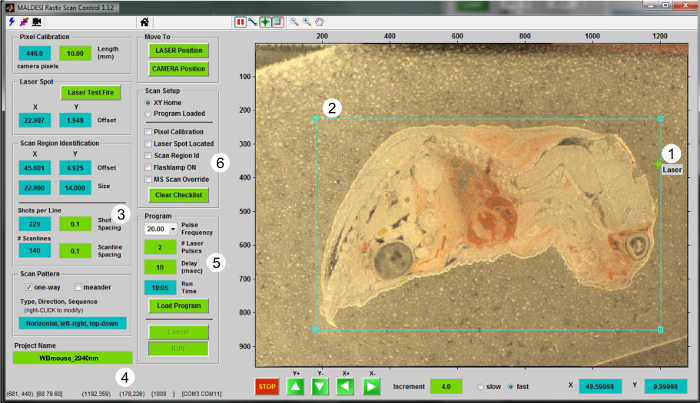
Рисунок 2. Пользовательский интерфейс для работы ИК-MALDESI MSI. Скриншот программы RASTIR Control Scan представлена. Шаги для перфорацияorming эксперимент MSI являются (1) местонахождение лазерного пятна, (2), рисование ROI, (3), выбирая размер шага ступени (в мм), (4), дающий имя файла, (5) выбрать правильный номер импульсов на вокселе наряду с желаемой скоростью повторения, и (6) проверки списка для работы с изображениями и настройки MS. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
- Выберите параметры масс-спектрометр, такие как режим ионизации, электрораспыление напряжения, скорости потока растворителя, температуры капилляра и времени впрыска в программном обеспечении масс-спектрометра. Обратитесь к Таблице 1 для примера параметров , используемых в всем теле ИК-MALDESI MSI.
Примечание: Из-за сложности биологических образцов и отсутствие методов разделения в MSI анализа, источник ИК-MALDESI соединен с высокой разрешающей способностью и высокой точностью массового инструмента. Способ приобретения может быть загружен для Analysэс , такие как параллельный мониторинг реакции (PRM) 7 или полярности переключения MSI 12. - После того, как все параметры (лазер, этап, и масс-спектрометр) были выбраны, поместите MS в режиме "рукопожатия" для синхронизации, и начать приобретение MS.
- С помощью программного обеспечения визуализации RASTIR, проверьте все шаги в контрольном списке (Рисунок 2-6) завершаются проверки коробки, и загрузить программу. После того как программа была загружена, кнопка "Run" будет доступен. Нажмите Run, чтобы начать захват сигнала MSI.
- После завершения эксперимента визуализации, остановить массовое приобретение спектрометра и поместить прибор в режим ожидания. Выключить продувку азотом в корпус, отключите электропитание Пельтье пластины, и выключите контроллер ступени и лазер.
- Откройте дверцу, снимите электрораспылением наконечник эмиттера из внутри корпуса источника, и удалить расширенную раскаленного металла MS впуск с использованием защитных перчаток. Внимание: расширенный металл MS на входе будет очень жарко.
- Надев перчатки и защитные очки, очистить расширенный вход металла капилляра ультразвуковой ванне в 15% -ной азотной кислоты в течение 10 мин, затем в ВЭЖХ-очищенной воды в течение 10 минут, и, наконец, в ВЭЖХ-класса метанола в течение 10 мин. Сушат входное отверстие металлический капиллярный под потоком азота, и вернуть в рабочее MS. Примечание: Утилизировать растворитель в соответствующих контейнерах отходов позже.
| параметр | Стоимость |
| Режим Ионизация | положительный |
| Электрораспылительная напряжения | |
| Скорость потока растворителя | 2 мкл / мин |
| Капиллярная температуры | 275 ° C |
| Диапазон сканирования | м / г 250-1,000 |
| Тип сканирования | Полное сканирование |
| Время впрыска | 110 мс |
| Разрешающая способность |
Таблица 1. Параметры прибора , используемые в всем теле ИК-MALDESI MSI.
5. Анализ данных
- Преобразование файлов исходных данных , генерируемых прибором для форматов данных , таких как mzXML 17 или imzML 18 с использованием свободного программного обеспечения , таких как MSConvert 17 и imzML преобразователя 19.
- Запустите MSiReader версии 1.0, программное обеспечение с открытым исходным кодом , разработанный для анализа высокой разрешающей способности данных MSI 20, на выделенном компьютере обработки. Загрузите файл изображения на MSiReader. Для пользовательского интерфейса MSiReader и некоторые из его встроенных функций, смотри рисунок 3.
- Генерация ионных карты аналитов путем ввода их m / z и выбрать соответствующее окно m / z в частях на миллион (м.д.) или Томсона (Th) (рис 3-1). Для получения высокой разрешающей способности (RP) инструментоввыбрать окно в диапазоне низких частей на миллион.
Примечание: соответствующее окно м / г зависит от РП и масса точности измерений (ММА) инструмента , что источником ИК-MALDESI соединен. - Далее интерпретировать данные , используя встроенные функции , такие как интерполяция (Рисунок 3-2), нормализация (Рисунок 3-3), оптический накладываемого изображения (рис 3-4), и пик , собирание (рисунок 3-5) 20.
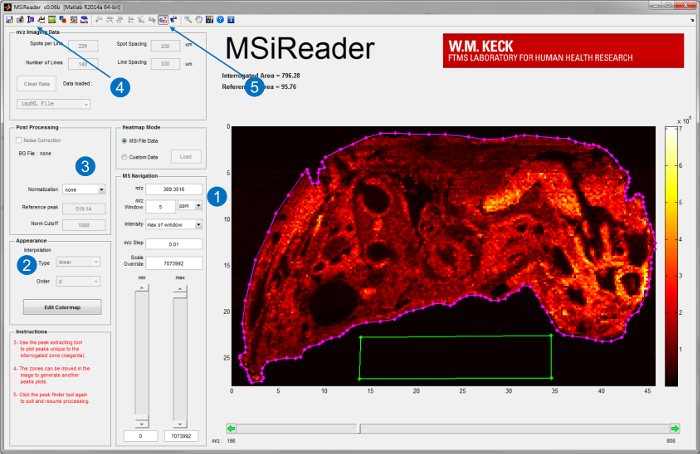
Рисунок 3. Пользовательский интерфейс MSiReader; Версия 1.0 20. После того, как файл будет загружен в программное обеспечение, ионные карты аналитов отображаются (1) ввода m / z и толерантности в промилле или Th. Дальнейший анализ, такой как (2) интерполяции или (3) нормализации также может быть выполнена. Оптическое изображение ткани также могут быть импортированы и с наложеннымиионные карты (4) для лучшей визуализации. Для получения нецелевой анализирует пик функции (5) сбор может быть использован для извлечения пиков тканеспецифические путем выбора участка ткани (линии пурпурного цвета) и эталонного участка офф-ткани (зеленый ящик). Пожалуйста , нажмите здесь , чтобы увидеть увеличенную версию эта фигура.
- Используйте функцию пикового выбора , чтобы создать список тканеспецифических значений m / z с использованием определяемых пользователем критериев. Примечание: Алгоритм PeakFinder использует различия в средней масс-спектре двух регионов. Эти значения m / z , то можно искать против метаболита баз данных , таких как Метлин 21 или липида MAPS. 22
- На рисунке 3 показан пример выбора региона допрашиваемое ткани (пурпурного полигон ROI) и вне ткани опорной области (зеленый многоугольник ROI).
Результаты
Изображения , представленные на рисунке 4 показано пространственное распределение метаболитов в различных органах в секции ткани всего тела. Уникальный m / z значения в конкретных областях тела были найдены с помощью MSiReader PeakFinder, с последующей пакетной об...
Обсуждение
Протокол выше описывает основные этапы выполнения эксперимента ИК-MALDESI MSI. Процесс матрица (раздел 3) занимает приблизительно 20 мин, что похож на типичного процесса нанесения матрицы для экспериментов MALDI MSI сублимацией или напыление с использованием роботизированного распылитель. Кро?...
Раскрытие информации
The authors declare no competing financial interests.
Благодарности
The authors thank Professor H. Troy Ghashghaei from NCSU Department of Molecular Biomedical Sciences for providing the whole mouse tissue. The authors also gratefully acknowledge the financial assistance received from National Institutes of Health (R01GM087964), the W.M. Keck foundation, and North Carolina State University.
Материалы
| Name | Company | Catalog Number | Comments |
| IR-MALDESI Source | Custom-made | N/A | Please refer to references 4 and 12 for an in-depth discussion of IR-MALDESI source development. |
| Q Exactive Plus | Thermo Scientific | Q Exactive Plus Hybrid Quadrupole-Orbitrap Mass Spectrometer | |
| Water, HPLC Grade | Burdick & Jackson | AH365-4 | |
| Methanol, HPLC Grade | Burdick & Jackson | AH230-4 | |
| Formic Acid | Sigma Aldrich | 56302 | |
| Tunable mid-IR Laser | Opotek Inc. | IR Opolette | Tunable 2,700-3,100 nm IR OPO laser |
| Nitrogen Gas | Arc3 Gases | AG S-NI300-5.0 | Grade 5.0 high purity nitrogen gas cylinder (300) |
| Cryostat | Leica Biosystems | CM 1950 | Cryomicrotome |
| High Profile Microtome Blades | Leica Biosystems | 3802123 | Leica DB80HS |
| Mounting Medium (OCT) | Leica Biosystems | 3801480 | Surgipath FSC 22 mounting medium |
| Cryostat Specimen Disc | Leica Biosystems | 14047740045 | 40 mm diameter |
| Glass Microscope Slides | VWR | 48312-003 | Frosted, selected, pre-cleaned |
Ссылки
- Mcdonnell, L. A., Heeren, R. M. A. Imaging Mass Spectrometry. Mass Spectrom. Rev. 26, 606-643 (2007).
- Chughtai, K., Heeren, R. M. A. Mass spectrometric imaging for biomedical tissue analysis. Chem. Rev. 110 (5), 3237-3277 (2010).
- Robichaud, G., Barry, J. A., Muddiman, D. C. Atmospheric Pressure Mass Spectrometry Imaging. Encycl. Anal. Chem. , (2014).
- Sampson, J. S., Hawkridge, A. M., Muddiman, D. C. Generation and detection of multiply-charged peptides and proteins by matrix-assisted laser desorption electrospray ionization (MALDESI) Fourier transform ion cyclotron resonance mass spectrometry. J. Am. Soc. Mass Spectrom. 17 (12), 1712-1716 (2006).
- Robichaud, G., Barry, J. A., Garrard, K. P., Muddiman, D. C. Infrared matrix-assisted laser desorption electrospray ionization (IR-MALDESI) imaging source coupled to a FT-ICR mass spectrometer. J. Am. Soc. Mass Spectrom. 24 (1), 92-100 (2013).
- Robichaud, G., Barry, J. A., Muddiman, D. C. IR-MALDESI Mass Spectrometry Imaging of Biological Tissue Sections Using Ice as a Matrix. J. Am. Soc. Mass Spectrom. 25 (3), 319-328 (2014).
- Barry, J. A., et al. Mapping Antiretroviral Drugs in Tissue by IR-MALDESI MSI Coupled to the Q Exactive and Comparison with LC-MS/MS SRM Assay. J. Am. Soc. Mass Spectrom. 25 (12), 2038-2047 (2014).
- Rosen, E. P., Bokhart, M. T., Ghashghaei, H. T., Muddiman, D. C. Influence of Desorption Conditions on Analyte Sensitivity and Internal Energy in Discrete Tissue or Whole Body Imaging by IR-MALDESI. J. Am. Soc. Mass Spectrom. 26, 899-910 (2015).
- Nelson, K. A., Daniels, G. J., Fournie, J. W., Hemmer, M. J. Optimization of whole-body zebrafish sectioning methods for mass spectrometry imaging. J. Biomol. Tech. 24 (3), 119-127 (2013).
- Park, J. J., Cunningham, M. G. Thin sectioning of slice preparations for immunohistochemistry. J. Vis. Exp. (3), e194 (2007).
- Bokhart, M. T., Rosen, E., Thompson, C., Sykes, C., Kashuba, A. D. M., Muddiman, D. C. Quantitative mass spectrometry imaging of emtricitabine in cervical tissue model using infrared matrix-assisted laser desorption electrospray ionization. Anal. Bioanal. Chem. 407 (8), 2073-2084 (2015).
- Nazari, M., Muddiman, D. C. Polarity Switching Mass Spectrometry Imaging of Healthy and Cancerous Hen Ovarian Tissue Sections by Infrared Matrix-Assisted Laser Desorption Electrospray Ionization (IR-MALDESI). Analyst. 141, 595-605 (2016).
- Hsu, C. C., et al. Design and Application of a Low-Temperature Peltier-Cooling Microscope. J. Pharm. Sci. 85 (1), 70-74 (1996).
- Jurchen, J. C., Rubakhin, S. S., Sweedler, J. V. MALDI-MS imaging of features smaller than the size of the laser beam. J. Am. Soc.Mass Spectrom. 16 (10), 1654-1659 (2005).
- Nazari, M., Muddiman, D. C. Cellular-level mass spectrometry imaging using infrared matrix-assisted laser desorption electrospray ionization (IR-MALDESI) by oversampling. Anal. Bioanal. Chem. 407 (8), 2265-2271 (2015).
- Rosen, E. P., Bokhart, M. T., Nazari, M., Muddiman, D. C. Influence of C-Trap Ion Accumulation Time on the Detectability of Analytes in IR-MALDESI MSI. Anal. Chem. 87, 10483-10490 (2015).
- Kessner, D., Chambers, M., Burke, R., Agus, D., Mallick, P. ProteoWizard: open source software for rapid proteomics tools development. Bioinformatics. 24 (21), 2534-2536 (2008).
- Schramm, T., et al. ImzML - A common data format for the flexible exchange and processing of mass spectrometry imaging data. J. Proteomics. 75 (16), 5106-5110 (2012).
- Race, A. M., Styles, I. B., Bunch, J. Inclusive sharing of mass spectrometry imaging data requires a converter for all. J. Proteomics. 75 (16), 5111-5112 (2012).
- Robichaud, G., Garrard, K. P., Barry, J. A., Muddiman, D. C. MSiReader: an open-source interface to view and analyze high resolving power MS imaging files on Matlab platform. J. Am. Soc. Mass Spectrom. 24 (5), 718-721 (2013).
- Smith, C. A., O'Maille, G., et al. METLIN: a metabolite mass spectral database. Ther. Drug. Monit. 27 (6), 747-751 (2005).
- Sud, M., et al. LMSD: LIPID MAPS structure database. Nucleic Acids Res. 35, D527-D532 (2007).
- Schwartz, S. A., Reyzer, M. L., Caprioli, R. M. Direct tissue analysis using matrix-assisted laser desorption/ionization mass spectrometry: practical aspects of sample preparation. J. Mass Spectrom. 38 (7), 699-708 (2003).
- Takai, N., Tanaka, Y., Inazawa, K., Saji, H. Quantitative analysis of pharmaceutical drug distribution in multiple organs by imaging mass spectrometry. Rapid Commun. Mass Spectrom. 26 (13), 1549-1556 (2012).
- Liu, J., Gingras, J., Ganley, K. P., Vismeh, R., Teffera, Y., Zhao, Z. Whole-body tissue distribution study of drugs in neonate mice using desorption electrospray ionization mass spectrometry imaging. Rapid Commun. Mass Spectrom. 28 (2), 185-190 (2014).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены