Method Article
Высокая Анализ Содержание скрининг для оценки токсикологических эффектов вредных и потенциально вредных компонентов (HPHC)
В этой статье
Резюме
The objective of the study was to assess the biological impact of 15 cigarette smoke constituents using a combination of an impedance-based real time cell analyzer and a high-content screening (HCS)-based platform for toxicological assessment in vitro. This study provides information on effective doses, toxicity and modes of action of the tested compounds.
Аннотация
Сигаретный дым (CS) является основным фактором риска развития сердечно-сосудистых и легочных заболеваний. Поскольку CS представляет собой сложный аэрозоль , содержащий более 7000 химических веществ 1 она является сложной задачей , чтобы оценить вклад отдельных компонентов в своей общей токсичности. Токсикологические профили отдельных компонентов, а также смеси могут быть , однако установлено в лабораторных условиях , с применением высокой пропускной ставить скрининговых инструментов, которые позволяют профилирование вредных и потенциально вредных компонентов (HPHCs) табачного дыма, как это определено продуктами и лекарствами США (FDA). 2
Для первоначальной оценки, инструмент импеданса на основе использовался для реального времени, этикетки свободной оценки токсичности соединения в. Прибор считывания зависит от адгезии клеток, жизнеспособность и морфологию, что все вместе обеспечивают обзор состояния клеток. Безразмерный параметр, названный индекс ячейки, используется для количественной оценки. Набор дифпротоколы окрашивания гой был разработан для флуоресцентных изображений на основе расследования и HCS платформа была использована для получения более подробную информацию о виде цитотоксичности, вызываемой каждым HPHC.
Из 15 протестированных составных частей, были отобраны только пять для HCS на основе анализа , поскольку они зарегистрировали вычислимый LD 50 (<20 мм). К ним относятся 1-aminonaphtalene, мышьяк (V), хром (VI), Кротоновый и фенолов. На основании их эффекта в HCS, 1-aminonaphtalene и Фенол может быть идентифицирован, чтобы вызвать нарушение функции митохондрий, и, вместе с хром (VI), как генотоксичное основано на усилении гистона Н2АХ фосфорилирования. Кротоновый был идентифицирован как окислительного стресса индуктора и мышьяк в качестве пути активатора стресс-киназы.
Это исследование показывает , что сочетание импеданса на основе и из HCS технологий обеспечивает надежный инструмент для оценки в пробирке CS компонентов.
Введение
Токсикологическая оценка рисков исторически опиралась на использование животных моделей, которые, хотя и фундаментальна в науках о жизни, также связаны с недостатками, такие как непоследовательного переводимости для людей и высокой стоимостью. Кроме того, наблюдается увеличение усилий , чтобы найти альтернативы тестирования на животных в духе "The 3П" 2 (замена, восстановление, и уточнения). Эти усилия были ускорены в течение последних нескольких лет, а не только из-за последних достижений, таких как методы с высокой пропускной способностью и системной биологии подходов, но и из-за законодательства, ограничивающего использование испытаний на животных, особенно в Европейском Союзе.
Сложность клеточных сигнальных путей, регулирующих реакцию на токсичных инсультов делает очевидным, что использование одиночных токсикологическим не будет достаточно, чтобы описать токсикологическую основе определенных соединений. Для этого, взаимодействие сотен взаимодействующих рroteins, способствующие биологической сети также должны быть приняты во внимание. Для изучения влияния токсикантов на этих сетях, система токсикологии подход в сочетании с фенотипическими средне- и скрининговых анализов с высокой пропускной способностью полезно сделать вывод о потенции и в то же время предоставить более подробную информацию о механизме действия отдельных токсикантов.
В данном исследовании мы использовали HCS как мощный инструмент скрининга, который состоит из автоматизированного микроскопа и биологического применения программного обеспечения, которое может приобретать, обрабатывать и анализировать данные изображения, полученные из конкретных флуоресцентных на основе клеточных анализов. Это позволяет визуально изменения внутри ячейки должны быть определены количественно, в одной клетке или субклеточном уровне, и множество параметров , которые будут анализироваться одновременно. 3 , например, ДНК двухцепочечной разрывы были оценены с использованием идентификации на основе антител гистона Н2АХ фосфорилирования и активные формы кислорода (ROS) были определены количественно с использованием клеток-ПЕРМЬeable супероксид чувствительный краситель.
Из - за легкого эпителиальные клетки представляют собой первый биологический барьер против ингаляционных токсикантов, в том числе сигаретного дыма, мы использовали первичные бронхиальные эпителиальные клетки в качестве модели в пробирке для профилирования эффект HPHCs опубликованных по контролю за продуктами и лекарствами США. 4 Эта рукопись является продолжением -до на предыдущем исследовании 5 , в котором мы оценивали биологическое воздействие другого подмножества HPHCs.
В рамках нашего рабочего процесса для оценки цитотоксичности в лабораторных условиях , мы первоначально оценивали потенций выбор 15 HPHC, используя в режиме реального времени клеточного анализа импеданса на основе системы (RTCA) , что позволило нам установить доза-диапазоны, пригодные для последующего HCS анализ (рисунок 1). Токсикологическую оценку HCS затем была проведена с использованием девяти многопараметрических конечных точек клеточной токсичности, каждый контролируется в двух временных точках (4 и 24 ч), Маркеры , используемые свидетельствовали о митохондриальной токсичности, повреждения ДНК, стресс - киназы, активные формы кислорода (ROS), глутатион содержание (GSH), каспазы 3 - 7 активности цитохром с выпуском и проницаемости клеточных мембран, как описано в таблице 1.
Наш подход позволил идентификация и характеристика влияния сигаретного дыма через дозы и времени зависимой выборки. В конечном счете, это произвело токсикологический профиль в пробирке для каждого HPHC. Мульти-omics подходы также могут быть использованы для дальнейшего дополнить анализ HCS. Это, наконец, и обеспечить более глубокое понимание воздействия на клеточной сигнализации и / или транскрипционном уровне.
протокол
1. Клетки бронхиального эпителия Сбор нормальных человеческих (NHBEs)
- Предварительно нагреть среду для культивирования клеток (бронхиальные эпителиальные рост клеток среднего дополненной среде), то HEPES, трипсин, и трипсин нейтрализующим раствором (ТНС) в водяной бане при 37 ° С.
- Сбора клеток при 80% слияния достигается.
Примечание: Следующая культура NHBE посева клеток условия могут быть использованы для получения оптимального слияния в непокрытых Т75 колбы с 20 мл среды:- Seed 1 × 10 6 клеток для 3-дневной культуре, 0,5 х 10 6 клеток для 4-дневной культуре и 0,25 × 10 6 клеток для 5-дневной культуры. Изменение средних каждые 2 дня, когда клетки в культуре, чтобы обновить питательные вещества. Культуры клеток при 37 ° С и 5% CO 2.
- Удалить супернатант из сосуда (ов) и добавьте HEPES , чтобы промыть клетки (например., 3 мл на 75 см 2 колбу). Поверните каждую колбу, чтобы покрыть клеточный монослой с золь HEPESсоциологическое загрязнение.
- Удалите раствор HEPES и добавляют раствор трипсина (например., 3 мл на 75 см 2 колбу). Поверните колбу, чтобы покрыть клеточный монослой с раствором трипсина.
- Выдержите в колбу в течение 5 мин при температуре 37 ± 2 ° C. Монитор открепления клеток под микроскопом и при необходимости инкубировать дольше и слегка постучите колбу, чтобы освободить оставшиеся прикрепленные клетки.
- Добавить TNS , чтобы остановить реакцию (например., 3 мл на 75 см 2 колбу) и передачи клеточной суспензии в 15 мл пробирку.
- Центрифуга клеточной суспензии при 300 х г в течение 5 мин.
- Жидкость над осадком сливают и вновь приостановить осадок клеток в 10 мл свежей среды, смешивая осторожно, чтобы получить однородную суспензию клеток.
- Фильтр суспензии клеток через клеточный фильтр 100 мкМ для удаления агрегатов и подсчета клеток. Примечание: В нашей лаборатории многоканальная система подсчета клеток электрического поля используется для точного и последовательно оценивать viablе число клеток.
2. Real Time Cell Analyzer (RTCA) основе дозы дальномер (ФПИ)
ПРИМЕЧАНИЕ: сопротивление на основе системы измерения используется для: 1) оценки токсичности соединения, 2) выбрать соединения, которые будут дополнительно исследованы с помощью HCS и 3) выберите соответствующие дозы для HCS. Клетки NHBE в пластинах RCTA дозируют путем добавления 25 мкл тестируемого соединения разведениях до 100 мкл среды, присутствующей в каждую лунку. Таким образом, все тестируемые растворы получают в 5 раз (5x) желаемой конечной концентрации.
- Посев NHBE клетки
- Программирование прибора для определения количества и продолжительности измерений импеданса. В этом исследовании данные были записаны каждые 15 мин в течение 48 часов (от 24 ч ± 2 ч до и 24 ч после введения дозы клеток с тестируемыми агентами).
- Измерьте пластине и с помощью пипетки 50 мкл подогретого среды в каждую лунку 96-луночного RTCA пластины. Примечание: Этот шаг представляет собой технические требованиядля прибора для расчета среднего электрического сопротивления, которая затем используется в качестве базового эталона для расчета на основе клеток.
- Приготовьте суспензию клеток при концентрации 144000 клеток / мл (± 5%) и добавляют приостановку 50 мкл клеток (7,200 клеток / лунку) в каждую лунку планшета RTCA, в котором 50 мкл / лунку среды уже добавлена для приборного фона измерение.
- Пусть клетки прилипать в течение 30 мин при комнатной температуре перед помещением их в каретку RTCA (для улучшения гомогенного распределения клеток). Инкубируйте пластин RTCA в колыбели RTCA в инкубатор (37 ° C и 5% CO 2) и начать запись данных для следующего 24 ± 2 ч до дозирования.
- Разведения HPHCs и положительного контроля
- Положительный контроль Разбавление
- Развести стауроспорину маточного раствора (10 мМ) в ДМСО 1:10 (таблица 3) и добавляют 5 мкл Dilution до 195 мкл среды для получения рабочего раствора 5x.
- HPHC Разбавление
- Растворить / Развести каждый HPHC в транспортном средстве (таблица 2) , чтобы сформировать 1 М маточного раствора. Развести каждый HPHC исходного раствора в соотношении 1:10 в среде для генерации 100 мМ раствор.
- Генерирование "соединение" мастер пластину, выполняя пятиступенчатый 1:10 серийное разведение с использованием среды + 10% транспортного средства для получения рабочих растворов 5x (Рисунок 2). Примечание: В конечном счете, окончательные дозы будут: 0,2 мкМ, 2 мкМ, 20 мкМ, 0,2 мм, 2 мм, 20 мм. Также готовят дозы 0, что соответствует единственному транспортном средстве, на этом шаге.
- дозирование
- Пауза инструмент RTCA и откройте подставку, чтобы удалить пластину.
- Снимите пластину и поместите его в инструмент температуры пластины RTCA (предназначенной для стабилизации температуры пластины RTCA в ходе экспериментальных процедур вне RTCAстанция), чтобы избежать охлаждения клеток, которые могут повлиять на измерения полного сопротивления.
- Добавить 25 мкл 5х раствора из "соединения основной пластины" к клеткам в трех экземплярах , поддерживая тот же порядок дозирования , как в соединении основной пластины (самая высокая доза в верхнем ряду и транспортного средства управления в строке номер 7) (рисунок 2). Не удаляйте существующий (100 мкл) среда для культивирования клеток.
- Добавьте 25 мкл 5х положительного контрольного раствора к клеткам в нижнем ряду (половинное справа) без удаления существующего культуральной среды. Добавьте 25 мкл среды для клеток в нижнем ряду (половинное слева) без удаления существующей клеточной культуральной среды.
- Уплотнение плита с планшетов. Поместите пластину обратно в базовую станцию RTCA и зафиксировать его. Перезапуск запись данных для требуемого времени экспозиции (например., 24 часа в сутки). Примечание: Применение этого герметика пленки рекомендуется, чтобы избежать возможного загрязнения, в том числе хорошо к хорошо перекрестного загрязнения.
- <сильный> Анализ данных RTCA и LD 50 Расчет
- Экспорт необработанных данных в виде текстового (.txt) или файла Excel (.xls). Примечание: Файл будет содержать всю информацию о макете пластины (соединений, доз и положения хорошо). Значения индекса Сырое ячейки организованы в 96-луночный формат (зеркальное отображение распределения луночного планшета) и обеспечиваются за каждый раз, точек, в которых имели место записи. Значение в позиции I в 96 - луночный планшет в момент Т обозначается CI T (I).
- Определить в качестве нормализации ссылки на последнюю точку времени перед дозированием для каждой позиции I в 96 - луночные планшеты (например, индекс клеток при 23 ч 50 мин 00 сек в положении I, CI T (I) = 23: 50: 00 = CI Ссылка (I)). Примечание: Эта информация должна быть аннотированный при выполнении дозирования.
- Разделить, на базе скважины, каждый раз, когда значения точки по ссылке нормализации для нормализации всех значений во время дозирования. Нормированное значение в PositioNi в 96 - луночный планшет в момент Т обозначается NCI T (I) , и, таким образом , определяется NCI T (I) = CI T (I) / CI Ссылка (I) при всех ^.
- Рассчитывают площадь под кривой (AUC) на 24 ч после введения дозы для каждого образца I (положение I в 96-луночный планшет), в том числе позиции для положительного контроля и транспортного средства.
- Получите АУК в положении я получается путем суммирования площадей каждого прямоугольника, каждый прямоугольник находится между двумя временных точках обозначим через т к и т л (т к <т л); вычислить каждую область прямоугольник с помощью х * у с х = т л - т к быть расстояние между двумя временных точках и у находящихся среднее значение активности двух временных точках (у = (NCI тк (I) + NCI ТЛ (я)) / 2).
Примечание: ППК через 24 часа после введения дозы для позиции г обозначается ППК (I). Поскольку все условия высевали в трех лунках медиана из трех значений используется.
<литий> Осуществить нормировку значений, используя следующее уравнение: - Получите АУК в положении я получается путем суммирования площадей каждого прямоугольника, каждый прямоугольник находится между двумя временных точках обозначим через т к и т л (т к <т л); вычислить каждую область прямоугольник с помощью х * у с х = т л - т к быть расстояние между двумя временных точках и у находящихся среднее значение активности двух временных точках (у = (NCI тк (I) + NCI ТЛ (я)) / 2).
- Участок и установите (с я, AUC_normalized (я)) -значения с использованием 4- х параметров уравнения Хилла. Когда это возможно, а также рассчитать LD 50.
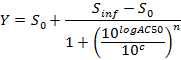
где Y = AUC_normalized,
Ноль Activity S уровень 0 = активность при нулевой концентрации испытуемого соединения,
Бесконечные активность S = уровень инф активность при бесконечной концентрации,
AC50 = концентрация , при которой активность достигает 50% от максимального уровня,
Коэффициент п = Мера склона на AC50 Хилл, и
с = концентрация в логарифмических единицах , соответствующих значениям на оси х доза-реакция кривой участка.
Примечание: AC50 соответствует LD 50 (цитотоксичности). Это является мерой потенции, где низкие значения указывают на высокую активность.
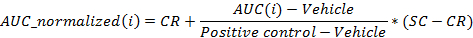
где я позиция в 96 - луночный планшет для которой ППК рассчитывалась на 24 ч после введения дозы,
Транспортное средство медиана значений ППК для транспортного средства лунок на планшете при 24 ч после введения дозы,
Положительный контроль является медиана АУК значений для положительных контрольных лунок на планшете , в 24 ч после введения дозы,
CR является требуемым средним нормализованное значение для транспортного средства (0%), и
SC является искомой медианный нормализованное значение для положительного контроля (-100%)
Примечание: В конце этого этапа, набор данных получается, что содержит, для каждой позиции I в 96-луночный планшет, концентрации ci (в логарифмических единицах), который применяется к выборке, содержащейся в положении / лунку I и его соответствующий нормированная AUC на 24 ч после дозирования AUC_normalizEd (I).
- Положительный контроль Разбавление
3. Измерение токсикологических эффектов от HCS
Примечание: В общей сложности девять многопараметрических маркеров токсичности, сгруппированных в шести различных анализах, которые измеряют с использованием HCS платформы (таблица 1). На основе анализа жизнеспособности клеток RTCA (Раздел 2) диапазон доз каждого компонента определяется и референсная доза 3R4F также включена. Эталонная доза эквивалентна сумме HPHC, присутствующего в дыме одной палки из опорного сигарет 3R4F.
- Посев NHBE клетки
- Приготовьте суспензию клеток при 120000 клеток / мл (± 5%) и добавляют 100 мкл суспензия клеток в каждую лунку HCS пластины 96-луночного (12000 клеток / лунку). Подготовьте достаточное количество пластин для оценки всех анализов (цитотоксичности, повреждения ДНК, стресс-киназы, ROS, содержание GSH и апоптозу) и временных точках (4 и 24 часа в сутки).
- Оставьте пластины HCS при комнатной температуре в течение 30 мин, чтобы позволить клеткам прикрепляться к лункам и затем инкубируют при 37 ° С и 5% СО 2 в течение 24 ± 2 ч до дозирования.
- Разбавление HCHPs и положительного контроля
Примечание: Клетки NHBE в пластинах из HCS дозируется путем добавления 25 мкл растворов образцов теста по 100 мкл среды, уже присутствующей в каждую лунку. Таким образом, все дозы приготавливают в 5х желаемой конечной концентрации.- Положительный контроль Разбавление (Положительный контроль Plate)
- Разлить 40 мкл исходного раствора каждого положительного контроля (таблица 3) в колонке № 2 (рис 4а, лунки затененных красным цветом). Разлить по 20 мкл транспортного средства в колонках # 3 и # 5 (рис 4а, затененные скважины в светло - голубой) и 40 мкл транспортного средства в колонке № 4 (рис 4а, колодцы затененные в светло - голубой).
- Вывод 12 мкл из лунок в колонке №2, дозировать его в лунки в колонке 3 и перемешать (Рисунок 4b), Продолжают до окончательного серийного разведения 3 дозами (Д1, Д2, и d3) и транспортного средства (V) для каждого положительного контрольного соединени получают (фиг.4С). Для создания положительного контроля пластины, подготовить 1:40 раствор соединений в средствах массовой информации (рис 4г).
- HPHC Разбавление (соединение Master Plate)
Примечание: выбранные диапазоны доз HPHCs для HCS приведены в таблице 2.- Развести каждый HPHC исходного раствора (1 М) в соотношении 1:10 в среде для концентрации 100 мМ. Выполните разведений с использованием среды с 10% транспортного средства, чтобы получить выбранные 5x дозы для каждого HPHC.
- Положительный контроль Разбавление (Положительный контроль Plate)
- дозирование
- Добавьте 25 мкл 5x растворов из основной пластины соединения к клеткам в трех экземплярах , сохраняя тот же порядок дозирования , как в соединении основной пластины ( самую высокую дозу в верхнем ряду и транспортного средства управления в строке номер 7) (рисунок 5). Не удаляйте еxisting (100 мкл) среда для культивирования клеток.
- Добавьте 25 мкл 5х раствора из положительной контрольной пластины к клеткам в нижнем ряду сохраняя тот же порядок дозирования , как и в положительной контрольной пластины (рисунок 5). Не удаляйте существующий (100 мкл) среда для культивирования клеток. Примечание: Каждый анализ имеет определенный положительный контроль; см Таблица 3. Инкубируйте планшет при 37 ° С и 5% CO 2 в течение желаемого времени экспозиции (4 или 24 ч).
- Окрашивание
- Подготовка всех Assays
- Предварительно нагреть буфера Wash (PBS), растворы которых при 37 ° С.
- Приготовьте раствор фиксация (4% раствор формальдегида) прибавление 10,81 мл 37% формальдегида в 89.19 мл промывочного буфера и предварительно прогреть его при 37 ° С.
- Готовят буфер пермеабилизирующего добавлением 10 мл 10-кратного буфера пермеабилизации до 90 мл промывочного буфера и предварительно прогреть его при 37 ° С.
- Подготовьте BloCking буфер добавлением 10 мл 10x блокирующего буфера в 90 мл промывочного буфера и предварительно прогреть его при 37 ° С.
- Предварительно нагреть среду для культивирования клеток при 37 ° С.
- Удалите пластины HCS из инкубатора после того, как 4 и 24 раза воздействия ч достигаются и выполняют следующие конкретные протоколы для каждого анализа.
- цитотоксичности
- Приготовьте достаточный объем (V) живых Окрашивание сотового раствора в соответствии со следующей формулой: объем среды (мкл) V = 50 х Ш х 1,2 (Вт Количество скважин)
- Разведите краситель митохондрии в живой клетке Окрашивание раствора в соответствии с инструкцией производителя. Разведите краситель проницаемости мембраны в живой клетке Окрашивание раствора в соответствии с инструкцией производителя.
- Добавьте 50 мкл раствора Окрашивание живых клеток в каждую лунку планшета (ов), помеченного знаком "цитотоксичности". НЕ удалить культуральную среду клеток и инкубируют в течение 30 мин при температуре 37 ° С, 5% СО 2.
- Аккуратно аспирата среды и окрашивания раствора и добавляют 100 мкл / лунку фиксации раствора в каждую лунку, а затем инкубировать пластину (ы) в течение 20 мин при комнатной температуре в темноте.
- Аккуратно аспирата фиксации раствора и промыть один раз 100 мкл / лунку промывочный буфер.
- Удалить промывочный буфер и добавьте 100 мкл / лунку буфера 1x пермеабилизирующего в каждую лунку и инкубировать в течение 10 мин при комнатной температуре в темноте.
- Отберите буфер пермеабилизации и мыть пластины дважды 100 мкл / лунку буфера для промывки.
- Отберите промывочный буфер и добавьте 100 мкл 1x блокирующим буфером в каждую лунку и инкубировать в течение 15 мин при комнатной температуре в темноте.
- Приготовьте достаточный объем (V) первичного антитела из раствора в соответствии со следующей формулой: объем блокирующего буфера (мкл) V = 50 х Ш х 1,2 (Вт Количество скважин). Развести анти-цитохром С антитела (мыши) 1: 250 в растворе первичного антитела.
- Отберите блокирующего буфераd добавить 50 мкл / лунку первичного антитела раствора в каждую лунку и инкубировать в течение 60 мин при комнатной температуре в темноте.
- Приготовьте достаточный объем (V) вторичной антителам и атомному раствора в соответствии со следующей формулой: объем блокирующего буфера (мкл) V = 50 х Ш х 1,2 (Вт Количество скважин). Развести антитела против мышиного 1: 500 в вторичное антитело и ядерное решение. Развести ядерный краситель 1: 1000 в вторичного антитела и ядерного решения.
- Отберите первичного антитела раствор и мыть пластины в три раза с 100 мкл / лунку буфера для промывки с помощью промывки планшетов.
- Отберите буфер для промывки и добавляют 50 мкл / лунку вторичными антителами и атомному раствора в каждую лунку планшета (ов) и инкубируют в течение 60 мин при комнатной температуре в темноте.
- Отберите вторичное антитело и ядерное решение и мыть пластины в три раза с 100 мкл / лунку буфера для промывки с помощью промывки планшетов. Добавьте 100 мкл / лунку буфера для промывки. Пластина (ы) является (являются) в настоящее времяготов оценивать на читателя HCS.
- Повреждение ДНК Анализ
- Аккуратно аспирата среду из пластин обозначенных "повреждение ДНК".
- Выполните те же действия, как описано в следующей последовательности: 3.4.2.4 - 3.4.2.8. Обратите внимание, что в данном случае, только среду удаляют во время стадии 3.4.2.4.
- Приготовьте достаточный объем (V) первичного антитела из раствора в соответствии со следующей формулой: объем блокирующего буфера (мкл) V = 50 х Ш х 1,2 (Вт Количество скважин)
- Развести анти-фосфо H2AX антитела (мыши) 1: 2000 в растворе первичного антитела.
- Выполните те же действия, как описано в 3.4.2.10.
- Приготовьте достаточный объем (V) из вторичного антитела и ядерного раствора в соответствии со следующей формулой: объем блокирующего буфера (мкл) V = 50 х Ш х 1,2 (Вт Количество скважин)
- Развести антитела против мышиного 1: 500 в вторичное антитело и ядерное решение.
- Развести Nucleaг красителя 1: 1000 в вторичного антитела и ядерного решения.
- Выполните те же действия, описанные в следующей последовательности: 3.4.2.12-3.4.2.14.
- Стресс киназы
- Аккуратно аспирата среду от каждой из пластин обозначенных "Stress" киназы.
- Выполните те же действия, как описано в следующей последовательности: 3.4.2.4 - 3.4.2.8. Обратите внимание, что в данном случае, только среду удаляют во время стадии 3.4.2.4.
- Приготовьте достаточный объем (V) первичного антитела из раствора в соответствии со следующей формулой: объем блокирующего буфера (мкл) V = 50 х Ш х 1,2 (Вт Количество скважин)
- Развести анти-фосфо cJun антитела (кролик) 1: 200 в растворе первичного антитела.
- Выполните те же действия, как описано в 3.4.2.10.
- Приготовьте достаточный объем (V) из вторичного антитела и ядерного раствора в соответствии со следующей формулой: объем блокирующего буфера (мкл) V = 50 х Ш х 1,2 (Вт Количество скважин)
- Развести антителам кролика 1: 500 в вторичное антитело и ядерное решение.
- Развести ядерный краситель 1: 1000 в вторичного антитела и ядерного решения.
- Выполните те же действия, описанные в следующей последовательности: 3.4.2.12-3.4.2.14.
- ROS Анализ
- Приготовьте достаточный объем (V) живых клеток окрашивающего раствора в соответствии со следующей формулой: объем среды (мкл) V = 50 х Ш х 1,2 (Вт Количество скважин).
- Разведите краситель ROS в живой клетке Окрашивание раствора в соответствии с инструкцией производителя
- Развести ядерный краситель 1: 1000 в живой клетке Окрашивание Solution.3.4.5.4) Добавить 50 мкл Живая Cell окрашиванию раствора в каждую лунку планшеты обозначенных "РОС"; НЕ извлекайте носитель клеточной культуры и инкубировать в течение 30 мин при комнатной температуре в темноте.
- Аккуратно аспирата среды и окрашивания раствора и промойте пластину три раза с 100 мкл / лунку среды.
- Аспирируйте среды, добавьте 100 _6, л / лунку фиксации раствора в каждую лунку и инкубировать пластины в течение 20 мин при комнатной температуре в темноте.
- Аккуратно аспирата фиксации раствора и Промывают планшет три раза 100 мкл / лунку промывочным буфером.
- Добавьте 100 мкл / лунку буфера для промывок. Пластина (ы) является (являются) готов к работе.
- Оценить пластину на читателя HCS в течение 1 часа.
- GSH Содержание Анализ
- Приготовьте достаточный объем (V) живых клеток ядерное окрашивание раствора в соответствии со следующей формулой: объем среды (мкл) V = 50 х Ш х 1,2 (Вт Количество скважин).
- Развести ядерной краситель (Дальний красный) 1: 1000 в живой клетке ядерной Окрашивание Solution.3.4.6.3). Добавьте 50 мкл живой клетки ядерного окрашивающего раствора в каждую лунку планшетов обозначенных "содержание GSH". НЕ извлекайте носитель клеточной культуры и инкубировать в течение 30 мин при 37 ° С, 5% СО 2.
- Приготовьте достаточный объем (V) живых клеток GSH окрашивающего раствора в соответствии соследующая формула: Объем HBSS (мкл) V = 50 х Ш х 1,2 (Вт Количество скважин)
- Разведите краситель GSH в живой клетке GSH Окрашивание Решение в соответствии с инструкциями поставщика.
- Аккуратно аспирата среды и раствора ядерное окрашивание и Промывают планшет трижды с 100 мкл / лунку среды.
- средней и добавьте 100 мкл / лунку живых клеток GSH окрашиванию раствора в каждую лунку планшета (ов) Аспирируйте.
- Инкубировать в течение 10 мин при комнатной температуре в темноте. Пластина (ы) является (являются) готов к работе.
- Оценить пластину (ы) на HCS чтения в течение 1 часа.
- Апоптоз Анализ
- Приготовьте достаточный объем (V) живых клеток окрашивающего раствора в соответствии со следующей формулой: объем среды (мкл) V = 50 х Ш х 1,2 (Вт Количество скважин).
- Разведите краситель каспазы 1: 300 в живой клетке окрашивающего раствора.
- Удалить среды для культивирования клеток, добавить 50 мкл Живая сотовый окрашиванию раствора в каждую лунку тон пластина (ы) , назначенный "Апоптоз" и инкубировать в течение 30 мин при температуре 37 ° С, 5% СО 2.
- Приготовьте достаточный объем (V) живых клеток ядерное окрашивание раствора в соответствии со следующей формулой: объем Фикс раствора (мкл) V = 50 х Ш х 1,2 (Вт Количество скважин).
- Развести ядерный краситель 1: 1000 в живой клетке ядерной окрашивающего раствора.
- Удалите раствор живого окрашивания клеток, добавляют 100 мкл / лунку живых клеток ядерное окрашивание раствора в каждую лунку планшета (ов) и инкубировать в течение 30 мин при комнатной температуре в темноте.
- Аспирируйте решение фиксаторный / ядерного красителя и мыть пластины (ы) в три раза с 100 мкл / лунку буфера для промывок.
- Добавьте 100 мкл / лунку буфера для промывок. Пластина (ы) является (являются) готов к работе.
- Оценить пластину (ы) на читателя HCS.
- Подготовка всех Assays
- Анализ данных HCS
- Экспорт необработанных данных в виде файла Excel (.xls). Примечание: значения индекса Raw ячейки организованы в виде 96-луночногов (зеркальное отображение распределения луночного планшета) и предоставляются на каждые конечные точки в данный момент времени точка после приема препарата.
- Осуществить нормировку значений, используя следующее уравнение:
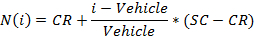
где I является измеренное исходное значение сигнала скважины,
Автомобиль является медианой измеренных значений сигнала для транспортного средства скважин на пластине,
CR является требуемым средним нормализованное значение для транспортного средства (0%), и
SC является требуемым средним нормализованное значение для положительного контроля (100),
Примечание: В конце этого этапа, набор данных получается , что содержит, для каждой позиции I в 96 - луночный планшет, концентрации с I (в логарифмических единицах) , который был применен к образцу , содержащейся в положении / лунку I и его соответствующий нормированного сигнала N (I). - Участок и соответствовать (с я, N (я)) - значения с помощью 4- х параметров уравнения Хилла,
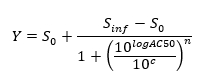
где ноль Activity S уровень 0 = активность при нулевой концентрации испытуемого соединения,
Бесконечные активность S = уровень инф активность при бесконечной концентрации,
AC50 = концентрация , при которой активность достигает 50% от максимального уровня,
Коэффициент п = Мера склона на AC50 Хилл, и
с = концентрация в логарифмических единицах , соответствующих значениям на оси х доза-реакция кривой участка.
Примечание: AC50 является мерой потенции, где низкие значения указывают на высокую активность.
Результаты
RTCA
Поскольку HCS конечные точки не будут информативны при отсутствии токсического эффекта не обнаружено, эти соединения не показаны уменьшилась Жизнеспособность клеток до самой высокой концентрации в RCTA не испытанной HCS (рис 3b, C, D, G, K, L, M , р). Соединения , показывающий снижение жизнеспособности клеток только на самой высокой концентрации (рис 3e, о) также для HCS отменяется. И, наконец, только компоненты с вычислимой LD 50 (<20 мм) выбирают для дальнейшего анализа HCS (рис 3а, F, H, J, N). HPHCs, отвечающие вышеуказанным критериям, являются: 1-aminonaphtalene, мышьяк (V), хрома (VI), Кротоновый и фенолом.
HCS
В Quality Check (QC), положительные элементы управления фисначала анализируется, чтобы гарантировать, что процедуры окрашивания выполняется правильно. Представительные фотографии положительных контрольных клеток , обработанных показаны на рисунке 6. Значения данных нормированы на транспортном средстве , как это описано ранее. Нет зависимостей доза-ответ не показаны как только три дозы протестированы и не все три дозы рассматриваются на каждом временной точке. Положительные дозы управления выбраны (на основе предыдущих экспериментов, данные не показаны) таким образом, что соответствующие реакции наблюдаются для каждой конечной точки на обоих 4 ч и 24 ч. В частности дозах 1 и 2 используются для оценки эффекта при 4 ч, при этом дозы 2 и 3 используются для оценки эффекта через 24 часа. Плиты отбрасываются, если ответ не наблюдается положительных доз управления. Обратите внимание, что для всех конечных точек, за исключением митохондриального мембранного потенциала и содержания GSH, увеличение интенсивности сигнала, как ожидается.
Все соединения, за исключением Фенол, индуцированных некротической Pheno тип, основанный на повышенной проницаемости клеточных мембран (рис 7а, F, H, L). 1-aminonaphtalene, хром (VI), Кротоновый и Фенол были идентифицированы как генотоксичен на основе расширения фосфорилирования гистона H2AX (рис 7E, J, п, р). Были найдены Фенол и 1-aminonaphtalene , чтобы вызвать серьезное нарушение функции митохондрий (рис 7b, о) , которая, с 1-aminonaphtalene, привело к увеличению высвобождения цитохрома С (рис 7в). Обнаружение повышенной активности каспазы 3/7 представили доказательства апоптического случае при воздействии хрома. Окислительный стресс индукции (ROS или GSH) также была обнаружена при обработке 1-aminonaphtalene, КРОТОНАЛЬДЕГИД и Фенол (рис 7d, м, д). И, наконец, Мышьяк индуцирует клеточный стресс , как показано увеличенным фосфорилированием фактора транскрипции cJun (рис 7g).
нагрузка / 53987 / 53987fig1.jpg "/>
Рисунок 1. Соединение Tox-Profiler рабочего процесса. А) Схема рабочего процесса с последующим в данном исследовании. Во- первых, доза-дальномер была выполнена с использованием платформы RTCA для выбора подходящих доз для последующего HCS , чтобы охарактеризовать профили токсичности составных конкретных. Б) опытно - конструкторские исследования. 24 ч после посева клетки были питателем и значения полного сопротивления под постоянным контролем в течение следующих 24 часов, в то время как HCS конечные точки были исследованы 4 и 24 ч после введения дозы. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
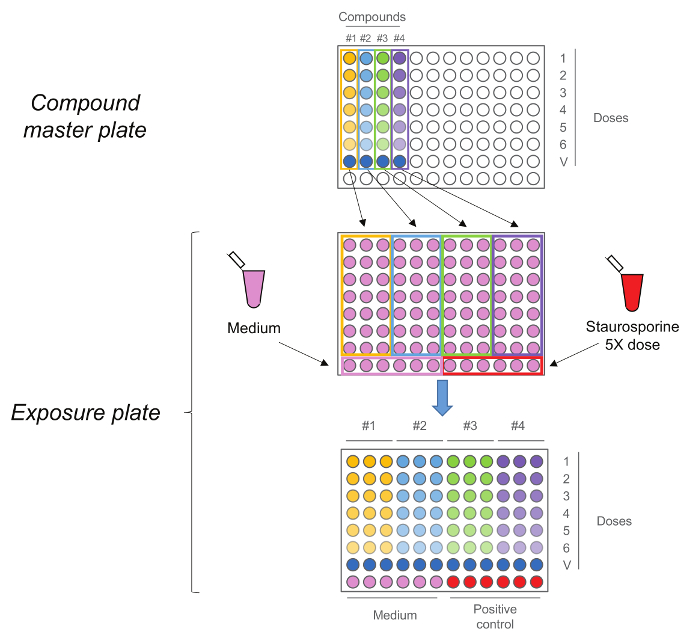
Рисунок 2. RTCA экспозиции пластины. Соединение мастер пластины сначала генерируется посредством выполнения пятиступенчатый 1:10 серийное разведение. Каждое соединение,в том числе управления транспортным средством (доза 0) затем добавляют в трех экземплярах на экспозицию пластины вместе со средой и стауроспорину в качестве контрольной группы. Следует отметить , что дозы последовательность сохраняется при передаче, высокие дозы в строке номер 1 во время управления автомобилем в строке № 7. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
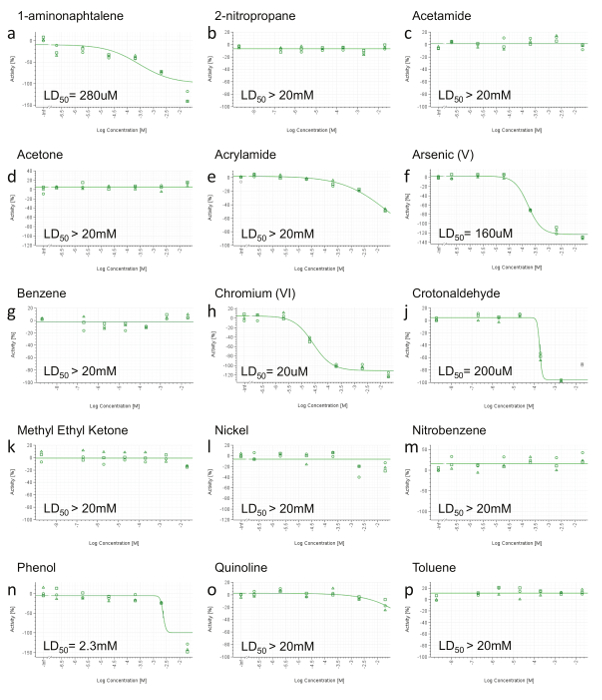
Рисунок 3. Представитель RTCA Жизнеспособность клеток Результаты. А) 1-aminonaphtalene, б) 2-нитропропана, с) ацетамида, d) Ацетон, д) акриламид, е) Мышьяк (V), г) Бензол, ч) Хром (VI) , , J) Кротоновый, к) метилэтилкетон, л) Nickeл (II), м) нитробензол, п) фенолом, о) хинолина, р) толуолом. На 24 ч после введения дозы, площадь под кривой (AUC) рассчитывали для каждой дозы (в том числе положительного контроля и транспортных средств), а также нормализованы в пределах от 0 до -100% активности (ось у), где 0 отражает активность транспортное средство и -100 положительного контроля. Значения затем были построены и оборудованы с использованием четырех параметров уравнения Хилла и, когда это возможно, LD 50 был рассчитан. Концентрации выражаются в логарифмической шкале (ось х). Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
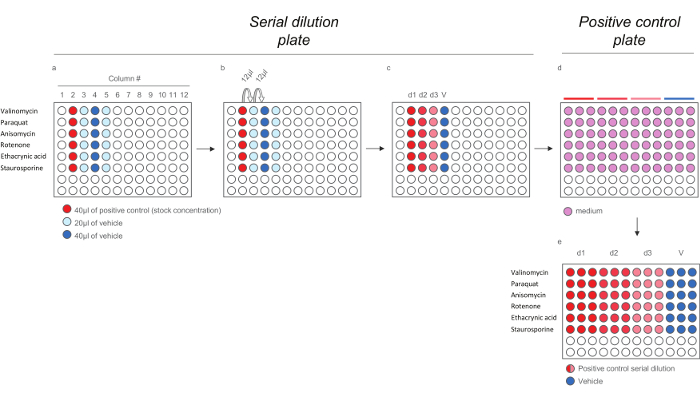
Рисунок 4. Схема Разбавление для положительных соединений управления для HCS Assays. А) Добавление положительного контроля вебиль к последовательному разбавлению пластины. б) серийного разведения положительного контроля. с) 200X положительные контрольные дозы. де) разбавление 200x положительных контролей доз в среде (1:40) для создания положительного контроля пластину , содержащую 5 - кратного доз. Обратите внимание , что каждая доза разводится в трех экземплярах , чтобы отразить окончательный макет в экспозиции пластины). Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
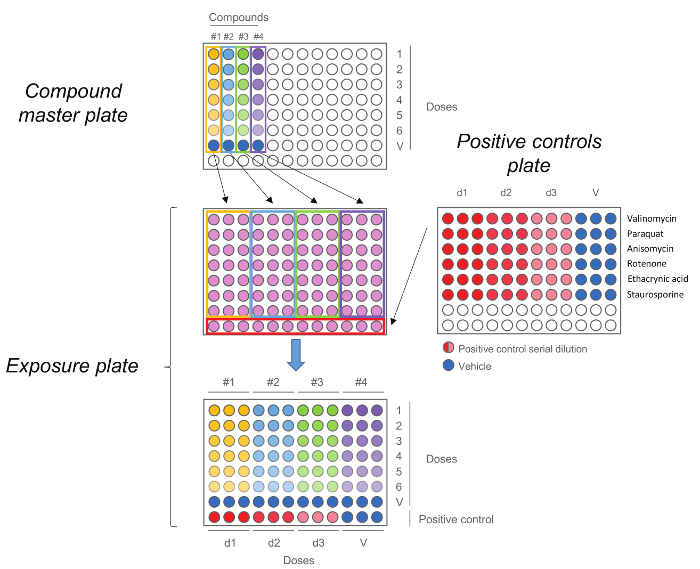
Рисунок 5. HCS экспозиции пластины. Соединение мастер пластины сначала генерируется посредством выполнения пятиступенчатый разбавления с. Каждое соединение, в том числе управления транспортным средством (доза 0) затем добавляют в трех экземплярах на экспозицию пластины вместе с положительным контролем. Обратите внимание, что порядок дозы сохраняется при передаче,высокие дозы в строке номер 1 во время управления автомобилем в строке № 7. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
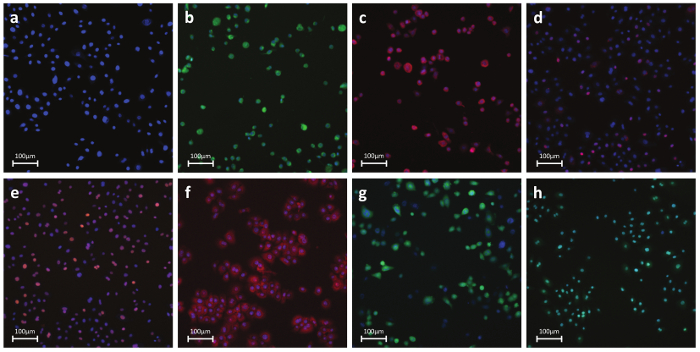
Рисунок 6. Представитель Флуоресцентные Фотографии или антитело Dye-окрашенных клеток а) ядерных параметров - Ядерный краситель:. Проницаемой краситель , который связывается с ДНК в живых или фиксированных клеток. Этот краситель используется для идентификации отдельных клеток к маркировке ядерной области б) некроз - проницаемости клеточных мембран краситель:. На основе красителя обнаружения целостности клеточных мембран. Реагент внутренне непроницаема к клеточной мембране. Во время некроза, мембрана становится проницаемой и краситель проникает в клетку и связывается с ДНК создания сильного флуоресцентного S. ignal с) Апоптоз - цитохром C: антителам на основе обнаружения высвобождения цитохрома С, известный отличительный признак раннего апоптоза. После индукции апоптоза, цитохром с высвобождается из митохондрий и диффундирует в ядро г) Повреждение ДНК - pH2AX:.. Антитело на основе обнаружения фосфорилирования гистона H2AX, известный признак разрывов двойной нити ДНК д) стресс киназного - cJun:. Антитело на основе обнаружение фосфорилирования на Ser-73 cJun, хорошо известной отличительной чертой клеточного стресса F) Окислительный стресс - ДНЕ: Водорастворимые обнаружение супероксидных радикалов. Сам Dihydroethidium флуоресцирует синего в цитоплазме , а окисленная форма этидий флуоресцирует красный на ДНК интеркаляции г) GSH - mBcl:. Водорастворимые обнаружение свободных молекул GSH. mBcl реагирует с GSH нагенерировать сильно флуоресцирующие продукт ч) Апоптоз - каспазы 3/7 активации:. водорастворимыми обнаружение каспазы 3/7 активности. Реагент нефлуоресцирующего с пептидным четыре аминокислоты, который ингибирует связывание ДНК. После каспазы-3/7 активации, пептид отщепляется позволяет красителю связываться с ДНК и производят яркий, флуорогенный ответ. Панели Bh показывают положительный контроль обработанных клеток. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
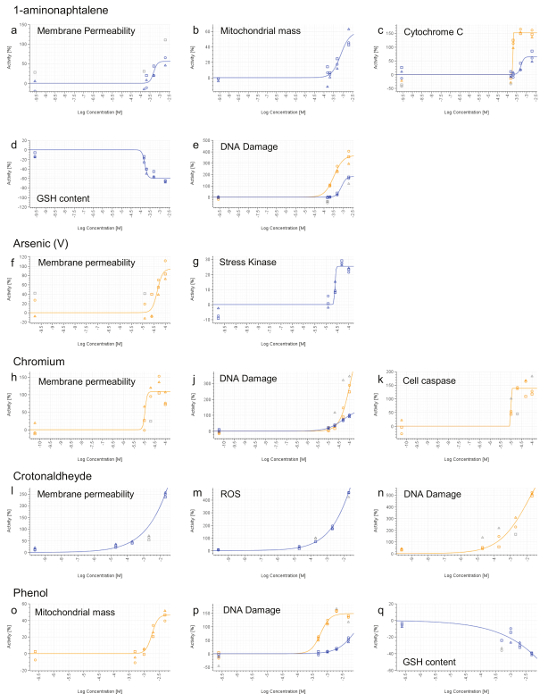
Рисунок 7. Результаты представитель HCS. 1-aminonaphtalene (АЭ), мышьяк (V) , (е и г), хром (VI) , (Hk), Кротоновый (п) и фенолов (OQ). 4 ч (синяя линия) иСигналы 24 часа в сутки (оранжевая линия) были рассчитаны для каждой дозы и нормированы на активности транспортного средства (0%). Значения, которые не включены в аппроксимации кривой вычислений показаны серым цветом. Концентрации выражаются в логарифмической шкале (ось х). Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
| анализ | Конечная точка # | Биологическая конечная точка | Клеточная отсек | функция Output |
| Цитотоксичность | 1 | Митохондриальная масса 6 | цитоплазма | Пятно средняя площадь |
| 2 | Митохондриальная мембранного потенциала 6 | цитоплазма | Пятно средней интенсивности | |
| 3 | релиз цитохрома C 7 | ядро | Средняя интенсивность | |
| 4 | Проницаемость клеточных мембран 8 | ядро | Средняя интенсивность | |
| Повреждение ДНК | 5 | фосфо-H2AX 9 | ядро | Средняя интенсивность |
| Стресс-киназа | 6 | фосфо-cJun 10 | ядро | Средняя интенсивность |
| ROS | 7 | ROS 11 | ядро | Средняя интенсивность |
| содержание GSH | 8 | GSH 12 | цитоплазма | Пятно средней интенсивности |
| апоптоз | 9 | Каспазы 3 13 | цитоплазма | Пятно средней интенсивности |
Таблица 1. Список HCS Assays и конечные точки.
| Средство передвижения | RTCA дозы (мкМ) | LD 50 | дозы HCS | |||||||||||
| Жизнеспособность клеток отобранных (мкМ) | 3R4F (нмоль) | |||||||||||||
| 1-Aminonaphtalene | EtOH | 20000 | 2000 | 200 | 20 | 2 | 0,2 | 280 мкМ | 2000 | 500 | 200 | 150 | 0,27 | |
| 2-нитропропан | EtOH | 20000 | 2000 | 200 | 20 | 2 | 0,2 | > 20 мМ | ||||||
| ацетамид | EtOH | 20000 | 2000 | 200 | 20 | 2 | 0,2 | > 20 мМ | ||||||
| Ацетон | вода | 20000 | 2000 | 200 | 20 | 2 | 0,2 | > 20 мМ | ||||||
| акриламид | вода | 20000 | 2000 | 200 | 20 | 2 | 0,2 | > 20 мМ | ||||||
| Мышьяк (V) | вода | 20000 | 2000 | 200 | 20 | 2 | 0,2 | 160 мкМ | 200 | 100 | 50 | 25 | 0,17 | |
| Бензол | EtOH | 20000 | 2000 | 200 | 20 | 2 | 0,2 | > 20 мМ | ||||||
| Хром (VI), | вода | 20000 | 2000 | 200 | 20 | 2 | 0,2 | 20 мкМ | 100 | 50 | 20 | 10 | 0.06 | |
| Кротоновый | вода | 20000 | 2000 | 200 | 20 | 2 | 0,2 | 200 мкМ | 20000 | 2000 | 200 | 20 | 2000 | |
| Метилэтилкетон | вода | 20000 | 2000 | 200 | 20 | 2 | 0,2 | >20 мМ | ||||||
| никель | вода | 20000 | 2000 | 200 | 20 | 2 | 0,2 | > 20 мМ | ||||||
| нитробензол | EtOH | 20000 | 2000 | 200 | 20 | 2 | 0,2 | > 20 мМ | ||||||
| Фенол | EtOH | 20000 | 2000 | 200 | 20 | 2 | 0,2 | 2,300 мкМ | 5000 | 2000 | 1000 | 500 | 240 | |
| хинолина | EtOH | 20000 | 2000 | 200 | 20 | 2 | 0,2 | > 20 мМ | ||||||
| Толуол | вода | 20000 | 2000 | 200 | 20 | 2 | 0,2 | > 20 мМ | ||||||
Таблица 2. Перечень тестируемых соединений HPHC с относительной ЛД 50 в 24 ч лечения. Соединения , выбранные для анализа HCS выделены оранжевым цветом , и испытанных доз также приведены. Доза 3R4F эквивалентно количеству компонента, присутствующего в дыме одной палки из опорного сигарет 3R4F.
| анализ | Соединение | Основной раствор | растворитель | Доза (ы) (мкМ) | ||
| Жизнеспособность клеток | стауроспорином | 10 мМ | ДМСО | 50 | ||
| Цитотоксичность | валиномицином | 10 мМ | ДМСО | 50 | 20 | 5 |
| Повреждение ДНК | Paraquat | 100 мМ | ДМСО | 500 | 200 | 50 |
| Стресс-киназа | Anisomycin | 2 мМ | ДМСО | 10 | 4 | 1 |
| ROS | Ротенон | 200 мМ | ДМСО | 1000 | 400 | 100 |
| содержание GSH | этакриновая кислота | 200 мМ | ДМСО | 1000 | 400 | 100 |
| апоптоз | стауроспорином | 40 мМ | ДМСО | 200 | 50 | 20 |
Таблица 3. Перечень положительного контроля и концентрациях , используемых для каждого анализа.
Обсуждение
Потребности в альтернатив экспериментам на животных, а также для новых подходов к тестированию с высокой пропускной способностью широко обсуждались в течение последних лет. Это привело ученых и регулирующих органов, чтобы изучить альтернативные методы для стандартного тестирования токсичности, используя клеточные анализы, которые тесно имитирующие физиологии тканей-мишеней. В данном исследовании мы продемонстрировали применимость объединения анализатора клеток в режиме реального времени (RTCA) с высоким содержанием Скрининг (HCS) платформы для оценки последствий воздействия отдельных составных частей CS на клетки эпителия легкого человека. Эта установка может быть аналогично применены для оценки цитотоксичности, вызванной различными другими воздухе загрязняющих веществ, взвешенных в воздухе частиц и наночастиц. Кроме того, полученные результаты могут быть сопоставлены с теми, от всего генома транскриптомику и вычислительных методов, основанных на причинных биологических сетей. Как сообщалось ранее, этот подход позволил нам подтвердить данные о молекулярном путивозмущение по CS экспозиции 5 с HCS концами, обращаясь эти направления в возмущения также фенотипу.
В анализе блок - схемы, анализ в режиме реального времени клеток обеспечивает жизнеспособность клеток , связанных с информацией в дозы и времени зависит от разрешения, что позволяет лучше принятия решений , которые доза и время экспозиции точка может быть благоприятным для нисходящего анализа 14. Принцип работы анализатора основан на изменении электрического сопротивления, порожденного клетками, поскольку они придают и распространение на поверхности культуры хорошо покрыты золотой микроэлектродом. Импеданс преобразуется в безразмерный параметр с именем клеточно-индекс, который может быть использован для контроля адгезии клеток, распространяясь, морфологии и в конечном счете жизнеспособность клеток. Хотя этот метод не дает информации о цитотоксическими механизмами, его чувствительность позволяет обнаружить морфологических клеточных изменений, даже при очень низких дозах, при которых HCS не информативна (данные не показаны). На основе previленные эксперименты, мы заметили, что методология RTCA способна обнаружить морфологические изменения в более низких дозах по сравнению с HCS конечными точками.
После первоначального скрининга с анализатором в режиме реального времени ячейки, HCS платформа была использована для получения более подробную информацию о виде цитотоксичности, вызываемой каждым HPHC. HCS анализ позволил панель к профилю HPHCs в сторону их потенциального воздействия на клеточные компартменты / органеллы, а также для выявления тех, выявляя генотоксичность или оксидативный стресс. Проведенный анализ выявил различные профили в котором выбранные HPHCs индуцируют цитотоксичность в клетках NHBE. В общем, все соединения, за исключением того, фенолом, было обнаружено, вызывают некроз в самой высокой испытанной дозе. В соответствии с потенциальной роли в развитии рака 1-aminonaphtalene индуцированного фосфорилирования H2AX в качестве маркера для генотоксичности, однако HCS панель также непокрытой активность этого HPHC в считывании митохондриальной токсичности (масса увеличилась и цитохрома С releaSE) и окислительный стресс (истощение GSH). Точно так же, как было описано ранее, Фенол был идентифицирован, чтобы вызвать нарушение функции митохондрий, а также привести к повреждению ДНК, а также истощение GSH. Хром (VI), одно из соединений, классифицированных как группа I канцерогенов, и Кротоновый были также и идентифицированы как генотоксичное, в частности, хрома (VI) также индуцирует апоптоз (каспазы активации каскада) и Кротоновый вызвало увеличилось поколение ROS. Наконец мышьяк (V), было обнаружено, что индуцирует фосфорилирование cJun который является маркером активации пути стресс-киназы.
В этом исследовании мы использовали клетки NHBE в качестве модели для легких эпителиальных клеток в пробирке. С помощью этих клеток в условиях HCS является беспрецедентным и позволило исследование более широкого круга конечных точек, в том числе генотоксичности и окислительного стресса маркеров. Оба живой клетки и неподвижные подходы окрашивания клеток были описаны в наших протоколах, демонстрируя гибкость общей методики. В Fакт, те же самые протоколы могут быть применены к более широкому кругу задач, которые могут быть решены с использованием любого флуоресцентного красителя или антитела. За успешное выполнение протоколов живых окрашивания, важно соблюдать время инкубации, так как некоторые из красителей имеют ограниченный период полураспада и сигнал флуоресценции может уменьшаться до получения изображения завершена. Кроме того, важно учитывать, что, если используется другой тип клеток, все условия окрашивания должны быть пересмотрены, как концентрация оптимального красителя и времени инкубации может быть различной.
В настоящей работе мы описали сценарий, в котором только пять соединений, в которых скринингу с использованием методологии HCS. С учетом ранее описанной компоновки пластин, они были питателем более 2-х различных наборов пластин в общей сложности 24-луночных планшетах (6 анализов и 2 временные точки) .The количество пластин также может быть увеличена, тем самым позволяя для одновременного скрининга более соединений или в исдование более конечными точками. Перед этим, однако, следует принять во внимание, что определенные конечные точки (GSH и РОС) требуют немедленного приобретения, и, как следствие, дозирование пластин должны быть выполнены в шахматном порядке, чтобы обеспечить приобретение предыдущей пластины. С другой стороны, используя фиксированный протокол окрашивания клеток представляет собой преимущество, так как пластины могут быть уложены, прерывая протокол на любой стадии после фиксации, для завершения процедуры окрашивания на более поздней стадии. Такой подход, например, обеспечит оператору время для завершения всех живых окрашивания клеток пластины без ущерба для качества данных.
Для дальнейшей оптимизации рабочего процесса путем уменьшения количества пластин, также было бы возможно мультиплексирование более конечных точек вместе. Например, в этом контексте повреждения ДНК и стресс киназа можно исследовать вместе, просто используя две вторичные антитела с флюорохромами, испускающих в различных Channels. Непрерывное развитие HCS платформы, в том числе полностью автоматизированного посева клеток, разведения соединения, дозирования и окрашивания, а также добавление новых конечных точек будет способствовать дальнейшему расширению возможностей жилищно-коммунальной платформы как мощный инструмент профилирования для HPHCs на эпителиальные и других типов клеток ,
Раскрытие информации
Все авторы являются сотрудниками компании Philip Morris International. Philip Morris International является единственным источником финансирования и спонсором этого проекта.
Благодарности
Авторы хотели бы поблагодарить Карста Luettich и Grégory Вильом для их рассмотрения рукописи.
Материалы
| Name | Company | Catalog Number | Comments |
| Cellomics ArrayScan VTI HCS Reader | Thermo | N01-0002B | |
| xCelligence RTCA MP | ACEA | 05331625001 | |
| Screener (HCS) | Genedata | NA | |
| CASY counter TTC | Roche | 05 651 719 001 | |
| e-Plates VIEW 96 | ACEA | 06 472 451 001 | |
| RTCA Frame 96 | ACEA | 05232392001 | |
| RTCA Cardio Temperature Tool | ACEA | 2801171 | |
| Plate sealer breathseal | Greiner bio-one | 676051 | |
| Normal Human Bronchial Epithelial cells (NHBE) | Lonza | CC-2540 | non-smoking 60-year-old Caucasian male donor |
| BEGM BulletKit | Lonza | CC-3170 | Warm at 37 °C before use |
| ReagentPack Subculture Reagents kit | Lonza | CC-5034 | Warm at 37 °C before use |
| Penicillin/Streptomycin (100x) | Corning | 30-002-CI | |
| Easy Flask filter cap 75 cm2 | Thermo Scientific | 12-565-349 | |
| 96 well assay plate black | Corning | 3603 | |
| Hoechst 33342 | Fisher Scientific | PI-62249 | |
| Draq5 (For Far Red Nuclear Staining) | Biostatus | DR50200 | |
| Mitochondrial Dye: MitoTracker Red CMXRos | Life technologies | M-7512 | |
| Mitochondrial Dye: MitoTracker Red CM-H2XRos | Life technologies | M-7513 | |
| ROS Dye: Dihydroethidium | Sigma | D7008 | |
| ROS Dye: CellROX | Life technologies | C10422 | |
| ROS Dye: MitoSOX | Life technologies | M36008 | |
| GSH Dye: Monochlorobimane | Sigma | 69899 | Toxic |
| GSH Dye: Monobromobimane | Life technologies | M-1378 | Toxic |
| Membrane permeability Dye: YO-PRO-1 | Life technologies | Y3603 | Irritating |
| Membrane permeability Dye: TO-PRO-1 | Life technologies | T3602 | Irritating |
| Membrane permeability Dye: TOTO-1 | Life technologies | T3600 | Irritating |
| Caspase Dye: Cellevent Caspase 3/7 green | Life technologies | C10423 | Irritating |
| Anti-Cytochrome C antibody (Mouse) | Thermo | MA5-11823 | |
| Anti-phospho-c-Jun antibody (Mouse) | Thermo | MA5-15889 | |
| Anti-phospho-H2AX antibody (Mouse) | Thermo | MA1-2022 | |
| Goat anti-Mouse IgG DyLight 650 | Abcam | ab96878 | |
| 10x permeabilization buffer | Fisher | 8408400 | |
| 4% Formaldehyde solution | Sigma | F1635 | Toxic |
| 10x blocking buffer | Fisher | 8408500 | |
| Dulbecco’s Phosphate Buffered Saline | Sigma | D8537 | |
| Hanks' Balanced Salt solution | Sigma | H8264 | |
| Staurosporine | Sigma | S4400 | Toxic |
| Valinomycin | Sigma | V0627 | Toxic |
| Paraquat | Sigma | 36541 | Toxic |
| Anisomycin | Sigma | A9789 | Toxic |
| Ethacrynic acid | Sigma | E4754 | Toxic |
| 1-Aminonaphthalene | Sigma | 34390 | Toxic |
| 2-Nitropropane | Sigma | 130265 | Toxic |
| Acetamide | Sigma | 695122 | Toxic |
| Acetone | Sigma | 650501 | Toxic |
| Acrylamide | Sigma | A9099 | Toxic |
| Arsenic (V) | Sigma | A6756 | Toxic |
| Benzene | Sigma | 12540 | Toxic |
| Chromium (VI) | Sigma | 216623 | Toxic |
| Crotonaldehyde | Sigma | 262668 | Toxic |
| Methyl ethyl ketone | Sigma | 34861 | Toxic |
| Nickel | Sigma | 203866 | Toxic |
| Nitrobenzene | Sigma | 48547 | Toxic |
| Phenol | Sigma | P5566 | Toxic |
| Quinoline | Sigma | 241571 | Toxic |
| Toluene | Sigma | 34866 | Toxic |
Ссылки
- Rodgman, A., Perfetti, T. A. The chemical components of tobacco and tobacco smoke. , CRC Press. Boca Raton, FL. (2013).
- Russell, W. M. S., Burch, R. L. The Principles of Humane Experimental Technique. , Methuen, London. (1959).
- Zock, J. M. Applications of high content screening in life science research combinatorial chemistry & high throughput screening. Comb. Chem. High. Throughput. Screen. 132 (9), 870-876 (2009).
- US Food and Drug Administration. Harmful and potentially harmful constituents in tobacco products and tobacco smoke; established list, federal register. , 20034-20037 (2012).
- Gonzalez-Suarez, I. Systems Biology Approach for Evaluating the Biological Impact of Environmental Toxicants in Vitro. Chem. Res. Toxicol. 27 (3), 367-376 (2014).
- Camilleri-Broet, S., Vanderwerff, H., Caldwell, E., Hockenbery, D. Distinct alterations in mitochondrial mass and function characterize different models of apoptosis. Exp. Cell. Res. 239 (2), 277-292 (1998).
- Li, P., et al. Cytochrome c and dATP-dependent formation of Apaf-1/caspase-9 complex initiates and apoptotic protease cascade. Cell. 91 (4), 479-489 (1997).
- Rogakou, E. P., Pilch, D. R., Orr, A. H., Ivanova, V. S., Bonner, W. M. Double strand breaks induce histone H2AX phosphorylation on serine 139. J. Biol. Chem. 273 (10), 5858-5868 (1998).
- Westwick, J. K., Weitzel, C., Minden, A., Karin, M., Brenner, D. A. Tumor necrosis factor α stimulates AP-1 activity through prolonged activation of the c-jun kinase. J. Biol. Chem. 269 (42), 26396-26401 (1994).
- Bindokas, V. P., Jordán, J., Lee, C. C., Miller, R. J. Superoxide production in rat hippocampal neurons: selective imaging with hydroethidine. J. Neurosci. 16 (4), 1324-1336 (1996).
- Barhoumi, R., Bailey, R. H., Burghardt, R. C. Kinetic analysis of glutathione in anchored cells with monochlorobimane. J. Cytometry. 19 (3), 226-234 (1994).
- Huang, T. C., Lee, J. F., Chen, J. Y. Pardaxin an antimicrobial peptide, triggers caspase-dependent and ROS-mediated apoptosis in HT-1080 Cells. Mar. Drugs. 9 (10), 1995-2009 (2011).
- Bao, S., Knoell, D. L. Zinc modulates cytokine-induced lung epithelial cell barrier permeability. Am. J. Physiol. Lung Cell Mol. Physiol. 291 (6), L1132-L1141 (2006).
- Xia, M., et al. Compound Cytotoxicity Profiling Using Quantitative High-Throughput Screening. Environ Health Perspect. 116 (3), 284-291 (2008).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены