Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Трехмерный культура анализа для изучения раковых клеток инвазивности и Satellite Опухоль Формирование
В этой статье
Резюме
Cancer cells are embedded in a collagen gel and then sandwiched in an acellular fibrin gel to generate a 3D culture system in which the invasiveness and formation of satellite tumors may be monitored.
Аннотация
Млекопитающим культуры клеток в монослоях широко используется для изучения различных физиологических и молекулярных процессов. Тем не менее, этот подход к изучению растущие клетки часто создает нежелательные артефакты. Таким образом, культура клеток в трехмерной (3D) окружающей среды, часто с использованием компонентов внеклеточного матрикса, возникла как интересную альтернативу из - за его близкое сходство с нативным в естественных условиях ткани или органа. Мы разработали систему культивирования клеток 3D с использованием двух отсеков, а именно : (I) центральный отсек , содержащий раковые клетки , внедренные в коллагеновый гель , действующего в качестве псевдо-первичной macrospherical опухоли и (II) периферийную бесклеточной отсеком , изготовленным из фибринового геля, т.е. внеклеточный матричный компонент отличается от используемого в центре, в котором раковые клетки могут мигрировать (фронт вторжения) и / или форме микросферических опухоли , представляющие вторичные или спутниковые опухоли. Формирование спутниковых опухолей в периферийном отделении являетсяудивительно коррелировало с известным агрессивностью или метастатического происхождения нативных опухолевых клеток, что делает эту систему 3D культуры уникальна. Эта культура подход клеток может рассматриваться для оценки инвазивность раковых клеток и моторику, клеточно-внеклеточный матрикс взаимодействий и в качестве метода оценки свойств лекарств против рака.
Введение
Исследование фундаментальных и медико - биологические характеристики раковых клеток вторжения / миграции и последующее создание метастазирования является предметом интенсивных исследований в 1,2 раза . Метастазы является конечной стадией рака и его клиническое управление остается неуловимым. Лучшее понимание метастазирования на клеточном и молекулярном уровнях будет способствовать развитию более эффективных методов лечения 3.
Некоторые свойства метастатических клеток могут быть изучены в пробирке 4 , включая их стволовости и потенциал , чтобы приобрести переходное состояние (например, эпителиоидная-мезенхимальных перехода) мигрировать и вторгнуться внутри , так и от первичной опухоли 5. Тем не менее, оценка в пробирке процессов / метастазирования вторжения было проблемой , поскольку она практически исключает вклад крови / лимфы. Органотипической культуры, которые встраивать фрагменты опухоли в коллагеновые гели Previouхитрая используются для мониторинга рака агрессивностью. Хотя сложность опухолей сохраняется (например, наличие незлокачественных клеток), фрагменты опухоли подвергаются ограниченной средней диффузии, к вариации выборки, и чрезмерно быстрый рост стромальных клеток 6. Альтернативный метод состоит в выращивании раковых клеток в пределах компонентов внеклеточного матрикса (ECM), который имитирует трехмерную (3D) среды клеток. Распространение линий клеток рака молочной железы в коллагеновый гель и / или базальную мембрану, полученной матрицы является одним из лучших охарактеризованных примеров культуры 3D-клеток. При использовании конкретных условий 3D культуры клеток, неупорядоченная сборка наблюдается для клеток рака молочной железы , выращенных в стандартных условиях может быть обращено к спонтанному образованию молочных желез ацинусов и трубчатых структур 7-10. Кроме того, образование многоклеточных опухолевых сфероидов, полученных из раковых клеток аденокарциномы скопились с использованием различных методов (например, висячей капли, плавающие сфероиды, агар заделки) в настоящее время является наиболее широко используемой культуры анализа 3D - клеток 11-13. Тем не менее, этот анализ ограничивается ограниченным набором линий раковых клеток, которые могут образовывать сфероиды и в течение короткого периода, доступной для изучения клеток в этих условиях.
В этом визуализируется техники, мы здесь , ввести сложный анализ культуры 3D клеток , где раковые клетки , представляющие интерес , внедренный в коллагеновый гель , чтобы позволить образование в пробирке псевдояруса первичной опухоли , которые могут быть в качестве альтернативы покрыта мембраной полученные матрицы базальной. После образования псевдо-первичная опухоль затем зажатой в бесклеточной матрицы (фибринового геля в данном случае), что позволяет раковым клеткам пересекает границу раздела между двумя матричными отсеков (см рисунок 1). Интересно отметить, что вторичные опухолевые-подобные структуры, происходящие из псевдо-первичной опухоли наряду с агрессивными раковыми клетками появляются вфибрина гель. Такая система 3D культуры обеспечивает гибкость , необходимую для исследования, например, противоопухолевые препараты, экспрессия генов и межклеточных и / или клеточно-ECM взаимодействий 14-16.
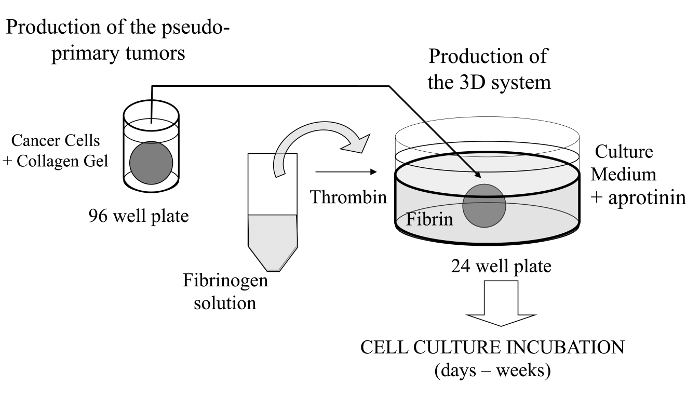
Рисунок 1:.. Обзор методов Схематическое описание способа сформировать систему культивирования клеток 3D в качестве модели для исследования рака Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
протокол
Примечание: Нет этики рассмотрения, так как животные и раковые клетки человеческого организма были приобретены или любезно предоставлены нам.
1. Создание Коллаген Заглушки (Псевдо-первичная опухоль)
- Готовят дисперсию коллагена. I типа коллагена из крысиного хвоста сухожилий (RTT) может быть либо добытых и стерилизовали , как сообщалось ранее 17, или куплен. Дисперсные лиофилизированный RTT коллагена (3,25-3,50 мг / мл в 0,02 н уксусной кислоты) с использованием блендера (установка высокоскоростной, пять 2 мин прогонов) для равномерного перемешивания.
- Harvest (трипсин-ЭДТА, как правило) и использовать трипанового синего для подсчета жизнеспособных клеток с помощью гемоцитометра. Отрегулируйте до желаемой плотности клеток (5 × 10 4 клеток на штекер).
- Подготовьте все растворы (NaOH, фетальной бычьей сыворотки, DMEM , 5x, NaHCO 3) отдельно (таблица 1) в стерильных условиях и держать охлажденным на льду. Примечание: Порядок добавления различных решений важно предотвратить осмотических или кислотные шоков в клетках.
- Выполните дисперсии клеток (1,25 × 10 6 клеток) в конечном растворе коллагена (5 мл) как можно быстрее. Хорошо перемешайте (пипетированием вверх и вниз), избегая при этом пузырьки воздуха, а затем быстро распределяют 200 мкл готового к использованию раствора в каждую лунку 96-луночного планшета. Аккуратно нанести удар мульти-луночного планшета с на поверхности рабочей области культивирования клеток капот, чтобы удалить пузырьки воздуха и для равномерного распределения раствора в лунках.
- После заполнения всех лунок (этот шаг занимает около 15-20 мин на 96-луночный планшет), хранить его в инкубатор.
- Инкубируйте планшет при 37 ° С от 2 часов до в течение ночи. Коллаген желатинизации (т.е. образование фибрилл) происходит в течение 30 мин. Добавить культуральной среды (100 мкл / лунку) в культуре для выполнения инкубации в течение ночи.
2. Первый слой фибрина гель
- Фибриноген Приготовление раствора.
Примечание: То же партия фибринового геля в идеале должны быть использованы для более воспроизводимым РесулТ.С., образование как фибрина гель может варьироваться между различными партиями коммерческого лиофилизированного фибриногена.- Всегда используйте свежеприготовленный раствор фибриногена. Доведите лиофилизированного фибриногена до комнатной температуры перед открытием флакона, чтобы избежать образования гидратов кристаллов.
- Постепенное растворить фибриногена в предварительно нагретом (37 ° С) Хэнкса сбалансированный солевой раствор (HBSS) с Са 2+ / Mg 2+ при рабочей концентрации 3 мг / мл (рассмотреть вопрос о подготовке 15% больше минимального конечного объема требуется : например, 17,25 мг в 5,75 мл для раствора 5 мл).
- Добавить подогретого HBSS по каплям сначала растворять фрагменты фибриногена. Разбейте большие фрагменты с помощью шпателя в стакане. Перемешивайте мензурку время от времени, чтобы облегчить смешивание. Не используйте мешалку пластину во время процедуры. Растворить оставшийся порошок с помощью пипетки суспензии вверх и вниз.
- Держите раствор фибриногена тепл в то время как Steriзующих решение путем пропускания его через фильтр с размером пор 0,22 мкм. Примечание: Если HBSS недостаточно тепло или фибриногена не полностью растворится, раствор может засорить фильтр. Если это применимо, заменить фильтр один или два раза, что может уменьшить концентрацию фибриногена и, таким образом, фибринового сгустка жесткость.
- Приостановить клетки , представляющие интерес (например, эндотелиальные клетки) в готовом к использованию фибриногена раствора при регулировке его конечного объема, в качестве альтернативной процедуры.
- Подготовка решений тромбин.
- Готовят раствор в DDH 2 O (50 единиц НИЗ / мл), а затем стерилизовать его , используя фильтр 0,22 мкм.
- Используйте соотношение / тромбин фибриноген ≥1: 0,0075 (об / об) с целью получения геля фибрина.
- Создание фибринового геля.
- Держите стерильный фибриногена и тромбина растворы на льду в течение всех последующих шагов. Гели фибрина могут образовывать в 24-луночные планшеты.
- Оперативно наложения йе поверхность каждой лунки с раствором фибриногена (200 мкл / лунку), избегая образования пузырьков воздуха. Способ 6 скважин одновременно.
- После того, как раствор фибриногена полностью покрывает поверхность лунок, наклоняя пластину под углом 45 ° и добавляют 1,5 мкл раствора тромбина в первую лунку, опуская тромбин в центре скважины, а затем осторожно взболтать пластину горизонтально 1-2 сек.
- Оставьте пластину в устойчивом положении под колпаком с ламинарным потоком (5-10 мин) до тех пор , гелеобразование / свертывание процесс не завершен (NB: процесс полимеризации не должен быть нарушен, например, путем транспортировки пластины в инкубатор).
- После того, как первые шесть скважин полимеризуется, повторите ту же последовательность (то есть 3 предыдущих шагов) в течение следующих шести скважин , пока все скважины не будут обработаны.
3. Второй слой фибринового геля и зажатой Коллаген подключи
- вариантA: (Использование коллагеновой штекера, немедленно).
- Убедитесь, что первый слой геля фибрин полимеризуется во всех скважинах деликатно наклоняя тарелку. Поместите 96-луночный планшет, содержащий коллагеновый гель стороны пробки бок с 24-луночного планшета (содержащего гели фибрин), чтобы облегчить перенос коллагеновых пробок.
- Добавьте одну каплю HBSS в каждую лунку планшета, содержащего коллагеновые пробки.
- Удалите каждую коллагена вилку из колодца с тонкой иглой, установленной на шприц (используется в качестве ручки) или с помощью микро-ложку (см видео). Передача каждого коллагена пробку на первый слой геля фибрина с использованием одного или двух микро-ложек, а убедившись, что коллаген плагин хорошо центрируется в скважину и стерильность в хорошем состоянии.
- Перекрытие предварительно формованной фибринового геля со вторым слоем фибриногена раствора (300 мкл / лунку) и ввести тромбин, как это описано в разделе 2.3, сохраняя минимальное 1:. Коэффициент 0,0075 и последовательность шести лунок в то время
- Вариант B (Покрытие Коллаген подключи с тонким слоем фактора роста восстановленного базальной мембраны (GFRBM)).
- Классные все готовые решения и инструменты заранее и держать их при 4 ° С или на льду (например, пипетки, наконечники, пробирки) во время обработки , так как замороженные аликвоты GFRBM очень чувствительны к чрезмерной скорости нагрева при оттаивании (следуйте инструкциям изготовителя) ,
- После удаления из лунок планшета, впитать каждый коллагеновый пробку в течение 2 мин в 1,5 мл центрифужную пробирку на льду, содержащую 100 мкл чистого раствора GRFBM.
- Передача каждого пробку, нанесенный на первый слой фибрина, обеспечивая при этом он хорошо по центру, как это описано ранее. Выдержите в штепсельные содержащих пластин при 37 ° С в течение 5 мин, чтобы позволить GRFBM с образованием геля. Добавьте второй слой фибрина, как на этапе 3.1.4.
4. среда для культивирования клеток Условия
- Заполните каждую лунку с культуральной средой (400 мкл). Культуральные среды и добавки будут выбраны на основе клеточной линии и условий эксперимента.
- Добавить апротинина, антифибринолитическим агентах в культуральной среде при конечной концентрации 100 единиц ингибитора калликреина (КИЕ) / мл.
Примечание: Храните пластины в инкубаторе для клеточных культур в условиях, используемых для клеточной линии испытания. - Залить культуры свежей средой, через день или в соответствии с экспериментальным графиком, и добавить апротинин. Перед добавлением свежей среды, слегка наклонить пластину (под углом 30-35 °) и наклонить пипеткой против стороны колодца, тщательно отсасывание кондиционированной среды под постоянным наблюдением.
Результаты
Как упоминалось ранее, интересной особенностью этого 3D - анализа клеточной культуры является то , что раковые клетки могут не только мигрировать из коллагеновой пробки к смежному фибринового геля, но также устанавливают вторичные опухоли (например, спутник опухо...
Обсуждение
В качестве важной технической сноске, важно, чтобы никакого зазора не присутствует на границе раздела между центральным и периферийным гелей. В противном случае это может привести к уменьшению способности клеток к миграции / вторжению гель фибрина. Пространство между коллагеном и гел?...
Раскрытие информации
The authors have no disclosure.
Благодарности
Work partially funded by Prostate Cancer Canada (grant # D2014-4 to SG and CJD) and the Canadian Institutes of Health Research (grant # MOP-111069 to SG). We would like to thank Dr. Richard Poulin for editorial assistance and Mrs. Chanel Dupont for technical assistance.
Материалы
| Name | Company | Catalog Number | Comments |
| Freeze-dried collagen | Sigma-Aldrich | C7661 | from rat tail tendon (soluble dispersion) or home-made (see Rajan et al., ref.#14) |
| Fibrinogen (freeze-dried) | Sigma-Aldrich | F8630 | Type I-S, 65 - 85% protein with ≥ 75% of protein is clottable |
| Thrombin | EMD Chemicals Inc. | 605157 | Gibbstown, NJ; NIH units/mg dry weight |
| Growth factor-reduced Matrigel | Corning | 356234 | Previously from BD Biosciences |
| Aprotinin | Sigma-Aldrich | A6279 | solution at 5 - 10T IU/ml (Trypsin Inhibitor Unit) |
| Micro-spoons | Fisher Scientific | 2140115 | Fisherbrand Handi-Hold Microspatula |
| 96 well plate, round base | Sarstedt | 3925500 | |
| 24 well plate | Sarstedt | 3922 | |
| Dulbecco's modified Eagle's Medium | Sigma Chemical, Co. | D5546 | DMEM |
| Fetal Bovine Serum | VWR | CAA15-701 | FBS, Canadian origin. |
| Trypsin-EDTA | Sigma Chemical, Co. | T4049 | |
| Hank’s Balanced Salt Solution | Sigma Chemical, Co. | H8264 | HBSS |
Ссылки
- Alizadeh, A. M., Shiri, S., Farsinejad, S. Metastasis review: from bench to bedside. Tumour Biol. 35 (9), 8483-8523 (2014).
- Roudsari, L. C., West, J. L. Studying the influence of angiogenesis in in vitro cancer model systems. Adv Drug Deliv Rev. , (2016).
- Bill, R., Christofori, G. The relevance of EMT in breast cancer metastasis: Correlation or causality. FEBS Lett. 589 (14), 1577-1587 (2015).
- Kimlin, L. C., Casagrande, G., Virador, V. M. In Vitro Three-Dimensional (3D) Models in Cancer Research: an Update. Mol Carcinog. 52 (3), 167-182 (2013).
- Obenauf, A. C., Massagué, J. Surviving at a Distance Organ-Specific Metastasis. Trends Cancer. 1 (1), 76-91 (2015).
- Sykes, J. A., Fogh, J. Separation of Tumor Cells from Fibroblasts. Human Tumor Cells In Vitro. 1, 1-22 (1975).
- Lang, S. H., Stark, M., Collins, A., Paul, A. B., Stower, M. J., Maitland, N. J. Experimental Prostate Epithelial Morphogenesis in Response to Stroma and Three-Dimensional Matrigel Culture. Cell Growth Differ. 12 (12), 631-640 (2001).
- Debnath, J., Muthuswamy, S. K., Brugge, J. S. Morphogenesis and Oncogenesis of MCF-10A Mammary Epithelial Acini Grown In Three-Dimensional Basement Membrane Cultures. Methods. 30 (3), 256-268 (2003).
- Shaw, L. M. Tumor cell invasion assays. Methods Mol. Biol. 294, 97-105 (2005).
- Nelson, C. M., Bissell, M. J. Modeling Dynamic Reciprocity: Engineering Three-Dimensional Culture Models of Breast Architecture, Function, and Neoplastic Transformation. Semin Cancer Biol. 15 (5), 342-352 (2005).
- Hedlund, T. E., Duke, R. C., Miller, G. J. Three-Dimensional Spheroid Cultures of Human Prostate Cancer Cell Lines. Prostate. 41 (3), 154-165 (1999).
- Le, V. M., Lang, M. D., Shi, W. B., Liu, J. W. A Collagen-Based Multicellular Tumor Spheroid Model for Evaluation of the Efficiency of Nanoparticle Drug Delivery. Artif. Cells Nanomed Biotechnol. 15, 1-5 (2014).
- Neto, A. I., et al. A Novel Hanging Spherical Drop System for the Generation of Cellular Spheroids and High Throughput Combinatorial Drug Screening. Biomater Sci. 3 (4), 581-585 (2015).
- Janvier, R., Sourla, A., Koutsilieris, M., Doillon, C. J. Stromal Fibroblasts are Required for PC-3 Human Prostate Cancer Cells to Produce Capillary-like Formation of Endothelial Cells in a Three-dimensional Co-culture System. Anticancer Res. 17 (3A), 1551-1557 (1997).
- Doillon, C. J., Gagnon, E., Paradis, R., Koutsilieris, M. Three-dimensional Culture System as a Model for Studying Cancer Cell Invasion Capacity and Anticancer Drug Sensitivity. Anticancer Res. 24 (4), 2169-2177 (2004).
- Gobeil, S., Zhu, X., Doillon, C. J., Green, M. R. A Genome-Wide shRNA Screen Identifies GAS1 as a Novel Melanoma Metastasis Suppressor Gene. Genes Dev. 22 (21), 2932-2940 (2008).
- Rajan, N., Habermehl, J., Coté, M. F., Doillon, C. J., Mantovani, D. Preparation Of Ready-To-Use, Storable And Reconstituted Type I Collagen From Rat Tail Tendon For Tissue Engineering Applications. Nat Protoc. 1 (6), 2753-2758 (2007).
- Horie, M., et al. Characterization of Human Lung Cancer-associated Fibroblasts in Three-dimensional In Vitro Co-culture Model. Biochem Biophys Res Commun. 423 (1), 158-163 (2012).
- Banyard, J., et al. Identification of Genes Regulating Migration and Invasion Using a New Model of Metastatic Prostate Cancer. BMC Cancer. 30 (14), 387 (2014).
- Palumbo, J. S., Degen, J. L. Fibrinogen and Tumor Cell Metastasis. Haemostasis. 31, 11-15 (2001).
- Dvorak, H. F. Tumor Stroma, Tumor Blood Vessels, and Antiangiogenesis Therapy. Cancer J. 21 (4), 237-243 (2015).
- Luoto, K. R., Kumareswaran, R., Bristow, R. G. Tumor Hypoxia as a Driving Force in Genetic Instability. Genome Integr. 4 (1), 5 (2013).
- Das, V., Bruzzese, F., Konečný, P., Iannelli, F., Budillon, A., Hajdúch, M. Pathophysiologically Relevant In Vitro Tumor Models for Drug Screening. Drug Discov Today. 20 (7), 848-855 (2015).
- Longati, P., et al. 3D Pancreatic Carcinoma Spheroids Induce a Matrix-rich, Chemoresistant Phenotype Offering a Better Model for Drug Testing. BMC Cancer. 13 (95), (2013).
- Tan, P. H., Chia, S. S., Toh, S. L., Goh, J. C., Nathanm, S. S. Three-dimensional Spatial Configuration of Tumour Cells Confers Resistance to Chemotherapy Independent of Drug Delivery. J Tissue Eng Regen Med. , (2013).
- Koutsilieris, M., Reyes-Moreno, C., Choki, I., Sourla, A., Doillon, C., Pavlidis, N. Chemotherapy Cytotoxicity of Human MCF-7 and MDA-MB 231 Breast Cancer Cells is Altered by Osteoblast-Derived Growth Factors. Mol Med. 5 (2), 86-97 (1999).
- Lang, N. R., et al. Biphasic Response of Cell Invasion to Matrix Stiffness in Three-Dimensional Biopolymer Networks. Acta Biomater. 13, 61-67 (2015).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены