Method Article
Определение иммунной системы подавления по сравнению защиты ЦНС для фармакологических вмешательств в аутоиммунного демиелинизации
* Эти авторы внесли равный вклад
В этой статье
Резюме
This protocol describes how to determine whether pharmacological treatments for experimental autoimmune encephalomyelitis show CNS protection as a consequence of suppressing immune cell infiltration or are neuroprotective during the onslaught of immune cell infiltration.
Аннотация
A major hallmark of the autoimmune demyelinating disease multiple sclerosis (MS) is immune cell infiltration into the brain and spinal cord resulting in myelin destruction, which not only slows conduction of nerve impulses, but causes axonal injury resulting in motor and cognitive decline. Current treatments for MS focus on attenuating immune cell infiltration into the central nervous system (CNS). These treatments decrease the number of relapses, improving quality of life, but do not completely eliminate relapses so long-term disability is not improved. Therefore, therapeutic agents that protect the CNS are warranted. In both animal models as well as human patients with MS, T cell entry into the CNS is generally considered the initiating inflammatory event. In order to assess if a drug protects the CNS, any potential effects on immune cell infiltration or proliferation in the periphery must be ruled out. This protocol describes how to determine whether CNS protection observed after drug intervention is a consequence of attenuating CNS-infiltrating immune cells or blocking death of CNS cells during inflammatory insults. The ability to examine MS treatments that are protective to the CNS during inflammatory insults is highly critical for the advancement of therapeutic strategies since current treatments reduce, but do not completely eliminate, relapses (i.e., immune cell infiltration), leaving the CNS vulnerable to degeneration.
Введение
Рассеянный склероз (РС) характеризуется воспалительным поражением преимущественно в белом веществе областях головного мозга на ранних стадиях болезни. После того, как долгосрочной прогрессии, серое вещество атрофия обнаруживается МРТ и отмечает нейродегенеративного стадии заболевания. Реактивный глиоз, демиелинизации и аксонального повреждения в белом веществе отнесены к ЦНС-инфильтрацией иммунных клеток. Ни один из методов лечения в настоящее время используются в MS обратном или непосредственно предотвратить нейродегенерации в ЦНС - вместо этого, они уменьшают воспаление, ослабляя активацию и / или инфильтрацию Т-клеток в ЦНС. Потому что нет никакого лечения для MS и пациенты, использующие текущие процедуры продолжают испытывать прогрессирования заболевания, открытия лекарств, которые предотвращают демиелинизации и потери нейронов являются критически важными. Тем не менее, различия между эффектами на клетки иммунной системы и тех , кто на ЦНС может быть трудно экспериментально, как результат - то есть, уменьшение повреждения центральной нервной системы - выглядит SAME, независимо от механизмов, с помощью которых это происходит. Таким образом, оценка защиты ЦНС должны быть партнерские отношения с оценками CNS-инфильтрации иммунных клеток и пролиферацию иммунных клеток на периферии, чтобы определить, как фармакологические препараты влияют на механизмы болезни.
Экспериментальный аутоиммунный энцефаломиелит (EAE) является хорошо налаженные животная модель аутоиммунных воспалительных заболеваний , которые непосредственно отвечают за обнаружение наркотиков в настоящее время используется для лечения MS 1-4. Мыши часто используются для EAE, с / 6 мышей C57BL быть популярным штамм на основе наличия генетических вариантов. C57BL / 6 мышей, индуцированные с EAE обнаруживают прогрессирование хронических заболеваний с началом около 10-й день после индукции. Проникновение спинного паренхимы мозга и мозжечка характерны гистопатологии этих животных, при отсутствии инфильтрации в корковом паренхимы 5. Кроме того, корковых поражений и демиелинизация в Ьдождь являются отличительными чертами заболевания 6-9, которые относительно отсутствуют у мышей C57BL / 6. Таким образом, может быть предпочтительным , когда можно использовать мышей SJL, которые имеют ремиттирующего заболевания и поражений в тех и в головном мозге и спинном мозге , которые появляются похожи на те , в мобильной станции 10.
Лечение не может быть классифицирована как нейропротекторного если иммунные клетки никогда не достигают ЦНС. Таким образом, этот протокол использует анализа методом проточной цитометрии мозгов, спинной мозг, и селезенке мышей EAE , чтобы определить влияние лечения на клеточной инфильтрацией иммунной в ЦНС и пролиферации иммунных клеток в периферии, как это показано ранее 11. Иммуногистохимическое анализ ткани ЦНС, чтобы определить степень и характер нейропротекции также описывается. Сочетание этих методов позволяет для определения, были ли активированы и широкое распространение на периферии, заключал ли иммунные клетки ЦНС клетки иммунной системы, и была ли CNS прЗащищённые от воспаления или повреждения. Если нейропротекторное действие подозревают, несмотря на эффекты на иммунную систему, экспериментаторы могут изменить лечение начинают после того, как раз инфильтрация клеток иммунной в ЦНС произошло.
Здесь мы приводим протокол с использованием двух различных моделей активного EAE, клеточно-опосредованном животной модели Т МС, и проточной цитометрии анализа в сочетании с иммуногистохимии в различных временных точках в течение болезни, чтобы определить эффективность экспериментальных методов лечения по различным аспектам MS патогенез. Этот метод поможет исследователям в дифференциации эффектов на пролиферацию иммунных клеток и инфильтрации против защиты ЦНС, что делает его легче сузить, как наркотики действуют на патогенез заболевания.
протокол
Экспериментальные процедуры с участием мышей должны соответствовать соответствующим институциональным и правительственных постановлений. Для настоящего исследования, мышей были размещены и обработаны в соответствии с Национальным институтом здоровья и Университета штата Алабама в Бирмингеме руководящих принципов институционального ухода за животными и использование комитета.
1. EAE Индукционные и Scoring
- Индуцируют EAE в C57BL / 6 мышей или 11-13 SJL мышей 10,11 , как описано ранее 13.
Примечание: Экспериментаторы должны выбрать модель идеально подходит для их исследований вопроса (см обсуждение для более подробно). - Баллы записи ежедневно , как описано выше 11 для каждой мыши , начиная с 7 -й день после индукции. Сравните среднесуточные показатели в течение долгого времени между группами лечения.
2. Лечение
- Лечить мышей EAE до появления болезни, чтобы определить, является ли лечение влияет на иммунную клеточную инфильтрацию или пролиферацию.
- Выберите лечение, мнеThOD доставки, и частота лечения при рассмотрении гематоэнцефалического барьера проницаемости, период полураспада, и дозировку препарата.
Примечание: EAE увеличивает барьерную проницаемость гематоэнцефалического и может позволить лекарства достичь ЦНС, которые иначе не могли бы быть в состоянии у здоровых животных. Проведение экспериментов для кривых доза-ответ, глядя на EAE клинические показатели могут помочь в выборе подходящей дозы препарата. контроль транспортных средств должны выполняться параллельно медикаментозному лечению. В качестве альтернативы, условные нокаутных мышей могут быть использованы с однопометниками в качестве контроля. - Используйте SJL или мышей C57BL / 6 для этого эксперимента. Лечить мышей в ранние сроки после индукции ЕАЕ (день 7), до появления симптомов с использованием выбранного способа доставки.
- Жертвоприношение и рассекают мышей на пике болезни (около 15 дней), как на этапе 3.1 и его подкомитетов шагов, основанных на самом высоком клинический показатель в среднем в течение долгого времени.
- Проведение проточной цитометрии на спинной мозг мышей (как в пункте 3.2) для определения infiltrati иммунных клетокна ЦНС, а также на селезенке (как на шаге 3.3) для определения пролиферации иммунных клеток на периферии. На отдельных мышей, поведение иммуногистохимии (как в шаге 4) для количественного определения астроцитов и микроглии, а также сохранение миелина.
- Выберите лечение, мнеThOD доставки, и частота лечения при рассмотрении гематоэнцефалического барьера проницаемости, период полураспада, и дозировку препарата.
- Лечить мышей EAE после начала болезни, чтобы определить, является ли лечение защищает центральную нервную систему после того, как иммунная клеточная инфильтрация произошло.
- Повторите шаг 2.1.1.
- Использование мышей SJL для этого эксперимента, так как эти мыши имеют измеримые ремиссию заболевания. Treat мышей во время первого пика болезни (или, при желании, на пике следующего рецидива), как измерено средними клиническими баллами.
- Жертвоприношение мышей при требуемой индукции время пост-EAE. Поскольку инфильтрация уже произошло, оно не может быть полезным для измерения инфильтрации с помощью анализа FACS. Тем не менее, принять спинного мозга для количественного определения реактивной глиоза и миелин, чтобы определить, есть ли защита ЦНС, несмотря на клеточной инфильтрацией иммунной.
3. цитометрии потока
- рассечение
- Этикетка три 15 мл конические трубки (один для мозга, один для спинного мозга, и один для селезенки) на животное с ID животного и типа ткани содержится. Хранить все ткани в отдельные пробирки для всей процедуры на льду.
- Для FACS анализа селезенке, жертвуют мышей на пике болезни (~ 15-й день после ЕАЕ индукции) с использованием диоксида углерода со скоростью потока около 15% объема контейнера в минуту в течение 2 - 3 мин. Подтвердите эвтаназии из-за отсутствия дыхания. После жертвы каждой мыши, удалить селезенку 14 и поместить в индивидуума, меченый 15 мл коническую трубку (со стадии 3.1.1) , содержащий ледяной среды RPMI с добавкой 2% FCS, 100 МЕ пенициллина и 100 мкг / мл стрептомицина ( упоминается как "средства массовой информации" по всему протоколу).
- Для FACS анализа головного и спинного мозга, сердца выполняют перфузии путем разрезания правого предсердия мышки с хирургическими ножницами, чтобы освободить circulatinг крови и прокалывая левый желудочек с помощью иглы, соединенной с шприц, заполненный 10 мл охлажденного льдом PBS. Медленно впрыскивать 10 мл PBS.
- Отрезать голову мыши и сделать разрезали средней линии головы с хирургическими ножницами. Пил назад вручную или с помощью пинцета и кожи делают разрезают по средней линии черепа с хирургическими ножницами, используя точку входа спинного мозга в качестве отправной точке.
- Отслаиваться череп с микро щипцами и использовать совок, чтобы освободить мозг. Поместите мозги в меченые 15 мл конические пробирки (из стадии 3.1.1), содержащих средства массовой информации.
- Удалить кожу мыши с пинцетом и хирургическими ножницами, и потрошить мышь с помощью хирургических ножниц. Отрезанные конечности, хвост, ребра, и любые окружающие мышцы с хирургическими ножницами, чтобы освободить позвоночный столб.
- Вырезать позвоночный столб в около 5 примерно равные части с хирургическими ножницами и выдавить один конец одной части с кровоостанавливающего, а затем использовать другой кровоостанавливающего то по-прежнему сжимая, двигаясь вдоль части, пока спинной мозг не выжимает из верхней части. Повторите эту процедуру для каждой части позвоночного столба и поместите шнуры в отдельные, помеченный 15 мл конические пробирки (из стадии 3.1.1), содержащих носители.
- Оценка инфильтрации иммунных клеток в головном и спинном мозге
- Вырезать мозги и спинной мозг на более мелкие кусочки с помощью стерильных ножниц. Измельчите с плунжером из 3 мл шприца через ячейки фильтра 70 мкм в новую 50 мл трубки в то время как полоскание сетчатый фильтр со средствами массовой информации. Доведите каждую пробирку до объема 50 мл со средствами массовой информации. Центрифуга при 453 мкг в течение 5 мин для осаждения клеток.
- Отберите супернатант и ресуспендируют осадок в 4 мл 40% -ного градиента плотности сред. Осторожно накладывать градиент плотности 40%, содержащий клетки на верхней части 2 мл 70% -ного градиента плотности в новой 15 мл коническую трубку-пипеткой медленно на стенку конической трубки, чтобы обеспечить надлежащее наслоение градиента. Спин при 796 мкг в течение 20 мин при комнатной температуре сиз тормоза.
- Осторожно снимите верхний слой миелина из градиента с пипетки для переноса 1 мл, а затем удалить жизнеспособных клеток на границе раздела с 1 мл пипетки для переноса и переноса в новый 15 мл коническую трубку. Доведите трубу до 15 мл с помощью средств массовой информации и центрифуге при 448 х г в течение 10 мин.
- Ресуспендируют осадок в 200 мкл среды и поместить в одну лунку 96-луночного планшета с круглым дном пластины (каждый образец от каждого животного будет идти в свою собственную ячейку). Центрифуга пластины при 410 х г в течение 5 мин.
- Смахнуть супернатант и ресуспендируют осадок в 200 мкл рестимуляции сред (RPMI, дополненной 10% FCS, 100 МЕ / мл пенициллина, 100 мкг / мл стрептомицина, 2 мМ L-глутамина, 1 x заменимых аминокислот, 1 мМ пирувата натрия и 55 мкМ β-меркаптоэтанола, плюс 50 нг / мл форболмиристатацетат (ФМА), 750 нг / мл иономицина, и ингибитор белка транспорта брефелдин а). Поместите пластину в инкубаторе при температуре 37 ° С в течение 4 часов.
Примечание: PMA и ionomycin результаты рестимуляции в активации всех Т-лимфоцитов, независимо от их антигенной специфичности, с тем, чтобы оценить общее количество каждого подмножества Т-клеток в данной ткани. Тем не менее, антиген-специфические реакции эффекторных Т - клеток можно оценить различными способами, в том числе restimulating клетки с MOG пептида в присутствии брефелдин А 15,16. - Оценка фенотипов ЦНС CD4 + Т - клеток
- После инкубации, центрифуги 96-луночного круглым дном пластины (из стадии 3.2.5), при 410 мкг в течение 5 мин и вылить надосадочную. Все следующие стадии окрашивания выполняются в этой пластине.
- Промыть клеток в 200 мкл PBS с 2% FCS и центрифуге при 410 х г в течение 5 мин. Смахнуть супернатант и инкубировать клетки с 200 мкл PBS, содержащий 2% FCS с Fc Block (клон 2.4G2) в течение 10 - 15 мин на льду.
- Для того, чтобы начать внеклеточный пятна, центрифужные клетки при 410 мкг в течение 5 мин, смахнуть супернатант и ресуспендируют осадок в 50 &# 956; л поверхности пятен коктейль, содержащий флуорофором меченые антитела против CD4 (1: 200, 1 мкг / мл), TCR & beta; (1: 200, 1 мкг / мл), и жизнеспособность краситель (1: 500), разведенного в PBS в течение 15 лет мин на льду. Центрифуга клетки при 410 мкг в течение 5 мин и смахнуть супернатанта. Вымойте клетки 2x в 200 мкл PBS затем центрифуги при 410 мкг в течение 5 мин.
- После удаления внеклеточного пятно, инициировать внутриклеточный процедуры окрашивания путем фиксации / пермеабилизации с последующим внутриклеточного окрашивания.
- Для начала, смахнуть супернатант и исправить / проницаемыми клетки с Foxp3 транскрипционных факторов красящих реагентов 17 ( в соответствии с инструкциями изготовителя, см Материалы List) в течение 30 мин до в течение ночи при 4 ° С
- Вымойте клеток в 150 мкл буфера пермеабилизации из комплекта и центрифуги пластины при 410 мкг в течение 5 мин. Смахнуть супернатант и морилки клеток в 50 мкл буфера пермеабилизации с флуорофором меченых антител против IL-17A (1: 200, 1 мкг / мл), IFN-γ (1: 200, 1 мкг / мл), и Foxp3 (1: 200, 2,5 мкг / мл), разведенного в PBS в течение 30 мин на льду.
- Центрифуга клетки при 410 мкг в течение 5 мин и смахнуть супернатанта. Для того, чтобы удалить избыток антител мыть 3 раза в 200 мкл буфера пермеабилизации затем центрифуге при 410 мкг в течение 5 мин. Смахнуть супернатант и ресуспендируют в 200 мкл PBS.
- Анализ клеток методом проточной цитометрии, стробирования на живой CD4 + TCR & beta ; + клеток , как описано выше 11 , чтобы оценить процент клеток , экспрессирующих каждую молекулу. Граф клеток с использованием гемоцитометра 18 или другой утвержденный метод для определения количества клеток на мышь с каждой из фенотипы CD4 + Т - клеток.
- Используя полученные данные, вычислить процент и количество CD4 + Т - клеток , пропитывая мозг и спинной мозг от каждой мыши, с особым акцентом на этих групп населения , которые играют решающую роль в патогенезе ЭАЭ и защиты19: IL-17A + IFN-γ - IL-17A + IFN-γ +, IL-17A - IFN-γ +, Foxp3 +.
- Оценка пролиферации периферических Т-клеток и их активации
- Измельчите селезенку с матовыми стеклами в культуре блюдо 60 х 15 мм. Поместите суспензию клеток в 15 мл коническую трубку с помощью средств массовой информации, чтобы приостановить клетки. Заполните трубку до 15 мл с помощью средств массовой информации и центрифуг клеток при 448 мкг в течение 5 мин.
- Отберите СМИ и ресуспендируют осадок в 2 мл ACK лизирующего буфера при комнатной температуре для лизиса красных кровяных клеток в течение примерно 3 мин.
- Доведите трубу до объема 15 мл с помощью средств массовой информации и деформации по ячейки фильтра 70 мкм в новую пробирку. Центрифуга клетки при 448 мкг в течение 5 мин, аспирата супернатант и ресуспендируют в 2 мл среды.
- Оценка периферической пролиферации CD4 + Т - клеток с помощью Ki-67 окрашивания
- Поместите небольшую аликвоту (как правило, 200 мкл) экuivalent числа спленоцитов из 3.3.3 в отдельные лунки (по одному на каждый образец) в 96-луночного круглым дном тарелку.
- Центрифуга при 410 мкг в течение 5 мин и смахнуть супернатанта. Ресуспендируют в 200 мкл PBS, содержащего 2% FCS и повторное центрифугирование. Смахнуть супернатант и ресуспендирования клеток с PBS, содержащий 2% FCS с Fc Block (клон 2.4G2) и инкубировать в течение 10 - 15 мин на льду. Для внеклеточного пятен повторите шаг 3.2.6.3.
- После удаления внеклеточного пятно, инициировать внутриклеточный процедуры окрашивания путем фиксации / пермеабилизации с последующим внутриклеточного окрашивания.
- Повторите шаг 3.2.6.4.1.
- Центрифуга клетки при 410 мкг в течение 5 мин и смахнуть супернатанта. Вымойте клетки 1x в 200 мкл буфера пермеабилизации из набора и центрифуге при 410 мкг в течение 5 мин. Смахнуть супернатант и морилки клеток в 50 мкл буфера для пермеабилизации с анти-Ki-67 антителом (1: 200, 1 мкг / мл) в течение 30 мин.
- Центрифуга клетки при 410 мкг Foг 5 мин и смахнуть супернатанта. Вымойте клетки 2x в 200 мкл буфера пермеабилизации из набора и центрифуге при 410 мкг в течение 5 мин.
- Смахнуть супернатант и мыть клетки 1x в 200 мкл PBS и центрифуге при 410 мкг в течение 5 мин. Анализ клеток с помощью проточной цитометрии, стробирования на живой CD4 + TCR & beta ; + клеток , как описано выше 11, а затем оценить процентов Ki-67 + клеток.
- Оценка периферических фенотипы CD4 + Т - клеток ,
- Поместите 200 мкл клеток (со стадии 3.3.3) в 96-луночного круглым дном пластины (одна скважина на образец) и центрифуге при 410 х г в течение 5 мин и повторно стимулируют, как в 3.2.5.
- Поместите планшет в инкубаторе при температуре 37 ° С в течение 4 часов. Выполните ту же процедуру окрашивания, как на этапе 3.2.6 и его подразделам шагов. Анализ клеток методом проточной цитометрии, как в 3.2.6.4.4-3.2.6.5.5.
4. Иммуногистохимияd Количественное
- подготовка ткани
- Жертвоприношение мышей EAE в отдельном эксперименте от тех, которые используются на этапе 3 и его подразделам шагов в любой момент после EAE индукции (часто ~ 30-й день, в хронической стадии заболевания для мышей C57BL / 6 или во время пика в средних клинических баллов для SJL мышей), выполнив следующие действия, чтобы определить степень реактивной глиоз и демиелинизации.
- Обезболить мышей с 2,5% изофлуран и 97,5% кислорода и подтвердить соответствующую глубину анестезии с нежным пят зажать с помощью щипцов, ищет отсутствия ответа. Выполните transcardiac перфузию, как описано в шаге 3.1.3. После инъекции PBS в левый желудочек, используйте новый шприц для введения 10 мл 4% параформальдегида в PBS . ВНИМАНИЕ: параформальдегид кожи и легких раздражитель, может привести к серьезному повреждению глаз, и есть подозрение вызывает рак. Избегайте вдыхания, проглатывания и контакта с кожей и глазами. Перфузия должны быть выполнены в вытяжном шкафу.
- Удалить мозги и позвоночнику, как описано в пунктах 3.1.4 - 3.1.6. Свяжите позвоночные столбцы палок шпагатом, чтобы обеспечить прямой выравнивание спинного мозга.
- Помещенный мозги в сцинтилляционные флаконы, меченных ID животного приблизительно с 20 мл 4% параформальдегида в PBS и спинной мозг в 50 мл конические пробирки, меченные ID животного с приблизительно 50 мл 4% параформальдегида в PBS, чтобы отправлять-FIX в течение ночи.
- Для cryoprotect мозги, промыть 3 раза в 1X PBS и хранить при температуре 4 ° С в 30% сахарозы в 1x PBS. Дайте мозги упасть на дно их контейнеров (около 3-х дней).
- Удалить кальций из позвоночного столба, промыв его 3 раза в 1x PBS и размещение его в большом объеме (около 50 мл для мыши спинного мозга) 0,5 М ЭДТА в 1x PBS (начиная с рН будет ~ 10; рН до ~ 7,8 не с 6 N HCl) в течение 2 - 3 недель до тех пор, кость больше не жесткой. Cryoprotect позвоночный столб, следуя шаг 4.1.5.
- Код для вставки мозги ипозвоночные столбцы в ОКТ следующие суб-шаги, как только они падают на дно их контейнеров.
- Сделать смесь из 1 части 30% -ной сахарозы в PBS и 1x 2-х частей ОКТ (например, добавить 15 мл 30% сахарозы в PBS 1x до 30 мл ОКТ).
- Добавить смесь октября / сахарозы к вложению формы (22 х 22 х 20 мм для мозгов и 22 х 30 х 20 мм для спинного мозга), пока не будет около ½ полной.
- Вырезать позвоночнику на 6 одинаковых по размеру части, используя лезвие бритвы и поместить в вложении формы 22 х 30 х 20 мм, обращенной вперед для корональных срезов спинного мозга. Поместите целые мозги в 22 х 22 х 20 мм форм лицом вперед.
- Добавить / OCT смесь сахарозы, чтобы покрыть ткань и оставьте на 1 час. так пузырьки могут уйти. В течение этого часа, добавляют 2-метилбутан блюдо, который может содержать вложения пресс-форм для флэш-замораживания. Поместите блюдо на сухом льду и накрыть для предварительного охлаждения.
- Флэш-замораживать плесени в 2-метилбутана на сухом льду и хранят при температуре -80 ° С внутри переменного токаontainer, чтобы предотвратить обезвоживание.
- Когда все будет готово, срез ткани на 16 мкм с криостата и смонтировать на электростатически заряженные слайды. Поместите каждый 10 - й раздел на слайде каждый для головного и спинного мозга (например, слайд - 1 будет иметь разделы 1, 11, и 21, и ползуна 2 будет иметь секции 2, 12, и 22, и так далее). Хранить слайды при температуре -80 ° С или использовать сразу для окрашивания.
- Окрашивание для реактивной глиоз и миелина
- Когда все будет готово для окрашивания, выбрать один слайд каждый для головного и спинного мозга на пятно для каждого животного в том же (или аналогичной, насколько это возможно) области. Для мозга, выберите слайды, показывающие, мозолистое тело и пояс стихаря сверток.
- Место слайды с ткани на блоке тепла при 70 ° С в течение 7 мин. Через 7 минут выключить нагревательный блок и дайте остыть горок на блоке тепла в течение еще 10 - 15 мин. Это позволит предотвратить срезы ткани от падения слайдах во время процедуры окрашивания,
- Промыть слайды 3 раза в 1x PBS с 0,1% неионогенного моющего средства (для внутриклеточных антигенов) или 1x PBS (для антител, направленных поверхностные антигены) в течение 5 мин.
Примечание: Поскольку антитела, используемые в настоящем протоколе являются внутриклеточными, неионогенные моющие средства будут использованы в последующих стадиях. Никогда не позволяйте горок полностью высохнуть после этого шага. - Поместите слайды в контейнер и крышка с цитратного буфера рН 3,0. Для того, чтобы цитратный буфер, добавляют 0,192 г безводной лимонной кислоты до конечного объема 100 мл в воде. Регулировка рН с помощью уксусной кислоты, если рН выше 3,0 или NaOH, если ниже.
- Инкубируйте слайды при температуре 37 ° С в течение 30 мин и промыть 3 раза в 1x PBS с 0,1% неионогенного моющего средства в течение 5 мин.
- Круг область вокруг ткани с гидрофобным барьерного ручкой и поместите слайды в увлажненной камере (например, слайд-ящик, содержащий влажные бумажные полотенца). Добавить блокирующего буфера в ткани. Инкубировать в течение 30 мин при комнатной температуре.
Примечание: Блокирующий буфер состоит из 1x PBSплюс 0,3% неионогенное моющее средство и соответствующая сыворотка (5%) на основании множества вторичных антител, т.е. лошадиной сывороткой в течение основного белка миелина (МВР) и глиального фибриллярного кислого белка (GFAP) и козьей сывороткой для Iba1. - Flick блокирующий буфер от слайдов и добавить первичных антител (1: 1000 или 0,2 мкг / мл козьего анти-основной белок миелина для олигодендроцитов, 1: 1000 или 1 мкг / мл до 3 мкг / мл мышиного анти-GFAP для астроцитов, или 1 : 750 или 0,67 мкг / мл анти-кролик Iba1 для микроглии), разбавленный в соответствующем блокирующем буфере (этап 4.2.6) к обведенной кружком области. Оставьте при 4 ° С в течение ночи в увлажненной камере.
- Флик антитела в блокирующем буфере от слайдов и мыть слайды 3 раза в 1x PBS с 0,1% неионогенного моющего средства в течение 5 мин.
- Добавить вторичного антитела (1: 200 или 7,5 мкг / мл биотинилированного лошадь анти-мышь для MBP и GFAP, или биотинилированного козьего анти-кроличьего для Iba1), разведенного в соответствующем блокирующем буфере (см Steр 4.2.6) к обведенной кружком области и оставить слайдов, чтобы инкубировать в увлажненной камере в течение 1 часа при комнатной температуре.
- Флик антитела в блокирующем буфере от слайдов и мыть слайды 3 раза в 1x PBS с 0,1% неионогенного моющего средства в течение 5 мин.
- Приготовьте авидин-биотин-пероксидаза комплекс (ABC) в иммунопероксидазной (см список материалов) за 30 минут перед использованием и агитировать на качалке, пока это необходимо в 4.2.12. Добавить 0,3% H 2 O 2 в метаноле к обведенной кружком области в течение 10 мин для гашения эндогенной активности пероксидазы.
- Флик решение от слайдов и мыть в 2 раза в 1x PBS или 1x PBS с 0,1% неионогенного моющего средства в течение 5 мин, затем 1 раз в 1x PBS. Добавьте ABC реагента в обведенной кружком области в течение 30 мин.
- Флик решение от слайдов и промыть 3 раза в 1x PBS в течение 5 мин, затем 2 раза в воде в течение 5 мин. Сделать решение 3,3'-диаминобензидин (DAB) (см список материалов) и добавить его для покрытия секций.
Примечание: Этот шаг необходим микроскоп для наблюдения оптимальной обнаруженияиона Время окрашивания и должно быть сделано для того же количества времени для слайдов для сравнения. - Промыть слайды 3 раза в воде в течение 5 минут каждый. Обезвоживает ткани путем размещения в следующих растворов в течение 2 мин каждого из них: 70% этанола в воде, 95% этанола в воде, 100% -ным этанолом в воде, 50% ксилола и 50% этанола, 100% ксилолов. Печать покровное на слайде с смолистым монтажной средой.
- В качестве альтернативы, выполнить иммунофлуоресцентного окрашивания , как описано ранее 11 для оценки реактивную глиоза с использованием антител против Iba-1 и GFAP.
- Возьмите изображения каждой секции спинного мозга (окрашивают соответствующими антителами с использованием DAB) с 4X, 0,13 цели НС и сохранять изображения в .tiff. С другой стороны, получать изображения мозолистого тела и пояс стихаря пучка в левом или правом полушарии головного мозга с помощью 20x, 0,50 цель NA и сохранять изображения в .tiff. Для более полного определения нагрузки поражения в головном мозге, это выгодно, чтобы включать в себя как hemispherэс в анализах.
- Измерение средней площади фракции реактивной глиоз (Iba1 и GFAP окрашивания)
- Скачать NIH ImageJ (http://imagej.nih.gov/ij/) и открыть на компьютере. На программное обеспечение ImageJ, используйте меню строку Файл> Открыть и выберите изображение из стадии 4.2.16. Нарисуйте область с помощью "Полигон" SELECTIONS инструмент на панели меню. Для спинного мозга, проследить весь раздел; для мозга, мозолистого тела и пояс стихаря пучка. Преобразование изображения до 16 бит, перейдя в меню Image> Type и нажав на "16-бит".
- Де-шум изображение, перейдя к процессу> Вычитание фона и установить «Прокатный радиус шара" , по крайней мере , размер самого большого объекта , который не является частью фона (см инструкцию ImageJ по адресу: //rsbweb.nih .gov / IJ / Docs / гид / 146-29.html).
Примечание: Для получения 4Х изображения Iba-1 окрашивания мы используем 4,0 и GFAP мы используем 50.0, но эти цифры могут изменяться в зависимости от увеличения изображения и окрашивания Intensity. - Проверить "Плавающая параболоид" и нажмите кнопку "OK". Перейти к Image> Adjust> Threshold ... и установите нижний пороговый уровень (верхний бар) с помощью ползунков. Включить только окрашивание, что является клеточным и соответствовать по изображениям. Для получения изображений с темным фоном (относится только к флуоресцентного окрашивания), убедитесь, что "Темный фон" флажок.
- Перейти к Анализировать> Установить Измерения ... и выберите "дробь" Area (дает процент порогами области в пределах области, представляющей интерес). Убедитесь в том, что "Ограничение до порога" снят и "Display метка" проверяется. Нажмите "OK" после завершения.
- Для получения измерений, перейдите к Анализировать> Измерить. А "Результаты" всплывающее окно появится, и эти данные могут быть сохранены как или скопировать в другую программу. Для анализа, сравните "доля площади" значения между группами лечения.
- Количественное MBP окрашиванием неавтоматическогоскую плотность
- Открыть изображение и нарисуйте область интереса, как описано в шаге 4.3.1. Перейти к Анализировать> Установить Измерения ... и выберите "Среднее значение серого" (сумма значений серого в пределах выбора, разделенной на число пикселей). Убедитесь в том, что "Ограничение до порога" снят и "Display метка" проверяется. Нажмите "OK" после завершения.
- Для получения измерений, перейдите к Анализировать> Измерить. Соблюдать "Результаты" всплывающее окно появится. Скопируйте эти данные и сохранить как или скопировать в другую программу.
- Для анализа, копировать и вставлять значения в другую программу. Преобразование среднее значение серого в оптическую плотность (OD) по следующей формуле: OD = log 10 (255 / среднее значение серого).
Результаты
Здесь мы использовали две модели EAE, чтобы понять, если фармакологический агент обеспечивает защиту ЦНС либо смягчающих ЦНС-Проникнув Т-клеток или предотвращения миелина и аксонов травмы во время натиска инфильтрация воспалительных клеток иммунной. Для того, чтобы определить , является ли терапевтическое средство предотвращает иммунную клеточную инфильтрацию в спинной мозг, модель мыши C57BL / 6 хронического аллергического энцефаломиелита используется при котором иммунная клеточная инфильтрация и патологии болезни преимущественно находится в спинном мозге (фиг.1А). Для того, чтобы определить , является ли терапевтическое лекарственное средство обеспечивает защиту ЦНС во время вторжения иммунных клеток в ЦНС, в животной модели SJL из ремиттирующего EAE используется, демонстрирующая патологии болезни и в головном мозге и спинном мозге (рис 1б).
Клинические оценки
Соответствующие клинические оценки производятся в соответствии со следующей разделу для типичных (Рисунок 1C) или атипичные (рис 1D) EAE. Для типичного клинического заболевания, оценка 0 не ненормальное поведение. При поднятии на основании хвоста, хвост может быстро вращаться (так же, как несущего винта вертолета) и задние ноги будут разведены. Клиническое оценка 1 представляет собой частично хромота хвост, который может быть определен путем поднятия мыши на основание хвоста. Нормальный вертолет типа Вращающийся может быть ослаблено или отсутствует, и часть хвоста может быть полностью хромота. Полезный способ определить степень хвоста паралича запустить свое пальцем вверх длину хвоста, как unparalyzed хвост, как правило, скручиваться вокруг пальца в то время как частично парализована хвост не сможет сделать это. Клинический балл 2 представляет собой полностью парализована хвост. Ни один движение хвоста не происходит вообще при выборе кнопки вверх мыши в основание хвоста. Клинический балл 3 представляет собой частичный паралич задних конечностей. Определение этой оценки требует, чтобы мышь может свободно перемещаться по FLAт поверхность. Если одна задняя конечность тянет, как мышь движется вперед, или если одна или обе задние конечности кажутся частично парализована, балл 3 может быть дано. Клинический балл 4 представляет собой полный паралич задних конечностей. С этим счетом, мышь не сможет перемещать свои задние конечности и будет тянуться себя вперед, используя свои передние конечности. Клинический балл 5 представляет собой умирающую мышь, или мышь с трудом движется сама по своей клетке или дыхании. Если мышь не может дотянуть вдоль нижней части клетки, или, если его дыхание затрудненное, мышь должна быть гуманно умерщвлены. Клинический балл 6 представляет собой мышь, найден мертвым в своей клетке. Счет 6 необычен и причины смерти, кроме EAE должны быть исследованы.
Атипичная клиническое заболевание может или не может сопровождаться параличом. Может возникнуть необходимость, чтобы включать в себя две отдельные системы подсчета очков, если мышь представляет с атипичным заболеванием плюс типичные симптомы. Оценка 0 не ненормальное поведение, As с типичной системой подсчета очков. Клинический 1 балл представляет собой небольшой поворот головы или наклон в то время как мыши ходьбе. Это может быть определено, позволяя мыши идти вперед и наблюдая постоянную левой или правой направленности к его движению. Клинический 2 балла представляет собой более выраженный поворот головы и слабой способностью выпрямления. Как и в случае нетипичного счетом 1, мышь имеет направленность на его движения и может иметь небольшие трудности с балансом. Клинический балл 3 представляет собой неспособность ходить по прямой линии. Мышь будет испытывать трудности балансировки и может использовать стороне клетки, чтобы помочь прямо себя как она ходит. Клинический балл 4 представляет собой мышь, лежащую на его стороне, не могла ходить из-за проблем балансировки. Мышь может быть в состоянии перетащить себя вдоль нижней части клетки, но может иметь направленность к его движению. Клинический балл 5 представляет непрерывной прокатки, если не поддерживается. Мышь, которая достигает этот счет должен быть гуманно усыпляют. клиникаАль счетом 6 представляет собой мышь, найден мертвым в своей клетке. Счет 6 необычен и причины смерти, кроме EAE должны быть исследованы.
Это может быть необходимо , чтобы обеспечить "в-между" баллов, например, при добавлении 0,5 до балла , если состояние изменяется мышь слегка или если выбирать между двух баллов трудно. Например, мышь, которая начинает двигаться медленнее, чем его обычные аналоги, но не отображает не паралич, или мышь, которая застежками ее задние ноги с передней вместо splaying свои ноги при поднятии за хвост может быть дана оценка 0.5 , Мышь, которая может только дотянуть вдоль нижней части клетки, и только в состоянии дергать свои задние конечности периодически или при прикосновении, может быть дана оценка 3,5.
Оценивая уменьшение иммунных клеток инфильтрации
После индукции EAE в / 6 модели мыши C57BL (рис 1А, день 0) антиген presentatiна и пролиферацию Т-клеток в селезенке происходит в дни 1 - 5 с последующей клеточной инфильтрацией иммунной в ЦНС около 7 день примерно от 3 до 5 дней после первоначального иммунных клеток мышей инфильтрации присутствующих с клиническими баллами. Для того, чтобы оценить, если терапевтический агент блокирует иммунную клеточную инфильтрацию в спинной мозг, наркотики или транспортное средство вводят на 7-й день после презентации антигена и пролиферации в селезенке, но прежде, чем иммунные клетки начинают проникать в спинной мозг. Если иммунная клеточная инфильтрация была ослаблена, клиническое течение заболевания должно отражать улучшение клинические показатели во время растущей фазы заболевания от дней от 10 до 15 (рисунок 2).
Снижение инфильтрация клеток иммунной также приведет к уменьшению нейровоспаления. Реактивная астроцитоз и microgliosis считаются основными отличительными чертами для нейровоспаления. Окрашивание для астроцитов с GFAP и микроглии с Iba-1 может быть использован для оценки чанэс в средней площади фракции окрашивания для количественного определения нейровоспаления (рисунок 3).
Для того, чтобы определить , является ли иммунная клеточная инфильтрация уменьшается, спинной мозг, удаляются и обрабатываются для анализа потока цитометрии на пике болезни (фиг.1А, примерно день 18). Это гарантирует, что наибольшее количество иммунных клеток, которые вошли в спинной мозг. Вход Т-клеток в ЦНС считается инициирующим воспалительного процесса и оба Th1 и Th17 клетки обнаружены в животных моделях аллергического энцефаломиелита, а также пациентов с рассеянным склерозом. Взятые вместе, анализ методом проточной цитометрии должен включать в себя оценку обоих типов патогенных Т-клеток. Кроме того, Tregs хорошо охарактеризованные подавитель Т-клетки, которые смочить болезнь. Таким образом, процент Tregs от общей популяции CD4 + должны быть оценены по сравнению с процентом населения эффекторных Т - клеток. Это позволит выявить, если общее снижение клеточной инфильтрацией Т произошло или если Therе является перекос фенотипы Т-клеток в ЦНС. Типичные точечные участки (рис 4А) показывают снижение общего числа CD4 + Т - клеток , просачивающейся в спинном мозге у мышей , обработанных лекарством по сравнению с спинном от обработанных носителем мышей (цифры в верхнем правом квадранте). Для оценки Th1, Th17 и Treg клетки следующие белки сигнатур оценивают следующим образом : IFN-gamma +, IL-17 + и FOXP3 +, соответственно , и должна быть уменьшена (рис 4A). Статистический анализ следует проводить на CD4 +, IFN-gamma +, IL-17 +, и числа Foxp3 + клеток , чтобы продемонстрировать значительное снижение (рис 4б). Чтобы исключить перекос подмножеств Т - клеток, статистическая оценка доли IFN-gamma + IL-17 +, IFN-gamma + IL-17 - IL-17 + IFN-gamma - и FOXP3 + клетки выполняется ( Fi4C фигура).
Для того, чтобы исключить возможность того, что снижение ЦНС-инфильтрации Т-клеток является следствием ингибирования пролиферации, активации и дифференцировке на периферии, а число активно пролиферирующие Т-клетки, в дополнение к доле подтипов Т-клеток должна быть оценена. Никаких изменений в процентах от CD4 +, IFN-gamma + IL-17 +, или Foxp3 + не должен быть найден , если активация и дифференцировка не изменяются (рис 5А). Кроме того, никаких изменений в клетках Ki67 + CD4 + не должно быть найдено , если пролиферацию не влияет (Фиг.5В). медикаментозного лечения вводятся на 7-й день или позже, чтобы избежать изменения первоначального презентации антигена и активацию Т-клеток на периферии. Тем не менее, в генетических моделях белки часто удаляются конститутивно во время эмбриогенеза или индуцированных перед индукцией ЕАЕ решений спленоцитов Ассssment большое значение.
Оценка защиты ЦНС
Для того, чтобы продемонстрировать, если конкретный терапевтический агент модулирует патологии заболевания в ЦНС после клеточной инфильтрацией иммунной, вмешательства препараты должны вводиться во время первого пика в клинической скоринг болезни. Модель SJL ЕАЕ является преимуществом для этих экспериментов, так как эти мыши демонстрируют ремиттирующего фенотип. Если лекарственная терапия предотвращает миелин-аксонов дегенерации, улучшение клинических показателей будет наблюдаться (рисунок 6). Патологическая оценка миелина должна подтвердить уменьшение повреждения миелина в соответствии с улучшением клинических показателей. Для количественной оценки целостности миелина, окрашивание мазка основного белка миелина (ОБМ) выполняется, а затем с помощью статистического анализа оптической плотности для этого окрашивания (рис 7). Для дальнейшего обоснования, что нейровоспаления поддерживается или уменьшается therapeUTIC вмешательства, реактивная глиоз может быть оценена путем измерения средней площади фракции реактивной глиоз , как описано выше (рисунок 3). Для того, чтобы подтвердить, что терапевтическое вмешательство непосредственно защищает центральную нервную систему без иммуномодулирующим действием, ослабление иммунной клеточной инфильтрацией в ЦНС и пролиферации в селезенке должны сбрасывать со счетов. Для решения этой проблемы , методы головного и спинного мозга оценки инфильтрации иммунных клеток и оценки пролиферации периферических Т - клеток и их активации должны быть выполнены , как описано выше (фиг.4 и 5). Взятые вместе, терапевтические агенты, которые блокируют повреждение клеток в ЦНС без признаков снижению ЦНС-инфильтрации Т-клеток или пролиферации Т-клеток на периферии являются ЦНС-защитные процедуры.
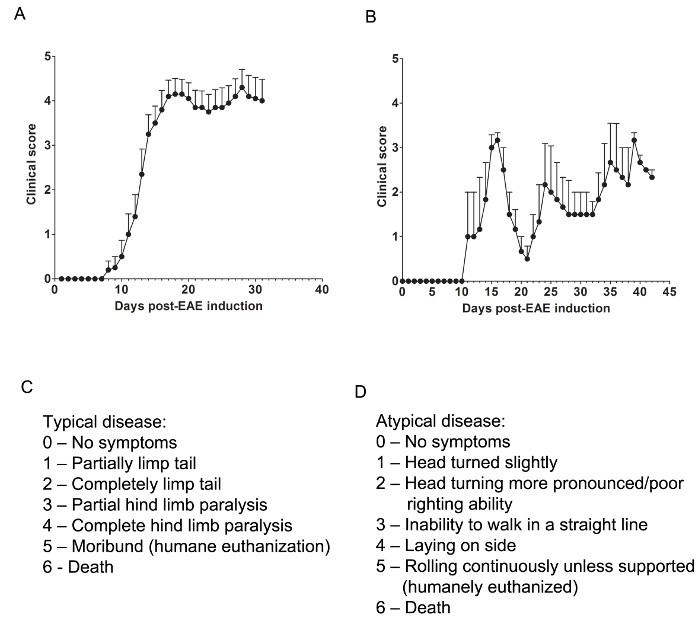
Рисунок 1. Представитель RESULTS клинических показателей от EAE в C57BL / 6 и SJL мышей. (A) Клинические показатели (среднее ± SEM) от мышей C57BL / 6 (N = 10) , индуцированное с MOG 35-55 производить EAE с хроническим заболеванием. (B) Клинические показатели (среднее ± SEM) мышей SJL (n = 3) , индуцированные с PLP 139-151 производить EAE с рецидивирующим заболеванием. (С) Клиническое скоринг рубрики используется для отслеживания прогрессирования заболевания у типичного мышей EAE. (D) Клиническая скоринг рубрика используется для отслеживания прогрессирования заболевания атипичной у мышей EAE. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
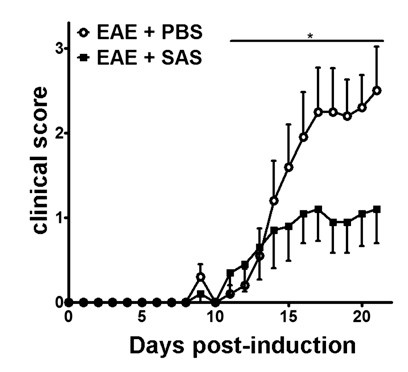
Рисунок 2. Медикаментозное лечение до иммунных клеток Проникновение в C57BL / 6 мышей с EAE. Клинические показатели (среднее ± SEM) мышей C57BL / 6 мышей , обработанных PBS (n = 20) или SAS (п = 19) из 7 -й день после иммунизации с MOG 35-55. Данные взяты из трех объединенных независимых экспериментов. Статистическая разница была определена с использованием непараметрического двух хвостами тест Манна-Уитни U, * р <0,05. Повторная печать с разрешения (11).
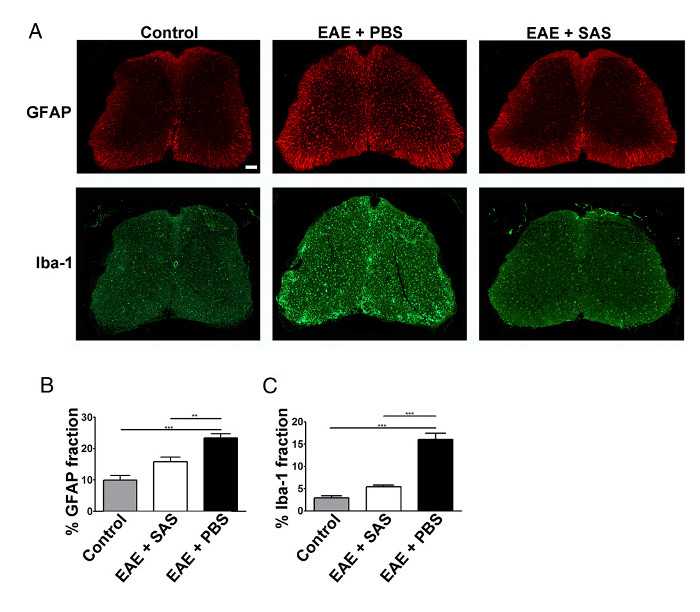
Рисунок 3. Иммунофлуоресцентного Окрашивание и Количественное Реактивный глиоз в спинном контроля, EAE, и обработали мышей C57BL / 6. (A) флуоресцентным для GFAP (астроцитов) и Iba-1 (микроглии) в спинном мозге управления (неиммунизированных ) мыши (левая панели) и мышей ЕАЕ, обработанных PBS (средний панели) или SAS (правая панели). Шкала бар = 100 мкм. Количественное окрашивания определяли с использованием метода доля площади для измерения процента immunopositive область для GFAP (B) и Iba-1 (C). Среднее ± SEM, п = 3 управления, п = 3 SAS обработанных или п = 4 PBS-обработанных мышей, 6 секций на мышь. Статистические различия определяли с помощью однофакторного дисперсионного анализа, * р <0,05, ** р <0,01, *** р <0,001. Повторная печать с разрешения (11). Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
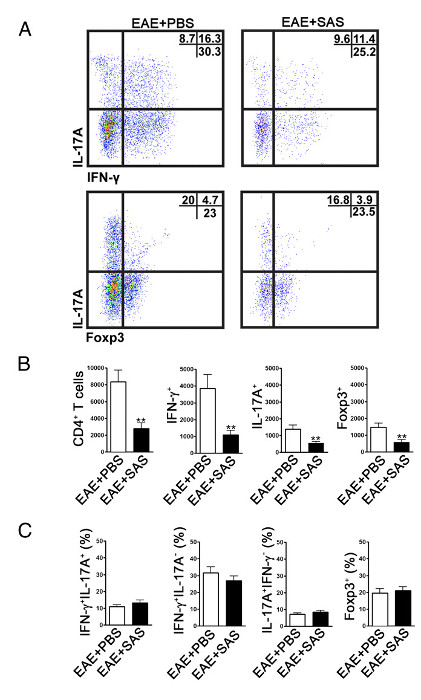
Рисунок 4. FACS - анализ EAE C57BL / 6 мыши спинном , демонстрирующих Снижение инфильтрация клеток T в экспериментальных мышей. C57BL / 6 мышей обрабатывали SAS или PBS, начиная 7 d postinduction ЕАЕ. Образцы спинного мозга были получены на 15 день (A) репрезентативные участки точечно показать Th1 (IFN-γ + / IL-17 -) и Th17 (IFN-γ- / IL-17 +) клетки CD4 + ворота (верхние панели) и регуляторных Т - клеток (Foxp3 +) (нижние панели). Точечные графики показывают проценты в правом верхнем квадранте. (B) , были статистически проанализированы абсолютного числа CD4 + клеток, а также ИФН-γ +, IL-17A + и FOXP3 + клетки. (С) Изменение в процентах от популяции Т - клеток между SAS- и PBS-обработанных мышей EAE также исследовали. Среднее ± SEM, п = 10 для PBS обрабатывали, и п = 9 для SAS очищенных от двух независимых экспериментов. Двухвостый тест т использовался для всех гистограммой. ** Р <0,01. Повторная печать с разрешения (11). Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
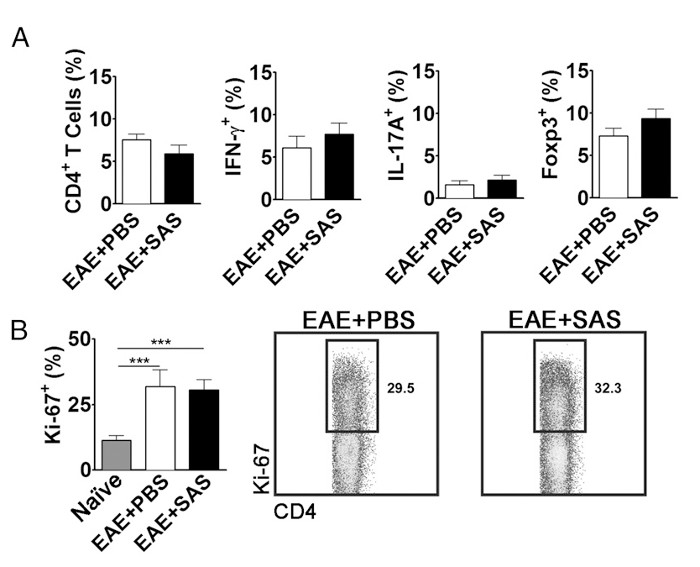
Рисунок 5. FACS Анализ EAE C57BL / 6 мышей селезенок Демонстрируя Эквивалентные Т - клеток профилей экспрессии и пролиферации в обработанных и необработанных мышей. Селезенки из SAS и PBS - обработанных мышей были проанализированы 15 D postinduction ЕАЕ. (А) процент CD4 + Т - клеток, Th1 (ИФН-γ + / IL-17 -), Th17 (IFN-gamma - / IL-17 +), и Т - клетки , регуляторные (Foxp3 +) в селезенке из PBS - лечение (N = 10) и SAS обработке (n = 9) мышей из двух независимых экспериментов. (В, левая панель) Процент Ki-67 + клеток в популяции CD4 + от наивных селезенке (п = 4), а также из PBS - (п = 5) и SAS-обработанных мышей (n = 5) , индуцируют EAE. Одностороннее ANOVA тест продемонстрировал статистическую значимость между долей Ki-67 + клеток из наивных селезенке по сравнению с любым или SAS PBS - обработанных селезенке EAE. Никакого значения не наблюдалось между SAS и PBS-обработанных селезенке EAE. (B, правая панель) Типичные точечные участки; Цифры указывают процент пролиферации. Точечные графики показывают проценты. Гистограммы представляют собой два хвостами тест т, *** р <0,001. Повторная печать с разрешения (11). Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
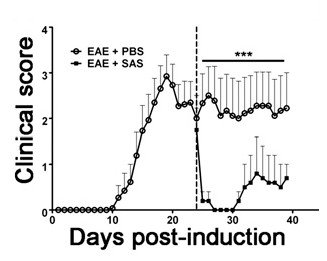
Рисунок 6. Медикаментозное лечение после иммунных клеток Проникновение в SJL мышей с EAE. Клинические показатели (среднее ± SEM) мышей SJL , обработанных PBS (n = 8) или SAS (п = 8) от 24 день после иммунизации (пунктирная линия) с PLP 139-151. Данные представляют собой среднее ± SEM из клинических показателей. Статистическая разница была определена с использованием непараметрического двух хвостами тест Манна-Уитни U, *** р <0,001. Верхняя строка представляет собой значения, которые используются для статистическойанализ. Повторная печать с разрешения (11).
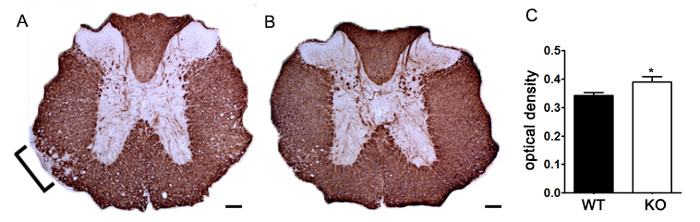
Рисунок 7. Количественное MBP Окрашивание с использованием оптической плотности. (А) представитель окрашивание МВР в грудном отделе спинного мозга от неустановленный генетического нокаута мышей по сравнению с контрольными однопометница C57BL / 6 мышей с индуцированной ЕАЕ. Кронштейн показывает репрезентативный участок восстановленного MBP окрашивания, указывающего демиелинизации. (B) MBP окрашивание грудного отдела спинного мозга от неустановленный генетического нокаута C57BL / 6 мыши. (С) нечеткое генетические нокаутных мышей , индуцированные с EAE (KO, N = 6 мышей, 2 - 4 поясничные и грудные секции на животное) имеют более высокую оптическую плотность (ОП) ОБМ окрашивания в спинном мозге , чем дикий тип (WT; п = 3 мыши, 2 - 4 поясничного и крестцового срезов на животных) мышей, индуцированные с EAE. Статистически проанализированы USIнг два хвостами тест т, * р <0,05. Усы представляют собой SEM. Масштабная линейка 100 мкм.
Обсуждение
У пациентов с МС продолжают испытывать рецидивы заболевания при приеме лекарств, которые ослабляют активацию и / или инфильтрацию Т-клеток в ЦНС, гарантирование развитие методов лечения, которые непосредственно защищают ЦНС. EAE классически используется для моделирования симптомов рассеянного склероза и может быть мощным инструментом при изучении природы взаимодействий между иммунной системой и центральной нервной системы в естественных условиях. Используя выбор времени соображений лечения в EAE, например, до или после начала заболевания, в сочетании с изучения инфильтрации иммунных клеток в ЦНС и пролиферацию и активацию на периферии, то можно разграничить эффекты лечения как на иммунную систему и ЦНС.
В то время как EAE у мышей C57BL / 6 более широко используется, EAE в SJL мыши может быть более представительным большинстве случаев РС, так как эти мыши имеют ремиттирующего фенотип и инфильтрации иммунных клеток в паренхимеголовного мозга 10. мышей SJL имеют четкое восстановление в период ремиссии, а также, что позволяет начать лечение после того, как болезнь представлена, но во время снижения воспаления. Важно учитывать, что у мышей SJL не всегда рецидиву и перечислению в синхронности, что приводит к потенциально большой изменчивостью, когда результаты объединяются. Таким образом, некоторые исследователи могут выбрать, чтобы показать репрезентативные результаты для клинических баллов от одного животного при приеме мышей для анализа FACS и гистологии в индивидуализированных точках прогрессирования заболевания.
Принимая во внимание, когда манипуляциях сделаны мышам EAE могут помочь в определении того, как лечение влияет на иммунную систему или ЦНС. Есть много вариантов, когда начинается лечение, каждый со своим собственным коннотации ли иммунные клетки вошли в центральную нервную систему, и как они могут взаимодействовать с центральной нервной системы. Лечение до появления симптомов означает, что иммунные клетки еще не вступили или причинили ущерб ЦНС.Лечение после появления симптомов означает, что иммунные клетки вошли в ЦНС и вызвали некоторый ущерб. Использование мышей SJL, лечение также может начаться во время рецидива, где иммунные клетки активно проникающими и вызывает воспаление, или во время ремиссии, где иммунные клетки могут быть менее распространены в ЦНС с меньшим воспалением. Исходные гипотезы относительно того, как лечение влияют на центральную нервную систему и иммунную систему могут быть сделаны при рассмотрении вопроса, где иммунные клетки находятся в патологическом процессе во время лечения.
Есть несколько способов, в которых лечение может повлиять на клетки иммунной системы и ЦНС, каждый из которых с конечным результатом снижения тяжести симптомов EAE. Поэтому, необходимо использовать анализ методом проточной цитометрии и иммуногистохимии, чтобы посмотреть, как клетки иммунной системы влияют на периферии и центральной нервной системы, является ли иммунные клетки вошли в ЦНС, и, как ЦНС реагирует на лечение. В то время как поток цитометрии анализ спинного мозга может определить, сколько ячеек гаве вошел в центральную нервную систему в данный момент времени, никто не может определить, что этот эффект связан с сокращением торговли иммунных клеток, если пролиферацию иммунных клеток не влияет в селезенке. Поэтому необходимо проанализировать как периферийное и ЦНС ткани и определить, что означают результаты механистически, когда сравниваются обе ткани. Также возможно для профилей иммунной клеточной активности, чтобы быть изменена путем обработки, например, имеющий переключатель в патогенного Т-хелперного тяжелых профиль в регуляторных Т-клеток-тяжелого профиля. Глядя на маркеры для различных типов клеток и сравнения экспрессии в процентном отношении между обработанных и необработанных животных, следовательно, также является важным фактором. Новая концепция в исследовании MS предполагает, что В-клетки играют важную роль в аутоиммунной демиелинизации. Это основано на результатах исследований , показывающих , что В - клетки необходимы для повторной активации Т - клеток 20. Эта концепция поддерживается успех лечения, такие как ритуксимаб, антитела против CD20 экснадавив на поверхности В - клеток 21,22. Как свидетельствует успех моноклональных антител окрелизумаба в клинических испытаниях, препараты , направленные на различные эпитопы CD20 могут улучшить эффективность B клеток , ориентированных терапии 23.
Одно ограничение методов, представленных здесь, является то, что можно на клетки иммунной системы, чтобы войти в ЦНС, но быть не в состоянии путешествовать в паренхиме. Иммуногистохимия может быть использован для обнаружения периваскулярное наручников иммунных клеток и оценивать расстояние, пройденное в паренхиме между обработанными и необработанными животными. Другим потенциальным ограничением включает эффекты микробиомом на EAE патогенеза. Комменсальных микрофлоры кишечника может в значительной степени влиять на патогенез заболевания 24; Таким образом, мыши размещались в разных колониях и даже в разных клетках может иметь значительные различия в степени тяжести заболевания. Соответственно, всегда предпочтительнее, где можно использовать элементы управления однопометница поднятые в той же клеткеэксперименты с EAE. Последнее замечание в том, что если экспериментально желательно устранить эффекты иммунных клеточных пролиферативных изменений на периферии, то можно сделать это с помощью пассивного индукцию передачи, а не активное индукции, описанный в данном протоколе.
Дальнейшее подтверждение того, для нейропротекции может быть достигнуто с помощью системы сокультивирования 11 , чтобы проверить конкретные механизмы клеточной гибели , либо с помощью условных нокаутных мышей , который позволяет для удаления белков , избирательно воздействующие на типе клеток. Кроме того, чтобы расширить изучение фармакологических агентов, которые нейропротективная, должны быть включены маркеры аксонального рассечения и гибели нервных клеток. Другой важной областью является ремиелинизация. Поврежденные аксоны неспособны ремиелинизируют кредитование дальнейшей поддержки, что нейропротекторное терапия должна быть важной частью ремиелинизацию терапии. Кроме того, немиелинизированные аксоны более уязвимы к травмам, чем myelinaTed аксоны. Это говорит о том, что, когда аксон становится демиелинизированные терапевтических вмешательств, которые способствуют своевременному ремиелинизацию предотвратит аксонов травмы. Для того, чтобы изучить эти пути, могут быть использованы другие модели в естественных условиях для демиелинизации и ремиелинизации (т.е. cuprizone и лизолецитин). Метод, описанный здесь, сосредоточены на оценке нейропротекции путем количественной оценки потери миелина. Для оценки ремиелинизации число клеток-предшественников, а также их способность пролиферировать и созревать бы также важно, чтобы исследовать. При упоминании этих альтернативных моделей, необходимо также рассмотреть различные модели энцефалита, которые вирусно опосредованные. Есть два хорошо охарактеризованные вирусные модели РНК , которые производят миелин потери: один мышиный энцефаломиелит Theiler, в не-оболочечного вируса пикорнавирусы , а другой мыши вирус гепатита, членом семейства вирусов Coronaviridae 25,26.
EAE является ценным инструментом для улudies того , как манипуляции или методы лечения влияют на иммунную систему и ЦНС в естественных условиях. Протокол, описанный здесь, может помочь определить, где лечение влияют на процесс болезни, будь то на периферии, на гематоэнцефалический барьер, или в ЦНС. Нет современные методы лечения рассеянного склероза не вылечить болезнь, а пациенты часто снижается с течением времени опыт. Кроме того, другие заболевания, связанные с иммунной инфильтрации клеток в ЦНС и деградации миелина, в том числе острый рассеянный энцефаломиелит, поперечный миелит и оптиконевромиелит, отсутствие процедур, которые защищают нервную систему, как она непосредственно под атакой инфильтрации иммунных клеток. Принимая во внимание, выбор времени обработки и с помощью проточной цитометрии анализа селезенки и спинного мозга в сочетании с иммуногистохимии ЦНС оценить воспаление и повреждение позволит механистических определений, которые будут сделаны в отношении лечения.
Раскрытие информации
Авторы не имеют ничего раскрывать.
Благодарности
Эта работа финансировалась NINDS P30-NS069324, Национальный Рассеянный склероз SocietyRG 4587-A-1, Civitan Международный научно-исследовательский фонд, Майк Л. Jezdimir Поперечный миелит фонд, Университет Фонда здравоохранения Услуги Alabama - Общий Благотворительный фонд, Национальный научный фонд 1355183 и T32 AI007051 из Национального института аллергии и инфекционных заболеваний, Национальные институты здравоохранения.
Материалы
| Name | Company | Catalog Number | Comments |
| 22 x 22 x 20 mm embedding mold | Fisher Scientific | NC9719245 | |
| 22 x 30 x 20 mm embedding mold | Fisher Scientific | NC9531194 | |
| 2-Mercaptoethanol (55 mM) | Thermo Fisher Scientific | 21985-023 | |
| 2-Methylbutane | Fisher Scientific | O3551-4 | |
| 30 x 22 x 20 mm embedding mold | Fisher Scientific | 18-30 | |
| ACK Lysing Buffer | Quality Biological | 118-156-101 | |
| anti-CD4 PE-Cy7 | BD Biosciences | 552775 | 0.2 mg/ml stock concentration |
| anti-Foxp3-FITC | eBioscience | 11-5773-82 | 0.5 mg/ml stock concentration |
| anti-GFAP (Cocktail) | Biolegend | 835301 | 1 - 3 mg/ml stock concentration |
| anti-Iba-1 Polyclonal Antibody (50 µg) | Wako | 019-19741 | 0.5 mg/ml stock concentration |
| anti-IFN-γ APC | eBioscience | 17-7311-82 | 0.2 mg/ml stock concentration |
| anti-IL-17A PerCP-Cy5.5 | eBioscience | 45-7177-82 | 0.2 mg/ml stock concentration |
| anti-Ki-67 PE | eBioscience | 12-5698-82 | 0.2 mg/ml stock concentration |
| anti-MBP (D-18) | Santa Cruz Biotechnology | sc-13912 | 0.2 mg/ml stock concentration |
| anti-TCRβ FITC | eBioscience | 11-5961-85 | 0.5 mg/ml stock concentration |
| anti-TCRβ PE | eBioscience | 12-5961-83 | 0.2 mg/ml stock concentration |
| Biotinylated Goat Anti-Rabbit IgG | Vector Labs | BA-1000 | 1.5 mg/ml stock concentration |
| Biotinylated Horse Anti-Mouse IgG | Vector Labs | BA-2000 | 1.5 mg/ml stock concentration |
| Citric Acid, Anhydrous, 99.5% | Fisher Scientific | AC42356-5000 | |
| Ethylenediaminetetraacetic acid (EDTA), tetrasodium salt dihydrate, 99% | Fisher Scientific | AC446085000 | |
| Fetal Bovine Serum | HyClone | SH30071.03 | |
| Fisherbrand Superfrost Plus Microscope Slides, case of 10 | Fisher Scientific | 12-550-15 | |
| Golgi Plug | BD Biosciences | 555029 | protein transport inhibitor |
| Immedge Hydrophobic Barrier Pen | Fisher Scientific | NC9545623 | |
| Ionomycin | EMD Millipore | 407952-5mg | |
| L-Glutamine, 100x | Corning | 25-005-Cl | |
| MEM Nonessential Amino Acids | Corning | 25-025-Cl | |
| Near IR Live/Dead Staining Kit | Life Technologies | L10119 | viability dye |
| Normal goat serum | Vector Labs | S-1000 | |
| Normal horse serum | Vector Labs | S-2000 | |
| Paraformaldehyde, 96% | Fisher Scientific | AC416785000 | |
| Penicillin-Streptomycin Solution, 100x | Corning | 30-002-Cl | |
| Percoll | GE Healthcare | 17-0891-01 | density gradient |
| Permount | Fisher Scientific | SP15-500 | resinous mounting medium |
| Phorbol 12-myristate 13-acetate (PMA) | Sigma | P1585-1mg | |
| Purified anti-Myelin Basic Protein Antibody | BioLegend | 808401 | |
| RPMI 1640 | Corning | 10-040-CM | |
| Sodium Pyruvate | Corning | 25-000-Cl | |
| Tissue-Tek CRYO-OCT Compound | Fisher Scientific | 14-373-65 | |
| Triton X-100 | Sigma-Aldrich | T9284 | nonionic detergent |
| Vectastain Elite ABC Kit (Standard) | Fisher Scientific | NC9206402 | avidin-biotin-peroxidase complex (ABC) in immunoperoxidase |
| Vector Laboratories Peroxidase Substrate Kit (DAB) | Fisher Scientific | NC9276270 | DAB solution |
Ссылки
- Teitelbaum, D., Meshorer, A., Hirshfeld, T., Arnon, R., Sela, M. Suppression of experimental allergic encephalomyelitis by a synthetic polypeptide. Eur J Immunol. 1, 242-248 (1971).
- Yednock, T. A., et al. Prevention of experimental autoimmune encephalomyelitis by antibodies against alpha 4 beta 1 integrin. Nature. 356, 63-66 (1992).
- Ridge, S. C., et al. Suppression of experimental allergic encephalomyelitis by mitoxantrone. Clinical immunology and immunopathology. 35, 35-42 (1985).
- Steinman, L., Zamvil, S. S. How to successfully apply animal studies in experimental allergic encephalomyelitis to research on multiple sclerosis. Annals of Neurology. 60, 12-21 (2006).
- Kuerten, S., et al. MP4- and MOG:35-55-induced EAE in C57BL/6 mice differentially targets brain, spinal cord and cerebellum. J Neuroimmunol. 189, 31-40 (2007).
- Brownell, B., Hughes, J. T. The distribution of plaques in the cerebrum in multiple sclerosis. J Neurol Neurosurg Psychiatry. 25, 315-320 (1962).
- Kidd, D., et al. Cortical lesions in multiple sclerosis. Brain. 122 (Pt 1), 17-26 (1999).
- Kutzelnigg, A., Lassmann, H. Cortical lesions and brain atrophy in MS. Journal of the neurological sciences. 233, 55-59 (2005).
- Geurts, J. J., et al. Cortical lesions in multiple sclerosis: combined postmortem MR imaging and histopathology. AJNR Am J Neuroradiol. 26, 572-577 (2005).
- Rasmussen, S., et al. Persistent activation of microglia is associated with neuronal dysfunction of callosal projecting pathways and multiple sclerosis-like lesions in relapsing--remitting experimental autoimmune encephalomyelitis. Brain. 130, 2816-2829 (2007).
- Evonuk, K. S., et al. Inhibition of System Xc(-) Transporter Attenuates Autoimmune Inflammatory Demyelination. J Immunol. 195, 450-463 (2015).
- Rowse, A. L., et al. Lithium controls central nervous system autoimmunity through modulation of IFN-gamma signaling. PloS one. 7, e52658(2012).
- Bittner, S., Afzali, A. M., Wiendl, H., Meuth, S. G. Myelin oligodendrocyte glycoprotein (MOG35-55) induced experimental autoimmune encephalomyelitis (EAE) in C57BL/6 mice. J Vis Exp. , (2014).
- Flaherty, S., Reynolds, J. M. Mouse Naive CD4+ T Cell Isolation and In vitro Differentiation into T Cell Subsets. J Vis Exp. , (2015).
- McWilliams, I. L., Rajbhandari, R., Nozell, S., Benveniste, E., Harrington, L. E. STAT4 controls GM-CSF production by both Th1 and Th17 cells during EAE. J Neuroinflammation. 12, 128(2015).
- Legoux, F. P., Moon, J. J. Peptide:MHC tetramer-based enrichment of epitope-specific T cells. J. Vis. Exp. , (2012).
- Law, J. P., et al. The importance of Foxp3 antibody and fixation/permeabilization buffer combinations in identifying CD4+CD25+Foxp3+ regulatory T cells. Cytometry Part A : the journal of the International Society for Analytical Cytology. 75, 1040-1050 (2009).
- Strober, W., et al. Monitoring cell growth. Current protocols in immunology. Appendix 3, Appendix 3A(2001).
- Korn, T., et al. Myelin-specific regulatory T cells accumulate in the CNS but fail to control autoimmune inflammation. Nature medicine. 13, 423-431 (2007).
- Pierson, E. R., Stromnes, I. M., Goverman, J. M. B cells promote induction of experimental autoimmune encephalomyelitis by facilitating reactivation of T cells in the central nervous system. Journal of immunology. 192, 929-939 (2014).
- Hauser, S. L., et al. B-cell depletion with rituximab in relapsing-remitting multiple sclerosis. The New England journal of medicine. 358, 676-688 (2008).
- Bar-Or, A., et al. Rituximab in relapsing-remitting multiple sclerosis: a 72-week, open-label, phase I trial. Ann Neurol. 63, 395-400 (2008).
- Kappos, L., et al. Ocrelizumab in relapsing-remitting multiple sclerosis: a phase 2, randomised, placebo-controlled, multicentre trial. Lancet. 378, 1779-1787 (2011).
- Berer, K., et al. Commensal microbiota and myelin autoantigen cooperate to trigger autoimmune demyelination. Nature. 479, 538-541 (2011).
- Bergmann, C. C., Lane, T. E., Stohlman, S. A. Coronavirus infection of the central nervous system: host-virus stand-off. Nat Rev Microbiol. 4, 121-132 (2006).
- Anghelina, D., Pewe, L., Perlman, S. Pathogenic role for virus-specific CD4 T cells in mice with coronavirus-induced acute encephalitis. The American Journal of Pathology. 169, 209-222 (2006).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены