Method Article
Транскрипционная Анализ нарождающегося РНК рыб
В этой статье
Резюме
Trophoblast giant cells (TGCs) play a key role in the placenta to ensure a healthy pregnancy. We present a protocol for assessing the transcriptional status of genes in TGCs by nascent fluorescent in situ hybridization on cryostat sections of post-implantation embryos or short-term cultures of embryonic day 7 ectoplacental cones.
Аннотация
Плацента является производным от одного экстра-эмбрионального происхождения, в трофэктодерме. В пери-имплантации мышиной бластоцисты, фресковая трофэктодерме клетки дифференцируются в первичные гигантские клетки трофобласта (ТГК) в то время как полярный трофэктодерме, закрывающая внутреннюю клеточную массу продолжает разрастаться позже дифференциации во вторичные ТГК. ТГК играют ключевую роль в развитии плаценты и имеют важное значение для успешной беременности. Исследование регуляции транскрипции специфических генов в процессе развития после имплантации может дать понимание развития ТГК. Клетки ectoplacental конуса (EPC) из эмбрионов на 7-7,5 дней гестации (E7-7.5), полученный из полярного трофэктодерме, дифференцироваться во вторичные 1 ТГК. ТГК может быть изучена на месте, на криостата участках эмбрионов на E7 , хотя количество ТГК очень низкая на данном этапе. Альтернативным средством анализа вторичного ТГК является использование краткосрочных культур отдельных ЕРС из Е7 эмбрионаs. Мы предлагаем технику , чтобы исследовать транскрипционный статус генов , представляющих интерес как в естественных условиях и в пробирке на уровне одной клетки с использованием флуоресцентных гибридизация (РНК FISH) в визуализировать зарождающихся транскриптов. Этот метод обеспечивает прямое считывание экспрессии генов и позволяет проводить оценку состояния хромосомного ТГК, которые являются большие endoreplicating клетки. Действительно, ключевой особенностью терминальной дифференцировки ТГК является то, что они выходят из клеточного цикла и пройти несколько раундов endoreplication.This подход может быть применен для выявления экспрессии любого гена, экспрессированный из аутосом и / или половых хромосом и может предоставить важную информацию в развития механизмы, а также плацентарные заболеваний.
Введение
Млекопитающие трофобласта гигантские клетки (ТГК) образуют барьер между материнской и эмбриональных тканей. Они опосредуют имплантацию и вторжение зародыш в матку и играют решающую роль в развитии для формирования плаценты. Они производят несколько факторов роста (цитокины) и гормоны семейства и стероиды Пролактин / плацентарный лактоген, необходимого для эмбрионального роста и выживания. ТГК большие, Мононуклеированные и полиплоидных клеток с клеточного цикла, в endocycle, который состоит из чередующихся S и G фазы. В самом деле, являются endoreplicating ТГК - клетки, способные пройти несколько раундов синтеза ДНК без какого - либо разделения 2. Для того чтобы исследовать транскрипционный статус генов в естественных условиях, в ТГК по сравнению с другими эмбриональных и экстраэмбриональных типов клеток, зарождающейся РНК рыбы может быть выполнена в естественных условиях на криостата секций 3 на определенных этапах после имплантации. ТГК легко узнаваемы по разделам из-за Theiг большой размер, и их активность генов транскрипционных могут быть записаны, но их количество на ранних стадиях после имплантации низка. Недостаточность на Е7 ТГК эмбриональных секций, привели нас выполнять краткосрочные культуры эмбриональных тканей trophectodermal для получения дифференцированных в ТГК с целью изучения регуляции экспрессии генов в процессе развития трофэктодерме. Кроме того, для того, чтобы оставаться физиологическим, насколько это возможно, установленные клеточные линии, т.е. трофэктодерме стволовые клетки (TS) не всегда подходят для изучения механизмов развития генерации вторичных ТГК являются ценным инструментом для изучения патологических беременностей, связанных с дефектами в ТГК из-за аномального гена регулирование на мышах.
Трофобласта клетки ectoplacental конуса (EPC) являются предшественниками вторичных 4 ТГК. Спонтанное дифференцировку культивируемых ЭПК к вторичным ТГК ранее сообщалось 5. Однако, в отличие от первичных ТГК, исследований по вторичной ТГК диффереференцирование остаются ограниченными, presumablydue к трудностям изоляции EPC эксплантов свободной от каких-либо материнских или эмбриональных тканей. Мы адаптировали эти методы, чтобы выполнить РНК FISH на вторичных производных от ТГК индивидуального эмбриона на E7, на стадии развития после имплантации, где ТГК очень мало, но может быть получен из EPC предшественников. FISH РНК для анализа ядерных первичных транскриптов никогда не было сделано на уровне уровне одной клетки на вторичных ТГК. Это позволяет точный анализ транскрипции и был использован , чтобы показать эпигенетическую нестабильность на ТГК после имплантации стадии 3.
Классический пример эпигенетике у млекопитающих, инактивация Х-хромосомы (XCI) изучается в лаборатории Heard 6. В этом процессе одна из 2-Х-хромосом у самок инактивируется. Некодирующих транскриптов Xist пальто Х - хромосомы , из которых она выражается в женских клетках и вызывает молчанию большинства генов. Использование РНК FISH,формирующиеся транскриптов генов Х-хромосомой могут быть исследованы как можно накопление Xist РНК на неактивной Х - хромосомы (Xi). Здесь мы опишем процедуру для выполнения РНК FISH на участках после имплантации эмбрионов и на краткосрочных культурах EPC. Этот протокол адаптирован из тех , которые были использованы для изучения XCI в дифференциации женских эмбриональных стволовых клеток и эмбрионов предимплантационной 7-11. Мы приводим примеры из XCI в женских эмбрионов в естественных условиях, а также в пробирке ТГК.
протокол
Процедуры на животных были проведены в соответствии с утвержденным институциональному уходу за животными и использовать комитета Института Кюри (КДЭОС-IC) протоколов (C 75-05-18). Работа также была проведена в рамках разрешения Министерства высшего образования и научных исследований Франции по использованию генетически модифицированных организмов (номер договора 5549CA-I).
1. Подготовка криостата секций
- Сбор эмбрионов из естественно овуляция / 6 2J мышей DBA х F1 C57BL / , как описано в Шей и др., 12. На 7-й день беременности (E7), жертвуют 8-12 неделя старый мышь шейным смещением. Соберите весь Conceptus т.е. децидуальной 12.
- Изолировать E7 conceptuses, как описано в разделе Шей и др., 12. Поместите их в 60 мм чашки Петри, содержащей PBS.
- Замораживание E7 мыши Conceptus для секций криостата.
- Подготовка адаптированных скважин из алюминиевой фольги 1 см в высоту ( "самодельных" с помощью стеклянной Пастера пипи др). Депозит каплю среды при заморозке тканей на дне этой небольшой емкости. Депозит Conceptus в правильной ориентации (то есть, для продольных секций зародыш должен поддерживаться в горизонтальном положении).
- Заполните лунку, содержащую Conceptus с тканью замораживания среды. Приостановить его с пинцетом в парах над жидким N 2 , с тем чтобы позволить ему заморозить медленно - затем погрузить блок в жидком N 2 в течение нескольких секунд , пока он не станет белым. Затем перевести блок в пробирку замерзания и хранить при температуре -80 ° C (может храниться в течение нескольких месяцев).
- Перед тем как крио-секционирования, поместите замороженный блок, содержащий Conceptus при -20 ° С в криостате в течение 30 мин. Выполните криосрезах толщиной 8 мкм. Депозитные 4 секции на слайде, чтобы обеспечить эффективное вложение. Место участки достаточно близко , чтобы подогнать под 18 х 18 мм 2 покровное.
- Проверьте качествосекций (неповрежденные и без царапин), а также ориентация эмбриона (продольные разрезы) с помощью стереомикроскопа и выбрать участки, пригодные для дальнейшего анализа. Как можно быстрее сдать их в Коплин банку и выполнять РНК FISH (см 3.3.2).
2. Получение вторичного ТГК
- Изолировать Conceptus (см 1.1 и 1.2).
- Рассеките E7 Ectoplacental конуса (EPC)
- Используйте стереомикроскопа и чашки Петри, содержащие стерильный PBS. Рассеките децидуальной с пинцетом. Пирс образец и открытые пинцет, чтобы разорвать две стороны децидуальной друг от друга.
- Раскошеливаться эмбриона. Используйте кончики закрытых тонких щипцов (Дюмон № 5) в ножницеобразный подобные действия, чтобы отделить EPC от собственно эмбриона. Используйте особую осторожность, чтобы получить идеально чистую пробу, отдельно от материнской ткани, а также от хориона и желтка. Промойте EPC эксплантов в PBS.
- С небольшой ложкой, передавать отдельные рассеченные EPC на 4-вэйл пластину, содержащую стерильный покровное в среде.
- Выведите из EPCs ТГК краткосрочных культур.
- Подготовьте 4-луночные планшеты, содержащие покровные. Стерилизация диаметром 12 мм круглой покровные стекла, погружая в этаноле, а затем с помощью пламенной сушки.
- Добавить 0,5 мл EPC среды в каждую лунку (EPC среде: RPMI 1640 с добавлением 15% FCS, 0,1 мМ 2-меркаптоэтанол и антибиотиками).
- Депозит сингл, рассеченные-ЕРС в центре покровное в скважине вместе с культуральной средой. Используйте тонкий пинцет, чтобы применить EPC на покровного стекла. Culturefor 3-5 дней при 37 ° С в атмосфере 5% СО 2. Индивидуальные эксплантов образует нарост , который распространяется в виде монослоя уплощенной (рис ТГК 2А).
3. РНК FISH
Примечание: Протоколы основаны на те , что описаны для эмбриональных стволовых клеток (ЭСК) в Chaumeil и др, 8 и Pollex и Heard 13..
- Расширенный ПодготовительномРацион маточных растворов
- Приготовьте 3 М ацетата натрия буфера с рН 5,2.
- Готовят 2x буфера гибридизации, содержащий 40% (вес / об) сульфата декстрана натрия, 20х БСА, 400 мМ ванадила рибонуклеозидом комплекс (VRC) в физиологическом растворе 4x цитрата натрия (SSC).
- Подготовьте монтажную среду, содержащую 90% (об / об) глицерина, 0,1% (вес / об) п-фенилендиамина, рН 9 в PBS.
- Свежеприготовленных растворов
- Готовят Фиксирующий раствор, состоящий из 3% свежеприготовленного параформальдегида (PFA) в PBS. Готовят пермеабилизирующего раствор, содержащий 0,5% Тритон-X-100 в PBS с добавлением 2 мМ VRC. Приготовьте промывочный буфер путем смешивания 50% формамида (FA) и 2 x SSC и доведения рН до 7,2-7,4.
- Готовят ДНК раствор против окрашивания, состоящего из 1 мкг / мл DAPI (4 ', 6-диамидино-2-фенилиндол дигидрохлорида) в 2х SSC.
- Закрепление и пермеабилизирующего в рамках подготовки к FISH
- Для клеток на покровные, мыть клетки в 1x PBS в течение 5 мв. Фикс клетки на покровных стеклах, или эмбриональных секций на слайдах, в течение 10 мин в фиксаторе (3% PFA) раствора при комнатной температуре.
- Полоскание клеткам трижды 1х PBS. Проницаемыми клетки в течение 5 мин в охлажденном льдом растворе пермеабилизации на льду. Мыть клетки три раза с 70% -ным этанолом. Магазин покровные в 4-луночные планшеты и слайды в 4-слайд-транспортной коробке в 70% этанола при -20 ° С.
Примечание: Покровные и слайды могут храниться в течение нескольких месяцев при -20 ° C. Тарелки и ящики, содержащие их, должны быть герметизированы с парафином, чтобы избежать испарения этанола.
- ДНК-зонд Этикетировочное
- Меченых зондов ДНК по нику перевода с использованием флуоресцентных нуклеотидов. Следуйте инструкциям производителя (таблица 1) 8.
- Для получения реакционной смеси 50 мкл, добавьте 1-2 мкг плазмиды, бактериальные искусственные хромосомы (BAC) или усиление многократного перемещения (MDA) (для амплификации ДНК, см 3.4.4) ДНК 17,5 мкл воды, 2,5 мкл 0,2 мМSR-, SG-, Cy5-дУТФ, 10 мкл 10 мМ каждого дНТФ смеси (дГТФ, дАТФ, дЦТФ), 5 мкл 10 мМ дТТФ, 5 мкл 10х буфера ник перевода и 8 мкл ник перевод фермента.
- Инкубируют в течение 16 часов при 15 ° C в темноте. Инактивировать реакцию замораживанием при -20 ° С. Храните зонды в течение нескольких месяцев при -20 ° C.
- MDA
Примечание: Для получения БАВ ДНК, количество ДНК, полученной после того, как классической подготовки низок, поэтому можно использовать стадию амплификации ДНК, прежде чем маркировки с использованием MDA. Использование коммерческого набора и следуйте инструкциям изготовителя (таблица 1). - Смешайте BAC ДНК 0,5 мкл с 9,5 мкл буфера для образцов. Нагреть 3 мин при температуре 95 ° С. Немедленно утолить на льду; оставить на льду 10 мин. Подготовка реакционного буфера / смеси ферментов: (9,5 мкл + 0,5 мкл фермента смесь) и держать на льду.
- Смешайте 10 мкл смеси ДНК + 10 мкл реакционного буфера / смеси ферментов. Инкубируют при 30 ° С по меньшей мере 20 часов. Деактивированы фермента путем нагревания образца 10 мин при 65 & #176; С. Холодный образец до 4 ° С перед хранением при -20 ° С.
- Проверьте MDA перевариванием. Добавить 1 мкл MDA, 2 мкл 10х буфера, 2 мкл Hind III и 15 мкл H 2 O. Инкубируют при 37 ° С в течение ночи. Бегите медленно на агарозном геле 0,8-1%, чтобы подтвердить точное амплификации ДНК. Четкие фрагменты ДНК с высокой молекулярной массой должны наблюдаться на геле.
- Probe Подготовка
- Используйте 0,1 или 1 мкг пробником на покровное или слайд.
Примечание: Добавить 2-5 мкг Cot-1 ДНК , если конкуренция необходима, например , большинство зондов , поскольку они могут содержать повторяющиеся последовательности , которые в противном случае кросс гибридизоваться и увеличение фона.- Для осаждения, добавьте 5 мкг ДНК спермы лосося, 1/10 объема 3 М ацетата натрия рН 5,2 и 3 объема этанола. Спин при 16000 х г и 4 ° С в течение 25 мин. Мытье окатышей с 70% -ным этанолом и спином вниз снова в течение 5 минут.
- Сухие гранулы в течение 2 мин в Концентратор / Спид Вак. Ресуспендируют в 100% формеамида в половине объема , необходимого для гибридизации (например, 2,5 мкл для покровного или 7 мкл для эмбриональных разделов на слайде). Поместите 30 мин при 37 ° C при встряхивании в термомиксер. Денатурации в течение 7 мин при 75 ° С.
- Угашайте на льду, или если конкуренция требуется поместить непосредственно при температуре 37 ° С в течение 30-60 мин. Приготовьте раствор зонда с равным объемом раствора гибридизации 2x.
- Используйте 0,1 или 1 мкг пробником на покровное или слайд.
- Гибридизация и промывные
- Дегидрировать; покровные в скважинах, и слайды в банке Коплин, путем последовательной промывки в 1x 80%, 95% 1x и 2x 100% этанола в течение 5 мин каждый. Сухие покровные и слайды полностью.
- Для гибридизации применяют 5 мкл смеси гибридизации с зондом (см 3.5) на слайд и опустите покровное, с клетками, обращенным внутрь гибридизация смеси. Для секций на слайде, нанесите 14 мкл смеси гибридизации с зондом (см 3.5) и накрыть 18 х 18 мм 2 покровное.
- Место слайды во влажной камере (папиросную бумагу пропитанную50% FA / 2 x SSC) и инкубируют при 37 ° С в течение ночи, в темноте.
- Пост-гибридизация Моет:
- Добавляют 1 мл 50% FA / 2 x SSC на покровное на слайде, чтобы ослабить его; осторожно удалите покровное из слайда (осторожно, чтобы не царапать клетки) и поместить его клеток стороной вверх в 4-луночного планшета, содержащего 50% FA / 2x SSC. Для секций на слайде, удалите покровное аналогичным образом и поместить слайд в банку Коплин, содержащей 50% FA / 2x SSC.
- Выполните 3 промывок, каждый из которых в течение 7 мин с подогретого 50% FA / 2х SSC при 42 ° C или 44 ° C для покровного или слайд, соответственно.
- Выполните 3 стирок с подогретым 2х SSC в течение 5 мин каждый при 42 ° C или 44 ° C для покровного или слайд, соответственно.
- Проводят контрастное ядра промывкой в 2х SSC с 1 мкг / мл DAPI в течение 3 мин при комнатной температуре. Промыть дважды с 2х SSC.
- Монтаж покровные и презентациями
- Для малых покровного из культивируемых ТГК, применять 5 & #181, л гистологическая среда на слайде. Поместите покровное клеток стороной вниз на верхней части капли.
- Для слайд с разделами, нанесите 15 мкл гистологическая среда на слайде. Поместите 22 х 22 мм 2 покровное в верхней части капли.
- Избегайте пузырьков. Сотрите излишки раствора монтажа. Печать покровное с небольшим количеством лака для ногтей. Если это возможно, изображение скользит сразу или хранить в течение нескольких месяцев при -20 ° С.
4. Микроскопия и анализ
- Приобретать изображения 3D последовательные оси г в 0,3 мкм с использованием флуоресцентного микроскопа (63X цель) и провести анализ 3D - стеков изображения , используя программное обеспечение ImageJ 14.
Результаты
ТГК могут быть идентифицированы по разделам E7 после DAPI окрашивания за счет их локализации в зародыш и их большого размера. Это показано на рисунке 1А на продольном разрезе. РНК FISH проводили на таких зародышевых участках с целью изучения инактивации Х-хромосомы в этой внеэмбриональной линии.
Несколько слайдов или покровные могут быть обработаны одновременно. При использовании различных красителей для маркировки РНК различных генов, можно обнаружить различные первичных транскриптов в том же самом ядре. По крайней мере , 2 зонды могут быть смешаны вместе, например Xist соединен с SG (зеленый сигнал) и Atrx в сочетании с SR (красный сигнал). Примером женского ТГК показана на рисунке 1В , где представлены 2 других происхождений, собственно эмбриона (Е) и висцеральной энтодермы (VE). Ядро ТГК показана с Xist РНК покрытие X хромosome, который инактивируется (Xi), а другая Х-хромосома, которая активна (Xa) отображает несколько точно определяет. Х-сцепленные ген Atrx первичных транскриптов экспрессируются из активной Х - хромосоме (не украшен Xist) в нескольких экземплярах из - за эндорепликации. Это иллюстрирует моноаллельную выражение , например, инактивация Atrx на одной Х - хромосоме.
Поскольку неоднородны ТГК по размеру , как показано на рисунке 2B, только самые крупные из них регистрируются. Три зонды могут быть также использованы , как показано на фиг.2С для вторичных ТГК. В этом случае Xist -SG (зеленый), две Х-сцепленные гены: Г6ФД -SR (красный) и Huwe1 -CY (пурпурного) были проанализированы в то же время в том же ядре. В то время как Г6ФД будет monoallelically выражена , как показано здесь (и ранее показано на вторичных 3 ТГК) Huwe1 является biallelically выразил демонстрируя свою прoperty бежать XCI. Эндорепликации, с несколькими т.е. точно определяет зарождающиеся стенограммы копии, также очевидно.
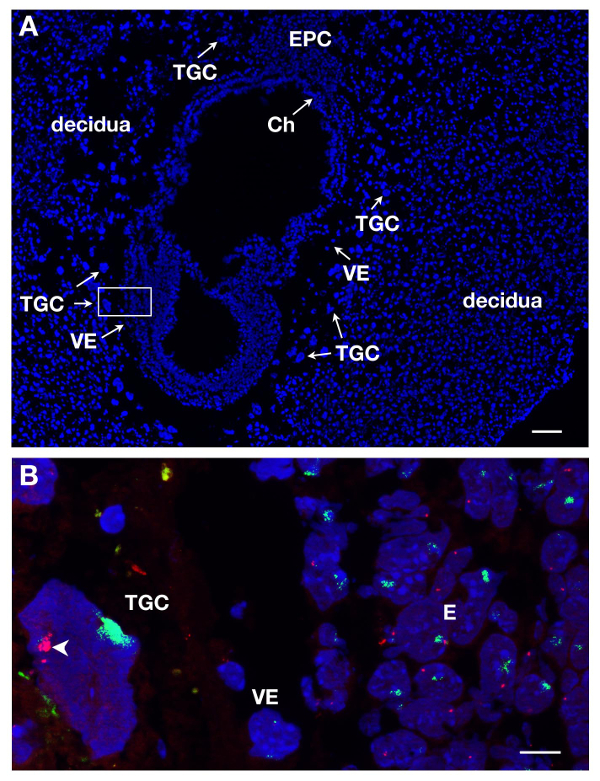
Рисунок 1. Выражение первичного транскрипта в Е7 из ТГК женского эмбрионального секции. (A) Продольный разрез зародыш E7 окрашивали DAPI. Эмбрион и экстра-эмбриональные ткани окружены материнской ткани, децидуальной. Локализация различных линий производится при DAPI окрашивания с целью 5X. ТГК определены из-за их больших размеров. Ч., хориона, Е, эмбрион, EPC, ectoplacental конус, VE, висцеральной эндодермы, ТГК, гигантские клетки трофобласта. Шкала бар = 100 мкм. (В) более высокое увеличение площади коробочной в в А (63x цель) РНК FISH. Atrx первичный транскрипт в красном и Xist РНК в зеленом визуализируются на 3 родословных = E, VE, ТГК. Южная Каролинаэля бар = 10 мкм. Пример в естественных условиях ТГК , где Atrx является monoallelically выраженной (Xa, и стрелки) ничего не говорится о Xist -покрытие Х - хромосомой (Xi); несколько сигналов Atrx видны на Xa обусловлены эндорепликации. Atrx = BAC клон RP23-260I15. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
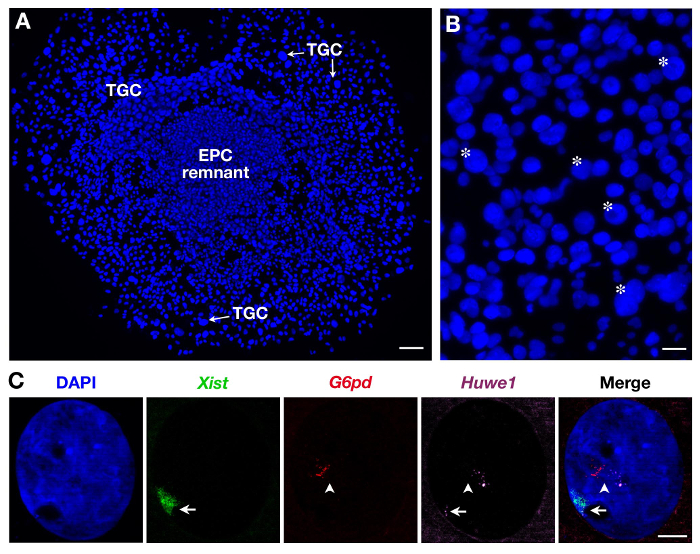
Рисунок 2. Выражение первичного транскрипта во вторичных ТГК , полученных из EPC. (A) Общий вид растущих вторичного (ТГК x5 цель). Шкала бар = 100 мкм. (B) Звездочка указывают на пример ТГК в соответствии с их размера (цели 10X). Шкала бар = 60 мкм. (C) Пример вторичной самки ТГК РНК FISH с использованием 3 -х зондов (Xist Domaв зеленый, покрывая инактивированную Х - хромосомы: Xi) , показывающий эндорепликации из Г6ФД и Huwe1 первичных транскриптов (несколько, в точно определяет красный и пурпурный). В то время как Г6ФД выражается monoallelically, экспрессия Huwe1 является биаллельных в этом ядре Huwe1 = BAC клон RP24-157H12;. Г6ФД = BAC клон RP23-13D21. Xi = стрелка; Xa = стрелолист (63X цель). Шкала бар = 10 мкм. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Обсуждение
Nascent РНК FISH представляет собой простой и чувствительный метод для одного анализа клеток транскрипционной активности в эмбриональных тканях на разных стадиях развития. Сила этого подхода является способность идентифицировать различные эмбриональные клоны на какой-либо конкретной стадии по морфологическим критериям. Однако это также требует, чтобы минимальный фон флуоресценции присутствует. Любой такой фон делает идентификацию различных эмбриональных регионов и типов клеток сложной задачей. Для обеспечения минимального фона, есть два важных шагов в этом протоколе. Первым из них является качество cryosection, а второй является эффективность (отношение сигнал-шум), РНК-FISH, которая зависит от уровня экспрессии генов и качества зонда. Что касается последнего, зонды поэтому всегда протестирована на культивируемые клетки на покровных стеклах (эмбриональные стволовые клетки или соматические клетки) перед использованием по разделам.
В этом протоколе, мы предоставляем йМетоды е требуется для проведения анализа FISH РНК на ТГК из двух различных типов подготовки проб (криостатные и первичных культурах эмбриональных эксплантов). Такой единый анализ клеток позволяет динамические изменения в экспрессии генов на разных этапах после имплантации необходимо оценить.
Методы мы описываем для генерации вторичного ТГК (на E7-7.5 стадиях после имплантации) были использованы в нашей лаборатории для изучения Х-хромосома инактивации модели экстра-эмбриональные линии, который состоит из этапов на ТГК после имплантации. Экстра-эмбриональное развитие у грызунов зависит от дифференциации ТГК. Действительно, ТГК имеют важное значение для плацентарного и, таким образом, эмбрионального развития. Дефекты в ТГК дифференциации вызывают эмбриональную летальность (для обзора см ссылку 15). Транскрипционной активности РНК с использованием ТГК FISH позволило нам продемонстрировать необычную Х - хромосомы статус инактивация такого типа клеток во время развития мыши 3.
Методы, представленные здесь, чтобы получить и изучить вторичные ТГК могут быть применены для изучения молекулярных путей в развитии важных внеэмбриональной тканей они являются частью, как в нормальных, так и мутантных мышей. Эти подходы могут быть адаптированы для изучения развития ТГК и у других млекопитающих. Наш анализ включал использование диких эмбрионов типа мыши позволяет нам оценить транскрипционной активности различных генов в в естественных условиях и в ТГК ТГК в пробирке , полученных из EPC эксплантов. Этот метод может быть расширен до анализа трансгенных мышей и / или добавлением молекул ингибитора в культуральной среде. Мы успешно использовали этот метод РНК FISH на другом типе ТГК, такие как первичные, которые появляются ТГК на более ранней стадии развития мыши, E3.0 blastocyts, которые могут быть индивидуально культивировали в течение 4-5 дней, в течение которого развитые вырост, то ИВМ в окружении крупных первичных 16,17 ТГК. Нарождающиеся транскрипты разныегены , а также Xist можно визуализировать и количественно , используя тот же подход РНК FISH 3.
Комбинированные иммунофлуоресценции и РНК рыбы также может быть выполнена на криостатные, а также в пробирке , культивируемых 3 ТГК. Это свидетельствует о том, что метод является достаточно надежным, так как первичные транскрипты в значительной степени подвержены деградации, и есть абсолютное требование РНКазных свободных соединений. IF / РНК FISH предоставляет дополнительную информацию об уровнях транскрипции, клеточной локализации и экспрессии белка, одновременно в данной клетке. Несмотря на то , участки залитой в парафин ткани использовались ранее для выявления возникающую РНК в опухолях человека , при сохранении морфологии 18 ткани, в наших руках, криостат секции являются более подходящими для сохранения как возникающую РНК и эпитопы , необходимое для обнаружения антител во время иммунофлюоресценции ,
В дополнение к РНК FISH, после IMmunofluorescence, хромосомная ДНК рыбы также могут быть выполнены на вторичных с использованием зондов , ТГК меченные флуорохромии аналогичными тем , которые используются для РНК - FISH 3. Флуоресцентные зонды могут быть либо плазмидами / fosmids или BACs, меченные флуоресцентными dUTPs, используемый здесь, и описаны в Chaumeil и др., 8. В качестве альтернативы, флуоресцентно меченых олигонуклеотидов могут быть использованы 19. Поскольку ДНК-рыба не требует прядей специфичности, олигонуклеотидные зонды могут быть предназначены для решения любой из двух комплементарных нитей в целевой области. Разветвленные ДНК - зонды, где усиление сигнала достигается за счет двух последовательных раундов специфических и усилителя зондов также могут быть использованы для повышения отношения сигнал-шум рыбы сигналов 20. В качестве альтернативы, РНК-зонды, такие как рибонуклеотидными зондами могут быть использованы, хотя в наших ДНК-зондов на основе гарантировать лучшее компромисс между качеством сигнала, специфичности и простоты использования.
И, наконец, 3D-изображение acquisitiна имеет важное значение для того, чтобы получить требуемую пространственную информацию в этих крупных клеток, и может быть выполнена с использованием различных флуоресцентных микроскопов, таких как микроскоп Apotome или эпифлуоресцентной микроскопов с деконволюции, такими как DeltaVision (GEH), или другие микроскопов подходит для формирования изображения срезов тканей, а также большой (> 20 мкм) ТГК. Следует отметить, что для отдельных локусов ДНК-копии, то точечное сигнал обнаружен зарождающейся РНК рыба или ДНК может не быть легко обнаружены с помощью конфокальной микроскопии.
В заключение отметим, что методы, которые мы описываем здесь должны быть полезны как для детального анализа TGS в контексте развития, но и в других ситуациях болезни. Многие гены, которые участвуют в развитии и функции ТГК у грызунов законсервированы у грызунов и человека, таких как факторы транскрипции, протеазы и молекул клеточной адгезии 21. Мыши являются ТГК модели клеток для изучения генов, которые регулируют развитие плацентарной А.Н.d поэтому дать понимание плацентарных заболеваний человека. Кроме того, из-за того, что эти клетки endoreplicating и поскольку некоторые раковые клетки занимаются программы endocycle, в дополнение к процессам амплификации генов, методы мы описываем также должны быть полезны в единичных исследованиях клеток, необходимых для изучения механизмов, приводящих к нестабильность генома в раковых клетках ,
Раскрытие информации
The authors have nothing to disclose.
Благодарности
Мы благодарим Софи Gournet за помощь с иллюстрациями, Джули Chaumeil за чтение рукописи, жилищный центр животных и платформы визуализации агрегата. Эта работа получила поддержку в рамках программы «Investissements d'Avenir» запущен правительством Франции и осуществляется ANR со ссылками ANR-10-LabX-0044 и ANR-10-IDEX-0001-02 PSL, то EpiGeneSys FP7 нет. 257082 Сеть передового опыта в EH, ERC Advanced Следователь наградит нет. не 250367 и ЕС FP7 SYBOSS предоставляют нет. 242129 в EH Авторы хотели бы отметить клеточной и тканевой визуализации Платформа генетики и развивающего отдела биологии (UMR3215 / U934) из Института Кюри, член France-биоимиджинга (ANR-10-InSb-04), за помощью света микроскопия.
Материалы
| Name | Company | Catalog Number | Comments |
| Stereomicroscope | Nikon | SMZ 1500 | |
| Stereomicroscope | Zeiss | Stemi SV6 | |
| Scissors Pascheff-Wolff | Moria | MC19 | |
| Dumont #5 forceps | Roth | PK78.1 | |
| 4-well tissue culture dishes | Nunc | 176740 | |
| 60 mm Petri dishes Falcon | Dutsher, France | 353004 | |
| 100 mm Petri dishes Falcon | Dutsher, France | 353003 | |
| Coverslips 18 mm x 18 mm | VWR | 631-1331 | |
| Coverslips 22 mm x 22 mm | VWR | 631-0125 | |
| 12 mm glass round coverslips | Harvard apparatus | 64-0712 | |
| Slides Superfrost plus | VWR | 631-9483 | |
| 4-slide Transport box Lockmailer | Dutsher, France | 40684 | |
| Cryotubes 1.8 ml Corning | Fisher Science | 10418571 | |
| Glass Coplin staining jars | Fischer Scientific | W1561L | |
| TissueTek O.C.T compound | VWR | 4583 | |
| RPMI 1640 medium | Invitrogen | 61870 | |
| Phosphate buffered saline (PBS) | Sigma-Aldrich | D1408 | 10x is used |
| Water | Sigma-Aldrich | W3500 | |
| Paraformaldehyde | Panreac Quimica, Spain | 141451 | 3% in PBS |
| Triton-X-100 | Euromedex | 2000-A | 0.5% final |
| Vanadyl ribonucleoside complex (VRC) | New England Biolabs, USA | S1402S | |
| Sodium dextran sulfate | Sigma-Aldrich | D8906 | |
| Bovine serum albumin (BSA) | New England Biolabs, USA | B9001S | |
| Formamide | Sigma-Aldrich | 47671-1L-F | aliquots kept at -20 °C |
| Illustra TempliPhi Kit Construct (Kit MDA) | Dutsher, France | 25-6400-80 | |
| Nick translation kit | Abbott, USA | 07J00-001 | |
| 20x SSC buffer concentrate | Sigma-Aldrich | S6639 | |
| Spectrum green dUTP | Abbott, USA | 02N32-050 | |
| Spectrum red dUTP | Abbott, USA | 02N34-050 | |
| Cy-5 dUTP | Dutsher, France | PA55022 | |
| Mouse Cot-1 DNA | Invitrogen | 18440016 | |
| DNA, MB grade | Invitrogen | Roche | DNA from fish sperm |
| 4′,6-diamidino-2-phenylindole dihydrochloride | Sigma-Aldrich | D9564 | DAPI |
| Glycerol | Sigma-Aldrich | G9012 | |
| p-phenylenediamine | Sigma-Aldrich | 695106 | |
| Centrifuge 5417R | Eppendorf, Germany | molecular biology grade | |
| Eppendorf concentrator plus | Eppendorf | ||
| Eppendorf Thermomixer comfort | Eppendorf | ||
| Liquiport Liquid pump | KNF Neuberger, Trenton, USA | ||
| Shake'N'Bake Hybridization oven | Boekel Scientific, USA | ||
| Cryostat | Leica | CM3050 |
Ссылки
- Cross, J. C. Genetic insights into trophoblast differentiation and placental morphogenesis. Sem. Cell Dev. Biol. 11, 105-113 (2000).
- Zybina, E. V., Zybina, T. G. Polytene chromosomes in mammalian cells. Int. Rev. Cytol. 165, 53-119 (1996).
- Corbel, C., Diabangouaya, P., Gendrel, A. -. V., Chow, J. C., Heard, E. Unusual chromatin status and organization of the inactive X chromosome in murine trophoblast giant cells. Development. 140, 861-887 (2013).
- Rossant, J., Tamura-Lis, W. Effect of culture conditions on diploid to giant-cell transformation in postimplantation mouse trophoblast. J. Embryol. Exp. Morphol. 62, 217-227 (1981).
- El-Hashash, A. H., Kimber, S. J. Trophoblast differentiation in vitro: establishment and characterization of a serum-free culture model for murine secondary trophoblast giant cells. Reproduction. 128, 53-71 (2004).
- Chow, J. C., Heard, E. X inactivation and the complexities of silencing a sex chromosome. Curr Opin Cell Biol. 3, 359-366 (2009).
- Chaumeil, J., Okamoto, I., Heard, E. X-chromosome inactivation in mouse embryonic stem cells: analysis of histone modifications and transcriptional activity using immunofluorescence and FISH. Methods Enzymol. 376, 405-419 (2004).
- Chaumeil, J., Augui, S., Chow, J. C., Heard, E. Combined immunofluorescence, RNA fluorescent in situ hybridization, and DNA fluorescent in situ hybridization to study chromatin changes, transcriptional activity, nuclear organization, and X-chromosome inactivation. Methods Mol. Biol. 463, 297-308 (2008).
- Okamoto, I., Otto, A. P., Allis, C. D., Reinberg, D., Heard, E. Epigenetic dynamics of imprinted XCI during early mouse development. Science. 303, 644-664 (2004).
- Okamoto, I., Arnaud, D., Le Baccon, P., Otte, A. P., Disteche, C. M., Avner, P., Heard, E. Evidence for de novo imprinted X-chromosome inactivation independent of meiotic inactivation in mice. Nature. 438, 369-373 (2005).
- Patrat, C., Okamoto, I., Diabangouaya, P., Vialon, V., Le Baccon, P., Chow, J., Heard, E. Dynamic changes in paternal X-chromosome activity during imprinted X-chromosome inactivation in mice. Proc. Natl. Acad. Sci. 106, 5198-5203 (2009).
- Geijsen Shea, K., N, Dissection of 6.5 dpc mouse embryos. J. Vis. Exp. (2), e160 (2007).
- Pollex, T., Piolot, T., Heard, E. Live-cell imaging combined with immunofluorescence, RNA, or DNA FISH to study the nuclear dynamics and expression of the X-inactivation center. Methods Mol. Biol. 1042, 13-31 (2013).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature Methods. 9, 671-675 (2012).
- Hemberger, M. IFPA award in placentology lecture - characteristics and significance of trophoblast giant cells. Placenta. 29, 4-9 (2008).
- Carney, E. W., Prideaux, V., Lye, S. J., Rossant, J. Progressive expression of trophoblast-specific genes during formation of mouse trophoblast giant cells in vitro. Mol. Reprod. Dev. 34, 357-368 (1993).
- Shin, J., et al. Maternal Rnf12/RLIM is required for imprinted X-chromosome inactivation in mice. Nature. 467, 977-981 (2010).
- Capodieci, P., Donovan, M., Buchinsky, H., Jeffers, Y., Cordon-Cardo, C., Gerald, W., Edelson, J., Shenoy, S. M., Singer, R. H. Gene expression profiling in single cells within tissue. Nat Methods. 9, 663-665 (2005).
- Beliveau, B. J., Joyce, E. F., Apostolopoulos, N., Yilmaz, F., Fonseka, C. Y., McCole, R. B., Chang, Y., Li, J. B., Senaratne, T. N., Williams, B. R., et al. Versatile design and synthesis platform for visualizing genomes with Oligopaint FISH probes. Proc. Natl. Acad. Sci. 109, 21301-21306 (2012).
- Kenny, D., Shen, L., Kolberg, J. A. Detection of viral infection and gene expression in clinical tissue specimens using branched DNA (bDNA) in situ hybridization. J. Histochem. Cytochem. 50, 1219-1227 (2002).
- Cross, J. C., Baczyk, D., Hemberger, M., Hugues, M., Simmons, D. G., Yamamoto, H., Kingdom, J. C. Genes, development and evolution of the placenta. Placenta. 24, 123-130 (2003).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены