Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Синтез циклических полимеров и характеристика их диффузионное движение в расплавленном состоянии на уровне отдельной молекулы
В этой статье
Резюме
Протокол для синтеза и определения характеристик диффузионного движения циклических полимеров на одной молекулы уровне представлена.
Аннотация
We demonstrate a method for the synthesis of cyclic polymers and a protocol for characterizing their diffusive motion in a melt state at the single molecule level. An electrostatic self-assembly and covalent fixation (ESA-CF) process is used for the synthesis of the cyclic poly(tetrahydrofuran) (poly(THF)). The diffusive motion of individual cyclic polymer chains in a melt state is visualized using single molecule fluorescence imaging by incorporating a fluorophore unit in the cyclic chains. The diffusive motion of the chains is quantitatively characterized by means of a combination of mean-squared displacement (MSD) analysis and a cumulative distribution function (CDF) analysis. The cyclic polymer exhibits multiple-mode diffusion which is distinct from its linear counterpart. The results demonstrate that the diffusional heterogeneity of polymers that is often hidden behind ensemble averaging can be revealed by the efficient synthesis of the cyclic polymers using the ESA-CF process and the quantitative analysis of the diffusive motion at the single molecule level using the MSD and CDF analyses.
Введение
Cyclic polymers are unique in that they do not have chain ends. They often exhibit unusual behaviors which is distinct from their linear counterpart, including increased thermal stability of polymer micelles by a linear-to-cyclic conversion,1,2 and spatial organization of DNA in bacterial cells by a loop formation.3 Topological interactions between the cyclic chains are believed to be the critical factor for such unusual behaviors.4,5 Therefore, characterizing the motion and relaxation of cyclic polymers under entangled conditions has been an important research topic in polymer science for decades.6
Cyclic polymer dynamics has been investigated using both synthetic and naturally occurring molecules by means of ensemble averaged experimental methods such as nuclear magnetic resonance (NMR), light scattering, and viscosity measurements.7-9 However, these studies often suffer from impurity molecules in the samples.10 Furthermore, spatiotemporal heterogeneities of the motion of individual molecules caused by inherent structural heterogeneity of entangled polymers are often hidden behind the ensemble averaging in these studies. In order to characterize molecular level dynamics of cyclic polymers, a synthesis method that provides high purity cyclic polymers and an experimental and analysis methods that allow for quantitative characterization of molecular motion at the single molecule level have to be developed. Here, we will show a method to synthesize high-purity cyclic and dicyclic poly(THF)s that incorporate a fluorophore unit using an electrostatic self-assembly and covalent fixation (ESA-CF) process11-13 and a method to analyze the motion of the individual fluorophore-incorporated polymer chains using a combination of mean-squared displacement (MSD) and cumulative distribution function (CDF) analyses.
A proper data processing has been shown to be essential for the accurate characterization of the diffusive motion. With an adequate MSD and CDF analyses, a multiple-mode diffusion of the cyclic and dicyclic polymers in the melt and semi-dilute solution of the linear polymer chains has been revealed,14-16 suggesting the significant effects of the topological states of the polymers on the diffusive motion of the chains under entangled conditions.17 While the experimental and analytical approaches to characterize the motion of the cyclic polymers are described in this protocol, the same method can be used to quantitatively characterize the diffusive motion in many other heterogeneous systems. The approach would be especially suitable when multiple diffusion components existing in the samples are to be analyzed.
протокол
1. Синтез монофункциональных и бифункциональных Поли (ТГФ)
- Монофункциональное поли (ТГФ)
- Пламя насухо 2-образным вырезом 100-мл колбу с круглым дном. Вакуумные и заполняют колбу с азотом (3 цикла).
- Добавить дистиллированную тетрагидрофуран (ТГФ) (50 мл) в колбу. Поместите колбу в водяную баню при температуре 20 ° С и уравновешивания температуры.
- Добавить метилтрифлатом (0,5 ммоль) в колбу с помощью шприца. Смесь перемешивают в течение 5-10 мин при температуре 20 ° С.
- Добавить N -фенил пирролидина (4-6 экв.) В колбу с помощью шприца. Смесь перемешивают в течение 30-60 мин.
- Полностью удалить растворитель при пониженном давлении (около 100 мм рт.ст.). Остаток растворяют в 3-5 мл ацетона. Добавить раствор ацетона в 300-500 мл н - гексана. Фильтр осадка и сушат под пониженным давлением.
- Бифункциональные поли (ТГФ)
- Пламя насухо 2-образным вырезом 100-мл колбу с круглым дном. Vacuum и заполнить колбу с азотом (3 цикла).
- Добавить дистиллированную ТГФ (50 мл) в колбу. Поместите колбу в водяную баню при температуре 20 ° С и уравновешивания температуры.
- Добавить ангидрида трифторуксусной кислоты (0,3 ммоль) в колбу с помощью шприца. Смесь перемешивают в течение 5-10 мин при температуре 20 ° С.
- Добавить N -фенил пирролидина (4-6 экв.) В колбу с помощью шприца. Смесь перемешивают в течение 30-60 мин.
- Полностью удалить растворитель при пониженном давлении (около 100 мм рт.ст.). Остаток растворяют в 3-5 мл ацетона. Добавить раствор ацетона в 300-500 мл н - гексана. Фильтр осадка и сушат под пониженным давлением.
2. Синтез перилен диимидом-4 включены вооруженные Звезда и 8-образный бициклических Поли (ТГФ)
- Вооруженный звезда поли (ТГФ)
- Ионный обмен
- Растворите периленкарбок диимид тетракарбоксилата натриевой соли в воде (10 мг / мл, 150 мл). растворятьсямонофункциональный поли (ТГФ) в ацетоне (160 мг / мл, 4 мл). Добавл ют по капле ацетонового раствора в интенсивно перемешиваемой водном растворе. Собирают образовавшийся осадок фильтрацией.
- Повторите описанную выше процедуру с извлеченного осадка (2.1.1.1) четыре раза.
- Ковалентная крепление
- Растворение полученного осадка в толуоле (5 мг / мл). Нагревание с обратным холодильником раствора в течение 4 ч.
- Полностью удалить растворитель при пониженном давлении (около 100 мм рт.ст.). Фильтр остаток через пробку из силикагеля с использованием н - гексан / ацетон (2/1 об / об). Добавить раствор в охлажденную льдом воду (300-500 мл), чтобы осадить продукт. Собирают осадок фильтрованием.
- Ионный обмен
- Двухцикличный 8-образный поли (ТГФ)
- Ионный обмен
- Растворите периленкарбок диимид тетракарбоксилата натриевой соли в воде (6 мг / мл, 50 мл). Растворите бифункциональный поли (ТГФ) (0,5 г) В 30-50 мл ацетона. Добавл ют по капле ацетонового раствора в интенсивно перемешиваемой водном растворе при 0 ° С. Собирают образовавшийся осадок фильтрацией.
- Повторите описанную выше процедуру с извлеченного осадка (2.2.1.1).
- Ковалентная крепление
- Растворение полученного осадка в толуоле (0,05 г / л). Нагревание с обратным холодильником раствора в течение 4 ч.
- Полностью удалить растворитель при пониженном давлении (около 100 мм рт.ст.). Добавить толуол частично растворяют остаток. Повторно осаждаются в 300-500 мл н - гексана.
- Фильтр образовавшийся осадок через пробку из силикагеля с использованием н - гексан / ацетон (2/1 об / об). Повторно осаждаются в 300-500 мл воды.
- Очищают образовавшийся осадок путем хроматографии на колонке с использованием 18 гель полистирола. Дальнейшей очистки сырого продукта с помощью препаративной гель - проникающей хроматографии (ГПХ) с 19 в качестве элюента смеси CHCl 3 РемуOve побочных продуктов путем мониторинга показателя преломления (RI) и УФ-детекторов.
- Ионный обмен
3. одиночных молекул флуоресцентной томографии Эксперимент
- Базовые приготовления
- Очистка микроскопа покровных стеклах
- Место No. 24 1,5 х 24 мм микроскоп крышка скользит в сосуд для окрашивания.
- Добавить раствор гидрида 1 М калия (100 мл) в банку и разрушать ультразвуком в течение 15 мин. Слейте раствор гидроксида калия при декантации и ополаскивают покровных стеклах с ультра-чистой водой несколько раз. Добавить спектроскопического класса этанола (100 мл) в банку и разрушать ультразвуком в течение 15 мин.
- Слейте этанол путем декантации и ополаскивают покровных стеклах с ультра-чистой водой несколько раз. После заливки от ультра-чистой воды декантацией, повторите шаг 3.1.1.2.
- Добавить ультра-чистую воду в банку и разрушать ультразвуком в течение 15 мин. Промыть покровных стеклах с ультра-чистой воды в несколько раз, Выньте крышку ускользает из кувшина с помощью пластиковых пинцеты и высушить их либо сухим воздухом или сухим азотом.
- Приготовление образцов полимерного расплава 14,15
- Добавьте 100 мкл немеченого линейного поли (ТГФ) в стеклянной бутылке и нагреть его до температуры выше точки плавления (приблизительно 25 ° C) с помощью фена.
- Развести флуорофора внедренной полимер (линейный, 4-вооруженных звезду, циклический или 8-образную дициклическую , синтезированный в 2,1 и 2,2) в хлороформе (1 мл, 10 -6 М). Добавляют 1 мкл раствора к 100 мкл расплава немеченого линейного поли (ТГФ).
- После тщательного перемешивания образца с наконечником пипетки, испаряются хлороформа путем нагревания образца с использованием сушилки.
ПРИМЕЧАНИЕ: Это обеспечивает расплав немеченого линейного поли (ТГФ) , содержащего 10 -8 М флуорофора включены полимеров. - Возьмите 10 мкл образца с использованием микро-пипетки и дROP его на очищенную покровным. Другими очищенную крышку скольжения на образце и сэндвич образца между двумя покровных стеклах.
- Нажмите пробу осторожно с помощью пластикового пинцета.
- Очистка микроскопа покровных стеклах
- Установка 15 флуоресцентных изображений Широкое поле
- Внедрение лазера возбуждения (488 нм) в задний порт инверсионного микроскопа
- Вставьте полосовой фильтр возбуждения и поляризатор в пути луча.
- Разверните луч приблизительно 1 см в диаметре с помощью расширителя пучка.
- Вставьте четвертьволновой пластины в пути луча. Установить оптическую ось волновой пластины на 45 градусов по отношению к этому поляризатора. В качестве альтернативы, вставить компенсатор Berek и установить оптическую задержку Л / 4.
- Вставьте диафрагму в пути луча возбуждения для регулировки размера пучка.
- Перед введением лазерного луча в задний порт инвертированного оптического microscoPE, вставить фокусирующую линзу (план-выпуклой линзы, фокусное расстояние ≈ 300 мм) в положении, где коллимируется лазерный луч из объектива.
- После того, как отражении лазерного луча с помощью дихроичного зеркала , установленного на светофильтров, вводится лазерный луч на образец через высокой числовой апертурой (NA) линзы объектива (например, Н. А. 1,3, увеличение в 100 раз, масло погружения).
- Приложить объективный нагреватель для объектива и установить температуру до 30 ° С.
- Монтаж стенда на предметный столик инверсионного микроскопа
- Отбросьте одну каплю иммерсионного масла на объектив и крепление образца на состояние микроскопа.
- Убедитесь, что толщина образца приблизительно 10 мкм получают путем проверки осевого положения нижней и верхней поверхности образца.
- Отрегулируйте фокусировку микроскопа до нескольких микрометров выше нижней поверхности образца.
- Получить циркулярно поляризованный свет возбуждения под объективом
- Вставьте поляризатор в коллимированный лазерный луч из объектива.
- Записывают интенсивности лазерного пучка, прошедшего через поляризатор, вставив измеритель мощности после поляризатора. Записывают, передаваемую мощность лазера под разными углами поляризации при вращении поляризатора.
- Если переданная мощность лазера не постоянна на всех углах поляризации, слегка вращать пластину четверти волны или Berek компенсатор, вставленный в пути пучка возбуждения.
- Повторите шаг 3.2.5.2 и 3.2.5.3 до постоянной передаваемой мощности лазера получается при всех углах поляризации. Убедитесь в том, что циркулярно поляризованный свет получается на образце.
- Установка ЭМ (электронного умножителя) отрицательный заряд связью (ПЗС) камеры
- Установите камеру EM-CCD с боковой порт микроскопа и подключить его к тон программное обеспечение захвата изображений.
- При необходимости синхронизации экспозиции камеры с механическим затвором или акустооптического перестраиваемого фильтра, вставленного в пути луча возбуждения, послав транзисторно-транзисторной логики (TTL) сигналы, генерируемые EM-CCD камеры к устройствам. В качестве альтернативы, синхронизировать экспозицию камеры на выходе лазера, посылая сигналы TTL, генерируемых ЭМ-ПЗС-камеры лазера.
Примечание: Последний вариант применим только тогда, когда твердотельный лазер, выходная мощность может быть модулируется входным транзисторно-транзисторной логики сигналы (TTL) используется для эксперимента. - Нанести усиление ЭМ (как правило, приблизительно 300) к ПЗС-камеры с помощью программного обеспечения управления камерой, чтобы получить флуоресцентного высокого качества изображения одного флуорофора.
- Установить область интереса (ROI) (как правило, 128 х 128 пикселей в центре поля зрения) с использованием программного обеспечения управления камерой.
Примечание: Это позволяет томографовнг эксперименты на частоты кадров 100 - 200 Гц в режиме передачи кадров, который необходим для визуализации движения Флуорофор внедренной полимерных цепей в образце расплава.
- Внедрение лазера возбуждения (488 нм) в задний порт инверсионного микроскопа
- Запуск эксперимента
- Оптимизация условий эксперимента
- Настройка области освещения образца до приблизительно 20 мкм в диаметре, используя диафрагму, вставленный в пути пучка возбуждения.
- Установка лазерного возбуждения мощности на образце до 4 - 8 мВт вручную, выбирая соответствующую нейтральной плотности (ND) фильтр, вставленный в пути пучка возбуждения.
Примечание: Это обеспечивает среднюю мощность лазера 1 - 2 кВт · см -2 в образце. - Запись флуоресцентные изображения образца при частоте кадров 100 - 200 Гц. Если интенсивность флуоресценции получены из отдельных флуорофором включены полимеров является слишком низкой, постепенно увеличивать мощность возбуждения с использованием юе ND фильтр до достижения примерно 100 мВт на образце.
- Если качество флуоресцентного изображения одной молекулы до сих пор не является удовлетворительным, проверьте примеси флуоресценции в образце путем регистрации флуоресценции изображения чистого расплава немеченого поли (ТГФ). В случае наблюдается высокий уровень фона флуоресценции, используют различные немеченого поли (ТГФ).
- Если плотность пятна флуоресценции, полученной из Флуорофор внедренной полимеров в расплаве слишком велико, чтобы пространственно изолировать их (это приводит к ошибкам в анализе диффузионного движения), снижение концентрации флуорофора внедренной полимеров в образце до пространственно наблюдаются единичные пятна.
- Если плотность пятна флуоресценции, полученной из Флуорофор внедренной полимеров в расплаве слишком низкое (это приводит к низкой пропускной способности эксперимента изображений), не увеличивают концентрацию Флуорофор внедренной полимеров в образце до достижения approprIate плотность пятна флуоресценции достигается.
- Если Флуоресцентные изображения, полученные из Флуорофор внедренной полимеров в расплаве размыты, увеличивают частоту кадров приобретения изображений.
ПРИМЕЧАНИЕ: Это часто требует меньшего ROI, как правило, 64 х 64 пикселей.
- Оптимизация условий эксперимента
- получение изображений
- После того, как условия эксперимента оптимизированы, оставьте установленный образец на предметный столик микроскопа в течение часа таким образом, что образец достигает условий равновесия.
- Запись 500 - 1000 последовательности флуоресцентного изображения флуорофора внедренной полимеров в расплавленном состоянии при 100 - 200 Гц частотой кадров. Если формат файла по умолчанию не TIFF, конвертировать все последовательности изображений в формате TIFF.
4. Анализ диффузионного движения
- Среднеквадратичное смещение (MSD) анализ
- Обрезка последовательности флуоресцентного изображения таким образом,что каждая последовательность изображений содержит одну и целенаправленный рассеивающий флуорофора внедренной полимера с использованием программного обеспечения для обработки изображений, например ImageJ.
- Когда вырезанный последовательности изображений содержат более 10 кадров, разделить последовательности изображений на множество последовательностей таким образом, что каждая последовательность состоит из 10 кадров.
- Определить положение молекул в каждой последовательности изображений точно двумерной гауссовой подгонки изображений.
- Определить коэффициент диффузии (D) отдельных молекул среднеквадратичного смещения (MSD) анализ диффузионных траекторий (т.е. зависящих от времени положениях молекулы) , используя уравнение 20
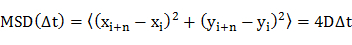
где х я и у меня есть позиции молекулы в изображении кадра I, а п обозначает номер кадра с промежутком времени & Delta ; t от кадра I. - Участок коэффициентов диффузии вчастота гистограммы.
Примечание: Как правило, гистограмма строится из более чем 100 молекул.
- Интегральная функция распределения (CDF) анализ
ПРИМЕЧАНИЕ: CDF, Р (г 2, я Δ T) соответствует кумулятивной вероятности нахождения диффундирующих молекул в пределах радиуса г от начала координат по истечении определенного времени запаздывания я Д т.- Вычислить квадратным смещение во время встречающийся отстает от 1Δt, 2Δt, ···, iΔt для всех диффузионных траекторий, полученных в п.4.1.3.
Примечание: Эти расчеты дают общую м я квадратным перемещений на некоторое время отстает от iΔt. - Расчет чисел квадратным смещений (L I) в пределах общего набора данных м я, которые меньше , чем R 2 при различных значениях г 2 (0 я против г 2 участки соответствуют CDF, P (R 2, iΔt).
- Вычислить квадратным смещение во время встречающийся отстает от 1Δt, 2Δt, ···, iΔt для всех диффузионных траекторий, полученных в п.4.1.3.
- Анализ CDFs с различными моделями диффузии
Примечание: Полученные CDFs обтянуты различных моделей диффузии; однородная модель диффузии, несколько режимов диффузии , в которых распределение D описывается гауссовым (одной гауссовой модели), а также несколько режимов диффузии , в которых распределение D описывается множественной Gaussian (множественный гауссова модель).- В однородной модели диффузии, определяют средний D путем установки CDF с помощью уравнения 21
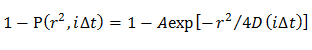
ПРИМЕЧАНИЕ: Любое отклонение от уравнения означает гетерогенную диффузии молекулы. - В одной гауссовой модели, определяют распределение вероятностей D описывается гауссовым (F (D)) путем подгонки CDF с использованием 15
on3 "SRC =" / файлы / ftp_upload / 54503 / 54503equation3.jpg "/>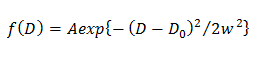
где A, W, и D 0 являются амплитуда, ширина, и центром гауссовой. - В двойной гауссовой модели, определяют распределение вероятностей J - й компонент D описывается гауссовым (F (D)) путем установки CDF с помощью 14
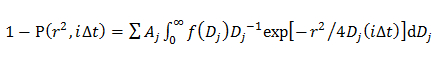

где А J представляет собой долю каждого компонента диффузионной и α мкВт дж и D 0 J являются амплитуда, ширина, и центром J - й компонент гауссовой.
- В однородной модели диффузии, определяют средний D путем установки CDF с помощью уравнения 21
- Расчет теоретической вероятности DISTRIпределение коэффициента диффузии
Примечание: распределения вероятности D , происходящих из - за статистических ошибок (р (D) d D) рассчитываются для различных моделей диффузии; однородная модель диффузии, несколько режимов диффузии , в которых распределение D описывается гауссовым (одной гауссовой модели), а также несколько режимов диффузии , в которых распределение D описывается множественной Gaussian (множественный гауссова модель).- В однородной модели диффузии вычислить статистическое распределение вероятностей D с помощью уравнения 22
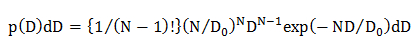
где N есть число точек данных в диффузионной траектории (N = 10 см 4.1.2), D 0 средний коэффициент диффузии (определяется анализом КОР, см 4.2.3.1) и D является экспериментальным путем коэффициент диффузии для индивидуальной траектории. - вединая гауссова модель диффузии, вычислить статистическое распределение вероятностей D с помощью уравнения 15

где F (D) обозначает распределение вероятностей D определяется с помощью анализа КОР (см 4.2.3.2) и D 0 средний коэффициент диффузии (определяется анализом КОР, см 4.2.3.2). - В двойной гауссовой модели диффузии, вычислить статистическое распределение вероятностей D с помощью уравнения 14

где F (D J) обозначает распределение вероятностей J - го компонента D (D) J определяется анализом КОР (см 4.2.3.3) и D 0j является средний коэффициент диффузии J - го компонента (определяется CDF анализ см 4.2.3.3).
- В однородной модели диффузии вычислить статистическое распределение вероятностей D с помощью уравнения 22
Результаты
Периленовой диимид внедренной 4-вооруженную звезду и 8-образную форму двухцикличный поли (ТГФ) s были синтезированы с использованием электростатического самосборки и ковалентной фиксации (ESA-CF) процесса (Рисунок 1, Рисунок 2). В заданный промежуток вре?...
Обсуждение
В 4- х вооруженных и 8-образные полимеры получают по протоколу ESA-CF (Рисунок 1), что является важным шагом для синтеза. 12,24 Монофункциональное и бифункциональный линейный поли (ТГФ) s с N -phenylpiperidinium концевыми группами были синтезировали в соответствии с предыдущей процед?...
Раскрытие информации
The authors have nothing to disclose.
Благодарности
This work was supported by a Grant-in-Aid for Scientific Research No. 22750122 (S.H.), No. 26288099 (T.Y.), and No. 23350050 (Y.T.) of the Japan Society for the Promotion of Science. S.H. is grateful for The Kurata Memorial Hitachi Science and Technology Foundation. The research reported in this publication was supported by the King Abdullah University of Science and Technology (S.H.).
Материалы
| Name | Company | Catalog Number | Comments |
| Materials | |||
| THF | Godo | ||
| Wakosil C-300 | Wako Pure Chemical Industries | ||
| Acetone | Godo | ||
| Toluene | Godo | ||
| n-Hexane | Godo | ||
| CHCl3 | Kanto Chemical | ||
| Bio-Beads S-X1 | Bio-Rad | ||
| Methyl triflate | Nacalai Tesque | ||
| Triflic anhydride | Nacalai Tesque | ||
| Potassium Hydroxide | Wako Pure Chemical Industries | ||
| Ethanol | Wako Pure Chemical Industries | ||
| Poly(tetrahydrofuran) | Aldrich | ||
| Chloroform | Wako Pure Chemical Industries | ||
| Immersion oil | Cargille | Type 37 / Type A | |
| Equipment | |||
| 2-Neck 100-ml round-bottom flask | |||
| Flask | |||
| Beaker | |||
| Funnel | |||
| Filter paper | Whatman | ||
| Reflux condenser | |||
| Syringe | |||
| Water bath | |||
| Magnetic stirrer | |||
| Rotary evaporator | |||
| Microscope cover slips (24 x 24 mm, No. 1) | Matsunami Glass | CO22241 | |
| Staining jar | AS ONE Corporation | 1-7934-01 | |
| Ultrasonic cleaner | VWR International | 142-0047 | |
| Inverted microscope | Olympus | IX71 | |
| Ar-Kr ion laser | Coherent | Innova 70C | |
| Berek compensator | Newport | 5540 | |
| Excitation filter | Semrock | LL01-488-12.5 | |
| Dichloric mirror | Omega optical | 500DRLP | |
| Emission filter | Semrock | BLP01-488R-25 | |
| Lens and mirror | Thorlabs | ||
| EM-CCD camera | Andor Technology | iXon | |
| Objective lens (100X, N.A. = 1.3) | Olympus | UPLFLN 100XOP | |
| Objective heater | Bioptechs | ||
| Preparative GPC | Japan Analytical Industry | LC-908 |
Ссылки
- Honda, S., Yamamoto, T., Tezuka, Y. Topology-Directed Control on Thermal Stability: Micelles Formed from Linear and Cyclized Amphiphilic Block Copolymers. J. Am. Chem. Soc. 132 (30), 10251-10253 (2010).
- Honda, S., Yamamoto, T., Tezuka, Y. Tuneable enhancement of the salt and thermal stability of polymeric micelles by cyclized amphiphiles. Nat. Commun. 4, (2013).
- Jun, S., Mulder, B. Entropy-driven spatial organization of highly confined polymers: Lessons for the bacterial chromosome. Proc. Natl. Acad. Sci. U. S. A. 103 (33), 12388-12393 (2006).
- McLeish, T. Polymers without beginning or end. Science. 297 (5589), 2005-2006 (2002).
- McLeish, T. Polymer dynamics: Floored by the rings. Nat. Mater. 7 (12), 933-935 (2008).
- Roovers, J., Tezuka, Y. . Topological Polymer Chemistry: Progress of Cyclic Polymers in Syntheses, Properties and Functions. , 137-156 (2013).
- Klein, J. Evidence for reptation in an entangled polymer melt. Nature. 271 (5641), 143-145 (1978).
- Leger, L., Hervet, H., Rondelez, F. Reptation in entangled polymer-solutions by forced rayleigh light-scattering. Macromolecules. 14 (6), 1732-1738 (1981).
- von Meerwall, E. D., Amis, E. J., Ferry, J. D. Self-diffusion in solutions of polystyrene in tetrahydrofuran - comparison of concentration dependences of the diffusion-coefficients of polymers, and a ternary probe component. Macromolecules. 18 (2), 260-266 (1985).
- Kapnistos, M., et al. Unexpected power-law stress relaxation of entangled ring polymers. Nat. Mater. 7 (12), 997-1002 (2008).
- Adachi, K., Takasugi, H., Tezuka, Y. Telechelics having unstrained cyclic ammonium salt groups for electrostatic polymer self-assembly and ring-emitting covalent fixation. Macromolecules. 39 (17), 5585-5588 (2006).
- Oike, H., Imaizumi, H., Mouri, T., Yoshioka, Y., Uchibori, A., Tezuka, Y. Designing unusual polymer topologies by electrostatic self-assembly and covalent fixation. J. Am. Chem. Soc. 122 (40), 9592-9599 (2000).
- Yamamoto, T., Tezuka, Y. Topological polymer chemistry: a cyclic approach toward novel polymer properties and functions. Polym. Chem. 2 (9), 1930-1941 (2011).
- Habuchi, S., Fujiwara, S., Yamamoto, T., Tezuka, Y. Single-molecule imaging reveals topological isomer-dependent diffusion by 4-armed star and dicyclic 8-shaped polymers. Polym. Chem. 6 (22), 4109-4115 (2015).
- Habuchi, S., Fujiwara, S., Yamamoto, T., Vacha, M., Tezuka, Y. Single-Molecule Study on Polymer Diffusion in a Melt State: Effect of Chain Topology. Anal. Chem. 85 (15), 7369-7376 (2013).
- Habuchi, S., Satoh, N., Yamamoto, T., Tezuka, Y., Vacha, M. Multimode Diffusion of Ring Polymer Molecules Revealed by a Single-Molecule Study. Angew. Chem. Int. Ed. 49 (8), 1418-1421 (2010).
- Habuchi, S., Tezuka, Y. . Topological Polymer Chemistry: Progress of Cyclic Polymers in Syntheses, Properties and Functions. , 265-290 (2013).
- Fernandez, P., Bayona, J. M. Use of off-line gel-remeation chromatography normal-phase liquid-chromatography fro the determination of polycyclic aromatic-compounds in environmental-samples and standard reference materials (air particulate matter and marine sediment). J. Chromatogr. 625 (2), 141-149 (1992).
- Biesenberger, J. A., Tan, M., Duvdevan, I., Maurer, T. Recycle gel permeation chromatography. 1. recycle principle and design. J. Polym. Sci. Pol. Lett. 9 (5), 353 (1971).
- Kusumi, A., Sako, Y., Yamamoto, M. Confined lateral diffusion of membrane-receptors as studied by single-particle tracking (nanovid microscopy) - effects of calcium-induced differentiation in cultured epithelial-cells. Biophys. J. 65 (5), 2021-2040 (1993).
- Schutz, G. J., Schindler, H., Schmidt, T. Single-molecule microscopy on model membranes reveals anomalous diffusion. Biophys. J. 73 (2), 1073-1080 (1997).
- Vrljic, M., Nishimura, S. Y., Brasselet, S., Moerner, W. E., McConnell, H. M. Translational diffusion of individual class II MHC membrane proteins in cells. Biophys. J. 83 (5), 2681-2692 (2002).
- Margineanu, A., et al. Photophysics of a water-soluble rylene dye: Comparison with other fluorescent molecules for biological applications. J. Phys. Chem. B. 108 (32), 12242-12251 (2004).
- Tezuka, Y., Oike, H. Self-assembly and covalent fixation for topological polymer chemistry. Macromol. Rapid Commun. 22 (13), 1017-1029 (2001).
- Deres, A., et al. The Origin of Heterogeneity of Polymer Dynamics near the Glass Temperature As Probed by Defocused Imaging. Macromolecules. 44 (24), 9703-9709 (2011).
- Flier, B. M. I., et al. Heterogeneous Diffusion in Thin Polymer Films As Observed by High-Temperature Single-Molecule Fluorescence Microscopy. J. Am. Chem. Soc. 134 (1), 480-488 (2012).
- Habuchi, S., Oba, T., Vacha, M. Multi-beam single-molecule defocused fluorescence imaging reveals local anisotropic nature of polymer thin films. Phys. Chem. Chem. Phys. 13 (15), 6970-6976 (2011).
- Zettl, U., et al. Self-Diffusion and Cooperative Diffusion in Semidilute Polymer Solutions As Measured by Fluorescence Correlation Spectroscopy. Macromolecules. 42 (24), 9537-9547 (2009).
- Kirstein, J., Platschek, B., Jung, C., Brown, R., Bein, T., Brauchle, C. Exploration of nanostructured channel systems with single-molecule probes. Nat. Mater. 6 (4), 303-310 (2007).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены