Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Капиллярный электрофорез Контролировать Peptide прививкой на хитозана пленок в режиме реального времени
В этой статье
Резюме
Free solution capillary electrophoresis is a fast, cheap and robust analytical method that enables the quantitative monitoring of chemical reactions in real time. Its utility for rapid, convenient and precise analysis is demonstrated here through analysis of covalent peptide grafting onto chitosan films for improved cell adhesion.
Аннотация
Свободное решение капиллярный электрофорез (CE) отделяет аналитов, как правило, заряженные соединения в растворе за счет применения электрического поля. По сравнению с другими аналитическими методами разделения, такими как хроматография, CE является дешевым, надежным и эффективным не требует подготовки образца (для ряда сложных природных матриц или полимерных образцов). CE быстро и может быть использован , чтобы следить за эволюцией смесей в реальном времени (например, кинетика химического реакции), а сигналы , наблюдаемые для отделенных соединений прямо пропорциональны их количеству в растворе.
При этом эффективность CE продемонстрирована для мониторинга ковалентной прививание пептидов на хитозана пленок для последующих биомедицинских применений. противомикробные и биосовместимые свойства хитозана делают его привлекательным материалом для биомедицинских применений, таких как субстратов для роста клеток. Ковалентно прививкой пептидные Rgds (аргинин - глицин -аспарагиновая кислота - серин) на поверхность хитозана пленок направлена на улучшение прикрепление клеток. Исторически сложилось так, хроматография и аминокислотного анализа были использованы для обеспечения непосредственного измерения количества привитого пептида. Тем не менее, быстрое разделение и отсутствие подготовки образцов, представленной CE позволяет осуществлять мониторинг равноточными еще в режиме реального времени процесса шунтирования пептида. СЕ способен отделить и количественно определить различные компоненты реакционной смесь: (непривитого) пептида, так и химических связующие агенты. Таким образом, использование СЕ приводит к улучшению пленок для последующих применений.
Хитозана пленки были охарактеризованы с помощью твердотельного ЯМР (ядерно-магнитный резонанс) спектроскопии. Эта техника более отнимает много времени и не могут быть применены в реальном масштабе времени, но дает прямое измерение пептида и, таким образом, подтверждает технику CE.
Введение
Бесплатное решение капиллярного электрофореза (CE) представляет собой метод , который отделяет соединений в растворах на основе их заряда к трению отношением 1,2. Отношение заряда к размеру часто упоминается в литературе, но это упрощение не относится к полиэлектролитов, в том числе полипептидов в этой работе, а также было показано , чтобы не подходить для небольших органических молекул 3. СЕ отличается от других методов разделения, в том, что она не имеющих стационарной фазы, только фоновый электролит (обычно буфер). Это позволяет технику быть устойчивой в своей способности анализировать широкий спектр образцов со сложными матрицами 4 , таких как растительные волокна 5, брожения варит 6 прививаемых на синтетических полимеров 7, образцы пищи 8, и практически не растворимые пептиды 9 без утомительной подготовки образцов и очистки. Это особенно важно для сложных полиэлектролитов, которые имеют проблемы растворения (ыUCH как хитозан 10 и геллановой камеди 11) и , следовательно , существуют в виде агрегированных или осаждают в растворе и успешно проанализированы без фильтрации проб. Кроме того, анализ сахара в сухих завтраках участвует инъекционного образцов с частицами образцов злаковых завтрака осаждают в воде 8. Это также распространяется на анализ разветвленных полиэлектролитов или сополимеров 12,13. Обширная работа также была завершена в разработке методов CE специально для анализа белков для протеомики 14 хирального разделения природных или синтетических пептидов 15 и микрочипов разделений белков и пептидов 16. Поскольку разделение и анализ происходят в капилляр, только небольшие объемы пробы и растворители используют , что позволяет CE иметь более низкую стоимость , чем другие бега методами разделения , в том числе хроматографии 5,6,17. Поскольку разделение с помощью CE быстро, это позволяет Monitoкольцо кинетики реакции. Это было продемонстрировано в случае прививкой пептидов на хитозана пленок для улучшения адгезии 18 клеток.
Хитозан представляет собой полисахарид , полученный из N -deacetylation хитина. Хитозан пленки могут быть использованы для различных биомедицинских применений , таких , как Биоадгезивы 19 и субстратов для роста клеток 18,20, вследствие биосовместимости хитозаном в 21. Прикрепление клеток к специфическим белкам внеклеточного матрикса, таких как фибронектин, коллагены и ламинин, напрямую связана с выживанием клеток 22. Следует отметить, что различные типы клеток, часто требуют прикрепление к различным белкам внеклеточного матрикса для выживания и нормальной работы. Прикрепление клеток к хитозана пленок было показано, повышена за счет прививке фибронектина 23; Тем не менее, подготовка, очистка и прививка таких больших белков не является экономически жизнеспособным. В качестве альтернативы ряд небольших пептидов ВГАе было показано, чтобы иметь возможность имитировать свойства больших белков внеклеточного матрикса. Например, пептиды , такие как фибронектин миметики RGD (аргинин - глицин - аспарагиновая кислота) и RGDS (аргинин - глицин - аспарагиновая кислота - серин), были использованы для облегчения и увеличения прикрепление 24 изолята. Ковалентная прививка RGDS на хитозана пленок приводит к улучшению прикрепление клеток для клеток , известных прикрепиться к фибронектина в естественных условиях 18. Подставив более крупные белки любит фибронектин с меньшими пептидами, которые имеют ту же функциональность обеспечивает значительное снижение затрат.
Здесь пептид прививкой к хитозана проводили , как ранее опубликованную 18. Как было показано ранее, этот подход обеспечивает простую и эффективную прививка с использованием сочетающих агентов EDC-HCl (1-этил-3- (3-диметиламинопропил) карбодиимида) и НГС (N -hydroxysuccinimide) для функционализации карбоновой кислоты RGDS быть привитыхитозан фильм. Два преимущества этого метода является то, что прививка не требует какой - либо модификации хитозана или пептида, и оно осуществляется в водной среде , чтобы максимизировать совместимость с будущими приложениями для культивирования клеток 18,20. Как можно заряжать сочетающие агенты и пептид, СЕ является подходящим методом для анализа кинетики реакции. Важно отметить, что анализ кинетики реакции через CE позволяет осуществлять мониторинг в режиме реального времени реакции прививки, и, таким образом, позволяет одновременно оптимизировать и количественной оценки степени прививки.
В то время как это обычно не нужно, результаты анализа CE могут быть проверены в автономном режиме с помощью прямого измерения пептида прививкой на хитозана пленок с использованием твердотельного ЯМР (ядерный магнитный резонанс) спектроскопии 25,26 , чтобы продемонстрировать ковалентной прививание пептида на пленку 18. Тем не менее, по сравнению с твердотельной ЯМР-спектроскопии, в реальном масштабе времени анализ, представленныйCE позволяет количественно оценить потребление пептида в реальном времени и, таким образом, способность оценивать кинетику реакции.
Вышеупомянутый способ прост и позволяет проводить анализ в режиме реального времени пептида прививки на хитозана пленок с непрямым квантификации степени прививки. Продемонстрированный метод может быть расширен, чтобы в реальном масштабе времени количественной оценки различных химических реакций, как долго, как реагентов или продуктов для анализа могут быть заряжены.
протокол
1. Получение хитозана пленок
- Взвешивают 2 г ледяной уксусной кислоты, полный до 100 мл сверхчистой воды.
- Отвешивают 1,7 г хитозана порошка, добавляют 100 мл 2% м / м уксусной кислоты водного раствора. Смесь перемешивают в течение 5 дней с мешалкой и магнитной мешалки при комнатной температуре либо покрытой алюминиевой фольгой или в темноте.
- Центрифуга хитозана дисперсии при 1076 х г при 23 ° С в течение 1 часа. Собирают супернатант с помощью шприца и удалите осадок.
- Для каждого фильма, аликвоты 10 мл хитозана суспензии в 9 см пластиковой чашке Петри при комнатной температуре. Оставьте фильмы, покрытые высохнуть в течение не менее 7 дней.
- С помощью ножниц вырезать сухие пленки в 1 х 1 см квадратов. Примечание: Эксперимент может быть приостановлена на данном этапе.
2. Подготовка фосфатно-буферном солевом растворе (ФБР)
- Взвесить 8 г хлорида натрия, 0,2 г хлорида калия, 1,44 г фос динатрия водородаФейт и 0,24 г дигидрофосфата калия.
- Растворите эти химикаты отвешивают в 800 мл сверхчистой воды и титруют раствор концентрированной соляной кислотой до рН 7,4.
Примечание: Эксперимент может быть приостановлена на данном этапе.
3. Приготовление 75 мМ бората натрия с буфером при рН 9,2
- Взвесить 3.0915 г борной кислоты. Растворите его в 75 мл сверхчистой воды.
- Титрование раствора борной кислоты до рН 9,2 с помощью раствора гидроксида натрия в концентрации 10 мкМ или выше.
Внимание: концентрированные растворы гидроксида натрия являются коррозионными и должны работать в перчатках. - В комплекте с сверхчистой водой, чтобы получить 100 мл раствора. Это дает 500 мМ бората натрия буфера при рН 9,2.
- Развести 500 мМ бората натрия буфера с сверхчистой водой до 75 мМ буфера бората натрия. Примечание: Эксперимент может быть приостановлена на данном этапе.
4. Получение хитозана Fiдля LMS реакции привитой сополимеризации
- Полоскание 10 квадратных хитозана пленок (1 х 1 см) в 5 мл PBS в течение 2 ч в чашке Петри при комнатной температуре.
- За это время подготовить и утвердить капиллярный электрофорез инструмента (этап 5).
5. Подготовка и проверка на капиллярный электрофорез Инструмента
- Приготовьте 43,5 см голую кварцевую капиллярную с внутренним диаметром 50 мкм (43,5 см является общая длина, эффективная длина для окна обнаружения, как правило, 35 см) путем ослабления полимера наружное покрытие из капилляра на заданной длине с тупые утвари затем щелкать капилляр.
- Создать окно для капилляра с помощью зажигалки для сжигания полимерного покрытия на 8,5 см от входа и после того, как он остынет протрите его с этанолом. Ожог покрытие капилляра на каждом конце в течение нескольких миллиметров с зажигалкой, и после того, как он остынет протрите его с этанолом.
- Место капиллярная ИНСИде окна обнаружения и установить его в капиллярной кассете, поместив его на равных длинах в входе и выходе и наматывая его шпинделей кассеты. Затем установите кассету в капиллярный электрофорез инструмента.
- Установка параметров для каждого метода разделения. В программном меню выберите пункт "метод", затем "редактировать весь метод". Установите температуру, время, напряжение и чаш, используемые для разделения (например, 25 ° C, 10 мин, 30 кВ).
- В разделе предобуславливание установите последовательные притоки: 10 мин с помощью 1 М гидроксида натрия (в воде), 5 мин с помощью 0,1 М гидроксида натрия (в воде), 5 мин сверхчистой водой и 5 мин с 75 мМ буфера бората натрия при рН 9,2 в течение первого способа серии анализов.
- Для последующих методов, установить набор последовательные притоки в секции предварительного кондиционирования: 1 мин с помощью 1 М гидроксида натрия (в воде), 5 мин с 75 мМ буфера бората натрия при рН 9.2.
- В разделе впрыска, установить параметры для гидродинамической инъекции с давлением 30 мбар в течение 10 сек для всех методов. В секции разделения, устанавливают условия разделения до 30 кВ при 25 ° С в течение 9 мин для всех методов.
Примечание: Обратитесь к руководству пользователя конкретного инструмента CE в качестве процедуры для работы с прибором CE может отличаться у разных производителей. Готовят раствор гидроксида натрия 1 М в день.
- Вводить и отделить нейтральный внутренний стандарт (10 мкл 10% об / об диметилсульфоксид (ДМСО), в водном растворе в 450 мкл 75 мМ буфера бората натрия). Затем вводят и разделить таким же образом стандарт oligoacrylate (растворенного в сверхчистой воде при 10 г ∙ л -1, см Перечень материалов) , чтобы проверить правильность капилляра. Пауза последовательность здесь, пока реакция прививка не готов к запуску.
6. Прививка RGDS на Хитозан Film
- Взвесить пептида (1 мг УВАЖЕНИЕМ)и соединительные средства (3 мг EDC-HCl и 2 мг NHS).
- 2 ч после начала хитозана замачивания пленки в PBS, растворить пептид и сочетающих агентов в 5 мл PBS.
- Возьмите 50 мкл аликвоты этого раствора. Добавляют 2 мкл 10% об / об ДМСО в воде в качестве внутреннего стандарта нейтрального в аликвоту. Анализ аликвоты с CE (см шаг 7).
- Удалите 5 мл PBS использовали для промывки хитозана пленок из чашки Петри. Добавляют 5 мл раствора пептида и связывающих агентов в чашку Петри, содержащую хитозана пленок.
- Накройте чашку Петри с парафиновой пленкой и поместить его на орбитальном шейкере при комнатной температуре. Принимать по 50 мкл аликвоты реакционной среды в установленное время.
Примечание: Общее время анализа с CE составляет 15 мин, при этом аликвота можно принимать каждые 15 мин (или каждые 30 мин , если две реакции отслеживаются параллельно, и т.д.).- Добавляют 2 мкл 10% об / об ДМСО в воде в качестве внутреннего стандарта нейтрального к каждому Aliquot.
Примечание: аликвоты должны быть проанализированы с CE, как только они будут приняты (этап 7).
- Добавляют 2 мкл 10% об / об ДМСО в воде в качестве внутреннего стандарта нейтрального к каждому Aliquot.
- Через 4 часа тряски и удаления аликвоты, удалите чашку Петри из шейкера. Удалите реакционную среду из чашки Петри. Добавьте 5 мл PBS для промывания хитозана пленок.
- Удалите PBS из чашки Петри, промойте хитозана пленку с сверхчистой водой и дайте им высохнуть в течение ночи. Удалите сверхчистой воды и хранить пленки при -20 ° С в пластиковом Петри.
7. Мониторинг прививкой реакции с использованием CE
- Вдохнуть и отдельные аликвоты реакционной среды немедленно после извлечения из чашки Петри, используя условия анализа, как и в разделе 5.2.
- После завершения разделений промыть капилляр сверхчистой водой в течение 10 мин. Сушат ее через вровень с пустой флакон (воздух) в течение 10 мин.
Примечание: Эксперимент может быть приостановлена на данном этапе.
8. Треа данных tment для CE
- Проверьте правильность каждого разделения, проверяя, что и ток во время разделения и время миграции электроосмотического маркера подвижности (ДМСО в данном случае) сходны с теми, которые использовались дл стандартного разделения oligoacrylate.
Примечание: до 10-15% вариации приемлемо от ожидаемого значения тока около 50 мкА и миграции временной стоимости 1,3 мин (электрофоретические значения подвижности следует использовать вместо того, чтобы время миграции, если требуется более высокая повторяемость). - Для каждого успешного разделения, экспортировать необработанные данные из электрофорез программного обеспечения капиллярного путем выбора определенного набора данных, щелкнув правой кнопкой мыши на экспорт и выбрав соответствующий сигнал.
- Преобразование исходных данных, записанных с помощью CE (представлены в виде УФ-поглощения в зависимости от времени миграции). Преобразование X-ось (временная миграция т м) в электрофоретической подвижности ц следующим уравнением 1:
п 1 "SRC =" / файлы / ftp_upload / 54549 / 54549eq1.jpg "/> (1)
где L D длина до детектора, L T является общая длина капилляра, V является напряжение, и т EO время миграции нейтрального монете (внутренний стандарт ДМСО в данном случае) 27.
Преобразование Y-ось необработанных данных (поглощение в а.е.) к распределению электрофоретических подвижностей W (i) следующим уравнением 2: 28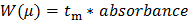 (2)
(2)
9. Дополнительная характеристика пептидных привитым пленок 18
- Вставьте пептидные привитым хитозана пленок, свернутые вокруг себя, в 4 мм твердотельного ЯМР ротора. Наполните ротор с фосфатным буферным солевым раствором для набухания пленок, и закройте ротор. Подождите несколько часов.
- Анализ фильма с 13 </ SUP> С ЯМР - спектроскопии 18.
Результаты
CE хорошо подходит для мониторинга прививка пептидов (например, УВАЖЕНИЕМ) на хитозана пленок. Подходящие связующие агенты включают в себя EDC-HCl и НГС , которые активируют пептидом привит на хитозана (рисунок 1). СЕ способен отделить различные молекулы, пред...
Обсуждение
Простота протокола, описанного здесь, делает его идеально подходит для широкого применения. Тем не менее, особое внимание должно быть обращено на следующие основные шаги.
Подготовка Правильное CE инструмент
Важно отделить известный стандарт неп...
Раскрытие информации
Авторы заявляют, что у них нет конкурирующих финансовых интересов.
Благодарности
MG, MO'C and PC thank the Molecular Medicine Research Group at WSU for Research Seed Funding, as well as Michele Mason (WSU), Richard Wuhrer (Advanced Materials Characterisation Facility, AMCF, WSU) and Hervé Cottet (Montpellier) for discussions.
Материалы
| Name | Company | Catalog Number | Comments |
| Water | Millipore | All water used in the experiment has to be of Milli-Q quality | |
| Chitosan powder (medium molecular weight) | Sigma-Aldrich | 448877 | lot MKBH1108V was used. Significant batch-to-batch variations occur with natural products such as polysaccharides |
| Acetic acid - Unilab | Ajax Finechem | 2-2.5L GL | laboratory reagent |
| Dimethylsulfoxide | Sigma-Aldrich | D4540 | laboratory reagent, slightly hazardous to skin, hazardous if ingested |
| Sodium hydroxide | Sigma-Aldrich | 221465 | laboratory reagent, corrosive |
| 1-ethyl-3-(3-dimethylaminopropyl)carbodiimide | Sigma-Aldrich | D80002 | Irritant to skin |
| N-hydroxysuccinimide | Sigma-Aldrich | 130672 | Irritant to skin |
| Sodium chloride | Ajax Finechem | 466-500G | laboratory reagent |
| Potassium chloride - Univar | Ajax Finechem | 384-500G | analytical reagent, slight skin irritant |
| Disodium hydrogen phosphate - Unilab | Ajax Finechem | 1234-500G | laboratory reagent, slight skin irritant |
| Potassium dihydrogen phosphate - Univar | Ajax Finechem | 4745-500G | analytical reagent, slight skin irritant |
| Oligoacrylate standard | custom made | See reference for synthetic protocol: Castignolles, P.; Gaborieau, M.; Hilder, E. F.; Sprong, E.; Ferguson, C. J.; Gilbert, R. G. Macromol. Rapid Commun. 2006, 27, 42-46 | |
| Boric acid | BDH AnalR, Merck Pty Ltd | 10058 | Corrosive |
| Hydrochloric acid - Unilab | Ajax Finechem | A1367-2.5L | laboratory reagent, corrosivie |
| Fused silica tubing | Polymicro (Molex) | TSP050375 | Flexible fused silica capillary tubing with standard polyimide coating, 50 µm internal diameter, 363 µm outer diameter |
| Agilent 7100 CE | Agilent Technologies | G7100CE | Capillary electrophoresis instrument |
| Orbital shaker | IKA | KS260 | |
| Electronic balance | Mettler Toledo | MS204S | |
| Milli-Q Synthesis | Millipore | ZMQS5VF01 | Ultrapure water filtration system |
| Parafilm | Labtek | PM966 | Parrafin wax |
Ссылки
- Muthukumar, M. Theory of electrophoretic mobility of a polyelectrolyte in semidilute solutions of neutral polymers. Electrophoresis. 17, 1167-1172 (1996).
- Barrat, J. L., Joanny, J. F. . in Advances in Chemical Physics, Vol Xciv Vol. 94 Advances in Chemical Physics. , 1-66 (1996).
- Fu, S. L., Lucy, C. A. Prediction of electrophoretic mobilities. 1. Monoamines. Anal. Chem. 70, 173-181 (1998).
- Harvey, D. . Modern Analytical Chemistry. , (2000).
- Oliver, J. D., Gaborieau, M., Hilder, E. F., Castignolles, P. Simple and robust determination of monosaccharides in plant fibers in complex mixtures by capillary electrophoresis and high performance liquid chromatography. J. Chromatogr. A. 1291, 179-186 (2013).
- Oliver, J. D., Sutton, A. T., Karu, N., Phillips, M., Markham, J., Peiris, P., Hilder, E. F., Castignolles, P. Simple and robust monitoring of ethanol fermentations by capillary electrophoresis. Biotechnology and Applied Biochemistry. 62, 329-342 (2015).
- Thevarajah, J. J., Sutton, A. T., Maniego, A. R., Whitty, E. G., Harrisson, S., Cottet, H., Castignolles, P., Gaborieau, M. Quantifying the Heterogeneity of Chemical Structures in Complex Charged Polymers through the Dispersity of Their Distributions of Electrophoretic Mobilities or of Compositions. Anal. Chem. 88, 1674-1681 (2016).
- Toutounji, M. R., Van Leeuwen, M. P., Oliver, J. D., Shrestha, A. K., Castignolles, P., Gaborieau, M. Quantification of sugars in breakfast cereals using capillary electrophoresis. Carbohydr. Res. 408, 134-141 (2015).
- Miramon, H., Cavelier, F., Martinez, J., Cottet, H. Highly Resolutive Separations of Hardly Soluble Synthetic Polypeptides by Capillary Electrophoresis. Anal. Chem. 82, 394-399 (2010).
- Mnatsakanyan, M., Thevarajah, J. J., Roi, R. S., Lauto, A., Gaborieau, M., Castignolles, P. Separation of chitosan by degree of acetylation using simple free solution capillary electrophoresis. Anal. Bioanal. Chem. 405, 6873-6877 (2013).
- Taylor, D. L., Ferris, C. J., Maniego, A. R., Castignolles, P., in het Panhuis, M., Gaborieau, M. Characterization of Gellan Gum by Capillary Electrophoresis. Australian Journal of Chemistry. 65, 1156-1164 (2012).
- Thevarajah, J. J., Gaborieau, M., Castignolles, P. Separation and characterization of synthetic polyelectrolytes and polysaccharides with capillary electrophoresis. Adv. Chem. 2014, 798503 (2014).
- Sutton, A. T., Read, E., Maniego, A. R., Thevarajah, J., Marty, J. -. D., Destarac, M., Gaborieau, M., Castignolles, P. Purity of double hydrophilic block copolymers revealed by capillary electrophoresis in the critical conditions. J. Chromatogr. A. 1372, 187-195 (2014).
- Righetti, P. G., Sebastiano, R., Citterio, A. Capillary electrophoresis and isoelectric focusing in peptide and protein analysis. Proteomics. 13, 325-340 (2013).
- Ali, I., Al-Othman, Z. A., Al-Warthan, A., Asnin, L., Chudinov, A. Advances in chiral separations of small peptides by capillary electrophoresis and chromatography. J. Sep. Sci. 37, 2447-2466 (2014).
- Kasicka, V. Recent developments in capillary and microchip electroseparations of peptides (2011-2013). Electrophoresis. 35, 69-95 (2014).
- Taylor, D. L., Thevarajah, J. J., Narayan, D. K., Murphy, P., Mangala, M. M., Lim, S., Wuhrer, R., Lefay, C., O'Connor, M. D., Gaborieau, M., Castignolles, P. Real-time monitoring of peptide grafting onto chitosan films using capillary electrophoresis. Anal. Bioanal. Chem. 407, 2543-2555 (2015).
- Rinaudo, M. Chitin and chitosan: Properties and applications. Prog. Polym. Sci. 31, 603-632 (2006).
- Li, Z., Leung, M., Hopper, R., Ellenbogen, R., Zhang, M. Feeder-free self-renewal of human embryonic stem cells in 3D porous natural polymer scaffolds. Biomaterials. 31, 404-412 (2010).
- Domard, A. A perspective on 30 years research on chitin and chitosan. Carbohydr. Polym. 84, 696-703 (2011).
- Shekaran, A., Garcia, A. J. Nanoscale engineering of extracellular matrix-mimetic bioadhesive surfaces and implants for tissue engineering. Biochim. Biophys. Acta Gen. Subj. 1810, 350-360 (2011).
- Custodio, C. A., Alves, C. M., Reis, R. L., Mano, J. F. Immobilization of fibronectin in chitosan substrates improves cell adhesion and proliferation. J. Tissue Eng. Regen. Med. 4, 316-323 (2010).
- Boateng, S. Y., Lateef, S. S., Mosley, W., Hartman, T. J., Hanley, L., Russell, B. RGD and YIGSR synthetic peptides facilitate cellular adhesion identical to that of laminin and fibronectin but alter the physiology of neonatal cardiac myocytes. Am. J. Physiol. Cell Physiol. 288, C30-C38 (2005).
- Lefay, C., Guillaneuf, Y., Moreira, G., Thevarajah, J. J., Castignolles, P., Ziarelli, F., Bloch, E., Major, M., Charles, L., Gaborieau, M., Bertin, D., Gigmes, D. Heterogeneous modification of chitosan via nitroxide-mediated polymerization. Polym. Chem. 4, 322-328 (2013).
- Gartner, C., Lopez, B. L., Sierra, L., Graf, R., Spiess, H. W., Gaborieau, M. Interplay between Structure and Dynamics in Chitosan Films Investigated with Solid-State NMR, Dynamic Mechanical Analysis, and X-ray Diffraction. Biomacromolecules. 12, 1380-1386 (2011).
- Castignolles, P., Gaborieau, M., Hilder, E. F., Sprong, E., Ferguson, C. J., Gilbert, R. G. High resolution separation of oligo(acrylic acid) by capillary zone electrophoresis. Macromol. Rapid Commun. 27, 42-46 (2006).
- Chamieh, J., Martin, M., Cottet, H. Quantitative Analysis in Capillary Electrophoresis: Transformation of Raw Electropherograms into Continuous Distributions. Anal. Chem. 87, 1050-1057 (2015).
- Maniego, A. R., Ang, D., Guillaneuf, Y., Lefay, C., Gigmes, D., Aldrich-Wright, J. R., Gaborieau, M., Castignolles, P. Separation of poly(acrylic acid) salts according to topology using capillary electrophoresis in the critical conditions. Anal. Bioanal. Chem. 405, 9009-9020 (2013).
- Chung, T. W., Lu, Y. F., Wang, S. S., Lin, Y. S., Chu, S. H. Growth of human endothelial cells on photochemically grafted Gly-Arg-Gly-Asp (GRGD) chitosans. Biomaterials. 23, 4803-4809 (2002).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены