Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Определение субстрата специфичностью для липазы и фосфолипазы кандидатов
В этой статье
Резюме
Many predicted (phospho)lipases are poorly characterized with regard to their substrate specificities and physiological functions. Here we provide a protocol to optimize enzyme activities, search for natural substrates, and propose physiological functions for these enzymes.
Аннотация
Микроорганизмы производят широкий спектр (фосфо) липаз, которые секретируются для того, чтобы внешние субстраты для организма. В качестве альтернативы, другие (фосфо-) липазы могут быть физически связаны с продуцирующего организма в результате чего оборот собственных липидов и часто порождая ремоделирование клеточных мембран. Хотя потенциал (фосфо-) липазы может быть предсказано с рядом алгоритмов, когда последовательность гена / белок доступен, экспериментальное доказательство активности ферментов, субстрат специфичностью, а также потенциальных физиологических функций часто не было получено. Эта рукопись описывает оптимизацию условий анализа для потенциальных (фосфо) липазы с неизвестными подложки и специфичностью, как использовать эти оптимизированные условия в поисках природного субстрата соответствующего (фосфо) липазы. Использование искусственных хромогенных субстратов, таких как производные р - нитрофенил, может помочь обнаружить незначительныеферментативная активность для предсказанного (фосфо) липазы в стандартных условиях. Столкнувшись такую незначительную ферментативную активность, особые параметры твердофазного иммуноферментного анализа фермента можно варьировать, чтобы получить более эффективный гидролиз искусственном субстрате. После определения условий, при которых фермент работает хорошо, разнообразие возможных природных субстратов должны быть исследованы на их деградации, процесс, который может сопровождаться использованием различных хроматографических методов. Определение субстратной специфичности в отношении новых ферментов, часто дает гипотезы для потенциальной физиологической роли этих ферментов, которые затем могут быть проверены экспериментально. Следуя этим рекомендациям, мы смогли идентифицировать фосфолипазу С (SMc00171) , который унижает фосфатидилхолин к фосфохолин и диацилглицерол, на решающем этапе для ремоделирования мембран в бактерии Sinorhizobium meliloti при фосфорных ограничивающими условиях роста. Для двух предсказывал patatin-как фосфолипаз (SMc00930 и SMc01003) одного и того же организма, мы могли бы пересмотреть свои субстратную специфичность и уточнить, что SMc01003 является диацилглицеринацилтрансферазы липазы.
Введение
Глицерин на основе липидов , такие как триацилглицеринов и (глицеро) фосфолипиды являются важными и , вероятно , наиболее известные классы липидные 1. Триацилглицерины (БИРКАХ) являются жиры или масла, которые обычно функционируют как липиды хранения, и, следовательно, в качестве потенциальных энергетических и углеродных источников. ДВТ может быть понижена липазы, которые часто выделяемыми продуцирующего организма переваривать внешних бирками и сделать их доступными в качестве источников углерода. Кроме того , липазы широко изучались на протяжении многих лет из - за их важных биотехнологического применения 2.
Из - за их амфифильного характера и их почти цилиндрическое форме (глицеро) фосфолипиды экспоната мембранообразующих свойств и , как правило , представляют собой основные липидные компоненты двухслойных мембраны 3. В простых микроорганизмов, таких как бактерии кишечной палочки, только три основных варианта головной группы, фосфатидилглицерина (PG), кардиолипину (CL), и phosphatidylethanolamine (PE) встречаются, хотя следует иметь в виду , что каждый из них может быть заменен с большим количеством различных жирных ацильных цепей в зп -1 или -2 зп ситуация , вызвавшая большое количество различных видов молекул ; 4 , Другие бактерии могут иметь другие фосфолипиды в дополнение или вместо. Например, Sinorhizobium meliloti, бактерия почвы, которая способна образовывать азотфиксирующую клубеньковых симбиозе с бобовой люцерны (Medicago сатива), содержит в дополнение к РЕ а второй цвиттерионная фосфолипид, фосфатидилхолин (PC) 5. Кроме того, липиды, не содержащие фосфор или глицерин могут быть амфифильными и являются составной частью клеточной мембраны. Например, при условиях роста фосфором ограничения, в S. meliloti, (глицеро) фосфолипиды в значительной степени заменены мембранными липидами , которые не содержат фосфор, то есть, сульфолипидов, орнитин липиды, и diacylglyceryl trimethylhomoserine (DGTS) 6. У бактерий DGTS образуется из диацилглицерина (DAG) в двухступенчатом пути 7 , но источник для генерации DAG не было понятно. Пульс-чейз эксперименты показали, что ПК может быть предшественником для DGTS 8 и с использованием методики , описанной в этой рукописи мы могли идентифицировать фосфолипазу С (PLCP, SMc00171) , который формируется под фосфорных ограничивающими условиями и который может преобразовать ПК в DAG и фосфохолина 8.
В отдельном исследовании, мы обнаружили , что ацил-КоА - синтетазы (Fadd) дефицитных мутант S. meliloti или кишечной палочки накопила свободных жирных кислот при входе в стационарной фазе роста 9. Хотя эти жирные кислоты, казалось, быть получены из мембранных липидов, точный источник свободных жирных кислот или фермента (ов), что их высвобождают не были известны. Опять же , применяя стратегию , изложенную в этой рукописи, два пататина типа 10 (фосфо-) липазы (SMc00930 и SMc01003) , что способствовало образованию свободных жирных кислот в S. meliloti 11 были предсказаны. Удивительно, но SMc01003 использовали DAG в качестве субстрата , преобразовав его в monoacylglycerol и , наконец , глицерин и свободные жирные кислоты 11. Поэтому SMc01003 является липаза DAG (DGLA).
Хотя ряд алгоритмов существуют для прогнозирования потенциального (фосфо) липазы 12,13, их точная функция и физиологическая роль, как правило , не известно. Здесь мы приводим протокол, клонировать и гиперэкспрессией предсказанных или потенциальных (фосфо) липазы. Эта рукопись объясняет, как анализы ферментов могут быть разработаны и оптимизированы для суперэкспрессированный (фосфо) липазы с использованием искусственных хромогенных субстратов. Мы приводим примеры, как с оптимизированной ферментного анализа реальной (фосфо) липаза субстрат можно встретить и каким образом эти результаты могут обогатить наше понимание микробной физиологии.
протокол
1. Клонирование и гиперэкспрессией структурный ген для предсказанной липазы
- С помощью полимеразной цепной реакции (ПЦР) 14 и специфических олигонуклеотидов (таблица 1) 15, усиливают интерес ген (smc01003, smc00930 или smc00171), согласно прогнозам, кодировать липазы или фосфолипазы, из геномной ДНК организма - хозяина (т.е. , С. meliloti).
- Введем специфические сайты рестрикции (запланированной последовательности олигонуклеотидов). Дайджест амплифицированного ДНК - фрагмента с соответствующими ферментами рестрикции , и клонировать его в вектор экспрессии , такой как плазмид серии рЕТ 16.
- После проверки правильности последовательности ДНК клонированного гена, преобразование вектора к экспрессии , такой как штамм кишечной палочки BL21 (DE3) pLysS 16.
- Приготовьте накануне вечером предварительной культуры экспрессии хозяина E. палочки BL21 (DE3) рлYss, несущее соответствующий рЕТ вектор с клонированного гена или пустым вектором, в 100 мл колбах с культурой , содержащей 20 мл бульона Лурии Бертани (LB) 17 плюс необходимые антибиотики. Культуры клеток при 30 ° С (или при обычной температуре роста бактерии , из которой липаза берет свое начало).
- Использование ночных предварительных культур, инокуляции 500 мл среды LB подогретую (плюс необходимые антибиотики) в 2 л колбы с культурой , чтобы получить начальную оптическую плотность при длине волны 620 нм (OD 620) = 0,05. Последующие рост культур и при OD 620 = 0,3, добавляют изопропил-бета-D-тиогалактозида (IPTG) до конечной концентрации 100 мкМ, и инкубировать при перемешивании при 30 ° С в течение 4 часов.
- В конце инкубационного периода, передают каждую культуру в центрифужную пробирку емкостью 500 мл и центрифуге при 5000 мкг при 4 ° С в течение 30 мин. Ресуспендируют бактериальных гранул клеток в 5 мл суспензионного буфера (например, SMc00930- и SMc01003-экспрессирующих клеток в 50 мМ Трис-HCl, рН 8,0, и SMc00171-экспрессирующих клеток в 50 мМ диэтаноламин-HCl, рН 9,8). Хранить клеточные суспензии при -80 ° С до использования.
2. Подготовить бесклеточной экстракты белка и Определение концентрации белка
- Размораживание бактериальных клеточных суспензий и хранить на льду. Pass клеточные суспензии трижды через ячейку холодного давления при 20000 фунтов на в 2. Удалить интактных клеток и клеточного дебриса центрифугированием при 5000 х г в течение 30 мин при температуре 4 ° С.
- После центрифугирования готовят аликвоты 100 и 500 мкл из надосадочной жидкости для последующего анализа и хранить их при температуре -80 ° С до использования.
- С помощью одного из 100 мкл аликвоты для определения концентрации белка в различных бесклеточных экстрактов методом выбора или , как описано 18.
3. С помощью искусственных субстратах для оптимизации ЭнзимДеятельность (фосфо) липазы
- Для начального охвата различных ферментативных активностей, используют искусственные субстраты , которые дают окрашенный продукт при гидролизе, например, р -nitrophenol (р) -np.
- Для получения ферментных анализов уже оптимизированы с искусственными подложками р - нитрофенил сложный эфир (намеченные для фосфолипазу С PLCP (SMc00171), а также для предсказанных пататина типа фосфолипаз SMc00930 и SMc01003), использование схемы пипетирующие описаны в таблице 2.
- При изучении нового потенциала (фосфо) липазу, подготовить первый стандартного ферментного анализа , содержащего 50 мМ Трис-HCl, рН 8,5, 100 мМ NaCl, 0,05% Triton X-100, 0,5 мМ п - нитрофенил-содержащего соединения (р - нитрофенил фосфата , бис- р - нитрофенил фосфата, р - нитрофенил деканоат, или р - нитрофенил - пальмитат) и белковый экстракт без клеток (проверка 1, 3, 10, 30, 100, 300, и 1000 мкг) в общем объеме 1 мл в 1 мл пластиковые CUVEttes.
Примечание: Используйте щелочной рН (Рисунок 1) , когда после гидролиза сложного эфира п - нитрофенил в непрерывном анализе. В качестве альтернативы, использовать одинарные анализы отсчете для диапазона значений рН, добавление NaOH в конце инкубационного периода , чтобы прекратить реакцию фермента , и , чтобы гарантировать , что во всех случаях р -np присутствует в виде фенолята. - Выполните изменение во времени для увеличения поглощения при 405 нм, в связи с формированием р -np, в спектрофотометре при 30 ° С в течение 5 мин. Количественная первоначально линейное формирование р -np путем определения начальный наклон увеличения оптической плотности в единицу времени.
- Вычислить изменение концентрации ( & delta ; C) при р -np используя закон Ламберта-Бера (ΔA = ε & delta ; C d) 1.
Примечание: ΔA является линейное изменение оптической плотности определяется, ε является молярный коэффициент поглощения при соответствующей длине волны (в единицах М -1 см -1), d является длина светового пути (1 см), и является delta ; C изменение концентрации (в единицах М) , которые будут определены.- Учитывая , что объем пробы составляет 1 мл, рассчитать количество р -np сформированную.
Примечание: Сумма = концентрация х объем. - Рассчитывают активность фермента путем деления количества р -np образованного к тому времени , в котором она формируется. Определить удельную активность фермента путем деления активности фермента на количество белка (в мг), который отвечает за формирование этой деятельности.
- Учитывая , что объем пробы составляет 1 мл, рассчитать количество р -np сформированную.
- Сравните изменения оптической плотности , спровоцированные белковых экстрактов , в которых были высказаны кандидатом гена (smc00171, smc00930 или smc01003) с экстрактами , которые укрывают только пустой вектор.
Примечание: Для того, чтобы продолжить следующие шаги, конкретные виды деятельности, вызванные белковых экстрактов, в которых был высказан ген-кандидат, должен быть по крайней мере в два раза или мруды, чем значения, полученные для конкретных видов деятельности, вызванных белковых экстрактов, которые укрывают только пустой вектор. - Для дальнейших экспериментов, выбрать те условия , в которых гидролиз р нитрофенил соединение представляет собой минимально с бесклеточных экстрактов (т.е. пустой вектор) и для которых наиболее выраженное образование р -np и р -nitrophenolate анион (рис 1) можно наблюдать , когда белковые экстракты используются, в которых был высказан ген - кандидат.
- После определения активности первоначального фермента в 3.1, оптимизации условий анализа для соответствующего фермента путем изменения рН, тип буфера, буферной силы, концентрации NaCl, детергенты, такие как Тритон Х-100, а также отсутствие или присутствие различных двухвалентных катионов.
- Для различных концентраций каждой переменной, определяют удельную активность фермента (см 3.1.4.2) (наибольшее число получено определяет условиеактивности фермента максимальной). Используйте сочетание оптимальных условий, возникающих для каждой переменной, чтобы определить оптимальную ферментного анализа, в котором каждая переменная присутствует в оптимальной концентрации.
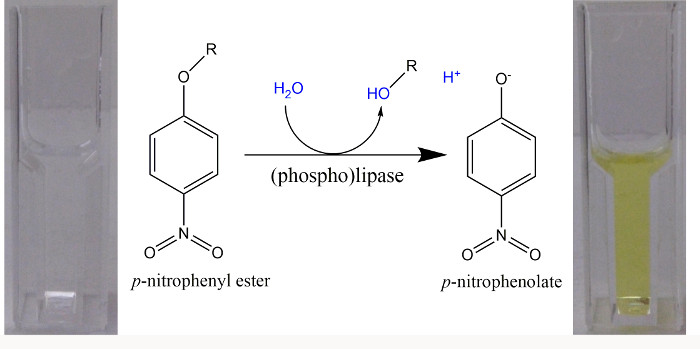
После гидролиза сложных эфиров п - нитрофенил, образуются Рисунок 1. р - нитрофенил эфиры в качестве искусственных субстратов для (фосфо) липазы в спектрофотометрического анализа. Кислотное (R-OH) и р -nitrophenol (р -np). В связи с рК а = 7.2 для диссоциации фенольного Н + от р -np, при рН> 9,2 более 99% находятся в ярко - желтой форме р -nitrophenolate и молярного коэффициента экстинкции 18,000 М -1 см - 1 может быть использован при длине волны 405 нм для количественного определения свободного р -nitrophenolate 22. Когда были использованы буферы с рН 8,5, оптическая плотность определяли при 400 нм и молярным коэффициентом экстинкции 14500 М -1 см -1 был использован 23. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Примечание: После того, как были определены оптимальные условия для активности фермента интерес, приступить к поискам реальной / физиологической субстрат этой липазы. В принципе, взять два, часто дополняют друг друга, подходы к достижению этой цели, в естественных условиях подход или подход в лабораторных условиях .
4. В естественных условиях Идентификация физиологического субстрата липазы
ove_content "> . Примечание: В подходе в естественных условиях, выражают липазы интерес в организме хозяина 8,11 для того , чтобы зарегистрировать в течение долгого времени , изменяет ли выражение липазы профиль host's липидный В другом подходе в естественных условиях, генерировать мутант , дефицитный представляющего интерес гена 8,11 и изучить ли ее липидный профиль отличается от дикого типа версии 6,8,11. для того , чтобы получить количественную оценку профиля липидов организма, простой способ состоит в радиоактивной клеточных соединений , извлечение липидов, отделяя их с помощью хроматографии, и количественной оценки радиоактивно меченных отделенных липиды.- Радиоактивной липидов.
- Готовят на ночь предварительной культуры организма интерес (E.coli или S. meliloti) в 5 мл желаемой культуральной среды (комплекс среднего или определенный минимальный средний) и расти при 30 ° С.
- Из предварительной культуры, прививают в 20 мл самне свежую среду в колбе для культивирования емкостью 100 мл для получения начальной OD 620 = 0,3 для культуры.
- Берут аликвоту (1 мл) культуры в стерильных условиях и переносят в 14 мл стерильного полистирола с круглым дном трубки.
- Добавляют 1 мкКи [1- 14 С] ацетата (60 мКи на ммоль) в 1 мл культуры.
- Выдержите в жидкой культуре при перемешивании при 30 ° С в течение 24 часов.
- В конце инкубационного периода, передать культуру в микроцентрифужных трубки 1,5 мл и центрифугируют при 12000 х г при комнатной температуре в течение 5 мин.
- Ресуспендируют осадок в 100 мкл воды. На данный момент, хранить суспензии клеток при -20 ° С или сразу же продолжать с извлечением полярных липидов (раздел 4.2).
- Добыча полярных липидов.
Примечание: Метод , описанный здесь , по существу , следует процедуре , описанной на Блай и Дайер 19.- К 100 мкл водного клеток SUSPension, добавить 375 мкл метанола в хлороформе раствор (2: 1; об / об).
- Вихревые в течение 30 сек и инкубировать в течение 5 мин при комнатной температуре.
- Центрифуга 5 мин при 12000 х г при комнатной температуре.
- Передача супернатант в новую 1,5 мл микроцентрифужных трубки.
- Добавить 125 мкл хлороформа и 125 мкл воды, вихревые 30 сек.
- Центрифуга 1 мин при 12000 х г при комнатной температуре.
- Перенести Нижнюю фазу хлороформа в чистую пробирку и сухой с потоком газообразного азота.
- Растворение высушенных липидов в 100 мкл смеси хлороформ: метанол (раствор 1: 1; об / об).
Примечание: В этот момент аликвоту 5 мкл раствора липида может быть определена количественно с помощью жидкостного сцинтилляционного счетчика. - Для анализа тонкослойной хроматографии (ТСХ), сухой вниз оставшиеся 95 мкл с потоком газообразного азота и растворяться высушенные липиды в 20 мкл смеси хлороформ: метанол (раствор 1: 1; объем / объем). Используйте 3 мкл аликвотыдля ТСХ-анализа.
- Разделение полярных липидов с помощью тонкослойной хроматографии (ТСХ).
Примечание: В зависимости от классов липидов, которые будут проанализированы различные комбинации твердых и подвижных фаз могут быть использованы для разделения. Здесь типичное разделение для заряженных полярных липидов и другой, больше подходит для нейтральных полярных липидов, с использованием высокоэффективной тонкослойной хроматографии (ВЭТСХ) силикагель алюминиевых листов в качестве твердой фазы, изложены.- Разделение заряженных полярных липидов двумерными ТСХ (2D-ТСХ).
- Нанесите 3 мкл аликвоты липидного образца в одном углу геля алюминиевого листа ВЭТСХ с силикагелем (10 х 10 см), 2 см от края пластины.
- Подготовьте и смешайте подвижной фазы (140 мл хлороформа, 60 мл метанола и 10 мл воды) для разделения в первом измерении.
- Покройте ТСХ разработки камеры с внутренней стороны хроматографической бумаги.
Примечание: Это должно гарантировать, что газовая фаза из камерыбудет быстро насыщается (в течение 30 мин) после того, как подвижной фазы для первого измерение было добавлено в камеру и камера была закрыта со стеклянной пластиной. - Подготовьте и смешайте подвижной фазы (130 мл хлороформа, 50 мл метанола и 20 мл ледяной уксусной кислоты) для разделения во втором измерении и передаче второй TLC развивающейся камере внутри покрытую хроматографическую бумагу, и пусть камеру насыщают.
- Тщательно передачи гель алюминиевый лист ВЭТСХ кремнезем с высушенного образца липида в первой камере и развивать (т.е. выполнять хроматографии) пластины в течение 60 мин в закрытой камере в первом измерении 5.
- Удалите пластину из камеры и дайте обсохнуть растворителей в капюшоне потока в течение 30 мин.
- После поворота пластины на 90 градусов по отношению к предыдущей хроматографии, перенесите силикагель алюминиевый лист HPTLC, на которых липиды были разделены в одном измерении, в SECONd камера и развивать пластины в течение 60 мин во втором измерении 5.
- Извлеките лист из камеры и дать растворителю высохнуть в ламинарном проточном в течение по меньшей мере 2 ч.
- Разделение нейтральных полярных липидов.
- Нанесите 3 мкл аликвоты образцов липида на гель алюминиевого листа ВЭТСХ кремнезема начиная 2 см от края пластины. Если несколько образцов анализируются в одномерной хроматографии, держать на расстоянии не менее 1,5 см между различными пятнами приложения.
- Подготовьте и смешайте подвижной фазы (140 мл гексана, 60 мл диэтилового эфира и 8 мл уксусной кислоты) и переноса в развивающейся камере ТСХ внутренне покрытые хроматографическую бумагу и покрытые стеклянной пластиной, чтобы позволить камерную насыщают (30 мин).
- Перенести силикагель алюминиевый лист HPTLC с высушенными образцами липидов в камеру и развивать пластины в течение 30 мин в закрытой камере.
- Удалите пластину из камерыи дать растворителю высохнуть в ламинарном проточном в течение 2 часов.
- Разделение заряженных полярных липидов двумерными ТСХ (2D-ТСХ).
- Количественное и визуализация разделенных полярных липидов.
- После того, как разработанный ТСХ лист высохнет, инкубировать ее с экраном photostimulable люминесценцию (PSL) в закрытой кассете в течение 3-х дней.
- Expose инкубированных экран сканера PSL и приобрести виртуальный образ разделенных меченных липидов.
- Выполнение количественной оценки с использованием PSL программного обеспечения 20.
- Визуализация и выделение отдельных классов полярных липидов.
- Выдержите развитую ТСХ-лист в течение 10 мин в камере хроматографии в присутствии 1 г кристаллов йода.
Примечание: Отдельно липидные соединения растворяет йод и появляются в виде коричневатых пятен. - Круг пятна с карандашом, сравнить их относительной подвижности (R е) стандартных соединений (т.е. 1,2-dipalmitoyl- зп -глицерол, дипалмитоил-L-альфа-фосphatidylcholine, DL-α-monopalmitin, или пальмитиновой кислоты), а также определить, к которым липид класс они могут принадлежать.
- В вытяжном шкафу, пусть йод испаряется из листа ТСХ.
- С помощью шпателя, скрести силикагель, содержащий соединение, интерес со стороны листа, и извлечь соединение из силикагеля со смесью 100 мкл воды и 375 мкл метанола: раствор хлороформа (2: 1; ИЗД / об).
- Продолжить с извлечением согласно Блай и Дайер, как описано (4.2.2 и выше).
- Хранить очищенный класс липидов в 100 мкл хлороформа: метанола раствор (1: 1; объем / объем) при температуре от -20 ° С до использования.
- Выдержите развитую ТСХ-лист в течение 10 мин в камере хроматографии в присутствии 1 г кристаллов йода.
5. In Vitro Идентификация физиологического субстрата липазы
Примечание: В подходе в пробирке, изучать ли липаза интерес может преобразовывать смесь отдельных липидов или отдельных чистых липидов к соответствующему HYDROLлиза продуктов в условиях, определенных в качестве оптимальной в 3.2.
- Используйте схемы пипетирования для анализов фермента согласно таблице 3 для PC конкретных фосфолипазы C SMc00171 (см 5.2), фосфолипазы А (см 5.3), и DAG липазы SMc01003 (см 5.4) активность.
- Определение фосфолипазы C активности PC специфические (Таблица 3).
- К 1,5 мл трубки микроцентрифужных, добавить 5000 импульсов в минуту (СРМ) из общего 14 С-меченого PC и раствор Тритона Х-100.
- Смешать и сушат в токе азота.
- Добавить диэтаноламин-HCl, рН 9,8 буфера, а также NaCl и MnCl 2 растворов и бидистиллированной воды для получения конечного объема 99,5 мкл. Vortex в течение 5 сек.
- Добавить 0,5 мкл фермента (5 мкг белка) (то есть, свободный от клеток экстракт , в котором избыточно экспрессируется SMc00171 присутствует) , чтобы инициировать реакцию. Кратко перемешать.
- Инкубируют при 30 ° С в течение 4 часов.
- Остановить реакцию с помощьюдобавление 250 мкл метанола и 125 мкл хлороформа.
- Экстракт липидов, как было описано ранее (см 4.2).
- Отдельные липиды одномерными (1D) -TLC (см 4.3.2 и 4.4), и анализировать их с помощью визуализации PSL.
- Определение активности фосфолипазы А (таблица 3).
- К 1,5 мл трубки микроцентрифужных, добавить 5000 СРМ всего 14 С-меченых фосфолипидов и раствор Triton X-100.
- Смешать и сушат в токе азота.
- Для окончательного анализа 100 мкл, добавляют Трис-HCl, рН 8,5, буфер раствором поваренной соли и воды. Vortex в течение 5 сек.
- Добавьте 5 мкл фермента (50 мкг белка) (то есть, свободный от клеток экстракт , в котором избыточно экспрессируется SMc00930 или SMc01003 присутствует).
- Инкубируют при 30 ° С в течение 5 часов.
- Остановить реакцию добавлением 250 мкл метанола и 125 мкл хлороформа.
- Экстракт липидов, как описано ранее (см 4.2), отдельныеих с помощью 1D-ТСХ с использованием 130 мл хлороформа, 50 мл метанола и 20 мл ледяной уксусной кислоты в качестве подвижной фазы, и анализировать их с помощью визуализации PSL.
- Определение диацилглицеринацилтрансферазы (DAG) активность липазы.
- Получение 14 С-меченного DAG.
- Радиоактивной С. meliloti культуры (см 4.1) и извлечь полярные липиды (см 4.2) , как описано. Отдельный S. meliloti Всего экстракты липидов по 1D-TLC в хлороформ: метанол: уксусная кислота (130: 50: 20; об / об) с использованием условий , описанных для разделения во втором измерении в 4.3.1.
- Визуализируйте PC йодом окрашивания и использовать карандаш, чтобы отметить локализацию фосфатидилхолин (PC).
- Изолировать радиоактивно ПК, как описано в 4.5.
- Количественно, извлеченной ПК с помощью сцинтилляционного счетчика.
Примечание: О 320000 имп PC ожидается. - Treat PC (250000 СРМ) с 0,1 U фосфолипазы С из Clostridium перфрингенс в 50 мМ Трис-HCl, рН 7,2, 0,5% Тритона Х-100 и 10 мМ CaCl 2 в течение 2 часов в общем объеме 100 мкл , и реакцию останавливают добавлением 250 мкл метанола и 125 мкл хлороформа.
- Экстракт липидов, как описано выше и отдельно от них 1D-ТСХ (см 4.3.2).
- Изолировать диацилглицерина из диоксида кремния пластины и количественно с помощью сцинтилляционного счетчика (как описано в разделе 4.2)
- Анализ липазы диацилглицеринацилтрансферазы (таблица 3).
- К 1,5 мл трубки микроцентрифужных, добавить 5000 КПМ 14 С-меченного DAG и раствор Triton X-100.
- Смешать и сушат в токе азота.
- Для окончательного анализа 100 мкл, добавляют Трис-HCl (рН 9,0), буфер, раствором хлорида натри и дважды дистиллированной воды. Vortex в течение 5 сек.
- Инициировать реакцию добавлением 5 мкл фермента (50 мкг белка клеточного экстракта бесплатно).
- Инкубируют при 30 ° С в течение 4 часов.
- Остановить реакцию добавлением 250 мкл метанола А.Н.D 125 мкл хлороформа и экстракт липидов, как было описано ранее (см 4.2).
- Анализировать нейтральные полярные липиды от 1D-TLC (см 4.1.3.2) и последующего PSL визуализации.
- Получение 14 С-меченного DAG.
Результаты
Активность PC конкретных фосфолипазы C SMc00171 с Бис р нитрофенил фосфатом
Бесклеточные экстракты , полученные из E. палочка BL21 (DE3) pLysS х, у которого было smc00171 выражены, были изучены на предмет их спо...
Обсуждение
За последние 20 лет, геномы многих организмов были секвенированы и хотя множество данных последовательностей генома была сформирована, функциональная интерпретация отстает и, следовательно, затрудняет наше понимание функции генома. функции генов в геномах часто присваиваются на осно...
Раскрытие информации
Авторы не имеют ничего раскрывать.
Благодарности
Эта работа была поддержана грантами от Consejo Nacional де Ciencias у Tecnología-México (КОНАСИТ-Мексика) (82614, 153998, 253549 и 178359 в Investigación Cientifica BASICA, а также 118 в Investigación ан Fronteras-де-ла-Ciencia) и от Dirección генерала де Asuntos де Личный Academico-Autónoma Universidad Nacional де Мехико (DGAPA-НАУ; PAPIIT IN202616, IN203612).
Материалы
| Name | Company | Catalog Number | Comments |
| Chloroform | JT Baker | 9180-03 | TLC analysis & Lipid extraction |
| Methanol | JT Baker | 9070-03 | TLC analysis & Lipid extraction |
| Acetic Acid | JT Baker | 9507-05 | TLC analysis & Lipid extraction |
| Hexanes | JT Baker | 9309-02 | TLC analysis & Lipid extraction |
| Diethylether | Sigma | 32203 | Enzymatic assays |
| bidistilled water | ANY | NA | Enzymatic assays |
| Tris Base | Sigma | T-1503 | Enzymatic assays |
| HCl | Baker | 9535-02 | Enzymatic assays |
| NaCl | Baker | 3624-01 | Enzymatic assays |
| Triton X-100 | Sigma | X-100 | Enzymatic assays |
| LB broth | ANY | NA | Bacterial growth, 10 g tryptone + 5 g yeast extract + 10 g NaCl per liter of bidistilled water |
| tryptone | Becton Dickinson and Company | 211705 | Bacterial growth |
| yeast extract | Becton Dickinson and Company | 212750 | Bacterial growth |
| TY broth | ANY | NA | Bacterial growth, 8 g tryptone + 3 g yeast extract + 66 mg CaCl2·2H2O per liter of bidistilled water |
| CaCl2·2H2O | Baker | 1332-01 | Enzymatic assays |
| isopropyl-β-D-thiogalactoside (IPTG) | Invitrogen | 15529-019 | Bacterial growth |
| Diethanolamine | Sigma | D-8885 | Enzymatic assays |
| MnCl2 | Sigma | 221279 | Enzymatic assays |
| Phospholipase A2 snake venom | Sigma | P0790 | Enzymatic assays |
| Phospholipase C Clostridium perfringens | Sigma | P7633 | Enzymatic assays |
| Bis-p-nitrophenyl phosphate | Sigma | 07422AH | Enzymatic assays |
| p-nitrophenyl stearate | Sigma | N3627 | Enzymatic assays |
| p-nitrophenyl dodecanoate | Sigma | 61716 | Enzymatic assays |
| p-nitrophenyl decanoate | Sigma | N0252 | Enzymatic assays |
| p-nitrophenyl palmitate | Sigma | N2752 | Enzymatic assays |
| p-nitrophenyl butyrate | Sigma | N9876 | Enzymatic assays |
| p-nitrophenyl octanoate | Sigma | 21742 | Enzymatic assays |
| Acetic Acid, sodium salt [1-14C] | Perkin Elmer | NEC084 | Bacterial growth |
| dimethylsulfoxide (DMSO) | JT Baker | 9224-01 | Enzymatic assays |
| Aluminium HPTLC silica gel 60 plates. Silica gel HPTLC plates size 20 x 20 cm, 25 sheets. | Merck | 105547 | TLC analysis & Lipid extraction |
| Spectrometer UV/VIS Lambda 35 | Perkin Elmer | NA | Enzymatic assays |
| Storm 820 Phosphorimager | Molecular Dynamics | NA | Photostimulable Luminescence scanner |
| Multipurpose Scintillation Counter | Beckman Coulter | NA | Radioactivity Quantification |
| French Pressure Cell | ThermoSpectronic | NA | Breakage of cells |
| chromatography paper 3MM Chr | Whatman | 3030917 | TLC analysis |
| Sinorhizobium meliloti 1021our | reference 11 | studied strain | |
| Escherichia coli BL21 (DE3) pLysS Competent cells | Novagen | 69451 | protein expression strain |
| pET9a vector | Novagen | 69431 | protein expression vector |
| pET17b vector | Novagen | 69663 | protein expression vector |
| sterile polystyrene round-bottom tube (14 ml) Falcon | Becton Dickinson | 352057 | radiolabeling of bacterial cultures |
| polypropylene microcentrifuge tubes (1.5 ml) | Eppendorf | 30125.15 | Enzymatic assays |
| 1,2-dipalmitoyl-sn-glycerol | Sigma | D9135 | lipid standard |
| L-α-phosphatidylcholine, dipalmitoyl | Sigma | P6267 | lipid standard |
| DL-α-monopalmitin | Sigma | M1640 | lipid standard |
| palmitic acid | Sigma | P0500 | lipid standard |
Ссылки
- Nelson, D. L., Cox, M. M. . Lehninger, Principles of Biochemistry. , (2013).
- Jaeger, K. E., Eggert, T. Lipases for biotechnology. Curr. Opin. Biotechnol. 13 (4), 390-397 (2002).
- Dowhan, W., Bogdanov, M., Mileykovskaya, E. Functional roles of lipids in membranes. Biochemistry of Lipids, Lipoproteins and Membranes. , 1-37 (2008).
- Dowhan, W. Molecular basis for membrane phospholipid diversity: why are there so many lipids?. Annu. Rev. Biochem. 66, 199-232 (1997).
- De Rudder, K. E. E., Thomas-Oates, J. E., Geiger, O. Rhizobium meliloti mutants deficient in phospholipid N-methyltransferase still contain phosphatidylcholine. J. Bacteriol. 179, 6921-6928 (1997).
- Geiger, O., Röhrs, V., Weissenmayer, B., Finan, T. M., Thomas-Oates, J. E. The regulator gene phoB mediates phosphate stress-controlled synthesis of the membrane lipid diacylglyceryl-N,N,N-trimethylhomoserine in Rhizobium (Sinorhizobium) meliloti. Mol. Microbiol. 32 (1), 63-73 (1999).
- Klug, R. M., Benning, C. Two enzymes of diacylglyceryl-O-4'-(N,N,N,-trimethyl)homoserine biosynthesis are encoded by btaA and btaB in the purple bacterium Rhodobacter sphaeroides. Proc. Natl. Acad. Sci. USA. 98 (10), 5910-5915 (2001).
- Zavaleta-Pastor, M., et al. Sinorhizobium meliloti phospholipase C required for lipid remodeling duringphosphorus limitation. Proc. Natl. Acad. Sci. USA. 107 (1), 302-307 (2010).
- Pech-Canul, A., et al. FadD is required for utilization of endogenous fatty acids released from membrane lipids. J. Bacteriol. 193 (22), 6295-6304 (2011).
- Banerji, S., Flieger, A. Patatin-like proteins: a new family of lipolytic enzymes present in bacteria?. Microbiology. 150 (Pt 3), 522-525 (2004).
- Sahonero-Canavesi, D. X., et al. Fatty acid-releasing activities in Sinorhizobium meliloti include unusual diacylglycerol lipase. Environ. Microbiol. 17 (9), 3391-3406 (2015).
- Fischer, M., Pleiss, J. The Lipase Engineering Database: a navigation and analysis tool for protein families. Nucl. Acid. Res. 31 (1), 319-321 (2003).
- Sigrist, C. J. A., et al. New and continuing developments at PROSITE. Nucleic Acids Res. 41 (Database issue), D344-D347 (2013).
- Lorenz, T. C. Polymerase Chain Reaction: Basic Protocol Plus Troubleshooting and Optimization Strategies. J. Vis. Exp. (63), e3998 (2012).
- Untergasser, A., et al. Primer3 - new capabilities and interfaces. Nucl. Acids Res. 40 (15), e115 (2012).
- Studier, F. W., Rosenberg, A. H., Dunn, J. J., Dubendorff, J. W. Use of T7 RNA polymerase to direct expression of cloned genes. Methods Enzymol. 185, 60-89 (1990).
- Miller, J. H. . Experiments in Molecular Genetics. , (1972).
- Desjardins, P., Hansen, J. B., Allen, M. Microvolume Protein Concentration Determination using the NanoDrop 2000c Spectrophotometer. J. Vis. Exp. (33), e1610 (2009).
- Bligh, E. G., Dyer, W. J. A rapid method for total lipid extraction and purification. Can. J. Biochem. Physiol. 37 (8), 911-917 (1959).
- Molecular Dynamics. . Phosphorimager SI User´s Guide. , (1994).
- Dixon, M., Webb, E. . Enzymes: Third Edition. , (1979).
- Rudolph, A. E., et al. Expression, characterization, and mutagenesis of the Yersinia pestis murine toxin, a phospholipase D superfamily member. J. Biol. Chem. 274 (17), 11824-11831 (1999).
- Kato, S., Yoshimura, T., Hemmi, H., Moriyama, R. Biochemical analysis of a novel lipolytic enzyme YvdO from Bacillus subtilis. Biosci. Biotechnol. Biochem. 74 (4), 701-706 (2010).
- Peppelenbosch, M. P. Kinome profiling. Scientifica (Cairo). , (2012).
- Manafi, M., Kneifel, W., Bascomb, S. Fluorogenic and chromogenic substrates used in bacterial diagnostics. Microbiol. Rev. 55 (3), 335-348 (1991).
- Kuznetsova, E., et al. Enzyme genomics: Application of general enzymatic screens to discover new enzymes. FEMS Microbiol. Rev. 29 (2), 263-279 (2005).
- Scopes, R. K. . Protein Purification, Principles and Practice. , (2010).
- Geiger, O., Lopez-Lara, I. M., Sohlenkamp, C. Phosphatidylcholine biosynthesis and function in bacteria. Biochim. Biophys. Acta. 1831 (3), 503-513 (2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены