Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Фабрикации UV-VIS и спектроскопии комбинационного рассеяния света иммуноанализа платформы
* Эти авторы внесли равный вклад
В этой статье
Резюме
Nanoparticle-based optical probes have been designed as a vehicle for detecting antigens using Raman and UV-Vis spectroscopy. Here we describe a protocol for preparing such probes for a UV-Vis/Raman spectroscopy immunoassay in such a way to incorporate future multiplexing capabilities.
Аннотация
Иммунологические используются для обнаружения белков, основанные на присутствии ассоциированных антител. Из-за их широкого использования в исследованиях и клинических условиях, большая инфраструктура иммунологического инструментов и материалов можно найти. Например, 96- и 384-луночные полистироловые планшеты имеются в продаже и имеют стандартную конструкцию для размещения видимой области ультрафиолетового (УФ-Вид) спектроскопии машины от различных производителей. Кроме того, большое разнообразие иммуноглобулины, меток обнаружения и блокирующих агентов для индивидуальных конструкций иммунологического анализа, таких как твердофазный иммуноферментный анализ (ELISA) доступны.
Несмотря на существующую инфраструктуру, стандартные наборы ELISA не удовлетворяют все потребности исследований, требующих индивидуального развития иммунологического анализа, который может быть дорогостоящим и отнимает много времени. Например, ELISA наборы имеют низкую мультиплексирование (обнаружение более чем одного анализируемого вещества в то время) возможности, поскольку они, как правило, зависят от флуоресценции или Colкалориметрические методы обнаружения. Колориметрический и флуоресцентные на основе анализа имеют ограниченные возможности мультиплексирования из-за широких спектральных пиков. В противоположность этому, спектроскопии комбинационного рассеяния света на основе метода имеют гораздо больше возможностей для мультиплексирования из-за узких пиков выбросов. Еще одним преимуществом спектроскопии комбинационного рассеяния света является то , что комбинационные журналисты испытывают значительно меньше , чем фотообесцвечивания флуоресцентных меток 1. Несмотря на преимущества, которые комбинационные репортеры над флуоресцентных и колориметрических тегов, протоколы для изготовления комбинационного рассеяния на основе иммунологические ограничены. Целью данной работы является создание протокола для подготовки функционализированных зондов для использования в сочетании с пенополистирольных плит для непосредственного обнаружения аналитов с помощью УФ-Vis анализа и спектроскопии комбинационного рассеяния света. Этот протокол позволит исследователям принять сделай сам подход для будущего обнаружения мульти-аналита в то время как спекулируя на заранее установленной инфраструктуры.
Введение
Типичные иммунологические сэндвич косвенно обнаружить присутствие антигена с использованием двух антител. Антитело захвата связан с твердой поверхностью и образует комплекс антитело-антиген, когда в непосредственной близости к соответствующему антигену. Антитело обнаружения затем вводят и связывается с антигеном. После промывания антитело / антиген / антитело остается и детектируют с помощью меченого антитела обнаружения , как показано на рисунке 1А. Типичное определение производится с помощью флуоресцентного или колориметрического детектора, ограничивая мультиплексирование до 10 аналитов из - за широких спектральных пиков 2,3. В отличие от систем на основе комбинационного имеют гораздо более узкие пики выбросов в результате чего расширенные возможности мультиплексирования с источниками претендующих на одновременное обнаружение до 100 аналитов 2,3.
Многие литературные источники доступны , которые охватывают важные аспекты , связанные с иммунологические тесты 4 - 6 таких , как шаг за шагомДетали для создания персонализированных наборов ELISA. К сожалению, эти протоколы для люминесцентной или колориметрического обнаружения, ограничивая возможности мультиплексирования специализированных иммуноанализа. Для удовлетворения этой потребности, мы представляем подробную процедуру для изготовления UV-VIS / комбинационное иммуноанализа , опубликованную ранее 7 для прямого иммуноанализа , как показано на рисунке 1В.
Этот протокол включает в себя изготовление функционализованный на основе наночастиц золота зондов, показанный на рисунке 2. Процедура , чтобы сделать / UV-VIS зондов комбинационного рассеяния начинает связыванием репортерам Рамана на поверхность наночастиц золота (AuNPs). Эти AuNPs затем функционализированные с антителами, которые связаны с полиэтиленгликолем (ПЭГ). Остающиеся сайты связывания на AuNPs блокируют связывание метокси полиэтиленгликоль тиольных (мПЭГ-SH) к AuNPs для предотвращения последующего неспецифического связывания во время анализа. Подготовленные зонды AuNP тестируются путем связывания с антигенамиприкрепляемых к лункам полистирольной пластины , как показано на фигуре 1В. После промывания планшета в AuNP зонды детектируются с использованием УФ-видимой спектроскопии в то время как соответствующие комбинационные репортеры детектируются с спектроскопии комбинационного рассеяния света. Сочетание UV-VIS и КР спектральных данных обеспечивает два способа анализа, расширения возможностей этого иммунологического анализа.
протокол
1. Приготовление буферами
- Забуференный фосфатом физиологический раствор (PBS) ,
- Развести 50 мл 10х PBS с 450 мл воды класса ВЭЖХ, чтобы сделать концентрацию 1x PBS. Стерильный фильтр, раствор с фильтром 0,22 мкм.
- Решение Хранить при комнатной температуре.
- Получение Трис - солевом буферном + Tween 20 (TBST)
- Развести 50 мл 10х Трис солевым буфером (TBS) с 450 мл воды класса ВЭЖХ, чтобы сделать концентрацию 1x. Добавьте 250 мкл Tween-20 в течение 0,05% (об / об) Tween-20. Стерильный фильтр, раствор с фильтром 0,22 мкм.
- Хранить при комнатной температуре.
- Приготовление сывороточный альбумин человека (HSA) , блокирующий раствор
- Взвешивают 0,45 г ЧСА в 15 мл стерильного профильтрованного 1х PBS, чтобы сделать 3% вес / объем раствора ЧСА. Vortex раствор до HSA полного растворения.
- Хранить раствор HSA при 4 ° С.
Примечание: бычьим сывороточным альбумином(БСА) также может быть использован в качестве блокирующего раствора.
- Приготовление пегилированного антитела раствор (ПЭГ-Ab)
Примечание: Раствор антитела должно быть от носителя или стабилизирующих белки, такие как БСА, которые будут мешать реакций конъюгации, конкурирующих за п-hydroxysulfosuccinimide (НСЗ) сайты связывания бесплатно. Если антитело приходит в растворе Трис или глициновый буфер, он должен пройти замену буфера для предотвращения амины или аммониевые соли с препятствующим протеканию реакции конъюгации НГС. Если антитело в лиофилизированной форме, она может быть повторно суспендировали в соответствии с рекомендациями производителя в концентрации 1-10 мг / мл.- Для получения антител в Трис-буфере или глицин, выполнить замену буфера до 100 мМ бикарбоната натрия с использованием колонки обессоливания. С помощью 100 мМ буфера для повышения рН до приблизительно 8,5, чтобы ускорить реакции конъюгации.
- Сода орто-пиридил дисульфид-ПЭГ-NHS (ОПСС-ПЭГ-NHS) с 100 мМ sOdium бикарбонат до объема 1 мл при концентрации 1 мг / мл или более.
Примечание: OPSS-PEG-NHS должны быть сделаны свежие и использовать в течение примерно 20 мин. Группа НГС на OPSS-PEG-NHS имеет период полураспада примерно 20-минутное в водном растворе при рН 8,5. - Добавить OPSS-PEG-NHS к раствору антител в соотношении 2: 1 (ПЭГ: Антитело) отношение конъюгации использоваться для испытательных образцов. В отдельной трубки микроцентрифужных, добавить OPSS-PEG-NHS в раствор антигена в соотношении 2: 1 конъюгации использоваться для контроля.
ПРИМЕЧАНИЕ: 2: 1 соотношение приобретает эффективность конъюгации 50%. Цель состоит в том, чтобы маркировать каждое антитело с одной цепью ПЭГ. На этом этапе более маркирование лучше, чем при маркировке. Используйте следующее уравнение для определения соответствующих объемов OPSS-PEG-NHS и раствор антител:
где V есть объем, С концентрация выражается в молекулах илиtibodies на мл. ПЭГ и нижние индексы Ab являются OPSS-PEG-NHS и антитела, соответственно. Конечный объем должен составлять приблизительно 250 мкл. - Выдержите раствор ПЭГ-Ab при 4 ° С в течение 8 часов или в течение ночи. Решение Хранить в рабочем аликвот приблизительно 25 мкл при -20 ° С, чтобы ограничить циклы замораживания и оттаивания и убедитесь в том, чтобы использовать низкие обязательные трубки.
2. Подготовить УФ-Vis / Раман Зонды
- Приготовьте голую решение AuNP
- Готовят раствор 2 мл AuNPs с концентрацией примерно 1 × 10 11 частиц на мл.
- Если AuNPs должны быть сосредоточены, заполнить низким связыванием центрифужные пробирки с 2000 мкл запаса AuNP и центрифуге при 5000 мкг в течение 20 мин или до супернатант ясно. Удалить супернатант с помощью пипетки, соблюдая осторожность, чтобы не мешать осадок AuNP.
- Смешайте оставшиеся решения AuNP в одну пробирку и оценить Concentraния путем получения измерения UV-VIS и сравнения значений известных концентраций, как это линейная зависимость.
- Готовят раствор 2 мл AuNPs с концентрацией примерно 1 × 10 11 частиц на мл.
- Определить соответствующий коэффициент репортер маркировки комбинационного
- Подготовка рабочего раствора репортера комбинационного растворенного в метаноле. Эта концентрация будет зависеть от используемого репортера. В этой работе, готовят 3,3'-diethylthiatricarbocyanine йодид (DTTC) в рабочем растворе 200 мкМ.
- Предполагая, конечный объем 100 мкл для каждой лунки, добавляют достаточное количество раствора рабочего репортера в каждую лунку первого ряда 96-луночный планшет таким образом, что репортер комбинационное будет колебаться в концентрации от 0,2 мкМ до 10 мкМ. Добавьте достаточно ЖХВР воды в каждую лунку таким образом, что объем составляет 80 мкл. Добавьте 20 мкл AuNP в каждую лунку делает конечный объем 100 мкл для каждой лунки. Пример приведен в таблице 1.
- Измерьте UV-VIS спектры от 400 до700 нм, использу планшет-чтение UV-VIS спектрофотометра. Соответствующая концентрация самая высокая концентрация с определенными пиками для спектров UV-VIS. Повторите шаг 2.2.2 при повышенных концентрациях до самого высокого соотношения концентраций репортеров к комбинационных AuNPs найден.
Примечание: Краситель и форма AuNP, размер, и производитель влияют на соответствующую концентрацию. Поэтому шаги, перечисленные должны быть оценены и изменены в зависимости от используемых компонентов. Этот протокол включал использование положительно заряженного красителя. Таким образом, связывание между AuNP и репортер был улучшен с помощью отрицательно заряженных AuNPs. Это было сделано с помощью цитрат ограничен AuNPs. Смотрите раздел Обсуждение для получения более подробной информации.
- Связывание репортер комбинационного и PEG-Ab к AuNP
- Приготовьте два 1,5 мл порций AuNP и репортер КРС в предварительно определенной концентрации, что позволяет репортер комбинационное связываться с AuNPs в течение 30 мин при комнатной температуре.
- Добавьте Pegylated антитело (PEG-Ab) к одной партии раствора репортер AuNP и КР создать 200: 1 отношение антител к частицам. Это решение будет для испытуемых образцов. В отдельной трубки микроцентрифужных, добавить антиген пегилированному к другой партии раствора репортера AuNP и КРС при 200: 1 отношение антител к частицам, которые будут использоваться в качестве контроля. Инкубируйте растворов в течение 30 мин при комнатной температуре.
Примечание: Отношение антител к частицам будут специфичными к AuNPs и красителя и должны быть оптимизированы для каждого конкретного случая. Цель здесь иметь самый высокий коэффициент антител ибо AuNP зонды связываются с одновременно предотвращая агрегацию частиц. Используйте следующее уравнение для определения соответствующих объемов, чтобы добавить вместе:
где V есть объем, С концентрация выражается в виде частиц или антител на мл. плавникаль объем должен быть примерно 1,5 мл.
- Блок остальные участки на поверхности AuNP с мПЭГ-SH.
- Подготовка Mpeg-SH путем растворения твердого полиэтилена метоксиполиэтиленгликоль тиола до концентрации 200 мкМ с использованием воды. Vortex раствора до мПЭГ-SH полностью не растворится.
- Добавить Mpeg-SH на 40000: отношение к решению AuNP-PEG-Ab сделали в шаге 2.3 1. Выдержите раствор при комнатной температуре в течение 10 мин, чтобы обеспечить оставшиеся участки на наночастицы золота блокируются. Используйте следующее уравнение для определения соответствующих объемов, чтобы добавить вместе:
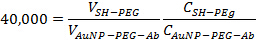
где V есть объем, С концентрация выражается в виде частиц или антител на мл. Конечный объем должен быть примерно 1,5 мл.
- Восстановление функционализированные зондов комбинационного рассеяния.
- Центрифуга частицы в количестве 5000 мкг в течение 20 мин при низкой связывания Centrifuge трубки или пока супернатант не ясно. Удалить супернатант с помощью пипетки осторожно, чтобы не мешать AuNPs.
- Ресуспендируют частицы с 1 мл раствора PBS 1x, что было сделано ранее. Оценить концентрацию AuNP, принимая UV-VIS измерение небольшого объема раствора (3 мкл) и сравнить результаты измерений с известной концентрацией AuNP. Настройка громкости таким образом, что окончательное решение по крайней мере , 1 × 10 11 частиц на мл.
- Хранить растворы при температуре 4 ° С до тех пор, пока не будет использован для функционализации иммуноанализа пластины. Используйте решения в течение одной недели.
| Объемы для добавления каждого компонента (мл) | |||
| конечная концентрация DTTC (мМ) | DTTC рабочего раствора (200 мМ) | AuNP | вода |
| 0,2 | 0,1 | 20 | 79,9 |
| 0,6 | 0,3 | 20 | 79,7 |
| 1 | 0,5 | 20 | 79,5 |
| 2 | 1,0 | 20 | 79 |
| 5 | 2.5 | 20 | 77,5 |
| 7 | 3.5 | 20 | 76,5 |
| 10 | 5.0 | 20 | 75 |
Таблица 1. DTTC разбавление пример. Различные разведений DTTC и связанные с ними объемы акций DTTC, золота раствора наночастиц и воды.
3. иммуноферментный плиты Подготовка
- Bind желаемыми антиген к иммуноанализа пластине.
- Подготовьте достаточное количество разбавленного антигена (50 мкг / мл), чтобы заполнить полистироловые лунки. Vortex решение,и сразу же добавляют раствор в лунки планшета. Разрешить антиген связываться с планшетами в течение 1 ч при комнатной температуре.
- Смыть несвязанных антигенов.
- Удалите излишки раствора антигена путем сброса раствора в контейнер для утилизации и ударять пластину против бумаги полотенцем покрытый столешницей.
- Добавить TBST в лунки, чтобы промыть поверхность затем удалить промывку таким же образом, как было указано выше. Повторите этот шаг еще два раза.
- Блок оставшиеся участки связывания на пластине для предотвращения неспецифического связывания.
- Добавить 70 мкл блокирующего раствора ЧСА в каждую лунку планшета и инкубируют при комнатной температуре в течение 30 мин.
- Удалить и промыть пластины, используя ту же процедуру, как указано в шаге 3.2. Накройте тарелку и хранить высыхать при температуре 4 ° С до готовности для дальнейшего использования.
- Функционализации иммунологического пластину.
- Добавить 70 мкл тон зондировать наночастицы, полученные в разделе 2, в первом столбце 96-луночного планшета и разбавить последующих колонках с использованием 1: 2 серийное разведение. Разрешить планшет инкубируют в течение по крайней мере 1 часа. Пример того , как подготовить иммунологического пластину приведена на рисунке 3.
- Промыть пластины с TBST пять раз, как описано в пунктах 3.2, убедившись в том, чтобы избавиться от AuNPs соответствующим образом. После последней промывки, добавляют 70 мкл 1х PBS в каждую лунку и накрыть тарелкой уплотнением.
Примечание: Контрольные образцы должны быть четкими. Если неспецифическое связывание произошло, контрольные образцы будут иметь такой же цвет, что и испытуемых образцов.
- Тест чувствительность анализа с помощью УФ-Вис и спектроскопии комбинационного рассеяния света.
- Для каждой лунки измеряют UV-VIS спектры в диапазоне от 400 до 700 нм с использованием планшет-считывания UV-VIS спектрофотометра.
- С использованием инвертированного микроскопа комбинационного рассеяния, фокусирования цели на поверхность скважины, которая имеет AuNP зондов. Обьживать спектров комбинационного рассеяния скважины. Собирают спектр в диапазоне от 1800 см -1 до 400 см -1. Повторите этот шаг для всех скважин.
- С помощью соответствующего спектрального программного обеспечения, выполнить 11 - го порядка Полином коррекции базовой линии для спектров комбинационного рассеяния света и порядка полиномом 3 - й для УФ-Vis спектров.
- С помощью соответствующего спектрального программного обеспечения, нормализовать Рамана и UV-VIS спектры. Установите максимальное значение 1 и масштабировать все остальные значения соответственно. Для нормализации спектров комбинационного рассеяния, выберите уникальный пик полистирола и установите его равным 1 и масштабировать все остальные значения соответственно.
- С помощью соответствующего спектрального программного обеспечения, проведения пиковой интеграции для каждого спектра. Для получения спектров комбинационного рассеяния, пик, представляющий репортеру комбинационное должен находиться в области отсутствуют пиков полистирола. Для выполнения пиковой интеграции, указать интегральные границы для желаемого пика и записать нужную площадь пика для всех образцов, включая элементы управления.
- PlOt средней площади пика интереса как функции от логарифма концентрации AuNP с ошибками для каждой точки, указывающей связанный с ним стандартное отклонение. Установить эти точки калибровки логистической кривой 4-х параметров.
- Определить среднее значение заготовки путем усреднения площади пика интереса для чистого образца. Определить стандартное отклонение этих областей; это стандартное отклонение заготовки.
- Для того же пика анализируемого в предыдущем шаге, найти стандартное отклонение этой площади пика для самой низкой концентрации.
- Вычислить предел заготовки и нижнего предела обнаружения, как указано в разделе результатов представителя. Используйте эти значения с калибровочными кривыми 4PL для определения LLOD с точки зрения концентрации AuNP.
Результаты
В этом исследовании, 60 нм частицы золота были использованы для УФ-видимой спектроскопии. УФ-Vis спектров поглощения от 400 до 700 нм были собраны и площадей пиков для каждой концентрации AuNP определяли с помощью программного обеспечения 8 спектрального анализа с открытым исходным кодо...
Обсуждение
В подробном протоколе, существует несколько критических точек обратиться. Одной из проблем является выбор репортера комбинационного и наночастиц золота. Хотя протокол был написан быть адаптирован для индивидуального использования, рамановские репортер DTTC был использован в качестве...
Раскрытие информации
The authors declare that they have no competing financial interests.
Благодарности
This work was supported by a Research Catalyst Award from Utah State University. The authors would like to thank Annelise Dykes, Cameron Zabriskie, and Donald Wooley for their contributions.
Материалы
| Name | Company | Catalog Number | Comments |
| 60 nm Gold Nanoparticle | Ted Pella, Inc. | 15708-6 | These are citrate capped gold nanoparticles. Please see Discussion for relationship between Raman reporter and AuNP surface charge and its imporance to proper selection of AuNP and/or Raman reporter. |
| Sodium Bicarbonate | Fisher Scientific | S233-500 | |
| Methanol | Pharmco-Aaper | 339000000 | |
| Tris Buffered Saline (10x) pH 7.5 | Scy Tek | TBD999 | |
| Bottle Top Filtration Unit | VWR | 97066-202 | |
| Tween 20 (polysorbate 20) | Scy Tek | TWN500 | Used as an emulsifying agent for washing steps. |
| Phosphate Buffered Saline 10x Concentrate, pH 7.4 | Scy Tek | PBD999 | |
| Protein LoBind Tube 2.0 ml | Eppendorf Tubes | 22431102 | LoBind tubes prevent binding of proteins and AuNPs to surfaces of the tubes. |
| Protein LoBind Tube 0.5 ml | Eppendorf Tubes | 22431064 | LoBind tubes prevent binding of proteins and AuNPs to surfaces of the tubes. |
| Microplate Devices UniSeal | GE Healthcare | 7704-0001 | Used for sealing and storing functionalized plates. |
| Assay Plate, With Low Evaporation Lid, 96 Well Flat Bottom | Costar | 3370 | |
| HPLC grade water | Sigma Aldrich | 270733-4L | |
| 3,3′-Diethylthiatricarbocyanine iodide (DTTC) | Sigma Aldrich | 381306-250MG | Raman reporter |
| mPEG-Thiol, MW 5,000 - 1 gram | Laysan Bio, Inc. | MPEG-SH-5000-1g | |
| OPSS-PEG-SVA, MW 5,000 - 1 gram | Laysan Bio, Inc. | OPSS-PEG-SVA-5000-1g | OPSS-PEG-SVA has an NHS end. |
| Mouse IgG, Whole Molecule Control | Thermo Fisher Scientific | 31903 | Antigen |
| Goat anti-Mouse IgG (H+L) Cross Adsorbed Secondary Antibody | Thermo Fisher Scientific | 31164 | Antibody |
| Human Serum Albumin Blocking Solution | Sigma Aldrich | A1887-1G | Bovine serum albumin can be used instead. |
| Mini Centrifuge | Fisher Schientific | 12-006-900 | |
| UV-Vis Spectrophotometer | Thermo Scientific | Nanodrop 2000c | |
| UV-Vis Spectrophotometer | BioTek | Synergy 2 | |
| Desalting Columns | Thermor Scientific | 87766 | |
| In-house built 785 nm inverted Raman microscope unit | N/A | N/A | An inverted Raman microscope is best for proper focusing onto surface of the well plate. Otherwise a very low magnification will be used due to height of the 96-well plate. An in-house built system was used as it was cheaper than buying from a vendor. However, any commercially available inverted Raman microscope system can be used. |
Ссылки
- Israelsen, N. D., Hanson, C., Vargis, E. Nanoparticle properties and synthesis effects on surface-enhanced Raman scattering enhancement factor: an introduction. Sci. World J. , e124582 (2015).
- Wang, Y., Schlücker, S. Rational design and synthesis of SERS labels. Analyst. 138 (8), 2224-2238 (2013).
- Wang, Y., Yan, B., Chen, L. SERS tags: novel optical nanoprobes for bioanalysis. Chem. Rev. 113 (3), 1391-1428 (2013).
- . . The Immunoassay Handbook: Theory and applications of ligand binding, ELISA and related techniques. , (2013).
- Cox, K. L., Devanarayan, V., Kriauciunas, A., Manetta, J., Montrose, C., Sittampalam, S. Immunoassay Methods. Assay Guid. Man. , (2004).
- . . ELISA development guide. , (2016).
- Israelsen, N. D., Wooley, D., Hanson, C., Vargis, E. Rational design of Raman-labeled nanoparticles for a dual-modality, light scattering immunoassay on a polystyrene substrate. J. Biol. Eng. 10, (2016).
- Menges, F. . Spekwin32 - optical spectroscopy software. Version 1.72.1. , (2016).
- Findlay, J. W. A., Dillard, R. F. Appropriate calibration curve fitting in ligand binding assays. AAPS J. 9 (2), E260-E267 (2007).
- Yu, X. Quantifying the Antibody Binding on Protein Microarrays using Microarray Nonlinear Calibration. BioTechniques. 54, 257-264 (2013).
- Armbruster, D. A., Pry, T. Limit of blank, limit of detection and limit of quantitation. Clin. Biochem. Rev. 29 (Suppl 1), S49-S52 (2008).
- . . EP17-A2: Evaluation of Detection Capability for Clinical Laboratory Measurement Procedures; Approved Guideline. 32. No 8, (2012).
- Leigh, S. Y., Som, M., Liu, J. T. C. Method for assessing the reliability of molecular diagnostics based on multiplexed SERS-coded nanoparticles. Plos One. 8 (4), e62084 (2013).
- Sinha, L. Quantification of the binding potential of cell-surface receptors in fresh excised specimens via dual-probe modeling of SERS nanoparticles. Sci. Rep. 5, 8582 (2015).
- Shi, W., Paproski, R. J., Moore, R., Zemp, R. Detection of circulating tumor cells using targeted surface-enhanced Raman scattering nanoparticles and magnetic enrichment. J. Biomed. Opt. 19, 056014 (2014).
- Xia, X., Li, W., Zhang, Y., Xia, Y. Silica-coated dimers of silver nanospheres as surface-enhanced Raman scattering tags for imaging cancer cells. Interface Focus. 3 (3), 20120092 (2013).
- McLintock, A., Cunha-Matos, C. A., Zagnoni, M., Millington, O. R., Wark, A. W. Universal surface-enhanced Raman tags: individual nanorods for measurements from the visible to the infrared (514-1064 nm). Acs Nano. 8 (8), 8600-8609 (2014).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены