Method Article
Срабатывание клеточный стресс и смерть с использованием обычных УФ-лазера конфокальной микроскопии
В этой статье
Резюме
Targeted manipulations to cause directed stress or death in individual cells have been relatively difficult to accomplish. Here, a single-cell-resolution ablation approach to selectively stress and kill individual cells in cell culture and living animals is described based on a standard confocal UV laser.
Аннотация
Using a standard confocal setup, a UV ablation method can be utilized to selectively induce cellular injury and to visualize single-cell responses and cell-cell interactions in the CNS in real-time. Previously, studying these cell-specific responses after injury often required complicated setups or the transfer of cells or animals into different, non-physiological environments, confounding immediate and short-term analysis. For example, drug-mediated ablation approaches often lack the specificity that is required to study single-cell responses and immediate cell-cell interactions. Similarly, while high-power pulsed laser ablation approaches provide very good control and tissue penetration, they require specialized equipment that can complicate real-time visualization of cellular responses. The refined UV laser ablation approach described here allows researchers to stress or kill an individual cell in a dose- and time-dependent manner using a conventional confocal microscope equipped with a 405-nm laser. The method was applied to selectively ablate a single neuron within a dense network of surrounding cells in the zebrafish spinal cord. This approach revealed a dose-dependent response of the ablated neurons, causing the fragmentation of cellular bodies and anterograde degeneration along the axon within minutes to hours. This method allows researchers to study the fate of an individual dying cell and, importantly, the instant response of cells-such as microglia and astrocytes-surrounding the ablation site.
Введение
Люминесцентной микроскопии уже давно используется для изучения влияния трансгенов в данио ЦНС, в частности , их влияние на развитие 1. Микроскопии высокого разрешения позволило детальное отображение клеточных процессов , участвующих в развитии мозга, формирование мышц, и многих других мероприятий в области развития 2. Изучение смерти отдельной клетки была более сложной, в основном из-за технических трудностей индукции селективной клеточной гибели при выполнении стандартных процедур обработки изображений. Тем не менее, сочетание изображений разрешением одноклеточных и высокой релевантностью методов абляции позволяет исследовать непосредственные клеточные реакции на стресс и травмы, а также из последующих межклеточных взаимодействий. Понимание этих процессов имеет решающее значение, в особенности для нейродегенеративных заболеваний, таких как болезнь двигательного нейрона (БДН), где нейрон-глиальных взаимодействий, как было показано способствовать прогрессированиюболезни 3.
БДН, или боковой амиотрофический склероз (БАС), является разрушительным нейродегенеративным заболеванием, которое влияет на моторные нейроны в стволе головного мозга, моторной коры и спинного мозга. Потеря этих нейронов приводит к потере мышечной массы, и пациенты умирают в течение 3 - 5 лет после установления диагноза 4. Моторные нейроны в связи спинного мозга мышечных волокон и играют существенную роль в обеспечении сокращения мышц. Несоблюдение этого сообщения или смерти этих нейронов постепенно ослабляет мышцы и влияет на способность пациента глотать, ходить, говорить и дышать. Визуальное смерть мотонейрона и краткосрочные последствия в живом организме животного дает прекрасную возможность лучше понять динамические процессы, связанные с нормальным клеточного гомеостаза и болезни.
Данио появились как привлекательная модель системы для изучения нейродегенеративных заболеваний 1. Этаиз-за преимуществ, предлагаемых этой модели организма, такие как внешнее оплодотворение, короткое время развития, оптический доступ к нервной системе, а также простоты трансгеноза. Кроме того, способность легко генерировать соединение трансгенного данио позволяет несколько стратегий маркировки различных типов клеток. Генетическая абляция подходы , чтобы убить конкретные типы клеток позволяют довольно широкое возмущение, но им не хватает тонкой регулировки ориентации отдельных ячеек 5. С помощью лазера методы, с другой стороны, обеспечивают точную временную и пространственный контроль и были использованы для различных моделей на животных. В то время как большинство подходов используют специализированное оборудование, такие как импульсные лазеры 6, 7, 8, 9, 10, 11, 12 или Двухфотонное Наладки 13, другойисследовательские группы недавно воспользовались УФ - лазером в обычных микроскопов софокусных 14.
Техника, описанная здесь сочетает в себе с высоким разрешением конфокальной микроскопии с лазерным опосредованную подход УФ, чтобы вызвать клеточный стресс или смерти в зависимости от дозы в отдельных двигательных нейронов. Он основан на использовании широко установленной 405-нм лазер, был успешно испытан в клеточной культуре и в живых животных, а также позволяет подробную характеристику клеточных взаимодействий, таких как микроглии клиренс после гибели нервных клеток.
протокол
Примечание: Дизайн, проведение и отчетность экспериментов на животных должны принимать во внимание нынешних руководящих принципов 15. Такая работа должна быть заранее утверждены местным органом по защите здоровья животных (в нашем случае, Комитета по этике животных из Macquarie University).
1. Подготовьте данио для монтажа и УФ-Cell абляции
- Сформировать данио (Danio rerio) , выражающая флуоресцентные белки.
- Чтобы выразить флуоресцентные белки , представляющие интерес в данио, выполняют инъекции плазмиды в стадию одной ячейки данио яйца (как описано в другом месте 16) или использовать флуоресцентные трансгенных линий. Для обозначения нескольких типов клеток, создавать составные трансгенных данио линии путем скрещивания линий, установленных трансгенные, имеющих отношение к вопросу о заинтересованности. Поместите один мужчина и одна женщина данио на каждой стороне ложного дна пары сопрягаемой бака вечером и снимите перегородку с наступлением светаНа следующее утро (как подробно описано в другом месте 17). Держите данио при 28 ° C и обрабатывать их в соответствии с установленными протоколами 17, 18.
- Сбор эмбрионов после успешного нереста, напрягая резервуар для воды, содержащей эмбрионы через пластиковую ситечко. Промыть яйца с водой системы и передавать их в яичном воду в чашке Петри.
- Осмотрите их под световым микроскопом, чтобы определить, оплодотворение. Магазин оплодотворенных яиц в чашку Петри и поместить их в термостате при 28 ° С 18.
- Необязательно: Выполните микроинъекции для обозначения конкретных клеточных популяций.
Примечание: Это альтернативный метод, который позволяет для экспрессии и визуализации белков, без необходимости увеличения стабильных трансгенных линий. Этот метод также является преимуществом, когда интересующий белок является токсичным и запрещает генерацию стабильной трансгенные линии.- Впрыскивать плазмидные конструкции в стадию одноклеточного из эмбрионов данио, как описано в другом месте 19, 20, 21.
Примечание: Этот метод приводит к мозаичной экспрессии интересующего белка. Интерес белок приводится в движение от промотора выбора (например, islet1 22, -3mnx1 23, 24, встретил 25 или MPEG1 26) по бокам Tol2 инвертированные повторы 20.
- Впрыскивать плазмидные конструкции в стадию одноклеточного из эмбрионов данио, как описано в другом месте 19, 20, 21.
- Возраст рыбы до нужного размера.
- Поднимите рыбу до 3 - 5 дней после оплодотворения (DPF) и поместите их под флуоресцентным микроскопом соединение. Экран животных для соответствующего выражения флуорофора и выберите ярко меченого рыбу. Отделить соответствующие личинки в другое блюдо с яичным водой для встраивания в концег (на магазин в 28 ° C инкубаторе).
Дополнительно: Эмбрионы могут быть помещены в 0,2 мМ 1-фенил-2-thioures раствора (PTU) Рингера через 24 ч после оплодотворения (HPF), чтобы ингибировать образование пигментации. Необходимо соблюдать осторожность, с PTU, так как он является токсичным и может иметь неблагоприятные физиологические, генетические или морфологические эффекты. - Для исследований на ранней стадии развития (<2 денье), dechorionate эмбрионов вручную при помощи острых щипцов. Dechorionate большое количество эмбрионов ферментативным путем добавления проназу (2 мг / мл) к яичной воды и выдержки их в термостате в течение 10 мин при 28 ° С.
- Проходят эмбрионов периодически через пипетки Пастера пластиковой, чтобы облегчить dechorionation. Завершение процесса, когда большинство эмбрионов вышли из своих хорионов, промывая их несколько раз с яичным водой.
- Поднимите рыбу до 3 - 5 дней после оплодотворения (DPF) и поместите их под флуоресцентным микроскопом соединение. Экран животных для соответствующего выражения флуорофора и выберите ярко меченого рыбу. Отделить соответствующие личинки в другое блюдо с яичным водой для встраивания в концег (на магазин в 28 ° C инкубаторе).
- Подготовка решения для данио вложения в агарозы.
- Готовят раствор анестезии путем добавления 4 г / л (MS222 Tricaine маточного раствора, рН 7,0)по каплям к чашке Петри, содержащие яичный воду. Доза 50 мг / л является рекомендуемая начальная точка (рис 1А).
- Подготовить запас агарозы легкоплавкого (0,8 - 1,5%) в яичном воде и аликвоту его в микропробирок 1,5 мл. Поместите аликвоты в блок предварительно нагретую тепла (38 - 40 ° C) и дайте ему уравновешиваться до заданной температуры (~ 30 мин; Рисунок 1В).
- Дополнительно: Для более долгосрочной визуализации (> 4 ч), подготовить небольшую агарозном круг в пределах 35 мм со стеклянным дном чашки Петри и дайте ей установить (Дополнительный рисунок 1).
ПРИМЕЧАНИЕ: Этот дополнительный шаг был эффективен в предотвращении любого перемещения всей агарозном капли с данио в течение более длительных сроков.- Чтобы сделать это, место ~ 300 мкл агарозы по внутренней окружности со стеклянным дном блюдо приготовить в форме пончика круг с небольшим отверстием посередине , в котором поместить рыбу (этап 1.5.3; Дополнительный рисунок 1) ,
- Установите данио в агарозы для микроскопии.
- Выберите 1 - 3 из предварительно просеивают рыбы для абляции и обезболить личинки, переводя их ( с помощью пипетки передачи) в чашку с раствором анестезии (этап 1.4.1; фиг.1С; примерно 5 мин).
Примечание: Рыба наркозом, когда они показывают неполную оперкулярной движение и снижение частоты сердечных сокращений и больше не показывать сенсорный ответ вызвал побег (TEER, неспособность уплыть после нежно касаясь их хвост с кисточкой). Обеспечить соответствующую анестезию за этичное отношение рыбы и предотвратить подергивания при переносе в агарозном или воздействием флуоресцентного света. - После анестезии подтверждается, подлизываться личинка с помощью регулируемого пипетку (с обрезанной 200 мкл наконечника установлен в ~ 30 мкл) и дайте ему опуститься на дно наконечника. Передача личинку в предварительно разогретой агарозы (этап 1.4.2), выпуская каплю жидкости сЛичинка в агарозы (стараются свести к минимуму количество яичного воды происходит в агарозы; Рисунок 1D).
- Всасывать рыбу в окружении агарозы. Разлить его быстро в предварительно подготовленную со стеклянным дном 35-мм блюдо.
- Используйте рассечение микроскоп и стандартную кисть (длинная подкладка, размер 1) , чтобы поместить животное в пределах агарозы на стороне (голову влево) так, чтобы тело и хвост плоские (рис 1E). При работе с несколькими рыбами, выравнивать всю рыбу в блюдо таким образом, чтобы они легко найти с помощью конфокальной микроскопии позже.
ПРИМЕЧАНИЕ: Быстро выполнять эту процедуру позиционирования и выравнивания (это может потребовать некоторой практики, так как агарозном начинает устанавливать сразу же после воздействия низких температурах). - Оставьте агарозном встраиваемый рыбу в течение 10 - 15 мин, пока агароза не установлено твердо. Осторожно долить 35-мм чашки Петри с ~ 2 мл воды , содержащей яйца Tricaine (рис 1F).
- Выберите 1 - 3 из предварительно просеивают рыбы для абляции и обезболить личинки, переводя их ( с помощью пипетки передачи) в чашку с раствором анестезии (этап 1.4.1; фиг.1С; примерно 5 мин).
2. Настройка конфокальной микроскопии и визуализации параметров
- Поместите чашку Петри со встроенным личинку на конфокальной столик микроскопа и сосредоточиться на спинной стороне спинного мозга животного (с использованием светлого поля). Осмотрите животное под соответствующим увеличением (40х) и флуоресцентного настройки и визуализировать структуру интереса (например, интенсивность флуоресценции меченых нейронов или микроглии движения) , чтобы подтвердить , что все параметры визуализации являются необходимы для последующего абляции (Рисунок 2). Мы обычно используем цель 40X для выполнения наших исследований времени замедленной.
- Необязательно: Для того, чтобы провести исследование замедленную в течение нескольких часов, желательно записать один или несколько временных точках до удаления , чтобы установить невозмущённую физиологический ответ клетки и ее окружения (например, микроглии движение установить базовую скорость и моторики).
- Определить толщину структурыЮр интерес для УФ лазерной абляции.
- С помощью Z-Drive, проверьте верхнюю и нижнюю часть интересующей структуры (например, ячейка сома) путем ручной фокусировки вверх и вниз. Примечание вниз плоскости г , который будет ABLATED (например, в центре ячейки).
Примечание: Из опыта, этот метод является наиболее эффективным путем ориентации нейронов спинного мозга , которые были ярко меченые (высокое отношение сигнал-шум , что позволяет легко визуализировать покадровой после абляции, например, рисунок 4) и абляции середине сомы клеток. Клеточное ядро флуоресценция может быть преимуществом, чтобы обеспечить правильную ориентацию и высокую эффективность абляции.
- С помощью Z-Drive, проверьте верхнюю и нижнюю часть интересующей структуры (например, ячейка сома) путем ручной фокусировки вверх и вниз. Примечание вниз плоскости г , который будет ABLATED (например, в центре ячейки).
3. Выполните Целевые лазерной абляции отдельных клеток в данио спинного мозга
Примечание: Для этого абляции и визуализации подход был использован конфокальный микроскоп (Leica SP5). Процедура абляции с использованием 405-нм диод для клеточно-специфической Destгвалт подробно описана в соответствии с программным обеспечением (Leica Application Suite, v2.7.3.9723). Тем не менее, любой обычный конфокальный микроскоп, который оснащен 405-нм лазером и FRAP (восстановление флуоресценции после фотообесцвечивания) или модуль отбеливателя позволит производительность одних и тех же клеточных манипуляций, но потенциально с немного разными настройками, параметры и имена.
- Запустите мастер FRAP, нажав на раскрывающемся меню в верхней части меню программного обеспечения (Рисунок 3А, 1 и 2). Обратите внимание новое окно с различными шагами , что позволяет наладка конкретных параметров для лазерной абляции (рис 3B, 3).
- Определение параметров изображения для абляции подхода путем выбора формата, скорость сканирования (фигура 3В, 4), и в среднем (фигура 3В, 5). Формат изображения 1,024 х 1,024 при скорости сканирования 400 Гц и линиив среднем 4 был наиболее применимым.
ПРИМЕЧАНИЕ: Там обычно нет необходимости изменять спектральную обнаружения (например, возбуждения или эмиссионных характеристик), так как они были определены в предыдущем приобретения.- Если еще не был выбран г-плоскости для абляции (как описано в пункте 2.4.), Нажмите кнопку "Live" и фокус через образец, пока люминесцентный структура или требуемую г-плоскость, которая будет абляции пока в фокусе.
- После того как общие параметры изображения установлены, доступ к "Bleach" шаг (фиг.3С, 6) для управления конкретных компонентов абляции.
Примечание: Комбинация интенсивности лазерного излучения (рис 3С, 8), скорость сканирования, а усреднение, которое было установлено на шаге 3.2 (рис 3В, 4 и 5), а также количество повторений , которые будут установлены в шаг 3.5 (рисунок 3E,12), будет определять общее время задержки УФ - лазера на ROI, и , следовательно, эффективность отбеливания.- Включите 405-нм лазер путем активации его для процедуры отбеливания (рис 3C, 8).
Примечание: Наиболее успешно с указанными выше параметрами была достигнута при интенсивности лазерного излучения 405 нм в диапазоне от 60 - 80% в нашей экспериментальной установки. Имейте в виду, что этот выходной мощности лазера приборостроение специфичны и будет отличаться для каждой конфокальной установки. - Используйте "наезда" вариант (рис 3C, 7) , чтобы максимизировать интенсивность отбеливания в выбранной ROI за счет уменьшения поля сканирования, поэтому максимальное время задержки. В качестве альтернативы, используйте опцию "Bleach" точка программного обеспечения выбора для этого процесса.
- Включите 405-нм лазер путем активации его для процедуры отбеливания (рис 3C, 8).
- Выберите один или несколько трансформирования (рис 3D, 10) абляции с помощью любого из инструментов рисования на ветру захвата изображенийвл (рис 3D, 9). Цель аксона бугор, например, с круглым инструментом рисования приблизительно 4 - 8 мкм.
Примечание: Область абляции регулируется в пределах от одного пикселя к большей площади, в зависимости от применения. - После установления ROI, нажмите кнопку "Time Course" (рис 3E, 11) и подтвердить количество циклов трансформирования будут проверяться / абляции (рис 3E, 12). Выберите "Pre-отбеливатель" и кадры "Post-Bleach" как хотелось бы, чтобы обеспечить обзор всего изображения непосредственно перед и сразу после процесса отбеливания.
- После установления всех необходимых параметров абляции, нажмите кнопку "Выполнить эксперимент" (рис 3E, 13) и контролировать эффективность абляции.
Примечание: В нашей установке FRAP, одно изображение будет принято до и после цикла FRAP с соответствующим лазером еxcitation (например, 488 нм возбуждения для EGFP-экспрессирующих клеток). Эти пред- и пост-абляции снимки позволяют быстро судить о том, как удовлетворительно ROI отбеливают и насколько эффективны выбранные параметры абляции. - Повторите процесс путем регулировки интенсивности лазерного излучения (фиг.3С, 8), скорость сканирования и усреднения (фигура 3В, 4 и 5), и повторы (рис 3E, 12) в случае , если выбранный ROI по- прежнему показывает высокую интенсивность флуоресценции после завершения FRAP цикл.
4. Выполните процедуры последующих действий, в том числе рыбы "спасения" или удалением
- Если эксперимент терминал, усыпить животное с передозировкой Tricaine. Удалите яйца воду и заменить его наркотизации маточного раствора в течение 10 мин. Для обеспечения эвтаназию, проверить под микроскопом для прекращения сердечных сокращений.
- Необязательный:Если эксперимент не терминал, удалите рыбу осторожно из агарозы с тонким пинцетом и кисточкой. Поместите рыбу в пресной воде яйца и дайте ему восстановиться под наблюдением в течение 15 мин. Если нормальное поведение плавание возвращается, вернуть рыбу в инкубатор.
- Утилизировать трансгенных животных в соответствии с потоком отходов утвержденном GMO учреждения.
Результаты
Описанный здесь метод позволяет абляции моторных нейронов в данио спинного мозга с использованием модуля FRAP коммерческого конфокальной микроскопии. Трансгенные линии данио , которые выражают зеленого флуоресцентного белка в нейронах под контролем специфических промоторов, таких как - 3mnx1, islet1, или Met, были использованы. Экспрессия GFP под контролем промотора мотонейронов (например, -3mnx1 или выполнены) позволяет с высокой разрешающей способностью визуализации клеточных тел, основными аксонов и периферических ветвей , простирающихся к мышцам (рисунок 4 и видео 1).
Нейроны в спинном мозге от 3- до 5-дневного возраста рыбы были успешно абляции, с общим временем пребывания 60 - 80 с при мощности лазера ~ 70%, а общие параметры, описанные в шаге 3. Успешное абляции достигается, когда флуоресценция затухает сразу после ампутациии никогда не возобновится (рисунок 5, C и D). Попытки абляции с другими лазерными линиями (например, лазерной линии 488 нм) не приводило к постоянному выцветания, и флуоресценции был восстановлен в короткие сроки. Важно отметить, что эта методика продемонстрировала характерные признаки апоптотической гибели клеток в УФ-абляции нейронов, таких как наличие аннексина V, согласующихся морфологических изменений сомный дегенерации и аксонов блеббинга из абляцированную нейроне 27.
Специфичность этого подхода подтверждена в экспериментах с использованием photoconvertible флуорофор Каед (который переключает излучение зеленого до красного после облучения ультрафиолетовым светом), где был преобразован один целевой нейрон (рисунок 5, А и В) , без признаков клеточного разрушение в течение нескольких часов. Использование более высокой мощности лазера вместо приводит то исчезновение целевого нейроне (без фотоконверсии или повторного появления флуоресценции) и фотоконверсии (без смерти) клеток в непосредственной близости (~ 20 мкм) к месту абляции (рисунок 5, C и D).
Одним из важных преимуществ этого лазерного метода абляции доза зависимости от подхода. Для того, чтобы клетки - мишени , с различной интенсивностью, несколько слоев тонкой настройки доступны путем регулировки мощности лазера (фиг.3С, 8), скорость сканирования и линии усреднения (фигура 3В, 4 и 5), размер ROI будет абляции (Рисунок 3D, 10), и повторы (рис 3E, 12). Следует отметить, что этот подход может быть также использован для применения клеточного стресса на отдельные клетки, а не вызывать гибель клеток. Например, тонкая настройка былавесьма ценным для оценки клеточных процессов во время смерти нейрона. Моторные нейроны с длинными аксонов выступами , которые были ABLATED с интенсивности лазерного излучения ниже УФ выявили характерную "блеббинг" (формирование и фрагментации клеточных пузырьках), которая началась на целевом сомы и продолжается вдоль аксона с течением времени (40 - 90 мин; Рисунок 4 ; 3D визуализации фильм этого абляции в видео 1). Следовательно, модулировать различные параметры лазерной абляции и, следовательно, уровень индуцированного клеточного стресса и временной ход смерти позволяет исследователям высокий уровень экспериментальной гибкости.
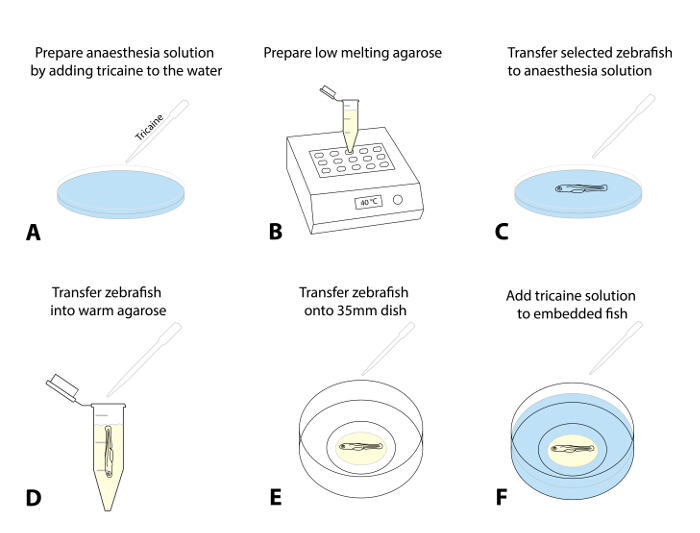
Рисунок 1: Вложение данио для живого изображения. (AF) , процедура живого изображения Встраивание: (А) Tricaine добавляется в яичном воды для анестезировать данио A та дозы начальная 50 мг / л. (Б) агарозы с низкой температурой плавления (0,8 - 1,5%) получают и нагревают до 38 - 40 ° C. (С) С помощью пипетки передачи, экранированный и выбранный данио переносят в кювету с раствором Tricaine. После успешного седации (мелкой оперкулярной движения, снижение частоты сердечных сокращений, отсутствие сенсорного вызвало ответ), рыба переносится в предварительно нагретый агарозы (D). Сведение к минимуму количества яичного воды, которая переносится в агарозы, чтобы предотвратить его последующего разбавления. (Е) Перенос капли агарозы (~ 30 - 50 мкл) , содержащую данио на стеклянным дном 35-мм блюдо. Выполните это под микроскопом рассечение и использовать щетку, чтобы аккуратно выровнять данио к предпочтительной ориентации. Подождите 10 - 15 мин, пока агароза не установлен, и добавить ~ 2 мл раствора Tricaine к блюду (F).апк "> Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этой фигуры.
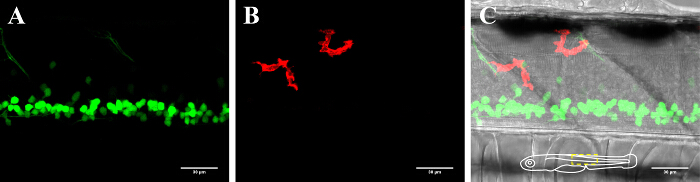
Рисунок 2: Визуализация нейронов и микроглии в спинном мозге в 3-DPF данио рерио. Визуализация микроглии и нейронов в спинном мозге 3-дневного возраста трансгенной данио выражения (А) GFP-позитивных нейронов (islet1: GFP) и (B) mCherry-положительных микроглии (MPEG1: GAL4, UAS: mCherry). (C) Композитный изображение нейрона и микроглии канала вместе с ярко-поле изображения. Схематическое вставки в (С) изображает ориентацию рыбы и очерчивает представленную область. Шкала бар = 30 мкм. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.

Рисунок 3: Этапы в процессе УФ лазерной абляции (как указано в протоколе, шаг 3). Шаги для управления модулем FRAP программного обеспечения в конфокальной программного обеспечения (Leica Application Suite). (A) Запуск модуля FRAP в качестве инструмента для выполнения УФ лазерной абляции. (B) Настройка Z-плоскости для абляции и другие FRAP параметры , такие как формат, скорость и усреднения, которые будут определять время задержки лазера. (C) Контроль интенсивности лазерного излучения и "Наезд" , чтобы максимизировать эффективность отбеливания. (D) Выбор одной или нескольких областей интереса (ROI) , который будет абляции. (E) Установка времени курс отбеливания определяет циклы отбеливатель и общее время лазерного ожидания на трансформирования. Пожалуйста , нажмите ее е, чтобы просмотреть большую версию этой фигуры.
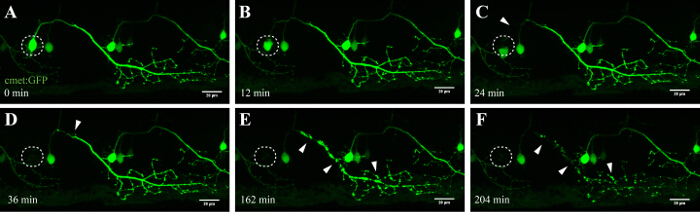
Рисунок 4: Антероградный вырождение УФ-абляции нейроне. Покадровый томография нейродегенерацией УФ-абляции спинного нейроне. (AF) УФ-облучение одного спинного нейроне (встречались: GAL4, UAS: EGFP; A; круг) привело к сомы нейрона сокращающейся и округление в течение долгого времени (AC), а затем аксонов фрагментации (CF, наконечники стрел) , Дегенерация аксонов началось на сомы (сайт абляции) и прогрессировало Антероградный в направлении дальнего конца аксона , пока , наконец, флуоресценция в сомы исчез и весь аксон показал "блеббинг" (DF). Шкала бар = 20 мкм. 3D-визуализации в заданный промежуток времени фильм этой абляции показано на видео 1.эс / ftp_upload / 54983 / 54983fig4large.jpg "целевых =" _blank "> Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этой фигуры.
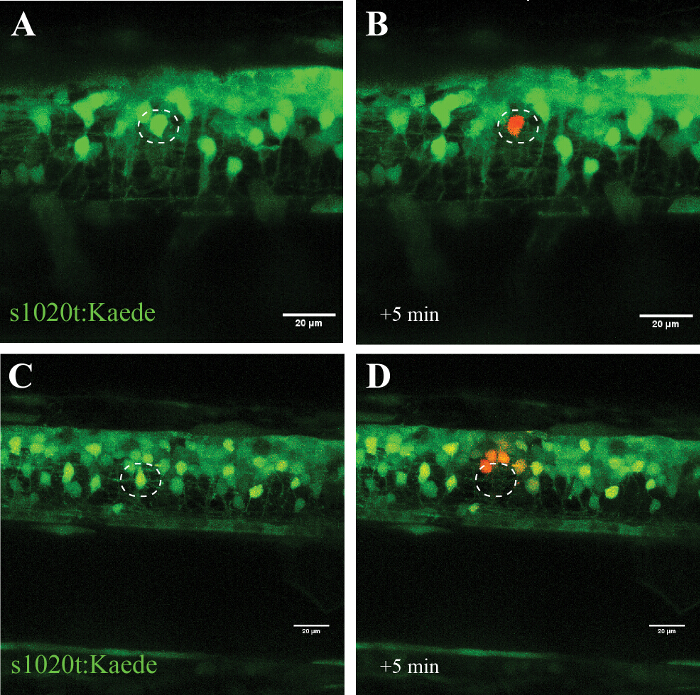
Рисунок 5: Подтверждение влияния УФ - облучения одноклеточного с использованием photoconvertible флуорофор (Каед) в двигательный нейрон. Проверка УФ-облучения одноклеточного через активацию photoconvertible флуорофор Kaede в нейроне. (AD) УФ - облучение нейронов , меченных Kaede. (A) фотопревращения одного нейрона (круг) с мощностью лазера на 30% в течение 10 сек привело к фотопревращения Kaede (от зеленого до красного) только целевой индивидуальной нейроне (B). Обратите внимание, что преобразованное клеток выживали в течение нескольких часов и не показали никаких видимых признаков износа, таких как блеббинга или округление. Абляция одного нейрона (C ; круг) с более высокой мощностью лазера (95% в течение 10 с) , приводило к немедленному исчезновению этого нейрона (D) и последующим фотопревращения Kaede в небольшом количестве окружающих нейронов в радиусе приблизительно 20 мкм. Шкала бар = 20 мкм. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
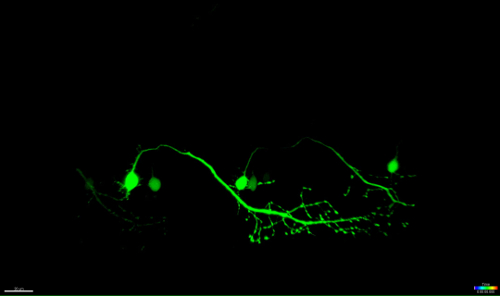
Видео 1: 3D поверхность рендеринга (Imaris) УФ - абляции нейроне , показанного на рисунке 4.
Замедленная видео нейроне, изображенной на рисунке 4 поверхность визуализации с помощью программного обеспечения визуализации (Imaris, битовой плоскости). Она освещает процесс усыхание абляцированную сомы, а затем аксонов фрагментации anterogradely по направлению к дистальному концу клетки.euron_ablation-3D_rendered.mov "целевых =" _blank "> Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительное Рисунок 1: Дополнительный агарозы литой для длительной съемки.
Для того, чтобы избежать перемещения рыбы и агарозы в течение длительного срока приобретения подготовить пончик образный круг агарозы по краям в середине стеклянным дном 35 мм блюдо (A). Пусть агарозном набор для ~ 10 мин и переносят рыбу во внутренний круг с каплей агарозы (B). Постарайтесь свести к минимуму количество агарозы для вложения (чистить излишки агарозы наружу после того, как ориентирование рыбы). Пожалуйста , нажмите здесь , чтобы загрузить этот файл.
Обсуждение
Лазерная абляция подходы
С помощью лазера методы абляции позволяют точное нацеливание индивидуальных или небольших групп клеток. Комбинируя эту технику с высокой разрешающей способностью микроскопии и генетических манипуляций на животных моделях, таких как данио позволяет исследователям систематически изучать судьбу отдельной клетки и взаимодействия после травмы.
УФ (405 нм), протокол лазерной абляции, описанный здесь описывается, как отдельные клетки могут быть подчеркнуты или убиты избирательно (в зависимости от дозы), в то время как соседние нейроны, глиальные клетки, и аксоны остаются невредимыми. Мы успешно использовали этот подход в экспериментах на клеточных культурах и описать здесь детальный подход к данио спинного мозга. Покажем реализацию этого подхода в данио спинного мозга избирательно подчеркивая индивидуальный нейрон в сети других клеток (рисунок 5, А и В), или убивая одного нейрон немедленно и без восстановления (рисунок 5, C и D).
Ранее специализированные лазерные системы, такие как лазер импульсного азота или лазерных систем двухфотонных, должны были вызвать повреждение тканей и двигательного нерва transections 10, 11, 12, 13. Эти лазерные системы были успешно использованы , чтобы привести к повреждению клеток, таких как тромбоз в артерий и вен 6, острое повреждение почек 7, сердечной травмы 8, а также изучить волны кальция и микроглии ответ после травмы головного мозга 9. Кроме того, Сустель и его коллеги использовали обычную установку конфокальной (351 нм и 364 нм УФ - лазеров) , чтобы вызвать повреждение эпителиального и глиальных клеток у дрозофилы 14 </ SUP>.
Актуальность Zebrafish моделей для понимания ALS (и других заболеваний человека)
Рерио являются широко используемой моделью организма, особенно для исследований в области развития 28, 29, 30. В то время как у них есть определенные ограничения, их потенциал, чтобы моделировать заболевания человека и дать понимание патогенных молекулярных механизмов огромен. Рыбок данио модели были хорошо созданы для изучения БДН и привели к важным молекулярными прозрений 31, 32, 33, 34. Трансгенные данио линии могут быть быстро генерируются (4 - 5 месяцев) и позволяют селективную отслеживание определенного типа клеток, особенности, которые делают их ценным дополнением к текущим моделям животных АЛС. Эмбрионы рыбок данио / личинки являются оптически прозрачными и предлагают уникальный Experiпсихические преимущества, которые позволяют долгосрочное живого создания образа на уровне одной клетки в головном мозге или спинном мозге, который не может быть легко достигнуто в моделях грызунов (или в организме человека). В сочетании с молекулярными методами, такими как одноклеточного абляции, это обеспечивает уникальную экспериментальную платформу для изучения точных молекулярных механизмов в естественных условиях.
Двигательными нейронами могут быть Избирательно Targeted Использование УФ лазерной абляции
Нейронов спинного мозга в данио начинают развиваться в течение 10 ч после рождения и устанавливаются приблизительно через 48 ч 35, 36. Такое быстрое развитие позволяет визуализацию этих нейронов в короткие сроки и с высокой пропускной способностью. Моторные нейроны обеспечивают необходимую связь между мозгом и мышцами и, в БАС, поражаются в моторной коре (верхние моторные нейроны), ствола головного мозга и спинного мозга (нижние моторные нейроны). Потеря этих нейронов неизбежно приводит к мюSCLE атрофия и слабость. Двигательные нейроны в спинном мозге данио могут быть идентифицированы по их различных проекций и использованием мотор-нейрон конкретных промоутеров , как -3MNX1. Ориентация клеток сомы таких нейронов выступающими выявили антероградную вырождение вдоль аксонов проекции с течением времени (рис 4 и видео 1). Одноклеточный разрешение визуализации спинальных двигательных нейронов дополнительно подтвердили транслокацию фосфатидилсерина и последующее аннексина V-маркировки после лазерной абляции (смотри рисунок 4 и Дополнительное видео 3 в 27). Хотя мы сообщаем об активации аннексина V в смерти нейронов после нашего УФ лазерной абляции подхода, мы не можем быть уверены, что каскад смерти, который запускается в течение этого ускоренного процесса, точно соответствует гибели нейронов, которая происходит во время нейродегенеративных или нормального клеточного гомеостаза.
Хотя это абляция подход очень воспроизводимыеи конкретные, различные стратегии вложения также могут влиять на эффективность УФ-абляции. По нашему опыту, это было самым успешным, чтобы минимизировать слой агарозы мы внедренного нашу рыбу. Более толстые слои вложение среды с дополнительным слоем яичного воды может привести к снижению мощности УФ излучения, в конечном счете, полученную клеткой вследствие затухания и эффектов рассеяния, которые происходят вдоль пути луча.
В будущем, пересечение различных трансгенных рыб линий позволит визуализации немедленного и краткосрочных (до 12 ч) ответы других пораженных клеток, таких как глии, к разрушению лазериндуцированной клеток. Например, астроциты и не-клеток автономной токсичности при нейродегенеративных расстройств , таких как БАС были в научно - исследовательском центре внимания и в значительной степени участвуют в патогенностью спорадической и семейной ALS 37, 38. Однако механизмы, лежащие в основе глиальных токсичности и селективностик двигателю нейроны остаются неясными. Мы и другие недавно воспользовались этим подходом к изучению полном охвате смерти нейронов путем микроглии и визуализировали клиренс нейрональных остатков 27, 39, 40.
Сочетание техники абляции с микроскопии высокого разрешения и маркеров для нейровоспаления позволит исследователям в будущем расширить понимание функции одноклеточных и взаимосвязанных клеточных систем. Характеристика этих процессов в обстановке в естественных условиях имеет решающее значение не только в условиях развития , но и в моделях нейродегенеративных заболеваний, в том числе БДН, где клеточные взаимодействия могут быть нарушены 3, 41.
Раскрытие информации
The authors declare that they have no competing financial interests.
Благодарности
This work was supported by the MND Research Institute of Australia and the Cure for MND Foundation [GIA 1638], the Snow Foundation, and Macquarie University [MQRDG 9201401462]. Imaging was carried out at the Microscopy Facility in the Department of Biomedical Sciences, Macquarie University. Other members of the MND research center are thanked for their contributions to the development of these methods and fish lines.
Материалы
| Name | Company | Catalog Number | Comments |
| Agarose low melting | Fisher-Scientific | Dissolve in egg water with tricaine (0.02%) at 0.8 - 1.5% | |
| Tricaine | Argent Labs | MS-222 | 0.02% |
| Harvard standard wall Borosilicate with filament Capillary Glass | World Precision Instruments, Inc. | GC100F-10 (short) GC100F-15 (long) | Pull to a resistance of 2 - 7 MΩ |
| Egg water | 0.6 g Instant Ocean sea salt, 4 mL of 1 mg/mL methylene blue in 10 L deionized water | ||
| 1-phenyl-2-thiourea (PTU) | Sigma | P7629 | |
| Pronase | Sigma | 10165921001 | |
| Heat block | Select BioProducts | Digital block heater (SBD110_) | |
| Microinjection apparatus | World Precision Instruments, Inc. | Microinjection was performed by hand under a steromicroscope (Leica) with a loaded glass needle and a Picospritzer II (General Valve corporation) | |
| Stereoscope | Leica | Bright field illumination microscopy was performed on a Leica M165FC stereo dissection microscope (Leica) | |
| Microscope | Leica | SP5 | |
| 35 mm glass bottom dish | MatTek Corporation | P35G-0-20-C |
Ссылки
- Becker, T. S., Rinkwitz, S. Zebrafish as a genomics model for human neurological and polygenic disorders. Dev Neurobiol. 72 (3), 415-428 (2012).
- Wilt, B. A., et al. Advances in light microscopy for neuroscience. Annu Rev Neurosci. 32, 435-506 (2009).
- Philips, T., Robberecht, W. Neuroinflammation in amyotrophic lateral sclerosis: role of glial activation in motor neuron disease. Lancet Neurol. 10 (3), 253-263 (2011).
- Robberecht, W., Philips, T. The changing scene of amyotrophic lateral sclerosis. Nat Rev Neurosci. 14 (4), 248-264 (2013).
- White, D. T., Mumm, J. S. The nitroreductase system of inducible targeted ablation facilitates cell-specific regenerative studies in zebrafish. Methods. 62 (3), 232-240 (2013).
- Jagadeeswaran, P., Paris, R., Rao, P. Laser-induced thrombosis in zebrafish larvae: a novel genetic screening method for thrombosis. Methods Mol Med. 129, 187-195 (2006).
- Johnson, C. S., Holzemer, N. F., Wingert, R. A. Laser ablation of the zebrafish pronephros to study renal epithelial regeneration. J Vis Exp. (54), e2845(2011).
- Matrone, G., et al. Laser-targeted ablation of the zebrafish embryonic ventricle: a novel model of cardiac injury and repair. Int J Cardiol. 168 (4), 3913-3919 (2013).
- Sieger, D., Moritz, C., Ziegenhals, T., Prykhozhij, S., Peri, F. Long-range Ca2+ waves transmit brain-damage signals to microglia. Dev Cell. 22 (6), 1138-1148 (2012).
- Lewis, G. M., Kucenas, S. Motor nerve transection and time-lapse imaging of glial cell behaviors in live zebrafish. J Vis Exp. (76), (2013).
- Rosenberg, A. F., Wolman, M. A., Franzini-Armstrong, C., Granato, M. In vivo nerve-macrophage interactions following peripheral nerve injury. J Neurosci. 32 (11), 3898-3909 (2012).
- Villegas, R., et al. Dynamics of degeneration and regeneration in developing zebrafish peripheral axons reveals a requirement for extrinsic cell types. Neural Dev. 7, 19(2012).
- O'Brien, G. S., et al. Two-photon axotomy and time-lapse confocal imaging in live zebrafish embryos. J Vis Exp. (24), (2009).
- Soustelle, L., Aigouy, B., Asensio, M. L., Giangrande, A. UV laser mediated cell selective destruction by confocal microscopy. Neural Dev. 3, 11(2008).
- Kilkenny, C., Browne, W. J., Cuthill, I. C., Emerson, M., Altman, D. G. Improving bioscience research reporting: the ARRIVE guidelines for reporting animal research. PLoS Biol. 8 (6), 1000412(2010).
- Essentials of Biology 2. JoVE. , JoVE Science Education Database. Mouse, Zebrafish, and Chick. Zebrafish Microinjection Techniques (2016).
- Avdesh, A., et al. Regular care and maintenance of a zebrafish (Danio rerio) laboratory: an introduction. J Vis Exp. (69), e4196(2012).
- Westerfield, M. The zebrafish book. A guide for the laboratory use of zebrafish (Danio rerio).Vol.4th ed. , Univ. of Oregon Press. Eugene. (2000).
- Clark, K. J., Urban, M. D., Skuster, K. J., Ekker, S. C. Transgenic zebrafish using transposable elements. Methods Cell Biol. 104, 137-149 (2011).
- Kwan, K. M., et al. The Tol2kit: a multisite gateway-based construction kit for Tol2 transposon transgenesis constructs. Dev Dyn. 236 (11), 3088-3099 (2007).
- Rosen, J. N., Sweeney, M. F., Mably, J. D. Microinjection of zebrafish embryos to analyze gene function. J Vis Exp. (25), (2009).
- Higashijima, S., Hotta, Y., Okamoto, H. Visualization of cranial motor neurons in live transgenic zebrafish expressing green fluorescent protein under the control of the islet-1 promoter/enhancer. J Neurosci. 20 (1), 206-218 (2000).
- Arkhipova, V., et al. Characterization and regulation of the hb9/mnx1 beta-cell progenitor specific enhancer in zebrafish. Dev Biol. 365 (1), 290-302 (2012).
- Flanagan-Steet, H., Fox, M. A., Meyer, D., Sanes, J. R. Neuromuscular synapses can form in vivo by incorporation of initially aneural postsynaptic specializations. Development. 132 (20), 4471-4481 (2005).
- Hall, T. E., et al. The zebrafish candyfloss mutant implicates extracellular matrix adhesion failure in laminin alpha2-deficient congenital muscular dystrophy. Proc Natl Acad Sci U S A. 104 (17), 7092-7097 (2007).
- Ellett, F., Pase, L., Hayman, J. W., Andrianopoulos, A., Lieschke, G. J. mpeg1 promoter transgenes direct macrophage-lineage expression in zebrafish. Blood. 117 (4), 49-56 (2011).
- Morsch, M., et al. In vivo characterization of microglial engulfment of dying neurons in the zebrafish spinal cord. Front. Cell. Neurosci. , (2015).
- Grunwald, D. J., Eisen, J. S. Headwaters of the zebrafish -- emergence of a new model vertebrate. Nat Rev Genet. 3 (9), 717-724 (2002).
- Lele, Z., Krone, P. H. The zebrafish as a model system in developmental, toxicological and transgenic research. Biotechnol Adv. 14 (1), 57-72 (1996).
- Veldman, M. B., Lin, S. Zebrafish as a developmental model organism for pediatric research. Pediatr Res. 64 (5), 470-476 (2008).
- Kabashi, E., et al. Gain and loss of function of ALS-related mutations of TARDBP (TDP-43) cause motor deficits in vivo. Hum Mol Genet. 19 (4), 671-683 (2010).
- Laird, A. S., et al. Progranulin is neurotrophic in vivo and protects against a mutant TDP-43 induced axonopathy. PLoS One. 5 (10), 13368(2010).
- Lemmens, R., et al. Overexpression of mutant superoxide dismutase 1 causes a motor axonopathy in the zebrafish. Hum Mol Genet. 16 (19), 2359-2365 (2007).
- Ramesh, T., et al. A genetic model of amyotrophic lateral sclerosis in zebrafish displays phenotypic hallmarks of motoneuron disease. Dis Model Mech. 3 (9-10), 652-662 (2010).
- Hanneman, E., Trevarrow, B., Metcalfe, W. K., Kimmel, C. B., Westerfield, M. Segmental pattern of development of the hindbrain and spinal cord of the zebrafish embryo. Development. 103 (1), 49-58 (1988).
- Lewis, K. E., Eisen, J. S. From cells to circuits: development of the zebrafish spinal cord. Prog Neurobiol. 69 (6), 419-449 (2003).
- Ilieva, H., Polymenidou, M., Cleveland, D. W. Non-cell autonomous toxicity in neurodegenerative disorders: ALS and beyond. J Cell Biol. 187 (6), 761-772 (2009).
- Philips, T., Rothstein, J. D. Glial cells in amyotrophic lateral sclerosis. Exp Neurol. 262, Pt B 111-120 (2014).
- Mazaheri, F., et al. Distinct roles for BAI1 and TIM-4 in the engulfment of dying neurons by microglia. Nat Commun. 5, 4046(2014).
- van Ham, T. J., Kokel, D., Peterson, R. T. Apoptotic cells are cleared by directional migration and elmo1- dependent macrophage engulfment. Curr Biol. 22 (9), 830-836 (2012).
- Radford, R. A., et al. The established and emerging roles of astrocytes and microglia in amyotrophic lateral sclerosis and frontotemporal dementia. Front Cell Neurosci. 9, 414(2015).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены