Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Картирование участок связывания аптамер на АТФ Использование Microscale Термофорез
В этой статье
Резюме
MicroScale Thermophoresis (MST) is a sensitive technology to characterize aptamer-target interactions. This manuscript describes an MST protocol to characterize aptamer-small molecule interactions.
Аннотация
Characterization of molecular interactions in terms of basic binding parameters such as binding affinity, stoichiometry, and thermodynamics is an essential step in basic and applied science. MicroScale Thermophoresis (MST) is a sensitive biophysical method to obtain this important information. Relying on a physical effect called thermophoresis, which describes the movement of molecules through temperature gradients, this technology allows for the fast and precise determination of binding parameters in solution and allows the free choice of buffer conditions (from buffer to lysates/sera). MST uses the fact that an unbound molecule displays a different thermophoretic movement than a molecule that is in complex with a binding partner. The thermophoretic movement is altered in the moment of molecular interaction due to changes in size, charge, and hydration shell. By comparing the movement profiles of different molecular ratios of the two binding partners, quantitative information such as binding affinity (pM to mM) can be determined. Even challenging interactions between molecules of small sizes, such as aptamers and small compounds, can be studied by MST. Using the well-studied model interaction between the DH25.42 DNA aptamer and ATP, this manuscript provides a protocol to characterize aptamer-small molecule interactions. This study demonstrates that MST is highly sensitive and permits the mapping of the binding site of the 7.9 kDa DNA aptamer to the adenine of ATP.
Введение
Взаимодействие между молекулами является основой природы. Таким образом, ученые во многих областях фундаментальных и прикладных исследований пытаются понять основные принципы молекулярных взаимодействий различных видов. Microscale Термофорез (MST) позволяет ученым осуществлять быстрый, точный, экономичный, и контроль качества характеристику молекулярных взаимодействий в растворе, со свободным выбором буферов. Есть уже более 1000 публикаций с использованием MST, с 2016 года в одиночку, описывая различные виды анализов, в том числе библиотеки скринингов, связывание валидаций событий, анализы конкуренции, а также эксперименты с несколькими партнерами связывания 1-8. В общем, МСТ позволяет исследовать классических параметров связывания, такие как аффинность связывания (стр.м.в мМ), стехиометрии и термодинамики, любого вида молекулярного взаимодействия. Большим преимуществом MST является возможность изучения связывания событий независимо от размера партнеров взаимодействия. Даже чалlenging взаимодействия между малыми аптамеров нуклеиновых кислот (15-30 нт) и задачи, такие как небольшие молекулы, лекарственные средства, антибиотики или метаболиты могут быть определены количественно.
Текущее состояние-оф-современные технологии для характеристики аптамеров-мишени взаимодействия либо лабораторного интенсивной и очень сложной или не в состоянии количественно аптамеров-малая молекула взаимодействиях 9,10. Поверхностного плазмонного резонанса (SPR) основе анализов 11,12 и действительно этикетки свободные калориметрических подходы, такие как изотермической калориметрии (титрования ITC), 13-15 изократическим элюирования 16, равновесному инфильтрации 17,18, рядный зондирования 19, гелеобразные анализах сдвига, stopped- потока флуоресценции спектроскопии 20,21, анизотропии флуоресценции (FA) 22,23, одной молекулы флуоресценции изображений 24,25 и Био-слой интерферометрии (BLI) 26 также являются либо неточными или несовместим с аптамеров-небольшой молекулы взаимодействия. Другое principaл вопросы этих методов низкая чувствительность, высокое потребление пробы, иммобилизация, ограничение массовых перевозок на поверхностях, и / или ограничения буфера. Лишь немногие из этих технологий обеспечивают интегрированные средства управления для агрегации и адсорбции эффектов.
MST представляет собой мощный инструмент для ученых , чтобы преодолеть это ограничение для изучения взаимодействия между аптамеров и малыми молекулами 27-29, а также другие цели , такие как белки 30-33. Технология опирается на движение молекул через температурных градиентов. Это направленное движение, называемое "термофорезу," зависит от размера, заряда и гидратной оболочки молекулы 34,35. Связывание лиганда с молекулой будет непосредственно изменять, по меньшей мере один из этих параметров, в результате чего в измененном термофоретического мобильности. Лиганды с малыми размерами не могут иметь значительное влияние с точки зрения изменения размера от несвязанного в связанном состоянии, но они могут иметь Др amatic воздействие на оболочку гидратации и / или заряда. Изменения в термофоретического движение молекул после взаимодействия с партнером по связыванию позволяет количественно оценить основные параметров связывания 2,7,34,36,37.
Как показано на рисунке 1А, устройство МСТ состоит из инфракрасного лазера фокусировалось на образец в стеклянных капиллярах с использованием тех же оптических систем для флуоресцентной детекции. Термофоретическая движение белков с помощью собственной флуоресценции триптофанов 6 или флуоресцентно меченого партнерского взаимодействия 3,8 можно отслеживать в то время как лазер создает температурный градиент (& Delta ; t 2-6 ° С). Полученная разность температур в пространстве, & Delta ; t, приводит к истощению или накопление молекул в области повышенной температуры, которая может быть определена количественно с помощью Соре коэффици- циент (С Т):
г "/>
С горячей представляет собой концентрацию в нагретой области, и с холодом концентрация в начальной холодной области.
Как показано на фигуре 1В, типичный результаты эксперимента MST в профиле движения MST (время трассировки), состоящий из различных этапов, которые могут быть разделены с помощью их соответствующих временных рамок. Первоначальная измеряют флуоресценцию в первые 5 секунд в отсутствие градиента температуры, чтобы определить точную начальную флуоресценцию и для проверки наличия фотообесцвечиванию или photoenhancement. Скачок температуры (T-Jump) представляет собой фазу, в которой изменения флуоресценции до термофоретического движения. Это начальное снижение флуоресценции зависит от тепловых зависящих от изменений фл uorophore квантового выхода. Фаза термофорезу следует, в которых флуоресценция уменьшается (или увеличивается) в связи с термофоретического движения молекул вплоть до стационарного распределения достигается.Обратное TJump и сопутствующее назад диффузия фл uorescent молекул можно наблюдать , как показано на рисунке 1В после того, как лазер выключен. Для того, чтобы получить доступ к основным параметрам связывания, различные молярные отношения партнеров взаимодействия анализируются и сравниваются. Как правило, 16 различных соотношений изучаются в одном эксперименте MST, в то время как оптический видимый молекулы поддерживается постоянным и поставляется с увеличением количества немеченого лиганда. Взаимодействие между этими двумя связывающими партнерами вызывает изменения в ТФ, и , таким образом , в нормированной флуоресценции, F норма, которая рассчитывается следующим образом :
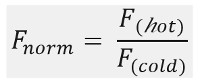
F горячей и холодной F представляют собой усредненные интенсивности uorescence Fl на де определены моменты времени следов MST. Аффинности связывания (K D или 50 значений EC) можно рассчитать по CURVе фитинга (рис 1C).
В целом, MST является мощным инструментом для изучения молекулярных взаимодействий любого рода. Эта рукопись предлагает протокол характеризовать сложные взаимодействия между молекулой небольшой аденозинтрифосфата (АТФ, 0,5 кДа) и 25-нт короткий оцДНК аптамеров DH25.42 (7,9 кДа). В течение рукописи, сайт связывания аптамеров на молекулы АТФ отображается вплоть до аденин группы АТФ.
протокол
1. Подготовка аптамеров рабочей запаса
- Следуйте инструкциям производителя и растворить олигонуклеотида (5-Cy5-ЦГКК GGGGAGTATTGCGGAGGAAGG-3, последовательность из ссылки 18) в воде, достигая конечной концентрации 100 мкМ.
- Подготовка аптамера рабочего раствора путем разбавления олигонуклеотидного запаса до 200 нм с буфером для связывания (20 мМ Трис, рН 7,6; 300 мМ NaCl, 5 мМ MgCl 2, 0,01% Tween 20).
- Выдержите смесь в течение 2 мин при 90 ° С, дайте образец сразу остыть на льду, а также использовать образец при комнатной температуре.
2. Подготовка лигандной серии разведений
- Для каждого лиганда (аденозинтрифосфата (АТФ), аденозин дифосфат (АДФ), аденозинмонофосфата (АМФ), аденин, гуанозинтрифосфат (GTP), цитидинтрифосфат (CTP), дезоксиаденозин трифосфата (дАТФ), и S-Аденозил метионин (SAM) ; 10 мМ каждый запас), готовят 16-ступенчатый последовательный dilutiна в 200 мкл микро реакционных труб.
Примечание: Центрифугирование запасов лиганда в течение 5 мин при 14000 х г, может помочь удалить агрегаты. Низкий уровень громкости, низкие трубки реакции связывания рекомендуется, чтобы избежать адсорбции молекул на стенках труб. - Начать с максимальной концентрацией по меньшей мере в 50 раз выше, чем расчетная сродства и снижают концентрацию лиганда на 50% в каждой стадии разбавления.
Примечание: Концентрация искатель инструмент реализован в программном обеспечении управления имитирует связывание данных и помогает при поиске нужного диапазона концентраций для серии разбавления. - Fill 20 мкл лигандного запаса (10 мМ) в пробирку 1. Добавьте 10 мкл буфера для связывания аптамеров в микротрубок реакции от 2 до 16.
- Передача 10 мкл трубы 1 к трубе 2 и правильно перемешать с помощью пипетки вверх и вниз несколько раз. Перенесите 10 мкл на следующую пробирку и повторить это разведение для остальных трубок.
- Откажитесь от 10 мкл избытка из последней трубки. Избегайте любого бuffer разведение эффекты. Буфер в трубе 1 и в трубах 2-16 должны быть идентичными.
3. Получение конечных реакционной смеси
- Подготовка индивидуальных реакций связывания с объемом 20 мкл (10 мкл рабочего раствора аптамеров + 10 мкл соответствующего лиганда разбавлении), чтобы свести к минимуму ошибки пипетирования. Объем всего 4 мкл является достаточной для фи LL капилляра.
- Добавьте 10 мкл рабочего раствора 200 нМ аптамеров к 10 мкл каждого лиганда разведения и должным образом перемешать с помощью пипетки вверх и вниз несколько раз.
- Инкубируйте образцы в течение 5 мин при комнатной температуре и наполняются во образцов в стандартные капилляры путем погружения капилляров в образец. Более длительное время инкубации может быть необходимо для некоторых взаимодействий; Тем не менее, 5 мин достаточно для большинства. Прикоснитесь капилляры только по бокам, а не на средней части, где будет принято оптическое измерение.
- Поместите капилляры на ее капиллярная лоток и запустить устройство MST.
4. Запуск устройства MST
ПРИМЕЧАНИЕ: Устройство содержит два предварительно установленные программные пакеты, на "контроль" программное обеспечение для установки технических условий эксперимента и анализа '' " 'программного обеспечения для интерпретации полученных данных.
- Перед установкой капиллярного лоток в устройство MST, запустите программу управления и регулировать общую желаемую температуру, выбрав '' включить ручное управление температуры "в '' контроля температуры" в раскрывающемся меню. Доведите температуру до 25 ° С таким образом.
Примечание: Инструменты MST может быть с регулируемой температурой от 22 до 45 ° C. - Подождите, пока температура достигнет ожидаемого уровня, а затем поместить капиллярную лоток в устройство MST.
- Установите светодиодный канал в '' красной "для Cy5 красителей и регулировать питание светодиодов, чтобы получить фл uorescencе сигнала от 300 до 1000 единиц флуоресценции в устройстве MST со стандартным датчиком. 25% Сила СИД используется в данном исследовании.
Примечание: от 6000 до 18 000 единицы флуоресценции рекомендуются для MST с датчиком высокой чувствительности.
5. Капиллярная сканирования
- Выполняют капиллярную сканирование, чтобы проверить различные аспекты качества образца путем выбора позиции капиллярную на программное обеспечение "управления" и нажав на кнопку "старт крышки сканирование" Перед началом измерения MST.
- Проверьте капиллярную сканирование флуоресценции повышения / закалкой и торчащие эффектов (U-образные или уплощенные пики) в программном обеспечении.
Примечание: Более подробная информация о выявлении и обработке флуоресценции и торчащие эффектов можно найти в обсуждении.
6. Измерение MST
ПРИМЕЧАНИЕ: Перед началом измерения MST, убедитесь, чтобы исключить прилипание эффекты, повышение / тушение эффектов, илиОшибки пипетирующие, и убедитесь, что капиллярная сканирования указывает на то, что сигнал флуоресценции является достаточным. Для получения более подробной информации, смотрите обсуждение.
- Назначают концентрации лиганда, из серии разведений в соответствующее положение капилляра в программном обеспечении '' управления "Рассмотрим стадию разбавления смешивания аптамера и лиганда. (1: 1).
- Введите самую высокую концентрацию лиганда (5 мм) для капиллярного # 1, выберите правильный тип для разведения (здесь, 1: 1), нажмите на максимальной концентрации, а также использовать функцию перетаскивания для автоматического назначения оставшиеся концентрации в капиллярах # 2- 16. Самая низкая концентрация составляет 152,6 нМ.
- Введите концентрацию фл uorescent аптамеров (здесь, 100 нМ) в соответствующем разделе программного обеспечения управления.
- Используйте настройки по умолчанию, которые обнаруживают флуоресценции в течение 5 сек, запись MST в течение 30 сек, и регистрации флуоресценции в течение еще 5 секунд после инактивации лазера т O монитор поворотную диффузию молекул.
- Регулировка мощности лазера до 20% в соответствующем разделе программы управления.
Примечание: Для того, чтобы получить наилучшее соотношение сигнал-шум и избежать неспецифических эффектов, лазер мощностью 20-40% рекомендуется. В отдельных случаях, более высокая мощность лазера может потребоваться, чтобы получить хорошее разделение несвязанных и связанных молекул. - Сохранить эксперимент после выбора папки назначения и начать измерение MST, нажав на кнопку '' измерения Start MST ".
Примечание: Файл .ntp будет создан в папке назначения. С помощью этой установки, одно измерение длится 10-15 мин. - Повторите экспериментальную процедуру , по крайней мере в два раза для более точного определения величины ЕС50.
Примечание: Для того, чтобы проверить техническую воспроизводимости, одни и те же капилляры могут быть отсканированы несколько раз (технических повторов).
7. MST Анализ данных
нт "> Примечание: Программное обеспечение для анализа позволяет анализировать данные о мошка во время измерения Программное обеспечение для анализа временных участков следов и изменений в нормированной флуоресценции (F норма) MST в зависимости от концентрации лиганда 37..- Запустите программное обеспечение для анализа MST (MO.Affinity Analysis) и загрузите файл .ntp из папки назначения. Выберите "MST" в качестве типа анализа в меню выбора данных.
Примечание: В случае лиганд-зависимых эффектов флуоресценции, начальная флуоресценция может быть выбран для анализа. - Добавьте соответствующую техническую или биологическую прогон (ов) к новому анализу путем перетаскивания и падение или нажав на кнопку "+" ниже соответствующего экспериментального пробега.
- Нажмите кнопку информация ниже соответствующего экспериментального прогона для получения информации о свойствах эксперимента, MST следов, капиллярный сканирования, форма капилляра, начальной флуоресценции и скорости отбеливания.
Примечание: Эти исходные данные могут альтак быть осмотрены на последующих этапах анализа. - Осмотреть следы MST для агрегации и осаждения эффектов, видимые как шишки и шипы.
Примечание: Для получения дополнительной информации о выявлении и обработке агрегирования эффектов, читать обсуждение. - Визуально проверьте капиллярную сканирование и форма наложения капилляров для адсорбции эффектов, видимый, как сплющенные или U-образных пиков. Осмотреть капиллярную сканирования и начальный флуоресценции для эффектов флуоресценции. Осмотреть скорость отбеливания для фотообесцвечиванию эффектов.
- Переключение в режим доза-реакция и изменения настроек анализа в режим "Эксперт", нажав на соответствующую кнопку. Выберите "T-Jump" в качестве стратегии оценки MST.
- Выберите модель "Hill" на кривой подгонки. Связующие параметры будут автоматически рассчитываться. Нормализовать данные, выбрав соответствующий тип нормализации в меню "Сравнить результаты". Экспортироватьданные либо как .xls или .pdf.
Примечание: В таблице ниже привязки графика приведены расчетные параметры связывания.
Результаты
В данном исследовании МСТ был применен для характеристики участок связывания аптамеров DH25.42 ДНК 18 на АТФ. В отличие от других исследований , характеризующих взаимодействие АТФ или АТФ-имитируя малых молекул с белками случайным образом помеченного одной или бол?...
Обсуждение
Контроль качества:
Неспецифические прилипание / адсорбции материала образца на поверхности, а также агрегации эффектов, оказывают серьезное влияние на качество данных сродством. Тем не менее, лишь немногие внедренный технологии обеспечивают точные и быстрые варианты ко...
Раскрытие информации
CE и TS являются сотрудниками 2bind GmbH, которая обеспечивает биофизических аналитические услуги. Публикация плата за это видео-статьи оплачиваются 2bind GmbH.
Благодарности
Авторы не имеют никаких подтверждений.
Материалы
| Name | Company | Catalog Number | Comments |
| Aptamer binding buffer | 20 mM Tris pH 7.6; 300 mM NaCl; 5 mM MgCl2; 0.01% Tween-20 | ||
| Fluorescently labeled ATP aptamer | IDT, Leuven, Belgium | sequence: DH25.42 50-Cy5-CCTGGGGGAGT- ATTGCGGAGGAAGG-3 | |
| ATP | Sigma Aldrich, Germany | A2383 | 10 mM stock solutions stored at - 20 °C |
| ADP | Sigma Aldrich, Germany | A2754 | 10 mM stock solutions stored at - 20 °C |
| AMP | Sigma Aldrich, Germany | A2252 | 10 mM stock solutions stored at - 20 °C |
| Adenine | Sigma Aldrich, Germany | A8626 | 10 mM stock solutions stored at - 20 °C |
| SAM | Sigma Aldrich, Germany | A7007 | 10 mM stock solutions stored at - 20 °C |
| dATP | Sigma Aldrich, Germany | 11934511001 | 10 mM stock solutions stored at - 20 °C |
| CTP | Sigma Aldrich, Germany | C1506 | 10 mM stock solutions stored at - 20 °C |
| GTP | Sigma Aldrich, Germany | G8877 | 10 mM stock solutions stored at - 20 °C |
| Monolith NT.115 | NanoTemper Technologies, Munich, Germany | MO-G008 | Blue/Red Channel MST device with standard detector, Monolith NT115 pico is MST device with high sensitivity detector |
| Monolith NT.115 capillaries Standard | NanoTemper Technologies, Munich, Germany | MO-K002 | |
| Eppendorf PCR tubes | Eppendorf, Germany | 30124537 | |
| Monolith control software. 2.1.33, pre-installed on the device | NanoTemper Technologies, Munich, Germany | ||
| MO.affinity analysis v2.1.1 | NanoTemper Technologies, Munich, Germany | ||
| Kaleidagraph 4.5.2 | Synergy Software |
Ссылки
- Linke, P., et al. An Automated Microscale Thermophoresis Screening Approach for Fragment-Based Lead Discovery. J Biomol Screen. 21 (4), 414-421 (2015).
- Jerabek-Willemsen, M., et al. MicroScale Thermophoresis: Interaction analysis and beyond. Journal of Molecular Structure. 1077, 101-113 (2014).
- Zillner, K., et al. Microscale thermophoresis as a sensitive method to quantify protein: nucleic acid interactions in solution. Methods Mol Biol. 815, 241-252 (2012).
- Zhang, W., Duhr, S., Baaske, P., Laue, E. Microscale thermophoresis for the assessment of nuclear protein-binding affinities. Methods Mol Biol. 1094, 269-276 (2014).
- Wienken, C. J., Baaske, P., Rothbauer, U., Braun, D., Duhr, S. Protein-binding assays in biological liquids using microscale thermophoresis. Nat Commun. 1, 100 (2010).
- Seidel, S. A., et al. Label-free microscale thermophoresis discriminates sites and affinity of protein-ligand binding. Angew Chem Int Ed Engl. 51 (42), 10656-10659 (2012).
- Seidel, S. A., et al. Microscale thermophoresis quantifies biomolecular interactions under previously challenging conditions. Methods. 59 (3), 301-315 (2013).
- Schubert, T., et al. Df31 protein and snoRNAs maintain accessible higher-order structures of chromatin. Mol Cell. 48 (3), 434-444 (2012).
- McKeague, M., Derosa, M. C. Challenges and opportunities for small molecule aptamer development. J Nucleic Acids. 2012, 748913 (2012).
- Ruscito, A., DeRosa, M. C. Small-Molecule Binding Aptamers: Selection Strategies, Characterization, and Applications. Front Chem. 4, 14 (2016).
- Chang, A. L., McKeague, M., Liang, J. C., Smolke, C. D. Kinetic and equilibrium binding characterization of aptamers to small molecules using a label-free, sensitive, and scalable platform. Anal Chem. 86 (7), 3273-3278 (2014).
- Chang, A. L., McKeague, M., Smolke, C. D. Facile characterization of aptamer kinetic and equilibrium binding properties using surface plasmon resonance. Methods Enzymol. 549, 451-466 (2014).
- Jing, M., Bowser, M. T. Methods for measuring aptamer-protein equilibria: a review. Anal Chim Acta. 686 (1-2), 9-18 (2011).
- Sokoloski, J. E., Dombrowski, S. E., Bevilacqua, P. C. Thermodynamics of ligand binding to a heterogeneous RNA population in the malachite green aptamer. Biochemistry. 51 (1), 565-572 (2012).
- Burnouf, D., et al. kinITC: a new method for obtaining joint thermodynamic and kinetic data by isothermal titration calorimetry. J Am Chem Soc. 134 (1), 559-565 (2012).
- Mannironi, C., Scerch, C., Fruscoloni, P., Tocchini-Valentini, G. P. Molecular recognition of amino acids by RNA aptamers: the evolution into an L-tyrosine binder of a dopamine-binding RNA motif. RNA. 6 (4), 520-527 (2000).
- Jenison, R. D., Gill, S. C., Pardi, A., Polisky, B. High-resolution molecular discrimination by RNA. Science. 263 (5152), 1425-1429 (1994).
- Huizenga, D. E., Szostak, J. W. A DNA aptamer that binds adenosine and ATP. Biochemistry. 34 (2), 656-665 (1995).
- Lee, E. R., Baker, J. L., Weinberg, Z., Sudarsan, N., Breaker, R. R. An allosteric self-splicing ribozyme triggered by a bacterial second messenger. Science. 329 (5993), 845-848 (2010).
- Wickiser, J. K., Cheah, M. T., Breaker, R. R., Crothers, D. M. The kinetics of ligand binding by an adenine-sensing riboswitch. Biochemistry. 44 (40), 13404-13414 (2005).
- Jucker, F. M., Phillips, R. M., McCallum, S. A., Pardi, A. Role of a heterogeneous free state in the formation of a specific RNA-theophylline complex. Biochemistry. 42 (9), 2560-2567 (2003).
- Zhao, Q., Lv, Q., Wang, H. Aptamer fluorescence anisotropy sensors for adenosine triphosphate by comprehensive screening tetramethylrhodamine labeled nucleotides. Biosens Bioelectron. 70, 188-193 (2015).
- Zhang, D., et al. A sensitive fluorescence anisotropy method for detection of lead (II) ion by a G-quadruplex-inducible DNA aptamer. Anal Chim Acta. 812, 161-167 (2014).
- Elenko, M. P., Szostak, J. W., van Oijen, A. M. Single-molecule imaging of an in vitro-evolved RNA aptamer reveals homogeneous ligand binding kinetics. J Am Chem Soc. 131 (29), 9866-9867 (2009).
- Elenko, M. P., Szostak, J. W., van Oijen, A. M. Single-molecule binding experiments on long time scales. Rev Sci Instrum. 81 (8), 083705 (2010).
- Zichel, R., Chearwae, W., Pandey, G. S., Golding, B., Sauna, Z. E. Aptamers as a sensitive tool to detect subtle modifications in therapeutic proteins. PLoS One. 7 (2), 31948 (2012).
- Baaske, P., Wienken, C. J., Reineck, P., Duhr, S., Braun, D. Optical thermophoresis for quantifying the buffer dependence of aptamer binding. Angew Chem Int Ed Engl. 49 (12), 2238-2241 (2010).
- Entzian, C., Schubert, T. Studying small molecule-aptamer interactions using MicroScale Thermophoresis (MST). Methods. 97, 27-34 (2016).
- Valenzano, S., et al. Screening and Identification of DNA Aptamers to Tyramine Using in Vitro Selection and High-Throughput Sequencing. ACS Comb Sci. 18 (6), 302-313 (2016).
- Jauset Rubio, M., et al. beta-Conglutin dual aptamers binding distinct aptatopes. Anal Bioanal Chem. 408 (3), 875-884 (2016).
- Breitsprecher, D., et al. Aptamer Binding Studies Using MicroScale Thermophoresis. Methods Mol Biol. 1380, 99-111 (2016).
- Stoltenburg, R., Schubert, T., Strehlitz, B. In vitro Selection and Interaction Studies of a DNA Aptamer Targeting Protein A. PLoS One. 10 (7), 0134403 (2015).
- Kinghorn, A. B., et al. Aptamer Affinity Maturation by Resampling and Microarray Selection. Anal Chem. 88 (14), 6981-6985 (2016).
- Duhr, S., Braun, D. Why molecules move along a temperature gradient. Proc Natl Acad Sci U S A. 103 (52), 19678-19682 (2006).
- Braun, D., Libchaber, A. Trapping of DNA by thermophoretic depletion and convection. Phys Rev Lett. 89 (18), 188103 (2002).
- Duhr, S., Arduini, S., Braun, D. Thermophoresis of DNA determined by microfluidic fluorescence. Eur Phys J E Soft Matter. 15 (3), 277-286 (2004).
- Jerabek-Willemsen, M., Wienken, C. J., Braun, D., Baaske, P., Duhr, S. Molecular interaction studies using microscale thermophoresis. Assay Drug Dev Technol. 9 (4), 342-353 (2011).
- He, K., Dragnea, V., Bauer, C. E. Adenylate Charge Regulates Sensor Kinase CheS3 To Control Cyst Formation in Rhodospirillum centenum. MBio. 6 (3), 00546 (2015).
- Brvar, M., et al. Structure-based discovery of substituted 4,5'-bithiazoles as novel DNA gyrase inhibitors. J Med Chem. 55 (14), 6413-6426 (2012).
- Pogorelcnik, B., et al. 4,6-Substituted-1,3,5-triazin-2(1H)-ones as monocyclic catalytic inhibitors of human DNA topoisomerase IIalpha targeting the ATP binding site. Bioorg Med Chem. 23 (15), 4218-4229 (2015).
- Jhaveri, S., Rajendran, M., Ellington, A. D. In vitro selection of signaling aptamers. Nat Biotechnol. 18 (12), 1293-1297 (2000).
- Khavrutskii, L., et al. Protein purification-free method of binding affinity determination by microscale thermophoresis. J Vis Exp. (78), (2013).
- Ramakrishnan, M., et al. Probing cocaine-antibody interactions in buffer and human serum. PLoS One. 7 (7), 40518 (2012).
- Chen, M., et al. Antiviral activity and interaction mechanisms study of novel glucopyranoside derivatives. Bioorg Med Chem Lett. 25 (18), 3840-3844 (2015).
- Wan, C., et al. Insights into the molecular recognition of the granuphilin C2A domain with PI(4,5)P2. Chem Phys Lipids. 186 (4,5), 61-67 (2015).
- Harazi, A., et al. The Interaction of UDP-N-Acetylglucosamine 2-Epimerase/N-Acetylmannosamine Kinase (GNE) and Alpha-Actinin 2 Is Altered in GNE Myopathy M743T Mutant. Mol Neurobiol. , (2016).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены