Method Article
Измерение Т-клетки с помощью визуализации аллореактивности проточной цитометрии
В этой статье
Резюме
В этой статье описан способ измерения аллореактивности в смешанной популяции Т-клеток с использованием проточной цитометрии изображений.
Аннотация
Измерение иммунологической реактивности к антигенам доноров, у реципиентов трансплантата, вероятно, будет решающим для успешного снижения или отмены иммуносупрессии. Неоднозначную реакцию лейкоцитов (MLR), предельное разведение пробы, и транс-виво гиперчувствительность замедленного типа (ГЗТ) анализа все были применены к этому вопросу, но эти методы имеют ограниченную предсказательную способность и / или существенные практические ограничения , которые уменьшают их полезность. Изображений проточной цитометрии является метод, который сочетает в себе многопараметрических количественные полномочия проточной цитометрии с возможностями обработки изображений флуоресцентной микроскопии. Недавно мы использовали в проточной цитометрии подхода визуализации для определения доли реципиентов Т-клеток, способных к образованию зрелых иммунным синапсов с донорскими антигенпрезентирующими клетками (АРС). Использование хорошо охарактеризованных мыши модели по пересадке сердца, мы показали , что частота в пробирке иммунных синапсов между Т-APC MembrАНЭ контактные события сильно предсказал исход аллотрансплантата в отторжении, толерантности, и ситуации, где выживание трансплантата зависит от индуцированных регуляторных Т-клеток. Частота Т-APC контактов увеличивается с Т-клетками от мышей во время острого отторжения и уменьшается с Т-клетками от мышей, оказываемой невосприимчивы к Аллоантигену. Добавление регуляторных Т - клеток к системе в пробирке уменьшается длительные контакты Т-APC. Чрезвычайно важно, этот эффект также был отмечен с человеческим поликлонально расширенной, встречающихся в природе регуляторных Т-клеток, которые, как известно, контролируют отторжение тканей человека в гуманизированных мышиных моделях. Дальнейшее развитие этого подхода может позволить более глубокой характеристику аллореактивного Т-клетки в отсеке реципиентов. В будущем, дальнейшее развитие и оценка этого метода с использованием человеческих клеток может служить основой для анализов, используемых для отбора пациентов для минимизации иммуносупрессии, и он может быть использован для измерения воздействия tolerogenIC терапии в клинике.
Введение
Твердые трансплантации органов превратило уход за пациентами с терминальной стадии заболеваний почек, печени, сердца и легких. Из-за различий в основных и второстепенных антигенов гистосовместимости, однако, Аллотрансплантаты незамедлительно отвергнуто реципиентов Т-клетками, если иммунодепрессанты не используются. Эти агенты имеют многочисленные неблагоприятные последствия, в том числе риски для рака и органной дисфункции. Поэтому основная клиническая цель состоит в том, чтобы снизить дозу иммуносупрессии до минимального уровня, необходимого для предотвращения отторжения трансплантата. Этот уровень может меняться в зависимости от степени активации врожденной иммунной системы; степень донор-реципиент несоответствия аллоантигена; и различия между пациентом в иммунной функции, фармакокинетики, фармакодинамики и.
К сожалению, врачи пересадки не имеют каких - либо инструментов для точной оценки донорской реактивности у отдельных пациентов 1. смешанныйРеакция лейкоцитов (MLR) может обнаружить донор реактивность, но он не может надежно предсказать исход трансплантата 2, 3. Лимитирующее разведение, анализы цитокин ELISPOTs, и транс-виво анализ либо измерить ограниченный диапазон ответов или не практичны 4, 5, 6, 7, 8 профилей экспрессии .Gene выявили сигнатур , связанные с оперативной толерантностью 9, 10, 11, 12 и отторжение 13, 14, 15, но это не всегда обобщенные по населению 16 и в конечном счете , может иметь ограниченную полезность в отдельных пациентах. Последовательность на основе AnalyГОС Т-клеточного рецептора (TCR) Т - клеток в периферической крови 17 или пролиферирующих в MLR 18 также были разработаны , но требуют дальнейшей проверки.
Концептуально, было бы желательно иметь анализ, который обнаруживает самые ранние шаги необходимые в активации Т-клеток реципиента с помощью антигена донора. Поскольку культивирования клеток в течение нескольких дней (как в MLR) можно ввести артефакты, такой тест, в идеале, не требуют измерений последующих событий, например, пролиферации или эффекторной функции. В равной степени, однако, было бы также желательно, чтобы тест, чтобы зависеть от некоторого элемента функции Т-клеток, так как чисто описательных оценок (Например, TCR - секвенирование) может быть не в состоянии различать анергические и функциональные Т - клетки.
Многочисленные исследования показали, что длительный Т-АРС контакт необходим для формирования иммунного синапса, который является важным первымшаг в ответ Т-клеток 19, 20, 21, 22. Мы недавно сообщили , что во время динамического в пробирке время покадровой обработки изображений, около 5 - 10% от мыши CD4 + Т - клетки образуют длительные контакты с аллогенной полученных из костного мозга дендритных клеток (BMDCs) 23. Частота длительного контакта была увеличена у животных, отклоненных трансплантата, тогда как у мышей , ранее оказываемых толерантными к тем же антигены, она оставалась на уровне видели в untransplanted мышей 23. Продолжительные взаимодействия были уменьшены в присутствии получателя Tregs и увеличение в их отсутствие, и мы наблюдали подобные явления с помощью Т - клеток человека и аллогенных моноцитов ДК (MoDCs) 23.
Тем не менее, перечисление длительных контактов сделано в поликлональном Т-клеток populatioп отнимает много времени и трудоемким. Поэтому мы сделали использование изображений проточной цитометрии для изучения формирования аллогенного иммунного синапса. Изображений проточной цитометрии включает в себя многопараметрических сбора и анализа данных, возможности обычного проточной цитометрии с возможностями визуализации одноклеточного флуоресцентной микроскопии. Эта техника была использована другими исследователями для изучения формирования иммунного синапса с помощью моноклональных Т - клеток 24, 26, 27 или в присутствии суперантигенов 28. В таких условиях, однако, частота реагирующих Т - клеток в диапазоне от 30-100%, в то время как аллореактивные Т - клетки , как правило , по оценкам, представляют 5-15% от общего репертуара Т-клеток 29, 30, 31, 32. Важно отметить, что мы показали, что поток изображений цитометрии может производить аиERy сопоставимой мера аллореактивных частот Т-клетки 23 и что изменения в частоте синапса внутри популяции Т-клеток поликлональной позволяют прогнозировать исход трансплантата 23. В настоящее время этот подход был оптимизирован для измерения прямой аллореактивности CD4 + Т - клеток, но, в принципе, также могут быть разработаны для изучения CD8 + Т - клеток , и косвенный путь. Косвенное аллореактивность , как полагают, становится все более актуальным при более длительном времени после трансплантации 33. Мы в настоящее время разрабатываем этот метод, чтобы использовать клетки человека, что позволит для тестирования больных. Таким образом, в будущем, общий подход может быть полезен для функциональной оценки Т-клеточных реакций в реципиентов трансплантата перед трансплантацией; сразу же после трансплантации; и в долгосрочной перспективе, когда минимизация наркотиков становится важной задачей.
протокол
1. Подготовка реагентов и материалов, необходимых
- Приготовьте фосфатно-солевой буфер (PBS), содержащую 2% фетальной телячьей сыворотки (FBS) ( "промывочный буфер"). Подготовьте PBS с 2% FCS, содержащим 0,1% неионного детергентом ( «завивка-промывочный буфером», см Таблицы материалов). Подготовьте PBS с 1,5% формальдегида.
Примечание: ВНИМАНИЕ! Формальдегид вызывает коррозию и потенциально канцерогенный и должен быть обработан во время ношения соответствующих средств индивидуальной защиты. - Подготовьте PBS, содержащей 2% FBS и 0,5 мМ этилендиаминтетрауксусной кислоты (ЭДТ) для разделения магнитных клеток ( «MCS буфера»).
- Подготовьте 50 мкг / мл фаллоидин-изотиоцианат флуоресцеина (фаллоидин-FITC) в диметилсульфоксиде (ДМСО). Подготовьте 1 мг / мл , окрашивающим ядра (например , 1 мг / мл 7-aminoactinomycin D (7-ААР) в ДМСО или бис-benzimide красителя, см Таблицу материалов) в ДМСО. Подготовка Флуорохром меченных антител подходит для клеток, представляющих интерес иформирования изображения проточной цитометрии.
- Получение тканей животных (например, лимфатические узлы и селезенка) в качестве источника Т - клеток и тканей аллогенных животных (например, селезенка и костного мозг) в качестве источника антигена-представляющих клеток или клеток - предшественников.
- Подготовка культуральной среды клеток (например, средний институт Memorial Roswell Park (RPMI) 1640 или Дульбекко Модифицированная Eagle Medium (DMEM) с добавлением 10% FBS), 50 мкМ 2-меркаптоэтанола, пенициллин, и стрептомицин и получить 24- и / или 96- луночные культуральные планшеты.
2. Приготовить антиген-представляющих клеток
Примечание: В теории, любая APC население можно было бы изучить с помощью этого метода. Незрелые костный мозг мыши дендритные клетки (ДК), как АРС были ответчик в данном случае. Существует множество протоколов для генерации этих клеток (например, ссылки 34 и 35). Вкратце, был использован следующий протокол.
- Промывка мозг от бедренных и большеберцовых костей во обороты в минутуЯ 1640 или DMEM.
- Пропускают суспендированные клетки через клеточный фильтр 70 мкм, чтобы удалить небольшие кусочки кости и мусора.
- Гранулы клетки центрифугирования, а затем лизировать красные клетки с использованием буфера хлорида аммония в течение 5 мин при комнатной температуре.
- Гранулы клетки центрифугирования (400 XG, 5 мин) и ресуспендирует осадок клеток.
- Промыть клетки в 5 - 10 мл промывочного буфера, гранул путем центрифугирования (400 XG, 5 мин) и повторно приостанавливать осадок клеток.
- Пополните гемопоэтических предшественников на колонке дл разделени клеток с помощью мечения клеток с биотинилированным анти-CD3 (5 мкг / мл), анти-В220 (5 мкг / мл), анти-МНС класса II (1 мкг / мл) и анти-CD11b (5 мкг / мл) антител.
- Гранул клеток путем центрифугирования (400 XG, 5 мин) и повторно приостанавливать осадок клеток.
- Инкубируйте клетки с анти-биотина магнитных микрогранул (см Таблицу материалов) при температуре 4 ° С в течение 10 мин.
- Мытье и осаждения клеток (400 мкг, 5 мин) и вновь suspenд их в 1 мл буфера MCS перед удалением меченых клеток с использованием большого положительного отбора (LS) магнитную колонку разделения клеток загрунтовать 3 мл буфера MCS и помещают в магнит. Промывают колонку 3 раза с 3 мл буфера MCS; проточный будет содержать нужные клетки.
- Культуры клеток, которые проходят через колонку в течение 6 дней в среде RPMI 1640 или DMEM с добавлением 2 нг мл рекомбинантного гранулоцитарного мыши макрофагальный колониестимулирующий фактор / (GM-CSF) и 2 нг / мл рекомбинантного человеческого & beta; 1 трансформирующий фактор роста (TGF 1) , Заменить половину среды каждые 2 дня со свежей полной среде, содержащей 2 нг / мл GM-CSF и TGF 1.
Примечание: Human TGF 1 обладает активностью в клетках мыши. Данные были получены с использованием этого незрелого ДК. Другие клетки (например, В - клетки и зрелые ДК) могут быть пригодны в качестве АРС , но не были протестированы в данном анализе. - Криоконсервации РС в 90% сыворотки / 10% ДМСО и хранить в жидком азоте; восстановить надень использования. Перед использованием подсчета количества жизнеспособных ГЦ в гемоцитометра с использованием трипанового синего. Повторное приостановить осадок клеток в культуральной среде при соответствующей плотности (см шаг 4.1) перед использованием в разделе 4.
3. Подготовка Т-клеток
- Используйте отрицательные методы выбора, чтобы избежать непреднамеренных передач активирующих или ингибирующие сигналов к клеткам.
Примечание: В этом примере, CD4 + Т - клетки получают для анализа.- Для подготовки CD4 + Т - клеток из селезенки мыши, пюре селезенки через сито ячейки 70 мкм с использованием на поршень шприца. Промыть фильтр ячейки с буфером для промывки.
- Гранул суспендированные клетки центрифугирования (400 XG, 5 мин), а затем лизис эритроцитов путем повторной суспендировани осадки в буфере хлорида аммония в течение 5 мин при комнатной температуре.
- Гранул клеток путем центрифугирования (400 XG, 5 мин) и повторно приостанавливать осадок.
- Вымойте клеткис в течение 5 - 10 мл промывочного буфера и гранул путем центрифугирования (400 мкг, 5 мин). Повторное приостановить осадок.
- Пятно клетки с биотинилированными антителами к CD8, главному комплексу гистосовместимости класса II (МНС II, 1 мкг / мл), и CD19 (5 мкг / мл). Инкубируют в течение 10 мин при 4 ° С.
- Промывают клетки в 10 мл буфера для промывки и гранул путем центрифугирования (400 XG, 5 мин). Повторное приостановить осадок.
- Инкубируйте клетки с анти-биотин магнитными микрогранули (см Таблицы материалов) в соответствии с инструкциями изготовителя.
- Промывают клетки в 10 мл буфера для промывки и гранул путем центрифугирования (400 XG, 5 мин); повторно приостанавливать осадок.
- Повторное приостановить клеток в 1 мл буфера MCS и обогатить CD4 + Т - клетки над магнитной разделительной колонны клеток загрунтованную 3 мл буфера MCS на магнит. Промывают колонку 3 раза с 3 мл буфера MCS. Колонка проточные будет содержать обогащенный Т-клетки.
- По стандартному cytome потокапопробовать, оценить чистоту Т-клеток с использованием аликвоты отрицательно отобранных клеток. Пятно клетки с использованием Флуорохромом-стрептавидином конъюгата (для выявления какой-либо меченный биотин клетки, которые должны были быть удалены на колонке) и антитело или антитела, чтобы идентифицировать популяцию Т-клетки, представляющий интереса (CD4 в данном случае); чистота ≥85% является приемлемым 23.
- Количество Т-клеток в гемоцитометра с помощью трипанового синего (≥90% жизнеспособность приемлемо).
Примечание: MCS буфер содержит ЭДТА, которые должны быть удалены перед анализом. Для достижения этой цели, осаждение клеток центрифугирования (400 XG, 5 мин) и мыть в 1 мл промывочного буфера. снова Гранулы клетки (400 мкг, 5 мин) и повторно приостанавливать в культуральной среде при соответствующей плотности (см шага 4.1).
- Количество Т-клеток в гемоцитометра с помощью трипанового синего (≥90% жизнеспособность приемлемо).
4. Со-инкубировать Т-клеток и РС
- Семенной Т-клетки и ДК в соотношении 2: 1 Т: Отношение постоянного тока в 24-луночный или 96-луночный планшет для культивирования. Гарантировать, что конечный объем культуры ≤500 мкл для 24-луночных планшетов или ≤50 мкл для 96-луночных планшетов.
Примечание: Меньшие объемы стимулирование межклеточных взаимодействий и позволяют пространство для последующего буфера фиксации.- Отрегулировать точные числа клеток эмпирически, но в качестве общего руководства, использовать 1 × 10 6 клеток Т и 0,5 × 10 6 РС на лунку (96-луночного планшета). Их следует рассматривать минимальные количества клеток, так как с использованием меньшего количества клеток делает перечисление иммунных синапсов трудно.
- Для увеличения числа клеток, создать дублирующие скважины и бассейн после стадии 5 (фиксации).
Примечание: При настройке дублирующих скважин, то целесообразно , чтобы семя РС во всех лунках, а затем семена Т - клетках во всех лунках; это сводит к минимуму расхождения во время инкубации между скважинами.
- Для увеличения числа клеток, создать дублирующие скважины и бассейн после стадии 5 (фиксации).
- Отрегулировать точные числа клеток эмпирически, но в качестве общего руководства, использовать 1 × 10 6 клеток Т и 0,5 × 10 6 РС на лунку (96-луночного планшета). Их следует рассматривать минимальные количества клеток, так как с использованием меньшего количества клеток делает перечисление иммунных синапсов трудно.
- Инкубируйте планшет в течение 4 ч при 37 ° С в атмосфере 5% СО 2.
- Добавьте в 3 раза объем культуры 1,5% формальдегида в PBS в каждую лунку и инкубировали при комнатной температуре в течение 30 мин; тт важно зафиксировать клетки перед удалением их из пластины, чтобы минимизировать нарушение межклеточных взаимодействий.
- Передача клеток в пластине в пробирки для последующей промывки и окрашивания. На этом этапе, выделить дополнительные ячейки для контроля одного пятна. Помимо этих элементов управления, вся культура должна быть окрашивали коктейль антител (см шаг 4.1.1).
6. Клетки Stain
- Пятно клеток в 100 мкл промывочного буфера, содержащего коктейль из желаемых флуорохромом конъюгированный антителами в течение 30 мин при комнатной температуре в защищенном от света месте.
Примечание: коктейль включает в себя клеточно-специфические и АРС-специфические антитела Т. Флюорохромы должны быть выбраны таким образом, чтобы их можно отличить с помощью конфигурации изображений проточной цитометрии. В тон эксперименты, показанные здесь, синий флуорофор-конъюгированного CD11b (5 мкг / мл, см Таблицу материалов) и АРС-конъюгированного CD90.2 (5 мкг / мл), были использованы. - Промыть клеток в 1 мл промывочного буфера и центрифуги в течение 5 мин при 400 х г. Слейте супернатант. Повторное приостановить клетки в завивка-промывочного буфера, содержащего FITC фаллоидин в 0,05-0,5 мкг / мл и инкубируют в течение 30 мин при комнатной температуре в защищенном от света.
Примечание: Концентрация фаллоидин FITC от приблизительно 0,1 мкг / мл работает хорошо для клеток мыши, но в соответствующей концентрацию , как ожидается, варьируется в зависимости от поставщика, типа клетка, и обработка изображений проточной цитометрии. - Промывают клетки в 1 мл завивки / промывочного буфера и центрифуги в течение 5 мин при 400 х г. Слейте супернатант. Повторное приостановить клетки в завивка / промывочного буфера , содержащие ядерный краситель в соответствующей концентрации (например, приблизительно 25 мкг / мл 7-AAD) и инкубируют в течение 30 мин при комнатной температуре в защищенном от света.
- Вымойте клеткис в 1 мл завивки / промывочного буфера и центрифуги в течение 5 мин при 400 х г. Слейте супернатант. Промывают клетки один раз в буфере для промывки, гранул и повторно приостанавливать в 50 - 100 мкл промывочного буфера, перенос клеток к маленьким, блокированных микроцентрифужных пробирках.
- Переходим к приобретению данных сразу или хранить клетки при 4 ° С в защищенном от света в течение нескольких дней до приобретения на визуализации проточной цитометрии.
Примечание: Клетки были успешно сохранены таким образом до 7 дней. Более длительное хранение, может быть возможно, но не было проверено.
7. Приобретение данных
- Инициализация и настройка потока изображений цитометра в соответствии с инструкциями изготовителя. Обеспечение стабильности ядра потока до сбора каких-либо данных.
- Резервные один канал для получения светлого изображения. Приобретение данных управления одним пятна канал выключен светлый.
- Нажмите на кнопку «Загрузить» и Inseк.т. пробирку, содержащую полностью окрашенный образец (образец, который был окрашивали со всеми необходимыми флюорохромами) в держатель.
- В окне «рабочего пространства», выбрать и создать новую диаграмму рассеяние с соотношением сторон по площади и ворота синглетов, где соотношение сторон близко к 1. Создать новую диаграмму рассеяния для каждого канала, используемого (интенсивности канала в горизонтальной оси) ,
- Для каждого флуорохрома, проверьте положительное население и, при необходимости, отрегулируйте лазерное напряжение в поле «Illumination».
- Выгрузка трубки и загрузить первый сингл-окрашивал трубку.
- В окне «Настройка Acquisition», введите имя образца и установить количество событий, которые должны быть собраны; если это один краситель (для контроля компенсации), 1000 - 2000 событий являются достаточными.
- В поле «Каналы», выбрать каналы, что каждый образец был окрашивали. Для контроля одного пятна, все каналы должны быть выбраны с помощью brightfIELD и боковое рассеивание прочь. Нажмите на кнопку «Запись» под окном «Приобретение»; когда число событий достигает заданное пороговое значение, приобретение автоматически прекращается.
- Нажмите кнопку «Return», чтобы разгрузить трубку. Повторите шаги 7.2.4 - 7.2.6 для каждого элемента управления одного пятна. В зависимости от цитометра и программного обеспечения, оно не может быть возможным , чтобы установить все из ворот , показанных на фиг.1 , во время сбора (точнее стробирования , выполняемых в процессе анализа, см раздел 8).
- Acquire образцы как для отдельных окрашенных образцов (в шаге 7.2), но в поле «Каналы», выбрать все каналы, которые необходимы, в том числе канала светлопольного.
- Перед записью данных, проверьте, чтобы подтвердить, что интенсивность канала подходит для определения желаемых клеточных популяций. Если нет, то настроить параметры лазерных и перезаписывать управление одним морилки, используя новые настройки, как описано в пункте 7.2.
- Для каждогообразец, получить несколько десятков тысяч событий.
Примечание: В большинстве случаев, межклеточные контакты событие небольшого меньшинство от общего числа клеток (большинство из них отдельные клеток). В общем, желательно иметь по крайней мере 100 событий в окончательной мембраны контакта ворот.
8. Анализ данных
- Анализ данных, полученных в потоке изображений цитометрии с использованием аналитического программного обеспечения можно бесплатно загрузить с сайта производителя для (учетная запись пользователя должна быть создана, см таблицу материалов).
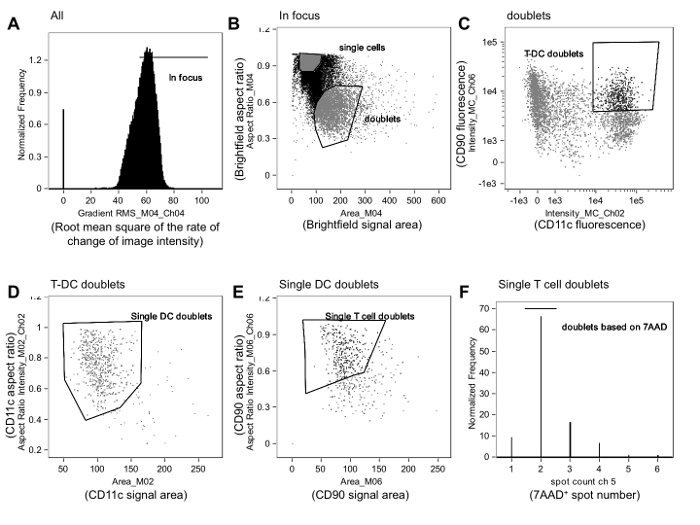
Рисунок 1. Gating стратегия , используемая для идентификации аллореактивных Иммунных синапсов. A. В фокусе события пропускаются от всех событий путем анализа изображений клеток на основе среднеквадратического квадрат скорости изменения профиля интенсивности изображения (Gradient RMS) с помощью чана светлого поляNel (канал 4, CH04), как описано в тексте. В. Среди в фокусе событий, дублеты отличается от одиночных клеток путем построения графика соотношения сторон в сравнении с областью для канала светлопольного. Отдельные клетки сгруппированы близко к соотношению сторон 1 и имеют меньшую площадь, в то время как дублеты близки к 0,5 и имеют большую площадь. C. Интенсивность флуоресценции АПК (в данном случае, дендритные клетки [DC] маркер, CD11c) затем нанесена против интенсивности флуоресценции Т-клеточных маркеров (в данном случае, CD90.2), и дважды положительные события закрытый типа. Границы ворот могут быть уточнены путем анализа изображения событий вблизи границ. Д. Т-APC дублеты затем уточнены таким образом , что они содержат только один APC, откладывая соотношение сторон по отношению к области маркеров APC (CD11c, CH02). Е. Эти одной APC дублеты затем уточнены таким образом , что они содержат только одну Т - клеток путем построения графика пропорции по отношению к площадиТ-клеточного маркера (CD90.2, CH06). F. Наконец, событие , содержащее только два ядра выбрано путем построения гистограммы подсчета пятна на канале окрашивающим ядра (7-AAD, CH05) и стробировании события , которые содержат только два 7-АСР-позитивные пятна (т.е. ядер). События в этих воротах анализируются для мембранного контакта и формирования синапсов, как описано на фиг.2. Данные были проанализированы слепым методом по отношению к проводимому лечению и от ранее опубликованного эксперимента 23. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Примечание: Эта стратегия стробирования описана в этом разделе , и изображена на рисунке 1. Анализ потока изображений цитометрии данных должен быть выполнен слепым способом по отношению к проводимому лечению. Хотя мы считаем, что иммунные синапсов и не-synaptiC контакты , как правило , легко отличить (смотрите ниже и на рисунках 2 и 3), ослепительного следует свести к минимуму смещение , возникающее из субъективности , присущей анализа изображений.
- Сформировать матрицу компенсации путем загрузки файлов данные управления одним морилки в мастер компенсации. После загрузки одиночных окрашенных файлов, выберите флуоресцентные каналы, используемые в эксперименте.
Примечание: Программа автоматически генерирует матрицу компенсации, но это должно быть подтверждено вручную , чтобы гарантировать , что правильные положительные популяции были выбраны.- Дважды щелкните значение в матрице и добавить график в области анализа. Создайте новые ворота, если это необходимо, чтобы исключить любые мертвые клетки / дублеты / ложные срабатывания; это новое утонченное положительное население может быть выбрано в поле матрицы в раскрывающемся меню для каждого канала.
- Повторите эту процедуру для каждого канала. Нажмите на кнопку «Готово», чтобы сохранить compensatioп матрица (.ctm файл).
- Получить анализ данных файл (.daf) из исходного файла (.rif) при загрузке файла .rif в программное обеспечение для анализа и применения матрицы компенсации.
- После того, как будут загружены данные, выполнить стробирование для идентификации Т-клеток-APC контактных событий.
Примечание: Типичная стратегия стробирования включает в себя определение в фокусе событий, выбирая дублеты на основе критериев размера (площади по сравнению с соотношением сторон события), и выбор Т - клеток APC дублетов как события, которые дважды положительным результатом на Т-клетку и APC маркеры (рис 1A-C).
Примечание: Соотношение сторон представляет собой отношение ширины события к его высоте, что позволяет дискриминацию отдельных клеток (соотношение близко к 1) от дублетов (отношение близко к 0,5). - Определить в фокусе событий пути построения среднеквадратичного квадрат скорости изменения профиль интенсивности изображения (градиент RMS) в светлопольном канале (Фигура 1А). Нажмите на гое градиенты RMS гистограммы для отображения событий на ячейки в отдельных бункерах, а затем поместить ворота исключая вне фокуса события.
- Участок площади по сравнению с соотношением сторон канала светлопольного и рисовать затвор , который идентифицирует дублеты на основе формы и размера (Фиг.) событий. Обзор изображения событий только внутри и вне границ этих ворот может помочь аналитике уточнить размер ворота и положение. Затем построить график этих дублетных событий, в которых появляется интенсивность клеточных маркеров Т на одной оси, а с другой появляется интенсивность маркеров APC. Рисовать дублет ворота Т-APC, содержащий события положительные для обоих маркеров.
- Среди дублетных событий Т-клеток-APC, выберите события, которые содержат только одну Т-клетки и одну APC.
- Делайте это путем построения графика соотношения сторон в сравнении с областью для маркеров APC и стробирования на дублетах , содержащих один APC (рис 1D). Участок соотношения сторон в сравнении с зоной для знака Т-клетокэр и ворота на дублетах , содержащих один Т - клетки (рис 1E).
Примечание: Дальнейшее уточнение может быть достигнуто путем построения гистограммы функции подсчета места применительно к ядерной флуоресценции пятен и стробированию на событиях только с двумя пятнами (рис 1F).
- Делайте это путем построения графика соотношения сторон в сравнении с областью для маркеров APC и стробирования на дублетах , содержащих один APC (рис 1D). Участок соотношения сторон в сравнении с зоной для знака Т-клетокэр и ворота на дублетах , содержащих один Т - клетки (рис 1E).
- В некоторых случаях эти две клетки внутри дублета не будет находиться в контакте; для идентификации клеток в контакте друг с другом, определяют объект маски для АРС и Т-клеток.
- Используйте опцию «Маски» в меню Analysis, чтобы открыть диспетчер Маски и определить новую маску. Введите имя, такие как «объект Т-клеточной маска». Нажмите кнопку «Функции», а затем в диалоговом окне выберите «Объект».
- Выберите канал , в котором обнаружен Т-клеточный маркер (например, CH06). Нажмите кнопку "OK".
Примечание: "Объект (M06, CH06, Tight)" отображается в поле Function. Эта маска объекта по умолчанию, как правило, присткс, но может потребовать оптимизации. - Повторите этот процесс для создания объекта маски APC в соответствующем канале.
- После идентификации APC и Т-клеточные масок, определяют мембранного контакт пути нанесения маркеров интенсивности флуоресценции Т-клетки в объектной маске APC против интенсивности флуоресценции APC в маске объекта Т-клетки. На этом участке, нарисовать затвор, который включает в себя только клетку в контакте друг с другом.
Примечание: Как правило, существует довольно четкие дважды положительные и дважды отрицательные популяции (фиг.2А). Границу между двойным положительным и отрицательным двойным населением можно установить путем анализа Светлых изображений клеток в пограничной области для того, чтобы клетки в контакте находятся в воротах, и клетка не в контакте исключена. - На данном этапе вручную просмотреть фаллоидин FITC изображения событий в этих воротах, чтобы различать зрелые иммунные синапсы от простого межклеточного контакта. Uзе функция «тег изображения», чтобы отметить эти изображения.
Примечание: Процент меченых иммунные событий (синапсы) внутри этих ворот может быть использован в качестве показателя прямой аллореактивности в популяции Т-клетки изучается.
Результаты
Этот метод был использован для исследования CD4 + аллореактивности Т-клетки у мышей , оказываемая толерантен к аллоантигенам донора перед гетеротопической трансплантацией сердца аллотрансплантата. На мышь линии СВА (H-2 к) были даны протокол , состоящий из способствующего развития толерантности донора-специфического (B6, Н-2 б) переливания крови в сочетании с не истощает CD4 - антитело одного месяца до получения B6 сердечного трансплантата. Этот результат протокола на долговременном выживании аллотрансплантата , который зависит от FOXP3 + регуляторных Т - клеток 36, 37. Через семь дней после трансплантации, селезенки CD4 + Т - клетки были получены из толеризованных и нетолеризованных получатели B6 сердечных аллотрансплантатов и совместно инкубировали с В6 полученных из костного мозга ДК в соответствии с этим протоколом. Рисунок 2 показывает репрезентативные данные из этого эксперимента. Мембраны контакт затвора показана на рисунке 2А, с зелеными перекрестия размещены на синаптическое событии (левая панель, 1) и на не-синаптическое событии (правая панель). Фигура 2В показывают Светлые и флуоресценцию каналы для этого события. Для уменьшения смещения, данные были проанализированы с помощью наблюдателя слепом к назначению лечения 23. Как показано на нескольких примерах на фиг.3, как из нетолеризованных (Фигура 3А-В) и толеризованных (рис 3C-D) , получатели карбоксибензальдегида B6 сердца, синапсы легко отличить от не-синаптических контактов наличием плотного ФИТЦ-положительного хребта на границе Т-APC. Эти результаты показывают, что визуальное обнаружение иммунных синапсов, сделанных Т-клеток-реципиентов отслеживает со степенью аллореактивности у реципиента.
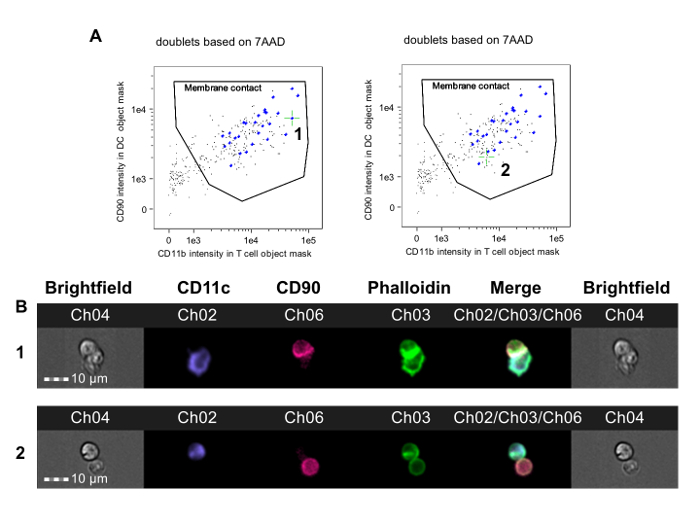
Рисунок 2. Идентификация Т-APC дублетов с мембранойКонтакт и Иммунная Synapse свита. События в окончательном дублета ворот (рис 1F) анализируются. А. Т-клеточный маркер флуоресценция в маске объекта APC представлена в зависимости от APC маркеров флуоресценции в маске объекта постоянного тока. Некоторые события дублетных имеют APC и Т-клетки без межклеточного контакта и появляются в нижнем левом углу участка (изображения не показаны). Мембрана контакт затвора, таким образом, может быть сделан вывод, что включает в себя только дублеты, в котором Т-клетки и АРС находятся в контакте. Изображения каждого события в этих воротах рассматриваются для доказательства актина цитоскелета перегруппировки в канале фаллоидина-FITC и могут быть помечены с помощью программного обеспечения для анализа. Левая панель показывает иммунное событие синапсов (с маркировкой 1 и обозначены зеленым перекрестием), в то время как правая панель указует на мембрану контакт событие без образования иммунного синапса (помеченные 2 и обозначены зеленым перекрестие). Определение формирования синапсов требует ручного обзора этихизображения, как показано в B. B. Верхняя строка показывает Светлое и флуоресценцию канал изображения для дублета с иммунным синапсом (соответствует событию 1 в А); нижняя строка показывает дублет с мембраной контакта, но не хватает формирования синапсов (соответствует событию 2 в А). Данные были проанализированы слепым методом по отношению к проводимому лечению и от ранее опубликованного эксперимента 23. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
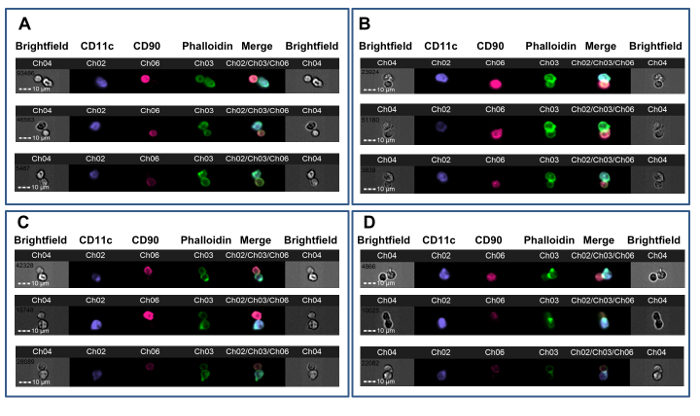
Рисунок 3. Примеры Т-APC Synapse формации. На мышах линии СВА получили сердечные аллотрансплантаты от доноров B6 после того, как либо нет предварительной обработки (AB) или после индукции толерантности с B6 цельной кровью под прикрытием не-разрушающих антител против CD4 ( Ронг> CD). Через 7 дней, селезенки CD4 + Т - клетки были испытаны для образования синапса с B6 РС. А. Три примера , не синаптические дублетов с мембраной из контакта нетолеризованных животных. Б. Три примера иммунных синапсов из не-толеризованного животного. С. Три примера , не синаптические дублетов с мембраной контактом из толеризованного животного. D. Три примера иммунных синапсов из толеризованного животного. формирование синапса указывается присутствием яркого, ФИТЦ-положительного хребта на границе Т-APC (CH03). Данные были проанализированы слепым методом по отношению к проводимому лечению и от ранее опубликованного эксперимента 23. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Таблица 1. Антитела и красители , используемые в данном исследовании. Флуорохром-конъюгированные антитела, красители, поставщики, и рекомендуемые концентрации представлены в таблице. Поток изображений цитометра канала, который был использован для обнаружения каждого флуорохрома также показан в таблице.
Обсуждение
Изображений проточной цитометрии был использован , чтобы продемонстрировать формирование иммунного синапса между моноклональными Т - клеток и АРС или в присутствии суперантигенов 24, 25, 26, 27, 28. Этот метод использует тот факт , что после продуктивного Т-клеток APC контакта, Т - клетка перестраивает свой актиновый цитоскелет, поляризационный его к месту контакта 21. Эта перестановка не происходит без сигнализации TCR, и поэтому она является ранним коррелятом активации Т-клеток 19, 20, 21. Метод, представленный здесь адаптируется этот подход к измерению аллореактивных частот Т-клетки в популяции Т-клетки поликлональной. Как таковой, он может в будущем служить в качестве основы для разработки тестов для доноров reactivi ти в клинической трансплантации.
Хотя прямые сравнения еще не было сделано, обнаружение аллореактивными иммунных синапсов, как представляется, имеют высокую предсказательную силу, чем обычные СКЛ. Например, предыдущая работа показала , что в протокол было описано выше , способствующие развитию толерантности, результаты в MLR не достоверно коррелирует с исходом трансплантата 2.
Целый ряд анализов были разработаны для операционно толерантного состояния у человека 9, 10, 11, хотя они не измеряют эффекторной функции клеток в ответ на аллоантиген. В противоположность этому , IFN- , ELISPOT анализах функции 8 мера эффекторных Т-клеток , но не может охватить весь спектр секреции цитокинов , которые могут иметь отношение к острым и хроническим отторжение аллотрансплантата, такие как IL-17 38,> 39. Предельного разбавления для анализа 4, который является трудоемким, а анализ транс-виво 6, который требует мышей, имеют существенные практические ограничения , которые препятствуют их применение в клинической практике . Недавние усовершенствования по анализу пролиферирующих клеток с использованием анализа последовательности TCR Т - клетки , реагирующих в СКЛЕ могут иметь значение, но , как анализ , представленный здесь, требуют дальнейшей проверки в клинических исследованиях 18, 40.
Дальнейшее развитие анализа на обнаружение иммунного синапса потребует ряд важных вопросов без ответа. Во-первых, анализ, разработанные только меры прямого аллореактивности. Прямой путь включает презентацию аллогенных MHC / пептидные комплексы на донорном полученное АРС. Последнее, как правило, устраняются быстро после трансплантации, и далее аллоантиген презентация Карриред путем АРС-получателей, представляющее нетронутые доноры MHC (пол-прямого путем) или обработанных антигенами-доноров на себя MHC (непрямой путь). Непрямой путь является важным фактором хронического отторжения аллотрансплантата 33, 41.
В принципе, это должно быть возможно обнаружить косвенные иммунные синапсы с помощью этого анализа, но косвенно аллореактивный Т - клетка имеет значительно более низкую частоту , чем прямые из них 42, 43, а это означает , что потребуется анализ большего числа событий. Второе соображение состоит в том , что мы проверили только с помощью этого анализа CD4 + Т - клеток, тогда как CD8 + Т - клетки также являются важным компонентом ответа анти-донора. Опять же , это должно быть возможно обнаружить CD8 + Т - клеток-APC синапсы с использованием этого метода. Другим ограничением является то, что этот метод требует ручной обзор и анализ изображений клеток в конечном MembRane контакт ворота, и мы сейчас работаем над автоматизацией этого шага.
Наконец, метод требует тестирования и развития в людях, и предварительные исследования с человеческими образцами в настоящее время выполняются. Далее фенотипический анализ Т-клетки подмножества (т.е. эффектор, память, нормативный и т.д.) в сочетании с обнаружением иммунных синапсов в реципиентах будет представлять собой мощный подход для характеристики аллореактивного Т-клеточного репертуара и будет важным направлением для будущая работа.
Раскрытие информации
Авторы не имеют ничего раскрывать.
Благодарности
SCJ была поддержана Международным обществом сердца и легких Трансплантация Research Fellowship и Королевского колледжа врачей и хирургов Канады Detweiler путешествую Fellowship.SM была частично поддержана Международным обществом сердца и легких Трансплантация премии развития карьеры (к) ВСП. СС при поддержке Национального института исследований в области здравоохранения Oxford Biomedical Research Centre.JH является получателем почки Research UK Старший Неклинические Fellowship. Эта работа финансировалась следующими гранты AB и KW: в Wellcome Trust грантовой программе (082519Z07Z), в British Heart Foundation Program Grant (PG / 10 / 62,28504) и Рамочной программы ЕС 7 (в одном исследовании; BioDRIM). Авторы хотели бы поблагодарить Майкл Парсонса и проточная цитометрия основного комплекса в научно-исследовательском институте Lunenfeld-Таненбаум, систему здравоохранения Синая, Торонто для обеспечения доступа и поддержки с инструментом ImageStream Mark X.
Материалы
| Name | Company | Catalog Number | Comments |
| Phosphate-buffered saline | Various | Varies | |
| Ethylenediamenetetraacetic acid, 0.5 M solution | Thermo Fisher Scientific | AM9260G | |
| Triton X-100 nonionic detergent | Sigma-Aldrich | X100 | |
| Beta-mercaptoethanol | Sigma-Aldrich | M3148 | |
| Dimethyl sulfoxide | Sigma-Aldrich | D8418 | |
| Formaldehyde | Sigma-Aldrich | F1635 | Solution is 37% formaldehyde and so must be diluted 25 times for 1.5% solution |
| Cell strainers, 70 μm pore size | Fisher Scientific | 08-771-2 | |
| Phalloidin-fluorescein isothiocyanate | Sigma-Aldrich | P5282 | |
| 7-aminoactinomycin D | Thermo Fisher Scientific | A1310 | Reconstitute in DMSO |
| Allophycocyanin-conjugated anti-mouse CD90.2 | eBioscience | 17-0902 | |
| Pacific blue-conjugated anti-mouse CD11b | eBioscience | 48-0112 | Pacific blue has been replaced by eFluor 450 |
| Biotinylated anti-mouse CD3 | eBioscience | 13-0032 | |
| Biotinylated anti-mouse MHC class II | eBioscience | 13-5321 | |
| Biotinylated anti-mouse B220 | eBioscience | 13-0452 | |
| Biotinylated anti-mouse CD8 | eBioscience | 13-0081 | |
| Biotinylated anti-mouse CD19 | eBioscience | 13-0193 | |
| Anti-biotin microbeads | Miltenyi Biotec | 130-090-485 | |
| LS columns | Miltenyi Biotec | 130-042-401 | |
| MidiMACS magnetic cell separator | MIltenyi Biotec | 130-042-302 | |
| recombinant mouse GM-CSF | Peprotech | 315-03 | |
| recombinant human TGFβ1 | Peprotech | 100-21 | Human TGFβ1 has activity on mouse cells |
| Amnis ImageStream X Mark II | Amnis/EMD Millipore | N/A | Imaging flow cytometer; details available at http://www.emdmillipore.com/ |
| IDEAS Software | Amnis/EMD Millipore | N/A | Free download (registration required): https://www.amnis.com/index.php/page/Display/login%20%20 |
| Cell culture medium | Various | Varies | |
| Fetal bovine serum | Various | Varies | |
| Cell culture plates | Various | Varies |
Ссылки
- Cravedi, P., Heeger, P. S. Immunologic monitoring in transplantation revisited. Curr Opin Organ Transplant. 17 (1), 26-32 (2012).
- Pearson, T. C., et al. The assessment of transplantation tolerance induced by anti-CD4 monoclonal antibody in the murine model. Transplantation. 55 (2), 361-367 (1993).
- Strober, S., Benike, C., Krishnaswamy, S., Engleman, E. G., Grumet, F. C. Clinical transplantation tolerance twelve years after prospective withdrawal of immunosuppressive drugs: studies of chimerism and anti-donor reactivity. Transplantation. 69 (8), 1549-1554 (2000).
- Fussell, S. T., Donnellan, M., Cooley, M. A., Farrell, C. Cytotoxic T lymphocyte precursor frequency does not correlate with either the incidence or severity of graft-versus-host disease after matched unrelated donor bone marrow transplantation. Transplantation. 57 (5), 673-676 (1994).
- Roelen, D. L., et al. Relevance of cytotoxic alloreactivity under different immunosuppressive regimens in clinical islet cell transplantation. Clin Exp Immunol. 156 (1), 141-148 (2009).
- VanBuskirk, A. M., et al. Human allograft acceptance is associated with immune regulation. J Clin Invest. 106 (1), 145-155 (2000).
- Poggio, E. D., Clemente, M., Hricik, D. E., Heeger, P. S. Panel of reactive T cells as a measurement of primed cellular alloimmunity in kidney transplant candidates. J Am Soc Nephrol. 17 (2), 564-572 (2006).
- Zitzner, J. R., Tambur, A. R. Role of ELISPOT Assays in Risk Assessment Pre- and Post-Kidney Transplantation. Cells. 1 (2), 100-110 (2012).
- Newell, K. A., et al. Identification of a B cell signature associated with renal transplant tolerance in humans. J Clin Invest. 120 (6), 1836-1847 (2010).
- Brouard, S., et al. Identification of a peripheral blood transcriptional biomarker panel associated with operational renal allograft tolerance. Proc Natl Acad Sci U S A. 104 (39), 15448-15453 (2007).
- Sagoo, P., et al. Development of a cross-platform biomarker signature to detect renal transplant tolerance in humans. J Clin Invest. 120 (6), 1848-1861 (2010).
- Halloran, P. F., Famulski, K. S., Reeve, J. Molecular assessment of disease states in kidney transplant biopsy samples. Nat Rev Nephrol. 12 (9), 534-548 (2016).
- Li, L., et al. Identification of common blood gene signatures for the diagnosis of renal and cardiac acute allograft rejection. PLoS One. 8 (12), e82153(2013).
- Khatri, P., et al. A common rejection module (CRM) for acute rejection across multiple organs identifies novel therapeutics for organ transplantation. J Exp Med. 210 (11), 2205-2221 (2013).
- Halloran, P. F., et al. Microarray diagnosis of antibody-mediated rejection in kidney transplant biopsies: an international prospective study (INTERCOM). Am J Transplant. 13 (11), 2865-2874 (2013).
- Mastoridis, S., Issa, F., Wood, K. J. Novel biomarkers and functional assays to monitor cell-therapy-induced tolerance in organ transplantation. Curr Opin Organ Transplant. 20 (1), 64-71 (2015).
- Miqueu, P., et al. Analysis of the peripheral T-cell repertoire in kidney transplant patients. Eur J Immunol. 40 (11), 3280-3290 (2010).
- Morris, H., et al. Tracking donor-reactive T cells: Evidence for clonal deletion in tolerant kidney transplant patients. Sci Transl Med. 7 (272), 272ra210(2015).
- Dustin, M. L., Bromley, S. K., Kan, Z., Peterson, D. A., Unanue, E. R. Antigen receptor engagement delivers a stop signal to migrating T lymphocytes. Proc Natl Acad Sci U S A. 94 (8), 3909-3913 (1997).
- Goldsmith, M. A., Weiss, A. Early signal transduction by the antigen receptor without commitment to T cell activation. Science. 240 (4855), 1029-1031 (1988).
- Grakoui, A., et al. The immunological synapse: a molecular machine controlling T cell activation. Science. 285 (5425), 221-227 (1999).
- Stoll, S., Delon, J., Brotz, T. M., Germain, R. N. Dynamic imaging of T cell-dendritic cell interactions in lymph nodes. Science. 296 (5574), 1873-1876 (2002).
- Juvet, S. C., Sanderson, S., Hester, J., Wood, K. J., Bushell, A. Quantification of CD4(+) T Cell Alloreactivity and Its Control by Regulatory T Cells Using Time-Lapse Microscopy and Immune Synapse Detection. Am J Transplant. 16 (5), 1394-1407 (2016).
- Ahmed, F., Friend, S., George, T. C., Barteneva, N., Lieberman, J. Numbers matter: quantitative and dynamic analysis of the formation of an immunological synapse using imaging flow cytometry. J Immunol Methods. 347 (1-2), 79-86 (2009).
- Burbach, B. J., et al. Distinct regulation of integrin-dependent T cell conjugate formation and NF-kappa B activation by the adapter protein ADAP. J Immunol. 181 (7), 4840-4851 (2008).
- Markey, K. A., et al. Cross-dressing by donor dendritic cells after allogeneic bone marrow transplantation contributes to formation of the immunological synapse and maximizes responses to indirectly presented antigen. J Immunol. 192 (11), 5426-5433 (2014).
- Moreau, H. D., et al. Dynamic in situ cytometry uncovers T cell receptor signaling during immunological synapses and kinapses in vivo. Immunity. 37 (2), 351-363 (2012).
- Wabnitz, G. H., Nessmann, A., Kirchgessner, H., Samstag, Y. InFlow microscopy of human leukocytes: A tool for quantitative analysis of actin rearrangements in the immune synapse. J Immunol Methods. , (2015).
- Ford, W. L., Simmonds, S. J., Atkins, R. C. Early cellular events in a systemic graft-vs.-host reaction. II. Autoradiographic estimates of the frequency of donor lymphocytes which respond to each Ag-B-determined antigenic complex. J Exp Med. 141 (3), 681-696 (1975).
- Macedo, C., et al. Contribution of naive and memory T-cell populations to the human alloimmune response. Am J Transplant. 9 (9), 2057-2066 (2009).
- Noorchashm, H., et al. A direct method for the calculation of alloreactive CD4+ T cell precursor frequency. Transplantation. 67 (9), 1281-1284 (1999).
- Suchin, E. J., et al. Quantifying the frequency of alloreactive T cells in vivo: new answers to an old question. J Immunol. 166 (2), 973-981 (2001).
- Lee, R. S., et al. Indirect recognition of allopeptides promotes the development of cardiac allograft vasculopathy. Proc Natl Acad Sci U S A. 98 (6), 3276-3281 (2001).
- Pickl, W. F., et al. Molecular and functional characteristics of dendritic cells generated from highly purified CD14+ peripheral blood monocytes. J Immunol. 157 (9), 3850-3859 (1996).
- Inaba, K., et al. Generation of large numbers of dendritic cells from mouse bone marrow cultures supplemented with granulocyte/macrophage colony-stimulating factor. J Exp Med. 176 (6), 1693-1702 (1992).
- Francis, R. S., et al. Induction of transplantation tolerance converts potential effector T cells into graft-protective regulatory T cells. Eur J Immunol. 41 (3), 726-738 (2011).
- Saitovitch, D., Bushell, A., Mabbs, D. W., Morris, P. J., Wood, K. J. Kinetics of induction of transplantation tolerance with a nondepleting anti-Cd4 monoclonal antibody and donor-specific transfusion before transplantation. A critical period of time is required for development of immunological unresponsiveness. Transplantation. 61 (11), 1642-1647 (1996).
- Faust, S. M., et al. Role of T cell TGFbeta signaling and IL-17 in allograft acceptance and fibrosis associated with chronic rejection. J Immunol. 183 (11), 7297-7306 (2009).
- Yuan, X., et al. A novel role of CD4 Th17 cells in mediating cardiac allograft rejection and vasculopathy. J Exp Med. 205 (13), 3133-3144 (2008).
- Emerson, R. O., Mathew, J. M., Konieczna, I. M., Robins, H. S., Leventhal, J. R. Defining the alloreactive T cell repertoire using high-throughput sequencing of mixed lymphocyte reaction culture. PLoS One. 9 (11), e111943(2014).
- Stanford, R. E., Ahmed, S., Hodson, M., Banner, N. R., Rose, M. L. A role for indirect allorecognition in lung transplant recipients with obliterative bronchiolitis. Am J Transplant. 3 (6), 736-742 (2003).
- Benichou, G., Valujskikh, A., Heeger, P. S. Contributions of direct and indirect T cell alloreactivity during allograft rejection in mice. J Immunol. 162 (1), 352-358 (1999).
- Liu, Z., et al. Contribution of direct and indirect recognition pathways to T cell alloreactivity. J Exp Med. 177 (6), 1643-1650 (1993).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены