Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Модель WinCF - недорогой и увлекательный микрокосм слизистой бронхиолы для изучения микробиологии легких
В этой статье
Резюме
Слизь, закупоренная воздухоносами пациентов с муковисцидозом (CF), является идеальной средой для развития микробных патогенов. В рукописи описан новый метод изучения микробиома легкого CF в среде, которая имитирует, где они вызывают заболевание, и как изменения химических условий могут стимулировать микробную динамику.
Аннотация
Многие хронические заболевания дыхательных путей в результате закупорки слизи из дыхательных путей. Лёгкий человек с муковисцидозом является примерным случаем, когда их слизистые пробками бронхиол создают благоприятную среду обитания для микробной колонизации. Различные патогенные микроорганизмы процветают в этой среде взаимодействующего друг с другом и движущие многими из симптомов, связанных с болезнью CF. Как и любой микробного сообщества, химические условия их обитания оказывают значительное влияние на структуру и динамику сообщества. Например, различные микроорганизмы процветают в различных уровнях кислорода или других концентраций растворенного вещества. Это также верно и в CF легких, где концентрация кислорода, как полагают, диск сообщества физиологию и структуру. Методы, описанные здесь, предназначены для имитации среды легкой и расти патогенных образом более похожи на то, из чего они вызывают заболевание. Манипулирование химического окружения этих микробов затем используется для изучения того, как в КемиИнтенсивность инфекций легкого определяет ее микробную экологию. Метод, называемый системой WinCF, основан на искусственной среде мокроты и узких капиллярных трубках, предназначенных для обеспечения градиента кислорода, подобного тому, который существует в слизистых бронхиолах. Манипулирование химическими условиями, такими как рН среды мокроты или давлением антибиотиков, позволяет визуализировать микробиологические различия в этих образцах с использованием цветных индикаторов, наблюдать за образованием газа или биопленки или экстрагировать и секвенировать содержание нуклеиновых кислот в каждом образце.
Введение
Описано в этой рукописи метод называют систему WinCF 1. Общая цель WinCF заключается в создании экспериментальной установки, способную моделировать среду слизи заполненных бронхиол легкихов. Это позволит для послушной системы для изучения микробных возбудителей заболеваний легких с гиперсекреции слизи фенотипа в том числе муковисцидоз (CF), хроническая обструктивная болезнь легких (ХОБЛ), астма и другие. Процедура была разработана специально для изучения CF, который характеризуется мутациями , которые вызывают выделения легких , чтобы стать толстыми и трудно очистить, в конце концов заполнение бронхиолы и другие небольшие проходов со слизью 2. Такие закупорки в легких не препятствуют газообмена , потому что вдыхаемый воздух больше не в состоянии достигнуть многих альвеол , а также обеспечивают среду обитания для бактериальной колонизации 3, 4. Невозможность предотвратить рост микробов вЧрезмерная легкая слизь в конечном итоге приводит к развитию сложных хронических инфекций дыхательных путей. Эти сообщества содержат множество организмов, включая вирусы, грибы и бактерии, такие как Pseudomonas aeruginosa , все взаимодействующие друг с другом 5 , 6 , 7 , 8 . Считается, что активность микробиома легкого МВ участвует во вспышках симптомов, называемых обострениями легких 1 , 9 , 10 , 11 . WinCF позволяет изучать поведение микробного сообщества вокруг этих обострений и в настоящее время расширяется, чтобы выступать в качестве базовой экспериментальной системы для изучения микробной экологии легких. Традиционно обострения изучались путем прямого анализа проб, взятых из легких. Много смешающих факторов делают прямой анализ микробного behavior в легкой сложном, с системой WinCF, многие из этих факторов удаляются и поведение микробиома легких может быть изучено более непосредственно, что позволяет более тонкого анализ бактериальной активности в слизи пробок бронхиолы.
Система WinCF обеспечивает способ расти и анализировать бактерии таким образом, что эффективно имитирует среду легких. Традиционные методы выращивания бактерий легкой часто вовлеченные образцы культивирования на традиционных чашках с агаром. Эти методы оставляют образцы открытыми для атмосферного кислорода, пренебрегая для учета гипоксических и часто бескислородных условий в бронхиолах легких , подключенных со слизью 12, 13. Культивирование на агаре в аэробных условиях не что иное, как среды CF легких и может ввести в заблуждение врачей и исследователей относительно поведения патогенов, которые они пытаются лечить. Кроме того, питательные вещества, доступные для бактерий на чашкахОтличаются от имеющихся в фактической мокроте, которая учитывается в WinCF за счет использования искусственной мокроты (ASM). Как показывают культуры Pseudomonas у Sriramulu et al. 14 , ASM включает в себя определенный набор компонентов, который имитирует ресурсы, доступные для микробов мокроты, а также повторяет физическую консистенцию мокроты. Поскольку у больного легкого есть специфический микробиома, изучение таких микроорганизмов в идеале должно происходить и в специфических условиях легкого.
Система WinCF позволяет быстро анализировать и легко манипулировать условиями эксперимента, чтобы наблюдать микробные изменения, похожие на то, как они происходят в фактическом бронхиоле легких. Эта методика позволяет инокулировать несметное число родственных типов образцов, включая мокроту, слюну, другие секреты тела и чистые или смешанные бактериальные культуры. Характер экспериментальной установки позволяет сразу визуально интерпретироватьмикробное поведение сообщества и предназначено для того, чтобы легко наносить вниз по течению от множества микробиологических и omics процедур. Такие исследования имеют важное значение, потому что бактериальные изменения состава сообщества на основе физико-химических условий окружающей их среды. С WinCF химических условий в средствах массовой информации можно манипулировать, чтобы проанализировать влияние на бактериальной активности. Так, например, кислотность в средствах массовой информации может быть изменена перед посевом с образцом. После инкубации бактериальной активности в каждой из этих условий можно непосредственно сравнивать, и могут быть сделаны выводы о том, как бактерии в этих образцах мокроты ведут в ответ на изменения рН. Здесь мы опишем порядок применения системы WinCF и примеры того, как химия СМИ можно манипулировать, чтобы изучить воздействие на микробиомом легких.
протокол
1. Подготовка запасов для искусственного мокроты СМИ
- Создание 5% раствора муцин. Добавить 1,0 г обезвоженного желудка свиньи муцин до 20 мл деионизированной воды. Автоклав полученного раствора.
Примечание: муцин стерилизация разрушит присущую структуру; другие способы стерилизации муцина в сухой форме включают в себя УФ-облучение и стерилизацию. Эти методы не были широко использованы для системы WinCF однако. - Добавьте 2,2 г KCl до 50 мл деионизированной воды и обеспечить растворение. Добавить 5,0 г NaCl до 50 мл деионизированной воды и обеспечить растворение. Автоклав эти два решения.
- Добавляют 100 мг ДНК спермы лосося 10 мл стерильной деионизированной воды. Нагревают этот раствор до приблизительно 85 ° С на водяной бане в течение нескольких часов, чтобы обеспечить растворение.
- Добавить 5,0 мг ферритина в 5,0 мл стерильной деионизированной воды.
2. Приготовление искусственной среды мокроты
- скомбинироватьСледующие компоненты: 16 мл основного раствора муцина, 2,0 мл основного раствора KCl, 2,0 мл основного раствора NaCl, 200 мкл эмульсии яичного желтка, 5,6 мл исходного раствора ДНК, 120 мкл исходного раствора ферритина, 5,78 мл основного вещества Раствор аминокислоты, 5,78 мл незаменимого раствора аминокислоты и 2,44 мл стерильной воды.
- При появлении небольших количеств осадка слегка встряхните, чтобы перемешать.
- Внесите 5,0 мл среды в восемь стерильных пробирков для центрифугирования на 15 мл.
ПРИМЕЧАНИЕ. Химические условия каждой трубки можно регулировать по желанию. Например, буферные растворы и индикаторы рН могут добавляться в каждую пробирку с целью сравнения микробного поведения при различных уровнях рН. Демонстрация этого показана в разделе репрезентативных результатов с 8 различными уровнями рН, от 5,0 до 8,5 с шагом 0,5 рН.
- Как только химические условия среды успешно обрабатываются, замораживание для последующего использования. Средства массовой информации будут оставаться стабильнымиДзен при -20 ° C в течение нескольких месяцев. Вихрь при оттаивании.
3. Подготовка контрольного прогона капиллярных трубок
- В стерильной биоте, заполните восемь стерильных микроцентрифужных пробирок с 250 мкл среды каждый.
- Приобретите еще восемь стерильных 15 мл центрифужных пробирок, каждая из которых соответствует микроцентрифужной пробирке, упомянутой на этапе 3.1.
- Стерилизовать бумажное полотенце с 70% раствором этанола и дать высохнуть. После высыхания разрывайте полотенце на куски по четыре квадратных дюйма каждый и скомкайте каждый кусочек на дне центрифужной пробирки на 15 мл. Для дополнительных трубок, спрей и сухие дополнительные бумажные полотенца по мере необходимости.
- С одной глыбой бумаги в нижней части каждой центрифужной пробирки слегка смочите каждый скот бумаги приблизительно 1,0 мл стерильной воды, чтобы создать влажную среду.
- Приобретите три стеклянных капиллярных трубки для каждой микроцентрифужной пробирки, приготовленной на этапе 3.1, и блок капиллярной трубки шпатлевки Sealaнт.
- Для каждой трубки микроцентрифужной, заполняют три капиллярные трубки со средствами массовой информации до около 5 мм от синих маркеров в верхней части трубки.
- Заполните, удерживая один конец трубки в микроцентрифужных трубки и наклона в направлении горизонтальной ориентации, что позволяет капиллярного действия для направления среды в трубе (см рисунок 1).
- Остановить начинку, аккуратно поместив палец в перчатке над открытым концом трубки, а затем уплотнение другого конца трубки, нажав его вниз в блок герметика.

Рисунок 1: Пример рН градиент, заполнение капиллярной трубки с искусственной мокротой средой. Среда добавляются посредством вставки одного конца трубки в жидкость, и наклон, чтобы облегчить капиллярное действие. Среда окраски в этом примере, из-за индикатором рН добавлен, чтобы помочь демонаПотенциальные изменения кислотности после инкубации. Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Поместите каждый набор из трех капиллярных трубок в 15 мл центрифужные пробирки, заполненные бумажными полотенцами, полностью увлажненными стерильной водой, замазанной шпаклевкой стороной вниз. Закройте пробирку и этикетку. Эти три капиллярные трубки предназначены для репликации каждого условия управления.
- Когда все 15 мл центрифужные пробирки заполнены соответствующими капиллярными трубками, поместите их в стойку. Поместите стойку так, чтобы трубки были инкубированы горизонтально (чтобы улавливать пузырьки газа) (см . Рис. 2 ). Инкубируйте капиллярные трубки внутри центрифужных пробирок (содержащих увлажненные бумажные сгустки) при 37 ° С в течение 48 часов.
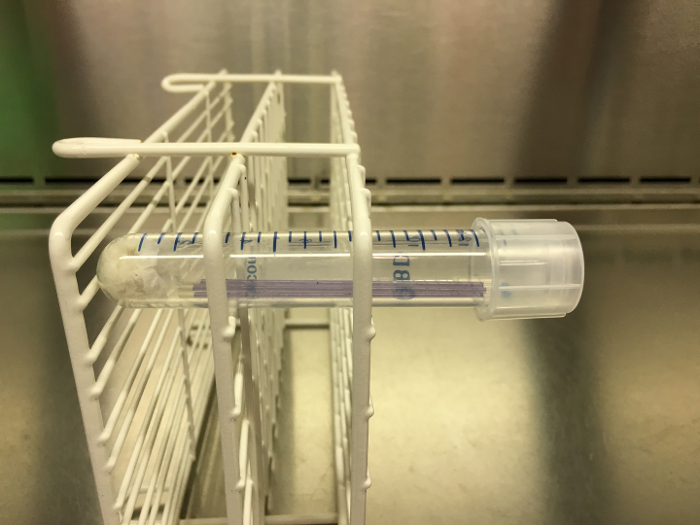
Рисунок 2: Пример градиента рН, капилляры Готовность к инкубации. После того, как три капиллярные трубки были заполнены и запечатаны, их помещают в центрифужную пробирку с влажным бумажным полотенцем в нижней части. Эта труба затем закрывают и помещают в стойку. Стойка должна быть ориентирована в сторону во время инкубации, как изображено здесь, так что добыча газа может наблюдаться как только инкубационный завершена. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
4. Визуализация управления капилляры после инкубации
- Снимите стойку центрифужные пробирки из инкубатора, убедившись, что держать трубки в горизонтальном положении. Осторожно вставьте капиллярные трубки из центрифужных пробирок, сохраняя каждый набор из трех отдельно от других множеств.
- Устройте капилляры рядом друг с другом на лайтбокса, все выстроились так, что содержимое трубок визавикие и освещено. Разорит каждые три труб для разделения различных химических условий.
- С трубкой выровнена и лайтбокс включен, фотография непосредственно сверху. (Смотри рисунок 3)

Рисунок 3: Пример градиента рН, контроль запуска, Преинкубация, нет Мокроту Добавлено. Искусственная слюна среды после добавления в капиллярные трубки в наборах из трех, увеличения рН слева направо. Сочетание показателей, добавленных к среде приводит к более кислым трубам появляются более желтым, в то время как менее кислые трубки становятся все более фиолетовым цветом. Трубки расположены горизонтально и подсвечиваются снизу, фотографировали сверху. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
- Утилизация изконтрольные материалы в биологически опасные отходы.
5. инокуляция WinCF капиллярных трубок с образцом мокроты
- В стерильной biohood, заполняют восемь стерильные пробирки микроцентрифужных с 225 мкл среды в каждой.
- Однородный образец мокроты путем удаления и извлечения мокроты повторно с 3 мл шприца (пластмассовый шприц без иглы). Делайте это до тех пор, мокрота не является гладкой консистенции.
- Добавьте 25 мкл гомогенизированной мокроты в каждую пробирку микроцентрифужных (1/10 разбавления в ASM средах), полученного на стадии 5.1. Затем вихрь пробирки в течение 30 лет, чтобы смешать в достаточной степени.
- Добавьте носитель для капиллярных трубок следуя той же процедуре, что и этапы 3.2 через 3.5.
6. Визуализация образца капилляры после инкубации
- После 48-часового периода инкубации, удалить и изображения капиллярных трубок следуя той же процедуре, что и этапы 4.1 через 4.3.
- Если пузырьки присутствуют в трубах, сделатьуверены, что фотографии, сделанные явно изображают разграничение пузырьков и средств массовой информации в трубках. Если биопленки присутствуют, убедитесь, что фотографии могут четко изобразить свое присутствие, а также.
7. Удаление СМИ для последующих применений
- Для того, чтобы облегчить анализ вниз по течению, удалить носитель из капиллярных трубок после визуализации. Потенциальные области применения включают в себя культивирование и ДНК / РНК последовательности и метаболомики профилирование.
Внимание: капиллярные трубки стеклянных, наполненные возбудителями являются существенной биологическая_опасность, таким образом, эти шаги необходимо сделать очень тщательно с конкретным оборудованием. Если капилляры ломаются, отчуждать в исправном контейнере биологическая_опасности Шарпса. - Используйте тупые иглы 25 калибра и 0,5 дюйма в длине, чтобы удалить носитель. Вставьте тупыми иглу в вставлен конец трубы, чтобы сломать печать.
- После того, как вскрыть пломбу, повернуть капиллярную трубку вверх дном и средства массовой информации будут капать из верхней части. яF среда не капает легко, используйте пипетку с кончиком 200 μL и вытащите среду из трубки, надавив на пипетку пипетки, когда вставите ее в конец капиллярной трубки. Соберите вытесненные трубчатые среды в подходящем контейнере (1,5 мл центрифужная пробирка).
ПРИМЕЧАНИЕ. Для транскрипционного или другого анализа РНК среда может быть выслана непосредственно в буферы стабилизации РНК.
8. Система флюда WinCF
ПРИМЕЧАНИЕ. Утилита WinCF Fluid Loading Utility (FLUD) - это дополнительный набор дополнительных устройств, предназначенных для оптимизации пропускной способности системы WinCF. WinCF FLUD System состоит в основном из 3D-материалов для печати. Трехмерное печатное производство позволяет быстро и легко заменять материалы для обеспечения минимального времени простоя для исследователей, а также минимальных производственных требований. Проекты, stl-файлы, инструкции по 3D-печати и руководство WinCF FLUD доступны в онлайн-версиинт.
- Подготовка среды для загрузки капиллярной трубки
- В стерильной biohood, заполняют восемь стерильного 2 мл микроцентрифужных пробирки с 900 мкл среды каждого.
- Однородная любые образцы мокроты путем удаления и извлечения мокроты повторно с 3 мл шприца (пластмассовый шприц без иглы). Делайте это до тех пор, мокрота не является гладкой консистенции.
- Добавьте 100 мкл гомогенизированной мокроты в каждую пробирку микроцентрифужных (1/10 разбавления в среде), полученного на стадии 8.1.1. Затем вихрь пробирки в течение 30 лет, чтобы смешать в достаточной степени.
- Слот заполненные и открытые микроцентрифужных трубки в держатель трубки ротатор ориентирован так, что трубы расположены вертикально.
- Размещение капиллярных трубок
- Получить три капиллярные трубки для каждой трубки микроцентрифужной на этапе 8.1.
- Слот три трубки в резиновой подставку так, чтобы они совместились с микропробирками на другом конце устройства.Убедитесь, что отмечены концы трубок отворачиваться от микропробирок. Установите три отверстия на нижней стороне подставки правильно над тремя шипами на люльке стенде.
- С размещаемых капиллярами отдыхают в своих направляющих каналах на устройстве, поместите резиновые утрамбовать над их midsections надежно, чтобы предотвратить смещение. (Смотрите рисунок 4)

Рисунок 4: FLUD Система Fully Loaded с капиллярами обеспеченных Rubber утрамбуйте За их Midsections. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
- Загрузка носителя в капиллярных трубок
- Осторожно использовать одну руку, чтобы захватить конец устройства, где капиллярные трубы лиAded, а другой рукой держите ротаторную стойку, в которую загружены микроцентрифужные трубки.
- Деликатно вращайте стойку микроцентрифуги так, чтобы микроцентрифужные трубки были почти горизонтальными и медленно продвигайте стойку к капиллярным трубкам. (См . Рисунок 5 )
- Когда концы капиллярных трубок контактируют со средой в микроцентрифужных пробирках, убедитесь, что капиллярное действие немедленно начинает заполнять капиллярные трубки. Чтобы настроить скорость заполнения и уровень заполнения, аккуратно поверните устройство в целом. Делая это, будьте осторожны, чтобы не высыпать среду из микроцентрифужных пробирок. (См . Рисунок 6 )
- Когда капиллярные трубки заполняются до желаемого уровня, поместите аппарат на поверхность и аккуратно, но быстро вытащите стойку микроцентрифужных трубок с концов капиллярных трубок, чтобы прекратить наполнение. Теперь микроцентрифужные трубки можно отвести назад до вертикального положения и закрыть,
- Запечатайте выступающие концы капиллярных трубок, надавив блок герметика на каждый тройной набор, запечатывая один комплект за один раз, пока все наборы не запечатаны. Чтобы уменьшить риск загрязнения, нажмите на другую часть герметизирующего блока на каждый набор из трех экземпляров (см . Рис. 7 ).

Рисунок 5: Система FLUD со средними трубами, установленными на горизонтальную ориентацию, готова к контакту с капиллярными трубками. Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
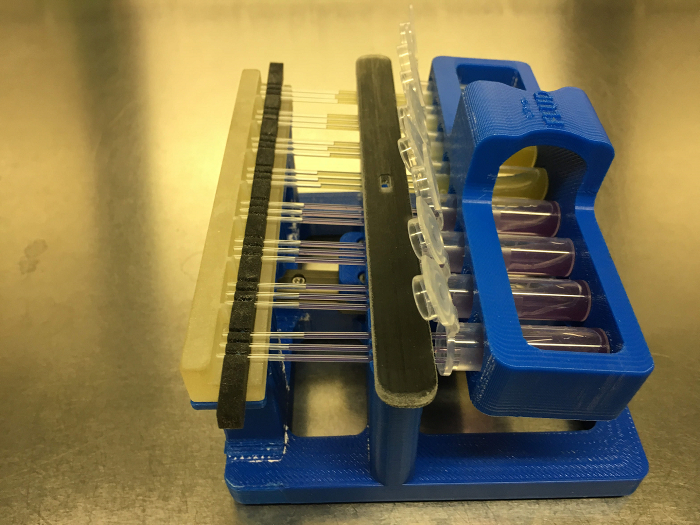
Рисунок 6: Система FLUD с загрузкой капиллярных трубок с помощью капиллярного воздействия. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.

Рисунок 7: Уплотнение Заполненные капилляры на FLUD System One Triplicate Установите на время с помощью герметика блока. Этот герметик блок имел пластик по краям, что было отрезано, чтобы предотвратить контакт с соседними наборами трех повторностей во время запечатывания. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
- инкубация
- Снимите резиновый набивать поверх в midsections трубы и поднимите резиновую подставку от главного аппарата. Это должно принять все капилляры с ним. Теперь установите подставку и трубки проводится на стойку визуализации. Это раCk имеет три заглушки, которые вставляются в подставку, а также небольшие направляющие каналы для установки трубок.
- Установите стойку для обработки изображений целиком в прозрачную пластиковую коробку для инкубации. Смочите небольшое количество стерильных бумажных полотенец в стерильной воде и поместите вдоль двух более коротких сторон коробки, чтобы обеспечить влажность во время инкубации. (См . Рисунок 8 )
- Полностью закройте коробку и установите в инкубаторе с температурой 37 ° C, следя за тем, чтобы трубки были горизонтальными. Инкубируйте в течение 48 часов.
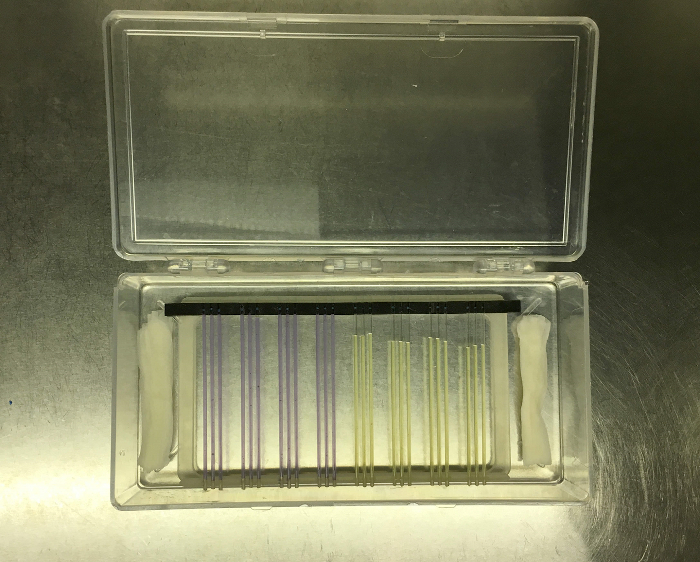
Рисунок 8: Капиллярные трубки в резиновой подставке, перенесенной из системы FLUD в стойку для изображений, которая была помещена в прозрачный инкубационный бокс наряду с влажными бумажными полотенцами для обеспечения влажности. Нажмите здесь, чтобы просмотреть увеличенную версиюфигурное.
- Визуализации и извлечения
- Снимите стойку изображения, удерживающую трубы из коробки инкубационной и установить его на лайтбокс, освещенный снизу. С уже трубками в стойке изображений, в трех экземплярах наборы будут правильно расположены и готовы к изображению сразу.
- Фокус камеры на трубах таким образом, что все они видны в поле зрения и свете от светового короба обеспечивает достаточный контраст и визуализацию цвета в красителях трубки. Фотография непосредственно сверху.
- Для того, чтобы извлечь содержимое труб, удалить капиллярные трубки из резиновой люльки одного набора трех повторов в то время. Аккуратно поднимите трубы и из люльки или слайд их.
- Для каждого набора трех повторов, следовать процедуре экстракции подробно с шагом 7.1 через 7.3.
Результаты
Микробиологический рост через различные химические условия, индуцируемые в пробах с резко в некоторых случаях и более тонко в других варьировался. Многие изменения активности были визуально в природе, будучи очевидным, как только инкубационный период закончился. В п...
Обсуждение
Микробиологический состав легкого с CF содержит большое разнообразие организмов, но условия в легких , вероятно , оказывают значительное влияние на то , что виды микробов могут выжить и процветать 13, 15. Конкретные механизмы, с помощью которых эти условия и?...
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Авторы хотели бы отметить Vertex Pharmaceuticals и Премию за инновации в области кистозного фиброза для финансирования Р. Куинна и NIH / NIAID для финансирования гранта 1 U01 AI124316-01, подхода системной биологии к лечению мультирезистентных патогенов. Мы также хотели бы поблагодарить Департамент механической и аэрокосмической инженерии UCSD за курс обучения старшему инженерному делу в области машиностроения для содействия сотрудничеству с инженерными аспектами этой работы.
Материалы
| Name | Company | Catalog Number | Comments |
| Color-Coded Capillary Tubes | Fisher Scientific | 22-260943 | |
| Cha-seal Tube Sealing Compound | Kimble-Chase | 43510 | |
| Mucin from porcine stomach | Sigma | M1778 | |
| Ferritin, cationized from horse spleen | Sigma | F7879 | |
| Salmon sperm DNA Sodium salt (sonified) | AppliChem Panreac | A2159 | |
| MEM Nonessential Amino Acids | Corning cellgro | 25-025-CI | |
| MEM Amino Acids | Cellgro | 25-030-CI | |
| Egg Yolk Emulsion, 50% | Dalynn Biologicals | VE30-100 | |
| Potassium Chloride | Fisher Scientific | P2157500 | |
| Sodium Chloride | Fisher Scientific | S271500 | |
| 15 mL centriguge tubes with Printed Graduations and Flat Caps | VWR | 89039-666 | |
| 50 mL centrifuge tubes with Printed Graduations and Flat Caps | VWR | 89039-656 | |
| 1.5 mL microcentrifuge tubes | Corning | MCT-150-R | |
| 2.0 mL microcentrifuge tubes | Corning | MCT-200-C |
Ссылки
- Quinn, R. A., et al. A Winogradsky-based culture system shows an association between microbial fermentation and cystic fibrosis exacerbation. ISME J . 9, 1024-1038 (2015).
- Quinton, P. M. Cystic fibrosis: impaired bicarbonate secretion and mucoviscidosis. Lancet. 372 (9636), 415-417 (2008).
- Harrison, F. Microbial ecology of the cystic fibrosis lung. Microbiology. 153 (Pt 4), 917-923 (2007).
- Caverly, L. J., Zhao, J., LiPuma, J. J. Cystic fibrosis lung microbiome: Opportunities to reconsider management of airway infection. Pediatr pulmonol. 50, S31-S38 (2015).
- Blainey, P. C., Milla, C. E., Cornfield, D. N., Quake, S. R. Quantitative analysis of the human airway microbial ecology reveals a pervasive signature for cystic fibrosis. Sci Transl Med. 4 (153), 153ra130 (2012).
- Willner, D., et al. Spatial distribution of microbial communities in the cystic fibrosis lung. ISME J. 6 (2), 471-474 (2012).
- Delhaes, L., et al. The airway microbiota in cystic fibrosis: a complex fungal and bacterial community--implications for therapeutic management. PloS one. 7 (4), e36313 (2012).
- Rogers, G. B., et al. D. Bacterial diversity in cases of lung infection in cystic fibrosis patients: 16S ribosomal DNA (rDNA) length heterogeneity PCR and 16S rDNA terminal restriction fragment length polymorphism profiling. J clin microbiol. 41 (8), 3548-3558 (2003).
- Stenbit, A. E., Flume, P. A. Pulmonary exacerbations in cystic fibrosis. Curr Opin Pulm Med. 17 (6), 442-447 (2011).
- Twomey, K. B., et al. Microbiota and metabolite profiling reveal specific alterations in bacterial community structure and environment in the cystic fibrosis airway during exacerbation. PloS one. 8 (12), e82432 (2013).
- Carmody, L. A., et al. Changes in cystic fibrosis airway microbiota at pulmonary exacerbation. Ann. Am. Thorac. Soc. 10 (3), 179-187 (2013).
- Worlitzsch, D., et al. Effects of reduced mucus oxygen concentration in airway Pseudomonas infections of cystic fibrosis patients. J. Clin. Invest. 109 (3), 317-325 (2002).
- Cowley, E. S., Kopf, S. H., LaRiviere, A., Ziebis, W., Newman, D. K. Pediatric Cystic Fibrosis Sputum Can Be Chemically Dynamic, Anoxic, and Extremely Reduced Due to Hydrogen Sulfide Formation. mBio. 6 (4), e00767-e00715 (2015).
- Sriramulu, D. D., Lünsdorf, H., Lam, J. S., Römling, U. Microcolony formation: a novel biofilm model of Pseudomonas aeruginosa for the cystic fibrosis lung. J. Med. Microbiol. 54 (Pt 7), 667-676 (2005).
- Quinn, R. A., et al. Biogeochemical forces shape the composition and physiology of polymicrobial communities in the cystic fibrosis lung. mBio. 5 (2), (2014).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены