Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
В этой статье
Резюме
Здесь мы описываем метод быстрого равновесного диализа (RED) для измерения связывания лекарственного средства с казумом от поражений и полостей легочного туберкулеза. Протокол также используется с матрицей, полученной из пенистого макрофага, которая является эффективным суррогатом казума.
Аннотация
Для искоренения туберкулеза необходимы схемы лекарств, которые могут проникать во множество слоев сложных легочных очагов. Распределение лекарств в казеозных ядрах полостей и поражений особенно важно, поскольку они содержат субпопуляции лекарственно-толерантных бактерий, которые также часто называют персистерами. Существующие методы измерения проникновения лекарств в очаги туберкулеза требуют дорогостоящих и длительных исследований фармакокинетики in vivo в сочетании с методами биоанализа или визуализации. В качестве альтернативы таким методам было предложено измерение связывания лекарства с макромолекулами кадьюма in vitro, поскольку это связывание препятствует пассивной диффузии молекул лекарственного средства через казум. Быстрорадикальный диализ - это быстрая и надежная система для проведения исследований связывания с белками плазмы и тканей. В этом протоколе мы использовали прибор с быстрым равновесным диализом (RED) для измерения связывания лекарственного средства с гомогенатами казума, который представляет собой эксцизиюВызванных поражениями и полостями инфицированных туберкулезом кроликов. Протокол также описывает, как создать суррогатную матрицу из макрофагов THP-1, нагруженных липидами, для использования вместо казума. Этот анализ казума / суррогатного связывания является важным инструментом при обнаружении лекарств от туберкулеза и может быть адаптирован для изучения распределения лекарственных средств при поражениях или абсцессах, вызванных другими заболеваниями.
Введение
Лечение туберкулеза легких требует эффективного распределения препаратов в различных типах поражений. Некротические поражения и полости содержат казеозные центры, которые содержат субпопуляции лекарственно-устойчивых или «стойких» бактерий. 1 , 2 Кавитационная болезнь связана с низкими показателями излечения и плохим прогнозом. 3 , 4 Предыдущие исследования показали, используя количественные методы и методы визуализации, что способность проникать в казуум значительно варьирует от одного класса наркотиков к другому. 5 , 6 Эти методы, однако, требуют использования моделей заражения животных, которые являются медленными и утомительными. Был разработан тест in vitro, который измеряет связывание лекарственного средства с ex vivo caseum. Было установлено, что это связывание обратно коррелирует с проникновением лекарств в казеозные гранулемы и, следовательно, являетсяиспользуется в качестве инструмента прогнозирования. 7
Равновесие диализ рассматриваются как золотой стандарт подхода к белкам плазмы исследованию связывания. Быстрый равновесный диализ (RED) устройство обеспечивает быструю, легкую в использовании и надежную систему для выполнения таких анализов. 8 Устройство состоит из двух компонентов: одноразовое использование, одноразовых вкладышей , состоящих из 2 -х камер , разделенных вертикального цилиндра полупроницаемой мембраны; и повторно используемые базовые пластины, которые могут содержать до 48 вставок в то время. Диализ мембрана имеет 8 кД молекулярной массы срез (MWCO), что идеально подходит для исследования связывания с наркотиками макромолекулы. Высокое отношение площади поверхности к объему мембранного отсека позволяет быстро диализ и уравновешивание. Обе вставка и базовая пластина были проверены для минимально неспецифического связывания. Сочетание RED устройства с биоаналитическими методами обеспечивает точные оценки несвязанных фракций лекарственных средств в рЛАЗМА. 8, 9
Хотя первоначально предназначено для измерения связывания с белками плазмы, КРАСНОЕ устройство используется в нескольких тканях исследования связывания с использованием гомогенат. 10, 11 В этом протоколе, мы оцениваем препарат связывания с caseum, некротическим мусор вырезал из некротических поражений и полостей туберкулеза-инфицированных кроликов. Бесклеточное и не сосудистое характер казеозного материала позволяет легко гомогенизировать в гомогенную суспензию, который совместит с анализом.
Учитывая, что caseum утомительно производить и трудно найти, протокол также был утвержден для использования с суррогатной матрицей, получают из пенистых макрофагов. ТНР-1 моноцитов макрофаги индуцируются с олеиновой кислотой, чтобы накопить несколько липидных тел, которые дают им их «пенистый» внешний вид. Эти липидные загруженные клетки собирают иОбрабатывается для получения матрицы, которую мы используем в качестве суррогата caseum. Это исследование показало, что связывание лекарственного средства с этой суррогатной матрицей хорошо коррелирует со связыванием с казумом, эффективно имитируя процесс in vivo , который препятствует проникновению наркотиков в казеозную сердцевину гранулем и полостей.
протокол
Все исследования на животных проводились в соответствии с Руководством по уходу и использованию лабораторных животных Национального института здоровья с одобрения Комитета по институциональному уходу и использованию животных NIAID (NIH), Bethesda, MD. Все исследования с участием M. tuberculosis проводились в лаборатории с уровнем биологической безопасности 3 (BSL-3).
1. Модель заражения кроликов и коллекция казума
- Инфицируйте белых кроликов Новой Зеландии с M. tuberculosis, используя аэрозольную систему воздействия носа только, как описано выше. 12 , 13 Позвольте инфекции прогрессировать в течение 12-16 недель. Седате кроликов с 35 мг / кг кетамина и 5 мг / кг ксилазина внутримышечно, эвтаназии кроликов с 0,22 мл / кг пентобарбитала натрия и фенитоин натрия внутривенно и приступить к вскрытии.
- Используя пинцеты и скальпель, удалите легкие из сундука caVity. Из каждой легочной доли вырезают отдельные полости и крупные некротические гранулемы с помощью скальпеля. Тщательно очистите казум от полостей и гранулемы. Взвешивают, записывают и хранят образцы в пробирках с 2-миллилитровыми пробками при -20 ° C до готовности к использованию.
- Гамма-облучение образцов инфекционного кадзума в 3 MegaRad на сухом льду, чтобы сделать их неинфекционными и безопасными для использования в лаборатории BSL-2.
2. In vitro генерирование суррогата кардиума из клеток ТНР-1
- Выращивают моноциты THP-1 в среде RPMI 1640 (2 мМ L-глутамина и 10% фетальной бычьей сыворотки) в колбах для культивирования клеток Т175 (80 мл / колбу). Инкубируйте колбы в атмосфере 5% CO 2 при 37 ° C в течение 3-4 дней.
- Центрифуга культуры из T175 колбу в двух 50 мл конических труб на 150 xg в течение 5 мин. Отбросьте супернатант и суспендируйте осадок в 10 мл среды RPMI 1640.
- Внесите 5 мкл этой культуры в 1,5 мл пробирку, содержащую 45 мкл tRypan голубой. Тщательно перемешать с помощью пипетки. Перенесите 10 мкл на гемоцитометр и подсчитайте количество жизнеспособных моноцитов THP-1 (неокрашенных), используя световой микроскоп (10-кратное увеличение). Рассчитайте количество жизнеспособных клеток на мл культуры. Разбавьте его средой RPMI до конечной плотности 1,25 × 10 6 клеток / мл.
- Нагрузка 40 мл культуры на большой планшет для культуры клеток (50 × 10 6 клеток / планшета). Добавить 40 мкл 100 мкМ РМА (форбол 12-миристат-13-ацетата, приготовленного в этаноле) и позволить клеткам прилипать в течение ночи в инкубаторе.
ПРИМЕЧАНИЕ: Конечная концентрация PMA составляет 100 нМ. - Разбавляют чистую олеиновую кислоту (ОА) (0,89 г / мл) в этаноле до концентрации 0,1 М ( то есть 31,7 мкл ОА в 968,3 мкл этанола). Развести этот раствор в свежей предварительно нагретой среде RMPI до концентрации 10 мМ. Развести эту суспензию ОА до 0,4 мМ (конечная рабочая концентрация) в среде RPMI, предварительно нагретой до 37 ° С.
- Удалить существующие носители и-adhered клетки из клеточной культуры пластин и осторожно добавляют 40 мл 0,4 мМ ОА в макрофагах THP-1 (ТНР-M). Инкубируют при 37 ° С в инкубаторе в течение ночи.
- С помощью светового микроскопа при 40-кратном увеличении, чтобы визуально подтвердить наличие многочисленных липидных включений тела в каждом ТНР-М. Удалить все среды RPMI из клеточной культуры пластин и осторожно вымыть прилипшие клетки дважды фосфатно-буферный раствор (PBS) с помощью серологической пипетки на 50 мл.
Примечание: липидные тела появляются как маленькие, четкие, сферические структуры в цитоплазме ТНР-М. - Добавить 40 мл 5 мМ этилендиаминтетрауксусной кислоты (ЭДТА) в PBS в каждую чашку. Инкубируют в течение 15 мин при 37 ° С.
- Отсоедините пенистые макрофаги (FM), несколько раз пипетирования вверх и вниз по поверхности всей пластины с помощью серологической пипетки 10 мл. Передача клеточной суспензии в коническую пробирку на 50 мл и спином вниз со скоростью 150 мкг в течение 5 мин.
- Ресуспендируют осадок клеток в 10 мл PBS (третий промывной PBS), ай передаче предварительно взвешенные конические пробирки 15 мл. Спин вниз снова при 150 мкг в течение 5 мин. Тщательно аспирата супернатант с помощью серологической пипетки и выбросьте.
- Тема с FM гранул до 3 циклов замораживания-оттаивания, чтобы лизировать клетки, и инкубируют их при 75 ° С в течение 20-30 мин для денатурации белков в матрице. Храните гранулы при температуре -20 ° С до готовности к использованию.
3. Быстрое Уравновешивание Диализ (КРС) Анализ
- Готовят 10 мМ исходные растворы всех исследуемых соединений в диметилсульфоксиде (ДМСО). Разбавить до 500 мкМ рабочих растворов в ДМСО до каждого анализа.
- Взвесить трубку, содержащую caseum суррогатной осадок. Отнимите вес порожней трубки, чтобы получить вес гранул в одиночку. Добавьте 2-3 металлические шарики на пробирку и, используя гомогенизатор ткани на 1200 ударов / мин в течение 1 мин, нарушить caseum или суррогатной матрицу в PBS (1: 9 вес / объем), чтобы достичь 10x разбавленной суспензии каждой матрицы.
- Spike 6,5 мкл 500МкМ раствора испытуемого соединения в 643,5 мкл гомогената для достижения конечной концентрации 5 мкМ (≤1% ДМСО) и вихря.
- Поместите КРАСНЫЕ вставки в основание. Добавить 200 мкл матрицы с лекарственным покрытием в донорную камеру (красное кольцо) каждой красной вставки и 350 мкл PBS в каждую камеру-приемник. Подготовьте 3 вставки для каждого испытуемого соединения (образцы из трех экземпляров). Уплотнительную пластину с клеевым пластинчатым уплотнением и инкубировать при температуре 37 ° С на термомиксере при 200 об / мин (1 xg) в течение 4 часов.
- После инкубации аккуратно перемешайте содержимое донорской и приемной камер с помощью пипетки вверх и вниз 2-3 раза. Внесите 20 мкл аликвоты гомогената из донорных камер и добавьте 20 мкл чистого PBS в 1,5 мл пробирку (1: 1). Аналогичным образом, пипеткой из 20 мкл аликвоты образцов PBS из приемной камеры и добавить 20 мкл чистого гомогената (матрица соответствия). 8
ПРИМЕЧАНИЕ. Матричное сопоставление исключает ne2-й изд отдельных калибровочных кривых (в гомогенате и PBS) должны быть сделан для количественного анализа. Содержание донора камеры может осаждаться в течение долгого времени. Аккуратно перемешать содержимое с помощью пипетки перед удалением аликвоты.
4. ЖХ-МС Количественное и анализ данных
- Добавьте 160 мкл 1: 1 метанол: ацетонитрил, содержащий 500 нг / мл диклофенак или 10 нг / мл верапамил (внутренний стандарт) в каждую пробирку и вихря для осаждения белков. Центрифуга при 10000 мкг в течение 5 мин для осаждения осадок и переноса супернатантов в 96-луночные глубоко-луночные планшеты для жидкостной хроматографии-масс-спектрометрии (ЖХ-МС) анализа. 7
- Построение калибровочных кривых от 1-1000 нМ для каждого испытуемого соединения, сохраняя при этом тот же состав, как матрицу образцов выше. Количественно концентрацию тестируемого соединения в образцах от донора и приемника камеры с использованием метода ЖХ-МС.
- Вычислить несвязанного фракции (е и) оF препарат в разбавленной матрице, используя уравнение 1. Вычислить f u в неразведенной матрице, используя уравнение 2 ( D = коэффициент разбавления 10). 14
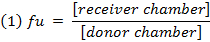
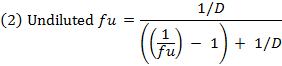
- Проверьте восстановление (баланс массы) каждого соединения, используя уравнение 3 для идентификации соединений с проблемами стабильности / метаболизма / неспецифического связывания.
ПРИМЕЧАНИЕ. Восстановление обычно составляет от 70% до 130%. 15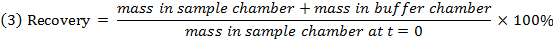
Результаты
Используя этот протокол, мы опробовали сотни препаратов для разработки лекарств против туберкулеза для их прогнозируемой эффективности в проникающем казуме. На рисунке 1 представлены основные понятия анализа RED. Диализная мембрана красных вставок позволяе?...
Обсуждение
Легочные некротические поражения и полости у больных туберкулезом содержат субпопуляции бактерий, которые не поддаются лечению. Казеозные ядра этих структур особенно ответственны за укрывательство этих персистеров во внеклеточной среде. Благоприятное распределение антибактериаль...
Раскрытие информации
Конкурирующих финансовых интересов нет.
Благодарности
Мы хотели бы поблагодарить Johnson & Johnson, Альянс TB, Astra Zeneca, Rib-X и Триус Therapeutics для обеспечения bedaquiline, PA-824 (pretomanid), AZD5847, radezolid и тедизолид соответственно. Брендан Прайдо, Мэтью Циммерман, Стивен Джузвин, Эмма Рей-Хурадо, Нэнси Руел, Льян Ли и Даниэла Вайнер оказывал поддержку с анализом MALDI, биоаналитических методов, подготовки caseum суррогата, химический синтез и выделение кролика caseum. Эта работа была проведена при финансовой поддержке Фонда Билла и Мелинда Гейтс, удостоенный # OPP1044966 и OPP1024050 к V Дартуа, NIH Shared Instrumentation Грант S10OD018072, а также совместного финансирования со стороны Фонда Билла и Мелинды Гейтс и Wellcome Trust для центра передового опыта для свинца оптимизации для болезней развивающегося мира P Уайат.
Материалы
| Name | Company | Catalog Number | Comments |
| New Zealand White Rabbits | Covance | - | |
| HN878 Mycobacterium tuberculosis | BEI Resources | NR-13647 | |
| Ketathesia (Ketamine) 100 mg/mL C3N | Henry Schein Animal Health | 56344 | |
| Anased (Xylazine) 100 mg/mL | Henry Schein Animal Health | 33198 | |
| Euthasol (pentobarbital sodium and phenytoin sodium) Solution | Virbac | 710101 | |
| THP-1 monocytic cell line | ATCC | ATCC TIB-202 | |
| 175 cm² TC-Treated Flask (T175) | Fisher Scientific | T-3400-175 | |
| RPMI 1640 media w/o glutamine | Fisher Scientific | MT-15-040-CV | |
| Hyclone Fetal Bovine Serum, Gamma irradiated | Fisher Scientific | SH3091003IR | |
| Hyclone L-glutamine, 200 mM | Fisher Scientific | SH3003401 | |
| Cellstar TC dish, 145 mm x 20 mm, vented | Fisher Scientific | T-2881-1 | |
| Phorbol 12-myristate 13-acetate (PMA) | Fisher Scientific | BP685-1 | |
| Ethylenediaminetetraacetic acid | Sigma | E6758 | |
| Oleic acid | Fisher Scientific | ICN15178101 | |
| Pierce RED Device Reusable Base Plate | Fisher Scientific | PI-89811 | |
| Pierce RED Device Inserts, 50/box | Fisher Scientific | PI-89809 | |
| Pierce RED insert removal tool | Fisher Scientific | 89812 | |
| Adhesive plate seal | Fisher Scientific | 08-408-240 | |
| PBS, pH 7.4, 10x 500 mL (Gibco) | Life Technologies | 10010-049 | |
| DMSO | Sigma | 472301 | |
| Acetonitrile | Sigma | 34998 | |
| Methanol | Sigma | 34860 | |
| Verapamil hydrochloride | Sigma | V4629 | |
| Diclofenac sodium salt | Sigma | 93484 | |
| Trypan Blue Solution, 0.4% | Fisher Scientific | 15-250-061 | |
| Ethanol, 200 proof | Fisher Scientific | 04-355-451 | |
| 2010 Geno/Grinder | SPEX SamplePrep | 2010 | |
| Bead Mill Homogenizer Accessory, Metal Bulk Beads | Fisher Scientific | 15-340-158 | |
| 484R Cobalt 60 Irradiator | JL Shepard | 7810-484-1 | |
| INCYTO C-Chip Disposable Hemacytometers | Fisher Scientific | 22-600-100 | |
| Upright Light Microscope | Leica | DM1000 | |
| Binary Liquid Chromatography system | Agilent | 1260 | Multi-compenent |
| Mass spectrometer | AB Sciex | 4000 |
Ссылки
- Sacchettini, J. C., Rubin, E. J., Freundlich, J. S. Drugs versus bugs: in pursuit of the persistent predator Mycobacterium tuberculosis. Nat Rev Microbiol. 6 (1), 41-52 (2008).
- Zhang, Y. Persistent and dormant tubercle bacilli and latent tuberculosis. Front Biosci. 1 (9), 1136-1156 (2004).
- Aber, V. R., Nunn, A. J. Short term chemotherapy of tuberculosis. Factors affecting relapse following short term chemotherapy. Bull Int Union Tuberc. 53 (4), 276-280 (1978).
- Chang, K. C., Leung, C. C., Yew, W. W., Ho, S. C., Tam, C. M. A nested case-control study on treatment-related risk factors for early relapse of tuberculosis. Am J Respir Crit Care Med. 170 (10), 1124-1130 (2004).
- Dartois, V. The path of anti-tuberculosis drugs: from blood to lesions to mycobacterial cells. Nature Rev Microbiol. 12 (3), 159-167 (2014).
- Prideaux, B., et al. The association between sterilizing activity and drug distribution into tuberculosis lesions. Nat Med. 21 (10), 1223-1227 (2015).
- Sarathy, J. P., et al. Prediction of Drug Penetration in Tuberculosis Lesions. ACS Infect Dis. 2 (8), 552-563 (2016).
- Waters, N. J., Jones, R., Williams, G., Sohal, B. Validation of a rapid equilibrium dialysis approach for the measurement of plasma protein binding. J Pharm Sci. 97 (10), 4586-4595 (2008).
- Singh, J. K., Solanki, A., Maniyar, R. C., Banerjee, D., Shirsath, V. S. Rapid Equilibrium Dialysis (RED): an In-vitro High-Throughput Screening Technique for Plasma Protein Binding using Human and Rat Plasma. J Bioequiv Availab. 14, 1-4 (2012).
- Liu, X., et al. Unbound drug concentration in brain homogenate and cerebral spinal fluid at steady state as a surrogate for unbound concentration in brain interstitial fluid. Drug Metab Dispos. 37 (4), 787-793 (2009).
- Able, S. L., et al. Receptor localization, native tissue binding and ex vivo occupancy for centrally penetrant P2X7 antagonists in the rat. Br J Pharmacol. 162 (2), 405-414 (2011).
- Subbian, S., et al. Chronic pulmonary cavitary tuberculosis in rabbits: a failed host immune response. Open Biol. 1 (4), 1-14 (2011).
- Via, L. E., et al. Tuberculous Granulomas are Hypoxic in Guinea pigs, Rabbits, and Non-Human Primates. Infect Immun. 76 (6), 2333-2340 (2008).
- Kalvass, J. C., Maurer, T. S. Influence of nonspecific brain and plasma binding on CNS exposure: implications for rational drug discovery. Biopharm Drug Dispos. 23 (8), 327-338 (2002).
- Di, L., Umland, J. P., Trapa, P. E., Maurer, T. S. Impact of recovery on fraction unbound using equilibrium dialysis. J Pharm Sci. 101 (3), 1327-1335 (2012).
- Lenaerts, A. J., et al. Location of persisting mycobacteria in a Guinea pig model of tuberculosis revealed by r207910. Antimicrob Agents Chemother. 51 (9), 3338-3345 (2007).
- Prideaux, B., et al. High-sensitivity MALDI-MRM-MS imaging of moxifloxacin distribution in tuberculosis-infected rabbit lungs and granulomatous lesions. Anal Chem. 83 (6), 2112-2118 (2011).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены