Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Оптических количественная оценка внутриклеточный pH в Drosophila melanogaster Malpighian трубочку эпителия с флуоресцентные генетически закодированный pH индикатор
В этой статье
Резюме
Клеточного ионного транспорта часто может оцениваться путем мониторинга внутриклеточного рН (рН,я). Генетически Encoded рН индикаторы (GEpHIs) обеспечивают оптических количественная оценка внутриклеточного рН в клетках нетронутыми. Этот протокол подробности количественная оценка внутриклеточного рН через сотовый ex vivo жить изображений Malpighian трубочки Drosophila melanogaster с pHerry, псевдо ratiometric генетически закодированный рН показатель.
Аннотация
Эпителиальных ионный транспорт имеет жизненно важное значение для системного ионного гомеостаза, а также поддержание основных клеточных электрохимических градиентов. Внутриклеточный pH (pHя) находится под влиянием многих ионных транспортеров и таким образом мониторинг pH,я является полезным инструментом для оценки деятельности перевозчика. Современные генетически закодированный рН индикаторы (GEpHIs) обеспечивают оптических количественного определения рНя нетронутым клеток на клеточном и субклеточном уровне. Этот протокол описывает в реальном времени количественная оценка клеточного рНя регулирования в Malpighian трубочки (МТС) Drosophila melanogaster через ex vivo жить изображения pHerry, псевдо ratiometric GEpHI с pK хорошо подходит для отслеживания изменения рН в цитозоль. Извлеченный взрослых летать МТС состоят из морфологически и функционально различных разделов одноклеточного слоя эпителия и может служить в качестве доступной и генетически шансов справиться с возникающими модель для исследования эпителиальных транспорта. GEpHIs предлагают ряд преимуществ перед обычными рН чувствительных флуоресцентных красителей и ионоселективные электроды. GEpHIs можно пометить различных клеточных популяций, предоставлены соответствующие промоутер элементы доступны. Эта маркировка особенно полезен в ex vivo, в естественных условияхи на месте препараты, которые по своей сути неоднородных. GEpHIs также количественной рНi в неповрежденной ткани с течением времени без необходимости повторного окрашивания лечения или ткани экстернализации. Основной недостаток текущей GEpHIs является тенденция агрегирования в цитозольной включений в ответ на повреждение тканей и построить гиперэкспрессия. Эти недостатки, их решения и преимущества GEpHIs продемонстрировал в этом протоколе путем оценки базолатеральной Протон (H+) транспорта в функционально различных главных и севрюга клеток извлеченных покупать МТС. Методы и анализ описанных легко адаптируется к широкий выбор препаратов, позвоночных и беспозвоночных, и изысканность Пробирной может масштабироваться от преподавания labs сложные определения ионного потока через конкретные перевозчиков.
Введение
Цель настоящего Протокола заключается в описания квантификации внутриклеточный pH (pHi) с использованием генетически закодированный pH индикатор (GEpHI) и продемонстрировать, как этот метод может использоваться для оценки базолатеральной H+ транспорта в модели насекомых (D. melanogaster) почечной структура, Malpighian трубочку (MT). МТС служат выделительной органов плодовой мухи и функционально похожи на млекопитающих нефрон в нескольких ключевых отношениях1. МТС аранжированы как 2 пары трубочки (передняя и задняя) в грудной клетки и живота летать. Одноклеточных эпителиальных трубка каждого MT состоит из метаболически активные главных клеток с собственный верхушечный (люминал) и базолатеральной (гемоцель) полярности, а также вставными севрюга клетки. Передняя МТС состоят из 3 морфологически, функционально, и развивающих разных сегментов, особенно первоначальных расширены сегмента, переходного этапа и секреторную основной сегмент, который присоединяется к Мочеточник2. На клеточном уровне транс эпителиальных ионного транспорта в Люмене осуществляется путем апикальной плазматической мембраны V-АТФазы3 и теплообменник щелочно металл/Ч+ , а также базолатеральной Na+-K+-АТФазы4, внутрь выпрямительные K+ каналы5, Na+-Cl−/HCO3− теплообменника (NDAE1)6, и++Na -K-2 Cl− cotransporter (NKCC; Ncc69)7, в то время как клетки Ито посредником Cl– и водный транспорт в8,9. Этот сложный, но доступным Физиологическая система обеспечивает отличные возможности для расследования эндогенного Ион транспортных механизмов в сочетании с различных генетических и поведенческих toolsets дрозофилы.
Обоснование для этого протокола был для описания генетически ковкого системы для изучения эпителиальных ионного транспорта с потенциалом для интеграции от ячейки поведение и экспорта средств в другие модели системы. Выражение pHerry10, GEpHI, производного от сочетание зеленого супер-эклиптики рН чувствительных pHluorin11,12 (SEpH) и красный рН регистра mCherry13, в МТС позволяет количественная оценка транспорта H+ отдельные ячейки MT через высокий K+/nigericin калибровки технику14. Как много ионных транспортеров двигаются H+ эквивалентов, количественная оценка внутриклеточного рН,я служит функционального представительства движения ионов через различные транспортеры. Система модель дрозофилы MT также предлагает мощные инструменты для генетических ткани конкретных трансген15 и РНК интерференции (RNAi)16 выражение, которое может сочетаться с сотовой изображений и анализы состава органа17 , 18 , 19 трубочку функции для создания надежных инструментов с вертикальной интеграции от молекул поведение. Это стоит в отличие от многих других протоколов для оценки эпителиальных биологии, как исторически такие измерения полагались на сложной и сложной микро рассечение, сложные ионоселективные электроды20,21, и дорогой рН чувствительных красители22 с ограничительной загрузки требования и бедных сотовой специфичность в разнородных тканей. GEpHIs были использованы обширно измерения рНя в различные типы клеток23. Ранние работы эксплуатируется присущие рН чувствительность от Зеленый флуоресцентный белок (ГПУП) для мониторинга рНя культивировали эпителиальные клетки24 , но в последние два десятилетия видели GEpHIs, используемые в нейроны25,26глии, грибов27 , и завод клетки28. Сочетание потенциал для сотовых ориентации генетической конструкции через GAL4/Уан выражение системы15 и физиологического доступности дрозофилы MT делают это идеальная подготовка для исследования рНя регулирование и транспорт ионов эпителия.
pHя регулирования была изучена на протяжении десятилетий и имеет жизненно важное значение для жизни. Подготовка MT предлагает надежную модель учить физиологии рНя регулирования, но также выполнять сложные расследования рНi регулирование ex vivo и в естественных условиях. Этот протокол описывает количественная оценка H+ движения через мембрану базолатеральной эпителиальных клеток дрозофилы MT с помощью NH4Cl пульс кислоты Погрузка техники21, но как рН показатель является генетически закодированы, эти методы и их теоретические основы могут применяться к любой подготовки поддаются трансгенез и жить изображений.
Access restricted. Please log in or start a trial to view this content.
протокол
Все шаги в этом протоколе соответствует руководящим принципам использования животных клиники Майо (Рочестер, MN).
1. летать животноводства
- Поднять мух и набор пересекает согласно стандартным животноводства29.
Примечание: Флуоресцентные репортер выражение в системе GAL4/Уан пропорциональна температуре, и таким образом поднимать температуру можно регулировать изменить уровень выражения. В то время как уровни высокой выражения часто приводят к лучшее соотношение сигнал шум это условие связано также с повышенной цитозольной и organellar агрегатов при использовании GFP фьюжн красный флуоресцентный белок (RFP) конструкции, такие как, pHerry10 30,31. Если агрегат является неизбежным, количественная оценка все еще возможно, выполняя точки калибровки в каждом эксперименте и нормализации данных таким образом, чтобы соотношение флуоресценции 1.0 соответствует рНя 7.0 (см. шаг 7.4 записку по калибровке ниже). - Установить кресты гомозиготных capaR-GAL432 мужчины гомозиготных бла pHerry10 девственной женщины и гомозиготных c724-GAL42 мужчин и гомозиготных бла pHerry девственница женщин разрешить изображений из рНя в основные клетки и клетки Ито МТ соответственно. 6 место бас pHerry самок с 3 GAL4 мужчины в свежие флаконов продовольствия и отпуска для сопряжения на 28 ° C.
Примечание: Личинки должно быть очевидным в течение 4 d и взрослые начинают Эклоз вокруг дней 10. - Собирать женского летит по eclosion и отложите в сторону для возраста 10 d 28 ° c.
Примечание: Сроки проведения экспериментов может корректироваться соответствовать любой ограничительных поведенческих анализов (например Рамзай секрецию пробирного17,19), которые будут соотноситься для внутриклеточного рН живых изображений. Мужчин мухи могут быть использованы, но трубочки от самки часто более широкую и работоспособную.
2. Подготовка поли L-лизин слайды.
- Нарисуйте границы 40 x 20 мм с гидрофобным Пап перо вокруг верхней части стандартного 75 x 25 мм слайдов и отложите в сторону для просушки на 15 мин на RT. использования больших coverslips если слайды не совместимы с изображений оптика.
- Передача 2 мл 0,01% раствор поли-L-лизин (PLL) на каждый слайд и отложите в сторону для 1 h на RT.
- Удалите избыток PLL с пипеткой. Сохраните решение в конической флаконе 50 мл для использования в будущем. Хранить при 4 ° C.
- Аспирационная любой оставшийся раствор с вакуумной линией. Запуск линии вакуумной над поверхностью весь слайд для обеспечения того, чтобы решения не на слайдах.
- Установите слайды сторону для 1 дополнительного h на RT до использования. Храните слайды сухой на RT сроком до 1 месяца в книге стандартного слайда.
3. Подготовка рассекает блюдо и стеклянные стержни
- Добавьте 0,5 мл эластомер отвердителя в 4,5 мл эластомера в 35 x 10 мм пенополистирола Петри на RT производить глубиной от 5 мм. микс с наконечником, одноразовые пипетки. Разрешить эластомер вылечить O/N на RT.
Примечание: Эластомер должны быть четкими и без пузырьков. Очистка пузырей может быть облегчено, сохраняя эластомер пластины в вакуумный сосуд для 10-15 мин после заливки. - Держите стеклянный стержень диаметром 5 мм между руками и Растопите центр стержня на освещенной горелка Бунзена потянув концы друг от друга. Как стекло расплавов тянуть более быстро производить тонкий (0,1 мм) и конический вал (рис. 1).
Примечание: Под углом 45 ° на хвостовике часто полезно в обработке трубочки. Это может быть достигнуто путем снижения одной рукой, как хвостовик тянет (см. Рисунок 1). - Сломать тонкие вала в середине с тупой стороной из углеродистой стали с одним краем лезвия бритвы. Осмотрите тонкий конец стержня под областью рассечения, чтобы убедиться, что место разлома является чистым.
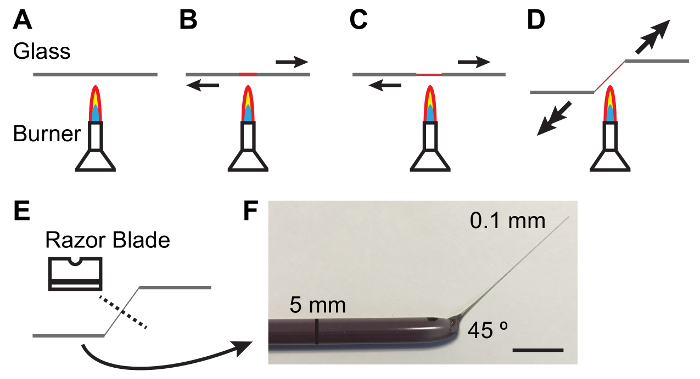
Рисунок 1: Изготовления стекла стержней для обработки Malpighian трубочки.
A - E. Процесс нагрева и потянув Стеклодрот производить конусность и угол подходит для обработки MTs. стрелки обозначают направление и величина силы должен применяться. Ф. фотография инструмента надлежащим образом сфабрикованные стекла. Шкалы бар = 10 mm. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
4. Подготовка перфузии системы и решения
Примечание: Перфузии системы отличаются от производителя. Этот протокол основан вокруг самотечных 8-канальный открытый резервуар с регулятором скорость входного потока и вакуум driven отток, но метод монтажа, что МТС как описано здесь могут быть адаптированы для работы с любой системой перфузии.
-
Подготовьте следующие решения:
- Аликвота Шнайдер средние (40 мл в конической флакон 50 мл) и хранить при 4 ° C.
- Подготовка решений (т.е. насекомое физиологический Phosphate-Buffered (комплексная стратегия миростроительства) и комплексная стратегия миростроительства с NH4Cl) в РТ при необходимости согласно таблице 1). Теплый решения RT перед использованием на день эксперимента.
Примечание: стратегии миростроительства и комплексная стратегия миростроительства с 40 мм NH4Cl может быть подготовлен в больших объемах (1 Л или более) и хранить при 4 ° C. - Подготовка 8 калибровочные растворы в 500 мл томов при pH = 5.0, 6.0, 6.5, 7.0, 7.3, 7.6, 8.0 и 9.0, как указано в таблице 1 и хранить при 4 ° C. Отрегулируйте пэ-аш каждого решения путем титрования HCl и N-метил D-glucamine (NMDG).
- В день экспериментов теплый 5 мл аликвоты калибровки решений RT и добавить фондовых nigericin раствора (20 мм диметилсульфоксида (ДМСО)) производить конечная концентрация 10 мкм.
Предупреждение: Ручка nigericin с перчатками. Лечить все оборудование, которое приходит в соприкосновение с nigericin как одноразовые. Nigericin остается на стекла и пластика и поставит под угрозу биологические препараты, если оборудование используется повторно.
-
Перфузии системы:
- Премьер системы перфузии, заполнив все водоемы с ddH2O (рис. 2). Открытые каналы один на время, чтобы разрешить все линии проксимальнее регулятор скорость потока для заполнения.
Примечание: Это может быть необходимо очистить воздух в линиях, открыв тупик канала и с помощью поршень привода потока из водохранилища. - Откройте 2 канала и позволяют ddH2O для слива. После водохранилища почти пусты, заполните первый водохранилище с комплексной стратегии миростроительства и второй резервуар с NH4Cl импульсного стратегии миростроительства. Установите скорость потока для максимального с регулятором потока скорость и позволить каждое решение поступать за 1 мин для заполнения дистальной части линии, а затем остановить поток (рис. 2).
- Позиция 2 наборов пайки «руки помощи» зажимы на изображения микроскопа. Поместите один зажим на каждой стороне изображений платформы.
- Тщательно тепла дистальной 0,5 дюйма кусок капиллярные стеклянные (внутренний диаметр 1,5 мм, наружный диаметр 0.86 мм, длина 100 мм) над помощью горелки Бунзена. Создайте колено 45 °, позволяя дистального конца согнуть под действием силы тяжести и удаление стекла от пламени, как только достигается желаемый угол. Повторите этот процесс с второй кусок капиллярного стекла.
- Вставьте стекло гнутое капилляров в поточной линии и линии вакуум связаны отток, соответственно и смонтировать их в «руки помощи» для приведения их в соответствие с изображений Этап микроскопа (рис. 3).
- Премьер системы перфузии, заполнив все водоемы с ddH2O (рис. 2). Открытые каналы один на время, чтобы разрешить все линии проксимальнее регулятор скорость потока для заполнения.

Рисунок 2: Перфузии системы и конфигурации изображений.
Компоненты, необходимые для физиологических оценки MT базолатеральной функции транспорта путем одновременного живут флуоресценции изображений и быстрого решения обмена. Газ линии показано являются необязательными и разрешить расширение экспериментов для оценки переноса HCO3– . Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
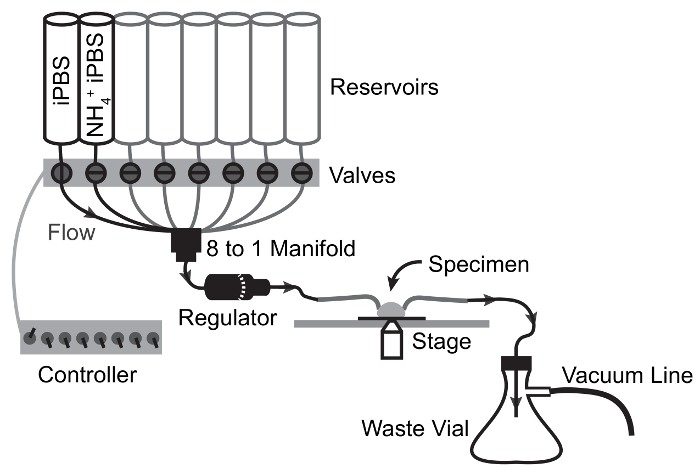
Рисунок 3: Схема потока перфузии аппарата для NH4Cl импульса экспериментов.
Стрелки показывают пути потока и клапан переключения точек. Решение перемещает от водохранилища образца, самотечный поток и обращается из образца камеры отходов колбы вакуумного всасывания. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
5. рассечение взрослых дрозофилы передней Malpighian трубочки.
- Соберите блюдо диссекции и вытащил стеклянной палочкой из раздела 3, PLL-покрытием слайд из раздела 2, клей перфузии ну делителя, вакуумные смазка, 4 x 2» полоса пленки для запайки, 2 пары #5 изысканных щипцами и 40 мл аликвоты ледяной Шнайдер средних и RT стратегии миростроительства.
- Распространения вакуумные смазка на Уплотнительная лента и нажмите клей перфузии ну делителя на ленту для покрытия нижней смазкой. Слезает клей перфузии ну делителя и поместите его жир сторона вниз поверх слайда с покрытием PLL. Удалите разделитель перфузии ну оставить отдельные образцы скважин, трассируется в гидрофобная смазка.
- Место 200 мкл RT стратегии миростроительства в смазка окружили хорошо на слайде PLL покрытием и переместить слайд под стереоскоп.
- Место Бас pHerry/capaR-GAL4 мух в пустой летают флакон и анестезировать их на льду за 10 мин.
Примечание: Этот метод анестезии, в отличие от CO2, гарантирует, что мухи не обезвоживая. - Налить ледяной Шнайдер среднего в рассечения блюдо и использовать тонкой щипцы для передачи одного наркотизированных женский летать в блюдо под рассечения стереоскоп.
- Держите лету грудной клетки с набором щипцами и использовать другой нежно сцепление кзади живота. Тяните открытой задней лету, используя пинцет короче, преднамеренное движений. Как только кишку виден, сцепление дистального конца и освободить кишечник и МТС от базовой трахеолы, потянув кишку от тела через повторяющиеся, краткие буксиров.
Примечание: Передний и задний МТС будет видно где они встречают стыке средняя и кишку через Мочеточник. Первая пара МТС быть свободная воля вероятно быть задней трубочки, как они окружают кишку. Это могут быть проигнорированы (рис. 4A). - Щепотка от передней МТС в мочеточник с тонкой щипцами после второй набор МТС бесплатно живота. Это будет отделить переднюю МТС от кишечника и закрыть мочеточника.
- Подобрать бесплатно передней МТС с вытащил стеклянная палочка, двигая стержня под мочеточника, таким образом, что канальцев попадают в обе стороны. Поднимите МТС прямо из раствора.
- Поверните стеклянный стержень, что МТС и мочеточник привязаны к нижней части стержня и опустите мочеточника прямо на слайд. Аффикс мочеточника и печатью дистальные концы МТС, нажав мочеточника вниз слайд стекла (рис. 4В). Не манипулировать МТС больше, чем необходимо. МТС следует быть плавающей в решении с мочеточника, привязанные к слайду.
- Используйте тонкой конец стеклянной палочкой аккуратно подметать каждый трубочку по всей поверхности слайда. Брейс стержень против слайд, чтобы избежать дробления трубочку и сдвиньте стержень над верхней частью трубочку, перемещение дистальной к проксимальной, прикрепить на всю длину каждого трубочку на поверхности слайда PLL-покрытием (рис. 4 c).
- Место клей делителя перфузии Ну обратно на слайде сформировать небольшую заполненные жидкостью более навесные трубочку.
- Поместите образец на микроскопа. Поместите приток и отток капилляров на входе и выходе открытие перфузии хорошо, соответственно.
Примечание: Разделителя также может быть прервана, если желаемого открытым перфузии камеры. В этом случае приток и отток капилляры можно выравнивать на противоположных сторонах изображения хорошо.
6. Проверка изображений протокол и здоровья трубочка
Примечание: Этот протокол выполняется на Перевернутый-поля epifluorescent микроскопом с GFP (SEpH) и наборы фильтров ППП (mCherry) (470/40 Нм возбуждения (ex), 515 нм longpass выбросов (ЭМ), 500 Нм дихроичных и 546/10 Нм ex, 590 нм longpass Эм, 565 Нм дихроичных), 10 X / 0,45 воздушные цели, монохромные камеры для захвата жить изображений и изображений программное обеспечение. Протокол может быть адаптирована для любого вертикально или инвертированный микроскоп с автоматизированной фильтра переключение между GFP и ППП Оптика и изображения приобретения программного обеспечения, хотя раз оптимальной экспозиции, интенсивности света и биннинга параметры будут меняться. В анализ всех интенсивности флуоресценции должны быть проанализированы как интенсивность средняя пиксель в регионе интереса (ROI), после того, как вычитание фона в каждом канале, используя РУА с содержит не флуоресценции, прилегающих к сигналу ROI.
- Включите Микроскоп, источник света и система электронного фотографирования.
- Открыть связанный изображений программное обеспечение.
- Посмотрите через окуляр и вручную настроить фокус до тех пор, пока люмен MT хорошо видна под пропускаемого света.
- Щелкните вкладку «Приобретение» в программное обеспечение для анализа изображений и в «Биннинга» раскрывающееся меню в разделе «Режим» выберите «2 x 2».
- Вставьте фильтр нейтральной плотности 5% света путь к сокращению освещения свет и свести к минимуму Фотообесцвечивание.
- Щелкните GFP (SEpH) канал в меню «Каналы», затем нажмите «Live» соблюдать флуоресцентного сигнала через камеру.
- Чтобы задать время экспозиции, что яркая значений пикселов в гистограмму интенсивности около 40% от максимального значения ползунок «Время», а затем нажмите кнопку «Стоп», чтобы остановить освещение.
- Повторите шаги 6.6-6.7 в ППП (mCherry) канал и подтвердить наличие расширенных первоначальных сегмента передней MT и отсутствие цитозольной mCherry агрегаты (индикативный повреждения тканей или гиперэкспрессия) (Рисунок 4 d).
Примечание: Расширены сегмента должна быть очевидна, как это наиболее проксимального отдела трубочку и диаметр внутренний просвет этого сегмента составляет ~ 20 мкм, больше, чем прилегающие переходного этапа. 2 x 2 пиксела биннинга часто достаточно, но может быть увеличена до дальнейшего сокращения требуемых освещенности. Типичный выдержек, между 150 и 800 ms/канал. Использовать как мало света как можно свести к минимуму Фотообесцвечивание. Сведение к минимуму Фотообесцвечивание имеет жизненно важное значение для использования dual Флюорофор такие показатели, как pHerry как два флуорофоров можно отбеливать самостоятельно, таким образом недействительными любые коэффициент калибровки. - Включение промежуток времени визуализации протокола, установив флажок «Ряды».
- Отрегулируйте «Продолжительность» в раскрывающемся меню в разделе «Ряды» 10 мин и бегунок «Интервал» 0 установить время общего захвата с частотой приобретение максимум изображений. Приобретение всего 0,2 Гц составляет часто достаточно.
- Проверьте как GFP (SEpH), так и коробки ППП (mCherry) в разделе «Каналы».
- Откройте линии стратегии миростроительства системы перфузии, активировав соответствующий контроллер и начните изображений протокол, нажав кнопку «Начать эксперимент.» После 1 мин, переключитесь на NH4Cl пульс решение для 20 s, открыв соответствующий клапан и закрытие линии стратегии миростроительства, затем вернуться к стратегии миростроительства, закрыв NH4Cl линии и открытие клапана стратегии миростроительства. Разрешить полный протокол изображений для завершения перед остановкой перфузии системы.
Примечание: Покадровый анализ должен выявить стабильной mCherry и Сеф сигнал, который увеличивает присутствии NH4Cl, утоляет после вымывания и постепенно восстанавливается. - 2-точки калибровки.
- Удалите также делителя, пилинг от базовой слайд и перфузии капилляров и зажимы от изображения хорошо.
- Применить 200 мкл калибровочных стратегии миростроительства (рН 7,4, 10 мкм nigericin) для изображений с пипеткой 200 мкл. Удаление решения из изображений с пипеткой, а затем заменить другой 200 мкл калибровочных раствора. Повторите этот процесс 4 раза для обеспечения полного решения обмена.
- Инкубируйте подготовки в калибровочный раствор за 30 мин до изображений. Повторите изображений протокол, используя те же параметры, которые определены в шагах 6.6-6.11, с изменением только 1 min образа захвата.
Примечание: Перфузии системы и капилляров не нужны в этот шаг и не должно придаваться изображений хорошо, чтобы не подвергать капилляров в nigericin. - Добавьте 200 мкл калибровочных стратегии миростроительства (рН 9,0, 10 мкм nigericin) изображений с пипеткой 200 мкл. Удаление решения из изображений с пипеткой, а затем заменить другой 200 мкл калибровочных раствора. Повторите этот процесс 4 раза для обеспечения полного решения обмена.
- Инкубируйте подготовку во втором решении калибровки за 10 мин до изображений. Повторите изображений протокол как шаг 6.13.3.
- Обзор снимок стека в программное обеспечение для анализа изображений для подтверждения, что не пикселов в любом канале насыщения, нажав кнопку «Означает ROI» и хотя прокрутки стека изображений с помощью ползунка «Кадр» наблюдая что значения не сообщили в гистограмму интенсивности достичь максимальное значение обнаружению. Если любые кадры содержат пикселы, которые достигают максимальной интенсивности обнаружению, уменьшите время или освещения интенсивность воздействия и повторите раздел 6.
Примечание: После того, как установлено, не изменяйте визуализации параметров между экспериментов или калибровки, если точки калибровки, должны использоваться в каждом подготовки (см. шаг 8.3).
- Анализ стека изображений для печати интенсивности флуоресценции и флуоресценции соотношение (SEpH/mCherry) как функцию от времени.
- Нажмите «Означает ROI» и выберите средство произвольной формы. Удерживайте левой кнопкой мыши для трассировки ~ 50 мкм длиной MT. Щелкните правой кнопкой мыши, чтобы закончить рисование ROI, а затем повторить в районе, прилегающем к MT для определения фона ROI (Рисунок 5A).
- Нажмите кнопку «Средней интенсивности» под «Измерения». Создайте таблицу значений интенсивности, нажав кнопку «Экспорт > таблицы данных > создать.»
- Щелкните значок шестеренка конфигурации и отменить выбор всех параметров, кроме «Время» и «Означает интенсивности». Щелкните правой кнопкой мыши вкладку для недавно созданной таблицы данных, выберите «Сохранить как» и экспортировать данные в виде файла .csv.
Примечание: Аналогичные измерения может также производиться с использованием свободного программного обеспечения таких как ImageJ. - Откройте таблицу таблицы и импорт данных таблицы путем выбора на вкладке «Данные», следуют «От текста».
- Используйте функции в таблице для вычитания Сеф фон интенсивности от интенсивности сигнала СЕФ в каждый момент времени. Повторите этот процесс для сигнала mCherry.
- Участок интенсивности каждого канала как функцию от времени, выбрав столбцы, содержащие время и скорректированные по фону интенсивность данных и затем нажмите «Вставить > точечной (графики) > точечные диаграммы с прямыми линиями» (Рисунок 5B).
- Используйте функции для вычисления соотношения флуоресценции Сеф/mCherry в каждый момент времени.
- Участок флуоресценции отношение как функцию от времени, выбрав столбцы, содержащие время и соотношение данных и затем щелкните «Вставить > точечной (графики) > Точечная с прямыми линиями» (рис. 5 c).
7. Полная калибровка pHerry в Malpighian трубочки Ex Vivo.
- Вскрыть и смонтировать новый набор передней МТС, как описано в разделе 5.
- Обмен комплексных стратегий миростроительства для калибровки стратегии миростроительства (рН 7,4, nigericin 10 мкм), как описано в шаге 6.13.2. Инкубируйте 30 мин.
- Найдите МТС и собирать пары изображений Сеф/mCherry, как описано в шагах 6.1-6.11. Замените другой запас калибровки стратегии миростроительства как описано в шаге 6.13.4, подождите 10 минут и изображение снова решение. Повторите этот процесс до тех пор, пока Сеф/mCherry соотношение было imaged во всех решений. Получать рН 9,0 изображения как образец редк оправится от высоких рН.
- Участок флуоресценции соотношение СЕФ в mCherry от калибровок в восьми образцов в зависимости от введенных рН,я как описано в шаге 6.14.9. Fit данные калибровки с кривой Больцмана для получения полного калибровка функции согласно уравнение 1 (рис. 5 d). Если данные противоречивы, участок калибровочные наборы от каждого образца, нормализуются таким образом, чтобы соотношение флуоресценции 1.0 соответствует рНi 7.0 и повторно анализировать (Рисунок 5E).
Примечание: Если последний процесс необходимых индивидуальных экспериментов потребуется их собственные внутренние точки калибровки33 (см. Количественная оценка шаг ниже (8.3)). -
Уравнение 1
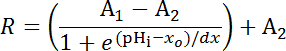
Где R = соотношение Сеф/mCherry и1,2, xoи dx являются кривой установки параметры, представляющие минимальное флуоресценции соотношение, максимум флюоресценции соотношение, pKи ширина функции соответственно. xo = очевидной pK pHerry, который может варьироваться от 7.1 и 7.4 в зависимости от типа клеток и точной калибровки условий.
8. Количественная оценка базолатеральной кислоты экструзии от Ex Vivo трубочку Malpighian эпителия.
- Изображение pHerry выражая севрюга клетки и выражая pHerry основных клеток одновременно.
- Рассечения передней МТС от мухи Бла pHerry/capaR-GAL4 , как описано в разделе 5, но не передавать МТС от рассечения Шнайдер средних изображения хорошо.
- Рассечения передней МТС от мухи Бла pHerry/c724-GAL4 в том же рассечения блюдо, используя процедуру, описанную в разделе 5.
- Перевод 2 комплекта МТС на же изображений хорошо, как описано в шагах 5,8-5.11.
Примечание: Когда радикальные герб МТС вниз слайд, место МТС Бла pHerry/c724-GAL4 и Бла pHerry/capaR-GAL4 трубочки вблизи друг друга, так pHerry выражая главных и севрюга клетки могут быть визуализированы в том же поле ( Рисунок 6A).
- Примените NH4Cl prepulse как описано в шаге 6.12.
Примечание: Если последовательное калибровки (рис. 4B) не может быть достигнута, выполняют точки калибровки, установив рНi 7.0 в конце каждого эксперимента с калибровки стратегии миростроительства (рН 7,0, 10 мкм nigericin, инкубации 30 мин) после клей перфузии ну делителя и перфузии оборудование были удалены. - Калибровки следы от севрюга и главных клеток различных сегментов MT (с помощью абсолютного или нормализованной соотношение в соответствующих случаях) с уравнения 2 и анализа на этапе восстановления после NH4Cl вывода путем применения с помощью функции экспоненциального распада программное обеспечение для статистического анализа и отмечая распад константа (τ) (Рисунок 6B).
Уравнение 2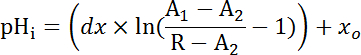
Где R = соотношение Сеф/mCherry и1,2, xoи dx являются кривой установки параметров определяется калибровки на шаге 7.4 (уравнение 1).- Вычислить скорость кислоты экструзии (JH +, см. уравнение 3) в зависимости от рНя для учета вариаций в отдыхая рН,я и кислоты, загрузки между подготовкой34. Используйте экспоненциальной функции, полученных на шаге 8.3 для вычисления производной рНя отношении время в каждом интервале времени.
Уравнение 3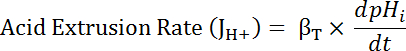
- Вычислить объем внутренней буферизации (βi; Уравнение 4) цитозоль на рН,я с самого начала каждого интервала в шаге 8.3.1 основанных на предыдущих литературы (см. уравнение 4).
Примечание: У дрозофилы, наиболее тщательно характеристика β,я приходит от личинок двигательного нерва терминалы35 , и предполагается, что эти данные можно провести для MT клеток в отсутствие других имеющихся данных.
Уравнение 4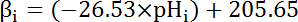
- Вычислить произведение βT (от шага 8.3.2)и dpHятребует (от шага 8.3.1) чтобы определить JH + (уравнение 3).
Примечание: В номинально бикарбонат свободных решений, таких как тех, которые описаны в настоящем Протоколе, гидрокарбонатно производные буферизации способности (βb) предполагается ~ 0 мм. Всего, буферизации способности (βT) представляет собой совокупность β,я иβbи таким образом βя = βT в отсутствие HCO-3–-/CO-2-36. - Участок JH + как функция рНя в начале каждого интервала времени, как указано в шаге 6.14.9.
- Применить экспоненциальный распад функции с частью всех наборов данных, которые перекрываются в рНя с помощью статистического анализа программного обеспечения. Сравните темпы изменения результирующей функций для сравнения кислотных экструзии ставок между клетками и MT сегментов (рис. 6 c).
Примечание: Наиболее подходящую функцию для кривой могут не всегда быть единый экспоненциальный. Другие функции может быть заменен, если они улучшить степень согласия. - Рассчитать кислоты потока (см. уравнение 5) в зависимости от рНя для учета изменения размера ячейки и формы.
Уравнение 5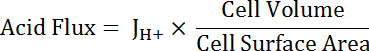
Примечание: Размеры ячейки может быть измерены непосредственно в изображениях или аппроксимировать. Основные клетки может быть представлено как половинки полые трубки с габаритами: внутренний диаметр 24 мкм; наружный диаметр 48 мкм; Высота 50 µm. Переходные севрюга клетки переменной но примерно может быть представлено как баллоны с высоты 50 мкм и диаметров 10 мкм. Просмотреть последний пункт Представитель результаты ниже. - Применить экспоненциальный распад функции с частью всех наборов данных, которые перекрываются в рНя с помощью статистического анализа программного обеспечения. Сравните темпы изменения результирующей функции для сравнения кислотных потоков между клетками и MT сегментов (рис. 6 d).
- Вычислить скорость кислоты экструзии (JH +, см. уравнение 3) в зависимости от рНя для учета вариаций в отдыхая рН,я и кислоты, загрузки между подготовкой34. Используйте экспоненциальной функции, полученных на шаге 8.3 для вычисления производной рНя отношении время в каждом интервале времени.
Access restricted. Please log in or start a trial to view this content.
Результаты
Здоровые ткани и надлежащей идентификации передней МТС жизненно важное значение для успеха этого протокола. Во время вскрытия следует позаботиться не непосредственно ощупь МТС и только ручка их мочеточника как захвата МТС непосредственно приведет к поломке (
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Успех количественного определения рН,я в МТС дрозофилы полностью зависит от здоровья извлеченные МТС и качество монтажа и вскрытие (Рисунок – C). Таким образом тщательной обработке ткани как описано абсолютно необходимо. Слайды, свежезаваренным ?...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Эта работа была поддержана низ DK092408 и DK100227 для производителя Айр был поддержан T32-DK007013. Авторы хотели бы поблагодарить д-р Джулиан а.т. Доу за CapaR-GAL4 и c724-GAL4 дрозофила запасов. Мы также благодарим Джейкоб Андерсон для помощи в поддержании экспериментальный полет кресты.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| Poly-L-Lysine (PLL) Solution | Sigma-Aldrich | P4832 | Store at 4 °C, can be reused. |
| Nigericin Sodium Salt | Sigma-Aldrich | N7143 | CAUTION: Handle with gloves. Store as aliquots of 20 mM stock solution in DMSO at 4 °C. |
| Adhesive Perfusion Chamber Covers, adhesive size 1 mm, chamber diameter × thickness 9 mm × 0.9 mm, ports diameter 1.5 mm | Sigma-Aldrich | GBL622105 | Can be substituted as needed to match perfusion system. |
| Sylgard 184 Silicone Elastomer Kit | Ellsworth Adhesives | 184 SIL ELAST KIT 0.5KG | Available from multiple vendors. |
| Helping Hands Soldering Stands | Harbor Freight Tools | 60501 | Available from multiple vendors. |
| Open Gravity-fed Perfusion System with Valve Controller, 8 to 1 Manifold and Reserviors | Bioscience Tools | PS-8S | Any comparable perfusion system can be used. |
| Flow Regulator | Warner Instruments | 64-0221 | Can be substituted as needed to match perfusion system. |
| Schneider's Medium | Fisher Scientific | 21720024 | Store at 4 °C in sterile aliquots. |
| #5 Inox Steel Forceps | Fine Science Tools | 11252-20 | Can be substituted based on experimenter comfort. |
| 35 x 10 mm polystyrene Petri dish | Corning Life Sciences | Fisher Scientific 08-757-100A | Exact brand and size are unimportant. |
| 75 x 25 mm Microscope Slides | Corning Life Sciences | 2949-75X25 | Exact brand and size can vary as long as perfusion wells are compatible. |
| Filimented Borosilicate Capillary Glass, ID 1.5 mm, OD 0.86 mm, thickness 0.32 mm | Warner Instruments | 64-0796 | Filiment not necessary, glass can be substituted to match perfusion tubing and perfusion wells. |
| Tygon Tubing, ID 1/16", OD 1/8", thickness 1/32" | Fisher Scientific | 14-171-129 | Available from multiple vendors, can be substituted to match perfusion system. |
| Vacuum Silicone Grease | Sigma-Aldrich | Z273554 | Available from multiple vendors. |
| Plastic Flow Control Clamp | Fisher Scientific | 05-869 | Available from multiple vendors, sterility not required |
| Glass rods, 5 mm diameter | delphiglass.com | 9198 | Exact size is personal preference, multiple vendors available |
| PAP Hydrophobic Pen | Sigma-Aldrich | Z377821 | Available from multiple vendors. |
| Sealing Film | Sigma-Aldrich | P7668 | Available from multiple vendors. |
| 15 mL Falcon tube | BD Falcon | 352096 | Available from multiple vendors. |
| 50 mL Falcon tube | BD Falcon | 352070 | Available from multiple vendors. |
| HEPES; 4-(2-Hydroxyethyl)piperazine-1-ethanesulfonic acid | Sigma-Aldrich | H3375 | Available from multiple vendors. |
| MES; 4-Morpholineethanesulfonic acid monohydrate | Sigma-Aldrich | 69892 | Available from multiple vendors. |
| TAPS; N-[Tris(hydroxymethyl)methyl]-3-aminopropanesulfonic acid | Sigma-Aldrich | T5130 | Available from multiple vendors. |
| 10X/0.45 Air Objective | Zeiss | 000000-1063-139 | Comparable objectives can be substituted. 40X objectives can be used for single cell imaging. |
| Dissecting Stereoscope | Zeiss | Discovery.V8 | Any dissecting stereoscope can be used. |
| UAS-pHerry transgenic Drosophila melagnogaster | Available from Romero Lab | First published: Citation 10 | |
| capaR-GAL4 driver line Drosophila melagnogaster | Available from Romero Lab | First published: Citation 32 | |
| c724-GAL4 driver line Drosophila melagnogaster | Available from Romero Lab | First published: Citation 2 | |
| Monochromatic High Sensitivity Digital Camera | Zeiss | Axiocam 506 mono | Exact brand and model can vary, can be replaced with any monochromatic high-sensitivity camera suited to live cellular imaging. |
| GFP/FITC filter set, 470/40 nm ex., 515 nm longpass em., 500 nm dichroic | Chroma | CZ909 | Any GFP/FITC filer set can be substituted. |
| RFP/TRITC filter set, 546/10 nm ex., 590 nm longpass em., 565 nm dichroic | Chroma | CZ915 | Any GFP/FITC filer set can be substituted. |
| Inverted Epifluoescent Microscope | Zeiss | Axio Observer Z.1 | Any comparable microscope with motorized filter switching can be used. Upright microscopes can be used with open perfusion baths and water-immersion objectives. |
| Statistical Analysis Software | Microcal | Origin 6.0 | Any software with comparable functionality can be substituted |
| Image Analysis Software | National Institutes of Health | ImageJ 1.50i | Any software with comparable functionality can be substituted |
| Image Acquisition Software | Zeiss | Zen 1.1.2.0 | Any software with comparable functionality can be substituted |
| Single-edged Carbon Steel Razor Blade | Electron Microscopy Sciences | 71960 | Available from multiple vendors. |
| Microscopy Slide Folder | Fisher Scientific | 16-04 | Available from multiple vendors. |
| Bunsen Burner | Fisher Scientific | 50-110-1231 | Available from multiple vendors. |
| Polystrene Drosophila Rearing Vials with Flugs | Genesee Scientific | 32-109BF | Comparable items can be substituted. |
| 2.5 L Laboratory Ice Bucket | Fisher Scientific | 07-210-129 | Available from multiple vendors. |
| NMDG; N-Methyl-D-glucamine | Sigma-Aldrich | M2004 | Available from multiple vendors. |
| 200 uL barrier pipette tips | MidSci | AV200 | Available from multiple vendors. |
| 200 μL variable volume pipette | Gilson Incorporated | PIPETMAN P200 | Available from multiple vendors. |
Ссылки
- Dow, J. A. T., Romero, M. F. Drosophila provides rapid modeling of renal development, function, and disease. Am J Physiol Renal Physiol. 299 (6), F1237-F1244 (2010).
- Sozen, M. A., Armstrong, J. D., Yang, M., Kaiser, K., Dow, J. A. Functional domains are specified to single-cell resolution in a Drosophila epithelium. P Natl Acad Sci USA. 94 (10), 5207-5212 (1997).
- Davies, S. A., et al. Analysis and inactivation of vha55, the gene encoding the vacuolar ATPase B-subunit in Drosophila melanogaster reveals a larval lethal phenotype. J Biol Chem. 271 (48), 30677-30684 (1996).
- Torrie, L. S., et al. Resolution of the insect ouabain paradox. P Natl Acad Sci USA. 101 (37), 13689-13693 (2004).
- Evans, J. M., Allan, A. K., Davies, S. A., Dow, J. A. Sulphonylurea sensitivity and enriched expression implicate inward rectifier K+ channels in Drosophila melanogaster renal function. J Exp Biol. 208 (Pt 19), 3771-3783 (2005).
- Sciortino, C. M., Shrode, L. D., Fletcher, B. R., Harte, P. J., Romero, M. F. Localization of endogenous and recombinant Na(+)-driven anion exchanger protein NDAE1 from Drosophila melanogaster. Am J Physiol Cell Physiol. 281 (2), C449-C463 (2001).
- Ianowski, J. P., O'Donnell, M. J. Basolateral ion transport mechanisms during fluid secretion by Drosophila Malpighian tubules: Na+ recycling, Na+:K+:2Cl- cotransport and Cl- conductance. J Exp Biol. 207 (Pt 15), 2599-2609 (2004).
- O'Donnell, M. J., et al. Hormonally controlled chloride movement across Drosophila tubules is via ion channels in stellate cells. Am J Physiol. 274 (4 Pt 2), R1039-R1049 (1998).
- Cabrero, P., et al. Chloride channels in stellate cells are essential for uniquely high secretion rates in neuropeptide-stimulated Drosophila diuresis. P Natl Acad Sci USA. 111 (39), 14301-14306 (2014).
- Rossano, A. J., Kato, A., Minard, K. I., Romero, M. F., Macleod, G. T. Na+ /H+ -exchange via the Drosophila vesicular glutamate transporter (DVGLUT) mediates activity-induced acid efflux from presynaptic terminals. J Physiol. 595 (3), 805-824 (2017).
- Sankaranarayanan, S., De Angelis, D., Rothman, J. E., Ryan, T. A. The use of pHluorins for optical measurements of presynaptic activity. Biophys J. 79 (4), 2199-2208 (2000).
- Miesenbock, G., De Angelis, D. A., Rothman, J. E. Visualizing secretion and synaptic transmission with pH-sensitive green fluorescent proteins. Nature. 394 (6689), 192-195 (1998).
- Shaner, N. C., et al. Improved monomeric red, orange and yellow fluorescent proteins derived from Discosoma sp. red fluorescent protein. Nat biotechnol. 22 (12), 1567-1572 (2004).
- Thomas, J. A., Buchsbaum, R. N., Zimniak, A., Racker, E. Intracellular pH measurements in Ehrlich ascites tumor cells utilizing spectroscopic probes generated in situ. Biochemistry. 18 (11), 2210-2218 (1979).
- Brand, A. H., Perrimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118 (2), 401-415 (1993).
- Dietzl, G., et al. A genome-wide transgenic RNAi library for conditional gene inactivation in Drosophila. Nature. 448 (7150), 151(2007).
- Dow, J. A., et al. The malpighian tubules of Drosophila melanogaster: a novel phenotype for studies of fluid secretion and its control. J Exp Biol. 197, 421-428 (1994).
- Hirata, T., et al. In vivo Drosophilia genetic model for calcium oxalate nephrolithiasis. Am J Physiol Renal Physiol. 303 (11), F1555-F1562 (2012).
- Schellinger, J. N., Rodan, A. R. Use of the Ramsay Assay to Measure Fluid Secretion and Ion Flux Rates in the Drosophila melanogaster Malpighian Tubule. J Vis Exp. (105), (2015).
- Caldwell, P. C. An investigation of the intracellular pH of crab muscle fibres by means of micro-glass and micro-tungsten electrodes. J Physiol. 126 (1), 169-180 (1954).
- Boron, W. F., De Weer, P. Intracellular pH transients in squid giant axons caused by CO2, NH3, and metabolic inhibitors. J Gen Physiol. 67 (1), 91-112 (1976).
- Rink, T. J., Tsien, R. Y., Pozzan, T. Cytoplasmic pH and free Mg2+ in lymphocytes. J Cell Biol. 95 (1), 189-196 (1982).
- Bizzarri, R., Serresi, M., Luin, S., Beltram, F. Green fluorescent protein based pH indicators for in vivo use: a review. Anal Bioanal Chem. 393 (4), 1107-1122 (2009).
- Kneen, M., Farinas, J., Li, Y., Verkman, A. S. Green fluorescent protein as a noninvasive intracellular pH indicator. Biophys J. 74 (3), 1591-1599 (1998).
- Raimondo, J. V., Irkle, A., Wefelmeyer, W., Newey, S. E., Akerman, C. J. Genetically encoded proton sensors reveal activity-dependent pH changes in neurons. Front Mol Neurosci. 5, 68(2012).
- Raimondo, J. V., et al. Tight Coupling of Astrocyte pH Dynamics to Epileptiform Activity Revealed by Genetically Encoded pH Sensors. J Neurosci. 36 (26), 7002-7013 (2016).
- Bagar, T., Altenbach, K., Read, N. D., Bencina, M. Live-Cell imaging and measurement of intracellular pH in filamentous fungi using a genetically encoded ratiometric probe. Eukaryot Cell. 8 (5), 703-712 (2009).
- Gjetting, K. S., Ytting, C. K., Schulz, A., Fuglsang, A. T. Live imaging of intra- and extracellular pH in plants using pHusion, a novel genetically encoded biosensor. J Exp Bot. 63 (8), 3207-3218 (2012).
- Greenspan, R. J. Fly pushing: the theory and practice of Drosophila genetics. , 2nd ed, Cold Spring Harbor Laboratory Press. (2004).
- Raimondo, J. V., et al. A genetically-encoded chloride and pH sensor for dissociating ion dynamics in the nervous system. Front Cell Neurosci. 7, 202(2013).
- Koivusalo, M., et al. Amiloride inhibits macropinocytosis by lowering submembranous pH and preventing Rac1 and Cdc42 signaling. J Cell Biol. 188 (4), 547-563 (2010).
- Terhzaz, S., et al. Mechanism and function of Drosophila capa GPCR: a desiccation stress-responsive receptor with functional homology to human neuromedinU receptor. PloS one. 7 (1), e29897(2012).
- Boyarsky, G., Ganz, M. B., Sterzel, R. B., Boron, W. F. pH regulation in single glomerular mesangial cells. I. Acid extrusion in absence and presence of HCO3. Am J Physiol. 255 (6 Pt 1), C844-C856 (1988).
- Chesler, M. The regulation and modulation of pH in the nervous system. Prog Neurobiol. 34 (5), 401-427 (1990).
- Rossano, A. J., Chouhan, A. K., Macleod, G. T. Genetically encoded pH-indicators reveal activity-dependent cytosolic acidification of Drosophila motor nerve termini in vivo. J Physiol. 591 (7), 1691-1706 (2013).
- Roos, A., Boron, W. F. Intracellular pH. Physiol Rev. 61 (2), 296-434 (1981).
- Vaughan-Jones, R. D., Wu, M. L. pH dependence of intrinsic H+ buffering power in the sheep cardiac Purkinje fibre. J Physiol. 425, 429-448 (1990).
- Buckler, K. J., Vaughan-Jones, R. D., Peers, C., Nye, P. C. Intracellular pH and its regulation in isolated type I carotid body cells of the neonatal rat. J Physiol. 436, 107-129 (1991).
- Bevensee, M. O., Schwiening, C. J., Boron, W. F. Use of BCECF and propidium iodide to assess membrane integrity of acutely isolated CA1 neurons from rat hippocampus. J Neurosci Methods. 58 (1-2), 61-75 (1995).
- Arosio, D., et al. Simultaneous intracellular chloride and pH measurements using a GFP-based sensor. Nat Methods. 7 (7), 516-518 (2010).
- Wu, Y., Baum, M., Huang, C. L., Rodan, A. R. Two inwardly rectifying potassium channels, Irk1 and Irk2, play redundant roles in Drosophila renal tubule function. Am J Physiol Regul Integr Comp Physiol. 309 (7), R747-R756 (2015).
- Schulte, A., Lorenzen, I., Bottcher, M., Plieth, C. A novel fluorescent pH probe for expression in plants. Plant Methods. 2, 7(2006).
- Shen, Y., Rosendale, M., Campbell, R. E., Perrais, D. pHuji, a pH-sensitive red fluorescent protein for imaging of exo- and endocytosis. J Cell Biol. 207 (3), 419-432 (2014).
- Johnson, D. E., et al. Red fluorescent protein pH biosensor to detect concentrative nucleoside transport. J Biol Chem. 284 (31), 20499-20511 (2009).
- Mahon, M. J. pHluorin2: an enhanced, ratiometric, pH-sensitive green florescent protein. Adv Biosci Biotechnol. 2 (3), 132-137 (2011).
- Li, Y., Tsien, R. W. pHTomato, a red, genetically encoded indicator that enables multiplex interrogation of synaptic activity. Nat Neurosci. 15 (7), 1047-1053 (2012).
- Tantama, M., Hung, Y. P., Yellen, G. Imaging intracellular pH in live cells with a genetically encoded red fluorescent protein sensor. J Am Chem Soc. 133 (26), 10034-10037 (2011).
- Matlashov, M. E., et al. Fluorescent ratiometric pH indicator SypHer2: Applications in neuroscience and regenerative biology. Biochimica et biophysica acta. 1850 (11), 2318-2328 (2015).
- Kogure, T., et al. A fluorescent variant of a protein from the stony coral Montipora facilitates dual-color single-laser fluorescence cross-correlation spectroscopy. Nat biotechnol. 24 (5), 577-581 (2006).
- Llopis, J., McCaffery, J. M., Miyawaki, A., Farquhar, M. G., Tsien, R. Y. Measurement of cytosolic, mitochondrial, and Golgi pH in single living cells with green fluorescent proteins. P Natl Acad Sci USA. 95 (12), 6803-6808 (1998).
- Poburko, D., Santo-Domingo, J., Demaurex, N. Dynamic regulation of the mitochondrial proton gradient during cytosolic calcium elevations. J Biol Chem. 286 (13), 11672-11684 (2011).
- Stornaiuolo, M., et al. KDEL and KKXX retrieval signals appended to the same reporter protein determine different trafficking between endoplasmic reticulum, intermediate compartment, and Golgi complex. Mol Biol Cell. 14 (3), 889-902 (2003).
- Makkerh, J. P., Dingwall, C., Laskey, R. A. Comparative mutagenesis of nuclear localization signals reveals the importance of neutral and acidic amino acids. Curr Biol. 6 (8), 1025-1027 (1996).
- Zacharias, D. A., Violin, J. D., Newton, A. C., Tsien, R. Y. Partitioning of lipid-modified monomeric GFPs into membrane microdomains of live cells. Science. 296 (5569), 913-916 (2002).
- McGuire, R. M., Silberg, J. J., Pereira, F. A., Raphael, R. M. Selective cell-surface labeling of the molecular motor protein prestin. Biochem Biophys Res Comm. 410 (1), 134-139 (2011).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены