Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Прогнозирование гена Silencing через Spatiotemporal Контроль выхода siRNA из фоточувствительных полимерных нановолокон
В этой статье
Резюме
Мы представляем новый метод, который использует фоточувствительные блок-сополимеры для более эффективного пространственно-временного контроля за отключением генов без каких-либо детектируемых эффектов вне мишени. Кроме того, изменения экспрессии генов могут быть предсказаны с использованием простых анализов высвобождения siRNA и простого кинетического моделирования.
Аннотация
Новые материалы и методы необходимы для лучшего контроля связывания с высвобождением нуклеиновых кислот в широком спектре применений, требующих точной регуляции активности генов. В частности, новые стимулирующие стимулы материалы с улучшенным пространственно-временным контролем над экспрессией генов будут открывать переводимые платформы в технологии обнаружения лекарств и регенеративной медицины. Кроме того, повышенная способность контролировать высвобождение нуклеиновой кислоты из материалов позволила бы разработать оптимизированные методы для прогнозирования эффективности нанопорошков априори , что привело бы к ускоренному скринингу транспортных средств доставки. Здесь мы представляем протокол для прогнозирования эффективности подавления генов и достижения пространственно-временного контроля над экспрессией генов с помощью модульной фотореактивной системы наносителя. Малая интерферирующая РНК (siRNA) комплексна с полимерами mPEG- b -поли (5- (3- (амино) пропокси) -2-нитробензилметакрилата) (mPEG- b- P (APNBMA)) для foRm устойчивые нанополосы, которые можно контролировать с помощью света, чтобы облегчить перестраиваемый, включение / выключение siRNA. Мы излагаем два дополнительных анализа с использованием флуоресцентной корреляционной спектроскопии и гель-электрофореза для точной количественной оценки выделения сиРНК из растворов, имитирующих внутриклеточные среды. Информация, полученная в результате этих анализов, была включена в кинетическую модель простой РНК-интерференции (RNAi), чтобы предсказать динамические реакции глушителя на различные условия фотостимуляции. В свою очередь, эти оптимизированные условия облучения позволили уточнить новый протокол для пространственно-временного контроля молчания генов. Этот метод может генерировать клеточные структуры в экспрессии генов с разрешением клеток к клетке и без обнаруживаемых эффектов вне цели. В совокупности наш подход предлагает простой в использовании метод прогнозирования динамических изменений экспрессии генов и точное управление активности siRNA в пространстве и времени. Этот набор анализов может быть легко адаптирован для тестирования широкого спектра otЕе системы, реагирующие на стимулы, для решения ключевых проблем, связанных с множеством применений в биомедицинских исследованиях и медицине.
Введение
Малые интерферирующие РНК (siRNAs) опосредуют замораживание после транскрипционного гена через каталитический RNAi-путь, который является высокоспецифичным, мощным и адаптируемым практически к любому гену-мишени 1 . Эти многообещающие характеристики позволили терапевтическим средствам siRNA продвигаться в клинических испытаниях человека для лечения многочисленных заболеваний, включая метастазирующую меланому и гемофилию 2 , 3 . Однако сохраняются значительные проблемы с доставкой, которые затруднили перевод 4 . В частности, средства доставки должны оставаться стабильными и защищать siRNAs от внеклеточной деградации, а также высвобождать полезную нагрузку в цитоплазму 5 . Кроме того, для многих применений RNAi требуются улучшенные методы для регулирования глушителя генов в пространстве и времени 6 , что уменьшит побочные эффекты в терапии siRNA 7 и позволит преобразовать aDvances в приложениях, начиная от клеточных микрочипов для обнаружения лекарств 8 до модуляции клеточных ответов в регенеративных лесах 9 . Эти проблемы подчеркивают необходимость в новых материалах и методах для лучшего контроля связывания с высвобождением в наноразмерах siRNA.
Одной из наиболее перспективных стратегий борьбы с высвобождением siRNA и усилением пространственно-временной регуляции является использование чувствительных к стимулам материалов 10 . Например, большое разнообразие биоматериалов было спроектировано с изменчивой аффинностью связывания нуклеиновой кислоты в ответ на измененный окислительно-восстановительный потенциал или pH, или приложенные магнитные поля, ультразвук или свет 11 . Хотя многие из этих систем демонстрируют улучшенный контроль активности нуклеиновой кислоты, использование света в качестве триггера особенно выгодно из-за его мгновенного временного отклика, точного пространственного разрешения и простоты перестраивания 12. Кроме того, потенциал фоточувствительных технологий для регулирования экспрессии генов был продемонстрирован с помощью современных индуцибельных промоторных и оптогенетических систем регуляторов; Однако эти системы страдают от многочисленных проблем, включая ограниченные возможности для регулирования эндогенных генов, проблемы безопасности, такие как иммуногенность, и трудности с доставкой многокомпонентных сборок 13 , 14 , 15 . Фотореактивные siRNA nanoparriers идеально подходят для преодоления этих недостатков и обеспечения более простого и более надежного подхода к пространственно-временному модулированию экспрессии генов 16 , 17 , 18 . К сожалению, методы точного предсказания результирующего ответа на нокдаун белка остаются неуловимыми.
Ключевой проблемой является то, что количественные оценки высвобождения siRNAРедко 19 , 20 , и даже когда эти оценки выполняются, они не были связаны с анализом динамики оборотов сиРНК / белка. Как количество выделяемой siRNA, так и ее персистенция / время жизни являются важными детерминантами результирующей динамики молчания генов; Следовательно, отсутствие такой информации является основным отключением, которое исключает точное прогнозирование доза-ответа в RNAi 21 . Решение этой задачи ускорит формулировку соответствующих структурно-функциональных связей в нановолокнах и улучшит информацию о конструкциях биоматериалов 22 . Кроме того, такие подходы позволят разработать более эффективные протоколы дозирования siRNA. В попытке понять реакцию динамического молчания несколько групп исследовали математические модели RNAi 23 , 24 , 25 . Эти рамки былиУспешным в предоставлении информации о siRNA-опосредованных изменениях экспрессии генов и определении этапов ограничения скорости 26 . Однако эти модели были применены только к коммерческим системам доставки генов ( например , Lipofectamine и polyethylenimine (PEI)), которые не способны к контролируемому выделению siRNA, и сложность моделей сильно ограничивает их полезность 27 . Эти недостатки подчеркивают неудовлетворенную потребность в новых материалах, способных точно настраивать выпуск siRNA в сочетании с обтекаемыми и простыми в использовании прогнозирующими кинетическими моделями.
Наш метод решает все эти проблемы за счет интеграции светочувствительной платформы нанометрового носителя со связанными методами для количественной оценки свободной сиРНК и динамики модели RNAi. В частности, точно контролируемый siRNA-релиз 28 нашей платформы контролируется двумя дополнительными методами для точного количественного определения инкапсулированных против unСвязанной сиРНК. Экспериментальные данные этих анализов вводятся в простую кинетическую модель для прогнозирования эффективности подавления гена априорно 29 . Наконец, природа включения / выключения нанослоев легко используется для создания структур клеток в экспрессии генов с пространственным контролем на шкале длины клеток. Таким образом, этот метод обеспечивает легко адаптируемый метод контроля и прогнозирования гашения генов в различных приложениях, которые выиграют от пространственно-временной регуляции поведения клеток.
протокол
1. Формулировка siRNA Nanocarriers
- Подготовьте отдельные растворы siRNA и mPEG- b- P (APNBMA) с равными объемами, разбавленными в буфере 20 мМ 4- (2-гидроксиэтил) пиперазин-1-этансульфоновой кислоты (HEPES) при рН 6,0.
- Добавить siRNA в концентрации от 32 мкг / мл до 20 мМ раствора HEPES.
ПРИМЕЧАНИЕ. СиРНК была нецелевой, универсальной отрицательной контрольной последовательностью; Однако, siRNA может быть спроектирована для нацеливания на любой интересующий ген. - Растворяют полимеры mPEG- b- P (APNBMA) в 20 мМ растворе HEPES. Добавьте подходящее количество mPEG- b- P (APNBMA), чтобы получить раствор 220 мкг / мл, так что отношение N / P (N, аминогруппы на mPEG- b -P (APNBMA), P, фосфатные группы на siRNA) 4.
ПРИМЕЧАНИЕ. Протокол синтеза полимеров mPEG- b- P (APNBMA) сообщается в другом месте 30 .
- Добавить siRNA в концентрации от 32 мкг / мл до 20 мМ раствора HEPES.
- Добавьте раствор mPEG- b- P (APNBMA) по каплям к равному объемуE раствора siRNA, осторожно перемешивая на вихревой машине. Продолжить вихрь в течение 30 с после добавления полимера. Инкубируйте образцы в темноте при комнатной температуре в течение 30 мин.
2. Измерение выхода siRNA с использованием гель-электрофореза
- Сформулируйте наноугрозы в соответствии с шагами 1.1-1.2 и масштабируйте объемы, чтобы учесть количество желаемых образцов.
- Смешайте нанонаполнитель с додецилсульфатом натрия (SDS).
- Подготовьте 1 мг / мл раствор SDS в воде. Выразите количество раствора SDS, необходимого для получения растворов с отношением S / P (S, сульфатные группы на SDS, P, фосфатные группы на siRNA) 15.
ПРИМЕЧАНИЕ. Если раствор полиплекса содержит 1 мкг siRNA, необходимо добавить 13 мкг SDS для достижения отношения S / P 15. - Добавьте раствор SDS к каждому раствору нанокарьера по каплям при осторожном перемешивании на вихревой машине. Продолжайте вращаться в течение 30 секунд после добавления SDS.
- Центрифугировать образцы при 3000 мкг в течение 5 с. Инкубируйте образцы в темноте при комнатной температуре в течение 30 мин.
- Подготовьте 1 мг / мл раствор SDS в воде. Выразите количество раствора SDS, необходимого для получения растворов с отношением S / P (S, сульфатные группы на SDS, P, фосфатные группы на siRNA) 15.
- Откалибруйте и установите УФ-лазер с фильтром 365 нм с интенсивностью 200 Вт / м. Убедитесь, что интенсивность света измеряется от места, где будет располагаться дно раствора образца.
- Загрузите раствор нанокарьера / SDS в стеклянную камеру, состоящую из стеклянных слайдов, разделенных резиновой прокладкой.
- Предварительно промыть стеклянные слайды в растворе этанол / вода 7: 3 (об. / Об.) В воде и полностью высушить. Отрежьте отверстие (прямоугольник ~ 2 x 3 см) в резиновой прокладке. Поместите резиновую прокладку на стеклянный предмет.
- Нанесите раствор нанокарьера / SDS на стеклянную ползунь внутри отверстия резиновой прокладки. Загрузите избыток раствора (избыток 20 мкл) на стекло скольжения, избегая контакта с резиновой прокладкой.
ПРИМЕЧАНИЕ. Некоторая жидкость будет потеряна во время последующих шагов. - Поместите второе стеклоСдвиньте верхнюю часть прокладки. Чтобы избежать образования пузырьков воздуха, сначала поместите один конец слайда вниз, а затем медленно опустите другой конец.
- Прикрепите зажимные зажимы к каждой стороне стеклянной камеры, чтобы закрыть его.
- Облучают образцы в течение требуемого периода времени ( например , 0-60 мин) с использованием УФ-лазера с фильтром 365 нм при интенсивности 200 Вт / м. Снимите зажимы и откройте камеру.
- Внесите в микроцентрифужную пробирку 25 мкл облученных образцов нанозерже / SDS. Инкубируйте растворы в темноте при комнатной температуре в течение 30 мин.
- Подготовьте 2% -ный агарозный гель, предварительно окрашенный 0,5 мкг / мл бромида этидия в буферном растворе Tris / Borate / EDTA (TBE) в соответствии со стандартными протоколами 31 . Подготовьте загрузочный буфер, содержащий 3: 7 (об. / Об.) Глицерин / вода.
- Добавить 5 мкл загрузочного буферного раствора до 25 мкл каждого образца нанокарьера / SDS. Инкубируйте образцы в темноте приКомнатной температуре в течение 10 мин.
- Загрузите 30 мкл каждого образца нанокарьера / SDS в 2% -ный агарозный гель. Запустите гель в темноте при 100 В в течение 30 мин. Образуйте гель, используя систему гелеобразования с фильтрами этидия бромида. Сохраните файлы изображений геля и перейдите к шагу 2.10 для количественной оценки интенсивности полосы. Убедитесь, что интенсивности полос достаточно яркие, чтобы четко визуализировать, но не слишком яркие, что сигналы насыщены.
- Определите интенсивность полосы с использованием общедоступного программного обеспечения ImageJ 32 .
- Используя инструмент ROI ImageJ, определите интенсивность флуоресценции свободных полос siRNA в каждой полосе, рисуя прямоугольник вокруг каждой полосы. Нарисуйте кривые интенсивности каждой полосы и проинтегрируйте область под кривыми, вычерчивая горизонтальную линию по кривым интенсивности и щелкая палочкой-трассировкой внутри закрытых областей.
- Вычислить относительную интенсивность каждой полосы, разделив площадь под cu(Без добавления mPEG- b- P (APNBMA) и добавления SDS). Сообщайте о проценте siRNA, высвобожденном как нормализованная интенсивность полосы каждого образца.
3. Измерение выхода siRNA с использованием флуоресцентной корреляционной спектроскопии (FCS)
- Получите siRNA, помеченную одним флуорофором на 5'-конце смысловой цепи.
ПРИМЕЧАНИЕ. SiRNA можно приобрести предварительно отожженными с этикетками, конъюгированными в нужном месте. Флуорофор должен быть фотостабильным и поглощать / излучать между 450 и 750 нм, чтобы избежать закалки ультрафиолетового света и переноса энергии с помощью mPEG- b- P (APNBMA). - Сформулируйте наноугрозы в соответствии со стадиями 1.1-1.2 с использованием меченой сиРНК. Масштабируйте тома, чтобы соответствовать количеству желаемых образцов.
- Инкубируйте растворы в SDS и облучайте в течение требуемого периода времени в соответствии со стадиями 2.2-2.6.
- ДГОВ камере для отбора проб FCS.
- Вымойте стеклянный предмет с раствором этанол / вода 7: 3 (об. / Об.) И полностью высушите стекло с помощью протирки и воздушного потока.
- Удалите кусочки бумаги с двухсторонней клеевой прокладки, чтобы открыть двухстороннюю клеевую прокладку. Прикрепите распорку к покровному стеклу.
- Нанесите раствор нанокарьера / SDS на прокладку крышки посередине отверстия с клеевой прокладки.
- Поместите стеклянную горку сверху покровного стекла. Надавите на стекло, чтобы убедиться, что слайд стекла и покровное стекло хорошо прикреплены и образуют уплотнение.
- Используйте конфокальный микроскоп для измерений FCS 33 . Используйте объектив апохромата с водой 40X с числовой апертурой 1,2. Используйте соответствующий лазерный канал возбуждения (488 нм) для сбора не менее 30 измерений по 10 с на каждый образец 34 . Убедитесь, что интенсивность лазерного излучения и детекцияТо же для каждого образца.
- В дополнение к экспериментальным образцам контрольные меры, включая: чистый образец без меченой сиРНК; И свободный образец siRNA с мечеными siRNA, но без mPEG- b- P (APNBMA).
- Проанализируйте данные с помощью специального программного обеспечения FCS. Определите базовую скорость счета каждого образца, определив стабильную скорость счета в течение времени, когда никакие нанопоходы не проходят через конфокальный объем 29 .
- Вычтите скорость счета пустого образца из каждого значения скорости отсчета базовой линии. Нормализовать полученные значения в свободном управлении siRNA для расчета процента свободной siRNA 35 .
4. Кинетическое моделирование для прогнозирования отключения генов
- Создание сценариев на математическом языке программирования с использованием простого набора обыкновенных дифференциальных уравнений для прогнозирования молчания генов 29.
ПРИМЕЧАНИЕ. Сценарии могут быть предоставлены по запросу.- Запишем множество обыкновенных дифференциальных уравнений как:
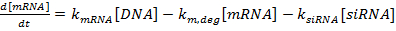 (1)
(1)  (2)
(2) 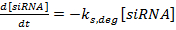 (3)
(3)
ПРИМЕЧАНИЕ. Для уравнений 1-3 члены k мРНК , k siRNA и k prot являются константами скорости для образования мРНК, siRNA и белка соответственно. Термины k m, deg , k s, deg и k p, deg - константы скорости для деградации мРНК, siRNA и белка соответственно. Константы скорости деградации вычисляются на основе периода полураспада компонентов, а константы скорости производства подходят для обеспечения того, чтобы установившиеся значения мРНК и белка достигались в отсутствие oF siRNA.- Определите периоды полураспада мРНК и белка для интересующего гена (ов), либо экспериментально, как описано в ссылке 36, либо из литературы (см. Обсуждение ). Также определите время удвоения для клеточной линии. Введите эти значения в соответствующие выражения скорости деградации.
- Настройте константы скорости производства, чтобы уровни экспрессии генов оставались стабильными при нормированном значении 100, если не вводится сиРНК. В частности, установите [siRNA] в ноль и измените значения констант скорости k мРНК , k siRNA и k prot до тех пор, пока [мРНК] и [белок] не останутся в пределах 1% от начального нормированного значения 100% в течение времени Моделирование.
- Используя относительные количества siRNA, высвобожденные из ранее описанного гель-электрофореза и анализов FCS в качестве оценок, отрегулируйте исходную относительную концентрацию siRNA в сценарии. В частности, измените [siRNA], чтобы быть пропорциональным относительному количеству высвобожденной siRNA со значением 100, соответствующему максимальному количеству 29 .
- Запишем множество обыкновенных дифференциальных уравнений как:
5. Культура клеток и доставка siRNA in vitro
- Культура NIH / 3T3 мышиные эмбриональные фибробласты в соответствии с протоколами от поставщика.
- Выращивайте клетки в среде роста (модифицированная Дульбекко среда орла (DMEM), дополненная 10% инактивированной теплом фетальной бычьей сывороткой и 1% пенициллина-стрептомицина). Поддерживайте ячейки при 37 ° C в увлажненной среде с 5% CO 2 .
- Высевают клетки в 6-луночных планшетах, обработанных культурой.
- Следуйте рекомендованной процедуре субкультуры у поставщика. Подсчитайте клетки с помощью гемоцитометра. Разбавьте клетки в добавочных средах роста до концентрации 75000 клеток / мл.
- Добавить 2 мл клеточной суспензии (75000 клетокС / мл) в каждую лунку 6-луночного планшета. Пусть клетки прилипают и восстанавливаются в течение 24 часов в инкубаторе.
- Подготовьте клетки для трансфекции путем промывания забуференным фосфатом физиологическим раствором (PBS) и добавлением 1,5 мл среды для трансфекции, не содержащей сыворотку и антибиотик (см. Таблицу материалов ) в каждую лунку.
- Сформулируйте нанокресты siRNA согласно этапам 1.1-1.2. Добавьте в каждую лунку 25 мкл раствора наносорьера, содержащего 30 пмоль сиРНК. Осторожно пипетируйте носитель вверх и вниз, чтобы перемешать. Поместите клетки в инкубатор в течение 3 часов.
- Удалите трансфекционную среду и промыть каждую лунку PBS. Добавьте 1 мл добавленной растительной среды и поместите клетки в инкубатор, чтобы восстановить в течение 30 мин.
- Чтобы подготовить клетки для лечения фотостимуляром, удалите добавленную среду для роста. Добавьте 1 мл трансфекционной среды (без фенольного красного) в каждую лунку.
ПРИМЕЧАНИЕ. Убедитесь, что трансфекционная среда не содержит фенольного красного. - Откалибруйте и установите УФ-лазер с фильтром 365 нм с интенсивностью 200 Вт / м. Убедитесь, что интенсивность света измеряется от места, где будет располагаться дно ячейки.
- Поместите ячейки на горячую пластину, установленную на 37 ° C. Снимите крышку пластины. Разогреть клетки сверху пластины в течение требуемого времени (до 20 мин) с использованием УФ-лазера с фильтром 365 нм при интенсивности 200 Вт м -2 .
- Удалите трансфекционную среду и добавьте 2 мл добавленной ростовой среды. Место в инкубаторе до дальнейшего анализа ( например , 24 часа для qPCR и 48 ч для вестерн-блоттинга).
- Измерьте изменения в экспрессии генов с использованием различных методов, таких как вестерн-блоттинг 37 и qPCR. 38 Для генов с видимыми сигналами, таких как GFP, используйте флуоресцентную микроскопию 29 .
ПРИМЕЧАНИЕ. Эти методы предлагаются из-за их простоты использования и точностиВ количественной экспрессии гена
- Измерьте изменения в экспрессии генов с использованием различных методов, таких как вестерн-блоттинг 37 и qPCR. 38 Для генов с видимыми сигналами, таких как GFP, используйте флуоресцентную микроскопию 29 .
6. Контроль за отключением генов в спатипотемпоральном методе
- Культура, семена и трансфектные клетки в соответствии со стадиями 5.1-5.7.
- Подготовьте фотомаску, которая полностью блокирует свет 365 нм и минимизирует отражения.
ПРИМЕЧАНИЕ. В этом случае для блокировки света и уменьшения отражений использовались 10 х 10 см алюминиевой фольги и черная строительная бумага. Алюминиевая фольга и строительная бумага были склеены вместе, чтобы сформировать единый блок.- Вырежьте / перфорируйте / станьте желаемую форму в фотомаску. Например, используйте лезвие с острыми кромками и отверстие-перфоратор для формирования линейного рисунка (длиной ~ 5 см) и кругового рисунка (диаметром ~ 7 мм) в фотомаске соответственно.
- Приклеить фотомаску к нижней части 6-луночного планшета с рисунком, центрированным под лункой, содержащей клетки с антибликовым покрытием ( например , черный cНа строительной бумаге), обращенной к плите. Убедитесь, что клей не расположен вблизи края (в пределах ~ 3 мм) от рисунка.
- Настройте две кольцевые опоры примерно на 25 см друг от друга и прикрепите платформу к каждому кольцевому стойку, чтобы платформы были одинаковой высоты. Приостановите пластину ячейки между двумя стойками, положив тарелку поверх платформ. Убедитесь, что пластина находится на уровне.
- Облучение клеток снизу образца в течение требуемого времени (до 20 мин) с использованием УФ-лазера с фильтром 365 нм с интенсивностью 200 Вт / м 2 .
- Удалите трансфекционную среду и добавьте 2 мл добавленной ростовой среды. Поместите в инкубатор для восстановления в течение как минимум 24 часов. Изобразите клетки с помощью флуоресцентной микроскопии, как описано 29 .
Результаты
После составления наноугрозов были проведены исследования с расщеплением siRNA для информирования об условиях облучения, которые должны использоваться в трансфекциях in vitro . Для определения процента siRNA, который был высвобожден, применяли различные дозы свет?...
Обсуждение
В этом методе есть несколько шагов, которые особенно важны. При составлении наноугрозов порядок добавления компонентов и скорость смешивания являются двумя важными параметрами, влияющими на эффективность 39 . Этот протокол требует, чтобы катионный компонент, mPEG- b -P (APN...
Раскрытие информации
Авторы заявляют, что у них нет конкурирующих финансовых интересов.
Благодарности
Авторы выражают благодарность Национальному институту общих медицинских наук Национального института здоровья (NIH) за финансовую поддержку через премию за институциональное развитие (IDeA) под номером гранта P20GM103541, а также номер гранта P20GM10344615. Представленные здесь заявления не отражают взглядов НИЗ. Мы также признаем Делавэрский институт биотехнологии (DBI) и Департамент экономического развития Делавэра (DEDO) за финансовую поддержку через премию Bioscience Center for Advanced Technology (Bioscience CAT) (12A00448).
Материалы
| Name | Company | Catalog Number | Comments |
| siRNA | Sigma-Aldrich | SIC001 | non-targeted, universal negative control |
| mPEG-b-P(APNBMA) | synthesized in our lab | N/A | photo-responsive polymer |
| HEPES | Fisher Scientific | BP310-100 | |
| sodium dodecyl sulfate | Sigma-Aldrich | 436143 | |
| rubber gasket | McMaster-Carr | 3788T21 | 0.5 mL thick |
| UV laser | Excelitas Technologies | Omnicure S2000 | collimating lens and 365 nm filter used |
| agarose | Fisher Scientific | BP160-100 | |
| ethidium bromide | Fisher Scientific | BP1302-10 | |
| siRNA labelled with Dy547 | GE Healthcare Dharmacon, Inc. | custom order | fluorophore conjugated to 5’ end of sense strand |
| microscope slide | Fisher Scientific | 12-550-A3 | pre-cleaned glass |
| Secure-Seal Spacer | Life Technologies | S24735 | double-sided adhesive |
| LSM 780 | Carl Zeiss | N/A | confocal microscope |
| ZEN 2010 | Carl Zeiss | N/A | FCS analysis software |
| MATLAB | MathWorks | N/A | programming language |
| NIH/3T3 cells | ATCC | ATCC CRL-1658 | |
| DMEM | Mediatech | 10-013-CV | growth media |
| fetal bovine serum | Mediatech | 35-011-CV | heat-inactivated |
| penicillin-streptomycin | Mediatech | 30-002-CI | |
| 6-well plates | Fisher Scientific | 08-772-1B | |
| Opti-MEM | Life Technologies | 11058021 | transfection media |
Ссылки
- Forbes, D. C., Peppas, N. A. Oral delivery of small RNA and DNA. J Control Release. 162 (2), 438-445 (2012).
- Davis, M. E., et al. Evidence of RNAi in humans from systemically administered siRNA via targeted nanoparticles. Nature. 464 (7291), 1067-1070 (2010).
- Bouchie, A. Companies in footrace to deliver RNAi. Nat Biotechnol. 30 (12), 1154-1157 (2012).
- Burke, P. A., Pun, S. H., Reineke, T. M. Advancing Polymeric Delivery Systems Amidst a Nucleic Acid Therapy Renaissance. ACS Macro Lett. 2 (10), 928-934 (2013).
- Gooding, M., Browne, L. P., Quinteiro, F. M., Selwood, D. L. siRNA Delivery: From Lipids to Cell-penetrating Peptides and Their Mimics. Chem Biol Drug Des. 80 (6), 787-809 (2012).
- Motta-Mena, L. B., et al. An optogenetic gene expression system with rapid activation and deactivation kinetics. Nat Chem Biol. 10 (3), 196-202 (2014).
- Wang, X., Chen, X., Yang, Y. Spatiotemporal control of gene expression by a light-switchable transgene system. Nat Methods. 9 (3), 266-269 (2012).
- Ziauddin, J., Sabatini, D. M. Microarrays of cells expressing defined cDNAs. Nature. 411 (6833), 107-110 (2001).
- Saltzman, W. M., Olbricht, W. L. Building drug delivery into tissue engineering. Nat Rev Drug Discov. 1 (3), 177-186 (2002).
- Mura, S., Nicolas, J., Couvreur, P. Stimuli-responsive nanocarriers for drug delivery. Nat Mater. 12 (11), 991-1003 (2013).
- Shim, M. S., Kwon, Y. J. Stimuli-responsive polymers and nanomaterials for gene delivery and imaging applications. Adv Drug Delivery Rev. 64 (11), 1046-1058 (2012).
- Kelley, E. G., Albert, J. N. L., Sullivan, M. O., Epps, T. H. Stimuli-responsive copolymer solution and surface assemblies for biomedical applications. Chem Soc Rev. 42 (17), 7057-7071 (2013).
- Weber, W., Fussenegger, M. Emerging biomedical applications of synthetic biology. Nat Rev Genet. 13 (1), 21-35 (2012).
- Konermann, S., et al. Optical control of mammalian endogenous transcription and epigenetic states. Nature. 500 (7463), 472-476 (2013).
- Shimizu-Sato, S., Huq, E., Tepperman, J. M., Quail, P. H. A light-switchable gene promoter system. Nat Biotechnol. 20 (10), 1041-1044 (2002).
- Huschka, R., et al. Gene Silencing by Gold Nanoshell-Mediated Delivery and Laser-Triggered Release of Antisense Oligonucleotide and siRNA. ACS Nano. 6 (9), 7681-7691 (2012).
- Li, H. -. J., Wang, H. -. X., Sun, C. -. Y., Du, J. -. Z., Wang, J. Shell-detachable nanoparticles based on a light-responsive amphiphile for enhanced siRNA delivery. R Soc Chem Adv. 4 (4), 1961-1964 (2014).
- Braun, G. B., et al. Laser-Activated Gene Silencing via Gold Nanoshell-siRNA Conjugates. ACS Nano. 3 (7), 2007-2015 (2009).
- Gilleron, J., et al. Image-based analysis of lipid nanoparticle-mediated siRNA delivery, intracellular trafficking and endosomal escape. Nat Biotechnol. 31 (7), 638-646 (2013).
- Wittrup, A., et al. Visualizing lipid-formulated siRNA release from endosomes and target gene knockdown. Nat Biotechnol. 33 (8), 870-876 (2015).
- Roth, C. M. Quantitative measurements and rational materials design for intracellular delivery of oligonucleotides. Biotechnol Prog. 24 (1), 23-28 (2008).
- Mao, S., et al. Influence of polyethylene glycol chain length on the physicochemical and biological properties of poly(ethylene imine)-graft-poly(ethylene glycol) block copolymer/SiRNA polyplexes. Bioconjugate Chem. 17 (5), 1209-1218 (2006).
- Raab, R. M., Stephanopoulos, G. Dynamics of gene silencing by RNA interference. Biotechnol Bioeng. 88 (1), 121-132 (2004).
- Cuccato, G., et al. Modeling RNA interference in mammalian cells. BMC Systems Biology. 5, 1 (2011).
- Varga, C. M., Hong, K., Lauffenburger, D. A. Quantitative analysis of synthetic gene delivery vector design properties. Mol Ther. 4 (5), 438-446 (2001).
- Chen, H. H., et al. Quantitative comparison of intracellular unpacking kinetics of polyplexes by a model constructed from quantum Dot-FRET. Mol Ther. 16 (2), 324-332 (2008).
- Bartlett, D. W., Davis, M. E. Insights into the kinetics of siRNA-mediated gene silencing from live-cell and live-animal bioluminescent imaging. Nucleic Acids Res. 34 (1), 322-333 (2006).
- Foster, A. A., Greco, C. T., Green, M. D., Epps, T. H., Sullivan, M. O. Light-Mediated Activation of siRNA Release in Diblock Copolymer Assemblies for Controlled Gene Silencing. Adv Healthc Mater. 4 (5), 760-770 (2015).
- Greco, C. T., Epps, T. H., Sullivan, M. O. Mechanistic Design of Polymer Nanocarriers to Spatiotemporally Control Gene Silencing. ACS Biomater Sci Eng. 2 (9), 1582-1594 (2016).
- Green, M. D., et al. Catch and release: photocleavable cationic diblock copolymers as a potential platform for nucleic acid delivery. Polym Chem. 5 (19), 5535-5541 (2014).
- Lee, P. Y., Costumbrado, J., Hsu, C. Y., Kim, Y. H. Agarose Gel Electrophoresis for the Separation of DNA Fragments. J Vis Exp. (62), e3923 (2012).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nat Methods. 9 (7), 671-675 (2012).
- Marquer, C., Leveque-Fort, S., Potier, M. C. Determination of Lipid Raft Partitioning of Fluorescently-tagged Probes in Living Cells by Fluorescence Correlation Spectroscopy (FCS). J Vis Exp. (62), (2012).
- Staaf, E., Bagawath-Singh, S., Johansson, S. Molecular Diffusion in Plasma Membranes of Primary Lymphocytes Measured by Fluorescence Correlation Spectroscopy. J Vis Exp. (120), e54756 (2017).
- Buyens, K., et al. Monitoring the disassembly of siRNA polyplexes in serum is crucial for predicting their biological efficacy. J Control Release. 141 (1), 38-41 (2010).
- Eden, E., et al. Proteome Half-Life Dynamics in Living Human Cells. Science. 331 (6018), 764-768 (2011).
- Towbin, H., Staehelin, T., Gordon, J. Electrophoretic transfer of proteins from polyacrylamide gels to nitrocellulose sheets: procedure and some applications. Proc Natl Acad. Sci U S A. 76 (9), 4350-4354 (1979).
- Wittwer, C. T., Herrmann, M. G., Moss, A. A., Rasmussen, R. P. Continuous Fluorescence Monitoring of Rapid Cycle DNA Amplification. Biotechniques. 54 (6), 314-320 (2013).
- Cho, S. K., Dang, C., Wang, X., Ragan, R., Kwon, Y. J. Mixing-sequence-dependent nucleic acid complexation and gene transfer efficiency by polyethylenimine. Biomater Sci. 3 (7), 1124-1133 (2015).
- Liu, Y. M., Reineke, T. M. Poly(glycoamidoamine)s for gene delivery: Stability of polyplexes and efficacy with cardiomyoblast cells. Bioconjugate Chem. 17 (1), 101-108 (2006).
- Schwanhausser, B., et al. Global quantification of mammalian gene expression control. Nature. 473 (7347), 337-342 (2011).
- Greco, C. T., Muir, V. G., Epps, T. H., Sullivan, M. O. Efficient tuning of siRNA dose response by combining mixed polymer nanocarriers with simple kinetic modeling. Acta Biomater. 50, 407-416 (2017).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены