Method Article
Ломтик метод для анализа обучения индуцированная пластичности
В этой статье
Резюме
Ломтик метод является эффективным методом для анализа обучения индуцированная изменения внутренние свойства и пластичность возбуждающим или тормозящее синапсы.
Аннотация
Ломтик метод является мощным инструментом для изучения обучения индуцированная нейронных пластичности мозга конкретных регионов. Для анализа индуцированных пластичности мотор обучение, мы обучили крыс использованием ускоренной ротор стержень задачи. Крысы выполнил задачу 10 раз в 30-е интервалы для 1 или 2 дней. Производительность была значительно улучшена в учебные дни, по сравнению с первого судебного разбирательства. Затем мы подготовили острый мозга фрагменты первичной моторной коры (M1) в неквалифицированных и квалифицированных крыс. Ток зажим анализ показал динамические изменения в отдыхая мембранного потенциала, Спайк порог, afterhyperpolarization и сопротивление мембраны в слой II/III пирамидных нейронов. Текущих инъекций индуцированной много больше шипов в 2-дневный подготовленных крысы чем неподготовленные элементов управления.
Для анализа индуцированных пластичности контекстного обучения, мы обучили крыс с помощью задачи ингибирующее расторжения (IA). Пережив фут шок в темной стороне коробки, крысы научились избежать его, оставаясь на освещенной стороне. Мы подготовили острый гиппокампа фрагменты из необученных, IA-обучение, непарные и проходных крыс. Напряжение зажим анализ был использован для последовательно записи миниатюрные возбуждающих и тормозной постсинаптический токи (mEPSCs и mIPSCs) от же CA1 нейронов. Мы нашли различные средние амплитуды mEPSC и mIPSC в каждом CA1 нейронов, предполагая, что каждый нейрон имел различные постсинаптических сильные возбуждающих и тормозящий синапсы. Кроме того по сравнению с неподготовленных управления, IA-подготовленных крысы были выше mEPSC и mIPSC амплитуды, с широким разнообразием. Эти результаты свидетельствуют о том, что контекстного обучения создает постсинаптических разнообразия в возбуждающих и тормозящий синапсов в каждом CA1 нейронов.
АМПА или ГАМК-А рецепторов, казалось, посредником постсинаптических токов, поскольку лечебная ванна с CNQX или bicuculline заблокирован события mEPSC или mIPSC, соответственно. Этот метод может использоваться для изучения различных видов обучения в других регионах, таких как сенсорной коры и миндалины.
Введение
Метод, разработанный Неер и Сакман, широко использовался для электрофизиологических экспериментов1. Патч поклеточного зажим техника2 может использоваться для записи внутриклеточных тока или напряжения, с помощью gigaohm уплотнения клеточной мембраны. Ток зажим техника позволяет нам анализировать различия в мембраны свойств, таких как отдыхая потенциал, сопротивления и емкость3. Напряжение зажим техника позволяет нам анализировать обучения индуцированная синаптической пластичности в возбуждающих и тормозящий синапсы.
Первичной моторной коры (M1) является Центральный регион, что имеет решающее значение для принятия квалифицированных добровольных движений. Предыдущие электрофизиологические исследования продемонстрировали развития долгосрочных потенцирование (LTP)-как пластичность в слое, II/III возбуждающим синапсов после подготовки квалифицированных мотор4. Кроме того, в естественных условиях imaging дальнейшего исследования продемонстрировали Ремоделирование M1 дендритных шипиков после квалифицированных идущие задачи5,6. Однако обучения индуцированная синаптических и внутренней пластичностью не было показано в M1 нейронов.
Мы недавно сообщили, что задача стержня ротор способствуют динамичные изменения в глутаматергические и ГАМК синапсов и изменили внутреннюю пластичности в M1 уровня II/III нейронов7. Здесь мы использовали технику зажим патч срез расследовать обучения индуцированная пластичности. Этот метод может также использоваться для расследования других видов пластичности зависящих от опыта в других регионах мозга. Например сенсорного ввода в коре ствола может укрепить АМПА рецептор опосредованный возбуждающим ввода в слой II/III нейронов8, и снабженные страх принадлежности укрепляет возбуждающим входов на нейронах боковых миндалины, который необходим для страх памяти9. Кроме того контекстные обучения создает разнообразие с точки зрения возбуждающих и тормозящий синаптических вклад в СА1 гиппокампа нейронов10,11.
протокол
всех животных жилья и хирургических процедур были в соответствии с руководящими принципами для животных эксперименты из Ямагути школы медицины университета и были одобрены институциональный уход животных и использование Комитета Ямагути Университет.
1. Животные
- использовать 4 - до 5-недельных самцов крыс Sprague-Dawley (послеродовой 28 до 31 дней возраста).
- Дом крысы в отдельных клетках пластиковые (40 см × 25 × 25 см) поддерживается при постоянной температуре (23 ° C ± 1 ° C) в рамках цикла свет/темно 12-h. Дать крысы ad libitum доступ к воде и продовольствию.
2. Ротор стержень тест
- расследовать двигательных навыков, обучения, Тема каждый Крыса испытания стержень ротора (диаметр стержня 7 см, ширина полосы 8,9 см; Высота падения 26,7 см) для 1 или 2 дней подряд ( Рисунок 1A в Kida et al., 2016 < sup класс = «внешней» > 7). Выполните задачу в комнате тихо, контролем температуры (23 ° c ± 1 ° C). Не беспокоить или обрабатывать крысы до test.
- Установите ротор стержень ускорение режим, который увеличивает линейно от 4 вращ. / мин до 40 вращ. / мин (8 π/мин до 80 π/мин) в 5 мин.
- Крыса надел покоя вращающегося стержня. Убедитесь, что все конечности на штоке.
- Измерить задержку падать от вращающегося стержня для оценки производительности мотор.
- Позволяют каждый Крыса 10 попыток (испытания) с интервалом 30-х.
- Если крыса падает от вращающегося стержня, установите его на стержень снова после интервала s 10-20.
- Пожертвовать Крыса с передозировкой Пентобарбитал (400 мг/кг) 30 мин после окончательного судебного разбирательства. Придать неподготовленных управления крыс с той же дозе анестезии в их дома клетки.
3. Ингибирующее избежания тест
- для расследования контекстного обучения, тема крысы ингибирующее расторжения (IA) тест ( Рисунок 1 d в Mitsushima и соавт., 2011, 2013 10 , 11) во избежание любой эпизодические опытом в день эксперимента, таких как контакт с другими, Кейдж изменения или очистки. Выполнить задачу в комнате тихо, контролем температуры (23 ° c ± 1 ° C).
Примечание: Тренажеры IA-2-х камерная акриловая коробка (длина 33 см, ширина 58 см, высота 33 см). Она имеет освещенный безопасной сторону и сторону темной шок, разделенных Люк ( рис. 1 d). - Место крыса в безопасной (lit) стороне окна подсветкой. Обрабатывать крысы аккуратно без стресса.
- Ждать некоторое время (10-20 s) чтобы акклиматизироваться крыса в окружающую среду.
- Открыть раздвижные двери, чтобы позволить крыса ввести поле темно по желанию.
- Измерение задержки (s), прежде чем крысы входит Роман темной стороне коробки. Задержку первого судебного разбирательства представляет собой крыса ' с производительностью до подготовки.
- После вступления в темной стороне, закройте дверцу и ударное кинулись электрические фут (2 s, 1,6 мА) через электрические стальных стержней в пол коробки. Разрешить проходных крыс для изучения тренажеры для 1 мин не будучи потрясен. Дом непарных крыс в клетке освещенная шок для нескольких дней и вдруг дать шок без эпизодических опытом. Аккуратно обрабатывать без стресса в любых группах.
- Сохранить каждый Крыса в темной коробке 10 s перед его возвращением домой клетку.
- На 30 мин после шока ног, опять же место крысы на освещенной стороне коробки. Измерить задержку войти на темную сторону.
- Вернуться домой клетке крыса.
- На 60 мин после шока, пожертвовать крысиный с передозировкой Пентобарбитал (400 мг/кг). Аккуратно обрабатывать крыса и вставляют анестезии внутрибрюшинно. В неподготовленных управления крыс, придать анестезии в их дома клетки без опыта, описанных выше.
4. Рассечение буфера
- распустить кристаллы 0,195 g NaH 2 PO 4-2 H 2 O, 0,188 г KCl, 0,074 g CaCl 2, 1,423 g MgCl 2-6 H 2 O и 12.579 g холина хлорида в ультрачистая вода (900 мл до 950 мл) . Приведены в таблице 1.
- Кристаллы 2.340 г аскорбиновой кислоты, 0,342 g пировиноградной кислоты натриевая соль, 2.100 g NaHCO 3 и 4.500 г глюкозы растворить.
- Добавить воды до 1000 мл. Спектр осмотического давления будет между 290 мОсм/Л и 300 мОсм/л. Отрегулируйте осмотического давления, добавив ультрачистая вода, если она находится в диапазоне.
- Пузыря решение с 5% CO 2 / 95% O 2 газовой смеси на ледяной температурах для 5 минут перед использованием.
5. Искусственные спинномозговой жидкости (ФАГО)
- растворения кристаллов 0,186 г KCl, 6.700 г NaCl и PO 0,156 g NaH 2 4-2 H 2 O в ультрачистая вода (900 мл до 950 мл). Таблица 2.
- Пузырь с газовой смеси на 5 мин
- Растворить кристаллики 1.800 г глюкозы и 2,184 g NaHCO 3, а затем добавить 4 мл MgCl 2 и 4 мл CaCl 2 от 1 М складе решения.
- Добавить воды до 1000 мл. Спектр осмотического давления будет между 290 мОсм/Л и 295 мОсм/л. Отрегулируйте осмотического давления, добавив ультрачистая вода, если она находится в диапазоне.
- Пузырь с газовой смеси до использования.
6. Внутриклеточные решения
- для записи текущего зажим (таблица 3), растворяют 0.0746 г KCl, 6.089 g K-глюконат, 0.476 g HEPES, 0.0456 g EGTA и 500 мкл MgCl 2 от 1 М складе решение в 180 мл ультрачистая вода (регулировка рН 7,2 с Кох).
- Добавить 0.4408 g Na 2 - АТФ, Na 0.0418 g 3 - GTP и 0.510 g Na-Креатинфосфорная кислота. Добавьте воду в 200 мл и скорректировать рН до 7,35 с Кох.
- Отрегулируйте осмотического давления до около 290 мОсм/Л, добавив ультрачистая вода.
- Магазин в 1-мл аликвоты в морозильной камере (-30 ° C).
- Для записи мембраной (таблица 4), растворяют 5.244 г CsMeSO 3, 0.672 CsCl, 0.476 g HEPES, 0.0456 g EGTA и 500 мкл MgCl 2 от 1 М складе решения в 180 мл ультрачистая вода. Отрегулируйте пэ-аш до 7,2 с CsOH. Для mEPSP и mIPSP записи используйте изменение концентрации 5.814 g CsMeSO 3 и 0,252 g CsCl для регулировки разворота потенциал реагирования рецептор ГАМК A 11.
- Добавить 0.4408 g Na 2 - АТФ, Na 0.0418 g 3 - GTP и 0.510 g Na-Креатинфосфорная кислота. Добавьте воду в 200 мл и скорректировать рН до 7,35 с CsOH.
- Отрегулируйте осмотического давления до около 290 мОсм/Л, добавив ультрачистая вода.
- Магазин в 1-мл аликвоты в морозильной камере (-30 ° C).
7. Нарежьте подготовка
- предварительного жертву, охлаждение все инструменты диссекции с колотым льдом ( рисунок 2A). Добавьте около 500 мл холодной воды в контейнер дробленый лед для увеличения площади поверхности контакта. Эта процедура была описана ранее, 10 , , 11 12.
Примечание: Инструменты здесь являются: большие ножницы, Ирис ножницы, шпателем, микро шпателем, щипцы, пинцеты, стакан 200 мл из нержавеющей стали, лезвие для мозга, обрезки, сердечной перфузии 120 мл шприц, заполнены с буфером рассечение, относились с газовой смеси, силиконовые трубки (20 см) подключены к плоский 18-иглы, этап рассечение нержавеющей мозга (толщина = 3 мм, φ = 12 см) и этап монтажа для vibratome ( = 5 см). - Пожертвовать крысиный 30 мин после завершения поведенческая парадигма, обезболивающим с передозировкой Пентобарбитал (400 мг/кг веса тела). Выполните срез подготовку быстро для обеспечения того, чтобы срезы так здоров, как можно в 10 , , 11 12. Extr мозгапротокол действий отвечает всем ветеринарным стандартам для нашего университета.
- Заполнения, 120 мл шприца с ледяной рассечение буфера (таблица 1) кипела с 5% CO 2 / 95% O 2 газовые смеси. Удалить все пузырьки воздуха до перфузии.
- После разоблачения сердце, вставить иглу в задней части левого желудочка.
- Выполнения transcardial перфузии мозга вручную с помощью шприца. Крупных крыс требуют больше рассечение буфер для перфузии. Опускайте мозга с ледяной рассечение буфер для 5 минут пузырь буфера непрерывно во время погружения.
- Отделки задней части мозга в угол параллельно дендритных ориентации целевой корковых региона с помощью лезвия. Поскольку мозг стоять на сцене диссекции с разреза конец нижней, начальный угол определяет угол всех последующих мозга фрагментов. Этот шаг является критически важным ( рис. 2B). Неправильный угол может прорваться через целевой пирамидных нейронов.
Примечание: Инструменты здесь являются: лезвие для обрезки мозга, фильтровальная бумага (ϕ = 10 см), этап рассечение нержавеющей мозга (толщина = 3 мм, φ = 12 см), шпателем, суперклей, капельницы и стадии монтажа для vibratome ( = 5 см). - Вырезать 350 мкм ломтиками толщиной корональных мозга с помощью vibratome. Заливка, рассечение камеры с ледяной буфера кипела с 5% CO 2 / 95% O 2 газовой смеси ( рис. 2 c). Пузырь буфера непрерывно в течение срез мозга.
- Trim периферии целевой области с помощью ножниц Ирис.
- Мыть, подстриженные ломтики мягко в комнатной температуре фаго кипела с 5% CO 2 / 95% O 2 (таблица 2).
- Сохранение обрезанных ломтики в камеру интерфейс, пока запись не выполняется ( Рисунок 2D и E). Инкубации 1 h в камере улучшает состояние клетки, но если срезы инкубировали для более чем 10 часов изменить фенотипы. Закройте крышку камеры препроводить газы и малых жидких капель фаго.
8. Патч поклеточного зажим
Примечание: поклеточного записи требуют усилителя и низкочастотный фильтр, настроенный на частоту среза 5 кГц. Сигналы оцифровываются и хранятся в компьютере. Хранимые данные анализируются автономных ( рис. 3A).
- Создание стеклянных электродов с помощью горизонтальных съемник. Заполните электроды с подходящим решением (таблицы 3 и 4) с помощью регулярных полиэтилена 1 мл шприца прилагается к тонкой стеклянной трубки и 0,22 мкм фильтром.
- До контакта с ячейкой, поддерживать положительное давление и отрегулировать пипеткой текущего нулю.
- После формирования gigaohm печать, применять отрицательное давление разрыва мембраны клетки (поклеточного конфигурации в рисунке 3F).
9. Анализ текущих зажим
- Свойства клеточной мембраны
- заполнить патча записи пипетки с внутриклеточной решение для записи текущего зажим (таблица 3). Сопротивление пипетки находится между 4 MΩ и 7 MΩ в фаго.
- После разрывов мембраны, удерживая напряжение мембраны на -60 МВ в V-образный зажим режиме. Затем, перейти от " Ванна " режим " клеток " режим в тесте мембраны, используя программное обеспечение для измерения внутренние свойства ячеек как мембрана емкости, сопротивления и постоянная времени.
- Исследование инъекций
- после записи внутренние свойства ячеек, переключите режим от V-образный зажим трек (я = 0) /I-CLAMP нормальный для текущего инъекции. Обратите внимание, что потенциал жидкого соединения не должно быть исправлены 10.
- Вставки текущей в ячейку для 300 г-жа изменить интенсивность тока ступенчатой от − 100 Па Па + 550 с 50-Па увеличивается. Подсчитать количество шипов (потенциалы действия) с текущего инъекции.
- Измерение минимального напряжения, необходимо побудить потенциал действия (это пороговое напряжение).
- Вычисления амплитуды afterhyperpolarization как разница между Спайк посвящения и низкого напряжения, достигли во время afterhyperpolarization 7.
10. Анализ напряжения зажим
- АМПА/NMDA соотношение
Примечание: АМПА/NMDA соотношение является традиционным способом оценки постсинаптических пластичности на глутаматергические возбуждающим синапсы 7 , 8 , 9 , 10 , 11. Однако, обратите внимание, что соответствующее увеличение обоих компонентов не могут изменить соотношение 13.- Perfuse запись камеры с физиологическим раствором кипела с газовой смеси и поддержания температуры при 22 ° C до 25 ° C. добавить 0,1 мм picrotoxin в решение блокировать ГАМК A - опосредованной ответ и добавить 4 μm 2- chloroadenosine для стабилизации вызвала нейронных ответ 14.
- Заполнить патча записи пипетки с внутриклеточной решение для напряжения зажим записи (таблица 4). Проверьте сопротивление записи пипетку в фаго. Сопротивление находится между 4 MΩ и 7 MΩ.
- Для записи в слой II/III пирамидных нейронов в M1, место биполярный вольфрама стимулирования электрода 200 мкм до 300 мкм сбоку клетки, регистрироваться под поверхностью сетчаточных в регионе представительства передних конечностей (2-мм сбоку Срединная) 15 , , 16 17.
- Для записи в СА1 Пирамидальный нейрон, разместите стимулирующих электродов 200 мкм до 300 мкм боковых (Шаффер залога волокно) или медиальный (temporoammonic путь) клетки, которые будет записан ( рис. 3B).
- Увеличения интенсивности стимула до синаптических ответ > 10 Па
- Рассчитать коэффициент АМПА/NMDA как соотношение пиковый ток измеряется в − 60 МВ в текущий измеренный в 40 мВ на 150 мс после наступления стимул. Обратите внимание, что следы 50 до 100 следует усредняются для расчета соотношения.
- Миниатюрный постсинаптических текущей записи
Примечание: подуманы, что миниатюрный возбуждающих постсинаптических токов (mEPSCs) соответствуют ответы, вызвало в пресинаптическом выпуске один пузырек глутамата 18 . В отличие от этого миниатюрные тормозной постсинаптический токов (mIPSCs) считается соответствуют вызвал в пресинаптическом выпуске один пузырек ГАМК 18 ответов. Увеличение амплитуды mEPSCs и mIPSCs отражает постсинаптических передачи укрепления, при увеличении в случае частота отражают увеличение числа функциональных синапсов или вероятности Пресинаптический выпуска 11 .- Заполнить пипеткой записи патч модифицированных внутриклеточных раствором (таблица 4) для регулировки разворота потенциал ГАМК A рецептор опосредованный тока до -60 м.
- Добавить 0,5 мкм Тетродотоксин в ванну, чтобы блокировать спонтанное потенциалы действия.
- Удерживать напряжение на -60 мВ до record mEPSC события на 5 мин
- Изменения Холдинг потенциал 0 mV для записи mIPSC события на 5 мин. Потому что M1 нейронов показать немного выше разворота потенциал для АМПА рецептор опосредованный токов, mIPSCs М1 нейронов, отражаются на + 15 МВ с 0,1 мм APV.
- Ждать несколько минут для стабилизации тока.
- Запись события mIPSC для 5 минут
- Обнаружить миниатюра события, с помощью программного обеспечения и использовать события выше 10 ПА для анализа. Подсчитать количество событий mEPSCs или mIPSCs на 5 минут, чтобы определить частоту. Средние амплитуды событий для получения средняя амплитуда.
- Подтверждают ли лечебная ванна с 10 мкм CNQX или 10 мкм bicuculline methiodide блокирует события mEPSCs и mIPSCs, соответственно.
- Сопряженные импульсный анализ
Примечание: пресинаптической пластичности могут быть проанализированы с помощью анализа паре пульс. Увеличение в паре пульс предполагает снижение в пресинаптическом глутамата или ГАМК выпуска вероятность 7 , 10 , 11.- Для анализа возбуждающим синапсы, добавить 0,1 мм picrotoxin и записывать ответ на -60 МВ. Хотя мы добавили 4 мкм 2-chloroadenosine в ванну, нам нужно иметь в виду, что препарат влияет на вероятность Пресинаптический выпуска 14.
- Для анализа ингибирующее синапсы, добавить 0,1 мм APV и 4 мкм 2-chloroadenosine в ванну и записать ответ в 0 mV. В M1 нейронов, запишите ответ на + 15 М.в.
- Применить спаренными импульсами с интервалом между стимулом 100 мс или 200 г-жа
- Записи 50-100 последовательных следы на каждом Холдинг потенциал и среднее значения.
- Рассчитать коэффициент парных пульс как отношение второй пик на первый пик постсинаптических тока.
Результаты
Как мы недавно описал7, ротор стержень обучения (рис. 1A) индуцированной динамические изменения в внутренней пластичностью M1 уровня II/III пирамидных нейронов. Измерение задержки пока крысы падения от вращающегося стержня позволяет нам оценить производительность квалифицированный обучение крысы. Больше времени задержки показывает производительность двигателя. В день 1 обучения крысы улучшили свои показатели стержень ротора до окончания судебного разбирательства. На 2 день, крысы достиг почти асимптотическая уровнях в среднем сессии баллов (рис. 1B). По сравнению с задержкой на первом суде, пост hoc анализ показал значительное улучшение в окончательные испытания на учебных дней (рис. 1 c).
На рисунке 4A показывает пример анализа текущих зажим, в котором нейрональных свойства изменено после двигательных навыков обучения. Инъекции 400 ПА и 500 Па течений необходимо побудить потенциалы действия в группе неподготовленных и 1-дневный подготовленных крысы, соответственно. В отличие от инъекции только 150 Па текущего был достаточно, чтобы выявить потенциалы действия в 2-дневный подготовленных крысы. Отношения между текущей интенсивности и числа потенциалы действия показано на рисунке 4В. Как 50 Па текущего было достаточно, чтобы выявить пики в 2-дневный подготовленных крысы; в отличие от 1-дневный подготовленных крысы ответил с меньшим количеством потенциалы действия, чем неподготовленные крыс на 350 Па и выше течений. Кроме того, Рисунок 4 c показывает, что 1-дневный подготовленных крысы показал Нижняя отдыхая потенциал, выше Спайк порог и глубже afterhyperpolarization, в то время как 2-дневный подготовленных крысы показал высокий потенциал покоя (рис. 4 c) и (сопротивление мембраны Рисунок 4 d).
Как было описано ранее11, IA обучение (рис. 1 d) индуцированной постсинаптических пластичности в возбуждающих и тормозящий синапсах нейронов СА1 гиппокампа. При измерении задержки в поле света, мы могли бы оценить производительность контекстного обучения крысы. 1E рисунок показывает результаты IA задачи. После парных электрическим током крысы научиться избегать темной стороне коробки и остаться в стороне освещенной, который обычно не предпочли бы. Тенденция избегать темная сторона поэтому указывает на приобретение контекстуальные воспоминания.
На рисунке 5 показан пример анализа напряжения зажим, в котором миниатюрные постсинаптических токи были резко изменилась после контекстного обучения. Расследовать обучения индуцированная пластичности, спонтанное AMPA-опосредованной mEPSCs и ГАМКA-опосредованной mIPSCs последовательно были записаны в присутствии 0,5 мкм Тетродотоксин (Рисунок 5A и B). Как показано на двумерной участках (рис. 5 c), каждый нейрон СА1 имел различные средние амплитуды для mEPSCs и mIPSCs. Хотя амплитуд были низкими и показал узкого ареала в неподготовленным, непарные, и проходных крыс, были различными в IA-подготовленных крысы (таблица 5). ANOVA, следуют пост hoc анализ показал значительное увеличение средней амплитуды mEPSC и mIPSC в IA-подготовленных крысы (Рисунок 5E), предлагая обучения индуцированная постсинаптических пластичности в CA1 нейронов.
Кроме того каждый нейрон СА1 выставлены различные частоты mEPSC и mIPSC (рис. 5 d). Хотя частоты были низкими и показал узкого ареала в неподготовленным, непарные, и проходных крыс, были различными в IA-подготовленных крысы (таблица 6). ANOVA, следуют пост hoc анализ показал значительное увеличение частоты mEPSC и mIPSC событий в IA-подготовленных крысы (Рисунок 5F). Существует два возможных толкования этих результатов. Во-первых, что контекстного обучения увеличилось количество функциональных синапсах нейронов. Другой является, что контекстного обучения увеличилась вероятность Пресинаптический релиз глутамата и ГАМК.
Для дальнейшего изучения пресинаптической пластичности, мы также провели паре импульса стимуляции, как сообщалось ранее,10,11.
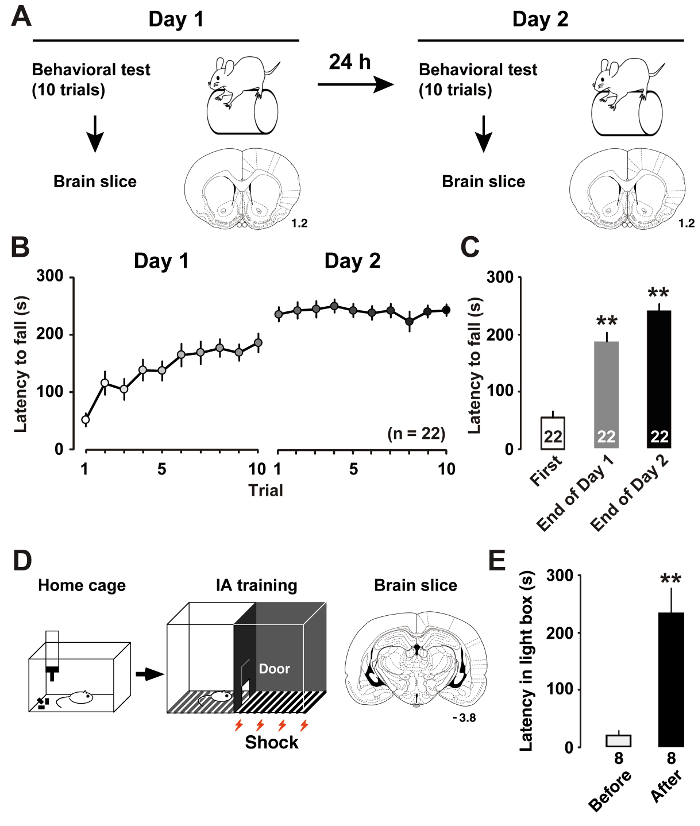
Рисунок 1 : Изучение производительности после тренировки.
A: экспериментальный дизайн показывает ротора стержень обучения и ломтик корональных мозга. B: средняя задержка падать от ускорения баррель стержень ротора. C: средняя задержка чтобы упасть стержня на первом и окончательные испытания на обучение7дней 1 и 2. P< 0,01 против первого судебного разбирательства. D: схема тормозной расторжения (IA) задачи и корональный мозга фрагмента. E: средняя задержка вступить в темное поле до и после подготовки IA11. P< 0,01 против до IA обучения. Номера корональных секции указывают расстояние впереди bregma в мм. Количество животных показано в нижней части панели. Планки погрешностей указывают SEM. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
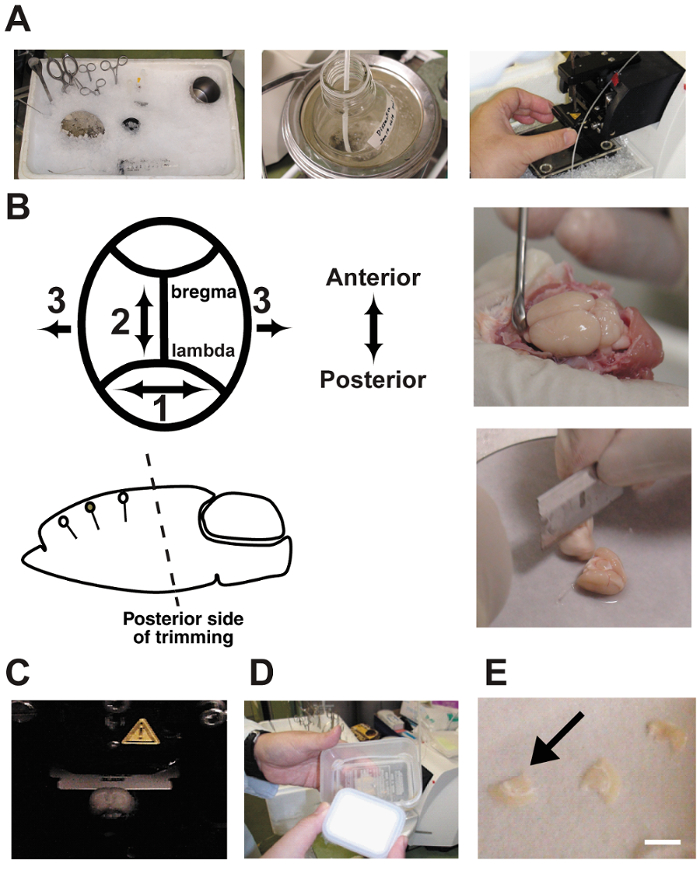
Рисунок 2 : Ломтик процедур.
A: фотографии показывают подготовка фрагментов острого мозга. Рассечение инструменты были охлаждается в колотым льдом до использования. B: мозг диссекции и обрезки. Обратите внимание, что угол обрезки на задней стороне должны быть ориентированы параллельно с дендритных ориентации. C: нарезка мозга в vibratome камере. Мозг купается в буфере диссекции и постоянно кипела с 5% CO2/95% O2 газовой смеси. D: интерфейс камеры изготовлены из двух пластиковых пищевых контейнеров и силиконовые трубки. Палата была заполнены с искусственным Ликвора и постоянно кипела с газовой смеси. E: срезы мозга были помещены на мокрой бумаге фильтр в камере.Бар = 5 mm. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
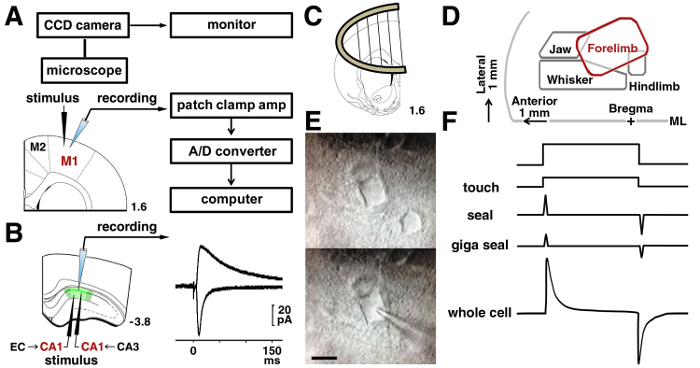
Рисунок 3 : Патч зажим процедуры.
A: патч зажим система, используемая для записи электрические сигналы от нейрона. Расположение стимулирования и записи электродов в слой нейронов II/III показаны в крыса моторной коры. B: для анализа Шаффер синапсы СА1 Пирамидальный нейрон, стимулирующих электродов был помещен в radiatum слой. Чтобы проанализировать temporoammonic синапсов, стимулирующих электродов был помещен в слое stratum moleculare. Представитель следы вызвала АМПА и показаны NMDA рецептор опосредованный возбуждающих постсинаптических течений в том же CA1 нейронов. C: ломтик якорь был использован для стабилизации среза в записи камеры. D: представление карты в моторной коры, на основе документов, опубликованных15,16,17. МЛ = срединной линии. E: IR-DIC микроскопии M1 слоя нейронов II/III до (верхняя) и во время записи (ниже). Бар = 10 мкм. F: изменения в пипетку, ток до касания (сверху) и в плодного (внизу). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
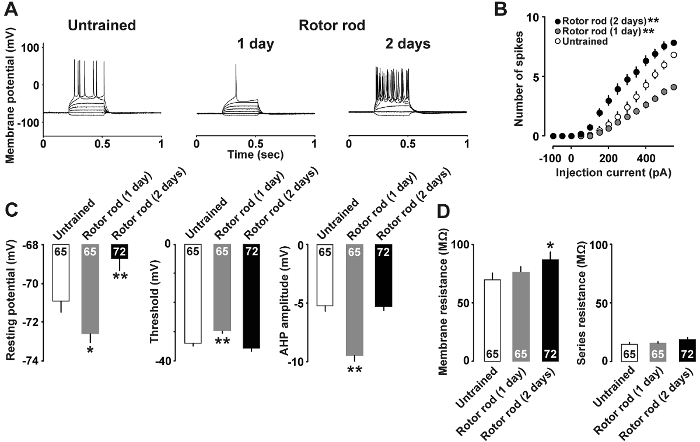
Рисунок 4 : Представитель результаты анализа текущих зажим7 .
A: представитель следы действий потенциалов записанный после индукции с текущего инъекции. B: отношения между означает текущий вход (ПА) против вывода (количество шипов) потенциал действия в срезах головного мозга от неподготовленных (открытый бар), 1-дневный подготовленных (серый баров) и 2-дневный подготовленных крысы (заполненных баров). C: отдыхая потенциал, порог и afterhyperpolarization слоя нейронов II/III. D: мембраны сопротивлению и серии нейронов. Мы использовали 9-10 крыс в каждой группе. В каждом баре показано количество клеток. Планки погрешностей указывают SEM. *P< 0,05, **P< 0,01 против неподготовленным. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
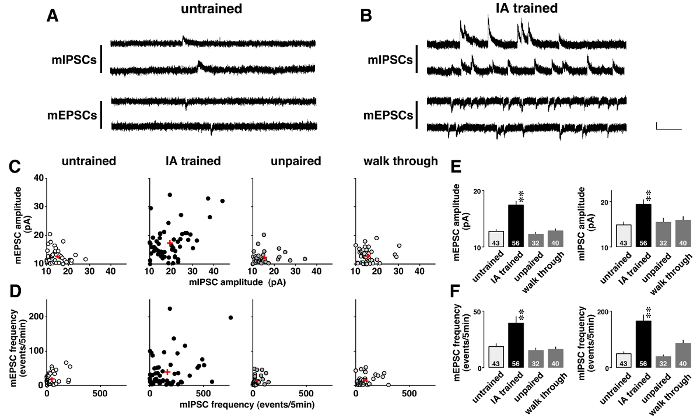
Рисунок 5 : Представитель результаты анализа напряжения зажим11 .
Представитель следы миниатюрные возбуждающих и тормозной постсинаптический токов (mEPSCs и mIPSCs) в неподготовленные (A) и тормозящий избежания (IA)-подготовленных крысы (B). mEPSCs-60 МВ и mIPSCs на 0 mV были измерены последовательно в том же СА1 Пирамидальный нейрон в присутствии Тетродотоксин (0,5 мкм). Вертикальная черта = 20 Па, турник = 200 мсек. C: двумерные участков среднего меня, (I) PSC амплитуд в неподготовленным, IA-обучение, непарные и проходных крыс. D: двумерные участков mE (I) PSC частоты в 4 группах. Обратите внимание, что каждый нейрон СА1 выставлены различные означает меня, (I) PSC амплитуды и частоты. IA обучение не только укрепить среднее амплитуд (E), но также увеличение частоты mE (I) PSC события (F). Мы использовали 4-6 крыс в каждой группе. Количество ячеек отображается в нижней части панели. Красные знаки плюс (C, D) и бары с вертикальными линиями (E, F) указывают среднее ± SEM. **P< 0,01 против неподготовленным крыс. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
| Рассечение буфера (всего 1 Л) | ||
| NaH2PO4 • 2 H2O | 0,195 г | 1,25 ммоль/Л |
| KCl | 0,188 г | 2,5 ммоль/Л |
| CaCl2 | 0,074 g | 0.5 ммоль/Л |
| MgCl2 • 6 H2O | 1,423 g | 7,0 ммоль/Л |
| Холина хлорид | 12.579 g | 90 ммоль/Л |
| Аскорбиновая кислота | 2.340 g | 11.6 ммоль/Л |
| Пировиноградная кислота | 0,342 g | 3.1 ммоль/Л |
| NaHCO3 | 2.100 g | 25 ммоль/Л |
| Глюкоза | 4.500 g | 25 ммоль/Л |
Таблица 1: Рецепт для рассечения буфера
| Искусственные CSF (всего 1 Л) | ||
| KCl | 0,186 g | 2,5 ммоль/Л |
| NaCl | 6.700 g | 114.6 ммоль/Л |
| NaH2PO4 •2H2O | 0,156 г | 1 ммоль/Л |
| Глюкоза | 1.800 g | 10 ммоль/Л |
| NaHCO3 | 2,184 g | 26 ммоль/Л |
| 1 М MgCl2 | 4 мл | 4 ммоль/Л |
| 1 М CaCl2 | 4 мл | 4 ммоль/Л |
Таблица 2: Рецепт для искусственного спинномозговой жидкости (CSF)
| Внутриклеточные решение для текущего зажим (всего 200 мл) | ||
| KCl | 0.0746 g | 5 ммоль/Л |
| K-глюконат | 6.089 g | 130 ммоль/Л |
| HEPES | 0.476 g | 10 ммоль/Л |
| EGTA | 0.0456 g | 0,6 ммоль/Л |
| 1 М MgCl2 | 500 МКЛ | 2,5 ммоль/Л |
| Na2 ATP | 0.4408 g | 4 ммоль/Л |
| Na3 GTP | 0.0418 g | 0.4 ммоль/Л |
| Креатинфосфорная кислота Na | 0.510 g | 10 ммоль/Л |
Таблица 3: Рецепт для внутриклеточного решения для текущего зажим запись
| Внутриклеточные решение для мембраной (всего 200 мл) | ||||
| CsMeSO3 | 5 | |||
Таблица 4: Рецепт для внутриклеточного решения для мембраной запись
| Параметры | неподготовленные | IA обучение | непарные | Прогулка по | |
| амплитуда mEPSC | Дисперсия | 5.8 | 32,1 | 4.7 | 5.9 |
| Стандартное отклонение | 2.4 | 5.7 | 2.2 | 2.4 | |
| Коэффициент вариации | 0,189 | 0.326 | 0,177 | 0.190 | |
| амплитуда mIPSC | Дисперсия | 17.1 | 56,7 | 31,8 | 20,7 |
| Стандартное отклонение | 4.1 | 7.5 | 5.6 | 4.5 | |
| Коэффициент вариации | 0,279 | 0,387 | 0,367 | 0.286 |
Таблица 5: Разнообразие амплитуд миниатюрные возбуждающих и тормозящий постсинаптических текущей (mEPSC и mIPSC) во избежание тормозной (IA)-обучение крыс
| Параметры | неподготовленные | IA обучение | непарные | Прогулка по | |
| mEPSC частота | Дисперсия | 278 | 2195 | 188 | 195 |
| Стандартное отклонение | 17 | 47 | 14 | 14 | |
| Коэффициент вариации | 0.902 | 1.198 | 0.893 | 0.874 | |
| mIPSC частота | Дисперсия | 3282 | 27212 | 1385 | 5135 |
| Стандартное отклонение | 57 | 165 | 37 | 72 | |
| Коэффициент вариации | 1,195 | 1.006 | 0.955 | 0.836 |
Таблица 6: Разнообразие миниатюрные возбуждающих и тормозящий постсинаптических текущего (mEPSC и mIPSC) частоты в ингибирующее расторжения (IA)-обучение крыс
Обсуждение
Основным ограничением ломтик метод — запись в подготовке срез, который могут не отражать то, что происходит в естественных условиях. Хотя в естественных условиях ток зажим анализ является более надежным, это технически сложно получить достаточных данных от сознательных животных. Поскольку каждый Пирамидальный нейрон имеет различные свойства сотовой, достаточное количество клеток необходимо должным образом проанализировать различия в нейронах после тренировки. Кроме того анализ напряжения зажим требует непрерывной медикаментозное лечение с CNQX, АПВ или bicuculline, чтобы определить характер постсинаптической реакции. Чтобы проанализировать ответы миниатюрные, вызванных один пузырек глутамата или ГАМК, непрерывного лечения с Тетродотоксин необходимо блокировать спонтанное потенциалы действия. Хотя недавно разработанная методика визуализации мульти фотон является мощным для анализа морфологических изменений возбуждающим синапсы19, комбинированные патч зажим техника необходима для анализа функции синапсов в естественных условиях. В настоящее время довольно трудно анализировать морфологические изменения в тормозные синапсы, поскольку наиболее ингибирующее синапсы не образуют колючки. В настоящее время фиксации срез будет наиболее подходящий метод для анализа свойств ячейки или функции возбуждающим/тормозной синапсов в дрессированных животных.
С помощью анализа текущих зажим (рис. 4), мы недавно сообщили Мотор обучения индуцированная встроенные пластичность нейронов слоя II/III. В частности 1-дневный подготовленных крысы показали значительное снижение отдыха мембранного потенциала и увеличение порога Спайк. 2-дневный подготовленных крысы показали значительное увеличение в отдыхая потенциал мембраны, что привело к повышенной возбудимостью. Эти результаты предложил, что динамические изменения в внутренней пластичностью M1 слоя нейронов II/III в подготовленных крысы. Дополнительные напряжения зажим анализ показал увеличение соотношения в паре пульс в 1-дневный подготовленных крысы, предполагая, что существует преходящее снижение в пресинаптическом ГАМК релиз вероятность7. Поэтому вполне возможно что расторможенность от ГАМК на уровне синапсов II/III может вызвать результате обучения индуцированная пластичности в M1. В поддержку этого фрагмента подготовка M1 требует лечебная ванна с блокатор рецепторов ГАМКA побудить LTP20.
Анализ миниатюрные постсинаптических потенциалов является мощным средством для выявления синаптической пластичности в IA-обучение животных. Последовательная запись mEPSCs и mIPSCs в одном CA1 нейронов позволяет анализ синаптических возбуждающим/тормозной силы каждого индивидуального нейрона. Начиная с одного меня, (I) PSC ответ приписывается один пузырек глутамата или ГАМК, увеличение в mE (I) PSC амплитуды предлагает постсинаптических укрепления. Используя меня, (I) анализ PSC, мы нашли индивидуальные различия в силе возбуждающим/тормозной вклад в каждый CA1 нейронов (рис. 5 c). IA подготовки явно способствует разнообразие в синаптической силы, но это было не наблюдается в других группах (таблица 5).
Обучения индуцированная синаптических разнообразия могут быть проанализированы математически. Путем расчета вероятности внешний вид каждой точки, данные из каждого нейрона могут быть преобразованы в self энтропия (бит) с использованием теории информации Клод Шеннон21. Точка с высоким появление вероятности (вокруг среднего уровня) указывает низкий self энтропия, а точка с очень редко вероятности (наклонно точка) высоким self энтропия. По сравнению с неподготовленных крыс, self энтропия в нейрон был явно увеличился в IA-подготовленных крысы, но не в непарные или проходных крыс22. Этот анализ свидетельствует о том, что там было увеличение в интра СА1 информации после контекстного обучения.
Ломтик метод может также использоваться для снабженные страх кондиционирования исследований в боковых миндалины9 и чувственного опыта исследований в коре ствола8. Кроме того этот метод может использоваться с различными другими методами для дальнейшего расследования. Например, вирус опосредованной Зеленый флуоресцентный белок (ГПУП)-тегами гена доставки техники могут быть объединены с техникой зажим патч для анализа функции конкретных молекул. Кроме того фокуса микроинъекции трассирующими Ретроградная может использоваться для визуализации определенных нейронов этот проект в определенной области. Затем используя технику ток зажим, клетки специфические свойства могут быть проанализированы в визуализированных нейронов23. Кроме того объединение двух Фотон лазерной сканирующей микроскопии с двух фотона лазерного uncaging глутамата был использован для демонстрации роста позвоночника конкретного и EPSC ответ в мыши кортикального слоя пирамидальных нейронов II/III19. Таким образом объединив его с Роман химикаты, Джин доставки и методов манипуляции фото совершенствуется ломтик метод.
Раскрытие информации
Авторы заявляют отсутствие конфликта интересов. Мы подтверждаем, что мы читали журнал позицию по вопросам, касающимся этических публикации, и мы заявляем, что этот доклад в соответствии с этими руководящими принципами. Спонсоры имел никакой роли в дизайн исследования, сбор данных, анализ, решение опубликовать или подготовка рукописи.
Благодарности
Мы хотели бы поблагодарить доктора лапы-мин-Тхейн-Oo, д -р Хан-Thiri-Цзынь и миссис H. Tsurutani за их технической помощи. Этот проект был поддержан дотаций для молодых ученых (Х.К. и я.с.), B д.м научных исследований (.), C д.м научных исследований (.) и научных исследований в инновационных областях (д.м.), от министерства образования, культуры, спорта, науки, и Технологии из Японии.
Материалы
| Name | Company | Catalog Number | Comments |
| Rota-Rod Treadmills | Med Associates Inc. | ENV577 | |
| inhibitory avoidance box | Shinano Seisakusho | ||
| Pentobarbital | Kyoritsu Seiyaku | ||
| Blade | Nisshin EM Co., Ltd | LC05Z | |
| Cardiac perfusion syringe | JMS Co., Ltd | JS-S00S | |
| Vibratome | Leica Microsystems | VT-1200 | |
| Horizontal puller | Sutter Instrument | Model P97 | |
| Microfilm 34 gauge | World Precision Instruments, Inc | MF34G-5 | |
| 0.22 µm filter | Millipore | SLGVR04NL | |
| Axopatch–1D amplifier | Axon Instruments | ||
| Digidata 1440 AD board | Axon Instruments | ||
| pCLAMP 10 software | Axon Instruments | ||
| Upright Microscope | Olympus | BX51WI | |
| CCD camera | Olympus | U-CMAD3 | |
| Camera controller | Hamamatsu Photonics K.K. | C2741 | |
| Stimulator | Nihon Kohden | SEN-3301 | |
| Isolator | Nihon Kohden | SS-104J | |
| Motorized manipulator | Sutter Instrument | MP-285 | |
| Micromanipulator | Narishige | NMN-21 | |
| Peristaltic Pump | Gilson, Inc | MINIPULS® 3 | |
| Glass capillary | Narishige | GD-1.5 | |
| Ag/AgCl electrode | World Precision Instruments, Inc | EP4 | |
| Slice Anchor | Warner instruments | 64-0252 | |
| Stimulus electrode | Unique Medical Co., Ltd | KU201-025B | |
| Materials | Company | Catalog Number | Comments |
| Dissection buffer/ artificial CSF | |||
| NaH2PO4 • 2H2O | Sigma-Aldrich Co. | C1426 | |
| KCl | Wako Pure Chemical Industries | 163-03545 | |
| CaCl2 | Wako Pure Chemical Industries | 039-00475 | |
| MgCl2 • 6H2O | Wako Pure Chemical Industries | 135-00165 | |
| Choline chloride | Sigma-Aldrich Co. | C7527 | |
| Ascorbic acid | Wako Pure Chemical Industries | 190-01255 | |
| Pyruvic acid Na | Wako Pure Chemical Industries | 199-03062 | |
| NaHCO3 | Sigma-Aldrich Co. | 28-1850-5 | |
| Glucose | Sigma-Aldrich Co. | 07-0680-5 | |
| Materials | Company | Catalog Number | Comments |
| Intracellular solution | |||
| K-Gluconate | Sigma-Aldrich Co. | G4500 | |
| HEPES | Wako Pure Chemical Industries | 346-01373 | |
| EGTA | Wako Pure Chemical Industries | 348-01311 | |
| Na2 ATP | Nacalai Tesque | 01072-24 | |
| Na3 GTP | Sigma-Aldrich Co. | G-8877 | |
| Na phosphocreatine | Sigma-Aldrich Co. | P-7936 | |
| CsMeSO3 | Sigma-Aldrich Co. | C1426 | |
| CsCl | Wako Pure Chemical Industries | 033-01953 | |
| Materials | Company | Catalog Number | Comments |
| Drugs in aCSF | |||
| 2-Chloroadenosine | Sigma-Aldrich Co. | C5134 | |
| Picrotoxin | Sigma-Aldrich Co. | P-1675 | |
| Tetrodotoxin | Wako Pure Chemical Industries | 207-15901 | |
| CNQX | Sigma-Aldrich Co. | C239 | |
| APV | Sigma-Aldrich Co. | A5282 |
Ссылки
- Neher, E., Sakmann, B. Single-channel currents recorded from membrane of denervated frog muscle fibres. Nature. 260 (5554), 799-802 (1976).
- Hamill, O. P., Marty, A., Neher, E., Sakmann, B., Sigworth, F. J. Improved patch-clamp techniques for high-resolution current recording from cells and cell-free membrane patches. Pflugers Arch. 391 (2), 85-100 (1981).
- Edwards, F. A., Konnerth, A., Sakmann, B., Takahashi, T. A thin slice preparation for patch clamp recordings from neurones of the mammalian central nervous system. Pflugers Arch. 414 (5), 600-612 (1989).
- Rioult-Pedotti, M. S., Friedman, D., Donoghue, J. P. . Learning-induced LTP in neocortex. Science. 290 (5491), 533-536 (2000).
- Yang, G., Pan, F., Gan, W. B. Stably maintained dendritic spines are associated with lifelong memories. Nature. 462 (7275), 920-924 (2009).
- Xu, T., et al. Rapid formation and selective stabilization of synapses for enduring motor memories. Nature. 462 (7275), 915-919 (2009).
- Kida, H., et al. Motor Training Promotes Both Synaptic and Intrinsic Plasticity of Layer II/III. Pyramidal Neurons in the Primary Motor Cortex. Cereb Cortex. 26 (8), 3494-3507 (2016).
- Takahashi, T., Svoboda, K., Malinow, R. Experience strengthening transmission by driving AMPA receptors into synapses. Science. 299 (5612), 1585-1588 (2003).
- Rumpel, S., LeDoux, J., Zador, A., Malinow, R. Postsynaptic receptor trafficking underlying a form of associative learning. Science. 308 (5718), 83-88 (2005).
- Mitsushima, D., Ishihara, K., Sano, A., Kessels, H. W., Takahashi, T. Contextual learning requires synaptic AMPA receptor delivery in the hippocampus. Proc Natl Acad Sci U S A. 108 (30), 12503-12508 (2011).
- Mitsushima, D., Sano, A., Takahashi, T. A cholinergic trigger drives learning-induced plasticity at hippocampal synapses. Nat Commun. 4, 2760 (2013).
- Kida, H., Mitsushima, D. Patch Clamp Technique in Brain Slices: Recording of Neuronal Activity in the Rat Primary Motor Cortex. Yamaguchi Medical Journal. 63, (2014).
- Watt, A. J., van Rossum, M. C., MacLeod, K. M., Nelson, S. B., Turrigiano, G. G. Activity coregulates quantal AMPA and NMDA currents at neocortical synapses. Neuron. 26 (3), 659-670 (2000).
- Baidan, L. V., Zholos, A. V., Wood, J. D. Modulation of calcium currents by G-proteins and adenosine receptors in myenteric neurones cultured from adult guinea-pig small intestine. Br J Pharmacol. 116 (2), 1882-1886 (1995).
- Tandon, S., Kambi, N., Jain, N. Overlapping representations of the neck and whiskers in the rat motor cortex revealed by mapping at different anaesthetic depths. Eur J Neurosci. 27 (1), 228-237 (2008).
- Adachi, K., Murray, G. M., Lee, J. C., Sessle, B. J. Noxious lingual stimulation influences the excitability of the face primary motor cerebral cortex (face MI) in the rat. J Neurophysiol. 100 (3), 1234-1244 (2008).
- Tennant, K. A., et al. The organization of the forelimb representation of the C57BL/6 mouse motor cortex as defined by intracortical microstimulation and cytoarchitecture. Cereb Cortex. 21 (4), 865-876 (2011).
- Pinheiro, P. S., Mulle, C. Presynaptic glutamate receptors: physiological functions and mechanisms of action. Nat Rev Neurosci. 9 (6), 423-436 (2008).
- Kwon, H. B., Sabatini, B. L. Glutamate induces de novo growth of functional spines in developing cortex. Nature. 474 (7349), 100-104 (2011).
- Hess, G., Donoghue, J. P. Long-term potentiation of horizontal connections provides a mechanism to reorganize cortical motor maps. J Neurophysiol. 71 (6), 2543-2547 (1994).
- Shannon, C. E. A mathematical theory of communication. Bell Sys Tech J. 27, (1948).
- Ono, K. M., D, Learning creates diversity of excitatory and inhibitory synapses in the hippocampal CA1: a possible amount of information at a single synapse. J Physiol Sci. 67, (2017).
- Wang, L., Conner, J. M., Rickert, J., Tuszynski, M. H. Structural plasticity within highly specific neuronal populations identifies a unique parcellation of motor learning in the adult brain. Proc Natl Acad Sci U S A. 108 (6), 2545-2550 (2011).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены