Method Article
Процедура и ключей оптимизации стратегии для автоматизированной капиллярного электрофореза на основе иммуноферментного анализа метода
В этой статье
Резюме
Проявляется на основе капиллярно иммуноферментного анализа, используя торговую платформу для измерения белков-мишеней от подготовки общего белка. Кроме того параметры анализа времени экспозиции, концентрацию протеина и антитела разрежения оптимизированы для системы модель культуры клеток.
Аннотация
Новые технологии, которые используют на основе капиллярно иммуноанализа обещают быстрее и более качественных белков оценки по сравнению с традиционными иммуноанализа. Однако подобно других анализов на основе антител белка, оптимизация на основе капиллярно иммуноферментного анализа параметров, таких как концентрацию белка, разбавления антитела и время воздействия является важной предпосылкой к поколению значимой и надежной данных. Измерения должны находиться в линейный диапазон assay где изменения сигнала прямо пропорциональна изменения в lysate концентрации. Процесс выбора соответствующей lysate концентрации, разбавления антитела и воздействия раз в строке эпителиальных клеток человека бронхов, Беас 2B, показано здесь. Линейность пробирного показано в диапазоне концентраций клеточных экстракт белка p53 и α-тубулина антителами. Пример сигнала выгорания рассматривается в высоких концентрациях с длительным воздействием раз, и кривая α-тубулина разбавления антитела показано, демонстрируя насыщения. Кроме того экспериментальные результаты примера сообщается доксорубицин лечение клеток, используя оптимизированные параметры.
Введение
Капиллярного электрофореза иммуноанализа мера выражения протеина в lysates клетки с использованием систем разделения размер или заряда и обеспечивает ряд преимуществ перед традиционными иммуноанализа. Например по сравнению с западной помарки, автоматизированные процедуры, основанной на капиллярной устраняет необходимость для гелей, устройства передачи, и ручной смывки. Кроме того абсолютное количество белка требуется меньше примерно 10 раз, что делает систем на базе капиллярного идеально подходит для использования с типы клеток редких или ограниченных образца1,2. Результаты, полученные в качестве лишь 3 h, с использованием автоматизированных систем и ранее были продемонстрированы более количественный и воспроизводимые чем обычные западной помарки процедуры3,4,5. Процесс для анализов на основе размера состоит из загрузки образцов, содержащих лаурилсульфат натрия (SDS), Дитиотреитол (DTT) и дневно помечены маркерами молекулярный вес в капиллярной колонки, содержащие укладка и разделение матрицы. Напряжение тока приложенное к капиллярам отделяет протеины в образцах по размерам, и УФ света обездвиживает разлученных белков в стенке капилляров. Капилляр затем иммуно исследован с целевой объект специфического основного антитела и хрен пероксидазы (ПХ)-конъюгированных вторичное антитело. Люминол и пероксид катализировать хемилюминесцентный света поколения, которое измеряется камеру спаренных устройств (CCD) заряда и проанализированы, чтобы quantitate белка.
Несмотря на относительную простоту и скорость автоматизированной на основе капиллярного электрофореза иммуноанализа платформы оптимизация условий пробирного концентрацию белка, разбавления антитела и время воздействия имеет важное значение для получения точных, воспроизводимые результаты. В целом следует выполнить следующие процедуры, чтобы оптимизировать assay для этих систем:
1) оценить и выбрать антитела для сигнала и специфичность белка цели должно выполняться экран. Если возможно, очищенный протеин или целевой epitope может использоваться для оценки специфики; Однако все еще важно для оценки потенциальных неспецифичный сигнал в общий белок, получены из модели системы.
2) далее динамический диапазон assay необходимо определить. В идеальной ситуации сигнал удвоение (измеряется с помощью площади пика) наблюдается как образец концентрация удваивается; Однако на практике, пропорционального изменения сигнала для ввода на предсказуемой основе (например, линейные подходят) является достаточным для количественного определения белка. Кроме того эта оптимизация будет определять концентрацию белка с высоким сигнала, но все еще в пределах диапазона линейной для экспериментальной модели.
3) Определите оптимальный антитела концентрации с использованием фиксированной белка концентрации, выбранного в шаге 2 оптимизации. С увеличением концентрации антитела, сигнал увеличивается до тех пор, пока она плато на насыщенность. Концентрация антител вблизи этот уровень насыщенности необходим для точного измерения концентрации протеина.
Процесс, используемый для оптимизации концентрации белка, разбавления антитела и времени экспозиции для автоматизированной базе капиллярного размер пробирного6 показана с помощью клеточных экстрактов, изолированы от Беас 2B, SV-40 превратил человека бронхов линия эпителиальных клеток. Белка изоляции от выдержек клетки или ткани могут быть выполнены с использованием ряда опубликованных протоколов7,8,9 и не будут покрыты здесь. Результаты пробной эксперимент, используя оптимизированные условия также сообщила, в общей и фосфорилированных (сериновые 15, серина 20) p53 в культурах подвергаются доксорубицин (общий химиотерапевтического агента, который индуцирует апоптоз клеток10) на 1.2, 1.8, и 2.4 мкг/мл СМИ за 4 ч до сбора урожая. P53 пик районах нормализуются к ɑ-тубулина, который используется как элемент управления загрузки.
протокол
Примечание: Убедитесь, что все реагенты и образцы готовятся согласно данным производителя ' протокол s, изложенные ниже. Пожалуйста, носите надлежащей личной защиты оборудования во время этой процедуры, которая включает в себя нитриловые перчатки, лабораторный халат, закрытыми носком туфли и защитные очки. Отдельно приводится таблица конкретных материалов, реагентов и необходимого оборудования. Концентрация общего белка образцов должна определяться заранее с использованием установленной методологии, которые совместимы с lysate буфера, такие как assay Брадфорд 11.
1. подготовка проб и реагентов от стандартного пакета как поставляемых изготовителем
- подготовить 400 мм рабочего раствора Дитиотреитол (DTT), добавить 40 мкл деионизированная вода прозрачная труба содержащие поставляется складе от производителя. Важно избежать введения пузыри в решение путем смешивания решение с медленным и нежный закупорить.
- Добавить 20 мкл 10 X буфер образца и 20 мкл подготовленный 400 мм DTT решения розовый трубка, содержащая флуоресцентные 5 X мастер смеси (см. Таблицу материалы).
Примечание: Mix Master (мм) запечатан изготовителем с крышкой фольги и должны быть пронзили наконечник пипетки. Смесь осторожно, Медленное дозирование избежать разбрызгивания DTT в пипетку. - Добавьте 16 мкл деионизированная вода, 2 мкл поставлено 10 X буфер образца и 2 мкл решения DTT подготовленный 400 мм Труба лестница белый биотинилированным, поставляемые производителем. Осторожно перемешать и передачи в 0,6 мл трубку для денатурации.
- Подготовка 0.1 x буфер образца путем разбавления предоставленного 10 X 1: раствор 100 с водой. Подготовить достаточно 0.1 x буфер образца для разбавления всех образцов.
- Рассчитать количество 0,1 x буфер образца, который добавляется в образец, который будет зависеть от окончательного желаемой концентрации общего белка. Смешайте 1 часть 5 x флуоресцентные мм с 4-х частей разбавленный образца для достижения желаемого окончательный белка концентрацию.
Тома
- рассчитать следующим образом: (i) объем 5 x флуоресцентные мм = (желаемые окончательные белка концентрация) / 5; (ii) объем запасов белка = (желаемые окончательные белка концентрация x общий объем необходимых) / белка фондовый концентрации; (iii) объем 0.1 x буфер образца = объем запасов белок общий объем - 5 x мм объем -.
2. Денатурация образцов и лестница
- подготовленное место образцов и биотинилированным лестница в блоке тепла 95 ° C за 5 мин вихревых трубок сразу же после инкубации, выполнить спина за ~ 5 s в настольной центрифуги и место на льду
Замечание: Некоторые белки могут потребовать мягче денатурируя условия (например, 70 o C на 10 мин) для предотвращения агрегации белков и улучшения миграции в матрице капилляров. Этот вариант, если есть тяжелые мазать на более высокой молекулярной массой (см. видео к примеру).
3. Подготовка антител
- определяется оптимизации (см. Представитель результаты и видео), подготовить желаемый dilution(s) первичных антител (например, 1:50, 1: 100) в предоставленный антитела Разбавителя 2.
Примечание: Антитела обычно используются в более высоких концентрациях для иммуноферментного анализа на основе капиллярно чем для традиционных Западный blotting. Предоставленный вторичное антитело готовы к использованию без разбавления.
4. Подготовка люминол-S и перекиси
- подготовить 1:1 смесь люминол S и пероксид.
- Vortex перемешать и хранить на льду
Примечание: Важно, что эта смесь готовится свежий для каждой экспериментальной assay. 250ul всего смесь необходимо запустить полную тарелку.
5. Подготовка анализа пластины
- , как показано на рисунке 1, загрузить образцы и реагенты, подготовленный выше в пластину пробирного. Смотрите подробные инструкции ниже для каждой строки. Свести к минимуму испарения из скважин, чтобы заменить крышку плиты между реагент дополнений.
- В строке A, накапайте 5 мкл биотинилированным лестницы в хорошо A1. Оставшиеся строки, накапайте подготовлены образцы (по 5 мкл) в скважины A2-A25.
Примечание: Важно, что А1 хорошо всегда содержит лестница, как первый капилляров в картридже оптимизирован для запуска этот стандарт. - В строке B, накапайте 10 мкл антител разбавителя 2 в каждой скважине (B1-B25).
- В строке C, накапайте 10 мкл антител разбавителя 2 в хорошо C1. В оставшиеся строки C скважин, накапайте 10 мкл основное антитело (скважины C2-C25).
- В строке D, накапайте 10 мкл стрептавидина-ПХ в хорошо D1. В оставшиеся строки D скважин, накапайте 10 мкл вторичные антитела (скважины D2-D25).
- В строк Е, накапайте 10 мкл свежеприготовленные люминол пероксид смесь в каждой скважине (E1-E25).
- Наконец, добавить 500 мкл буфера мыть за квартал для каждой из строк Топ 3 буфера скважин.
Примечание: Важно свести к минимуму формирования пузыря закупорить осторожно и не высылать окончательный объем от кончика, как пузыри могут вмешиваться с капиллярной загрузки и запуска. - После загрузки всех скважин, центрифуга пластину в ~ 1000 x g 5 мин при комнатной температуре, чтобы удалить пузыри и убедитесь, что жидкость находится в нижней части скважины. Поп любых видимых пузыри с небольшой пипеткой подсказка или чистые иглы (например, 25 колеи стерильные " респ Топ " иглы).

Рисунок 1 . Дозирования шаблон для плиты пробирного. Цветовое кодирование представляет надлежащего реагенты и образцы (до 24 всего) добавил к пластине пробирного. Добавить биотинилированным лестницы хорошо A1 (оранжевый), подготовлены образцы из скважин A2 до A25 (светло-голубой), разбавителя 2 антитела к колодцам B1 B25 и C1 (светло-зеленый), основное антитело для скважин C2 до С25 (синий), стрептавидина HRP для хорошо D1 (темно-розовый), вторичные антитела Уэллс D2 до D25 (тёмно-зелёный) и смесь люминол пероксид скважин E1 до E25 (фиолетовый). Мыть буфер добавляется в первых трех строках больше середину плиты скважин (синий). пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
6. Начиная с капиллярной иммуноанализа инструмент
- Убедитесь, что инструмент и сопутствующие компьютер включены. Заказ не прогрева.
- Открыть приборостроение Программное обеспечение на компьютере. Во-первых, выберите " Assay " вкладку в правой части окна и " новых Assay " под " меню файл " на левой стороне. Выберите размер, размер диапазона (например, 12-230 kDa) и картридж тип (например, 25 капилляров), который был использован для конкретного assay.
Примечание: Один пробирного мая также ввода параметров, включая концентрацию белка, тип антитела и разбавления, при желании, но они не требуются для запуска assay. - Открыть дверь на прибор, нажав на кнопку на верхней панели оранжевого.
- Тщательно удалить капиллярную картридж из упаковки. Не касаясь стеклянные капилляры сами, установите картридж в держатель картриджа. Проверьте картридж Гостиный, наблюдая за внутренний свет изменения от оранжевый синий.
- Крепко пластину на скамейке и Осторожно отделите печать испарения из нижней части пластины. Поп пузырьков, видели в эти разделения матрицы скважины с smвсе наконечник пипетки или чистые иглы (например, 25 колеи стерильные " респ Топ " иглы).
- Место пробирного пластины на пластину держателя, обеспечения упора и закройте дверцу инструмент.
- Нажмите " начало " кнопку в программном обеспечении.
Примечание: Если кнопка Пуск не появляется, связь с прибором была потеряна. Выберите инструмент из верхнего левого меню, а затем подключить. Должен появиться всплывающее с серийным номером документа; Выберите этот параметр, а затем нажмите кнопку Подключить. Теперь должна появиться кнопка Пуск. - При запуска, отказаться от пластины. Выньте картридж и место в Шарпс контейнер для утилизации, наряду с любой иглы, которые возможно были использованы для поп пузыри. Оставить власть на, чтобы избежать проблем с подключением, если инструмент используется регулярно (например, по крайней мере раз в неделю).
7. Эксперимент анализ
- до анализа, обеспечения, выполняются следующие проверки качества.
- Флуоресцентные стандарты проверки, выбрав " Показать стандартов " значок. Убедитесь, что в правильно определены стандарты " представление графа " вкладка. Если они неверны, перейдите к " одно представление " значок, щелкните правой кнопкой мыши на правильный пик и выберите " силу стандарт ", или щелкните правой кнопкой мыши на неправильно пик и выберите " не стандарт ". Выполнять эту проверку для каждой новой капиллярные.
- Проверка биотинилированным лестница, нажав на " образцы " и " одно представление " иконы. Выберите по лестнице в закладке эксперимент. Если пик неправильно, щелкните правой кнопкой мыши на нем в " представление графа " и выберите " удалить пик ".
Примечание: например, биотинилированным лестница для 12-230 кДа комплект должен показать 12, 40, 66, 116, 180 и 230 кДа калибровки пиков. Если этот шаг не выполняется, будет неправильно рассчитана размера образца пиков, ложные результаты. - Зрения и анализировать образец пиков. Извлечь данные из таблицы пиков, включая молекулярный вес, площади пика, высота пика и сигнал-шум (S/N), необходимые для экспериментальных расчетов.
Результаты
Время экспозиции - Определение сигнала выгорания
Сигнал выгорания может произойти при слишком быстро истощается субстрат luminol и перекись водорода. Это может быть определено путем изучения данных на время экспозиции различных хемилюминесценции. В анализ программного обеспечения перейдите к «Редактировать – > анализа – > изображения». Воздействия в диапазоне от 5 до 480 s. Ось y в electropherogram сообщает сигнал/время, поэтому данные из каждого воздействия должны иметь аналогичный коэффициент времени сигнала. Этот коэффициент снижается с последовательно длительного воздействия luminol становится разряжен, как видно с антителом p53 ДУ-1 (рис. 2). Из-за истощения субстрата этот assay может считаться измеримые до 0,2 мкг/мкл концентрации только на 5-30 s воздействия. Таким образом, в этом примере, 15 s был определен оптимальный данных анализа выдержка для p53.
Lysate титрования - Определение линейный динамический диапазон
Важно, что измерения приниматься в линейный динамический диапазон калибровочных, где изменения сигнала как измеряется площадь пика пропорционального изменения количества белка в образце. Использование оптимальной экспозиции время 15 s выбранной в предыдущем разделе, демонстрируется пробирного линейность p53 и ɑ-тубулина над больше чем 15 раз диапазон концентрации (рис. 3). По нашему опыту, значение R2 > 0,9 линейной регрессии подходит считается приемлемым для разрежения спектра очищенный протеин известные количества (если пробирного абсолютные количественные измерения) или образец lysate неизвестных целевого белка (если пробирного Это относительное количественного измерения).
Оптимизации разбавления антитела
Использование антител в насыщения концентрации помогает гарантировать, что любые изменения сигнала измерены только из-за изменений в количестве белка. В качестве демонстрации две линии клетки Беас 2B, клеточных экстрактов (0,2 мкг/мкл общего белка загружается в assay) были зондируемой с серийно разреженных ɑ-тубулина антитела в концентрациях от 1:25 - терапевтами (рис. 4). Хемилюминесцентный сигнал (измеряется здесь, как площади пика) был заговор против разбавления антитела. Насыщение было отмечено около 1:50 разрежения, где кривая начинает заметно плато.
Экспериментальных суда - доксорубицин лечения в клетках Беас 2B
С помощью оптимизированного пробирного условий, культуры клеток Беас 2B лечили три различные концентрации доксорубицина (1,2, 1.8 и 2,4 мкг/мл) за 4 ч (Рисунок 5, Таблица 1). Активация p53 через столб-поступательные изменения опосредует несколько клеточных реакций, включая арест клеточного цикла, старение и апоптоз12. В частности фосфорилирование Серина 15 было обусловлено transcriptional активации p53, что приводит к апоптозу после доксорубицин лечения13. В этой демонстрации ɑ-тубулина нормированный пик областях представлены как раз управления. Интересно, что 3.5 до 4-кратное увеличение p53 фосфорилирование Серина в 15 и в 2 раза увеличивает уровень p53 фосфорилированных на Серин 20 наблюдались после 4 h воздействия доксорубицина. Эти результаты свидетельствуют о активация p53; Однако, нет доза ответ рассматривается для концентрации выбрали (и наоборот, низкие дозы испытания вызвали высокий реакции). Общая p53 не продемонстрировал четкий ответ в этой модели системы. Ранее мы наблюдали активация p53 фосфорилирования в отсутствие увеличения уровней общего p53 в аналогичных условиях в Цинк лечение Беас 2B клетки14.

Рисунок 2 . Сравнение изображений воздействия для выявления сигнала выгорания. Лейн просмотров шоу, снижение концентрации белка для Беас 2B лизатов исследован с p53 ДУ-1 антител при разбавлении 1: 500. Хемилюминесцентного сигнала коэффициенты, как пик высот в инструмент программного обеспечения, накладываются. В отличие от высоты пика интенсивности визуальные группы автоматически генерируются и регулируется инструмент для помощи просмотра полосы и являются несопоставимыми из одной панели в другую. Обратите внимание уменьшение хемилюминесцентного сигнала как увеличивается время экспозиции, с сигналом, начинают исчезать (Сплит пик) на двух длинных воздействия, указанием субстрата истощения. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 3 . Lysate титрования, показаны Лейн просмотров. Lysate титрования, показаны Лейн просмотров (A) Беас 2B lysate, когда исследовали с 1: 500 p53 ДУ-1 или 1:50 ɑ-тубулина. В отличие от пиковых значений области интенсивности визуальные группы автоматически генерируются и регулируется инструмент для помощи просмотра полосы и являются несопоставимыми из одной панели в другую. Линейный регрессионный анализ (B) подтверждает, что анализы линейные по всему диапазону, тестирование, от 0,01 до 0,20 мкг/мкл и 0,025 до 0,40 мкг/мкл, с2 значения R 0.999 и 0.985, соответственно. Концентрации общего белка в середине диапазона линейной были выбраны для размещения потенциальных целевых белков вариации в любом направлении (например, 0,2 мкг/мкл для α-тубулина). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 4 . Α-тубулина разбавления антитела кривых для двух отдельных лизатов белка Беас 2B с и без базовых нормализации. Определенный deparтемпературы от линейности рассматривается в 1:50 (0,02) разрежения, определяющее насыщенность. 1:50, поэтому был выбран в качестве оптимального разрежения для этого антитела. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
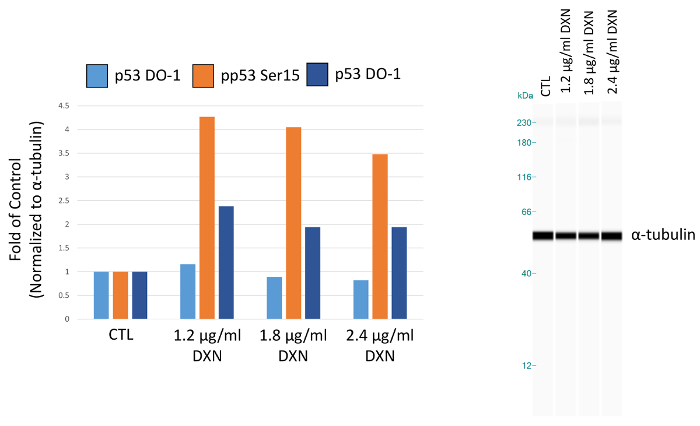
Рисунок 5. Эффект от лечения 4 h доксорубицин (DXN) на общей и серина фосфорилированных выражение протеина p53 Беас 2B клеток. Пик районах нормализуется до α-тубулина и как раз управления (CTL). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
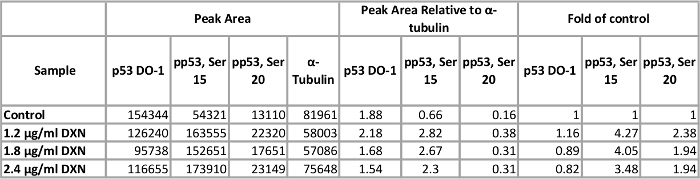
Таблицы 1. Эффект от лечения 4 h доксорубицин (DXN) на общей и серина фосфорилированных выражение протеина p53 Беас 2B клеток. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой таблицы.
Обсуждение
На протяжении десятилетий наблюдается устойчивый интерес к разработке методов капиллярного электрофореза на основе иммуноферментного анализа из-за низкой образца и реагента расходов, снижение обработки времени по сравнению с традиционными методами и высокой совместимости Автоматизируйте процедуры4,15. Существует ряд различных протоколов для разделения белков, которые использовали капилляров, включая рассев методом электрофореза, Электрокинетический, полимерные и изоэлектрической методы, которые изолировать белки с различными свойствами (соответственно, Электростатический заряд, раздел равновесия, просеивание свойства разделения матрицы и рН)16. Здесь мы описываем, основанные на антитела (или иммуноанализа) Капиллярный электрофорез метод, с использованием полимерной просеивание разделения, которая была автоматизирована и коммерчески принятой3. Преимущества этой системы включают в себя простоту использования и эксплуатации, стандартизированных и коммерчески доступных реагентов и надежный, чувствительность измерений, которые требуют меньше реагента и образцы, по сравнению с традиционными белка анализы как Западная помарка, энзим соединенный иммуноферментного анализа и другие форматы3,4,5. В предыдущих оценок этой технологии было отмечено, что размер диапазона белков, которые могут быть оценены было ограничено доступны разделения матрицы4, однако недавние предложения расширили измеряемого диапазона от 2 до 440 кДа17 . Кроме того некоторые lysate буферы известны несовместимыми с Пробирной18, поэтому отбор экспериментальных реагентов, используемых должны рассматриваться заранее.
Основным преимуществом автоматизированной процедуры с коммерчески доступных компонентов является последовательность результатов через стандартизированные методы и реагенты. Это минимизирует вероятность отказа пробирного автоматизируя важные шаги в рамках процедуры. Однако важно отметить, что некоторые виды практики, должны соблюдаться во время протокол к минимуму проблемы с капиллярного электрофореза на основе иммуноферментного анализа. Во-первых важно, что люминол S/пероксид смесь готовят свежие и сразу перед пластины загрузки. Последовательное сроков приведет к последовательным свечением после добавления окислителя, который приведет к последовательной измерений для конкретного антитела assay после анализа. Кроме того важно, что используются реагенты не истек, который в основном влияет на потенцию окислителя. Кроме того важно, что порядок загрузки образцов, антител и другие реагенты строго соблюдаться (см. Рисунок 1). Любой реагент, накапаны из места приведет к отказ пробирного и впустую run.
Помимо этих критических шагов основной проблемы, возникающие с техникой как правило могут быть преодолены путем оптимизации. Действительно эти условия являются специфическими для каждой комбинации модель системы/антитела и поэтому должны определяться эмпирически для каждого нового assay. В этой статье, мы ориентируемся на три общих процедур оптимизации: время экспозиции, lysate титрования и основное антитело разрежения. Способность генерировать измеримые результаты зависит от анализа времени экспозиции, когда субстрат luminol не истощается быстро, как субстрат истощения приводит к потере сигнала. Лизатных титрование определяет линейный динамический диапазон каждого анализа, которые могут отличаться в различных модельных системах, а также различных антител, даже для той же цели белка. Разбавления антитела выбрали на или вблизи насыщения концентрации обеспечить изменения в сигнал не будут затронуты нехватка свободного антитела, но только различия количество доступных белка целевой epitope. Другие соображения во время процесса оптимизации может включать время инкубации антитела и укладки/примеры время загрузки. В большинстве случаев настройки по умолчанию для инструмента предлагают наилучший баланс резолюции и чувствительности. Однако в некоторых случаях, плохой резолюции или чувствительность может быть улучшено путем настройки этих параметров.
Методы капиллярного электрофореза на основе иммуноферментного анализа обеспечивают быстрый, эффективный и воспроизводимые белка измерения. Хотя эти методы главным образом были использованы в исследования и разработки параметров, согласованность этих технологий имеет потенциальную полезность в нормативных и клинических приложений. Например выявление восприимчивы субпопуляций экологических токсикантов или больных с прогрессирования заболевания может основываться на белковых биомаркеров, измеряется в доступных матриц, таких как кровь, моча и слюна. Как реагент и падение расходы операции и количество образцов и целевых показателей, которые могут быть одновременно начисленных увеличивается мы увидим скорее всего капиллярного электрофореза на основе иммуноферментных методов, используемых для этих типов приложений.
Раскрытие информации
Авторы заявляют, что они не имеют никаких финансовых интересов. Этот манускрипт был рассмотрен национального здравоохранения и экологических последствий научно-исследовательская лаборатория и утвержден для публикации. Содержание не обязательно отражают взгляды АООС, ни упоминание названия торговых или коммерческих продуктов является одобрение или рекомендация для использования.
Благодарности
Авторы хотели бы поблагодарить Keith Tarpley нас EPA управления исследований и развития-Research Triangle Park (ORD-RTP) графических и медиа команды для развития, лентой и редактирования обучающего видео. Мы также хотели бы поблагодарить Дебора Причетт от ProteinSimple за полезные переговоры относительно оптимизации наших данных,. JM Guynn поддержал Окриджская институт науки и образования программа исследований/участие в агентство по охране окружающей среды США.
Материалы
| Name | Company | Catalog Number | Comments |
| Wes instrument | ProteinSimple (Santa Clara, CA) | 004-600 | |
| P53 DO-1 primary antibody | Santa Cruz Biotechnology, Inc. | sc-126 | |
| phosphorylated p53 (ser 15) primary antibody | Cell Signaling Technology | 9286 | |
| phosphorylated p53 (ser 20) primary antibody | Cell Signaling Technology | 9287 | |
| alpha-tubulin primary antibody | Cell Signaling Technology | 3873 | used as a loading control |
| Compass Software | ProteinSimple (Santa Clara, CA) | provided with the Wes | |
| 12-230 kDa Master kit | ProteinSimple (Santa Clara, CA) | PS MK02 (since replaced by a new kit #) | |
| www.proteinsimple.com/consumables_sw_wes.html | INCLUDES PART NO: Wash Buffer (60 mL) 042-202 10X Sample Buffer (440 μL) 042-195 Pre-Filled Microplates (8) PS-PP01 Capillary Cartridges (8) PS-CC01 Antibody Diluent II (20 mL) 042-203 Luminol-S (1.5 mL) 042-233 Peroxide (1.5 mL) 042-234 Streptavidin-HRP (132 μL) 042-414 Standard Pack (8): Biotinylated ladder, fluorescent 5X master mix, DTT, and empty 0.6 mL tube PS-ST01 Anti-Rabbit Secondary Antibody 042-206 or Anti-Mouse Secondary Antibody 042-205 | ||
| Name | Company | Catalog Number | Comments |
| Cell culture, treatment, and harvest (using vendor recommended protocols; protocols not included in manuscript) | |||
| BEAS-2B cells | American Type Culture Collection (ATCC, Manassas, VA) | CRL-9609 | |
| keratinocyte growth medium, KGM Gold | Lonza Ltd (Basel, Switzerland) | 192152 | for cell culture |
| keratinocyte basal medium, KBM Gold | Lonza Ltd (Basel, Switzerland) | 192151 | serum free medium for chemical dosing |
| doxorubicin | Sigma-Aldrich (St. Louis, MO) | D1515 | |
| Coomassie Blue Bradford Assays | ThermoFisher Scientific (Waltham, MA) | 23200 | for protein quantification |
| Nuclear Extract kit | Active Motif (Carlsbad, CA) | D1515 | used to prepare whole cell lysates |
| INCLUDES: | |||
| Lysis Buffer AM1 | |||
| 1M dithiothreitol (DTT) | |||
| Protease Inhibitor Cocktail | |||
| 10X PBS | |||
| Phosphatase Inhibitors |
Ссылки
- Bradley, H. L., Sabnis, H., Pritchett, D., Bunting, K. D. . Hematopoietic stem cell protocols. 1185, (2014).
- Guo, L., Eldridge, S., Furniss, M., Mussio, J., Davis, M. Use of Human Induced Pluripotent Stem Cell-Derived Cardiomyocytes (hiPSC-CMs) to Monitor Compound Effects on Cardiac Myocyte Signaling Pathways. Curr Protoc Chem Biol. 7 (3), 141-185 (2015).
- Chen, J. Q., et al. Absolute quantitation of endogenous proteins with precision and accuracy using a capillary Western system. Anal Biochem. 442 (1), 97-103 (2013).
- Chen, J. Q., Wakefield, L. M., Goldstein, D. J. Capillary nano-immunoassays: advancing quantitative proteomics analysis, biomarker assessment, and molecular diagnostics. J Transl Med. 13, 182 (2015).
- Liu, S., et al. The Application of a Novel Nanovolume Capillary Electrophoresis- Based Protein Analysis System in Personalized & Translational Medicine Research. J Bioanal Biomed. S3 (004), (2013).
- ProteinSimple Western. . Size Assay Development Guide, Revision 1. , (2014).
- Eaton, S. L., et al. A guide to modern quantitative fluorescent western blotting with troubleshooting strategies. J Vis Exp. (93), (2014).
- Eslami, A., Lujan, J. Western blotting: sample preparation to detection. J Vis Exp. (44), (2010).
- Silva, J. M., McMahon, M. The fastest Western in town: a contemporary twist on the classic Western blot analysis. J Vis Exp. (84), e51149 (2014).
- Thorn, C. F., et al. Doxorubicin pathways: pharmacodynamics and adverse effects. Pharmacogenet Genomics. 21 (7), 440-446 (2011).
- Ernst, O., Zor, T. Linearization of the bradford protein assay. J Vis Exp. (38), (2010).
- Taira, N., Yoshida, K. Post-translational modifications of p53 tumor suppressor: determinants of its functional targets. Histol Histopathol. 27 (4), 437-443 (2012).
- Thompson, T., et al. Phosphorylation of p53 on key serines is dispensable for transcriptional activation and apoptosis. J Biol Chem. 279 (51), 53015-53022 (2004).
- Currier, J. M., Cheng, W. Y., Menendez, D., Conolly, R., Chorley, B. N. Developing a Gene Biomarker at the Tipping Point of Adaptive and Adverse Responses in Human Bronchial Epithelial Cells. PLoS One. 11 (5), e0155875 (2016).
- Moser, A. C., Hage, D. S. Capillary electrophoresis-based immunoassays: principles and quantitative applications. Electrophoresis. 29 (16), 3279-3295 (2008).
- Shintani, H. . Handbook of Capillary Electrophoresis Applications. , (1997).
- . Wes reagents and consumables :: ProteinSimple Available from: https://www.proteinsimple.com/consumables_sw_wes.html (2017)
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены