Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
In Vivo Оценка механических и вязкоупругих свойств крысиного языка
В этой статье
Резюме
Мы описываем хирургическую процедуру в анестезированной модели крысы для определения мышечного тонуса и вязкоупругих свойств языка. Процедура включает в себя специфическую стимуляцию гипоглоссальных нервов и применение пассивных кривых силы / деформации Лиссажу к мышце.
Аннотация
Язык - это сильно иннервированный и васкуляризированный гидростат мышц на полу устья большинства позвоночных. Его основные функции включают поддержку жевания и деградации, а также вкусовые ощущения и фонетику. Соответственно, сила и объем языка могут влиять на способность позвоночных выполнять основные виды деятельности, такие как питание, общение и дыхание. Человеческие пациенты с апноэ во сне имеют расширенные языки, характеризующиеся уменьшением мышечного тонуса и увеличенным внутримышечным жиром, который можно визуализировать и количественно определять с помощью магнитно-резонансной томографии (МРТ). Способность измерять генерацию силы и вязкоупругие свойства языка являются важными инструментами для получения функциональной информации для корреляции с данными визуализации. Здесь мы представляем методы измерения образования силы языка у анестезированных крыс Цукера посредством электрической стимуляции гипоглобулярных нервов и для определения вязкоупругих свойств oF язык, применяя пассивные кривые силы / деформации Лиссажу.
Введение
Язык обеспечивает необходимую поддержку для жевания, дегуляции, вкуса и речи. Присутствие внешней и внутренней мускулатуры с выраженной иннервацией и анатомией / функцией объясняет уникальность этого мускульного гидростата. Недавние достижения в технике визуализации позволили более детально рассмотреть сложную анатомию 1 . Снижение функциональности языка, атрофия языка, дисфагия и речевые затруднения также являются распространенными проявлениями миопатических состояний, таких как паркинсон 2 , амиотрофический болевой склероз (ALS) 3 , миотоническая дистрофия (MD) 4 и другие миопатии.
Изменения в составе мышц, связанные с распространенными болезненными состояниями, влияют на механические и вязкоупругие свойства языка. Например, функциональный анализ силы языка обнаружил изменения в сократительных свойствах, связанных со старениемSs = "xref"> 5 , 6 , гипоксия 7 , 8 и ожирение 9 , 10 . В случае мышечной дистрофии повышенный фиброз приводит к более высокой жесткости мышц, что приводит к снижению соответствия деформации при применении протокола деформации Лиссажу 11 . И наоборот, изменения в содержании мышечного жира, как и те, которые описаны у пациентов с ожирением, изменяют как метаболические 12, так и механические свойства скелетных мышц 13 , 14 и, как прогнозируется, увеличивают соответствие мышц деформации. Повышенный жир языка также коррелирует с развитием обструктивного апноэ сна (OSA) у людей 17 путем увеличения объема языка до точки частичной окклюзии верхних дыхательных путей (апноэ) 15 , 16 . СимА также у людей, инфильтрация жировой ткани была зарегистрирована у тучных крыс Цукера 10 , что свидетельствует о том, что эта модель является ценным инструментом для изучения влияния инфильтрации жира на физиологию языка.
Измерение силы языка требует деликатных хирургических методов, чтобы изолировать и билатерально стимулировать гипоглоссальные нервы 17 , 18 . Такие методы были ранее описаны у крыс 5 , 17 , 19 , 20 , кроликов 21 и людей 22 , 23 , но с ограниченными визуальными средствами для исследователя. Благодаря высокому техническому характеру доступность подробного протокола значительно улучшит доступность и воспроизводимость этого метода. Цель нашей экспериментальной парадигмы - плохоИспользовать достоверную и надежную методику измерения прочности и вязкоупругих свойств языка в модели крысы. Для этого крыса анестезируется, появляются гипоглоссальные нервы, а трахея канюлирована, чтобы обеспечить свободный доступ к языку животного. Затем шовный шлейф соединяет кончик язычка с преобразователем силы, способным контролировать как силу, так и длину, в то время как два биполярных крюковых электрода стимулируют гипоглоссальные нервы, чтобы вызвать сжатие языка. После того, как измерение силы завершено, возможности контроля длины усилителя силы используются для быстрого изменения длины язычка в соответствии с протоколом синусоидальной волны с фиксированной амплитудой (кривые Лиссажу), длительностью и частотой, что позволяет получить Его вязкоупругие свойства 11 , 24 . Протокол будет направлять исследователя через шаги вскрытия, позиционирование животного на экспериментальной платоRm, размещение электродов и, наконец, получение и анализ данных о силе и вязкоупругости.
протокол
Все процедуры, в том числе животные, были одобрены Институтом по уходу и использованию животных (IACUC) Университета Пенсильвании (протокол № 805822). Описанная процедура является терминальной и не требует использования асептических условий или продуктов фармацевтического класса.
1. Хирургические процедуры
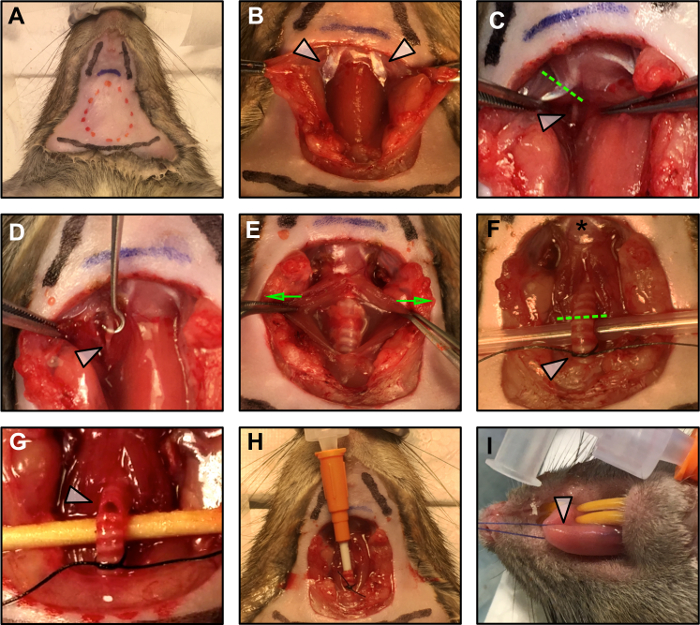
Рисунок 1: Хирургические процедуры.
(A) Демонтаж хирургического плана. Красная пунктирная линия указывает область разреза. Две черные линии указывают положение челюсти, а нижняя черная линия обозначает положение грудной клетки. Синяя линия указывает на подъязычную кость. (B) Воздействие заднего живота дистальной мышцы (стрелки) после тупого рассечения жировой ткани, подъязычной и подмаксильной Арильные железы. (C) Резекция заднего живота дистальной мышцы (пунктирная зеленая линия), чтобы обнажить гипоглобулярный нерв (белая стрелка). (D) Гипоглоссальный нерв (белая стрелка) очищается от окружающей фасции. (E) Трахея открывается, осторожно вытягивая вокруг нее гладкую мышцу (зеленые стрелки указывают направление прилагаемой силы) и поднимается (F), чтобы подготовиться к интубации. Звезда указывает на вставку языка на подъязычную кость. Зеленая пунктирная линия обозначает точку разреза для интубации. Белая стрелка указывает на свободный узел, подготовленный для закрепления канюли на месте после ее введения. (G) Разрез трахеи для канюлирования. (H) Катетер трахеи вставлен и закреплен на месте квадратным узлом. (I) Применение шва к языку.Target = "_ blank"> Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Анестезия и подготовка к операции
- Поместите крысу в индукционную камеру с 4% изофлурановой анестезией.
- Положите животное на спину над источником тепла и поддерживайте анестезию с 1 - 3% изофлураном из носекона, обеспечивая дыхательную скорость не менее 70 вдохов в минуту.
- Бритье шеи с помощью клипера для волос и крема для снятия волос. При использовании крема для удаления волос нанесите крем с помощью аппликатора с хлопковым наконечником до удаления меха. Длительное воздействие крема для удаления волос может вызвать раздражение кожи.
- Очистите хирургическое поле 70% -ным спиртом ( рис. 1А ).
- Проверьте дыхательный образ животного и рефлексы (отсутствие рефлекса пальца ноги), прежде чем приступать к первоначальному разрезу. Необходим постоянный мониторинг и оценка глубины анестезии (reСкорость дыхания и отсутствие рефлексов каждые 10 мин); Животное должно находиться под глубоким хирургическим планом анестезии в течение всей процедуры.
- Игнорирование гипоглигических нервов
- Откройте хирургическое поле с помощью пары рабочих ножниц путем резекции и удаления кожи, как показано красной пунктирной линией на рисунке 1A .
- Тупые рассекают через любую жировую ткань, подъязычные и подчелюстные железы и мышечный слой, окружающий трахею.
ПРИМЕЧАНИЕ. Будьте осторожны во время вскрытия. Используйте тупое рассечение, когда это возможно, и будьте осторожны, чтобы не повредить кровеносные сосуды шеи. - Определите задний живот дистальной мышцы (PD), боковой к трахее ( рис. 1B - белые стрелки). Гипоглоссальный нерв проходит под этой мышцей ( рис. 1C - белая стрелка). При электрокаутере резекция PD proxImal к подъязычной кости ( рис. 1C - пунктирная линия).
ПРИМЕЧАНИЕ. Не допускайте, чтобы нерв или ткань вокруг него становились сухими. Добавьте каплю минерального масла на нерв, чтобы защитить его. Чтобы избежать сокращения мышц из-за распространения поля стимула с электродов, осторожно прижигайте мышечную ткань в возможных местах контакта вокруг нерва. - Используя пару тонких щипцов, рассекайте гипоглобальный нерв от окружающей фасции. С помощью крючка убедитесь, что для соединения биполярного электрода ( рис. 1D ) имеется не менее 3 мм нерва.
- Используя микро-гемостатические щипцы, раздавите гипоглобулярный нерв как дистально от подъязычной кости ( рис. 1D - белая стрелка), чтобы избежать ретроградного распространения стимула. Сокрушите нерв, надавив на него с помощью микро-гемостатических щипцов в течение 5 с. Когда гемостат захватывает нерв, краткий tВедьма у основания языка должна быть видна.
- Повторите процедуру для другой стороны.
- Интубация трахеи
- Выложите трахею, осторожно отделяя окружающие гладкие мышцы тупым рассечением ( рисунок 1E - как показано зелеными стрелками).
ПРИМЕЧАНИЕ. Будьте консервативны и используйте предпочтительно тупое рассечение. Сравните диаметр канюли с диаметром трахеи. Канюля должна правильно вписываться в трахею и должна оставаться стабильно вставленной после ушивания, как описано в шагах с 1.3.2 по 1.3.5. - Аккуратно поднимите трахею, используя пару шовных зажимных щипцов и пропустите под ним 4-0 шов, рядом с грудной клеткой. Свяжите начальный рыхлый узел между 6-м и 7-м кольцами из гортани ( рис. 1F - белая стрелка). Этот узел будет закрыт после того, как канюля будет вставлена, чтобы удерживать его на месте.
- Сдвиньте стержень(Смажьте пипетку минеральным маслом для облегчения введения) под трахею, чтобы поднять ее и облегчить введение канюли (канюля IV 14 gx 3.25).
- Вырежьте небольшой разрез между 4-м и 5-м кольцами из гортани ( рис. 1G - белая стрелка). После первого разреза отверстие будет иметь тенденцию к распространению, поэтому должно быть консервативным при первоначальном разрезе, чтобы избежать полной резекции трахеи.
ПРИМЕЧАНИЕ. Перед выполнением разреза трахеи убедитесь, что канюля готова и доставка анестезии включена. - Начните введение анестезии через канюлю и аккуратно вставьте ее в разрез, мягко продвигаясь внутрь трахеи длиной примерно 5 колец. Закрепите канюлю на месте швом, чтобы создать воздухонепроницаемое уплотнение ( рис. 1H ).
ПРИМЕЧАНИЕ. Убедитесь, что никакая жидкость не попадает в зарубцованную трахею, чтобы избежатьocation. После того, как трахея будет вырезана, животное будет вдыхать воздух в помещении. Поэтому важно быстро вставить канюлю, чтобы поддерживать анестезию. Когда / если вы перемещаете животное, контролируйте правильное положение канюли в трахее. - Аккуратно удалите животное из носекона.
ПРИМЕЧАНИЕ. Использование инъекционных анестетиков вместо изофлурана может упростить процедуру, устраняя необходимость в интубации трахеи и очистке экспериментальной рабочей области от избыточных труб.
- Выложите трахею, осторожно отделяя окружающие гладкие мышцы тупым рассечением ( рисунок 1E - как показано зелеными стрелками).
- Сшивание языка
- Замочите 20-сантиметровый шов 5/0 (мы предлагаем Шелк, черная плетеная) в PBS.
- Удерживая рот крысы открытой, аккуратно держите кончик языка с помощью щипцов для шовного зажима.
- Пропустите шов медиально через кончик языка ( рисунок 1I - белая стрелка), обращая внимание, чтобы держать язык влажным с физиологическим раствором, чтобы избежать потенциальной тканинаносить ущерб.
- Закрепите петлю шириной около 4 см (диаметр может меняться в зависимости от расстояния между животным и преобразователем силы).
ПРИМЕЧАНИЕ. Убедитесь, что шов и язык мокрые, чтобы облегчить введение и избежать ненужных повреждений ткани.
2. Экспериментальная установка
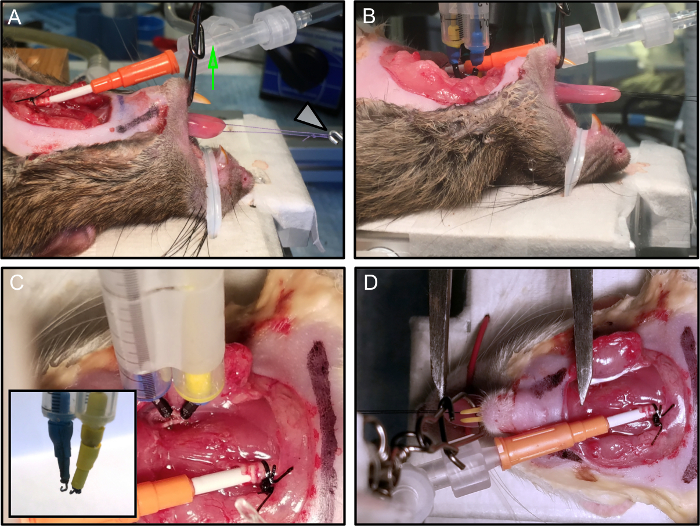
Рисунок 2: Позиционирование и защита животных.
(A) Мышь расположена на экспериментальной платформе. Челюсть закреплена, и рот поддерживается открытым при приложении вертикального натяжения (зеленая стрелка). Шовный шлейф соединен с преобразователем силы (белая стрелка). (B) Электроды подключены. (C) Каждый электрод, установленный на микроманипуляторе, стабильно соединен с нервом. Инкрустация показывает завершение tОн зацепляет электрод. (D) Оптимальная длина языка измеряется суппортом Вернье, от вставки на уровне подъязычной кости до кончика языка. На этом рисунке электроды были удалены для ясности. Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Примечание. Расположите животное на спине на нагретом лотке устройства, используя следующие меры безопасности, чтобы избежать движения во время эксперимента.
- Закрепите нос крысы в лотке с металлическим скручиванием с пластмассовым покрытием, непосредственно подключенным к нагретой платформе ( рис. 2А , 2В ).
- Держите рот крысы открытым, применяя вертикальное натяжение (используйте 3-ходовой поворот, привязанный к 9-миллиметровой испытательной моноволоконной линии и удерживайте его с помощью палки для фотоаппарата) ( Рисунок 2A - зеленая стрелка).
ПРИМЕЧАНИЕ. Альтернативным подходом к стабилизации крысы является использование грызуна для грызунов или его индивидуальная модификация. Важно, чтобы рот поддерживался открытым и стабильным, чтобы избежать движений шеи, которые могут повлиять на качество измерений. - Подключите шовную петлю к преобразователю силы ( рис. 2A - белая стрелка).
- Используя хирургическую ленту, иммобилизуйте конечности и живот крысы, чтобы ограничить движения во время стимуляции.
- Примените два стимулирующих крючкообразных биполярных электрода к рассеченным гипоглоссальным нервам, проксимально к месту раздавливания ( рис. 2C ).
- Используйте стимулирующие биполярные электроды, изготовленные из пары иглопробивных иглопробивных стальных иглодержащих электродов, удерживаемых вместе на расстоянии 2 мм друг от друга с помощью пластиковой опоры (здесь мы использовали две серологические пипетки с 1 мл, записанные вместе).
- Согните концы иглообразных электродов до формы крючкаДостаточно маленький, чтобы сформировать устойчивый контакт с нервом (диаметр ~ 1 мм) ( рисунок 2C - инкрустация).
- Подсоедините два провода каждого электрода к штабелируемому двойному связующему столбу с гнездом BANC с гнездом для бананов и затем подключите к модулю стимулятора in situ системы тестирования мышц (таблица 3) с использованием разветвителя BNC.
ПРИМЕЧАНИЕ. Убедитесь, что животное стабильно и что шея и язычок выровнены по отношению к рычагу преобразователя силы. Продолжайте следить за частотой дыхания и следите за тем, чтобы ограничения не мешали дыханию.
3. Оптимальная длина (L 0 ) и максимальное изометрическое определение силы
- Регулярно отрегулируйте длину языка и применяйте изометрические стимулы дрожания до тех пор, пока не будет достигнута максимальная сила.
- Определите L 0 как длину, при которой изометрическое усилие твика ( таблица 1 ) является максимальным и записывается для последующей нормализацииИзмерение силы, поскольку оно изменяется для каждого животного. Используя суппорт Вернье, измерьте длину языка от вставки на уровне подъязычной кости ( рис. 2D ) до кончика языка.
ПРИМЕЧАНИЕ. Правильное расположение электродов необходимо для обеспечения оптимального контакта с нервами. Оптимальное позиционирование должно оказывать подобные и аддитивные силы при стимуляции одного из двух нервов или обоих, соответственно.
- Определите L 0 как длину, при которой изометрическое усилие твика ( таблица 1 ) является максимальным и записывается для последующей нормализацииИзмерение силы, поскольку оно изменяется для каждого животного. Используя суппорт Вернье, измерьте длину языка от вставки на уровне подъязычной кости ( рис. 2D ) до кончика языка.
- Перед началом эксперимента подключите оба электрода к стимулятору и выполните тетаническую стимуляцию ( таблица 1 ). Во время этого сокращения наблюдайте за животным, чтобы убедиться, что положение стабильное, и проверьте наличие нежелательных видимых сокращений мышц шеи.
- Измерить изометрическую силу, применяя подергивание, которое следует через 20 с путем тетанической стимуляции. Повторяйте стимуляции 3 раза, обеспечивая 4-минутное восстановление между циклами стимуляции (цикл включает в себя одно дергание иE tetanic stimulation), и записывать максимальные подергивания и тетанические силы.
- Поддерживайте язык во влажном состоянии, применяя несколько капель PBS между схватками.
ПРИМЕЧАНИЕ. Если участвуют мышцы шеи, осторожно меняйте расположение электродов так, чтобы они не касались окружающей мышечной ткани и при необходимости прижигали ткань, контактирующую с электродами.
4. Определение вязкоупругих свойств (кривые Лиссажу)
- Дайте языку отдохнуть в течение 3 - 5 минут после определения изометрической силы. Выполните кривые Лиссажу, начинающиеся с L 0 , поэтому положение животного и преобразователя силы никогда не должно изменяться.
- Без стимуляции гипоглоссальных нервов применяют циклы пассивных растяжек ( таблица 2 ) с увеличением смещения (d), то есть 5, 10, 15, 20, 25, 30, 35, 40, 50% от L 0 (для более высоких амплитуд может потребоваться двойное Контроллер режима с высокимR, чем 305C-LR). Например, амплитуда 40% L 0 приведет к деформации языка от + 20% L 0 до -20% L 0 .
- Используйте фиксированную частоту синуса 2 Гц с 10 повторениями в каждом цикле на общую продолжительность 5 с за каждый цикл. Изменения частоты синуса использовались в прошлом с тканями, такими как диафрагма 24, и их можно было использовать для изменения экспериментального протокола.
- Разрешить 30 с между каждым циклом и обеспечить влажность языка во время всей процедуры.
ПРИМЕЧАНИЕ. Держите язык влажным во время процедуры, добавляя несколько капель PBS. Убедитесь, что удерживающее зажим удерживается на месте во время растяжек, особенно когда смещение достигает 40% или выше.
- Сразу же после завершения эксперимента, в то время как животное все еще находится под глубоким хирургическим планом анестезии, эвтаназируйте животное в соответствии с утвержденным протектором животного IACUCocol. Рассекайте язык для дальнейшей обработки ( например, замороженное разделение или хранение для биохимических анализов).
Результаты
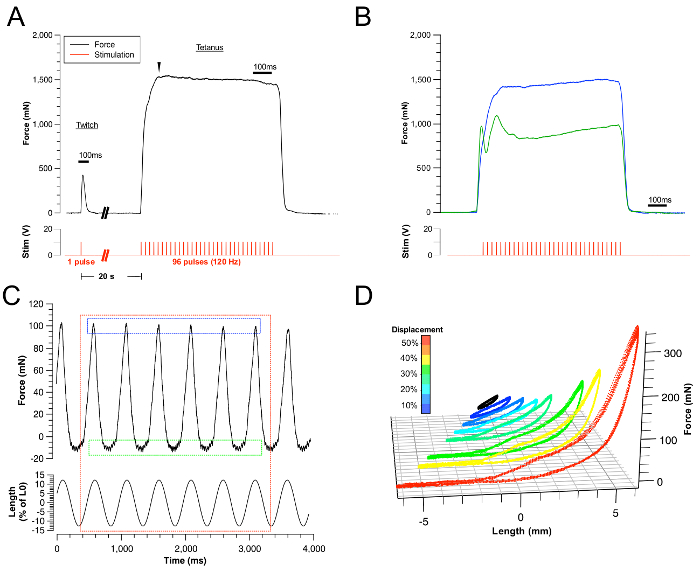
Рисунок 3: Представительские результаты.
(A) Примеры успешных следов твинта и тетанической силы. Соответствующая стимуляция представлена красным следом. (B) Пример неудачных тетанич?...
Обсуждение
Предполагается, что изменения в метаболизме и / или составе языка, например, инфильтрация жировой ткани вследствие ожирения, приводят к количественным изменениям параметров, которые оцениваются по нашему протоколу. Количественная оценка силы языка представляет большой интерес, ?...
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Это исследование было поддержано двумя национальными институтами медицинских грантов: HL089447 («Ожирение и OSA: понимание важности жирной и метаболической функции») и HL094307 («Понимание взаимосвязи между ожирением и жирным жиром»)
Материалы
| Name | Company | Catalog Number | Comments |
| SurgiSuite (heated Surgical tray) | Kent Scientific | SurgiSuite-LG | Includes heated platform |
| LED Lighting and Magnification Kit | Kent Scientific | SURGI- 5003 | |
| RC2 Rodent Circuit Controller | VetEquip | 922100 | |
| Isoflurane | Butler Schein Animal Health Supply | 29405 | |
| Alcohol Prep | Webcol | 6818 | |
| Cotton-tipped applicators | MediChoice | WOD1002 | |
| Hair clipper | Conair | ||
| Hair remover lotion | Nair | ||
| Medical tape | Transpore | 3M | |
| D-PBS | Corning | 21-030-CM | |
| Operating Scissors | World Precision Instruments | 503717-12 | |
| Hemostatic Forceps | Merit | 97-458 | Any tissue forceps can be used instead |
| Microdissecting Forceps, Angled, Serrated, 10.2 cm, SS | World Precision Instruments | 504479 | |
| Suture Tying Forceps | Fine Science Tools | 18025-10 | |
| Blunt Micro Hook | Fine Science Tools | 10062-12 | |
| Microhemostat | Fine Science Tools | 12075-14 | |
| Thermal cautery | WPI | 501292 | Disposable cauteries are available at lower cost |
| IV 14g x 3.25" cannula | BD | B-D382268H | For tracheal cannulation |
| Braided silk non-absorbable suture size 4-0 | Harvard Apparatus | SP104 | For stabilization of the tracheal cannula |
| Braided non-absorbable silk 5/0 suture | Surgik LC, USA | ESILRC15387550 | For suturing the tongue |
| Plastic-coated metal twist-tie (or electrical wire) | For securing the rat's nose to the platform | ||
| Camera stick | |||
| 3 way-swivel and Trilene 9 Kg test monofilament line | Berkley | For securing the jaw and maintaining the mouth open | |
| Camera stick with adjustable angle | For supporting the 3 way-swivel and maintaining the mouth open. | ||
| in situ Muscle Test System | Aurora Scientific | 809C | This system is designed for mice and was modified by extending the platform. Alternatively the rat-specific 806D system can be used. |
| Dual-Mode Muscle lever (force transducer) | Aurora Scientific | 305C-LR | 309C offers higher excursion capabilities than 305C-LR. Link for more information and specifications: http://aurorascientific.com/products/muscle-physiology/dual-mode-muscle-levers/ |
| Needle Electrodes (surgical steel, 29 gauge) | AD Instruments | MLA1204 | 300C is recommended for use in mice. |
| Magnetic Stands | World Precision Instruments | M10 | Used for making the bipolar stimulating hook electrodes |
| Kite Manual Micromanipulator | World Precision Instruments | KITE-R and KITE-L | Require a steel plate |
| Stackable Double Binding Post with Banana Jack x BNC Jack | McMaster Carr | 6704K13 | |
| Carbon fiber composites digital caliper | VWR | 36934-152 |
Ссылки
- Sanders, I., Mu, L. A three-dimensional atlas of human tongue muscles. Anat Rec (Hoboken). 296 (7), 1102-1114 (2013).
- Ciucci, M. R., et al. Tongue force and timing deficits in a rat model of Parkinson disease. Behav Brain Res. 222 (2), 315-320 (2011).
- Easterling, C., Antinoja, J., Cashin, S., Barkhaus, P. E. Changes in tongue pressure, pulmonary function, and salivary flow in patients with amyotrophic lateral sclerosis. Dysphagia. 28 (2), 217-225 (2013).
- Wang, Z. J., Huang, X. S. Images in clinical medicine. Myotonia of the tongue. N Engl J Med. 365 (15), e32 (2011).
- Ota, F., Connor, N. P., Konopacki, R. Alterations in contractile properties of tongue muscles in old rats. Ann Otol Rhinol Laryngol. 114 (10), 799-803 (2005).
- Schwarz, E. C., Thompson, J. M., Connor, N. P., Behan, M. The Effects of Aging on Hypoglossal Motoneurons in Rats. Dysphagia. 24 (1), 40 (2008).
- Pae, E. -. K., Wu, J., Nguyen, D., Monti, R., Harper, R. M. Geniohyoid muscle properties and myosin heavy chain composition are altered after short-term intermittent hypoxic exposure. J Appl Physiol. 98 (3), 889-894 (2005).
- Fuller, D. D., Fregosi, R. F. Fatiguing contractions of tongue protrudor and retractor muscles: influence of systemic hypoxia. J Appl Physiol. 88 (6), 2123-2130 (2000).
- Ray, A. D., Farkas, G. A., Pendergast, D. R. In-situ mechanical characteristics of the tongue are not altered in the obese Zucker rat. Sleep. 32 (7), 957 (2009).
- Brennick, M. J., et al. Tongue fat infiltration in obese versus lean Zucker rats. Sleep. 37 (6), 1095-1102 (2014).
- Stedman, H. H., Sweeney, H. L., Shrager, J. B., Maguire, H. C., Panettieri, R. A., Petrof, B., Narusawa, M., Leferovich, J. M., Sladky, J. T., Kelly, A. M. The mdx mouse diaphragm reproduces the degenerative changes of Duchenne muscular dystrophy. Nature. 352 (6335), 536-539 (1991).
- Goodpaster, B. H., Wolf, D. Skeletal muscle lipid accumulation in obesity, insulin resistance, and type 2 diabetes. Pediatr Diabetes. 5 (4), 219-226 (2004).
- Loro, E., et al. IL-15Rα is a determinant of muscle fuel utilization, and its loss protects against obesity. Am J Physiol Regul Integr Comp Physiol. 309 (8), R835-R844 (2015).
- Rahemi, H., Nigam, N., Wakeling, J. M. The effect of intramuscular fat on skeletal muscle mechanics: implications for the elderly and obese. J R Soc Interface. 12 (109), 20150365 (2015).
- Kim, A. M., et al. Tongue fat and its relationship to obstructive sleep apnea. Sleep. 37 (10), 1639-1648 (2014).
- Kim, A. M., et al. Metabolic activity of the tongue in obstructive sleep apnea. A novel application of FDG positron emission tomography imaging. Am J Respir Crit Care Med. 189 (11), 1416-1425 (2014).
- Gilliam, E. E., Goldberg, S. J. Contractile properties of the tongue muscles: effects of hypoglossal nerve and extracellular motoneuron stimulation in rat. J Neurophysiol. 74 (2), 547-555 (1995).
- Sokoloff, A. J. Localization and contractile properties of intrinsic longitudinal motor units of the rat tongue. J Neurophysiol. 84 (2), 827-835 (2000).
- Becker, B. J., Russell, J. A., Connor, N. P. Effects of aging on evoked retrusive tongue actions. Arch Oral Biol. 60 (6), 966-971 (2015).
- Connor, N. P., et al. Tongue muscle plasticity following hypoglossal nerve stimulation in aged rats. Muscle Nerve. 47 (2), 230-240 (2013).
- Seo, J., et al. Nerve cuff electrode using embedded magnets and its application to hypoglossal nerve stimulation. J Neural Eng. 13 (6), 066014 (2016).
- Friedman, M., et al. Targeted hypoglossal nerve stimulation for the treatment of obstructive sleep apnea: Six-month results. Laryngoscope. 126 (11), 2618-2623 (2016).
- Heiser, C., Maurer, J. T., Steffen, A. Functional outcome of tongue motions with selective hypoglossal nerve stimulation in patients with obstructive sleep apnea. Sleep Breath. 20 (2), 553-560 (2016).
- Syme, D. A. Passive viscoelastic work of isolated rat, Rattus norvegicus, diaphragm muscle. J Physiol. 424, 301-315 (1990).
- Connor, N. P., et al. Effect of tongue exercise on protrusive force and muscle fiber area in aging rats. J Speech Lang Hear Res. 52 (3), 732-744 (2009).
- Schaser, A. J., Stang, K., Connor, N. P., Behan, M. The effect of age and tongue exercise on BDNF and TrkB in the hypoglossal nucleus of rats. Behav Brain Res. 226 (1), 235-241 (2012).
- Puhan, M. A., et al. Didgeridoo playing as alternative treatment for obstructive sleep apnea syndrome: randomised controlled trial. BMJ. 332 (7536), 266-270 (2006).
- Guimarães, K. C., Drager, L. F., Genta, P. R., Marcondes, B. F., Lorenzi-Filho, G. Effects of oropharyngeal exercises on patients with moderate obstructive sleep apnea syndrome. Am J Respir Crit Care Med. 179 (10), 962-966 (2009).
- Ueda, H., Almeida, F. R., Chen, H., Lowe, A. A. Effect of 2 jaw exercises on occlusal function in patients with obstructive sleep apnea during oral appliance therapy: a randomized controlled trial. Am J Orthod Dentofacial Orthop. 135 (4), 430 (2009).
- Strollo, P. J., et al. Upper-airway stimulation for obstructive sleep apnea. N Engl J Med. 370 (2), 139-149 (2014).
- Perrier, P., Payan, Y., Zandipour, M., Perkell, J. Influences of tongue biomechanics on speech movements during the production of velar stop consonants: A modeling study. J Acoust Soc Am. 114 (3), 1582-1599 (2003).
- Connor, N. P., et al. Tongue muscle plasticity following hypoglossal nerve stimulation in aged rats. Muscle & nerve. 47 (2), 230-240 (2013).
- Brady, J. P., et al. AlphaB-crystallin in lens development and muscle integrity: a gene knockout approach. Invest Ophthalmol Vis Sci. 42 (12), 2924-2934 (2001).
- Spassov, A., et al. Differential expression of myosin heavy chain isoforms in the masticatory muscles of dystrophin-deficient mice. Eur J Orthod. , ciq113 (2010).
- Lever, T. E., et al. Videofluoroscopic Validation of a Translational Murine Model of Presbyphagia. Dysphagia. 30 (3), 328-342 (2015).
- Gantois, I., et al. Ablation of D1 dopamine receptor-expressing cells generates mice with seizures, dystonia, hyperactivity, and impaired oral behavior. Proc Natl Acad Sci. 104 (10), 4182-4187 (2007).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены