Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Пример извлечения и одновременного хроматографического Quantitation доксорубицин и митомицин C после доставки наркотиков комбинации в наночастиц опухоли подшипник мышей
В этой статье
Резюме
Этот протокол описывает эффективный и удобный аналитический процесс извлечения образца и одновременное определение несколько препаратов, доксорубицин (DOX), митомицин C (MMC) и кардио токсичных DOX метаболит, doxorubicinol (DOXol), в биологическом образцы из модели доклинические груди опухоль лечить с помощью наночастиц формулировки синергетический наркотиков комбинации.
Аннотация
Комбинированная химиотерапия часто используется в клинике для лечения рака; Однако связанные неблагоприятные эффекты для нормальной ткани может ограничить его терапевтический эффект. Было показано, что препарат на основе наночастиц сочетание смягчить проблемы, с которыми сталкиваются бесплатные наркотиками комбинированной терапии. Наши предыдущие исследования имеют показали, что сочетание двух противоопухолевых препаратов, доксорубицин (DOX) и митомицин C (MMC), производится синергетический эффект против обоих мышиных и рака молочной железы человека клетки в пробирке. DOX и MMC совместно загружен полимер липидов гибрид наночастиц (DMPLN) обходить различные насосы транспортер измеряем, которые наделяют множественной лекарственной устойчивости и продемонстрировал расширение эффективности модели опухоли груди. По сравнению с обычными решение формы, такие превосходной эффективности DMPLN приписывали синхронизированных фармакокинетики DOX и MMC и биодоступность внутриклеточных наркотиков в течение опухолевых клеток, включаемые nanocarrier PLN.
Для оценки фармакокинетики и био распределение совместно ведении DOX и MMC в свободное решение и наночастиц формы, метод анализа множественной лекарственной простой и эффективной помощью реверс фаза высокоэффективной жидкостной хроматографии (ВЭЖХ) был разработано. В отличие от сообщалось ранее методы, которые проанализированы DOX или MMC индивидуально в плазме этот новый метод ВЭЖХ имеет возможность одновременно quantitate DOX, MMC и основной метаболит DOX кардио токсичные, doxorubicinol (DOXol), в различных биологических матрицы ( Например, цельной крови, опухоли груди и сердце). Двойной флуоресцентные и ультрафиолетов абсорбирующий зонд 4-methylumbelliferone (4-му) был использован как внутренний стандарт (и.с.) для обнаружения одношаговый несколько анализа наркотиков с обнаружения различных длинах волн. Этот метод был успешно применен для определения концентрации DOX и MMC наночастиц и решения подходов в цельной крови и различных тканей в мышиных модели ортотопическая опухоли молочной железы. Аналитический метод представил является полезным инструментом для предварительного клинического анализа на основе наночастиц доставки наркотиков комбинаций.
Введение
Химиотерапия является механизм первичного лечения для многих видов рака, но это часто связано с серьезные неблагоприятные эффекты и ограниченной эффективности благодаря лекарственной устойчивости и другие факторы1,2,3. Чтобы улучшить результаты химиотерапии, получающим комбинации были применены в клинике, основанные на соображениях, таких как non перекроя токсичность, различные механизмы действия препарата и не крест наркотиков сопротивления4,5 , 6. в клинических испытаниях, лучше скорость реакции опухоли часто наблюдалось одновременное использование управляемых комбинации препаратов, по сравнению с режима последовательного наркотиков доставки7,8. Однако благодаря субоптимальных био распределение свободного лекарственных форм, одновременного введения нескольких препаратов может привести к выдающихся нормальной ткани токсичности, что перевешивает терапевтического эффекта9,10,11. Было показано, что доставки лекарств на основе Nanocarrier изменить фармакокинетики и био распределение инкапсулированные наркотиков, повышение опухоли целевые накопления12,,1314. Как указывалось в наших последних статей, наночастицы, совместно загружен с наркотиков синергических сочетаний продемонстрировали возможность смягчить проблемы, с которыми свободного препарата комбинации, из-за их контролируемые временных и пространственных Сопредседатель поставки несколько препаратов в опухолевой ткани, позволяя наркотиков синергических эффектов против рака клеток4,,1516. В результате Улучшенный терапевтической эффективности и низкой токсичности были продемонстрированы в обоих доклинических и клинических исследований по4,17,18.
Наши предыдущие в vitro исследования обнаружили, что сочетание двух противоопухолевых препаратов, доксорубицин (DOX) и митомицин C (MMC), производится синергетический эффект против нескольких линий клеток рака молочной железы и, Кроме того, совместно Загрузка DOX MMC в рамках наночастицы гибридный полимер липидов (DMPLN) преодолевал различные множественной лекарственной устойчивостью связанные измеряем насосы (например, Р-гликопротеина и рака устойчив белка молочной железы)19,20,21. В естественных условиях, DMPLN позволило пространственно временных Сопредседатель доставку DOX MMC опухоли сайты и увеличение биодоступность препаратов в раковые клетки, как указано в умеренности формирования DOX метаболит doxorubicinol (DOXol)22. В результате DMPLN повышение апоптоз клеток опухоли, торможение роста опухоли и длительного пребывания выживания, по сравнению с свободной комбинации DOX и MMC или липосомальных DOX формулировка22,23,24, 25.
Анализируя фактическое количество наркотиков, совместно поставленный nanocarrier имеет решающее значение для разработки эффективных наночастиц составов. Многие методы были разработаны для анализа уровня плазмы от разовых доз DOX или MMC, с помощью высокопроизводительной жидкостной хроматографии (ВЭЖХ) самостоятельно или в сочетании с масс-спектрометрия (МС)26,27,28 , 29 , 30 , 31 , 32 , 33 , 34. Однако, эти методы зачастую длительным и непрактичным для комбинированной терапии как большое количество биологических образцов должны подготавливаться отдельно для анализа нескольких препаратов (иногда включая наркотиков метаболитов). В дополнение к сильным связывание с белками плазмы DOX и MMC, красные кровяные клетки также имеют большой потенциал для привязки и сконцентрировать Многие противораковые препараты35,36. Таким образом анализ плазмы для DOX или MMC может запутывать фактические крови концентрации наркотиков. Настоящая работа (рис. 1) описывает простой и надежный несколько наркотиков анализа методом обратной фазы ВЭЖХ одновременно извлекать и quantitate DOX, MMC и DOX метаболит doxorubicinol (DOXol) от цельной крови и различных тканей ( Например, опухолей). Она успешно применяется для определения фармакокинетики и био распределение DOX и MMC, а также формирование DOXol после доставки лекарств через бесплатные решения или наночастиц формы (т.е., DMPLN и липосомальных DOX) в orthotopically имплантированных модель мыши мышиных опухоли молочной железы после внутривенного введения (и.в.) инъекций22.
протокол
все эксперименты на животных были одобрены животное уход из университета здоровья сети Комитета в институте рака Онтарио и проводились в соответствии с канадского Совета по животных уход руководство.
1. Биологическая подготовка образца
- сбор цельной крови, главных органов и груди опухоль на заранее время очки после внутривенного введения (и.в.) приема препарата, содержащего формулировки (например, DMPLN, липосомальных DOX)
- придать груди опухоль подшипник мыши и.в. подготовленные наркотиков содержащих формулировку.
- Анестезировать мыши на назначенный-моменты времени (например, 15 мин), давая ингаляции 2% изофлюрановая в герметичной камере.
- Заложить наркотизированных мышь на его спине и положил его нос через Стволы пожарные, которая постоянно поставляет 2% изофлюрановая.
Примечание: Для обеспечения мыши подвергается глубокой анестезии, аккуратно Сожмите носовой конечностей и искать любые twitching движения мыши. - Тщательно очистить груди и живота регионов, с использованием 70% этанола, а затем выполнить терминала процедура сердечной проколов на глубокую наркотизированных мышей с использованием гепаринизированным 1 мл шприц и иглу 23 G. Гепарин
- сбор цельной крови в обозначенные натрия распыляется пластиковой трубки и слегка взболтать трубки обеспечить сбор цельной крови соприкасается с покрытием гепарина стенки трубы. Соберите как минимум 50 мкл цельной крови. Всегда держать образцы на льду
- Лента все четыре конечности, мыши, чтобы обеспечить его и открыть брюшной полости и грудной клетки мыши, используя пару ножниц и пинцет. Сдвиг в сторону кишечника и толкать вверх подвергать достаточно воротной вены печени. Вырезать воротной вены для стока крови.
- Perfuse весь мыши тело с 50 мл ледяной 0,9% физиологического раствора через сердце, используя шприц 10 мл с иглой 25 Г.
Примечание: Согнуть иглу под углом 90° для руководства шприц в воротной вены. - Акцизных органов в следующем порядке: сердца, легких, печени, селезенки, почек. Затем отдельно опухоли молочной железы от окружающих соединительной ткани, используя разрез ножницы в правой молочной железы жировой ткани мыши. Собрать все органы индивидуально в 1,5 мл полипропиленовые трубы и быстро заморозить их в жидком азоте.
Примечание: отдельные желчного пузыря от печени. - Хранения цельной крови на 4 ° C и подакцизным тканей в морозильной камере-80 ° C до последующего анализа ВЭЖХ.
- Экстракт DOX, MMC и DOXol от биологической матрицы.
- Взвесить все замороженные расчлененных ткани быстро и перенести их в 13 мл округлены нижней конической трубки. Чтобы избежать возможных наркотиков метаболизм или деградации, держать образцы на ice.
- Добавить 1-5 мл буфера lysis ледяной клеток в пробирку.
Примечание: Объем буфера для использования зависит от веса ткани, основанные на соотношении ткани буфер 1 g: 5 мл (w/v); для небольших органов, например сердца и селезенки, соотношение составляет 1 g: 2мл. - Использовать движение вверх вниз инсульта для гомогенизации образцы тканей на льду со скоростью 18000 об/мин, с использованием электрического ручного гомогенизатор.
Примечание: Завершенные гомогенизации требуется примерно 3-5 итераций процесса короткий гомогенизации менее чем 15 s, следуют ткани охлаждения над льдом между каждой короткой гомогенизации. - Мыть 10 мм пилообразному генератор зонда гомогенизатор с дистиллированной деионизированной (DDI) H 2 O, этанол 70%, а затем DDI H 2 O между каждый образец ткани, чтобы избежать перекрестного загрязнения.
- Передачи 50 мкл огневки ткани или цельной крови в 1,5 мл полипропиленовые микро пластиковых пробирок и Спайк с 5 мкл внутреннего стандарта (и.с.) 4-methylumbelliferone (4-му) (2000 нг/мл) в трубку.
Примечание: 4-му решения был подготовлен в метаноле здесь. - Добавить 250 мкл ледяной экстракции растворителем в пробирку, содержащую цельной крови или тканей огневки.
Примечание: Экстракции растворителем состоит из 60% Ацетонитрил (АКС) и 40% аммония ацетат (5 мм) с pH скорректирована с рН = 3.5 с помощью 0,05% муравьиной кислоты. Используйте образец (v/v) 1:5: экстракции растворителем соотношение объема. - Энергично вихревой смеси на 2 мин, центрифуги на 3000 x g силы на 4 o C на 10 мин и пипетки 200 мкл супернатант в другой предварительно охлажденные свежие микро пластиковых пробирок.
- Испарится супернатант при 60 ° C под медленный поток газа азота с защитой от света.
- Воссоздать засохшие остатки с 100 мкл ледяной метанола, энергично вихрь 30 s и центрифуги на 3000 x g при 4 ° C для еще 5 минут
- Передача супернатант в вставке флакон ВЭЖХ и поместить образец флаконов в автоматический пробоотборник лоток для инъекций.
2. ВЭЖХ инструментария и параметры операции
- подготовить ВЭЖХ мобильный фазы с последовательной воспроизводимость
- мера 500 мл ВЭЖХ класса H 2 O, с помощью мерного цилиндра.
- Мера 500 мл ВЭЖХ класс Ацетонитрил (ACN) с помощью отдельного мензурку.
- Тщательно добавить 0,5 мл trifluoroacetic кислоты (ТФК) (осторожно) в каждый из 500 мл, H 2 O и АКС для получения мобильных фазы H 2 O и АКС, содержащие 0,1% TFA, соответственно.
Примечание: TFA токсичные и коррозионные и должны быть обработаны под лаборатории зонта. Все жидкостной смеси готовятся при комнатной температуре. - Подвижных фазах фильтра через фильтр мембраны нейлона с 0,45 мкм размер пор и перенести его в чистые бутылки водохранилище ВЭЖХ.
- Set-up ВЭЖХ инструментария для одновременного обнаружения DOX, MMC и DOXol и и.с. 4-му.
- Переключение на градиент насос, де Гассер, авто сборники, массив фотодиод детектор и детектор флуоресценции multi λ.
- Ввода начальных условий мобильных фазового состава до 16,5% H 2 O (0,1% TFA) и 83,5% АКС (0,1% TFA) (v/v).
- Установка УФ детектор на двух каналах, один на 310 Нм для 4-му (и.с.), а другой на 360 Нм для MMC.
- Установить детектор флуоресценции на двух каналах, один на λ ex / λ ет = 365/445 Нм для 4-му и другой на λ ex / λ ет = 480 Нм/560 Нм для DOX и DOXol, соответственно.
- Задать скорость потока Изократические 1,0 мл/мин
- Сбалансировать столбец 18 предустановленных обратная фаза C (4,6 мм x 250 мм, 5 мкм) при комнатной температуре за 10 мин для создания базовых.
- Отдельные препараты (DOX MMC, DOXol и 4-му), с использованием градиента мобильный фаза состояния.
- Inject 15 мкл извлеченные и повторно сосредоточены образцов, с помощью авто сборники.
- Постепенно изменить исходное состояние мобильного фазы (см. Протокол шаг 2.2.2) до 100% АКС (0,1% TFA) свыше 18 мин с использованием автоматизированных градиент насос.
Примечание: Во время процесса разъединения, четырех каналов (два УФ абсорбента и две люминесцентные) появляются одновременно с каждым каналом, отображение одного препарата соединения (см. шаг протокол 2.2.3 и 2.2.4). - Сохранить 100% АКС (0,1% TFA) за 1 мин и затем вернуться к начальной фазе мобильных состояния в течение 1 мин
- Повторно состояние столбца с первоначальный этап мобильных скоростью потока 1,5 мл/мин на 4 мин для следующей инъекции образца.
3. ВЭЖХ проверки
- подготовить стандарты работы DOX, MMC и DOXol и 4-му (и.с.).
- Весят отдельно 1 мг порошка для MMC и DOX наркотиков (осторожно) и 4-му на свежий, малым весом бумаги (3 x 3 дюйма 2).
Обратите внимание, что все противораковые препараты считаются опасность для здоровья, что может привести к острой токсичности и зародышевых клеток мутагенность вдыхания или проглатывания. Они должны быть тщательно обработаны с перчаток и масок. - Передачи весил DOX, MMC и 4-му в новых индивидуальных 1,5 мл полипропиленовые микро пластиковых пробирок.
- Добавляют 1 мл метамфетаминAnol и вихревой кратко для получения 1 мг/мл, концентрация DOX и MMC.
- Добавить 1 мл метанола во флакон, содержащий предварительно взвешенный 1 мг DOXol (осторожно) и вихревой кратко для получения 1 мг/мл концентрация DOXol.
Примечание: DOXol является метаболитом кардио токсичных и должны быть обработаны тщательно. - Пипетку 20 мкл подготовленных запасов решений DOX, MMC, DOXol и 4-му в новый отдельный 1,5 мл полипропиленовые микро пластиковых пробирок и 980 мкл метанола для получения рабочей стандарт 20 мкг/мл каждого препарата.
- Развести 20 мкг/мл DOX, MMC и DOXol с использованием метанола для получения рабочих стандартов 50 нг - 20 мкг/мл для DOX, MMC и DOXol и 2000 нг/мл по 4-му И.С.
- Уплотнение крышку трубки рабочих растворов с узкой кусок парафина пленки покрытия для предотвращения испарения метанола, обернуть весь трубы с алюминиевой фольгой, чтобы избежать воздействия прямого света и хранить при -20 ° с.
- Весят отдельно 1 мг порошка для MMC и DOX наркотиков (осторожно) и 4-му на свежий, малым весом бумаги (3 x 3 дюйма 2).
- Определить, линейность, точности и точности DOX, MMC и DOXol в биологических матрицы (т.е., цельной крови и опухоли огневки).
- Одновременно Спайк 5 мкл рабочих стандартов DOX и DOXol (50 нг/мл - 20 мкг/мл), MMC (1000 нг/мл - 16 мкг/мл) и 4-му (2 мкг/мл) в 50 мкл пустых цельной крови или тканей огневки в полипропиленовые микро-пробирок для получения кривой стандартной концентрации, начиная от 5-2000 нг/мл препарата соединений и 200 нг/мл по 4-му (и.с.).
- Выполнения наркотиков извлечения assay описано в протоколе 1.2.
- Использовать низкой, средней и высокой концентрации DOX и DOXol (50, 500 и 2000 нг/мл) и MMC (100, 1000, 2000 нг/мл) за день внутри и между точностью и правильностью.
Примечание: Подготовьте свежие стандартной концентрации в день анализа.
- Анализ образцов
- Inject 15 мкл пример, с помощью авто сборники.
- Постепенно изменить подвижная фаза более 0 до 18 мин, увеличивая состав ACN на интервале.
- После 18 мин, держите состояние мобильных фазы за 1 мин
- Вернуться в исходное состояние над следующей 2 мин, затем заново сбалансировать для 4 мин до следующей инъекцией.
- После каждого запуска образца, обратите внимание, что пики наркотиков соединений с их срок хранения отображаются как следовать: MMC, DOXol, 4-му (и.с.) и DOX.
- Интегрировать пик площадь под кривой (AUC) наркотиков соединений с помощью программного обеспечения ВЭЖХ.
- Расчета AUC соотношение между отдельными наркотиков составные и и.с. (уравнение 1) и использовать стандартные кривые, подготовленные в соответствии с теми же процедурами извлечения для определения концентрации наркотиков DOX, MMC и DOXol в разработке DMPLN.
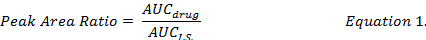
- вычислить процент восстановления наркотиков (уравнение 2) путем сравнения концентрации наркотиков, воссоздана с использованием метанола из экстрактов шипами биологических образцов, стандарта (" аккуратно ") наркотиков решение в метаноле.
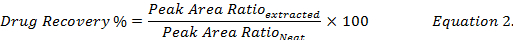
Результаты
Два противораковые препараты, DOX и MMC, а также DOX метаболит, DOXol, одновременно были обнаружены без биологического вмешательства в условиях же прикладной градиента ВЭЖХ с помощью 4-му как и.с. для флуоресценции и УФ-детекторы. DOX, MMC, DOXol и 4-му были хорошо отделены друг от друг...
Обсуждение
По сравнению с другими Хроматографические методы, позволяющие обнаружения одного препарата видов в то время, настоящий Протокол ВЭЖХ имеет возможность одновременно quantitate три препарата соединений (DOX, MMC и DOXol) в той же биологической матрицы без необходимости изменения Подвижная фаза. Э?...
Раскрытие информации
Авторы не имеют финансовых интересов и конфликтов интересов.
Благодарности
Авторы с благодарностью признают оборудования грант от естественных наук и инженерных исследований (СЕНТИ) Совет Канады для ВЭЖХ, эксплуатации грант от Канадского института медицинских исследований (КНИИЗ) и канадских исследований рака молочной железы (CBCR) Альянс X.Y. Ву и Университет Торонто стипендию на Чжан R.X. и т. Чжан.
Материалы
| Name | Company | Catalog Number | Comments |
| Doxorubicin | Polymed Theraeutics | 111023 | Anticancer drug |
| Mitomycin C | Polymed Theraeutics | 060814 | Anticancer drug |
| Doxorubicinol (DOXol) | Toronto Research Chemicals | D558020 | Metabolite of DOX |
| 4-Methylumbelliferone sodium salt | Sigma-Aldrich | M1508 | Internal standard |
| Myristic Acid | Sigma-Aldrich | 544-63-8 | Materials for poly-lipid hybrid nanoparticles |
| Polyoxyethylene (100) Stearate | Spectrum | M1402 | Materials for poly-lipid hybrid nanoparticles |
| Polyoxyethylene (40) Stearate | Sigma-Aldrich | P3440 | Materials for poly-lipid hybrid nanoparticles |
| Pluronic F68 (PF68) | BASF Corp. | 9003-11-6 | Materials for poly-lipid hybrid nanoparticles |
| Ultrasonication (UP100H) | Hielscher, Ultrasound Technology | NA | Nanoparticle preparation |
| Water Bath (ISOTEMP 3016HS) | Fisher Scientific | NA | Nanoparticle preparation |
| Liposomal Doxorubicin (Caelyx) | Janssen | Purchased from the pharmacy Princess Margaret Hospital | Clinically-approved nanoparticle formulation |
| HPLC-graded Methanol | Caledon Chemicals | 6701-7-40 | HPLC mobile phase composition |
| HPLC-graded H2O | Caledon Chemicals | 8801-7-40 | HPLC mobile phase composition |
| HPLC-graded Acetonitrile | Caledon Chemicals | 1401-7-40 | HPLC mobile phase composition |
| Trifluoroacetic Acid | Sigma-Aldrich | 302031 | HPLC mobile phase composition |
| 0.45 μm Nylon Membrane Filter Paper | Whatman | WHA7404004 | HPLC mobile phase preparation |
| 1cc Plastic Syringes | Becton, Dickinson and Company | 2606-309659 | Treatment injection |
| 5cc Plastic Syringes | Becton, Dickinson and Company | 2608-309646 | Tissue collections |
| 30G 1/2 Needles | Becton, Dickinson and Company | 305106 | Treatment injection |
| 25G 5/8 Needles | Becton, Dickinson and Company | 305122 | Tissue collections |
| Sterile 0.9% Saline | Univeristy of Toronto House Brand | 1011 | Tissue perfusion |
| 13 ml Rounded-bottom conical tube | SARSTEDT | 62.515.006 | Prolyprolene, tissue homogenization |
| Alpha Minimum Essential Medium (MEM) | Gibco | 12571063 | Cell medium |
| 1 x Phosphate Buffer Saline | Gibco | 10010023 | Tissue homogenization |
| Triton X-100 | Sigma-Aldrich | X100-100 ML | Tissue homogenization |
| Formic acid | Caledon Chemicals | 1/5/3840 | Adjust pH for extraction solvent |
| Sodium heparin sprayed plastic tubes | Becton, Dickinson and Company | 367878 | Blood collection |
| Analytical Weigh Balance | Sartorius | CPA225D | NA |
| pH meters | Fisher Scientific | 13-637-671 | accumet BASIC |
| Vortex Mixter | Fisher Scientific | 02-215-365 | Vortexing samples at desired speed |
| 1.5 ml Microcentrifuge Tube | Fisherbrand | 2043-05408129 | Prolyprolene |
| Model 1000 homogenizer | Fisher Scientific | 08-451-672 | Tissue homogenization |
| Centrifuge 5702R | Eppendorf | 5702R | Extraction preparation |
| Heated Evaporator System | Glas-Col | NA | Sample reconstitution |
| HPLC Screw Thread Vials | DIKMA | 5320 | HPLC sample injection |
| HPLC Screw Caps with PTFE White Silicone Septa | DIKMA | 5325 | HPLC sample injection |
| HPLC Polypropylene Insert | Agilent Technologies | 5182-0549 | Maximum volume 250 μl, HPLC sample injection |
| Xbridge C18 Column | Waters Corporation | 186003117 | Drug analysis |
| Gradient pump | Waters Corporation | W600 | Drug analysis |
| Auto-sampler | Waters Corporation | W2707 | Drug analysis |
| Photodiode array detector | Waters Corporation | W2998 | Drug analysis |
| Multi λ fluoresence detector | Waters Corporation | W2475 | Drug analysis |
| EMPOWER 2 | Waters Corporation | NA | Data analysis software |
| Scientist | Micromath | NA | Pharmacokinetic analysis |
| Female Balb/c Mice | Jackson Laboratory | 001026 | In vivo |
| EMT6/WT Breast Cancer Cells | Provided by Dr. Ian Tannock; Ontario Cancer Institute | NA | In vivo |
Ссылки
- Holohan, C., Van Schaeybroeck, S., Longley, D. B., Johnston, P. G. Cancer Drug Resistance: An Evolving Paradigm. Nat. Rev. Cancer. 13 (10), 714-726 (2013).
- Szakacs, G., Paterson, J. K., Ludwig, J. A., Booth-Genthe, C., Gottesman, M. M. Targeting Multidrug Resistance in Cancer. Nat Rev Drug Discov. 5 (3), 219-234 (2006).
- Kong, A. -. N. T., Kong, A. .. N. .. T. .. ,. . Inflammation, Oxidative Stress, and Cancer: Dietary Approaches for Cancer Prevention. , (2013).
- Zhang, R. X., Wong, H. L., Xue, H. Y., Eoh, J. Y., Wu, X. Y. Nanomedicine of Synergistic Drug Combinations for Cancer Therapy - Strategies and Perspectives. J Control Release. 240, 489-503 (2016).
- Webster, R. M. Combination Therapies in Oncology. Nat. Rev. Drug. Discov. 15 (2), 81-82 (2016).
- Waterhouse, D. N., Gelmon, K. A., Klasa, R., Chi, K., Huntsman, D., Ramsay, E., Wasan, E., Edwards, L., Tucker, C., Zastre, J., Wang, Y. Z., Yapp, D., Dragowska, W., Dunn, S., Dedhar, S., Bally, M. B. Development and Assessment of Conventional and Targeted Drug Combinations for Use in the Treatment of Aggressive Breast Cancers. Curr Cancer Drug Targets. 6 (6), 455-489 (2006).
- Cancello, G., Bagnardi, V., Sangalli, C., Montagna, E., Dellapasqua, S., Sporchia, A., Iorfida, M., Viale, G., Barberis, M., Veronesi, P., Luini, A., Intra, M., Goldhirsch, A., Colleoni, M. Phase Ii Study with Epirubicin, Cisplatin, and Infusional Fluorouracil Followed by Weekly Paclitaxel with Metronomic Cyclophosphamide as a Preoperative Treatment of Triple-Negative Breast Cancer. Clin Breast Cancer. 15 (4), 259-265 (2015).
- Masuda, N., Higaki, K., Takano, T., Matsunami, N., Morimoto, T., Ohtani, S., Mizutani, M., Miyamoto, T., Kuroi, K., Ohno, S., Morita, S., Toi, M. A Phase Ii Study of Metronomic Paclitaxel/Cyclophosphamide/Capecitabine Followed by 5-Fluorouracil/Epirubicin/Cyclophosphamide as Preoperative Chemotherapy for Triple-Negative or Low Hormone Receptor Expressing/Her2-Negative Primary Breast Cancer. Cancer Chemother Pharmacol. 74 (2), 229-238 (2014).
- Carrick, S., Parker, S., Thornton, C. E., Ghersi, D., Simes, J., Wilcken, N. Single Agent Versus Combination Chemotherapy for Metastatic Breast Cancer. Cochrane Database Syst Rev. 15 (2), 003372 (2009).
- Cardoso, F., Bedard, P. L., Winer, E. P., Pagani, O., Senkus-Konefka, E., Fallowfield, L. J., Kyriakides, S., Costa, A., Cufer, T., Albain, K. S., Force, E. -. M. T. International Guidelines for Management of Metastatic Breast Cancer: Combination Vs Sequential Single-Agent Chemotherapy. J Natl Cancer Inst. 101 (17), 1174-1181 (2009).
- Alba, E., Martin, M., Ramos, M., Adrover, E., Balil, A., Jara, C., Barnadas, A., Fernandez-Aramburo, A., Sanchez-Rovira, P., Amenedo, M., Casado, A. Multicenter Randomized Trial Comparing Sequential with Concomitant Administration of Doxorubicin and Docetaxel as First-Line Treatment of Metastatic Breast Cancer: A Spanish Breast Cancer Research Group (Geicam-9903) Phase Iii. J Clinn Oncol. 22 (13), 2587-2593 (2004).
- Sadat, S. M., Saeidnia, S., Nazarali, A. J., Haddadi, A. Nano-Pharmaceutical Formulations for Targeted Drug Delivery against Her2 in Breast Cancer. Curr. Cancer Drug Targets. 15 (1), 71-86 (2015).
- Devadasu, V. R., Wadsworth, R. M., Ravi Kumar, M. N. V. Tissue Localization of Nanoparticles Is Altered Due to Hypoxia Resulting in Poor Efficacy of Curcumin Nanoparticles in Pulmonary Hypertension. Eur. J. Pharm. Biopharm. 80 (3), 578-584 (2012).
- Li, S. D., Huang, L. Pharmacokinetics and Biodistribution of Nanoparticles. Mol. Pharm. 5 (4), 496-504 (2008).
- Zhang, R. X., Ahmed, T., Li, L. Y., Li, J., Abbasi, A. Z., Wu, X. Y. Design of Nanocarriers for Nanoscale Drug Delivery to Enhance Cancer Treatment Using Hybrid Polymer and Lipid Building Blocks. Nanoscale. 9 (4), 1334-1355 (2017).
- Wang, X., Li, S., Shi, Y., Chuan, X., Li, J., Zhong, T., Zhang, H., Dai, W., He, B., Zhang, Q. The Development of Site-Specific Drug Delivery Nanocarriers Based on Receptor Mediation. J. Control. Release. 193, 139-153 (2014).
- Batist, G., Gelmon, K. A., Chi, K. N., Miller, W. H., Chia, S. K., Mayer, L. D., Swenson, C. E., Janoff, A. S., Louie, A. C. Safety, Pharmacokinetics, and Efficacy of Cpx-1 Liposome Injection in Patients with Advanced Solid Tumors. Clin Cancer Res. 15 (2), 692-700 (2009).
- Mayer, L. D., Harasym, T. O., Tardi, P. G., Harasym, N. L., Shew, C. R., Johnstone, S. A., Ramsay, E. C., Bally, M. B., Janoff, A. S. Ratiometric Dosing of Anticancer Drug Combinations: Controlling Drug Ratios after Systemic Administration Regulates Therapeutic Activity in Tumor-Bearing Mice. Mol. Cancer Ther. 5 (7), 1854-1863 (2006).
- Prasad, P., Cheng, J., Shuhendler, A., Rauth, A. M., Wu, X. Y. A Novel Nanoparticle Formulation Overcomes Multiple Types of Membrane Efflux Pumps in Human Breast Cancer Cells. Drug Deliv Transl Res. 2 (2), 95-105 (2012).
- Shuhendler, A. J., Cheung, R. Y., Manias, J., Connor, A., Rauth, A. M., Wu, X. Y. A Novel Doxorubicin-Mitomycin C Co-Encapsulated Nanoparticle Formulation Exhibits Anti-Cancer Synergy in Multidrug Resistant Human Breast Cancer Cells. Breast Cancer Res Treat. 119 (2), 255-269 (2010).
- Shuhendler, A. J., O'Brien, P. J., Rauth, A. M., Wu, X. Y. On the Synergistic Effect of Doxorubicin and Mitomycin C against Breast Cancer Cells. Drug Metabol. Drug Interact. 22 (4), 201-233 (2007).
- Zhang, R. X., Cai, P., Zhang, T., Chen, K., Li, J., Cheng, J., Pang, K. S., Adissu, H. A., Rauth, A. M., Wu, X. Y. Polymer-Lipid Hybrid Nanoparticles Synchronize Pharmacokinetics of Co-Encapsulated Doxorubicin-Mitomycin C and Enable Their Spatiotemporal Co-Delivery and Local Bioavailability in Breast Tumor. Nanomedicine. 12 (5), 1279-1290 (2016).
- Zhang, T., Prasad, P., Cai, P., He, C., Shan, D., Rauth, A. M., Wu, X. Y. Dual-Targeted Hybrid Nanoparticles of Synergistic Drugs for Treating Lung Metastases of Triple Negative Breast Cancer in Mice. Acta Pharmacol Sin. , 1-13 (2017).
- Shuhendler, A. J., Prasad, P., Zhang, R. X., Amini, M. A., Sun, M., Liu, P. P., Bristow, R. G., Rauth, A. M., Wu, X. Y. Synergistic Nanoparticulate Drug Combination Overcomes Multidrug Resistance, Increases Efficacy, and Reduces Cardiotoxicity in a Nonimmunocompromised Breast Tumor Model. Mol Pharm. 11 (8), 2659-2674 (2014).
- Prasad, P., Shuhendler, A., Cai, P., Rauth, A. M., Wu, X. Y. Doxorubicin and Mitomycin C Co-Loaded Polymer-Lipid Hybrid Nanoparticles Inhibit Growth of Sensitive and Multidrug Resistant Human Mammary Tumor Xenografts. Cancer Lett. 334 (2), 263-273 (2013).
- Rafiei, P., Michel, D., Haddadi, A. Application of a Rapid Esi-Ms/Ms Method for Quantitative Analysis of Docetaxel in Polymeric Matrices of Plga and Plga-Peg Nanoparticles through Direct Injection to Mass Spectrometer. Am. J. Anal. Chem. 6 (2), 164-175 (2015).
- Daeihamed, M., Haeri, A., Dadashzadeh, S. A Simple and Sensitive Hplc Method for Fluorescence Quantitation of Doxorubicin in Micro-Volume Plasma: Applications to Pharmacokinetic Studies in Rats. Iran. J. Pharm. Res. 14, 33-42 (2015).
- Alhareth, K., Vauthier, C., Gueutin, C., Ponchel, G., Moussa, F. Hplc Quantification of Doxorubicin in Plasma and Tissues of Rats Treated with Doxorubicin Loaded Poly(Alkylcyanoacrylate) Nanoparticles. J. Chromatogr. B Analyt. Technol. Biomed. Life Sci. 887-888, 128-132 (2012).
- Al-Abd, A. M., Kim, N. H., Song, S. C., Lee, S. J., Kuh, H. J. A Simple Hplc Method for Doxorubicin in Plasma and Tissues of Nude Mice. Arch Pharm Res. 32 (4), 605-611 (2009).
- Loadman, P. M., Calabrese, C. R. Separation Methods for Anthraquinone Related Anti-Cancer Drugs. J. Chromatogr. B Biomed. Sci. Appl. 764 (1-2), 193-206 (2001).
- Zhang, Z. D., Guetens, G., De Boeck, G., Van Cauwenberghe, K., Maes, R. A., Ardiet, C., van Oosterom, A. T., Highley, M., de Bruijn, E. A., Tjaden, U. R. Simultaneous Determination of the Peptide-Mitomycin Kw-2149 and Its Metabolites in Plasma by High-Performance Liquid Chromatography. J. Chromatogr. B Biomed. Sci. Appl. 739 (2), 281-289 (2000).
- Alvarez-Cedron, L., Sayalero, M. L., Lanao, J. M. High-Performance Liquid Chromatographic Validated Assay of Doxorubicin in Rat Plasma and Tissues. J. Chromatogr. B Biomed. Sci. Appl. 721 (2), 271-278 (1999).
- Paroni, R., Arcelloni, C., De Vecchi, E., Fermo, I., Mauri, D., Colombo, R. Plasma Mitomycin C Concentrations Determined by Hplc Coupled to Solid-Phase Extraction. Clin. Chem. 43 (4), 615-618 (1997).
- Song, D., Au, J. L. Direct Injection Isocratic High-Performance Liquid Chromatographic Analysis of Mitomycin C in Plasma. J Chromatogr B Biomed Appl. 676 (1), 165-168 (1996).
- Schrijvers, D. Role of Red Blood Cells in Pharmacokinetics of Chemotherapeutic Agents. Clin. Pharmacokinet. 42 (9), 779-791 (2003).
- Colombo, T., Broggini, M., Garattini, S., Donelli, M. G. Differential Adriamycin Distribution to Blood Components. Eur. J. Drug Metab. Pharmacokinet. 6 (2), 115-122 (1981).
- Maeda, H., Nakamura, H., Fang, J. The Epr Effect for Macromolecular Drug Delivery to Solid Tumors: Improvement of Tumor Uptake, Lowering of Systemic Toxicity, and Distinct Tumor Imaging in Vivo. Adv. Drug Deliv. Rev. 65 (1), 71-79 (2013).
- Gustafson, D. L., Rastatter, J. C., Colombo, T., Long, M. E. Doxorubicin Pharmacokinetics: Macromolecule Binding, Metabolism, and Excretion in the Context of a Physiologic Model. J. Pharm. Sci. 91 (6), 1488-1501 (2002).
- Gabizon, A., Shiota, R., Papahadjopoulos, D. Pharmacokinetics and Tissue Distribution of Doxorubicin Encapsulated in Stable Liposomes with Long Circulation Times. J. Natl. Cancer Inst. 81 (19), 1484-1488 (1989).
- Motlagh, N. S., Parvin, P., Ghasemi, F., Atyabi, F. Fluorescence Properties of Several Chemotherapy Drugs: Doxorubicin, Paclitaxel and Bleomycin. Biomed Opt Express. 7 (6), 2400-2406 (2016).
- Mohan, P., Rapoport, N. Doxorubicin as a Molecular Nanotheranostic Agent: Effect of Doxorubicin Encapsulation in Micelles or Nanoemulsions on the Ultrasound-Mediated Intracellular Delivery and Nuclear Trafficking. Mol Pharm. 7 (6), 1959-1973 (2010).
- Cielecka-Piontek, J., Jelińska, A., Zając, M., Sobczak, M., Bartold, A., Oszczapowicz, I. A Comparison of the Stability of Doxorubicin and Daunorubicin in Solid State. J. Pharm. Biomed Anal. 50 (4), 576-579 (2009).
- Gilbert, C. M., McGeary, R. P., Filippich, L. J., Norris, R. L. G., Charles, B. G. Simultaneous Liquid Chromatographic Determination of Doxorubicin and Its Major Metabolite Doxorubicinol in Parrot Plasma. J. chromatogr. B Analyt. Technol. Biomed. Life sci. 826 (1-2), 273-276 (2005).
- Liu, Z. S., Li, Y. M., Jiang, S. X., Chen, L. R. Direct Injection Analysis of Mitomycin C in Biological Fluids by Multidemension High Performance Liquid Chromatography with a Micellar Mobile Phase. J. Liq. Chromatogr. Relat. Technol. 19 (8), 1255-1265 (1996).
- Zhou, Y., He, C., Chen, K., Ni, J., Cai, Y., Guo, X., Wu, X. Y. A New Method for Evaluating Actual Drug Release Kinetics of Nanoparticles inside Dialysis Devices Via Numerical Deconvolution. J. Control. Release. 243, 11-20 (2016).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены