Method Article
Создание личиночной данио рерио как модель животного к расследованию Trypanosoma cruzi подвижности In Vivo
* Эти авторы внесли равный вклад
В этой статье
Резюме
В настоящем Протоколе дневно обозначенных т. cruzi вводили в прозрачной данио рерио личинки, а паразит подвижности наблюдалось в естественных условиях с помощью микроскопии флуоресцирования света листа.
Аннотация
Болезнь Шагаса это паразитические инфекции, вызванные Trypanosoma cruzi, чьи моторики важно не только для локализации, но и для сотовых привязки и вторжения. Текущий животных моделей для исследования т. cruzi разрешить ограниченное наблюдение паразитов в естественных условиях, представляющий вызов для понимания поведения паразита на начальных этапах инфекции в организме человека. Этот простейших flagellar этап в вектор и млекопитающих хостов, но Есть никаких исследований, описывающих его подвижность в естественных условиях. Целью данного проекта было создать живой позвоночных zebrafish модель для оценки подвижности т. cruzi в сердечно-сосудистой системы. Прозрачные данио рерио, личинки вводили с дневно помечены trypomastigotes и наблюдается с помощью микроскопии флуоресцирования света листа (LSFM), неинвазивный метод визуализации живых организмов с высоким оптическим разрешением. Паразиты могут быть визуализированы для длительных периодов времени из-за этот метод относительно низкий риск по сравнению с конфокальный фотоповреждения или микроскопия помощью эпифлуоресцентного. Т. cruzi паразитов были замечены, путешествуя в системе кровообращения, живые рыбки данио рерио в разных размеров кровеносных сосудов и желток. Они могут также рассматриваться прилагаемый к стенке желточного мешка и предсердно клапан несмотря на мощные силы, связанные с сокращениями сердца. LSFM т. cruzi-привитых данио рерио личинок-это ценный метод, который может использоваться для визуализации, распространение паразитов и оценивать их тропизма, миграции и подвижности в динамической среде сердечно-сосудистой системы живых животных.
Введение
Болезнь Шагаса вызвано простейших паразитов т. cruzi. Примерно 6-7 миллионов человек во всем мире инфицированы т. cruzi. Заболевание передается главным образом в Латинской Америке, но уже сообщалось в Соединенные Штаты, Канада и многие европейские, а также некоторых стран Западной части Тихого океана, главным образом из-за миграции инфицированных лиц1. Шагаса в значительной степени трансмиссивных и переданы для людей контакта с калом hematophagic насекомых Триатомовые клопы подсемейства, широко известный как «целовать ошибок». Однако т. cruzi может также передаваться через переливание крови, вертикальная передача от матери ребенку, или употребление в пищу продуктов питания, загрязненных паразитов2. Острой фазе инфекции главным образом бессимптомно или конститутивно симптоматическая и длится от 6 до 8 недель, после чего участия иммунной системы контролирует паразита нагрузки, но не полностью устранить инфекции3. Большинство людей введите хронической бессимптомной фазы; Однако почти 30% больных разработать симптомом хронической фазы, в котором сердечно-сосудистой системы и реже пищеварительной и нервной систем, нарушенной4. Этот сценарий представляет собой проблему для лечения заболеваний и управления, поскольку Есть нет вакцины, и есть только два эффективных препаратов для Шагаса: benznidazole и нифуртимокс. Обе процедуры требуют длительного администрирования и может иметь серьезные побочные эффекты2.
Возросшее понимание поведения т. cruzi поведения в естественных условиях является ключом к определению паразитарные миграции, сотовой вложения и вторжения в пределах принимающей страны; отсутствие в vivo моделей ограничивает развитие новых терапевтических подходов. В vitro исследования т. cruzi инфекции показали, что подвижность trypomastigotes имеет важное значение для привязки к принимающей клеточных мембран и последующих клеточных вторжения5. Энергии истощения в trypomastigotes в культуре совместно с линией клеток восприимчивых было показано, уменьшить сотовой вторжения6. Интересно, что в trypanosomatids, flagellar движение также характеризуется как уклонение механизм против паразитов специфические антитела7.
Flagellar подвижность был широко изучены в пробирке в Trypanosoma brucei, тесно связанных паразита, который вызывает Африканский трипаносомоз8. В vitro исследования моторики этих трипаносом показал, что моделирование условий кровью или жидкостями организма, в том числе вязкость и наличие препятствий, представитель клеток крови, имеет важное значение для паразита движение вперед9 . Как еще он не удалось визуализировать движение паразитов в крови в естественных условиях.
Данио рерио личинки являются мощной модели для изучения хост возбудитель взаимодействий в естественных условиях. Они являются небольшими, недорогой и относительно легко поднять по сравнению с другими установленными позвоночных моделями для болезни Шагаса. Данио рерио имеют врожденного и адаптивного иммунитета похожи на людей, но их адаптивной иммунной системы начинает развиваться на 4 дня пост оплодотворение (dpf) и не созрели для еще несколько недель10. Во время раннего развития когда присутствуют только макрофагов, есть большое окно для изучения поведения паразита без немедленного вмешательства иммунной10. Однако самое главное преимущество использования данио рерио личинки как позвоночных модель для изучения поведения возбудителя заключается в их оптической прозрачности, что делает их поддаются микроскопических скрининг и изображений11. Кроме того есть несколько инструментов для обработки рыбы генетики. К примеру Каспер штамм — мутант линия данио рерио с без пигментации, что делает животное полностью транспарентным и полезным для визуализации отдельных органов и для слежение в реальном времени вводили клетки12.
Основным ограничением продольных наблюдения быстро движущихся паразитов в живой данио рерио с помощью конфокальной или микроскопия помощью эпифлуоресцентного заключается в невозможности изображений на приобретение высокой скорости и глубины проникновения больших с хорошим качеством изображения и низкой риск повреждений. Легкие лист флуоресценции micsroscopy (LSFM) является формирующейся Тепловизионная техника, которая преодолевает эти ограничения разрешить эти замечания. С помощью одной цели для обнаружения флуоресценции и вторая цель ортогональных освещения, что только освещает фокальной плоскости обнаружения цели, это возможность получения высокого разрешения оптического разделы как Конфокальный микроскоп, но с значительно сниженным фотоповреждения, даже в том, что касается эпифлуоресцентного микроскопии13. LSFM техника, используемая здесь называют одной плоскости освещения микроскопии (SPIM), в которой тонкий лист света освещает одной плоскости в пределах данио рерио личинки.
Цель этой методологии является установить личиночной данио рерио как жизнеспособной модели-инфекции для понимания т. cruzi подвижности и связанное с ним поведение в естественных условиях. Для этого, мы вводили прозрачный данио рерио личинки дневно обозначенные trypomastigotes, сотовых форме ответственность за заражение людей и определили движение т. cruzi в сердечно-сосудистой системы циркуляции данио рерио с помощью LSFM.
протокол
следующие протоколы были одобрены институциональный уход животных и использование Комитета из Лос Андес университета (CICUAL). Биобезопасности уровня 2 (BSL-2) руководящие принципы строго следует использовать для предотвращения загрязнения с возбудителя т. cruzi.
Примечание: животных уход и обслуживание: Каспер данио рерио, генетически модифицированных штамм данио рерио (Danio rerio) используется в настоящем Протоколе, из-за их ценные оптической прозрачности на всех этапах развития. Рыба манипулировать, используя оптимальный уход мульти танк условий для видов 14, в 14 ч света-10 h темные цикла, 28 ± 1 ° C, pH (7,0-7,4) контролируемых рециркуляции воды системы. Животных кормят два раза в день с живой артемии (Artemia salina) и обогащенный выращивания продуктов питания. Все протоколы были одобрены CICUAL на Универсидад де-Лос-Андес (C.FUA_14-017).
1. Подготовка яйцо воды
0,6 г/Л- подготовить аквариум соли в обратный осмос (RO) или обессоленной воды (DI) и в решение добавьте Метиленовый синий 0,01 мг/Л.
Примечание: Измеренная проводимость должна быть 400-500 мкСм/см и рН уровня на 7,2-7,9. Чтобы снизить рН, аэрации воды яйцо на несколько часов.
2. Приготовление раствора фондовая Tricaine
- подготовить 0,4% tricaine раствор путем растворения 400 мг tricaine (MS-222) в 97,9 мл дистиллированной воды (ddH 2 O). После того, как порошок полностью не растворится, Отрегулируйте пэ-аш до 7.0 с помощью 2.1 мл 1 М трис (рН 9,0) и охладите решение.
3. Подготовка 1,0% температура плавления агарозы
- растворяют низких плавления точки агарозы порошок в яйце воде до конечной концентрации 1,0%. Нагреть смесь в микроволновую печь или на горячей плите с постоянно помешивая, пока представляется однородной агарозы решение.
- Хранить аликвоты на 4 ° C не более чем неделю.
4. Сопрягаемые пробирного и эмбриона коллекции
- за три дня до инъекции созданы вязки с помощью здорового пар мужской и женский рыбы в разведении танков. Обогащение с стеклянные шарики и искусственные растения повышает нереста. Вязки должна быть создана во второй половине и оставил на ночь.
- Следующее утро, собирать породил яйца, слива цистерны через ситечко и мойки яйца с водой яйцо. Удалите все яйца, инвертирование ситечко и наливание воды яйцо через стрейнер в чашку Петри. Сохранить эмбрионы здоровой, чистой их воды путем удаления любого мусора и мертвых эмбрионов с передачей Пластиковые пипетки.
- Переноса эмбрионов в инкубаторе при стабильной температуре 28,5 ° C позволяет развитие зародышей согласно данио рерио промежуточных стандартов 15. Изучить эмбрионы два раза в день и отбросить нежизнеспособные яйца, чтобы сохранить сцепление здоровым.
5. Эмбриона Dechorionation
Примечание: Эта процедура является обязательным, если эмбрионы не вылупились во время инъекции. В этой процедуре " личинок " животных из их Хорион от 48 h вперед вывесить оплодотворение (hpf).
- В день эксперимента, место Петри, содержащий здорового эмбриона под рассечения стереоскоп.
- Захватить противоположные концы хориона с двумя острыми щипцами (Дюмон #5), и нежно слезы и вытащить открыть хориона. Отражаются около 5-6, личинки внедряются в то время и, как правило, 3-4.
- Удалить chorions из воды, с помощью передачи пипетки.
6. Подготовка материала инъекций
- подготовить 1.0 мм иглы с помощью тонкой стенки капилляров стекла и микропипеткой съемник устройства со следующими параметрами: 2 легких весов 1 тяжелый вес, верхняя тяга 2 мм + 5 мм нижняя тяга, 75.9 ° C (шаг 1) + (78,2 ° C Шаг 2). Хранить иглы в чашке Петри на полосе глина моделирования. Идеальная игла должны иметь узкие подсказка, как т. cruzi измерения приблизительно 20 х 1-3 мкм и будет легко проходить через иглу. Может изменяться длина наконечника: длиннее подсказка является полезным для достижения более глубоких структур, но короче подсказка будет более жесткой, облегчая инъекции для пользователя.
Примечание: Размер кончика иглы зависит от температуры используется: более высокая температура для шага 2 приводит в кончик длиннее и тоньше. - Приготовляют раствор 1,5% агарозном ddH 2 O и залить его в 10 см Петри. Обложка на глубину приблизительно 1.0 см.
- Место сборных микроинъекции плесени над агарозы и позволить ему затвердеть.
- Поднимите сборных микроинъекции плесень и добавить яйца воды для хранения при 4 ° C. Это предотвращает высыхание агарозы.
- Добавить яйцо воды Стоковый раствор tricaine до конечной концентрации 150 мг/л. магазин на 4 ° C.
7. Клеточные культуры для паразита роста
- паразитов поддерживаются в линию клеток человека астроцитома (CRL-1718), с помощью метода, описанного в Варгас-Самбрано et al. 16
- начать культуры клеток человека в колбах культуры T25 (площадь = 25 см 2) на плотности тарелок 5 2 x 10 или 4 x 10 5 клеток в 4 мл среды RPMI 1640 с 10% сыворотки плода теленка (FCS), дополнены с 2 мм L-глютамином, глюкоза 4,5 г/Л, 10 мм HEPES, пируват 1 мм и 1% пенициллин стрептомицином (именуемые " завершить СМИ "). Инкубировать астроцитома культур при 37 ° C в среде 5% CO 2.
- Как только монослой вырожденная, отсоединить клетки, с помощью 2 мл 0,25% трипсина-ЭДТА, инкубации их за 3 мин при 37 ° C. визуально проверить клетки для отряда и блокировать решение трипсина, используя 3 мл RPMI 1640 с 10% FCS в 15 мл.
- Центрифуга суспензию клеток 5 мин в 1350 x g.
- Мыть результате сотовой Пелле в среде DMEM 15-мл пробирку и центрифуги для 5 мин на 1350 x g при 22 ° с.
- Подсчитать количество ячеек вручную в камере Нойбауэр и проверить жизнеспособность в световой микроскоп на 40 кратном.
- Нежно вновь приостановил сотовых пеллет в 4 мл полного средств массовой информации и использовать его для создания новых культур клеток, используя 2 x 10 5 клеток за флакон культуры T25.
8. Cruzi т. культура и маркировка
- паразиты являются штамм первоначально получены от зараженного человека и характеризуется как штамм (MHOM/CO/01/DA), т. cruzi да генотип TcI дискретного ввода блока (DTU) 16. После 3 или 4 суток культивирования, собирать движущихся паразитов от супернатант культуры клеток человека астроцитома и центрифуги для 5 мин в 1350 x g. отказаться от среднего.
Примечание: Паразитов в полной среды может использоваться для повторного культуры в соотношении 1:1 с астроцитома клеток в колбах культуры T25. - Аккуратно вновь приостановить Пелле в 10 мл стерильной 1 x Натрий-фосфатный буфер (PBS) с 0.1% FCS и центрифуги для 5 мин в 1350 x g.
- Удалить супернатант и вновь приостановить в 1 мл ФСБ. Возьмите 10 мкл для подсчета свободноплавающих паразитов в камере Нойбауэр.
- Взять остальные вновь приостановлено паразитов (990 мкл) и 1 мкл Карбоксифлуоресцеина диацетата SuccinimiDyl эфира (CFSE), конечной концентрации 5,0 мкм. инкубировать в течение 10 минут при комнатной температуре.
Примечание: CFSE запасов на 5 мм должны быть aliquoted и поддерживаться на уровне -20 ° с. - Гранулы паразитов (1350 x g, 5 мин). Воссоздания паразита Пелле, стряхивая трубки и стирать в 10 мл 1 x PBS-0.1% FCS следуют последующих спина (1350 x g, 5 мин).
- Удалить супернатант и нежно вновь приостановить Пелле помечены паразита в ПБС с соответствующим объемом для получения конечной концентрации около 10-20 паразитов/nL для инъекций.
- Использовать небольшой объем (∼ 10 мкл, примерно 1 x 10-4 -2 x 10 4 паразитов) из trypomastigotes оценить жизнеспособность и маркировки. Перевернутый флуоресцентным микроскопом может использоваться для прямой визуализации паразитов. В передаваемых света режиме проверьте, что паразиты двигаться. В режиме флуоресценции, используйте фильтр флуоресцеин Изотиоцианаты (FITC) для оценки паразита маркировки.
9. Инъекций данио рерио личинки
- загрузки паразита
- взять 10 мкл паразитов из ресуспендирования (100 мкл) и загрузить их в запаянные стеклянные иглы с помощью кончика пипетки 10 мкл microloader.
- Вставить иглу стекла в иглодержатель микроманипулятор, использовать магнитного стенд и место рядом с стереоскоп.
- Использование тонкой щипцы под стереоскоп, вырезать иглы, создавая тупым открыть конец и измерить размер капли для получения объем впрыска 1 nL (это эквивалентно шарик диаметром 0,12-0,13 мм при измерении в минеральное масло 17). Длиннее подсказка является предпочтительным, таким образом, чтобы игла может достигать структур глубоко внутри рыбы не повреждая ткани. В этом протоколе, используется тупой иглой, но среза иглы могут быть использованы также.
- Установка
- анестезировать личинки 48 hpf, с tricaine 150 мг/Л. Убедитесь, что они не отвечают на ощупь, но убедитесь, что сердце бьется.
- Место личинки в микроинъекции агарозы плесень в боковой позиции.
- Место иглодержатель рядом с Стереоскоп и отрегулировать микроманипулятор, таким образом, чтобы кончик иглы в центре поля зрения. Переместите Петри блюдо, приготовленное в шагах 6.2 - 6.4, так что личиночной желток близка кончик иглы. Проверить состояние личинка сохранения бьющееся сердце.
- Значения microinjector следующим образом: инъекции давление 9,6 фунтов на дюйм (psi); держать давление: 20 psi; 100 мс спектр стробирования; значение периода 1.9 (соответствует параметру 10,9 мс). Объем впрыска должно быть между 1-3 nL, с приблизительно 10-20 паразитов/nL.
10. Инъекции паразита
- Inject рыбы в Улучшенный передняя часть желток в воздуховод Кювье. Этот шаг следует практиковать обеспечить выживаемость животных после инъекции. Она занимает примерно 10 минут, успешно придать личинки 5-6.
- Как элемент управления, придать личинок 1-2 с того же объема транспортного средства (ПБС).
- Немедленно передать воде свежие яйца личинка.
11. LSFM монтаж из вводят личинки
- переноса личинок, вводится с паразитов к пустой Петри и тщательно удалить окружающие воды с пластиковых дозаторов и фильтровальную бумагу. Сразу же 100 мкл разогретой 1,0% низких плавления агарозы точки (см. шаг 3 для подготовки агарозы) для покрытия личинка. Обеспечить агарозы не более 40 ° C.
- Вставьте прямой провод внутри 1,0 мм стеклянный капилляр и использовать его как поршень, чтобы всосать вверх личинка в вертикальном положении. Убедитесь в том оставить небольшое количество агарозы выше личинка. Подождите, пока агарозы твердеет прежде чем подвергать личинка (это потребует несколько минут). При необходимости, вытолкнуть избыток агарозы ниже личинка и резать выкл
- Место капилляра в держателе образца микроскопа и вытолкнуть конца, содержащие личинки до тех пор, пока он висит свободно от капилляров. Образца камеры должны быть заполнены раствором tricaine (150 мг/Л) и температуры, установленной на 28 ° с.
- Положение личинка перед учеником обнаружения цели с помощью XYZ-микроманипулятор системы. Для вращения вокруг вертикальной оси используйте этап вращения. Позиционирование личинка должно быть сделано в передаваемых света режиме, чтобы четко определить личиночной структуры.
12. LSFM изображений из вводят паразитов
- изменения для флуоресценции режим и регулировать интенсивность освещения, а также время экспозиции для снижения фотоповреждения и оптимизировать время разрешение. Для этих конкретных экспериментов мы использовали мощностью 2,8-3,0 МВт для образца и подвергается каждый кадр для 200 мс, с помощью камеры с 6.45 мкм пикселей и ~ 70% Квантовая эффективность на длинах волн обнаружения. Эти параметры должны привести к надлежащим образом экспонированные снимки на около 5 кадров/s. Убедитесь, что использовать объективный с высоким возможным числовая апертура.
- Начать видео приобретение региона интерес (ROI). В нашем случае паразиты наблюдаются прилагаемый к клапанам и свободно движущихся вокруг области сердца. Рекомендуется взять видео одной плоскости с течением времени, или использовать систему микроманипулятор или пьезо гальво сосредоточить внимание различных плоскостях, в то время как паразит движется.
Примечание: Данная процедура полезна для коротких приобретение раз до 2 ч. Для приобретения в долгосрочной перспективе, личинки должны устанавливаться с помощью альтернативных методов 20.
13. Обработка изображений и анализ приобретенных данных
Примечание: обработка изображений была выполнена на персональном компьютере с 2,90 ГГц процессором, 8.00 ГБ оперативной памяти и видеокарта с 1.00 ГБ памяти.
- Открыть приобретенного набора данных в обработки изображений программное обеспечение по выбору. Открытое программное обеспечение Фиджи рекомендуется для LSFM обработки данных и анализа 21.
- В программное обеспечение анализа изображения, настроить уровни яркости и контраста для повышения изображений.
Примечание: Нет фиксированных параметров используется в данном случае, но при выборе " авто " параметр может быть полезен для получения первоначального расширение. - Выберите ROI.
Примечание: Для отслеживания отдельных паразитов, Фиджи имеет оба ручного и автоматического отслеживания плагины доступны.
14. Восстановление Imaged личинки
- Удалить личинки тщательно от агарозы с помощью тонкой щипцы и инструмент цикла волос. Передача рыбу обратно к воде свежие яйца и проверьте для восстановления после 15 минут возвращения личинка в инкубатор на 28 ± 0.5 ° C.
- В качестве альтернативы, переходите к усыпить фотосъемка личинки с передозировкой tricaine. Затем ввести личинок в раствор гипохлорита натрия (6,15% NaClO) на 5 минут, чтобы убить паразита. Распоряжаться согласно учреждение ' s стандартные протоколы.
Результаты
Оптимальные условия для инъекций:
Группы данио рерио личинок вводили на 24, 48, 72, 96 и 120 hpf, на различных анатомических участках и их выживание был рассмотрен каждый день в течение 5 дней. Через 5 дней после инъекции, эмбрионы вводят в 24 hpf имел 6,25% выживания (2/32), тогда как 95% (38/40) личинок, вводят в 48 hpf выжил. Как элемент управления личинки вводили с ПБС как транспортное средство. Не было выявлено различий в выживаемости между вводили транспортного средства и вводят паразита личинок, указывающее не зависящих от паразитических влияния на выживаемость рыбы (p = 0,08). Личинки, вводят между 72-120 hpf у постоянных инъекций объем сопоставимых выживаемости до 48 вводят hpf личинок. Для всех процедур, представленные здесь 48 hpf личинки были использованы из-за их легкости манипулирования и разработав органов и легко проницаемые кожи без очевидной повреждения после инъекции.
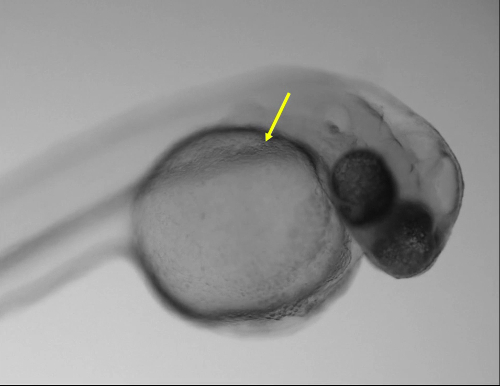
Личинки, вводят в 48 hpf были вводят в пространстве перикарда, хвост мышц, задний мозг желудочка, слуховой пузырек, Хорда и канальные Кювье в желточного мешка. Не наблюдалось разницы в выживании личинок, вводят на различных анатомических участках. Однако быстрый и простой региона придать был протока Кювье, расположенный в передней части желточного мешка (рис. 1, 1 кино). Инъекции в этом месте допускается введение более высоких объемах с более низкий риск травмы для жизненно важных структур. Кроме того между 24-72 hpf, этот регион является оптимальным сайт для прямого доступа к развивающихся сосудистую и сердце11.
Паразит визуализации с помощью LSFM:
В течение 8-10 мин после инъекции т. cruzi в протока Кювье паразиты были определены в zebrafish личинки, с помощью LSFM из-за их CFSE флуоресцентного сигнала и оптической прозрачности личинки. После прививки паразиты были замечены что либо придерживаться стен вокруг системы кровообращения или путешествие в направлении потока крови (рис. 2, рис. 3). Когда паразита остается прикрепленным к сердечной структуры, например предсердно клапан, она колеблется с сокращениями сердца, указав, что молекулярные механизмы для соблюдения паразитов может быть эффективным в нашей позвоночных модели (2 фильм, кино 3 Дополнительная кино 1). Т. cruzi также придерживаться стен личинок желточный мешок ( рис. 2, фильм 2), структура, которая будет впоследствии реабсорбируется и стать частью данио рерио кишечника22. Это может быть похож на то, что происходит на этапе хронических болезней в зараженных людей, где паразиты находятся в cardiomyocytes и пищеварительной системы нервной23,24. Когда не прилагается, паразиты дрейфовал через поток крови в том же направлении эритроцитов ( рис. 3, 4 кино). Паразитов можно наблюдать в различных судов размера рыбы, но были более обильны в пространство перикарда и в регионе рядом желток, содержащий поток крови ( рис. 2, рис. 3, Дополнительные фильм 2).
В 10 мин пост инъекций было более трудно пятно одиночные формы паразита из-за их распределение вдоль сосудистую и неспособность быстро экрана различных анатомических сайты рыбы из-за ограниченного поля зрения LSFM (на 40 кратном ). После 24 часов пост инъекции (hpi), CFSE сигнал начинает накапливаться в регионе рядом развивающихся кишечника (дополнительная цифра 1).

Рисунок 1: Оптимальные укола. (A) образ личинка 48 hpf показаны оптимальный укола на воздуховод Кювье (желтая стрелка) с помощью регулярных стереоскоп. (B) Magnified вид коробки в показаны протока Кювье (желтая стрелка). Шкалы бар = 200 мкм (A), 50 мкм (B). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
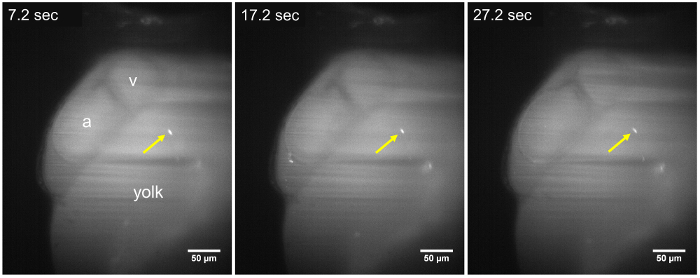
Рисунок 2: LSFM изображения статических паразита в 48 личинка hpf. Т. cruzi паразит (желтая стрелка) по-прежнему соблюдать стенок желточного мешка, на протяжении всего покадровой последовательности (7.2 s, 17,2 s и 27,2 s), около ~ 15 мин после инъекции паразита. Никаких изменений в позиции паразитов наблюдается в период приобретения по крайней мере 30 s. а, атриум; v, желудочка. Шкалы бар = 50 µm. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
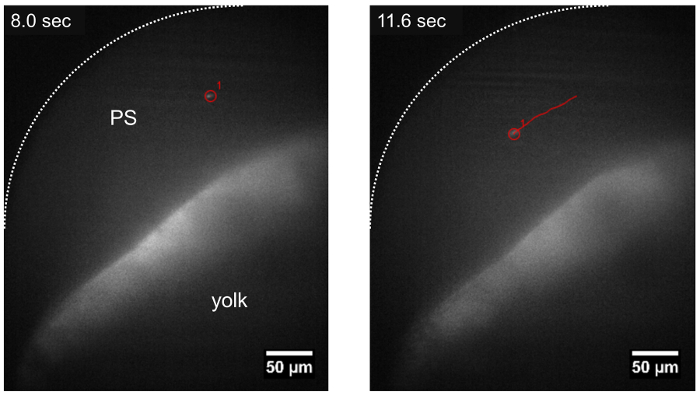
Рисунок 3: Траектории паразита путешествие в пространстве перикарда, используя LSFM. Т. cruzi паразит может отслеживаться во время дрейфа в пространстве перикарда (PS), после направления потока крови (трек, отображаются в красном цвете) около ~ 15 мин после инъекции паразита. Шкалы бар = 50 µm. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Фильм 1: Долина циркуляции крови желток в личинки 48 hpf. Кино личинки 48 hpf показаны Долина циркуляцию крови или протока Кювье, с помощью регулярного стереоскоп. Различных регионах сосредоточены во время видео, чтобы показать красных кровяных клеток, обеспечивая циркуляцию повсеместно в воздуховоде. Желтая стрелка показывает оптимальную укола. Фильм был записан около 10-15 мин после инъекции паразита. Пожалуйста, нажмите здесь, чтобы скачать видео,.
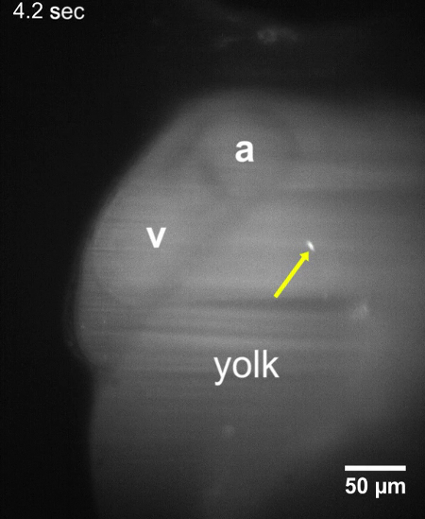
Фильм 2: Т. cruzi паразитов прилагается к стенам желточного мешка. LSFM фильм личинка 48 hpf показаны, что паразиты т. cruzi по-прежнему соблюдать желточного мешка около 10-15 мин после инъекции паразита. Никаких изменений в позиции паразита наблюдалось в период приобретения по крайней мере 30 s. а, атриум; v, желудочка. Пожалуйста, нажмите здесь, чтобы скачать видео,.

Фильм 3: Т. cruzi паразитов прилагается к стенкам сердца. Фильм LSFM личинки 48 hpf показаны remai паразитов, т. cruzi n присоединились к стенке сердечно-сосудистой системы, несмотря на сильное сердце схватки около 10-15 мин после инъекции паразита. Эритроцитов может наблюдаться как черный округлые тени. Пожалуйста, нажмите здесь, чтобы скачать видео,.

Фильм 4: паразитов, перемещение в пространстве перикарда. Фильм LSFM личинка 48 hpf показаны т. cruzi паразитов, дрейфующих в пространстве перикарда. Два паразитов могут быть прослежены в разное время точках (ID 1, красный круг, и ID 2 в желтом круге), после схожей траектории. Фильм был записан около 10-15 мин после инъекции паразита. Пожалуйста, нажмите здесь, чтобы скачать видео,.
Дополнительные рисунок 1: накопление CFSE флуоресцентного сигнала в желтке. Стереоскоп изображения larva wildtype вводят в 48 hpf на воздуховод Кювье. CFSE флуоресцентного сигнала постепенно накапливается в желтке, через два дня после инъекции (48 hpi). Шкалы бар = 500 мкм. пожалуйста, нажмите здесь, чтобы скачать рисунок.
Дополнительные фильм 1: паразитов прикреплены к стенам и клапаны системы кровообращения. Стереоскоп время серии изображений дикого типа личинки вводят в 48 hpf. Изображения взяты интервалом 0.2 s захвата т. cruzi паразитов в синхронности с сокращениями сердечной мышцы в предсердно клапан. Фильм был записан около 30 мин после инъекции паразита. Пожалуйста, нажмите здесь, чтобы скачать видео,.
Дополнительные фильм 2: перемещение и придерживался паразитов в перивентрикулярной пространстве и желток. Фильм LSFM личинка 48 hpf показаны т. cruzi паразитов дрейфующих или придерживаться перикарда пространства или желток. Представление передачи света было отмечено за первые 5 s. Флуоресценции мнение было отмечено с 5,2-25,8 s. Фильм был записан около 10-15 мин после инъекции паразита. Пожалуйста, нажмите здесь, чтобы скачать видео,.
Обсуждение
Это исследование подчеркивает преимущества данио рерио, как животной модели для изучения возбудителя поведения в естественных условиях. В частности, это исследование предлагает метод для визуализации патогенный т. cruzi в своей естественной среде: кровяной циркуляции. Окружающей среды кровообращения микроокружения рыб сопоставима с млекопитающих, и trypanosomatids были разработаны механизмы для путешествий, уклонение от иммунной системы и присоединение к клеткам для инфекции в этой среде25. Этот протокол предоставляет описание оптимальные процедуры для культуры т. cruzi в линию клеток человека и последующая изоляция flagellar форм для люминесцентные маркировки. Затем он показывает соответствующие параметры для успешного введения паразитов в прозрачной данио рерио позднее монтажа и визуализация с помощью LSFM. Наконец этот протокол предложений для эффективной и действенной в vivo визуализации движения в обращении с помощью LSFM и расположение паразита.
Жгутика трипаносом вытекает из его задней региона, вытекающих из тела клетки, и висит бесплатно на передней части организма26. Т. cruzi продвигает себя, размахивая жгутика впереди тела, которое ползёт паразита всего тела. Flagellar движения необходима не только для подвижность паразит, как и в случае brucei т.27 (возбудитель Африканский трипаносомоз), но он также используется для сотовых инфекции, как было продемонстрировано в т. cruzi5 ,28. Хотя данио рерио не естественный принимающей страны т. cruzi, паразита сократительной способности могут быть изучены в развивающейся сердечно-сосудистой системы циркуляции системы, используя протоколы, описанные здесь. Кроме того существуют виды трипаносом, заразить карповые, класс данио рерио, например т. carassii и т. borreliв25. Эти виды паразитов могут быть использованы для изучения в режиме реального времени движения и механизмы крепления этих trypanosomatids; такие исследования могут оказать понимание процесса инфекции клеток млекопитающих.
В этом исследовании, вводят подвижные cruzi т. паразиты были наблюдаемых путешествие через сердечно-сосудистой системы циркуляции привитых рыбы, перемещаясь вместе с непрозрачной эритроцитов и придерживаясь структуры в стенах сердечно-сосудистой системы. Мы использовали LSFM построенный дом с 10 X ахроматические рабочим расстоянием воздуха цель (17,6 мм) для освещения руку с числовой апертуры 0.25. 40 X цель погружения apochromatic воды с числовой апертуры 0,8 и рабочее расстояние 3,5 мм был использован для обнаружения руку. Цель обнаружения был погружен в палате образец, в то время как цель освещения был вне камеры. Порт в камере, запечатанный с coverslip и оптические клея допускается для освещения пучка войти в камеру, как показано в Лоренцо et al. 18 для освещения, мы использовали 50 МВт DPSS лазера на 488 нм, мощность которого был модулированные Акусто оптический перестраиваемый фильтр. Обнаружения пути используются фильтры совместим с зеленого флуоресцентного белка (ГПУП) или FITC. Микроскопом света лист с держатель образца капиллярной (в идеале с автоматической ротации) и контроля температуры образца камеры должны быть пригодны для этого приложения. Микроскоп следует согласовать и калибровать согласно инструкциям производителя или пользователя Лаборатория стандартные протоколы до приобретения, в случае необходимости. В этом протоколе мы под контролем микроскопа с помощью программного обеспечения SPIM19.
Важно отметить, что в обращении данио рерио, личинок паразитических вложений является эффективным. В кардинал Вен паразиты оставался прилагаемый для до нескольких минут; в сердце они провели клапаны и стены, колеблющимся с сокращениями сердца. Дальнейшие исследования остаются с целью выяснения ли т. cruzi взаимодействует с течет эритроцитов, которые дрейф в направлении потока крови. Предыдущий в vitro исследования показали, что наличие твердых структур (например, клетки крови), или увеличению вязкости жидкости для имитации крови в пробирке, имеет значительное влияние на подвижность и скорость паразита 9.
Есть много вопросов относительно курса инфекции T. cruzi в организме человека после amastigotes побег фагоцитирующих клеток, первоначально инфицированной клетки типа29. К примеру как они приходят, чтобы их органы-мишени? Какие существуют механизмы для тропизм к предпочтительным органов, таких как инфаркт, пищеварительной и центральной нервной системы? Интересно, что в этом исследовании паразиты были изначально отображаемого в самом сердце потому, что это был сайт наивысшую плотность паразитов. Однако CFSE сигнал впоследствии накопленных в развивающихся кишечника путем инъекций пост 7 дней. Хотя анатомии рыб и млекопитающих отличается, результаты этого исследования демонстрируют формы тропизма, как было отмечено, что паразиты выставлены тропизм к органов известно предпочитаемая несмотря на научные разногласия. Одно существенное ограничение этого исследования касается температуры, используемых в экспериментах. Данио рерио личинки должны храниться около 28 °C в течение всей процедуры. Хотя эта температура может быть похож на узел вектор (насекомые Триатомовые клопы подсемейства), это сильно отличается от теплокровных млекопитающих, которые составляют окончательный хостов (около 37 ° C). Т. cruzi , как известно, имеют flagellar живых форм в обоих узлов; Однако важно иметь в виду, что этот фактор может иметь эффект в поведении животных в естественных условиях.
Хотя fish´s адаптивной иммунной системы не пожилые до 4 недель после оплодотворения, врожденная иммунная система активна в начале развития10. 48 или 96 hpf, в кратчайшие сроки фагоцитирующих клеток были замечены, что охватил помечены трипаносом (данные не показаны). Это ограничивает окно времени для визуализации паразита. Однако если исследование должно было сосредоточить внимание на оценке fish´s иммунный ответ, может быть рекомендовано инъекций на более поздних этапах. Кроме того инъекции паразитов в трансгенной рыбы строки с метками макрофаги или другие клетки иммунной системы может быть полезным при изучении паразита привязанность и эндоцитоз возможных механизмов. Важно отметить, что если паразитов помечены CFSE, трансгенными ячейку метки не должно быть GFP и маркер в желтого или красного конца спектра не требуется.
Для оценки подробных направление движения паразита, может быть полезно следовать их траектории в трех измерениях (3D). Для 3D визуализации и реконструкции процесса необходим высокоскоростной системы. С оборудование, используемое в настоящем Протоколе это возможно только для визуализации паразитов в одной плоскости. В этом случае мы и приоритетными для поддержания стабильности фокальной плоскости во время движения паразита, записи траектории в одной плоскости.
Методология, предложенная здесь прокладывает путь для дальнейшего расследования поведения паразита в сердечно-сосудистой системы циркуляции. Таким образом существенные шаги для визуализации живой флуоресцентный паразитов внутри данио рерио личинки являются:(i) использование раннего вылупившиеся эмбрионы (24-48 hpf) или личинок или животных между 72-96 hpf с без пигментации так, что они являются прозрачными и легко придать; (ii) изображения личинки как можно скорее после инъекции, чтобы избежать паразита фагоцитирующих клеток; и (iii) основное внимание LSFM на сайте интерес (например, перикарда район) и поддерживать фокус. Эта новая процедура позволяет визуализировать trypomastigotes в среде сопоставимы с ее природные инфекции нишу, обеспечивая для в первый раз возможность изучить т. cruzi в живом организме.
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Эта работа была поддержана Convocatoria Interfacultades из Vicerrectoría de Investigaciones de la Универсидад де Лос Андеси программы USAID исследований и инноваций стипендий. Мы благодарим Хуан Рафаэль Буитраго и Yeferzon Ardila за рыба обслуживания и помощи.
Материалы
| Name | Company | Catalog Number | Comments |
| 0.5-10 μL Micropipette | Fisherbrand | 21-377-815 | |
| Agarose RA | Amresco | N605 | Regular |
| Agarose SFR | Amresco | J234 | Low Melting point |
| Aquarium salt | Instant ocean | SS15-10 | |
| Cell Count chamber | Boeco | Neubauer | |
| Cell culture flasks | Corning | 430639 | |
| Centrifuge | Sorvall | Legend RT | |
| CFSE | ThermoFisher | C34554 | |
| Detection objective | Nikon 40x 0.8NA | 40x CFI APO NIR | |
| DMEM medium | Sigma-Aldrich | D5648 | |
| Dumont #5 fine forceps | World precision Instruments | ||
| Ethyl 3-aminobenzoate methanesulfonate salt (Tricaine) | Sigma-Aldrich | A5040 | |
| Fetal calf serum (FCS) | Eurobio | CVFSVF00-01 | |
| Filter | Chroma | ET-525/50M | |
| Glass capillaries for embryo mounting | Vitrez Medical | 160215 | |
| Glass capillaries for pulling needles | World precision instruments | TW100-4 | |
| Glucose | Gibco | A2494001 | |
| HEPES | Gibco | 156300-80 | |
| Incubator | Thermo Corporation | Revco | |
| Larval microinjection mold | Adaptive Science Tools | I-34 | |
| Laser | Crystalaser | DL488-050 | |
| L-glutamine | Gibco | 250300-81 | |
| Methylene blue | Albor Químicos | 12223 | |
| Micromanipulator | Narishige | MN-153 | |
| Micromanipulator system | Sutter Instrument | MP-200 | For LSFM |
| Micropipette puller device | Narishige | PC-10 | |
| Microscope | Olympus | CX31 | |
| Microscope (inverted) | Olympus | CKX41 | |
| Multipurpose microscope | Nikon | AZ100M | |
| Neubauer counting chamber | Boeco Germany | ||
| Penicillin-streptomycin | Gibco | 15140-163 | |
| Petri dish 94x16 | Greiner bio-one | 633181 | |
| Plastic pasteur pipette | Fisherbrand | 11577722 | |
| Rotation stage | Newport | CONEX-PR50CC | |
| RPMI-1640 medium | Sigma-Aldrich | R4130 | |
| Sodium pyruvate | Gibco | 11360-070 | |
| Stereoscope | Nikon | C-LEDS | |
| Tricaine (MS-222) | Sigma-Aldrich | 886-86-2 | |
| TRIS | Amresco | M151 | |
| Trypsin-EDTA (0.25%) | Gibco | R-001-100 | |
| Tubes 15 ml | Corning | 05-527-90 |
Ссылки
- Bern, C. Chagas's Disease. New England Journal of Medicine. 373 (5), 456-466 (2015).
- Sosa Estani, S., Segura, E. L., Ruiz, A. M., Velazquez, E., Porcel, B. M., Yampotis, C. Efficacy of chemotherapy with benznidazole in children in the indeterminate phase of Chagas’ disease. The American Journal of Tropical Medicine and Hygiene. 59 (4), 526-529 (1998).
- Rosas, F., Roa, N., Cucunuba, Z. M., Cuellar, A., Gonzalez, J. M., Puerta, J. C. Chagasic Cardiomyopathy. Cardiomyopathies - From Basic Research to Clinical Management. , (2012).
- Finkelsztein, E. J., et al. Altering the motility of Trypanosoma cruzi with rabbit polyclonal anti-peptide antibodies reduces infection to susceptible mammalian cells. Experimental Parasitology. 150, 36-43 (2015).
- Martins, R. M., Covarrubias, C., Rojas, R. G., Silber, A. M., Yoshida, N. Use of L-Proline and ATP Production by Trypanosoma cruzi Metacyclic Forms as Requirements for Host Cell Invasion. Infection and Immunity. 77 (7), 3023-3032 (2009).
- Engstler, M., et al. Hydrodynamic Flow-Mediated Protein Sorting on the Cell Surface of Trypanosomes. Cell. 131 (3), 505-515 (2007).
- Uppaluri, S., et al. Impact of Microscopic Motility on the Swimming Behavior of Parasites: Straighter Trypanosomes are More Directional. PLoS Computational Biology. 7 (6), e1002058 (2011).
- Heddergott, N., et al. Trypanosome Motion Represents an Adaptation to the Crowded Environment of the Vertebrate Bloodstream. PLoS Pathogens. 8 (11), e1003023 (2012).
- Gratacap, R. L., Wheeler, R. T. Utilization of zebrafish for intravital study of eukaryotic pathogen–host interactions. Developmental & Comparative Immunology. 46 (1), 108-115 (2014).
- Meijer, A. H., Spaink, H. P. Host-Pathogen Interactions Made Transparent with the Zebrafish Model. Current Drug Targets. 12 (7), 1000-1017 (2011).
- White, R. M., et al. Transparent Adult Zebrafish as a Tool for In Vivo Transplantation Analysis. Cell Stem Cell. 2 (2), 183-189 (2008).
- Huisken, J. Slicing embryos gently with laser light sheets. BioEssays. 34 (5), 406-411 (2012).
- Westerfield, M. . The zebrafish book: A guide for the laboratory use of zebrafish (Danio rerio). , (2000).
- Kimmel, C. B., Ballard, W. W., Kimmel, S. R., Ullmann, B., Schilling, T. F. Stages of embryonic development of the zebrafish. Developmental Dynamics. 203 (3), 253-310 (1995).
- Vargas-Zambrano, J. C., Lasso, P., Cuellar, A., Puerta, C. J., González, J. M. A human astrocytoma cell line is highly susceptible to infection with Trypanosoma cruzi. Memórias do Instituto Oswaldo Cruz. 108 (2), 212-219 (2013).
- Rosen, J. N., Sweeney, M. F., Mably, J. D. Microinjection of Zebrafish Embryos to Analyze Gene Function. JoVE (Journal of Visualized Experiments). (25), e1115-e1115 (2009).
- Lorenzo, C., et al. Live cell division dynamics monitoring in 3D large spheroid tumor models using light sheet microscopy. Cell Division. 6, 22 (2011).
- Edelstein, A. D., Tsuchida, M. A., Amodaj, N., Pinkard, H., Vale, R. D., Stuurman, N. Advanced methods of microscope control using μManager software. Journal of Biological Methods. 1 (2), e10 (2014).
- Weber, M., Mickoleit, M., Huisken, J. Multilayer Mounting for Long-term Light Sheet Microscopy of Zebrafish. Journal of Visualized Experiments. (84), (2014).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Ng, A. N. Y., et al. Formation of the digestive system in zebrafish: III. Intestinal epithelium morphogenesis. Developmental Biology. 286 (1), 114-135 (2005).
- Higuchi, M. D. L., et al. Correlation between Trypanosoma cruzi parasitism and myocardial inflammatory infiltrate in human chronic chagasic myocarditis: Light microscopy and immunohistochemical findings. Cardiovascular Pathology: The Official Journal of the Society for Cardiovascular Pathology. 2 (2), 101-106 (1993).
- Vago, A. R., Silva, D. M., Adad, S. J., Correa-Oliveira, R., d'Avila Reis, D. Chronic Chagas disease: presence of parasite DNA in the oesophagus of patients without megaoesophagus. Transactions of the Royal Society of Tropical Medicine and Hygiene. 97 (3), 308-309 (2003).
- Wiegertjes, G. F., Forlenza, M., Joerink, M., Scharsack, J. P. Parasite infections revisited. Developmental & Comparative Immunology. 29 (9), 749-758 (2005).
- De Souza, W. Basic cell biology of Trypanosoma cruzi. Current Pharmaceutical Design. 8 (4), 269-285 (2002).
- Langousis, G., Hill, K. L. Motility and more: the flagellum of Trypanosoma brucei. Nature Reviews. Microbiology. 12 (7), 505-518 (2014).
- Johnson, C. A., et al. Cellular response to Trypanosoma cruzi infection induces secretion of defensin α-1, which damages the flagellum, neutralizes trypanosome motility, and inhibits infection. Infection and Immunity. 81 (11), 4139-4148 (2013).
- Magalhães, L. M. D., Viana, A., Chiari, E., Galvão, L. M. C., Gollob, K. J., Dutra, W. O. Differential Activation of Human Monocytes and Lymphocytes by Distinct Strains of Trypanosoma cruzi. PLoS neglected tropical diseases. 9 (7), e0003816 (2015).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены