Method Article
Живой изображений, следуют одной ячейки отслеживания для мониторинга клеточной биологии и прогрессирования Lineage нескольких нейронных популяций
* Эти авторы внесли равный вклад
В этой статье
Резюме
Описан надежный протокол контролировать нейронных популяций покадровой видео микроскопия, следуют программного обеспечения-пост-обработки. Этот метод представляет собой мощный инструмент для выявления биологических события в выбранной популяции во время живых изображений экспериментов.
Аннотация
Понимание механизмов, которые контролируют критические события биологических нейронных клеточных популяций, например распространения, дифференциации или ячейки решения судьбы, будет иметь решающее значение для разработки терапевтических стратегий для многих заболеваний нервной системы. Нынешние методы для отслеживания клеточных популяций полагаются на их окончательные результаты в неподвижных изображений и они обычно не обеспечивают достаточной временное разрешение для выявления поведенческих особенностей в одиночных клетках. Кроме того изменения в смерти клетки, поведенческие гетерогенность популяции клеток, разбавление, распространение или низкая эффективность маркеров, используемых для анализа клеток являются все важные недостатки, которые приведут к неполной или неверной read-outs результатов. И наоборот живые изображения и одну ячейку, отслеживания соответствующих условиях представляет собой мощный инструмент для отслеживания каждого из этих событий. Здесь покадровой видео микроскопия протокол, следуют постобработки, описан отслеживать нейронных популяций с резолюцией одну ячейку, используя специальное программное обеспечение. Описанные методы позволяют исследователям для решения основных вопросов, касающихся клеток биологии и линии прогрессирования различных нейронных популяций.
Введение
Для того, чтобы разрабатывать новые и более эффективные терапевтические стратегии для регенерации нейронных популяций, мы должны сначала понять основные механизмы, которые поддерживают клетки с регенеративной нейронных потенциалом. Достижение этой цели требует всеобъемлющее знание факторов, которые регулируют баланс между покоя, распространения/дифференциация, режим и сроки отдела, длина клеточного цикла, мигрирующих потенциала, жизнеспособность, и т.д. Хотя это технический подход, который был нанят для многих лет1, живут изображений и непосредственного наблюдения по-прежнему остаются наилучшим вариантом для мониторинга событий, перечисленных выше. В отличие от многих других подходов сосредоточены на концевой отсчетов живут изображений и одноклеточного слежения предоставляют информацию по всей длине эксперимент2,3,4,5, 6. Таким образом, добавление временное разрешение позволяет смерть клетки, поведение неоднородной ячейки или ячейки судьба решений, а также многие критические события должны быть определены, которые в противном случае может пройти незамеченным. В идеале, эти функции клеток лучше всего должно контролироваться на одну ячейку уровня в естественных условиях, где обе внутренние (ячейка автономной) и внешние (клетки ниши) сигналы принимаются во внимание.
Однако, хотя в в vitro ситуации события происходят в среде, не воспроизводить естественной обстановке, условия low-density культуре, обычно используется в эти протоколы являются более подходящими выявить внутренние характеристики клетки. Кроме того более упрощенный контроль окружающей среды, просто изменив среднего роста, могут служить ценным инструментом для расследования индивидуальных роль каждого внешние фактор, который определяет нейронных нишу, а также экологические факторы, которые могут быть вызваны в патологических сценарии7,8,9,10,11,12,13. Поэтому когда правильно настроена, как и в протоколе, предлагаемые здесь, живой изображений обеспечивает решение осуществимо в пробирке для решения большинства вопросов, ранее перечисленных.
Короче говоря этот протокол описывает аппаратные средства, программное обеспечение, культуры условия и основные шаги, необходимые для успешного выполнения живых изображений эксперимент, следуют одной ячейки отслеживания. Этот подход обеспечивает ценную информацию, которая помогает выявить фундаментальные аспекты биологии и линии прогрессии, нескольких нейронных популяций.
протокол
В следующих разделах описываются шаги, необходимые для выполнения живых изображений, следуют одной ячейки отслеживания нескольких нейронных популяций (рис. 1). Все процедуры с участием животных, указанных в настоящем протоколе должны быть проведены в соответствии с руководящими принципами международного Совета для лабораторных животных науки (ICLAS).
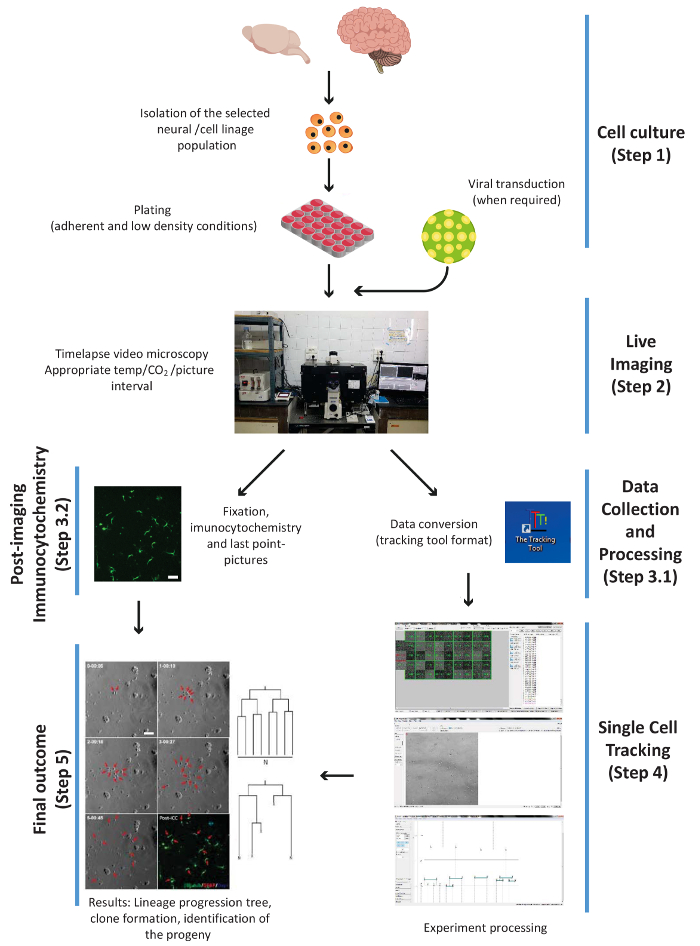
Рис. 1. Схема, иллюстрирующая основные экспериментальные шаги процедуры, то есть: клетки культуры, живые изображения, PICC и сбор данных, одноячеистый отслеживания и окончательный результат. Шаги нумеруются согласно рабочий поток протокола. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
1. клеточной культуры: Изоляции и обшивки из выбранных нейронных населения или ячейки Lineage
Примечание: В связи с настоящим Протоколом, для проверки ее утилиты для анализа биологических нейронных клеток приводятся примеры его применения в различных клеточных популяций. К ним относятся: нервные стволовые клетки (aNSCs), полученных от мыши Субэпендимальные зоны (ОЭЗ) (для изоляции подробный протокол см.14); Послеродовые корковых астроциты учиться нейрональных перепрограммирования (для изоляции подробный протокол см15); Послеродовые мозжечковой астроциты (для изоляции подробный метод см.16); и мыши нейро 2a нейробластома клеточной линии (N2a).
- Заполнение ячеек непосредственно на поли D-лизин 24-ну пластины с покрытием. Использование 1 мл питательной среды на хорошо. Инкубируйте пластины при 37 ° C и 8% CO2 для aNSCs, или при 37 ° C и 5% CO2 для астроциты/клеточная линия за 2 ч до живой изображений. Избегайте использования coverslips для предотвращения нежелательного движения как перемещенных моторизованный столик микроскопа, который делает одну ячейку отслеживания неосуществимым.
Примечание: Плотность клеток и культуральных сред, используемых в экспериментах являются: 30-40 000 клеток/хорошо для aNSCs в Дульбекко модифицированная орла среднего (средне DMEM:F12 питательной смеси); 20 000 клеток/N2a клеток в среде DMEM высокие глюкоза, 80000 клеток/скважины для мозжечковой астроциты в среде DMEM высокой глюкозы; и 55-65 000 клеток/хорошо для послеродового астроциты в среде DMEM:F12 питательной смеси. - Стандартизируйте протокол культуры, регулируя плотность клеток культуры в наименьшее количество клеток осуществимым. Тем не менее плотность клеток должен быть достаточно высоким для поддержания жизнеспособности культуры.
Примечание: Если плотность ячеек слишком высока, избыток мусора или бедных диссоциации (кусты) может препятствовать отслеживания одиночных клеток.
2. жить изображений покадровой видео микроскопия
- Включите Микроскоп камеры, оборудования, систем и инкубации. Установите температуру и воздуха давление до 37 ° C и 8% CO2 для aNSCs, или 37 ° C и 5% CO2 для линии астроциты/клеток. Позволяют CO2 уровни стабилизации для 1-2 ч и температуры.
Примечание: Специальное оборудование требуется для выполнения анализа отснятого видео, включая: яркие поле/фаза контраст/флюоресценцию Микроскопы с моторизованным компонентов; Инкубационный устройства, которые контролируют температуру, CO2 и влажности; и наконец, надежные и достаточно мощное аппаратное и программное обеспечение, способных приобретение и обработку объем фотографии получены во время живых изображений экспериментов (пожалуйста, проверьте Таблицу материалов). - После того, как клетки прочно прикреплены к плите (2 ч после покрытия), используйте постоянный маркер сделать небольшой знак на нижней части один хорошо, что не будет использоваться для отслеживания, то есть, хорошо, что не содержит клеток.
Примечание: Этот знак будет использоваться как ссылка нулю координаты xyz, и он может использоваться в любое время во время или после эксперимента или между изменениями средних, чтобы вернуться в нулевое положение. - Установите пластину внутри камеры микроскопа инкубации и прочно закрепите пластину на сцену, чтобы избежать каких-либо нежелательных движение во время перемещения моторизованный столик микроскопа.
- Разрешить температура среды культуры клеток чтобы сбалансировать в камере около 20 мин. Этот шаг позволит избежать потери фокуса во время записи вследствие дилатации компонентов.
- Начать жить изображений программного обеспечения и выберите промежуток времени модуль для настройки эксперимента.
- Установите общая продолжительность эксперимента и циклы приобретения изображения в «меню закладки график». Из-за присущего Фототоксичность о передаваемых или флюоресценция света используется определите адекватные интервал баланс между временное разрешение анализа и потенциальные гибели клеток.
Примечание: К примеру, в общей сложности 120 h был выбран для aNSC культур, приобретения brightfield изображения каждые 5 минут считать, что приобретение 120 h один фильм в этой конфигурации потребуется 120-150 гигабайт свободного пространства в устройстве компьютера. - Выберите изображение позициях, определенных x и координаты y и фокусное расстояние (координата z) в «xyz точек на вкладке меню». Включите точку отсчета (координат xyz ноль) как исходное положение для того, чтобы получить координаты в любое время.
- Выберите тип приобретения в «волны вкладка меню выбора», brightfield, только или в сочетании с эпифлуоресцентного возбуждения при необходимости. Выберите время экспозиции. Имейте в виду, что чрезмерное воздействие передается, и особенно флуоресцентный свет, может поставить под угрозу жизнеспособность клеток (как указано выше).
- Для aNSCs, мозжечковой астроциты и N2a ячеек выберите brightfield (10-50 мс время экспозиции).
- Для transduced корковой астроциты выберите brightfield (10-50 мс время экспозиции) в сочетании с красным/зеленым светом флуоресцирования, в зависимости от репортера, используемые для эксперимента (длина волны возбуждения красный: 550 Нм и 400 мс Выдержка; зеленый возбуждения Длина волны: 460-500 Нм и выдержка 100 мс).
- Определите имя эксперимент и папку, где будут храниться образы. Сохраните список позиций для перезагрузки эксперимент в любое время и после того, как были созданы все условия, запустите эксперимент, нажав на кнопку «запустить».
- Приостановить эксперимент и повторно настроить фокус условия, нажав «перезаписать кнопку z» один раз в день до завершения эксперимента. Если во время живых изображений требуются изменения в среде, приостанавливать эксперимент и получить пластины из камеры промежуток времени.
Примечание: Изменения в рН среды из-за смерти клетки или чрезмерного распространения, а также вариации в комнатной температуре, может повлиять на правильной фокусировки микроскопа на клетки. Для чувствительных культур (например, aNSCs) мы рекомендуем использовать среды с 4-(2-hydroxyethyl)-1-piperazineethanesulfonic кислота (HEPES) (конечная концентрация: 1 мм).
3. После обработки изображений Immunocytochemistry (ПМКД), сбор данных и обработка
- По окончании эксперимента паузу программное обеспечение и получить пластина для фиксации и PICC, как описано в следующих шагах.
- Выполнение фиксации клеток: вымыть клетки один раз с 1 мл фосфатный буфер (PBS) и 500 мкл параформальдегида (PFA) (4% в PBS), инкубации 10 мин при комнатной температуре (RT).
Предупреждение: Параформальдегида является сильным фиксатором и должны обрабатываться тщательно, чтобы избежать контакта с кожей или глазами. Она должна управляться только внутри зонта. - Вымыть клетки три раза с 1 мл раствора PBS и 500 мкл раствора блокировки (PBS, содержащий 2% (wt/vol) бычьим сывороточным альбумином (БСА) и 0,2% (vol/vol) неионных ПАВ). Инкубировать 1 час на RT.
- Удалять блокирующие решение и 250-400 мкл раствора первичного антитела. Проинкубируйте 2 ч на RT. Первичного антитела решение содержит первичных антител, разбавленных в PBS, содержащий 2% (wt/vol) BSA и 0,2% (vol/vol) неионных ПАВ. Антитела, используемые в эксперименты, описанные здесь: СВМС (1: 500), βIII-тубулина (1:1, 000) и α-тубулина (1:1, 000). Как это осуществляется непосредственно в колодец, требуются большие объемы растворов (250-400 мкл), чтобы охватить все клетки.
- Вымойте три раза с 1 мл раствора PBS и 250-400 мкл раствора вторичные антитела (разбавленный как описано в шаге 3.4). Вторичные антитела, которые используются в эксперименты, описанные здесь: анти мыши флюоресцеином (FITC) (терапевтами), анти кролик Cy3 (1: 500). Инкубируйте 1 час на RT в темноте.
- Мойте три раза в 1 мл ФСБ. Держите клеток в 1 мл PBS для последующих этапов протокола.
- Положите пластину на микроскопа и прочно прикрепить его на сцену, чтобы избежать нежелательного движения во время перемещения моторизованный столик микроскопа.
- Извлечение xyz нулевой позиции, используя знак на шаге 2.2 и повторно установить позиции до этой контрольной точки, нажав на кнопку «Смещение всех X, Y, Z». Повторно установите Фокусное расстояние для каждой позиции.
- Приобрести заключительный раунд изображения, Настройка необходимых условий для флуоресценции выбросов в «меню вкладки выбор длины волны» с целью выявления антигенов, ранее объектом ПМКД.
- Вкратце, в дополнение к brightfield, активировать FITC (возбуждения: 495 нм) и Cy3 (возбуждения: 550 Нм) варианты приобретения программного обеспечения. Используйте 10-50 мс для brightfield 400 мс воздействия для выявления флуорофоров и нажмите на кнопку «1 Петля времени», приобрести заключительный раунд фотографии.
Примечание: Интенсивность флуоресценции могут отличаться в зависимости от результата ПМКД. Отрегулируйте время экспозиции, чтобы получить оптимальное качество изображения.
- Вкратце, в дополнение к brightfield, активировать FITC (возбуждения: 495 нм) и Cy3 (возбуждения: 550 Нм) варианты приобретения программного обеспечения. Используйте 10-50 мс для brightfield 400 мс воздействия для выявления флуорофоров и нажмите на кнопку «1 Петля времени», приобрести заключительный раунд фотографии.
- Выберите файл/экспорт программного обеспечения и экспортировать изображения в формате Объединенная группа экспертов в области фотографии (Jpeg) или меткой формат файла изображения (Tiff) в папку предопределенные назначения.
- Преобразовать изображения экспортируются в формат, требуемый программного обеспечения отслеживания: отслеживание инструмент17 (ТТТ). Для достижения этой цели, определить входные данные и выходной папки в «ТТТ конвертер инструмент «эксплуатации окна, а также маркеры, используемые для позиции (xy), каналы (c) и моменты времени (t) и нажмите кнопку «преобразовать изображения».
Примечание: Изображения должны быть переименованы в соответствии с конкретными параметрами, и они должны храниться в отдельных папках для каждой позиции, используемых в эксперименте. Инструкции по установке, требования, переименование должности/изображений и использование инструмента отслеживания доступны для загрузки по адресу: https://www.bsse.ethz.ch/csd/software/tTt-and-qtfy.html.
4. одну ячейку отслеживания
- После переименования данные, запускайте программное обеспечение ТТТ. Выберите папку имя и ТТТ работ пользователя.
Примечание: Отслеживание инструмент работы папка будет содержать все данные, проанализированы и экспортированные результаты. Рабочий каталог должен иметь имя tTtexport, содержащие вложенные папки с именем «AVIexport», «Конфигурация», «TreeExport» и «tTtfiles». - Выберите эксперимент, чтобы быть загружены в «окно папки выберите эксперимент», указывающее путь к папке, где хранится эксперимент, и затем нажмите кнопку «Загрузить эксперимент».
- Запустить конвертер файлов журнала для преобразования загруженных изображений в формат, который может быть прочитан отслеживания программного обеспечения (для экспериментов, загружается в первый раз, это будет предложено автоматически программным обеспечением).
- Выберите положение для отслеживания, щелкнув его символ (после преобразования, обзор позиций, записанная во время экспериментов будет отображаться в окне «Расположение позиции»). Каждая позиция будет представлено символом, состоящий в картину положения и его соответствующий номер (см. Рисунок 1).
- Как только позиция был выбран и отображается список изображений, доступных на право «позиции макета окна», выберите их и нажмите кнопку «Загрузить изображения».
- Как только загрузка закончена, и появляется окно «Редактор ячейки», выберите длин волн и изображения интервал отслеживаться в окне «Редактор ячейки». Волны 0 соответствует brightfield, 1 — на FITC, 2 Cy3 и 3 DAPI. В эксперименты, описанные здесь, используется интервал 1, то есть, все изображения, загруженные. Чтобы уточнить, интервал 2 означает загрузку каждого второго изображения.
- После загрузки изображения вернитесь к окну «макет позиции» и дважды нажмите на значок, представляющий ранее загруженных позиция. «Фильм» окно что позволяет отслеживания одну ячейку, чтобы выполняться.
- Следуя инструкциям отслеживания инструмент переходите к отслеживания. Выберите 0 канал (соответствующий brightfield) и настроить яркость и контрастность («настроить кнопку гамма»). Запуск отслеживания, нажав клавишу F2.
Примечание: Во время отслеживания, отслеживаемые ячейка будет сопровождаться поместив указатель мыши на нем и нажать клавиши «0». Деление клеток, апоптоз клеток и утраченных клеток кнопки доступны для мониторинга событий эти конкретные ячейки.
5. Окончательный результат
- После завершения одной ячейки отслеживания и потомство определено, сохраните эксперимент (вкладку ячейка редактора окна/файл / сохранить текущее дерево как) и приступить к экспортировать результаты.
- Экспортируйте линии деревьев и данные ячейки в «экспорт меню» расположен в окне «Редактор ячейки». Аналогичным образом, экспорт ячейки изображения и фильмы через меню «Экспорт» доступны через окно «кино». Изображения, линии деревьев, данных и фильмы будут экспортированы в папку Рабочий ТТТ.
Результаты
Метод, описанный позволяет критические вопросы, касающиеся клеточной биологии нескольких нейронных популяций необходимо решить. Например было невозможно контролировать прогрессирование линии нейрогенных и oligodendrogliogenic aNSCs7,8,14,18. Отслеживание одного aNSCs и их потомства (рисунок 2A, B), можно продемонстрировать, что aNSCs было изолированных в vitro поддерживать их нейрогенной природы, в основном генерации нейробласты, и что они следуют последовательность предложил в VIVO19 , но не ранее продемонстрировали на уровне отдельной ячейки. Кроме того эта культура система позволила асимметричной клеточных делений для отображения в первый раз в aNSC линии от ОЭЗ (рис. 2B), предоставляя уникальную модель для изучения НСК самообновлению8,14. Аналогичным образом и независимо от линии проанализированы можно было получить ценные данные, касающиеся роста клеток, раундов отдела, жизнеспособность клеток или длина клеточного цикла.
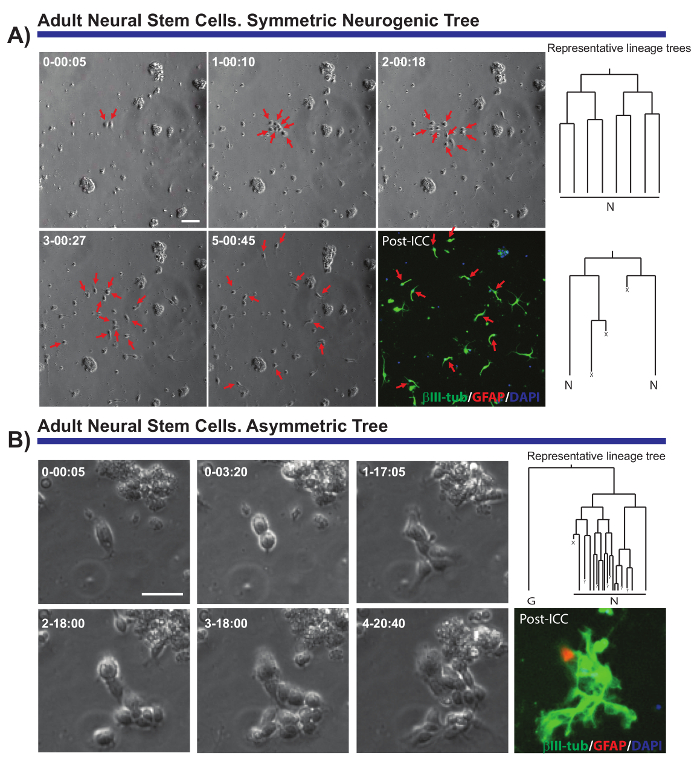
Рисунок 2. Пример aNSCs изолированы от ОЭЗ и проанализированы живых изображений и одноклеточного отслеживания. Фаза контрастность изображения изображают прогрессирование клон в разное время точках (день h: мин). Окончательное изображение соответствует immunocytochemistry пост изображений (ПМКД) для глиальной фибриллово кислой белка (СВМС, красный), βIII-тубулина (зеленый) и 4', 6-diamidino-2-phenylindole (DAPI, синий). (A) анализ симметричный нейрогенный деревьев через различных раундов усиления подразделений сформировать после митотическая нейробласты. Красные стрелки указывают на клетки, включены в симметричных деревья. Справа отображаются линии деревьев соответствующий клонов и порожденных tTt программного обеспечения. (B) пример прародителя, генерации асимметричных нейрогенный дерево, с одной ветви, претерпевает усилительных отделах производить нейробласты в то время как другие порождает покоя СВМС позитивные клетки через потенциальных событий самообновления. Справа отображается дерево lineage, порожденных программного обеспечения ТТТ. В всех деревьев линии: «N» изображает пост митотическая нейробласты; «G», покоя СВМС положительных клеток; «X», гибель клеток; и «?» утраченных клеток. Линейки шкалы представляет 50 µm. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Живут изображений и одноклеточного отслеживания анализа также обеспечивает точная индикация мигрирующих мощностей нейронных населения. Такая информация была получена от послеродового мозжечковой астроциты, представленные до нуля рану пробирного20, генерации информации относительно среднее расстояние, пройденное астроциты, при закрытии раны (рис. 3). Кроме того это было можно увидеть, что некоторые из астроцитов разделены во время процесса заживления, в то время как другие остаются неизменными на протяжении всего эксперимента. Поразительно те, которые разделены кажется более плодовитым мигрирующих поведение, чем их коллеги деления-(путешествуя два раза, как далеко в среднем). Это явление предлагает очень интересные гетерогенность в астроциты способность сформировать шрам после травмы, которая бы было разбавлено вне в считывания классической концевой анализ эксперимента.
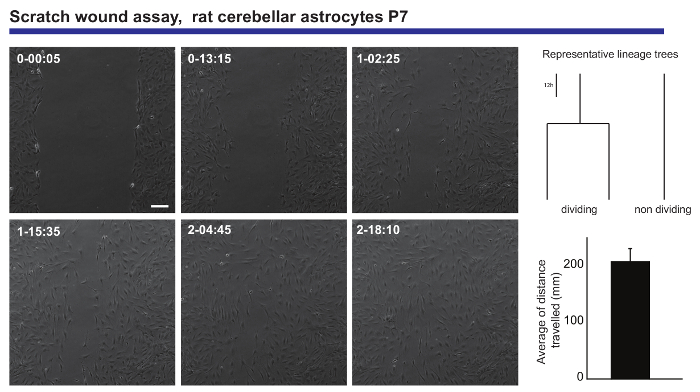
Рис. 3. Анализ поведения мигрирующих послеродовой мозжечковой астроциты в нуля раны assay. Фаза контрастность изображения изображают рану в разное время точках (день h: мин). Линии деревьев, порожденных программного обеспечения tTt, иллюстрируют представитель поведение, с точки зрения деления клеток, из астроцитов при закрытии раны. Гистограмма показывает среднее расстояние, пройденное астроциты, анализируемой одноклеточного отслеживания (среднее ± S.E.M.). Линейки шкалы представляет 50 µm. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Еще одна интересная особенность покадровой видео микроскопия экспериментов является способность сравнивать пролиферации и дифференцировки в популяции клеток. Мы протестировали N2a клетки, покрытие в условиях, которые способствуют распространению (в присутствии 10% плода бычьим сывороточным (ФБС)) или дифференциации (при наличии 0,5% FBS + 10 мкм арахидоновой кислоты). Это было можно проследить происхождение прогрессирование эти клетки при пролиферативных условиях (Рисунок 4A), тогда как дифференцирования клетки не размножаются и образуют невритов (Рисунок 4B). Удивительно одна ячейка отслеживания допускается колоний с различными распространение потенциала следует отличать neurite удлинение (и Ретракция) оцениваться, обеспечивая точный и количественные данные, которые впоследствии могут быть экспортированы.
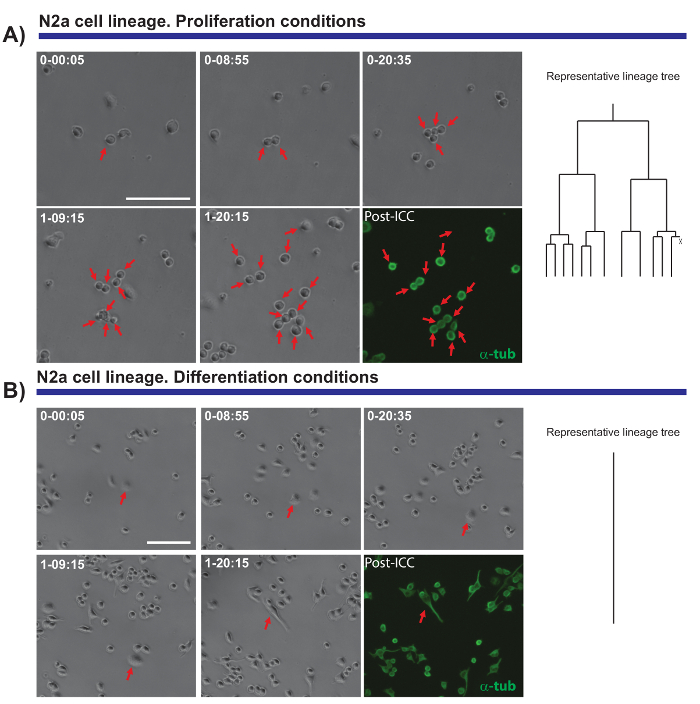
Рисунок 4. Мониторинг N2a клеточной биологии в распространение (A) или дифференциации условий (B). Фаза контрастность изображения изображающие прогрессирование клон в разное время точках (день h: мин). Окончательное изображение соответствует immunocytochemistry пост изображений (ПМКД) для α-тубулина (зеленый). (A) одной ячейки отслеживания позволяет раундов отдела контролироваться, а также неоднородность в Пролиферативная реакция различных клеток. Справа дерево lineage, порожденных программного обеспечения tTt иллюстрирует пролиферативной поведение N2a клеток. (B) клеток условиях дифференциации выход клеточного цикла и генерировать невритов, процесс, который может быть эффективно измеряется после визуализации анализа. Одноместный ячейки отслеживания, представленный деревом линии справа, показывает, как клетки N2a выход клеточного цикла и остановка деления клеток условиях дифференциации. Линейки шкалы представляет 50 мкм.Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Наконец, живут изображений и одноклеточного отслеживания является чрезвычайно полезным для мониторинга молекулярных и морфологических изменений, когда клетки принимаются для перепрограммирования. Живой изображений послеродовой астроциты, преобразованы с Achaete жучка гомолога 1 (Ascl1) обеспечивает ценные данные относительно морфологических изменений, которые происходят во время перепрограммирования или блокирования деления клеток, когда астроциты перепрограммировать (см. Рисунок 5). Кроме того, когда Ascl1 трансдукции сочетается с трансдукции конструкции кодировки для зеленых флуоресценции белков (ГПУП) под контролем промотора двойной Cortin (DCX), это можно определить точки точное время, когда нейронов определенных маркеров начинают быть выражены в перепрограммировать клетки (рис. 5). Покадровой видео микроскопия позволяет также количество ячеек, которые успешно завершить перепрограммирования количественно и по сравнению с клетки, которые умирают во время этого процесса. Мониторинг таких мероприятий привело к идентификации критических «контрольно-пропускных пунктов», в клетках, которые были успешно перепрограммировать9.
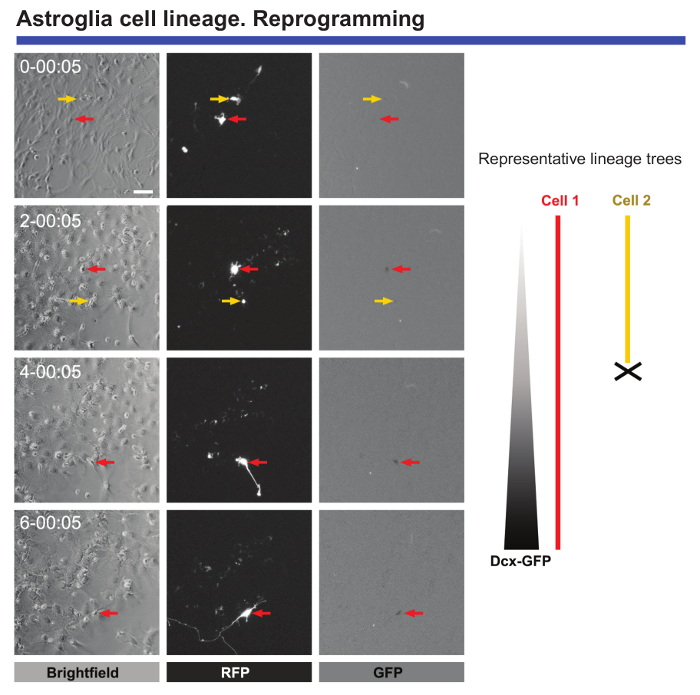
Рисунок 5. Анализ послеродового корковых астроциты, подвергается нейрональных перепрограммирования. Перепрограммирование было вызвано трансдукция с про нейрогенных Ascl1-красной флуоресценции белков (RFP) векторов. Нейрональных преобразования контролируется совместно трансдукция с вектор кодирования GFP под контролем промотора DCX. Фаза контраст изображения показывают прогрессирование перепрограммирования в разное время точках (день h: мин). Флуоресценции изображения ППП и GFP выражения, соответственно. Живут изображений и одноклеточного отслеживания позволили важных событий для подражания, например морфологических изменений, отсутствие деления клеток во время перепрограммирования, гибель клеток, и точное время, когда перепрограммировать клетки начинают выразить нейрональных маркеры могут быть определены . Представляет линейку 80 мкм. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Обсуждение
Одним из наиболее важных ценностей живых изображений является возможность выполнять точные линии трассировки, разъяснение критических аспектов линии прогрессии в нейронных населения. Трассировки линии определяется как идентификация и мониторинг всех потомков одного прародителя, от основателя клон для последующего клонирования сформировал21. Удивительно альтернативные методы, используемые для отслеживания (например, вирусный трансдукция или многоцветной репортер конструкции21) линии имеют критический недостаток, whereby окончательный результат основывается на фотографии и он не обязательно составляют всю последовательность. Это означает, что смерть клетки, неоднородности в поведении популяции клеток, разбавление, распространяя или плохой эффективности маркеров, наряду с другими важными недостатками, привести к неполной или неверной read-outs результаты2. Кроме того живой изображений позволяет исследователю проанализировать важные особенности биологии нейронных популяций, таких как режим и сроков деление клетки, рост клеток, миграция, распространение против дифференциации, длина клеточного цикла, neurite формирование, сложности и длины, ячейка выбор судьбы (дифференциации) или преобразования (перепрограммирование).
Кроме того, живой изображений можно легко дополнить другие анализа, предназначенный для получения данных из одной клетки, такие, как, например, РНК последовательности. Однако достижения комбинированных выгоды от живых изображений и других методов требует, чтобы те клетки, ранее контроль в кино являются позже повторно определены и индивидуально, собранные для вторичного анализа. Это может быть достигнуто с помощью Микроскопы, которые включают позиционные координат, путем применения флуоресцентные репортеров для конкретных ячеек или анализа распределения групп клеток как ссылки. Действительно сочетание транскриптом профиля и поведение отдельных клеток может представлять мощный маршрут для выяснения новых молекулярных сигналов, участвующих в биологии клетки.
Одной из основных проблем, которые могут подорвать живой эксперимент изображений является плотность культуры недостаточно клеток. Как указывалось ранее, при высокой плотности избыток мусора или бедных диссоциации (комок образование) могут повлиять на качество и пространственное разрешение изображений, делая невозможным одноклеточного отслеживания. Таким образом условия различных клеточных популяций под исследования должна быть скорректирована в наименьшее количество клеток возможно без ущерба для жизнеспособности клеточной культуры.
Частоту захвата изображений также имеет решающее значение и должны тщательно скорректированы, особенно когда используется флуоресцентной подсветки. Чрезмерное воздействие передается и особенно флюоресценция света может поставить под угрозу жизнеспособность клеток. Кроме того чрезмерная задержка между захвата изображений может мешать временное разрешение анализа.
Еще один важный шаг в живых изображений эксперимента является периодическая корректировка фокусировки. Неудача в правильный параметр/повторно-setting из Фокусное расстояние может препятствовать отслеживания одну ячейку. Кроме того необходимо тщательно проверить, что инкубации камера сохраняет надлежащей температуры, влажности и CO2 уровнях, изменения нежелательные изменения, которые могут вызвать смерть клетки.
Наконец после того, как была выполнена ПМКД, важно должным образом извлечь xyz нулевой позиции до последнего раунда захвата изображений. Неправильное повторное установление xyz нулевое положение сделает его трудным для соответствия фазово контрастной и иммунофлюоресценции изображения, препятствующие идентификации потомства ячейки.
Хотя этот подход имеет много положительных аспектов, по-прежнему сохраняются некоторые ограничения для живой съемки нейронных популяций. Например плотность низкая клеток, необходимых для выполнения успешной одноклеточного отслеживания aNSCs делает невозможным использовать биохимических анализов, например западной blotting14. Кроме того мониторинг, быстро деления населения как мозжечка астроциты или N2a клетки временно ограничен, как это часто слишком сложно отслеживать клетки как культур недалеко от впадения. Кроме того многие методы культуры, а также присущие биологические ограничения, связанные с изоляции клеток, часто компромисс жизнеспособность клеток более длительных периодов времени, ограничивая продолжительность живой изображений экспериментов. Наконец изоляция клетки из их естественной среды имеет позитивные и негативные последствия. Клетки изолированы от их физиологических ниши может не получать важные сигналы, которые модулировать их поведение, хотя в то же время, он представляет собой мощное средство для проверки эффекта этих сигналов индивидуально в прогрессии линии конкретных нейронных населения.
С учетом ограничений, описанных выше, становится ясно, что идеальный методологических сценарий будет выполнять жить изображений и одной ячейки отслеживания экспериментов в нормальных физиологических условиях в естественных условиях. Однако существующие методы не могут следовать одной клетки для длительных периодов времени в глубоких регионах мозга2. Таким образом будущее живых изображений следует сосредоточиться на преодолеть это ограничение, стремясь полностью проанализировать клеточной биологии из одной клетки в vivo с самых незначительных возможно вмешательство физиологической среды3.
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Мы благодарим Beatriz гасконец за ее помощь и искусства работы на рисунке 1. Мы также благодарим д-р C. Норрис за его помощь. Работы, представленные здесь была поддержана исследовательских грантов, «красный де Джубая Consolider-Инхенио испанский ионного канала инициатива» (BFU2015-70067REDC), MEC (BFU2014-53654-P), БРАД-CM (S2013/ICE-2958), UCM-Сантандер (PR26/16-18В-3) и Фонд Рамон Программа грантов Аресес (PR2018/16-02). Фелипе Ortega признает Ramon y Cajal программа испанского министерства экономики и конкурентоспособности (MEC: Исправительные-2013-13290).
Материалы
| Name | Company | Catalog Number | Comments |
| Poly-D-lysine | Sigma | P0899 | Working solution 0.02 mg mL-1 |
| 24 wells plate | Falcon | 352047 | |
| Dulbecco’s modified Eagle’s medium (DMEM): F12 Nutrient Mixture medium (-L Glutamine) | Invitrogen | 21331-020 | |
| DMEM High Glucose medium | Sigma | D6546 | |
| Bovine Serum Albumin | Sigma | A6003 | |
| Triton X-100 | Merck | 11869 | non-ionic surfactant |
| Mouse anti-β III Tubulin | Sigma | T8660 | |
| Rabbit anti-GFAP | DakoCytomation | Z0334 | |
| Mouse anti-α Tubulin | Sigma | T5168 | |
| Anti-Mouse FITC | Jackson Laboratories | 715-095-150 | |
| Anti-Rabbit Cy3 | Jackson Laboratories | 711-165-152 | |
| Brightfield/Phase contrast/fluoresence microscope | Nikon | TE-2000-E | |
| CFI PLAN FLUOR DLLL 10X objetives | Nikon | Ref 280MRH10101 | |
| CFI SUPER PLAN FLUOR ELWD AMD 20X objetives | Nikon | Ref 280MRH48230 | |
| pE-300 LED fluorescence | Cool LED | Ref Number 1981 | |
| 310M-201 Incubation system (temperature) | OKO-Lab | Serial Nº VOF007307 | |
| Pro-ScanII Motorized stage system | Prior | Serial Nº 60018 | |
| High precision microscope camera version 4.2 | ANDOR Zyla | VSC-03650 | |
| Specifc software for live imaging with timelapse module: NIS-Elements AR4.5 | Nikon | NIS-Elements AR4.5 -Hasp ID: 13CE819E | |
| OKO touch Incubation system (CO2) | OKO-lab | Serial number 1716 | |
| Murine Neuro-2a Neuroblastoma Cell line | ATCC | ATCCCCL131 | |
| HEPES buffer solution 1 M | Invitrogen | 15630-056 |
Ссылки
- Conklin, E. G. The Mutation Theory From the Standpoint of Cytology. Science. 21 (536), 525-529 (1905).
- Ortega, F., Costa, M. R. Live Imaging of Adult Neural Stem Cells in Rodents. Front Neurosci. 10, 78 (2016).
- Skylaki, S., Hilsenbeck, O., Schroeder, T. Challenges in long-term imaging and quantification of single-cell dynamics. Nat Biotechnol. 34 (11), 1137-1144 (2016).
- Schroeder, T. Tracking hematopoiesis at the single cell level. Ann N Y Acad Sci. 1044, 201-209 (2005).
- Schroeder, T. Imaging stem-cell-driven regeneration in mammals. Nature. 453 (7193), 345-351 (2008).
- Etzrodt, M., Endele, M., Schroeder, T. Quantitative single-cell approaches to stem cell research. Cell Stem Cell. 15 (5), 546-558 (2014).
- Ortega, F., et al. Oligodendrogliogenic and neurogenic adult subependymal zone neural stem cells constitute distinct lineages and exhibit differential responsiveness to Wnt signalling. Nat Cell Biol. 15 (6), 602-613 (2013).
- Costa, M. R., et al. Continuous live imaging of adult neural stem cell division and lineage progression in vitro. Development. 138 (6), 1057-1068 (2011).
- Gascon, S., et al. Identification and Successful Negotiation of a Metabolic Checkpoint in Direct Neuronal Reprogramming. Cell Stem Cell. 18 (3), 396-409 (2016).
- Karow, M., et al. Reprogramming of pericyte-derived cells of the adult human brain into induced neuronal cells. Cell Stem Cell. 11 (4), 471-476 (2012).
- Kleiderman, S., et al. Conversion of Nonproliferating Astrocytes into Neurogenic Neural Stem Cells: Control by FGF2 and Interferon-gamma. Stem Cells. 34 (12), 2861-2874 (2016).
- Bunk, E. C., et al. Prox1 Is Required for Oligodendrocyte Cell Identity in Adult Neural Stem Cells of the Subventricular Zone. Stem Cells. 34 (8), 2115-2129 (2016).
- Aravantinou-Fatorou, K., et al. CEND1 and NEUROGENIN2 Reprogram Mouse Astrocytes and Embryonic Fibroblasts to Induced Neural Precursors and Differentiated Neurons. Stem Cell Reports. 5 (3), 405-418 (2015).
- Ortega, F., et al. Using an adherent cell culture of the mouse subependymal zone to study the behavior of adult neural stem cells on a single-cell level. Nat Protoc. 6 (12), 1847-1859 (2011).
- Heinrich, C., et al. Generation of subtype-specific neurons from postnatal astroglia of the mouse cerebral cortex. Nat Protoc. 6 (2), 214-228 (2011).
- Jimenez, A. I., et al. Potentiation of ATP calcium responses by A2B receptor stimulation and other signals coupled to Gs proteins in type-1 cerebellar astrocytes. Glia. 26 (2), 119-128 (1999).
- Hilsenbeck, O., et al. Software tools for single-cell tracking and quantification of cellular and molecular properties. Nat Biotechnol. 34 (7), 703-706 (2016).
- Ortega, F., Berninger, B., Costa, M. R. Primary culture and live imaging of adult neural stem cells and their progeny. Methods Mol Biol. 1052, 1-11 (2013).
- Kriegstein, A., Alvarez-Buylla, A. The glial nature of embryonic and adult neural stem cells. Annu Rev Neurosci. 32, 149-184 (2009).
- Yu, A. C., Lee, Y. L., Eng, L. F. Astrogliosis in culture: I. The model and the effect of antisense oligonucleotides on glial fibrillary acidic protein synthesis. J Neurosci Res. 34 (3), 295-303 (1993).
- Kretzschmar, K., Watt, F. M. Lineage tracing. Cell. 148 (1-2), 33-45 (2012).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены