Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Применение высокоскоростных суперразрешением скорость микроскопии в прямом первичной ресничку
В этой статье
Резюме
Недавно мы сопоставлены трехмерной (3D) пространственного расположения транспортных маршрутов для различных белков, translocating внутри первичного реснички в живых клетках. Здесь этот документ детали экспериментальной установки, процесс биологических проб и анализ данных для флуоресценции 3D супер-резолюции, недавно изображений подход применяется в живут первичной ресничек.
Аннотация
Основной ресничку на основе микротрубочек выступ на поверхности многих эукариотических клеток и содержит уникальный состав белков функции критически в подвижности клеток и сигнализации. Так как реснички не способны синтезировать свои собственные белки, около 200 уникальных цилиарной белки нужно торговли между в цитозоле и первичных ресничек. Однако, это по-прежнему технический вызов карта трехмерные (3D) расположения транспортных путей для этих белков в живой первичной реснички из-за ограничений в настоящее время существующих методов. Чтобы победить вызов, недавно мы разработали и занятых высокоскоростной виртуальный 3D супер резолюции микроскопии, называют точечные края возбуждения суб дифракции (скорость) микроскопия, чтобы определить 3D пространственное расположение транспортных путей для Оба цитозольной и мембранных белков в первичной реснички живых клеток. В этой статье мы покажем подробные настройки скорости микроскопии, подготовка клеток, выражая флуоресцировани обозначенного белка цилиарной белки, слежение в реальном времени одной молекулы индивидуальных белков в живой ресничку и достижения из 3D пространственных вероятностных карт плотности транспортных маршрутов для ресничный белков.
Введение
Так как заявил Эрнст Аббе в 1873 году, резолюции обычных световой микроскопии было считается ограничивается примерно 200 Нм вследствие дифракции света от объективного1,2. В настоящее время методы световой микроскопии суперразрешением нарушать это ограничение и разрешить захват динамических изображений с разрешением суб дифракции (< 200 Нм). Методы, как правило, делятся на две широкие категории: стимулировали выбросов истощения (интереса) микроскопии основанные подходы, которые генерируют объем освещения суб дифракции вследствие нелинейных оптических ответ флуорофоров в образцы3; и photoactivated световой микроскопии (PALM) и стохастические оптических реконструкции микроскопии (шторм)-на основе суперразрешением методы, которые используют математические функции для локализации центроиды флуорофоров и затем восстановить эти центроиды сформировать суперразрешением изображения4,5. В настоящее время благодаря сравнительно несложной оптические установки, PALM шторм широко используются и активируя только небольшое подмножество флуорофоров в каждом фрейме долго видео биологической подготовки. Это позволяет для более точной локализации по 2D Гаусса фитинга флуоресцентные пятна, называется точка распространения функция (ФСФ), дневно меченых белков в каждом кадре видео. 2D расположение каждого дневно меченых молекул может затем накладывается на одной плоскости изображений для создания изображения суперразрешением биологической подготовки1,2. Хотя эти сингл молекула локализации, супер резолюции подходы к микроскопии конечно революцию, как было выполнено визуализации биологических образцов, есть еще проблемы, которые необходимо преодолеть. Например шторм и PALM могут достигнуть их лучших пространственного разрешения после фиксации биологических образцов и таким образом представлять статическое представление дневно меченых белков, который является аналогичные ограничения электронной микроскопии. Кроме того для достижения высокого пространственного разрешения для каждого белка-дневно обозначенных в живых клеток, образцы должны быть imaged на очень длинные частоты кадров, которые не в состоянии захватить динамики белков. Таким образом это необходимо для преодоления этих основных технических препятствий.
Чтобы получить высокое разрешение пространственно-временных, которая хорошо подходит для обнаружения быстро движущихся белков и РНК в живых клеток, мы разработали супер-резолюции скорость микроскопии в нашей лаборатории (рис. 1)6,7, 8. несколько крупных технических достижений в микроскопии скорость ранее позволили нам успешно отслеживать nucleocytoplasmic перевозок малых молекул, белки, мРНК и вирус через родной ядерной поры комплексы (НПС)6, 7 , 8. кратко, следующие особенности микроскопии скорость будет использоваться для отслеживания быстро движущихся макромолекул через суб микрометра осесимметричной структуры в живых клеток, таких как NPC и первичных реснички: (1) наклонной или вертикальная подсветка ПСФ позволяет возбуждения молекул одного внутри небольшой дифракционный предел тома в фокальной плоскости (рис. 1); (2) склонны ПСФ можно значительно избежать вне фокуса флуоресценции и таким образом улучшить соотношение сигнал шум. (3) оптическая плотность 100-500 кВт /2 см в ПСФ освещения позволяет тысячи фотоны должны быть собраны из одного флуорофоров с быстрого обнаружения скорости (> 500 Гц). (4) быстрого обнаружения скорость также значительно уменьшает сингл молекула пространственной локализации ошибки (< 10 Нм) при определении пространственных траекторий перемещения флуоресцентных молекул в живых клеток, потому что молекулярной диффузии является одним из основных факторов причиной несовершенства одной молекулы локализации для движущихся молекул. (5) налаженные 2D к 3D алгоритмы преобразования позволяют нам предоставлять 3D пространственных вероятностных карт плотности транспортных маршрутов для молекул в NPC или первичной ресничку. Примечательно, что наш процесс преобразования между декартовой и цилиндрических координации системы используется для создания 3D пространственной плотности вероятности карта, вместо того, чтобы 3D сингл молекула отслеживания (рис. 2). Ранее электронной микроскопии данные показали, что ВСНП9,10 и основной ресничку11 имеют осесимметричной структуры. В принципе случайно диффундирующих молекул, движущихся через NPC или первичной ресничку должны также иметь осесимметричной дистрибутивов. Как показано на рисунке 2, большое количество случайно диффундирующих молекул внутри цилиндра будет генерировать осесимметричной дистрибутивов на вид поперечного сечения, что в NPC, далее привело примерно единообразной пространственной распределение в рамках каждого очень маленькие субрегиона между двумя соседними кольцами (2 рисунокE). Это равномерное распределение приводит, что пространственное распределение измерении θ в цилиндрической системе является постоянным. Затем можно упростить 3D координаты (X, R, θ) быть 2D координат (R, X, константа). На самом деле наш процесс преобразования между декартовой и цилиндрических системами является от 2D (X, Y) 2D (R, X, константа). Постоянное θ, относится к пространственной плотности p в рисунке 2E, рассчитывается с помощью уравнения A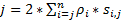 .
.
В конечном счете сингл молекула отслеживания имеет широкое применение в биологических исследований, таким образом, вполне естественно, что множество методов будут разрабатываться для заполнения конкретных биологических нишах12,,1314. Так обстоит дело с скорость микроскопии. Ранее при сочетании с 3D преобразования алгоритма, этот метод был разработан для устранения 3D транспортных маршрутов транзитных молекул через НПК, суб-diffraction-размера и вращательно-симметричных биологической структуры6. В этом документе первичный ресничек показано отличную модель органеллы также. Основная ресничек, цилиндрические, антенна как органеллы (~ 125 Нм радиус), которые проектируют от поверхности наиболее mammalian клетки15,16,17. Они отвечают за получение внешних сигналов и препровождающее внутриклеточные реакции, обычно связанных с ростом и метаболизм,1516. Таким образом, поток структурных белков, утилизация трансмембранные рецепторы и передаче внутриклеточных посланников жизненно важные обязанности основного ресничек. На стыке между первичной ресничек и клетки тела является критической избирательности барьер, называется переходной зоне или TZ, через который все это транспортного белка должно произойти,11,18,19 20. Подуманы, что помимо стробирования функции TZ, по крайней мере два транспортных процессов, intraflagellar транспорт и пассивной диффузии, отвечает за движение белка через этот регион16,21, 22. с точки зрения здоровья человека, потеря первичных ресничек и последующего дерегулирования течению сигнализации характерно многих раковых заболеваний. Кроме того многие генетических заболеваний, как Синдром Барде-Бидля и поликистозный болезни почек, связаны с дефектных белков транспорт23. Ограничение на размер суб дифракции и сложный процесс селективного белка транспорта через TZ сделать основной реснички главной мишенью для этой техники. В этом документе методы, мы продемонстрируем отслеживания цилиарной трансмембранным белком рецепторов соматостатина 3 (SSTR3)24, внешне помечены Alexa Fluor 647 и компонент IFT, IFT2025, помечены с молекулой плавленого GFP.
протокол
1. низ 3T3 подготовка клетки для микроскопии скорость со склада
- 1,5 недели до начала эксперимента, восстановить свежие культуры клеток низ 3T3 из замороженных запас оттаивания при 37 ° C и передачи клетки до 25 см2 клетки культуры колба с 3 мл Дульбекко изменение Eagle среднего (DMEM) дополнены 110 мг/мл пируват натрия, глютамин 2 мм, плода бычьим сывороточным 10% и 1% пенициллина/стрептомицина.
- Инкубируйте клетки при 37 ° C в 5% CO2 инкубатора.
- Разбиение ячеек на 80% confluency, о каждые два дня, по крайней мере три раза до экспериментальных день для обеспечения однородности клеточного цикла. Trypsinize клетки с трипсин 0.25% для 2 минут при 37 ° C, аспирационная трипсина и заменить его с 2 мл среды. Пипетка средне неоднократно разбить ячейку кластеры, удалите нужное количество клеток и довести общий объем средств массовой информации обратно до 3 мл.
Примечание: Низ 3T3 были ранее генетически выразить СПОЗ-4, белок, локализует TZ26, сливается в отеле terminus C к mCherry. mCherry является Флюорофор, который может быть возбужден с 561 Нм освещение количественно локализовать TZ избирательности барьер и ориентировать первичного ресничек. - За два дня до эксперимента, плита клетки в 35 мм стекла дно блюдо на 60-70% confluency с 1,5 мл же среднего шага 1.1 и возвращение клетки в инкубаторе.
- Один день до эксперимента, химически transfect клетки с желаемой плазмиды. Смешать 500-1000 нг желаемого плазмида (см. Примечание ниже) в соотношении подаются с трансфекции реагента в 0,25 мл сокращение сыворотке СМИ без антибиотиков для 30 min. аспирата СМИ от 35 мм стекла блюдо дно и заменить его с плазмида 0,25 мл / Трансфекция реагент микс плюс дополнительные 1,25 мл сокращение сыворотке СМИ без антибиотиков. Сокращение сыворотке СМИ служит цели содействия успешной трансфекции, вызывая рост первичной ресничек, а также поддерживая клетки достаточно долго для выполнения эксперимента. Возвращение клетки в инкубатор для эксперимента на следующий день.
Примечание: При выполнении одной молекулы отслеживания IFT20, плазмиды, содержащий генетически модифицированные IFT20 сливается в его C terminus в GFP-используется25. При выполнении одной молекулы отслеживание SSTR3, плазмиды, содержащие генетически модифицированные SSTR3 сливается в его N terminus в акцепторной пептида (AP) домен и C расположен в GFP используется22. В дополнение к SSTR3 конструкции плазмиды, содержащие биотин лигаза Бира должны выражаться совместно и трансфекции СМИ должны быть дополнены с 10 мкм биотин. Бира затем придает биотина AP домена недавно синтезированных молекул AP-SSTR3-GFP на уровне ER. Alexa647, конъюгированных с тремя из четырех биотин привязки сайтов стрептавидина, в среднем, затем может быть дополнен в СМИ до визуализации дневно метку AP-SSTR3-GFP молекул на внешней поверхности клетки22,27 . В этом методе; используются GFP и AlexaFluor647 Однако другие флуоресцентных зондов может использоваться, если они имеют аналогично высокой фото стабильность и квантовый выход. - Если с помощью внешне меченых SSTR3 конструкции, удалить СМИ от стекла дно блюдо 1 h до эксперимента, мыть ячейки 5 раз с 1 мл физиологического раствора фосфатного буфера (PBS) и добавить 1 мл сокращение сыворотке СМИ дополнена 1 мкм проспряганное Alexa647 стрептавидина.
- Не более чем за 15 мин до эксперимента, извлеките из стекла блюдо дно и мыть transfected и помечены клетки 5 раз с 1 мл раствора PBS.
- Место 1 мл буфера изображений (20 мм HEPES, 110 мм KOAc, 5 мм NaOAc, 2 мм MgOAc, 1 мм EGTA, рН 7.3) в блюдо дно стекла.
Примечание: В буфере визуализации, клетки являются жизнеспособным, не более чем 3 h. Таким образом только в 2 h экспериментов выполняются на каждое блюдо.
2. скорость микроскопия
Примечание: Скорость микроскопии установки включает Перевернутый флуоресценции микроскоп с 1.4-NA 100 × нефти погружения apochromatic цели, 35 МВт 633 нм He-Ne лазера, 50 МВт 488 нм и 561 Нм Лазеры твердого, получить на чипе умножения заряд сочетании устройство камеры и Микроскоп пакет программного обеспечения для сбора данных и обработки (рис. 1). Для визуализации отдельных каналов, GFP, mCherry и Alexa647 в восторге от 488 нм, 561 Нм, или 633 нм лазеры, соответственно. Для отслеживания одной молекулы, централизованное освещение используется для отслеживания отдельных дневно меченых молекул. Для эпифлуоресцентного изображений, вогнутая линза помещается в лазер освещения пути расширить луча в однородном поле освещения. Собранные ту же цель, отфильтрованные по Дихроичный фильтр (405/488/561/635) и фильтр выбросов (405/488/561/635) и образы с выше ПЗС-камеры, работающие на 500 для отслеживания одной молекулы или 2 Гц для флуоресценции выбросы эпифлуоресцентного изображений.
- Прикрепите днище стекла на этап микроскопа и найдите ячейку, которая надлежащим образом выражая требуемой конструкции. Найдя подходящий ячейки, выравнивание место NPHP4-mCherry на базе первичной реснички с расположением на плоскости изображения, соответствующий лазерный единой точки освещения.
- Захватить изображение эпифлуоресцентного NPHP4-mCherry и IFT20-GFP или AP-SSTR3-GFP, используя функцию «Snap» на вкладке «Камеры» окна «Фокус элементов управления» при использовании пакета программного обеспечения цифровой микроскопии (см. Таблицу материалы).
Примечание: Эти изображения будут выступать в качестве ссылки для последующих одной молекулы мест. - После получения исходных образов локально снижают концентрацию метками одной молекулы. Фото отбеливатель TZ с 1 МВт лазерной подсветки для 20 s или до тех пор, пока интенсивность флуоресценции близка фон флуоресценции.
Примечание: Когда точные концентрации можно управлять, 0,1-1 Нм, помечены одной молекулы используются. - Подготовить для отслеживания одной молекулы, уменьшите мощность лазера освещение ~0.15 МВт для одной молекулы, помечены GFP или ~0.5 МВт для молекул, помечены Alexa647.
- Как только мощность лазера и визуализации параметров набора, максимальный выигрыш и интенсификации и частота кадров 2 мс, для одной молекулы изображений, привлекать соответствующие освещения лазер и записывать не photobleached, обозначенный одной молекулы, как они транспортируются через регион photobleached TZ, нажав кнопку «Поток» в закладке «Камеры» окна «Фокус элементов управления».
Примечание: Не более 2 мин видео должно быть захвачен свести к минимуму последствия цилиарной дрейф до незначительного уровня. - После захвата видео одной молекулы, обработки видео с помощью 2D Гаусса фитинга алгоритм, например, проблеск лабораторией Gelles, который точно локализуется центроид возбуждения PSF в области, охватывающей каждого одной молекулы интерес (АОИ).
- Выберите все одной молекулы местоположения с точностью < 10 Нм и исправить центр ресничек, основанных на распределении мест одной молекулы с 2D функции Гаусса.
Примечание: С помощью 2D к 3D преобразования алгоритма, 3D транспортных маршрутов IFT20-GFP и AP-SSTR3 маршрутов четко указаны на цилиарных axonemal или цилиарной мембраны, соответственно.
3. 2D в 3D преобразования
- После того, как собраны несколько тысяч локализации для транзита молекул (сигнал/шум соотношение > 11) в ресничку, выберите длинной оси ресничку как X-измерение. Сделать Y гистограммы измерение мест и получить суммы Бен 10 нм с шагом.
Примечание: 2D в 3D преобразования может оцениваться вручную или любого программного обеспечения или языка программирования. Авторы успешно осуществили преобразование как Matlab, так и Python 2.7.
Результаты
Этот раздел показывает данные, полученные от выполнения микроскопии скорость на TZ первичных ресничек для изучения транспортного маршрута SSTR3 соединены ~ 15 Нм внешних компоновщику Alexa647 (рисA). Он служит двойной цели проверки алгоритма 3D преобра...
Обсуждение
Этот протокол описывает применение микроскопии скорость основного ресничку, клеточных сигналов органеллы, который очень зависит от эффективного белков транспорт. СКОРОСТЬ микроскопии может обеспечить высокого разрешения (< 10 Нм) мест для дневно меченых молекул, как они проходят через...
Раскрытие информации
Авторы заявляют отсутствие конфликта интересов.
Благодарности
Мы благодарим д-р Кристен верхей (Мичиганского университета, Анн-Арбор) и д-р Грегори Pazour (Университет штата Массачусетс Медицинская школа) за предоставление некоторые плазмиды. Проект был поддержан грантов от национальных институтов здравоохранения (низ GM097037, GM116204 и GM122552 к W.Y.).
Материалы
| Name | Company | Catalog Number | Comments |
| 25 cm2 tissue culture dish | Corning | VV-01936-00 | |
| Penicillin/streptomycin | ThermoFisher | 15140122 | |
| Fetal bovine serum | ThermoFisher | 10438018 | |
| DMEM | ThermoFisher | 10566-016 | |
| OPTIMEM | ThermoFisher | 31985062 | |
| Trypsin | ThermoFisher | 25300054 | |
| Phosphate buffered saline | Sigma-Aldrich | P3813-1PAK | |
| Transit LT1 | Mirus | MIR 2300 | |
| 35 mm glass bottom dish | MatTek | P35GCOL-0-14-C | |
| AlexaFluor 647-conjugated streptavidin | ThermoFisher | S21374 | |
| Biotin | Sigma-Aldrich | B4501-100MG | |
| 633 nm He-Ne laser | Melles Griot | 25-LHP-928-249 | |
| 561 nm solid state laser | Coherent | OBIS 561-50 LS | |
| 488 nm solid state laser | Coherent | 1185053 | |
| Inverted fluorescence microscope | Olympus | IX81 | |
| 1.4-NA 100× oil-immersion apochromatic objective | Olympus | UPLSAPO 100× | |
| On-chip multiplication gain charge-coupled-device camera | Roper Scientific | Cascade 128+ | |
| Dichroic filter | Semrock | Di01- R405/488/561/635-25x36 | |
| Emission filter | Semrock | NF01-405/488/561/635-25X5.0 | |
| Slidebook 6.0 | Intelligent Imaging Innovations | digital microscopy software |
Ссылки
- Huang, B., Bates, M., Zhuang, X. Super-resolution fluorescence microscopy. Annu Rev Biochem. 78, 993-1016 (2009).
- Leung, B. O., Chou, K. C. Review of super-resolution fluorescence microscopy for biology. Appl Spectrosc. 65, 967-980 (2011).
- Willig, K. I., Rizzoli, S. O., Westphal, V., Jahn, R., Hell, S. W. STED microscopy reveals that synaptotagmin remains clustered after synaptic vesicle exocytosis. Nature. 440, 935-939 (2006).
- Betzig, E., et al. Imaging intracellular fluorescent proteins at nanometer resolution. Science. 313, 1642-1645 (2006).
- Rust, M. J., Bates, M., Zhuang, X. Sub-diffraction-limit imaging by stochastic optical reconstruction microscopy (STORM). Nat Meth. 3, 793-796 (2006).
- Ma, J., Yang, W. Three-dimensional distribution of transient interactions in the nuclear pore complex obtained from single-molecule snapshots. Proc Natl Acad Sci USA. 107, 7305-7310 (2010).
- Ma, J., Goryaynov, A., Sarma, A., Yang, W. Self-regulated viscous channel in the nuclear pore complex. Proc Natl Acad Sci USA. 109, 7326-7331 (2012).
- Ma, J., et al. High-resolution three-dimensional mapping of mRNA export through the nuclear pore. Nat Comm. 4, (2013).
- Akey, C. W., Radermacher, M. Architecture of the Xenopus nuclear pore complex revealed by three-dimensional cryo-electron microscopy. J Cell Biol. 122, 1-19 (1993).
- Akey, C. W. Interactions and structure of the nuclear pore complex revealed by cryo-electron microscopy. J Cell Biol. 109, 955-970 (1989).
- Czarnecki, P. G., Shah, J. V. The ciliary transition zone: from morphology and molecules to medicine. Trends Cell Biol. 22, 201-210 (2012).
- Elf, J., Li, G. -. W., Xie, X. S. Probing transcription factor dynamics at the single-molecule level in a living cell. Science. 316, 1191-1194 (2007).
- Anzalone, A., Annibale, P., Gratton, E. 3D orbital tracking in a modified two-photon microscope: an application to the tracking of intracellular vesicles. J Vis Exp. , (2014).
- Ritter, J. G., Veith, R., Veenendaal, A., Siebrasse, J. P., Kubitscheck, U. Light sheet microscopy for single molecule tracking in living tissue. PloS one. 5, 11639 (2010).
- Marshall, W. F., Nonaka, S. Cilia: tuning in to the cell's antenna. Curr Biol. 16, 604-614 (2006).
- Scholey, J. M., Anderson, K. V. Intraflagellar transport and cilium-based signaling. Cell. 125, 439-442 (2006).
- Yang, T. T., et al. Superresolution pattern recognition reveals the architectural map of the ciliary transition zone. Sci Rep. 5, 14096 (2015).
- Craige, B., et al. CEP290 tethers flagellar transition zone microtubules to the membrane and regulates flagellar protein content. J Cell Biol. 190, 927-940 (2010).
- Kee, H. L., et al. A size-exclusion permeability barrier and nucleoporins characterize a ciliary pore complex that regulates transport into cilia. Nat Cell Biol. 14, 431-437 (2012).
- Najafi, M., Maza, N. A., Calvert, P. D. Steric volume exclusion sets soluble protein concentrations in photoreceptor sensory cilia. Proc Natl Acad Sci USA. 109, 203-208 (2012).
- Nachury, M. V., Seeley, E. S., Jin, H. Trafficking to the ciliary membrane: how to get across the periciliary diffusion barrier. Annu Rev Cell Dev Biol. 26, 59-87 (2010).
- Ye, F., et al. Single molecule imaging reveals a major role for diffusion in the exploration of ciliary space by signaling receptors. Elife. 2, 00654 (2013).
- Ross, A. J., et al. Disruption of Bardet-Biedl syndrome ciliary proteins perturbs planar cell polarity in vertebrates. Nat Genetics. 37, 1135-1140 (2005).
- Handel, M., et al. Selective targeting of somatostatin receptor 3 to neuronal cilia. Neuroscience. 89, 909-926 (1999).
- Follit, J. A., Tuft, R. A., Fogarty, K. E., Pazour, G. J. The intraflagellar transport protein IFT20 is associated with the Golgi complex and is required for cilia assembly. Mol Biol Cell. 17, 3781-3792 (2006).
- Awata, J., et al. NPHP4 controls ciliary trafficking of membrane proteins and large soluble proteins at the transition zone. J Cell Sci. 127, 4714-4727 (2014).
- Howarth, M., Ting, A. Y. Imaging proteins in live mammalian cells with biotin ligase and monovalent streptavidin. Nat Protoc. 3, 534-545 (2008).
- Huang, B., Wang, W., Bates, M., Zhuang, X. Three-dimensional super-resolution imaging by stochastic optical reconstruction microscopy. Science. 319, 810-813 (2008).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены