Method Article
Визуализация внутриклеточных SNARE людьми флуоресценции жизни изображений микроскопия
В этой статье
Резюме
Этот протокол описывает новый метод, позволяющий для количественного визуализации сложных формирования SNARE белков, основанный на передачи энергии резонанса Фёрстер и флуоресценции жизни изображений микроскопии.
Аннотация
Растворимые N- ethylmaleimide чувствительных фьюжн белка (NSF) вложение белка рецептора (SNARE) белки являются ключ для мембранных людьми, как они катализируют мембраны фьюжн в эукариотических клеток. Белка семьи SNARE состоит из около 36 различных членов. Конкретные внутриклеточных транспортных маршрутов катализируемые конкретные наборы 3 или 4 SNARE белков, которые таким образом способствуют специфика и верности оборота мембраны. Однако изучая точное предназначение SNARE белков является технически сложной задачей, потому, что ловушки очень обильные и функционально излишним, с большинство ловушек, имея несколько и дублирование функций. В этом протоколе описан новый метод для визуализации сложных формирования SNARE в живых клеток. Этот метод основан на выражая SNARE белков C-неизлечимо сливается с флуоресцентных белков и измерения их взаимодействие энергии резонанса Фёрстер передачи (ЛАДА) нанимающей флуоресценции жизни изображений микроскопии (FLIM). Путем установки жизни гистограмм флуоресцирования с моделью многокомпонентных распада, Лада-FLIM позволяет (полу-) количественной оценки доли SNARE комплекс формирования на различных везикулы. Этот протокол успешно применяется для визуализации SNARE комплекс формирования на плазматической мембраны и от англ отсеков в mammalian клетки линии и первичных иммунных клеток и может быть легко расширен для изучения функции ловушки на другие органеллы в животных, растений и грибковых клеток.
Введение
Торговля людьми мембраны является центральным элементом эукариотических клеток, где мембрана везикулы бутон от от доноров органелл и затем перейти к и предохранитель с целевой органеллы1,2. За исключением митохондрий все эти шаги фьюжн мембраны катализируемые членов SNARE белка семьи1,2. Белка семьи SNARE состоит из около 36 членов в mammalian клетках и около 20 членов в дрожжи2. Силки протеины содержат один или два ~ 52 остатков Лонг, изначально неструктурированных регионов, называемый SNARE-мотивы. Силки белки часто привязаны к мембраны трансмембранного спирали1,C-терминала2. Ловушки могут быть классифицированы на основании Центральной остатков, которые они вносят вклад в сложный ЛОВУШКУ в аргинин (R) и глютамин (Q) ловушки1,2. Мембрана фьюжн управляется взаимодействия 3 или 4 родственных ловушки, которые вместе способствовать 4 SNARE-мотивы и распространяются через доноров и акцепторов мембраны1,2. Силки комплекс состоит из одного мотива Р-ловушки и три Q-SNARE мотивы (называемых Qa, Qb и КК). Сложные образования начинается в N-Термини SNARE-мотивы, образуя так называемые транс-Силки-комплекс и приступает к C-Термини, образуя плотный α-винтовой биспиральных пакет называется СНГ-SNARE-комплекс. Комплекс формирования даже одну ЛОВУШКУ комплекс перетаскивает доноров и акцепторов мембраны вместе и преодолевает барьер для мембранных фьюжн3.
Назначение различных комплексов SNARE конкретных транспортных маршрутов в пределах клетки часто технически сложным. Хотя ловушки, несомненно, способствовать специфика мембраны людьми, они неразборчивый, функционально излишним, и их функции пересекаются1,2. Из-за этого возмущений эксперименты ориентации ловушек, таких как Нокаут гена, РНК-интерференция, введение блокирующих антител, или фрагментами растворимых SNARE, выступающей в качестве доминирующей негативы, часто не приводят к ясно фенотипов как другие Ловушки компенсировать2,4. Кроме того трудно дифференцировать конкретные мембраны фьюжн шаги от вверх по течению оборота событий, потому что ловушки могут быть вовлечены в нескольких транспортных маршрутов2. Локализация исследования сковывания микроскопии подходы, с помощью immunolabeling или генетических фьюжн репортер флуоресцентные белки, страдают от проблем, что: (i) ловушки найти несколько органеллы как они часто посредником несколькими людьми шаги и (ii) их локализации не означает автоматически, что функционально они участвуют в формировании комплекса SNARE. Наконец SNARE комплексы могут быть идентифицированы с помощью иммунопреципитации эксперименты с использованием одной из ловушки как приманку и другие ловушки как цели, но это не позволяет назначение этих комплексов для определенных органелл или маршруты незаконного оборота. Таким образом в настоящее время существует не альтернативный метод для визуализации SNARE комплексы с organellar резолюции. Иммунофлюоресценции не может доказать SNARE взаимодействий, но может показать только наличие или отсутствие совместного локализации, а иммунопреципитации только может показать SNARE взаимодействий в целом клеток населения, но не назначить органеллы где эти частотными.
Чтобы преодолеть эти ограничения, Роман метод, позволяющий для количественного визуализации SNARE комплексов в живых клеток с organellar резолюции недавно был разработан Verboogen и др. 5 этот метод основан на выражение пар ловушки с спектрально смещенные флуоресцентных белков, C-неизлечимо сливается с их трансмембранных спиралей. После завершения синтеза мембранных и формирования СНГ-Поймайте комплекс, эти флуорофоров на C-Термини трансмембранных спиралей немедленно сопоставленные друг другу. Флуорофоров, затем хорошо в пределах расстояния Фёрстер (обычно < 5 Нм), что привело в ладу Флюорофор Грин смещается доноров в красно смещается акцепторной Флюорофор5,6. ЛАДУ результаты закалки Флюорофор доноров и увеличение выбросов акцепторной Флюорофор, которая может быть измерена по соотношению доноров и акцепторов выбросов (ratiometric лад). Однако ratiometric ладу между двух различных молекул является сложной задачей, из-за кросс talk и различные уровни флуоресценции доноров и акцепторов ловушки на различные органеллы и среди клеток7,8. ЛАДУ могут также быть измерены от флуоресценции жизни, который является время между возбуждением и излучение фотонов. Если Флюорофор доноров может освободить свою энергию на ладу, этот конкурирующих результат процесса в явное сокращение жизни флуоресценции. Это может быть измерен FLIM7,8. Время существования ладу гораздо более надежными, чем ratiometric ладу для измерения взаимодействий между двух различных молекул, как флуоресценции жизни является неотъемлемой собственностью Флюорофор и нечувствительна к его концентрации. Кроме того Лада является приближение количественных, потому что эффективность ладу обратно пропорциональна шестой силу расстояние между доноров и акцепторов флуорофоров (по существу функция шаг). Таким образом путем установки флуоресценции жизни гистограммы зарегистрированных FLIM с моделью двухкомпонентных распада, Лада-FLIM позволяет для (полу-) количественной оценки доли SNARE молекул, участвующих в ЛОВУШКУ комплекс формирования5.
Недавно этот лад-FLIM метод был использован, Verboogen и др. для визуализации сложных формирования SNARE в первичной дендритных клеток иммунной системы5. Было показано, что при обнаружении патогенных стимул, дендритные клетки перенаправлять их мембраны торговли сопровождается повышенной комплексообразующие Р-ловушки связанные везикул мембранных белков (VAMP) 3 с Синтаксин Qa-SNARE 4 специально на плазматической мембраны. Скорее всего это повышенное образование сложных SNARE требуется для удовлетворения повышенной секреторной потенциала секрецию воспалительных цитокинов, таких как интерлейкина-65. Этот протокол описывает экспериментальные шаги, необходимые для приобретения ладу-FLIM данных для визуализации и (полу-) количественные измерения SNARE комплексов.Это объясняется как подходят поклеточного флуоресценции жизни гистограммы с моно - и Би экспоненциальный распад функций, что приводит к очевидным флуоресценции жизни как количественную оценку SNARE взаимодействий. В этом протоколе линия широко используемых клетки HeLa используется в качестве примера, но метод может быть легко расширен для изучения SNARE комплексов в других эукариотических клеток.
протокол
1. Подготовка образцов в Микроскоп
- Выражение Синтаксин Qa-SNARE 4 сливается с mCitrine (Синтаксин 4-mCitrine; Флюорофор доноров) и Р-ловушки VAMP3 сливается с mCherry (VAMP3-mCherry)
Примечание: Другие ловушки с флуоресцентных белков, сливается с их трансмембранных спиралей C-терминал может также использоваться. Вместо mCitrine-mCherry другие донорно акцепторной пар спектрально разлученных флуорофоров также может быть использоваться (например, СЛП-рекламы ЯФП).- НеЬа клетки растут и разделить 900.000 НеЬа клетки над тремя 35 мм диаметр стекла дно блюда подходит для микроскопии.
Примечание: В принципе, этот протокол может быть адаптированы для других типов эукариотических клеток и микроскопии блюда.- Поддержания культур клеток HeLa в T75 флакон с 10 мл высокой глюкозы Дульбекко, орла изменения среднего (DMEM), дополнены 10% плода телячьей сыворотки (FCS) и 1% антибиотик противогрибковое (содержащая амфотерицин B, пенициллина и стрептомицина) при 37 ° C и 5% CO 2 в инкубатор культуры клеток.
- Пополнять среднего два раза в неделю и разделение клетки 1:10 раз в неделю или когда клетки добраться до 85-90% confluency к новым T75 колбы (500000 клеток/флакон, в среднем).
- Удаление DMEM и мыть HeLa монослои дважды с 8 мл стерильного фосфат амортизированное saline (PBS) 3 мин.
- Удаление PBS и добавить 2 мл PBS с 2 мм Этилендиаминтетрауксусная кислота (ЭДТА).
- Инкубировать клетки для 5 минут при 37 ° C и 5% CO2 в инкубатор культуры клеток и впоследствии слегка агитировать Фляга для разделения клетки HeLa из нижней части колбы.
- Промыть клетки с 10 мл среды, передачи подвеска в 15 мл трубку и удалить 10 мкл Алиготе для подсчета.
- Разбавьте 1:1 с 0,4% Трипановый синий краситель Алиготе и подсчитать количество ячеек с Bürker Горяева9.
Примечание: Считайте два 4 x 4 квадратов и несколько клеток на количество клеток/мл на 10 000 человек. - После того, как клетки, подсчета, принять 900.000 клетки из 15 мл трубки, разделите их над 3 стекла дно блюда (см. шаг 1.1.1) и подготовиться к трансфекции.
- Transfect клетки путем электропорации10 (см. Таблицу материалы) с Синтаксин 4-mCitrine конструкции (доноров, пример #1), Синтаксин 4-mCitrine вместе с VAMP3-mCherry (пример 2) и Синтаксин 3 сливается с mCitrine и mCherry ( Пример #3).
Примечание: Другие методы transfection клетки также может быть использоваться11. Тандем в образце #3 является положительный контроль для оценки кратчайшее время жизни ожидаемого (т.е., максимальным ожидаемым ладу).
- НеЬа клетки растут и разделить 900.000 НеЬа клетки над тремя 35 мм диаметр стекла дно блюда подходит для микроскопии.
- Культура клетки в одночасье в высокие глюкоза DMEM поставляется с FCS 10% и 1% антибиотик противогрибковое при 37 ° C с 5% CO2 в инкубатор культуры клеток.
- Аспирационная DMEM и вымыть клетки один раз с живой клетки изображений среднего (140 мм NaCl, 2,5 мм KCl, 1.8 мм CaCl2, 1 мм MgCl2, 20 HEPES, рН = 7,4, мОсм = 300; см. Таблицу материалы) для 2 мин и впоследствии место клетки в свежих изображений Средний.
2. запись данных FLIM
- Место образца #2 под домена времени FLIM конфокального микроскопа с импульсным возбуждением источником для доноров Флюорофор (например, mCitrine) и сбора данных, время решена. Держите клетки при 37 ° C с подогревом стадии.
Примечание: С целью погружения воды 63 X 1.20 NA, пульсирующий белый лазерный свет оснащен конфокального микроскопа, используемые в настоящем Протоколе (пульсирующий 80 МГц, < длительность импульса 100 л.с.), фотон множитель трубки (ПЛТ) и Time-Correlated один фотон подсчета (TCSPC ) системы (см. Таблицу материалы для конкретной установки используется). Другие FLIM Микроскопы также может быть использоваться (например, Однофотонная лавинные диоды (SPAD) вместо ПМТС, одной длины волны Импульсные лазеры вместо белого света импульсных лазеров). - Выберите ячейку с видимым выражением mCitrine и mCherry меченых SNARE белков и записать образ конфокальный 256 × 256 пикселей с одновременным возбуждение обоих флуорофоров перед каждым измерением FLIM. Шаг пикселей примерно вдвое меньше, чем дифракции ограничено пространственным разрешением микроскопа (~ 200 Нм) должны быть использованы. Для mCitrine возбуждают в 516 Нм и собирать выбросов из 521-565 Нм; для mCherry возбуждают в 610 Нм и собирать выбросов из 613-668 Нм.
Примечание: Сделать не положение плоскости изображения слишком близко к нижней части блюдо (в течение ~ 2 мкм расстояние), так как это приведет к отражение пика в гистограмме жизни флуоресценции. Одновременного возбуждения доноров и акцепторов флуорофоров является предпочтительным, как это позволяет преодолеть потенциальные проблемы движения образца. Однако может также использоваться последовательного возбуждения. - Запись образа FLIM, нажав Запустить FLIM с изображением FLIM записывается с одинаковыми размерами и пространственным разрешением как конфокальное изображение записал на шаге 2.2. Запись изображения по крайней мере 50 000 фотоны поклеточного FLIM анализ, или по крайней мере 400 фотоны/пиксель. Только будоражат доноров Флюорофор mCitrine и не Флюорофор акцепторной mCherry и таким образом возбуждают в 516 Нм и собирать выбросов из 521-565 Нм.
- Повторите шаги 2.1-2.3 для нескольких ячеек и для других образца #1 (только для доноров) и пример #3 (mCitrine-mCherry тандем конструкции).
- Запись функция ответа инструмент (МАФ). Настройтесь монохроматора выбросов детектор длина волны возбуждения (например, запись выбросов от 510-550 Нм) и затем запишите образ FLIM с обратно рассеяния от чистого стекла Крышка выскальзования, нажав на кнопку Запуска FLIM. Использовать же волны возбуждения (516 Нм) и лазерной энергии, как для записи данных ячеек на шаги 2.1-2.4.
Примечание: Если несколько пиков видны в МАФ или монохроматоры выбросов не могут быть настроены, МАФ также может быть измерена с раствором Люминесцентную краску с сверхбыстрым временем жизни, например, тушения флуоресценции органического красителя в насыщенный водный раствор йодида калия. Кроме того это не строго необходимо для записи МАФ, потому что распад склона гистограмм флуоресцирования также могут быть установлены без деконволюция МАФ. Однако МДФ позволяет исправить для временные характеристики детектора фотонного используется и тем самым делает подходит гистограммы жизни более точным.
3.Преобразование записей Фотон FLIM изображений
- Скачать и установить программное обеспечение преобразования PT32ICS5.
Примечание: Время существования данных также могут быть проанализированы другие программного обеспечения, включая программное обеспечение от нескольких производителей микроскопов. - Настройка программного обеспечения PT32ICS.
- Задайте Размер 256 × 256 пикселей размер изображения через Параметры | Размер.
- Установите канал 2 через настройки | Размер.
Примечание: Канал mCitrine выбросов зависят исключительно от конфигурации микроскопа. Неправильно канала приведет к FLIM изображение с не фотонов (т.е., черный изображение) и как следствие пустой «LifetimeTable.txt»-файл. Правильный канал могут быть определены путем проб и ошибок. - Установить выходной ImageJ (xyz) (или TRI2 (xyt)) для создания изображений FLIM (шаг 3.4).
- Нажмите кнопку преобразовать и загрузить один или несколько фотонных следы (файлы .pt3). Чтобы выбрать несколько трассировок фотон, держите нажатой клавишу Ctrl .
Примечание: Новые 64-битный формат .ptu также может быть преобразован. - Убедитесь, что программное обеспечение PT32ICS создает следующие файлы в ту же папку, в которой будут сохранены файлы pt3: один фотон стек за .pt3 Фотон трассировки в стандартный формат изображения цитометрии (.ics), один растровый файл в .pt3 Фотон след (.bmp), текстовый файл за конверсию (_Report.txt) содержащий информацию о Фотон статистики (например, общее количество фотонов в каждой .pt3 Фотон трассировки, время резолюции детектора) и второй текстовый файл за конверсию (_LifetimeTable.txt), содержащий общее гистограмм флуоресцирования жизни в формате с разделителями табуляции для каждого .pt3 Фотон трассировки.
Примечание: ICS-файл может использоваться для одного пикселя, уместно, чтобы генерировать FLIM изображения, например с TRI2 программного обеспечения12,13 или тонкий кривой библиотеки в Фиджи ImageJ14,15. Этот файл может также использоваться для фазового анализа16, например с Gated Phasor время плагин для Фиджи от Spechron. Файл точечного рисунка не содержит жизни информацию. Второй текстовый файл используется для анализа состава клеток FLIM в шаге 4.
4. Монтаж гистограмм флуоресцирования жизни для анализа поклеточного FLIM
Примечание: Этот шаг (deconvoluted установка МАФ) требует программного обеспечения, способный deconvoluted установку. Монтаж на склонах гистограмм флуоресцирования без деконволюция МАФ может быть сделано с другим программным обеспечением, а также.
- Откройте программу программное обеспечение анализа данных, способной установку с Деконволюция (Таблица материалов) и импортировать текстовый файл, содержащий гистограмму для Каждый фотон трассировки (_LifetimeTable.txt) через файл | Импорт | Одноместный ASCII.
- Реорганизовать таблицу таким образом, что МАФ находится во втором столбце таблицы (с помощью копирования и вставки). Место МАФ во втором столбце B рядом с время значения в первом столбце A.
- Определить качество записанных Фотон следы, выбрав все столбцы, нажав Ctrl + A и выбрав участок | Мультипанельные | 9 Группа. Не анализировать Фотон следы с высоким отражением пик (Рисунок 4F).
- Выберите все столбцы, содержащие гистограммы контролем качества жизни, которые будут установлены, а также МАФ в столбце B, с помощью Ctrl ключ и загрузить нелинейного монтажа через анализ | Оборудование | Нелинейные Кривая Fit | Открыть диалоговое окно.
- Загрузить deconvoluted нужным функцию (доступна в дополнительный файл 1) путем добавления этой функции в программное обеспечение для анализа (через категории | Определяемые пользователем | Функции | Добавить). Выберите форму функции файл «FLIM_convoluted_IRF.fdf». Эта функция подходит жизни гистограмм флуоресцирования с функцией моно экспоненциальный распад deconvoluted с МАФ (т.е., второй столбец B в таблице) (уравнение 1):
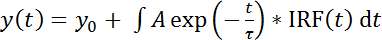 (Уравнение 1)
(Уравнение 1)
с т время, τ очевидной флуоресценции жизни, А амплитуда и y0 смещение.
Примечание: Еще одним вариантом является соответствовать жизни гистограмм с Би экспоненциальная функция fit (уравнение 2):
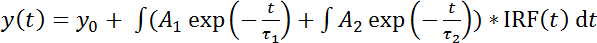 (Уравнение 2)
(Уравнение 2)
Фиксируя жизни медленный компонент (τ1) единственное условие доноров (шаг 1.1.2: Пример #1) и что быстро компонента (2τ) к конструкции тандем (пример #3), это позволяет оценки фракции Силки белков в комплексе (F) от амплитуды медленно (1A) и быстро компонентов (В2; см. обсуждение; Уравнение 3):
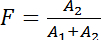 (Уравнение 3)
(Уравнение 3)
В дополнительный файл 2доступен файл подходят функции для deconvoluted Би экспоненциальный установки «FLIM_convoluted_IRF_biexp.fdf». - Выберите установлены кривых | X тип данных как же как входные данные.
Примечание: Это приведет к соответствующим x-ось масштабирование кривых. - Соответствовать кривых, нажав Fit.
Примечание: Это будет конвертировать fit и генерировать лист отчета в массиве с таблицей, содержащей флуоресценции продолжительностей жизни, отводы и амплитуд. Он также будет генерировать данные листа с кривых и остатков fit.
Результаты
Обоснование анализа для измерения SNARE взаимодействий на ладу-FLIM показан на рисунке 1. C-Термини трансмембранных спиралей родственных белков SNARE сплавлены к паре спектрально смещенные флуоресцентных белков (например, mCitrine и mCherry). Формирование СНГ-Поймайте комплекс мембраны слияние результатов в этих флуоресцентных белков, сразу же становится сопоставленные друг другу и ладу. Рисунок 2 показывает представитель конфокальный изображения клетки HeLa, выражая дневно меченых SNARE белков. Показано выражают ячейки Синтаксин 4-mCitrine (доноров Флюорофор) с VAMP3-mCherry (акцепторной Флюорофор), а также контролировать условия клеток, выражая только Синтаксин 4-mCitrine конструкция (только доноров; не ладу) и Синтаксин 3 сливается с обеих mCitrine и mCherry в тандеме (максимальным ожидаемым лад). Рисунок 3 показывает, сопровождающих флуоресценции жизни и FLIM изображения, созданные на установку гистограммы жизни каждого пикселя с моно экспоненциальный распад функции (рис. 3A–B) и (Би экспоненциальный распад функции Рисунок 3 c - D). рисунке 4A показано МАФ нашей установки измеряется обратно рассеяния крышки стекла микроскопа. В рисунке 4В–E, представитель флуоресценции гистограммы жизни всей ячейки FLIM анализ вместе с сопроводительными подходят показаны кривые для моно экспоненциальный распад функции. Рисунок 4F показана гистограмма флуоресцентный жизни эксперимента образ слишком близко к поверхности покрытия стекла микроскопа, результате видно отражение пика. Рисунок 4 g показывает гистограмму жизни с представителем подходят с функцией Би экспоненциальный распад.

Рисунок 1: схема обоснования для визуализации SNARE комплексы лад. (A) структурная модель нейрональных ловушки (белок базы данных 3HD717) связанные везикул мембранных белков (VAMP) 2 (синий; R), Синтаксин 1 (красная; Qa-SNARE) и SNAP25 (зеленый; содержит как мотив Qb - и Qc-SNARE). C-конечная трансмембранного спирали Синтаксин-1 конъюгированных с mCitrine (Флюорофор доноров; белка базы данных 3DQ118). C-конечная трансмембранного спирали VAMP2 конъюгированных с mCherry (акцепторной Флюорофор; белка базы данных 2H5Q19). (B) схемы SNARE при посредничестве мембраны фьюжн, что приводит к ладу. После сплавливания мембраны путем формирования СНГ-ловушки, Силки комплекс немедленно сопоставленные друг с другом, что приводит к ладу. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
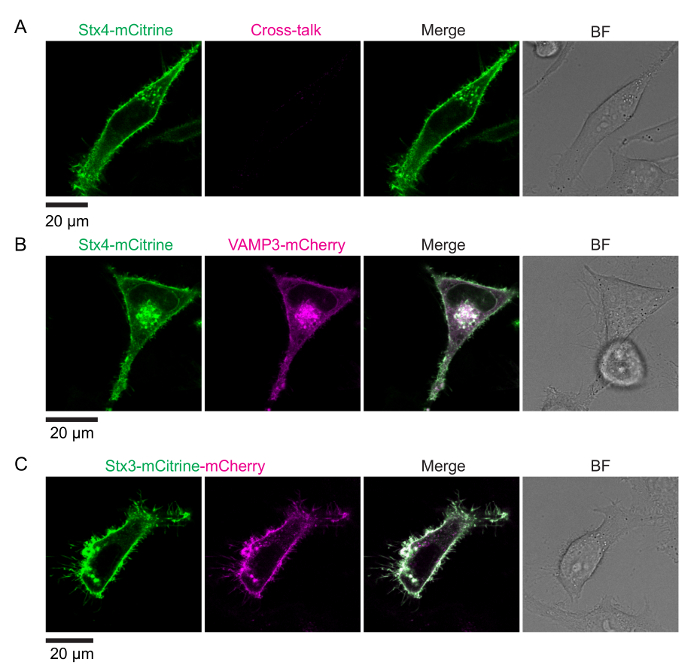
Рисунок 2: выражение SNARE белков сливается с флуоресцентные белки. Первый столбец: Флюорофор доноров, возбужденных в 516 Нм. Второй столбец: акцепторной Флюорофор, возбужденного в 610 Нм. (A) доноров только условие. Представитель конфокальное изображение НеЬа клетки, выражая Синтаксин 4-mCitrine (Флюорофор доноров; зеленый слияния). Акцептор канал (вторая колонка) показывает флуоресценции кросс talk. (B) отрицательный контроль (не беспокоить). Представитель конфокальное изображение НеЬа клетки, выражая оба Синтаксин 4-mCitrine с VAMP3-mCherry (акцепторной Флюорофор; пурпурный слияния). (C) положительный контроль (максимальным ожидаемым лад). Представитель конфокальное изображение клетки HeLa, выражая тандем 3-mCitrine-mCherry Синтаксин построить. Обратите внимание, что сигнал флуоресценции mCitrine и mCherry сигналов, делает не полностью перекрываются, вероятно, из-за снижения сопротивления mCitrine лизосомальных деградации, по сравнению с mCherry (см. раздел "обсуждение"). BF: поле и ярко. Масштаб баров, 20 мкм. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
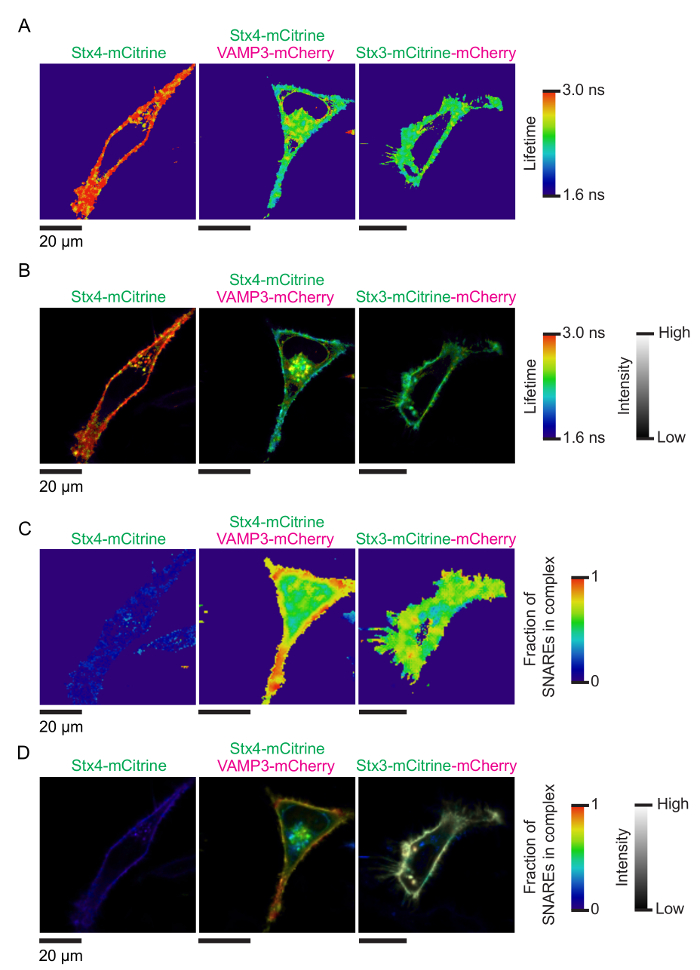
Рисунок 3: FLIM изображения комплекс формирования SNARE. (A) представитель флуоресценции образы жизни клеток, показано на рисунке 2. Изображения были получены путем преобразования следы фотон, Записанная системой TCSPC (.pt3) для изображения цитометрии стандарт (.ics) с помощью программного обеспечения PT32ICS. Пиксель установлены флуоресценции жизни, генерации изображения были затем использование TRI2 программного обеспечения12,13 с порога от 15-100% интенсивности, 7 пикселей круговой биннинга и monoexponential применении алгоритма (Марквардт). Цвет показывает средний очевидной флуоресцентные жизни. (B) FLIM изображения, где образы жизни флуоресцирования (показано в группе A) были замысловатого с интенсивностью флюоресценции mCitrine доноров Флюорофор (показано на рис. 2). Свертка была выполнена с ImageJ Фиджи с помощью макроса на заказ (см. Таблицу материалы). (C) флуоресценции жизни и FLIM изображения клетки HeLa, выражая Синтаксин 4-mCitrine и VAMP3-mCherry от групп A-B, но теперь с установку с Би экспоненциальный распад кривых (с продолжительностей жизни, крепится к условиям управления; см. шаг 4.4 в протокол). Пиксель цвета указывают оценкам фракций F Синтаксин 4 в комплексе с VAMP3 (уравнение 3). (D) так же, как группа B, но для Би экспоненциальный подходят. Свертка была выполнена с ImageJ Фиджи с помощью макроса на заказ (см. Таблицу материалы). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
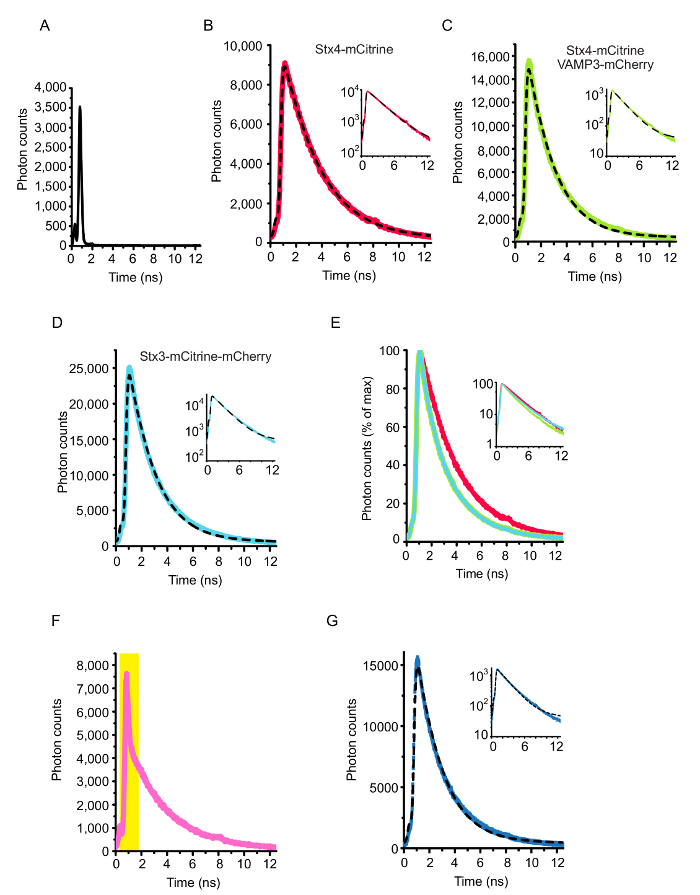
Рисунок 4: вся ячейка анализ FLIM. (A) Функция реагирования инструмент (МАФ) установки. МАФ была измерена с помощью обратно рассеяние на интерфейсе стекла воды (с помощью микроскопии чистую стеклянную посуду, содержащих воду).(EB–) Все ячейки жизни гистограммы для клетки, показано на рисунке 2 и на рисунке 3. Все Фотоны присутствует в образы, были объединены. Кривые были deconvoluted с МАФ и оснащены функциями моно экспоненциальный распад (уравнение 1). Для этих клеток, флуоресценции продолжительностей жизни были получены из 2.82 ns (клетки, выражая только Синтаксин 4-mCitrine; доноров только группы B), 2.09 ns (клетки совместно выражая Синтаксин 4-mCitrine с VAMP3-mCherry; панель C) и 2,08 ns (клетки, выражая Синтаксин 3 - mCitrine-mCherry тандем построить; Максимальная ожидаемого ладу управления; Группа D). Вставками показывают же графики, но теперь с логарифмической шкале по оси y. Группа E показывает оверлей распада кривых панелей B-D. (F) пример гистограммы флуоресцентные жизни записал слишком близко к поверхности скольжения обложки микроскопа. Это приводит к большой отражение пик (изображен желтый затененной области). (G) так же, как Группа C, но теперь установку с Би экспоненциальный распад кривой с продолжительностей жизни фиксированной к условиям управления (см. шаг 4.4 в протоколе). Амплитуды быстрый (1A) и медленной (2A) компоненты были 14.42 и 0.01, соответственно, что приводит к оценкам доля ловушки в сложных F 0,99 (уравнение 3). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Дополнительный файл 1. Функцию файл FLIM_convoluted_IRF пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный файл 2. Функцию файл FLIM_convoluted_IRF_biexp пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Этот протокол демонстрирует использование ладу-FLIM для визуализации SNARE взаимодействий между Синтаксин 4 и VAMP3 в живых клеток HeLa. Синтаксин 4 — это белок Qa-ЛОВУШКУ, преимущественно местонахождения на плазматической мембраны, где он опосредует экзоцитоз1,2,,2021. VAMP3 является Р-ЛОВУШКУ, которая главным образом описал найти на рециркуляции от англ отсеков и опосредует людьми в других endosomes, а также плазматической мембраны1,2,20. Однако Лада-FLIM assay можно легко адаптировать для изучения других белков SNARE. Единственным условием является, что эти ловушки содержат C-терминал трансмембранного спирали, что характерно для большинства белков SNARE далеко1,2. Кроме того протокол, описанные здесь могут быть адаптированы для визуализации SNARE комплексов в любой тип эукариотических клеток, включая растения и дрожжей. В этом протоколе мы использовали сокращение флуоресценции жизни Флюорофор доноров как мера ладу. Как дополнительный подход жизни акцепторной Флюорофор могли бы быть изучены, которая обеспечивает недвусмысленное доказательство что резонанс передача энергии происходит потому что сенсибилизированных излучение вызывает собственный рост фаза.
В настоящее время лад-FLIM техника может быть не способны визуализировать SNARE комплексов в лизосомальных отсеках. Для конструкции 3-mCitrine-mCherry тандем Синтаксин флуоресценции mCherry часто можно найти более накопленных в районе juxtanuclear, который вероятно соответствует лизосомальных отсеков, в то время как mCitrine сигнал более обильны в сотовых периферии5. Аналогичные juxtanuclear накопление mCherry, по сравнению с mCitrine было отмечено, когда же белки SNARE, сливается с этим флуоресцентные белки были совместно выразили5. Лизосомы, характеризуются чрезвычайно низкий рН (< 4) и высокая активность протеолитических ферментов. Накопление juxtanuclear mCherry скорее всего вызвана высоким сопротивлением mCherry Флюорофор лизосомальных деградации, по сравнению с mCitrine Флюорофор. Это не благодаря рН закалки mCitrine, как juxtanuclear накопление mCherry также происходит после фиксации клетки5. Таким образом метод ладу-FLIM недооценивает количество лад в регионах (лизосомальных) juxtanuclear и это потребует других флуоресцентные репортер белков, которые выжить в суровых условиях в пределах люмен лизосом.
ЛАД-FLIM в принципе позволяет получить (полу-) количественная оценка доли ловушки в комплексе5. Как мы объясняли в настоящем Протоколе, это требует установку жизни гистограмм флуоресцирования с двойной экспоненциальный распад функции (уравнение 2), где быстрые компонента пропорциональна амплитуде на долю ловушки в комплексе ( Уравнение 3). Однако такие установки с 2 компонентная модель является технически сложным. Установки с несколькими параметрами бесплатно подходят (две жизни флуоресценции и два амплитуд) требует очень большое количество фотонов, особенно поскольку параметры будут влиять друг на друга и небольшие ошибки в жизни будет влиять на амплитуд и вице- VERSA. Для преодоления этих проблем установки, флуоресценции продолжительностей жизни медленно компонента могут быть установлены для жизни доноров единственное условие (т.е., не МУЧИТЬ; только mCitrine настоящее время) и что быстро компонента жизни тандем построить ( Максимальная ожидаемого лад). Однако это должно также интерпретировать с осторожностью, потому что флуоресценции продолжительностей жизни не могут же, как и эти управления государства и может отличаться из-за нескольких причин (самостоятельно закалки, ориентацию диполя, вариации в микроокружения). Несколько комплексов SNARE в непосредственной близости (< 10 Нм) может результат в расстояни зависимая ладу, тот же принцип, что позволяет лад для использования в качестве «молекулярная правитель», но в этом случае, скрывает количественная оценка SNARE комплексов. Кроме того количественная оценка не всегда имеет смысл, потому что помечены сковывания конкурировать с ловушки эндогенные (без метки). Как следствие уровень экспрессии mCherry меченых SNARE является основным фактором, определяющим для процент ладу5. Из-за всех этих оговорок рекомендуется подогнать флуоресцентные жизни гистограммы с функцией моно экспоненциальный распад (уравнение 1). Это имеет то преимущество, что она не требует каких-либо априорных знаний продолжительностей жизни и результате очевидной средняя флуоресцентные жизни обеспечивает Твердомеры для SNARE комплексообразующие5.
Тем не менее ожидается, что количественные ладу-FLIM изображений двухкомпонентные установки моделей будет иметь мощный будущих приложений. Силки кодирование генов в хромосоме могут сливается с репортер флуоресцентные белки, например, ТРИФОСФАТЫ/CAS9. Это приводит к люминесцентные маркировки эндогенного SNARE белков, с уровня эндогенного белка и никакую предпосылку немеченого ловушки и таким образом позволяет для значимого количественной оценки доли SNARE комплексов ладу-FLIM. В то время как выражение уровня эндогенного ловушки может быть довольно низким и дать относительно низкой флуоресцентные сигналов, ожидается, что может быть получено достаточное количество фотонов, особенно для всей ячейки FLIM (который требует лишь несколько 1000 фотонов). Кроме того эти ладу-FLIM измерения могут быть выполнены с более чувствительным лавинный фотодиод детекторов, которые приведет также к выше флуоресценции сигналов и лучше Фотон статистики.
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Эта работа была поддержана Ипатия стипендий от Медицинский центр университета Radboud, премию развития карьеры от человека пограничной науки программы, программы 2013 гравитации из Нидерландской организации научных исследований (НВО; ICI-024.002.009), ВиДи грант от НВО (ALW ВиДи 864.14.001) и начиная с Грант от Европейского совета научных исследований (ERC) под седьмой рамочной программы Европейского союза (Грант соглашения номер 336479).
Материалы
| Name | Company | Catalog Number | Comments |
| Plasmid DNA 'syntaxin 4-mCitrine' | Addgene | ID 92422 | Other SNAREs with fluorescent proteins fused to their C-terminal transmembrane helices can also be used. Instead of mCitrine-mCherry, other donor-acceptor pairs of spectrally separated fluorophores can also be used (e.g., CFP-YFP). |
| Plasmid DNA 'VAMP3-mCherry' | Addgene | ID 92423 | Other SNAREs with fluorescent proteins fused to their C-terminal transmembrane helices can also be used. Instead of mCitrine-mCherry, other donor-acceptor pairs of spectrally separated fluorophores can also be used (e.g., CFP-YFP). |
| Plasmid DNA 'syntaxin 3-mCitrine-mCherry' | Addgene | ID 92426 | Positive control for maximum achievable FRET. |
| Hela cells | |||
| 35 mm glass bottom dishes | Willco Wells | HBST-3522 | Other live cell imaging chambers will work as a substitute |
| Dulbecco's Modified Eagle Medium | Gibco, Life Technologies | 31966-021 | |
| Fetal calf serum | Greiner Bio-one | 758093 | |
| Antibiotic-antimycotic solution | Gibco, Life Technologies | 15240-062 | Pen/Strep will work as a substitute |
| Live cell imaging medium | Thermo Fisher Scientific | A14291DJ | Any other live cell imaging solution will work, as long as fluorescence from the medium is prevented |
| Leica SP8 confocal microscope with a 63x 1.20 NA water immersion objective | Leica | SP8 | Other confocal microscopes capable of time-domain FLIM can also be used |
| Pulsed white light laser | Leica | SP8 | Other pulsed laser sources can also be used |
| Time-Correlated Single Photon Counting (TCSPC) system | PicoQuant | PicoHarp 300 | |
| PT32ICS conversion software | Available at the 'Software'-section of www.membranetrafficking.com | ||
| data analysis software programme capable of deconvolution | Originlabs | OriginPro 2016 | |
| Fiji ImageJ | |||
| Custom-made Fiji ImageJ macro for convolution of FLIM image with Intensity | Fiji ImageJ | Available at the 'Software'-section of www.membranetrafficking.com | |
| Bürker Haemocytometer | VWR | 630-1541 | |
| HeLa cells | ATCC | ATCC CCL-2 | |
| PBS | B Braun Melsungen AG | 362 3140 | |
| EDTA 2 mM | Merck | 108417 | CAS: 60-00-4 |
| 15 mL tubes | Greiner Bio-one | 188271 | |
| Trypan blue | Sigma Aldrich | 93595 | CAS: 72-57-1 |
| NEON cell electroporation device | Thermo Fisher Scientific | MPK5000S |
Ссылки
- Jahn, R., Scheller, R. H. SNAREs - engines for membrane fusion. Nat Rev Mol Cell Biol. 7 (9), 631-643 (2006).
- Hong, W. SNAREs and traffic. Biochim Biophys Acta. 1744 (2), 120-144 (2005).
- van den Bogaart, G., Jahn, R. Counting the SNAREs needed for membrane fusion. J Mol Cell Biol. 3 (4), 204-205 (2011).
- Bethani, I., Werner, A., Kadian, C., Geumann, U., Jahn, R., Rizzoli, S. O. Endosomal fusion upon SNARE knockdown is maintained by residual SNARE activity and enhanced docking. Traffic. 10 (10), 1543-1559 (2009).
- Verboogen, D. R. J., González Mancha, N., Ter Beest, M., van den Bogaart, G. Fluorescence lifetime imaging microscopy reveals rerouting of SNARE trafficking driving dendritic cell activation. eLife. 6, (2017).
- Degtyar, V., Hafez, I. M., Bray, C., Zucker, R. S. Dance of the SNAREs: assembly and rearrangements detected with FRET at neuronal synapses. J Neurosci. 33 (13), 5507-5523 (2013).
- Jares-Erijman, E. A., Jovin, T. M. FRET imaging. Nat Biotechnol. 21 (11), 1387-1395 (2003).
- Wallrabe, H., Periasamy, A. Imaging protein molecules using FRET and FLIM microscopy. Curr Opin Biotechnol. 16 (1), 19-27 (2005).
- JoVE Science Education Database Basic Methods in Cellular and Molecular Biology. Using a Hemacytometer to Count Cells. JoVE. , (2017).
- Thermo Fisher Scientific. . NEON transfection system cell protocols HeLa. , (2017).
- Kim, T. K., Eberwine, J. H. Mammalian cell transfection: the present and the future. Anal Bioanal Chem. 397 (8), 3173-3178 (2010).
- Barber, P. R., Ameer-Beg, S. M., Gilbey, J. D., Edens, R. J., Ezike, I., Vojnovic, B. Global and pixel kinetic data analysis for FRET detection by multi-photon time-domain FLIM. Proc. SPIE. 5700, 171 (2005).
- Barber, P., et al. Multiphoton time-domain fluorescence lifetime imaging microscopy: practical application to protein-protein interactions using global analysis. J R Soc Interface. 6 (Suppl 1), S93-S105 (2009).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nat Methods. 9 (7), 671-675 (2012).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat Methods. 9 (7), 676-682 (2012).
- Hinde, E., Digman, M. A., Welch, C., Hahn, K. M., Gratton, E. Biosensor Förster resonance energy transfer detection by the phasor approach to fluorescence lifetime imaging microscopy. Microsc Res Tech. 75 (3), 271-281 (2012).
- Stein, A., Weber, G., Wahl, M. C., Jahn, R. Helical extension of the neuronal SNARE complex into the membrane. Nature. 460 (7254), 525-528 (2009).
- Barstow, B., Ando, N., Kim, C. U., Gruner, S. M. Alteration of citrine structure by hydrostatic pressure explains the accompanying spectral shift. PNAS. 105 (36), 13362-13366 (2008).
- Shu, X., Shaner, N. C., Yarbrough, C. A., Tsien, R. Y., Remington, S. J. Novel chromophores and buried charges control color in mFruits. Biochemistry. 45 (32), 9639-9647 (2006).
- Veale, K. J., Offenhäuser, C., Lei, N., Stanley, A. C., Stow, J. L., Murray, R. Z. VAMP3 regulates podosome organisation in macrophages and together with Stx4/SNAP23 mediates adhesion, cell spreading and persistent migration. Exp Cell Res. 317 (13), 1817-1829 (2011).
- Gómez-Jaramillo, L., et al. Syntaxin-4 is implicated in the secretion of antibodies by human plasma cells. J Leukoc Biol. 95 (2), 305-312 (2014).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены