Method Article
Обтекаемый 3D мозжечковой дифференциация протокол с Факультативным 2D модификации
В этой статье
Резюме
Мы опишем среднего определен протокол для hPSCs, с использованием упрощенных 3D дифференциации и снижение факторов роста, способны генерировать агрегаты клеток с раннего нейроэпителиальных структуры и позитивные мозжечковой связанные маркеры, а также необязательный 2D модификация для дифференциации клеток как однослойная для создания функциональных нейроны.
Аннотация
Уменьшение сложности и стоимости дифференциации протоколов имеет важное значение для исследователей. Этот интерес подходит с опасения по поводу возможных непреднамеренных последствий что кучность внешние факторы могут ввести в человеческих плюрипотентных стволовых клеток (hPSC) модели развития мозга или патофизиологии, например маскировки болезни фенотип. Здесь мы представляем два мозжечковой дифференциация протоколы для hPSCs, разработан с простой способ запуска, меньше патронирования факторов и меньше материальных требований, чем предыдущих протоколов. Недавно мы разработали процедуры культуры, которые генерируют свободные 3-мерной (3D) продуктов, согласуется с другими протоколами «органоид» мозга, включая морфологии отношение к моделированию развития мозга как sub/Вентрикулярная зона - и ромбических губы подобных структур. Второй использует сторонником, 2D монослоя процедуру полной дифференциации, которая показана способны генерировать функциональных нейроны мозжечка, как продукция являются позитивными для мозжечковой связанные маркеры и выставку нейроноподобных кальция притоков. Вместе эти протоколы предлагают ученых на выбор вариантов подходит для различных научно-исследовательских целей, а также базовой модели для тестирования других видов обтекаемый нейронных дифференцирования.
Введение
В vitro протоколы для дифференциации hPSCs сторону мозжечковой линий первоначально действовали на принципе передразнивать в vivo мозжечковой развития1,2,3,4. Таким образом они требуют целого ряда факторов, представил в определенное время для про мозжечковая кучность и созревания. Главными среди них были WNT, костных морфогенетических белков (БМП) и факторы роста фибробластов (FGFs) с известных ролей в середине задний мозг развитие и формирование наружного Организатор5,6,7. Конечно каждый дополнительный шаг и фактор означает увеличение трудоемких манипуляции и больших расходов для исследователя, и поэтому разработка проще протоколы, способной на равных результатов представляет интерес. Этот практический вопрос хорошо согласуется с гипотетический вопрос, ли клетки требуют такой жесткой, внешний контроль над их развития в пробирке.
Мозжечковая дифференциации протокол, опубликованный в 2015 году выступил необходимость использования обширные количество факторов роста, используя только FGF2, FGF19 и стромальных клеток, полученных фактор 1 (SDF1) для структурирования цели8. Это исследование также отличается от предыдущих мозжечковой протоколов, с помощью системы свободного плавающего 3D культуры. Помимо производства позитивных клеток мозжечка маркеров, мозг «organoids» порожденных их техника были продемонстрированы выставить соответствующие морфологии, недоступны в традиционных 2D монослоя культур, таких как ромбические губ подобных структур. Хотя и менее сложным и дорогостоящим в отношении факторов роста, другие функции, такие как формирование единой embryoid органов (EBs) и культуры в 96-луночных пластины (96WPs), сделал это процедурно комплекс во время первоначальных шагов. Еще один 3D протокол опубликован в том же году, сообщает успешной дифференциации нейронных линий, с помощью общих и недорогой клеточной культуры техники9. Хотя эта группа изучает корковых вместо мозжечковой дифференциации, нельзя исключать применение их концепции мозжечковой дифференциации.
Недавно мы сообщили 3D мозжечковой дифференциация протокол, с помощью сокращения числа факторов патронирования (а именно, FGF2, 4 и 8), а также Упрощенная установка, сохраняя клетки в тарелки (6WPs) 6-хорошо во всем, чтобы свести к минимуму средних требований10. Чтобы помочь производства гранул клеток, сглаженную агонистов (SAG) был использован на этапе окончательного созревания. SAG является менее дорогим химические альтернативы Еж Соник (ТСС), который был использован в ранее мозжечковой протоколов, из-за его роль в содействии росту блок клеток прекурсоров (НКТ) в естественных условиях1,2, 11,12,13. Дифференциация продукции согласуются с теми, от других 3D протоколов, включая присутствие мозжечковой связанные маркеры в морфологически соответствующих структур8,9. Такие результаты укрепить ранее сообщение, что подробные мимикрия в естественных условиях окружающей среды не может быть необходимым для сложных 3D в vitro дифференциация протоколов.
В дополнение к 3D протокол, этот доклад описывает 2D протокол, разработанный с же быстрой установки, основные материалы и сокращено количество факторов роста. Он способен производить клетки из человеческих эмбриональных стволовых клеток (ЭСК) или индуцированных плюрипотентных стволовых клеток (hiPSCs), положительный для маркеров, связанные с рано нейронные, мозжечка и блок ячеек самобытности. Кроме того кальций изображений указывает на присутствие функциональных человеческих нейронов. Возможность выбора между протоколами, добавляет уровень гибкости для исследователей, для тех, кто заинтересован в либо: (1) формирование определенных ячеек типов, (2) моделирование развития человеческого мозга и связанные структуры, (3) анализ оптимизированы в монослое Параметры (например, патч зажим записей), или (4) ячеек взаимодействий в смешанных нейронных культур. Их простой и недорогой природа делает их доступными для исследователей, которые являются новыми в hPSC поле, или нужна база hPSC процедуры из которого для дальнейшего изучения вариантов дифференцировки.
протокол
1. Подготовка
Примечание: Для всех шагов смотрите Таблицу материалы для конкретных элементов.
-
Подготовка 500 мл определены hPSC питательной среды для hPSC культуры
Примечание: Используйте среднего для шагов 2.1-2.6.- Размораживание hPSC средних дополнения на ночь (o/n) при 4 ° C. Удаление 12,5 мл hPSC базовой среды из средних бутылку, а затем добавить 10 мл дополнения и 2,5 мл (делая 100 U/L) пенициллина/стрептомицина (Pen/Strep) к бутылке.
- Хранить при 4 ° C и использовать в течение 2 недель.
Примечание: Средство hPSC может использоваться для замораживания вниз клеток путем добавления 10 мкм рок ингибитора (РИ) и 10% ДМСО.
-
Подготовка 1 Л нейронных обслуживания среднего (НММ) дифференциация культуры
Примечание: Используйте среднего для шагов 3.1-4.4.- Mix глютамина укрепленные DMEM/F12 и нейронных основных средних (соотношение 1:1) в 1 Л бутылки, то дополнение с дополнением N2 (1 x), (1 x) B27 дополнение, 5 мкг/мл инсулин, 1,5 мм L-глютамином, 100 мкм несущественные аминокислот (NEAA), 100 U/L ручка/воспаление и 10 мкм бета меркаптоэтанол.
- Хранить среды при температуре 4 ° C и использовать в течение 3 недель.
Примечание: Перед добавлением добавки к смешанной базальной среднего, удалите соответствующий объем скорректировать объем добавлены компоненты, основанные на складе концентрации.
-
Подготовка 500 мл 0,5 мм ЭДТА рабочего раствора для пассированый hPSCs
Примечание: Используйте среднего для шагов 2.4 и 2.5.- Под капотом потока передачи 49 мл из фосфата буфер солевой (PBS) от бутылка 500 мл стерильного PBS Тюбик 50 мл. Добавьте 0,5 мл 0,5 М ЭДТА и 0,9 г NaCl в Тюбик 50 мл. Аккуратно перемешать, распустить.
- Фильтр стерилизуйте решение с использованием 0,22 мкм фильтром и передачи для стерильных PBS бутылка 500 мл. Хранить при комнатной температуре (RT).
-
Подготовка hPSC культуры плиты для hPSC культуры
Примечание: Используйте пластины для шагов 2.1-2.6.- Сделать 50 x рабочего раствора hPSC соответствующие адэрентных покрытия (ГООК): оттепель флакон ГООК o/n при 4 ° C. Разбавьте ГООК в соотношении 1:1 с DMEM/F12 и передачи как 400 мкл аликвоты в 1,5 мл пробирок. Магазин 50 x рабочего раствора ГООК-80 ° c.
Примечание: ГООК (важно) затвердевает быстро на RT, поэтому необходимо, чтобы все компоненты (DMEM, трубки и т.д.) хранятся на льду (или на 4 ° C). - Оттепель труба 50 x рабочего раствора ГООК при температуре 4 ° C, а затем разбавить 50 x в холодной среде DMEM/F12. Добавьте 750 мкл/колодец разреженных ГООК в 6WP. Инкубировать пластина для по крайней мере 1 ч при 37 ° C.
Примечание: ГООК пластины могут быть сохранены для 1 недели при температуре 4 ° C, обтекания пластины после 1 h инкубационного периода. Теплый пластины до 37 ° C перед использованием.
- Сделать 50 x рабочего раствора hPSC соответствующие адэрентных покрытия (ГООК): оттепель флакон ГООК o/n при 4 ° C. Разбавьте ГООК в соотношении 1:1 с DMEM/F12 и передачи как 400 мкл аликвоты в 1,5 мл пробирок. Магазин 50 x рабочего раствора ГООК-80 ° c.
-
Подготовить антиадгезионные (AA) пластины для дифференциации культуры
Примечание: Используйте пластины для шагов 3.1-4.1.- Сделать 5 мг/мл поли (2-гидроксиэтилкрахмала метакрилат) (поли хема) раствор в 95% этаноле. Shake o/n при 37 ° C, пока получено четкое решение. Магазин на RT.
Примечание: Фильтрация через 0,22 мкм фильтр можно удалить нерастворенных поли хема. - Добавьте поли хема в пластину культуры, так, что она охватывает в нижней части каждой скважины. Инкубировать пластины при 37 ° C в течение 2 дней и осмотрите пластину для обеспечения полного испарения жидкости/форма покрытия скважин. AA пластины могут быть обернуты и хранятся на RT.
- Сделать 5 мг/мл поли (2-гидроксиэтилкрахмала метакрилат) (поли хема) раствор в 95% этаноле. Shake o/n при 37 ° C, пока получено четкое решение. Магазин на RT.
-
Подготовить поли-L-орнитин/Ламинин (ООП/Лам) пластины для дифференциации культуры
Примечание: Используйте пластины для шагов 4.2-4.4.- Покройте поверхность скважин, используя 20 мкг/мл ООП, растворяют в стерильной PBS. Инкубировать пластины o/n 37 ° c. Аспирационная ООП и промойте 3 раза с PBS.
Примечание: (Необязательно) Incubated пластина с ООП может завернутый и хранить при 4 ° C до тех пор, пока требуется. - Слой поверхности области ООП покрытием скважин, используя 10 мкг/мл Лам растворяют в стерильной PBS. Инкубируйте по крайней мере 2 ч при 37 ° C или o/n при 4 ° C. Удаление Лам и мыть скважин 2-3 x с PBS, затем сразу же добавить соответствующие среднего или клетки.
Примечание: (Необязательно) удален Лам решение можно хранить при 4 ° C и повторно использоваться в 2 раза. (Важно) Запрещают LAM-покрытием поверхности высохнуть; чтобы предотвратить это немедленно добавить PBS или соответствующего среднего.
- Покройте поверхность скважин, используя 20 мкг/мл ООП, растворяют в стерильной PBS. Инкубировать пластины o/n 37 ° c. Аспирационная ООП и промойте 3 раза с PBS.
2. Протокол 1: Фидер свободный hPSC культуры
Примечание: ЭСК получены от некоммерческой организации (линия H01, смотрите Таблицу материалы). Три линии контроля hiPSC (hvs51, 60 и 88) были получены путем перепрограммирования фибробласты из трех здорового человека пациентов (фибробласты были производным от анонимный, не позволяющие идентифицировать доноров и поэтому освобождаются от утверждения IRB)10, 17.
- Сохранить hPSCs в культуре фидер бесплатно
- После оттаивания и покрытие hPSCs на ГООК пластин в hPSC среде (см. шаг 2.2), поддерживать hPSCs при 37 ° C с 5% CO2. Обновить hPSC среднего ежедневно (см. шаг 2.3), за исключением дня после отогрева или пассированый и изучить клетки под микроскопом (цели: 2.5x/0.06, 5 x / 0,12 Ph0, 10 x / 0,25 Ph1) наблюдать рост оценить и определить потенциальные области дифференцировки (Рисунок 3 , верхней левой панели показывает пример дифференциации).
- Прохождение hPSCs каждые 3-4 дня, или когда культура достигает > 80% слияния. Если менее 5% клеток экспонат дифференциации, использование нормального hPSC, пассированый метод (см. шаг 2.4), в противном случае используйте метод нежный (см. шаг 2.5). Когда больше не нужны в культуре, hPSCs могут быть заблокированы для длительного хранения (см. шаг 2.6).
- Размораживание hPSCs в hPSC среде
- Передача необходимый объем hPSC среды в стерильные пробирки для процесса размораживания (9 мл/криогенные трубки) и подготовленных ГУОК пластины для получения талой клетки. Дополнить среднего в обеих трубок с 10 мкм ри.
- Получить cryotube из LN2 хранения и место прямо в ванну с водой (37 ° C). Когда только небольшой ледяной кристалл останков, удалить из водяной бани и передавать содержимое тюбика криогенных трубки для оттаивания процесс (общий объем 10 мл). Центрифуга для трубки на 290 x g 5 мин на RT.
- Для удаления ГООК использовать Серологические Пипетки раствор из скважин пластину ГООК (см. шаг 1.4) предназначен для получения клеток и добавить hPSC среде с 10 мкм ри.
Примечание: Ду (важно) не аспирата ГООК решение с всасывающей иглы, или он может затвердеть и засорить линий для вакуумного насоса. - Удалить супернатант из трубки и Ресуспензируйте клетки в hPSC среде с 10 мкм ри. Распространите клетки к пластине назначения при соотношении 1 криогенных трубка/хорошо 6WP. Инкубировать при 37 ° C с 5% CO2и не обновлять среднего за 1 день.
Примечание: Начиная с клетки на 5% O2 может увеличить выживание клетки.
- Обновить hPSC средний
- Теплый необходимый объем hPSC среды в стерильную пробирку в РТ или на водяной бане; предлагается 2 мл/хорошо 6WP.
Примечание: (Необязательно): добавив дополнительное количество средних hPSC, hPSCs может оставаться дополнительный день без обновления; Однако не позволяют это больше, чем один раз в неделю. - Аспирационная среднего из скважин, содержащих hPSCs и добавить свежие hPSC среды.
- Культура hPSCs в инкубаторе при 37 ° C и 5% CO2.
- Теплый необходимый объем hPSC среды в стерильную пробирку в РТ или на водяной бане; предлагается 2 мл/хорошо 6WP.
- HPSCs проход в hPSC среде
- Передавать необходимый объем hPSC среды в стерильные пробирки, пассированый процесса и подготовке ГООК пластины получить пассированный клетки. Дополнить среднего для назначения плиты с 10 мкм ри. Теплый средних трубы на RT или на водяной бане.
Примечание: Подготовка и обработка будет отличаться, если с использованием альтернативного ЛКМ, чем перечисленные в Таблице материалов. - Для удаления ГООК использовать Серологические Пипетки раствор из скважин пластину ГООК (см. шаг 1.4) предназначен для получения клеток и добавить hPSC среде с 10 мкм ри.
Примечание: (важно) ДУ не аспирата ГООК решение с всасывания иглы, как он может затвердеть и засорить линий для вакуумного насоса. - Аспирационная среднего из скважин с hPSCs быть пассированной, вымыть клетки дважды с 0,5 мм ЭДТА, затем добавить 0,5 мм ЭДТА и инкубировать в течение 2-5 мин при температуре 37 ° C.
Примечание: 1 мл/колодец 6WP-достаточного объема ЭДТА для мытья и инкубации. - Проверьте скважин под микроскопом (цели: 2.5x/0.06, 5 x / 0,12 Ph0, 10 x / 0,25 Ph1). Если клетки начинают отсоединить, аспирационная раствора ЭДТА и скрытой клетки бесплатно с помощью среднего hPSC.
Примечание: (важно) заботиться не для того, чтобы удалить весь hPSC колоний, когда аспирационных ЭДТА (не ждать, пока отсоединение всей колонии). Не заподлицо клетки более чем 5 раз, как это может нанести вред hPSCs и влияет на плюрипотентности. Кроме того не позволяйте клетки стоят в hPSC среде с ри перед сбросом клетки из скважин, как они могут повторно присоединиться к пластине. - Основываясь на эмпирических определения (обычно связано с слияния, размер колоний, и темпы роста), передачи hPSCs скважин назначения пластины с помощью разделения соотношение 1:4-1:16 (т.е., 1 а от оригинальной пластины для 4 скважин назначения плита). Инкубировать при 37 ° C с 5% CO2и не обновлять среднего за 1 день.
Примечание: Разделение соотношения так высоко, как можно избежать скученности и улучшения внешнего вида колоний 1:16-1:20.
- Передавать необходимый объем hPSC среды в стерильные пробирки, пассированый процесса и подготовке ГООК пластины получить пассированный клетки. Дополнить среднего для назначения плиты с 10 мкм ри. Теплый средних трубы на RT или на водяной бане.
- HPSCs проход с помощью метода нежный (G-метод)
- Передавать необходимый объем hPSC среды в стерильные пробирки, для passaging процесса и подготовке ГООК пластины получить пассированный клетки. Дополнить среднего для назначения плиты с 10 мкм ри. Теплый средних трубы на RT, или на водяной бане при температуре 37 ° C.
- Использование Серологические Пипетки ГООК решение удалить из скважин ГООК плиты (см. шаг 1.4) предназначен для получения клеток и добавить hPSC среде с 10 мкм ри.
Примечание: Ду (важно) не аспирата ГООК с всасывающей иглы, или он может затвердеть и засорить линий для вакуумного насоса. - Аспирационная среднего из скважин с hPSCs чтобы быть пассированной и мыть ячейки, дважды с помощью 0,5 мм ЭДТА. На второй стирки, подождите 30 s перед аспирационных ЭДТА, затем добавьте 1 mL PBS и проинкубируйте 4-9 минут при 37 ° C. Во время ожидания, подготовьте стерильную пробирку с 4 мл ФСБ.
Примечание: 1 мл/колодец 6WP-достаточный объем ЭДТА для стирки. - Проверьте скважин под микроскопом (цели: 2.5x/0.06, 5 x / 0,12 Ph0, 10 x / 0,25 Ph1). Если клетки начинают отсоединить, Аккуратно постучите по стенкам пластины, чтобы помочь бесплатно колоний. Когда > 50% колоний свободное плавание, использовать 5 мл Серологические Пипетки для передачи колоний в 1 мл PBS в пробирку, содержащую 4 мл PBS (не нарезанных).
Примечание: (важно) поскольку цель заключается в том, чтобы очистить hPSC культуры, проверить, чтобы определить, является ли продифференцированным что клетки остаются прикреплены к плите. Кроме того нет необходимости для прохода всех колоний в хорошо с помощью этого процесса, поэтому колоний, которые остаются прикрепленными могут быть оставлены. - Подождите 5-10 мин на RT для ячеек поселиться в трубе (не центрифуги). Аспирационная PBS из трубки, стараясь не удалить поселились hPSCs. Ресуспензируйте тщательно клетки в hPSC среде (не нарезанных) и передачи клетки к пластине назначения с помощью разделения соотношение 1:4-1:16. Инкубировать при 37 ° C с 5% CO2и не обновлять среднего за 1 день.
- Заморозить вниз hPSCs
- В зависимости от слияния используйте 1 хорошо hPSCs, в 2-3 дней (максимум) в культуре, для заполнения 1-2 ампул криоконсервирования для хранения2пер.
- В конце пассированый (шаг 2,5), использовать 500 мкл или 1 мл hPSC среды для передачи клетки от 1 хорошо 6WP для 1 или 2 флаконов криоконсервирования, соответственно (500 мкл/флакона). В каждую пробирку 500 мкл 2 x замораживание среднего содержащие среднего hPSC, 20 мкм Ри и 20% ДМСО.
Примечание: (Необязательно) клетки могут быть переданы непосредственно в 1 x замораживание среднего в 1 мл/ФЛ. - Место криогенных трубы в контейнере криогенные (содержащую изопропанол) предварительно охлаждается до 4 ° C и магазин сразу от-80 ° C.
- На следующий день передачи криогенной трубы LN2 бака для длительного хранения.
3. Протокол 2: 3D» органоид» дифференциация
-
Установка дифференциации с модифицированных G-метод пассированый из hPSCs
- Трансфер необходимый объем NMM количество назначения скважин в стерильную пробирку. Дополнение с 4 FGF2 нг/мл и 10 мкм ри. Теплый средних трубки на RT, или на водяной бане при температуре 37 ° C.
Примечание: В зависимости от впадения возникновение скважин, hPSCs сосредоточены во время распространения назначения пластины 2:1 или 3:1 соотношение (т.е., 2 скважины от оригинальной пластины 1 хорошо пластину назначения), с конца объемом 2,5 мл/хорошо из 6WP. - Аспирационная среднего из скважин, содержащие hPSCs быть продифференцированным и мыть ячейки, дважды с помощью 0,5 мм ЭДТА. На второй стирки, подождите 30 s перед аспирационных ЭДТА, затем добавьте 1 mL PBS и проинкубируйте 4-9 минут при 37 ° C. Во время ожидания, подготовьте стерильную пробирку с 4 мл ФСБ.
Примечание: 1 мл/колодец 6WP-достаточный объем ЭДТА для стирки. (Важно) Предпочтительнее использовать hPSCs, были не более 3 дней в культуре после последнего прохода и по крайней мере 1-2 проходы после оттаивания. - Проверка скважин под микроскопом (цели: 2.5x/0.06, 5 x / 0,12 Ph0, 10 x / 0,25 Ph1). Если клетки начинают отсоединить, свободные клетки нежным нажатием по бокам пластины. Передать клетки трубка, содержащая 4 мл PBS с 5 мл пипетки.
Примечание: (важно) света промывки и Тритурация разрешается разрушить колоний и собирать свободные клетки, но игнорировать клетки, которые остаются приклеенная к пластине. - Позволяет трубе сидеть в течение 10 мин на RT, для разделения гравитации. При необходимости, слегка центрифуга клетки (не больше чем 200 x g на RT, за 5 мин) при необходимости.
- Аспирационная PBS из трубки, стараясь не удалить поселились hPSCs, Ресуспензируйте клетки в NMM с 4 нг/мл FGF2 и 10 мкм Ри и затем распространить AA-покрытием плиты в соотношении 2:1 или 3:1. Инкубировать при 37 ° C с 5% CO2и не обновить средство для 3 дней, если не требуется (см. шаг 3.2.1).
Примечание: (Необязательно) для удобства передачи клетки, добавить часть культуры среднего скважин назначения плиты до распределения и Ресуспензируйте клетки в меньший объем. Кроме того hPSCs может витражи и рассчитывает определить точный Начальная плотность клеток. Однако окончательный объем в пластину назначения должно быть 2,5 мл/хорошо 6WP.
- Трансфер необходимый объем NMM количество назначения скважин в стерильную пробирку. Дополнение с 4 FGF2 нг/мл и 10 мкм ри. Теплый средних трубки на RT, или на водяной бане при температуре 37 ° C.
-
Сохранения свободного плавающего дифференциация культуры при 37 ° C (5% CO2)
- Проверьте пластины каждый день для изменения в средний цвет, накопление отмерших клеток, глыба и приверженность также днища.
- Дополнительно: Независимо от среднего изменения расписания обновления (в том числе первые 3 дня не освежающий) среднего, если он превратился желтый и следуйте инструкциям для среднего изменения/обновления (шаг 3.3). Если большинство клеток мертвых, следуйте инструкциям для среднего изменения/обновления с разделением гравитации (шаг 3.4).
Примечание: Формирование EBs и роста в крупных клеток агрегаты, как ожидается, но клетки и клетки агрегаты могут собираться вместе в большой массы не за счет индивидуального роста/распространения. Если это наблюдается, легкие Тритурация с распадаются масс является допустимым. Если клетки начинают придерживаться AA-поверхности, остальные плавающие содержимое скважин могут быть непосредственно переданы новые скважины или переведены в процессе среднего изменения/обновления. Не пытайтесь перевести клетки, которые присоединились к пластине.
- Дополнительно: Независимо от среднего изменения расписания обновления (в том числе первые 3 дня не освежающий) среднего, если он превратился желтый и следуйте инструкциям для среднего изменения/обновления (шаг 3.3). Если большинство клеток мертвых, следуйте инструкциям для среднего изменения/обновления с разделением гравитации (шаг 3.4).
- На 3 день измените среднего NMM с 4 нг/мл FGF2. Обновление среды каждый день.
- На 7 день, измените среднего NMM с 1 мкм ретиноевой кислоты (RA), 100 нг/мл FGF8B и 4 нг/мл FGF2. Обновление среды каждый день.
Примечание: (важно) РА светочувствительной. Образцы культуры РА защищайте от света. - На 14 день измените среднего NMM с 100 нг/мл FGF8B, FGF4 100 нг/мл и 20 нг/мл FGF2. Обновление среды каждый день.
- На 17-й день измените среднего NMM с 100 нг/мл FGF8B. Обновление среды каждый день.
- На 21 день измените среднего NMM с 100 нг/мл мозга получены нейротрофических фактора (BDNF) и 10 нг/мл глиальных производные нейротрофических факторов (GDNF). Обновление среды каждый день.
- День 28 измените среднего NMM с 100 нг/мл BDNF и 10 нг/мл GDNF, 3 нг/мл SAG, 100 нг/мл нейротрофических факторов 3 (NT3) и 25 мм KCl. обновить среднего каждый день.
- На день 35 Соберите 3D organoids для анализа.
- Проверьте пластины каждый день для изменения в средний цвет, накопление отмерших клеток, глыба и приверженность также днища.
-
Изменить/обновить дифференциации среднего для 3D культуры
- Трансфер необходимый объем NMM с соответствующие компоненты (см. шаги 3.2.2-3.2.7 для расписания компонента) в стерильную пробирку. Тепло в водяной бане при температуре 37 ° C.
- Совет пластину и осторожно встряхнуть до тех пор, пока клетки поселиться в нижних краев лунки. Тщательно удалить 2 мл старой среды с использованием Серологические Пипетки, избегая удаления клеток, а затем добавить 2 мл свежей среды. Инкубируйте при 37 ° C с 5% CO2.
Примечание: Объем (важно) конец должен быть 2,5 мл/хорошо 6WP. Если происходит испарение, не удаляйте 2 мл старых, как это будет далее высохнуть клеточных культур; Вместо этого добавьте дополнительные среднего.
-
Изменить/обновить дифференциация средней тяжести разделения
- Трансфер необходимый объем NMM с соответствующие компоненты в стерильную пробирку. Тепло в водяной бане при температуре 37 ° C.
- Передача содержимого из скважин в стерильную пробирку и позволяет трубе сидеть в течение 10 мин на RT, для разделения гравитации.
- Использование пипетки для удаления старых среднего из трубки, заботиться, чтобы не удалить поселились клетки, Ресуспензируйте в NMM с соответствующие компоненты, а затем распространять для новых скважин, AA-покрытием. Инкубируйте при 37 ° C с 5% CO2.
Примечание: (Необязательно) для удобства, часть культуры среды могут быть добавлены к назначению скважин до распределения, с дифференциации клеток высокомобильна в низкой громкости. Конце объем должен составлять 2,5 мл/хорошо 6WP.
4. Протокол 3: Альтернативные 2D дифференциация культуры
-
Начать и поддерживать культуру, используя шаги согласно раздела 3 для 3D протокола через день 12
- Выполните шаги 3.1-3.2.3 и среднего изменения/обновления согласно шаги 3.3 и 3.4.
-
Перейдите в и поддерживать как 2D монослойном культивировании
- На 13 день дифференциации, следуйте инструкциям для изменения/обновления средней тяжести разделения (шаг 3.4), распространять только клетки/агрегатов для ООП/Лам покрытием плиты (см. шаг 1.6) с конца объемом 2,5 мл/хорошо 6WP.
Примечание: Носитель может быть дополнен с 10 мкм ри в ходе первоначального покрытия для присоединения и выживания клеток. (Важно) Желательно, чтобы равномерно клетки в скважинах, чтобы избежать низкой плотности или вытеснения на тарелках и проход (см. шаг 4.4) при необходимости. Предпочтительный размер ООП/Лам покрытием пластин (то есть, 6WP, 12WP и т.д.) должна эмпирически определяться, основанный на скорость распространения для линии клеток и цель для продукта. Инструкции будут давать томов для 6WP и может быть преобразован вдвое для каждого удвоение числа хорошо (то есть, 2 мл/хорошо для 6WP, 1 мл/хорошо для 12WP, и т.д.) - На 14 день измените среднего NMM с 100 нг/мл FGF8B, FGF4 100 нг/мл и 20 нг/мл FGF2. Обновление среды каждый день, как описано в шаге 4.3.
- На 17-й день измените среднего NMM с 100 нг/мл FGF8B. Обновление среды каждый день, как описано в шаге 4.3.
- На 21 день измените средне NMM с 100 нг/мл BDNF и 10 нг/мл GDNF. Обновление среды каждый день, как описано в шаге 4.3.
- День 28 измените среднего NMM с 100 нг/мл BDNF 10 нг/мл GDNF, SAG 3 нг/мл, 100 нг/мл NT3 и 25 мм KCl. обновить средство каждый день, как описано в шаге 4.3.
- На день 35 собрать клетки для анализа, или сохранить в той же среде, в качестве шага 4.2.5 для расширенной культуры (потенциальные ограничения не проверял).
- На 13 день дифференциации, следуйте инструкциям для изменения/обновления средней тяжести разделения (шаг 3.4), распространять только клетки/агрегатов для ООП/Лам покрытием плиты (см. шаг 1.6) с конца объемом 2,5 мл/хорошо 6WP.
-
Изменить/обновить дифференциации среднего для 2D культуры
- Трансфер необходимый объем NMM с соответствующие компоненты (см. шаги 4.2.2-4.2.5 для расписания компонента) в стерильную пробирку. Тепло в водяной бане при температуре 37 ° C.
- Аспирационная среднего из скважин, а затем добавить новое средство 2 мл. Инкубируйте при 37 ° C с 5% CO2.
Примечание: (Необязательно) конце тома может храниться на 2,5 мл/хорошо 6WP, с помощью пипетки для удаления 2 мл старой среды и добавление 2 мл свежей среды. Зарезервировать часть старых среднего в скважинах и предотвращая клетки от контакта воздуха, может уменьшить шок в клетки во время изменить шаги.
-
Проход 2D дифференциация культуры
- Передача необходимый объем NMM с соответствующие компоненты (см. шаги 4.2.2-4.2.5 для расписания компонента) в стерильные пробирки, для пассированый процесс и, отдельно, чтобы подготовить ООП/Лам покрытием пластину для получения пассированный клетки. Дополнить среднего назначения пластины с 10 мкм ри. Теплый средних трубы на RT, или на водяной бане при температуре 37 ° C. Чтобы сэкономить на компоненты, вполне возможно использовать NMM только для мытья клетки во время процесса passaging.
Примечание: (.важно) если товары будут использоваться в кальция изображений экспериментов, обеспечить прохождение клетки между 2-6 дней до конца дифференциации. - Аспирационная среднего из скважин, чтобы быть пассированной. Добавить 300 мкл/хорошо агента основе трипсина диссоциации (см. Таблицу материалы), вихревой плита покрытия скважин, а затем немедленно удалить агент диссоциации.
- Разрешить пластину сидеть за 2 мин на RT, а затем ослабьте клетки путем выстукивать на стороны пластины. Добавить 600 мкл/хорошо определенных трипсина ингибитора (DTI) и передать стерильную пробирку с 5 мл NMM клетки в DTI.
- Центрифуга трубки на 290 x g 15 мин на RT. аспирата среднего и добавить еще 5 мл NMM трубки.
- Центрифуга трубки на 290 x g 15 мин на RT. аспирата среднего и Ресуспензируйте клетки в соответствующей среде, содержащей ри.
- Распределить клетки на пластину ООП/Лам, используя коэффициент разделения 1:1-1:12, в зависимости от первоначального слияния, темпы распространения и размер дифференциального происхождения к пластине назначения и поддерживать при 37 ° C с 5% CO2.
- Передача необходимый объем NMM с соответствующие компоненты (см. шаги 4.2.2-4.2.5 для расписания компонента) в стерильные пробирки, для пассированый процесс и, отдельно, чтобы подготовить ООП/Лам покрытием пластину для получения пассированный клетки. Дополнить среднего назначения пластины с 10 мкм ри. Теплый средних трубы на RT, или на водяной бане при температуре 37 ° C. Чтобы сэкономить на компоненты, вполне возможно использовать NMM только для мытья клетки во время процесса passaging.
Результаты
Визуальный обзор снижение роста фактор 2D и 3D мозжечковой дифференциация протоколы
Рисунок 1 показывает общий график для 2D и 3D мозжечковой дифференциация протоколов, выявление внешних факторов и время обшивки. На рисунке 2изображен типичный ход hPSCs переживает 3D мозжечковой дифференциация: с Госкомсанэпиднадзором линии H01 начиная как колоний в фидера свободной культуры в день 0 (вверху слева на рисунке); переживает EB формирования день 2 (верхний средний); растет в более крупные агрегаты клеток с очевидной люмен, после нейронной индукции с РА и FGF8 в день 14 (справа вверху); формирование агрегатов различного размера и формы на день 28 (нижний левый); Разработка в сложности с различными структурами одного агрегата указывается в день 28 (ниже среднего); и продолжал морфологические изменения в те же структуры в день 35 (внизу справа). На рисунке 3изображен типичный ход hPSCs переживает 2D мозжечковой дифференциация: с Госкомсанэпиднадзором линия H01 как колоний в фидера свободной культуры в день 0 (верхнем левом углу фигуры, с круг, указывающий область дифференцированных клеток среди Госкомсанэпиднадзором колоний) ; переживает EB формирования день 2 (верхний средний); растет в более крупные агрегаты клеток с очевидной люмен, после нейронной индукции с РА и FGF8 в день 13 (справа вверху); растет число как адэрентных клеток после обшивки на 14 день (нижний левый); и тогда как монослоя клеток с более комплекс/зрелой морфология в день 35 под низким (ниже среднего) и большого увеличения (внизу справа).
3D продукты Exhibit маркеры и структуры ранних нейроэпителия
Рисунок 2 (нижнее левое изображение) и Рисунок 4 Показать неоднородность 3D совокупных морфологии, видели на протяжении культивирования, из-за различной роста и/или созревания ставки, а также стохастические слияния или разваливается агрегатов. Несмотря на разнородность каждый дифференциации производит агрегаты экспонируется ранних нейронов и нейронных маркеров, в том числе мозжечковой гранул маркер ZIC1, как указано immunocytochemistry (ICC) пятная на рисунке 5. Что еще более важно Рисунок 5 и Рисунок 6 предположить, что простой 3D культуры, с сокращением факторов роста, способен генерировать агрегатов с сложных структур, связанных с развитием мозга таких ранних neuroepithelium и губ ромбическими.
2D продуктов Exhibit мозжечковой маркеры и функциональную активность нейронов
В то время как 2D культур не могут воспроизвести сложных трехмерных структур, они способны создавать клетки экспонируется ранних нейронов и нейронных маркеров, включая мозжечковой блок клеток маркер ZIC1, как указано в МУС окрашивания на рисунке 7. Анализ выражения гена через RT-PCR, как показано на рисунке 8, поддерживает МУС окрашивание результаты, хотя наличие ранних гранул ячейке маркер ATOH1 является переменной между экспериментов и линии. Кальция изображений более легко обрабатывается в 2D культуры. Как видно на рисунке 9, дополнительное видео 1и дополнительное видео 2, электрически стимулируется клетки показывают притока кальция, которые являются типичными нейронов стрельбы шаблонов, предлагая поколение функциональных нейроны.
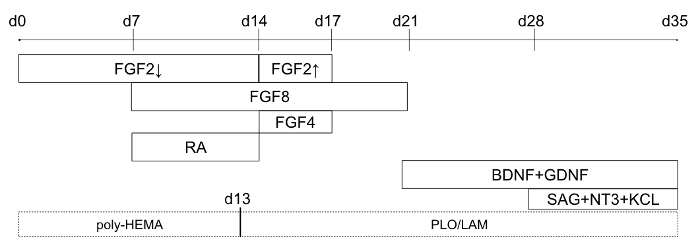
Рисунок 1: временная шкала дифференциации протокола (начиная день 0 дифференциации). Сплошная линия коробки указывают, когда конкретные факторы добавляются к питательной среды, и пунктирная линия прямоугольники указывают пластины покрытие для факультативного 2D модификации. Для FGF2 стрелка вниз относится к более низкой концентрации (4 нг/мл) и стрелку вверх относится к более высокой концентрации (20 нг/мл). Эта цифра была изменена10Холмс и Гейне. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
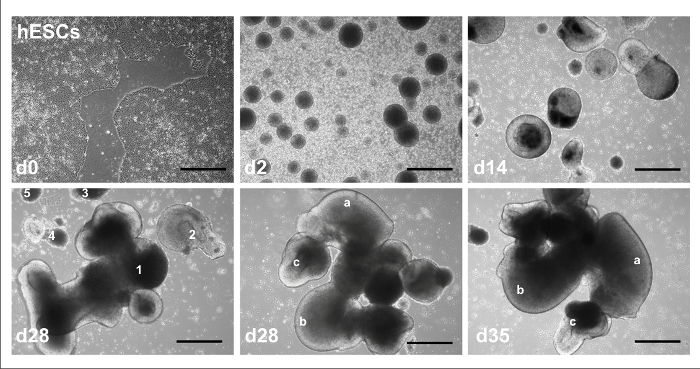
Рисунок 2: представитель brightfield изображения 3D протокола. Госкомсанэпиднадзором колоний в d0, EBs на d2, агрегатов после индукции на d14, агрегаты различного размера и морфологии (пронумерованы 1-5) в d28, единый агрегат с уникальным, идентифицируемой черты (обозначается буквами –c) на d28, и видимые изменения в тех же функций в d35. Шкалы бар = 100 мкм. Эта цифра была изменена10Холмс и Гейне. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 3: представитель brightfield изображения 2D протокола. Госкомсанэпиднадзором колоний d0, EBs на d2, агрегатов после индукции в d13, после обшивки агрегатов на d14, после созревания на d35, как видно на 5 x увеличение и 20 кратным увеличением. Белый круг в верхней левой панели показывает область дифференцированных клеток среди Госкомсанэпиднадзором колоний. Шкалы бар = 50 µm. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
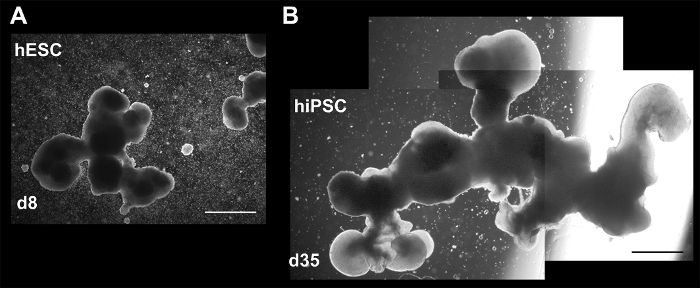
Рисунок 4: Brightfield изображения показаны различного размера и сложности в 3D культуры. Агрегаты на 8 день (A) (ЭСК) и (B) d35 (hiPSCs). Последние изображения состоит из трех отдельных изображения, чтобы показать весь совокупный. Обе агрегатов может пострадали от слияния небольших агрегатов или потери (разрыва) структур. Шкалы бар = 200 µm. Эта цифра публикуется Холмс и Гейне10. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
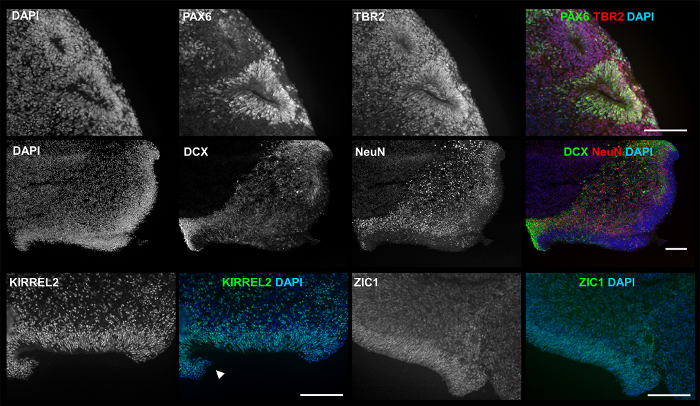
Рисунок 5: ICC изображения 3D продукции показывают соответствующие маркеры и структуры. В культуре d35, выставка 3D продуктов: PAX6 (зеленый) и TBR2 (красный), просвет нейронных розетка как формирования (первая линия); DCX (зеленый) и NeuN (красный) от внешнего края Вентрикулярная зона (VZ)-как структура (вторая строка); KIRREL2, связанные с верхней мозжечковой neuroepithelium маркер (Третий ряд, слева); и ZIC1 маркера, связанного с мозжечковой гранул клетки (третья строка, право). Эксперимент проводился несколько раз с использованием четырех различных hPSC линий: линии Госкомсанэпиднадзором H01 (n = 5) и iPSC линии hvs88 (n = 4), hvs60 (n = 3) и hvs51 (n = 1). Стрелки указывают губ ромбическими (RL)-как структура. Шкалы бар = 100 мкм. Эта цифра публикуется Холмс и Гейне10. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 6: желудочковая зоны как структура крупных масштабах в 3D продукт. В культуре d35 агрегатную Госкомсанэпиднадзором производные является положительным для PAX6 (зеленый) и TBR2 (красный) обычно ассоциируется с ранних нейронов, найденных внутри желудочков зоны (VZs) и субвентрикулярной зоны (SVZs), в естественных условиях. (Вверху) Звездочка (*) знаки в апикальной части VZ-как региона, идущую вдоль края агрегатной функции, с указанием глубины/отдел VZ скобки / SVZs. (средний) Merged сигналы показывают отдельные разделы PAX6 +/ TBR2-клетки, увеличиваясь в размерах в верхний правый конец из VZ. (Внизу) Высокое увеличение изображения разделе указывается прямоугольник в средней панели. Шкалы бар = 100 мкм. Эта цифра была изменена10Холмс и Гейне. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
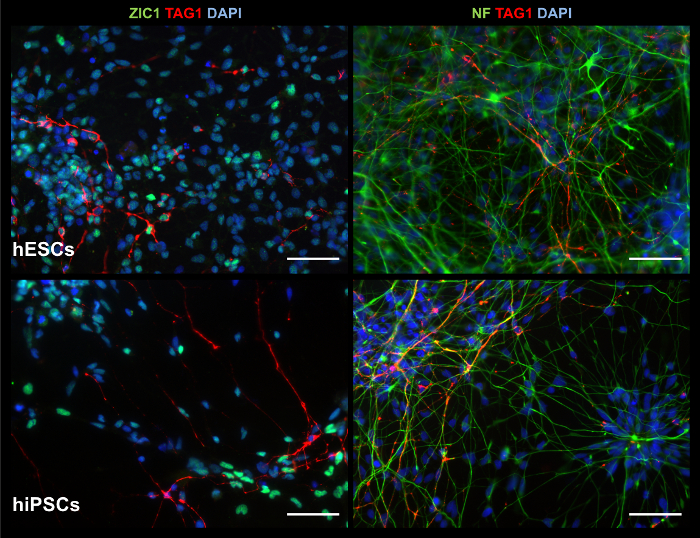
Рисунок 7: ICC изображения 2D продукции показывают соответствующие маркеры. В культуре d35, 2D продуктов экспонат, из ЭСК (верхняя строка) и hiPSCs (Нижняя строка), клетки позитивные для: блок клеток маркер ZIC1 и мигрирующих нейронов мозжечка маркер Метка1 (левая колонка); и neurofilament нейронов маркер (NF) и Метка1 (правая колонка). Шкалы бар = 50 µm. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
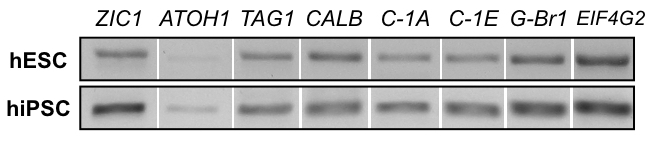
Рисунок 8: RT-PCR 2D продукции. анализ выражения мРНК Госкомсанэпиднадзором линии H01 (верхняя строка) и hiPSC линии hvs60 (Нижняя строка) в конце 2D протокол показывает продуктов с электрофорезом геля для: блок клеток маркер ZIC1, блок клеток маркер ATOH1, мигрирующих нейронов мозжечка маркер Метка1, Пуркинье ячейки маркер кальбиндин (CALB), кальция напряжени тока зависимых каналов CACNA1A (C-1A), CACNA1E (C-1E), гамма - аминомасляная кислота (ГАМК) B рецепторов 1 (G-Br1) и уборки ген EIF4G2).
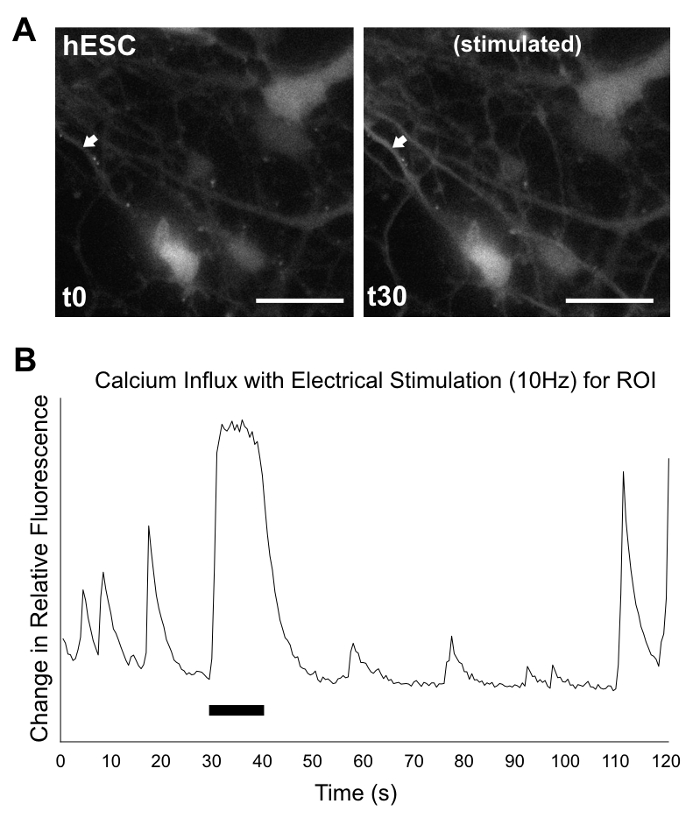
Рисунок 9: кальция изображений/анализ 2D продукции. В культуре d35 hPSC дифференциация продукции были записаны на 2 мин под микроскопом, после инкубации с fluor5 краской. 30 s, клетки были стимулировали электрически для 10 s 10 Гц в. (A) по-прежнему фото шоу ЭСК в 0 s (слева) и после начала электростимуляция 30 s (справа). Стрелки указывают области интереса (ROI) для анализа притока кальция. (B) графический анализ показаны изменения в относительной флуоресценции против времени для ROI (изменения в флуоресцировании = (F-F0) / f0, где F0 = (∑F1-n) / n), с шипами нейроноподобных, происходящих до, во время и после стимуляция. Черная полоса указывает длину электрической стимуляции. Масштаб бар (белый) = 50 µm. Полная запись для Госкомсанэпиднадзором (как видно здесь) и hiPSC линии (не показан) доступны Дополнительные видео 1 и 2 дополнительные видео, соответственно. Записи в формате AVI, на скорости 4 x. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Дополнительные видео 1: кальция, визуализации видео 2D продукта от линии Госкомсанэпиднадзором H01. В культуре d35 дифференциация продукции от линии Госкомсанэпиднадзором H01 были записаны на 2 мин под микроскопом, после инкубации с fluor5 красителя. 30 s, клетки были стимулировали электрически для 10 s в 10 Гц. записей были сделаны 2 кадров/с и перерабатывается в видео AVI ~ 7 кадров/сек, производства видео продолжительностью ~ 30 сек, скоростью ~ 4 x. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительные видео 2: кальция, визуализации видео 2D продукта от линии hvs51 hiPSC. В культуре d35 дифференциация продукции из hiPSC линии hvs51 были записаны на 2 мин под микроскопом, после инкубации с fluor5 краской. 30 s, клетки были стимулировали электрически для 10 s в 10 Гц. записей были сделаны 2 кадров/с и перерабатывается в видео AVI ~ 7 кадров/сек, производства видео продолжительностью ~ 30 сек, скоростью ~ 4 x. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Сложность и затраты являются соответствующие факторы для исследователей стволовых клеток при выборе или разработке протоколов дифференциации. Это особенно верно, поскольку это открытый вопрос сколько внешнего контроля, необходимых для создания типов желаемого клеток, или — представляют по-разному — как компетентным hPSCs на производство их собственного развития окружающей среды, если оставить себе с достаточной питательные вещества. Введение внешние факторы в пробирке может очень хорошо продукцию нужной ячейки, но они могут также столкнуться с внутренней развития потенциала клеток будет выставлялись в естественных условиях. Эти соображения важны, особенно если целью является использование пациента производные iPSCs для моделирования заболевания. Широкое использование структурирования и/или факторов роста может маскировать болезни фенотипов. Протоколы, подробно изложены в настоящем докладе следуют тенденции предыдущих исследований для уменьшения сложности, стоимости и/или использования патронирования внешние факторы8,9.
Основываясь на результатах сообщили Мугурама et al. и наши собственные недавнее исследование, кажется, что это можно достичь дифференциации направлении мозжечковой судьбы без согласованных усилий, чтобы воспроизвести в vivo условия, как делали ранее исследования 1 , 2 , 3 , 4 , 8 , 10. интригующим часть является то, что два исследования разные наборы факторов роста, предполагая, что ни набор необходимы, хотя оба используется FGF2. Мы побежали дополнительные тесты, где FGFs выборочно исключены из протокола и показали, что клетки способны генерировать же продукты без внешняя FGFs10. Различия между нашими исследованиями были квалифицированы тот факт, что мы использовали различные hPSC линии и методы культуры, индуцированной нейронных дифференциации с РА и включены компоненты для поддержки выживание клетки гранул и созревания (BDNF, GDNF, SAG и KCL)11 –14. Кроме того было занято менее сложный способ запуска, по сравнению с Мугурама et al.. Их протокол начал путем создания единой EBs в 96WPs, который физически и химически изоляции их друг от друга. Протокол здесь были все УИК, относительно переполненных вместе в 6WPs во время формирования EB, что позволило им взаимодействовать свободно. Это может дифференциально влияние физических и химических окружающей среды EBs и позднее organoids (включая встроенные сигналы соединений) неизвестна и могут быть изучены. Кроме того, хотя мы показываем выражение генов связанные с — и поэтому наводящий — мозжечковой происхождения, расположен в пределах структуры, морфологически похожие на те, сообщает Мугурама et al., мы не можем исключать поколения нейронов подобных структур, которые являются не мозжечковая идентичности. Будущие исследования, используя большой группа антител как те сообщали Мугурама et al. (т.е., ATOH1, CALB, и т.д.) будет делать такие назначения и сравнение продуктов обоих протоколов, более убедительным.
В 3D протокол важно начать и поддерживать достаточное количество клеток в культуре для обеспечения достаточного числа конечных продуктов для анализа. Учитывая значительный падеж рано в протоколе, мы рекомендуем, начиная с более чем 500 EBs/хорошо в течение первых 3 дней в культуре (рис. 1). Это не должно быть трудно добиться данной колонии размеров для hPSCs в культуре фидер бесплатно, но может быть не так просто для тех, кто по-прежнему использовать фидер зависимые методы. Учитывая большое количество клеток, важно наблюдать за изменением цвета в средних (с указанием изменений рН) и накоплению мертвых клеток. Оба должны быть исправлены для предотвращения распада культуры. Там также может быть глыба ячеек и агрегатов в массивных конструкций. Хотя он все еще может привести к агрегаты, которые могут быть проанализированы, количество продукта значительно сократится, поэтому разбивая их на меньшие агрегатов с нежным Тритурация может быть полезным. Однако, следует избегать тревожной нормальных агрегатов, которые сами могут вырасти до больших размеров (рис. 4). Если агрегаты становятся слишком разреженный, рекомендуется сочетать скважин, так что агрегаты не полностью изолированы. Изменчивость продукта (в число, размер и морфология) является известной проблемой в 3D клеточной культуре, в том числе для этих протоколов, начиная с изолированной, единообразных шаги формирования EB, предполагая, что менее сложную процедуру запуска (например, протокол, описанные здесь ) может быть более практичным,8,15. Хотя эта разнородность является то, что исследователи должны иметь в виду, особенно во время анализа, сообщил протокол создают продукты в соответствии с теми, кто в других 3D протоколы по8,9,15. На основе размера и морфологии, они попадают в пределах нейронных розетка для церебральной органоид, как описано в недавнем обзоре Келава и Ланкастер15, с наиболее уместно классификации сфероида. Особенно заметно, присутствие трехмерных структур наводящий нейронных розеток с люмен, (суб) желудочка зон и ромбической губы как функции (рис. 5 и Рисунок 6) как определены другие группы8 , 15 , 16 , 17. Поскольку каждый эксперимент производится по крайней мере один совокупных с предполагаемым VZ/SVZs и мозжечковая связанные маркеры (ZIC1, KIRREL2), те являются полезными критерии для определения успеха 3D дифференциации, с помощью нашего протокола, с RL-как Особенности предоставления дополнительной поддержки. Увеличение продолжительности культуры последние 35 дней не был испытан, но могут применяться для определения максимальной степени роста, сложности и зрелости, допускаемых этой техники.
2D протокол использует же non сторонник EB формирования и нейронной индукции процесс 3D протокол и поэтому также применять комментарии выше. После того, как покрытие, следует рассмотреть другой набор соображений. EBs следует придерживаться быстро для клетки размножаться наружу на пластину. Если существуют проблемы с соблюдением, помимо ри (если уже не используется), сократить объем среднего, или экспериментальные изменения в ООП/Лам концентрации могут быть применены. Важно сохранить клетки от выращивания слишком плотной или разреженные (предпочтительно вырос между 20-80% confluency) в скважинах; Ежедневный мониторинг и своевременного пассированый важно избежать более confluency или плавающей клетки. В отличие от 3D протокол не должно быть значительных падеж во время культуры, хотя могут существовать области слабый рост, или замедление темпов распространения. Что влияет на состояние созревания клеток (например, удаление клеточных процессов и развитых сетей между клетками) и следует иметь в виду, когда приближается точек где клетки будут собраны или проанализированы в некотором роде. Например для кальция изображений это очень важно для прохода клетки между 2-6 дней до анализа. Пассированый слишком близко к анализ может означать клетки не имели времени для подключения и/или пожилые и слишком далеко может привести в клетках переполненности, затрудняя изображений. Хотя может существовать изменчивость между эксперименты, результаты согласуются с теми, кто в первоначальный 2D мозжечковой протоколы1,2. МТП окрашивание и гена анализ выражения подтверждают наличие клеток позитивные для гранул ячейке маркер ZIC1, а также выявление маркеров, связанные с другими нейронных и мозжечковая тождества (рис. 7 и рис. 8). Кальция изображений, которая включает в себя электрической стимуляции клеток с fluor5 красителя инкубирован, указали функциональную активность нейронов (Рисунок 9, дополнительная цифра 1и Дополнительные рисунок 2), хотя это не подтверждено если эти были блок клеток. Это утверждать, что, предоставляя клетки больше времени, чтобы созреть, расширяя длину культуры последние 35 дней, следует увеличить количество функциональной активности нейронов. Этот потенциал можно было бы изучить в будущем.
Помимо направления исследований, предложенных выше было бы интерес для определения различий в продукт тождества (количество и качество) между протоколами 2D и 3D. Важность внешние FGFs не был протестирован в протоколе 2D, и было бы полезно знать, если отсутствие 3D структуры после покрытия, и поэтому связанные сигнальных путей, сделает более или менее зависимыми от тех, кто рано кучность соединений 2D культур. Более урезанная протоколов (например, не РА, BDNF, SAG) одинаково правдоподобными линии для дальнейшего расследования. Наконец, будущие исследования могут воспользоваться новых исследовательских инструментов лучше характеризуют (и оценить эффективность поколения) мозжечковой нейрональных подтипы конкретного человека.
С данной оговорки в виду как сообщили, что протоколы могут быть использованы для верхней мозжечковой дифференцирования, с продуктами, подходит для различных целей. Они могут служить практических отправных точек для исследователей, проведение экспериментальных исследований, тестирования жизнеспособности линий для такого разграничения, или как базовая модель для других типов целевых нейронных дифференцировки клеток.
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Мы благодарны Gerbren Jacobs и Jurjen Broeke за их экспертную техническую помощь, чтобы Приска Leferink для содействия поколения и характеристика двух линий управления iPSC и Лиза Gasparotto для демонстрации наших процедур.
Материалы
| Name | Company | Catalog Number | Comments |
| DMEM/F12+Glutamax | Gibco | 31331-028 | glutamine fortified DMEM/F12 |
| Neurobasal medium | Gibco | 21103-049 | neural basic medium |
| N2 supplement | Gibco | 17502-048 | |
| B27 supplement | Gibco | 17504001 | |
| Insulin | Imgen | PT468-B | |
| L-glutamine | Gibco | 25030-024 | |
| Non-essential Amino Acids (NEAA) | Gibco | 11140-035 | |
| beta-mercaptoethanol | Gibco | 21985-023 | |
| Poly-L-Ornithine | Sigma | P3655 | |
| Poly (2-hydroxyethyl methacrylate) | Sigma | P3932 | aka Poly-Hema |
| Laminin | Sigma | L2020 | |
| E8 medium and supplement | Gibco | A1517001 | hPSC medium and supplement |
| Penicillin/Streptomycin | Gibco | 15140-122 | |
| Sodium Chloride | Sigma | S-5886 | |
| y-27632 (ROCK inhibitor) | SelleckChem | S1049-10mg | |
| DMSO | Sigma | D-2650 | |
| Geltrex | Gibco | A1413302 | hPSC-appropriate adherent coating (PAAC) |
| 0,5M EDTA | Gibco | 15575-020 | |
| 0.2 um filter | VWR | 28145-77 | |
| 1.5 mL Eppendorf tube | VWR | 525-0130 | |
| DMEM/F12 | Gibco | 21331-020 | |
| Ethanol | VWR | 83804360 | |
| Parafilm | Sigma | PM996 | wrap for culture plates |
| cryotubes | ThermoFisher | 368632 | |
| TrypLE | Gibco | 12563-029 | trypsin-based dissociation agent |
| Defined Trypsin Inhibitor (DTI) | Gibco | R-007-100 | |
| FGF-2 | Peprotech | 100-18B | |
| FGF-4 | R&D Systems | 100-31 | |
| FGF-8B | Peprotech | 100-25 | |
| Retinoic Acid | Sigma | R2625 | |
| Brain Derived Neurotrophic Factor | Peprotech | 450-02 | |
| Glial Derived Neurotrophic Factor | Peprotech | 450-10 | |
| Potassium Chloride | Sigma | P5405 | |
| Neurotrophic Factor 3 | Peprotech | 450-03 | |
| Smoothened Agonist (SAG) | Cayman | 11914 | CAS 912545-86-9 |
| Axiovert 40C microscope | Zeiss | Brightfield imaging microscope | |
| Axiocam | Zeiss | Brightfield imaging - image aquisition | |
| Eppendorf Centrifuge 5810 | Eppendorf | 521-0996 | centrifuge for cell culture |
| PBS (gebufferde natrium oplossing) | Braun Medical | 3623140 | |
| 5 ml Serological pipets | VWR | 612-4950 | |
| 10 ml Serological pipets | VWR | 612-4951 | |
| 6-wells culture plates | VWR | 734-2323 | |
| 12-wells culture plates | VWR | 734-2324 | |
| hESCs | WiCELL | line H01 |
Ссылки
- Erceg, S., et al. Efficient differentiation of human embryonic stem cells into functional cerebellar-like cells. Stem Cells Dev. 19, 1745-1756 (2010).
- Erceg, S., Lukovic, D., Moreno-Manzano, V., Stojkovic, M., Bhattacharya, S. S. Derivation of cerebellar neurons from human pluripotent stem cells. Curr Protoc Stem Cell Biol. , (2012).
- Su, H. L., Muguruma, K., Matsuo-Takasaki, M., Kengaku, M., Watanabe, K., Sasai, Y. Generation of cerebellar neuron precursors from embryonic stem cells. Dev Biol. 290, 287-296 (2006).
- Salero, E., Hatten, M. E. Differentiation of ES cells into cerebellar neurons. Proc Natl Acad Sci U S A. 104, 2997-3002 (2007).
- Joyner, A. L. Engrailed, Wnt and Pax genes regulate midbrain--hindbrain development. Trends Genet. 12, 15-20 (1996).
- Joyner, A. L., Liu, A., Millet, S. Otx2, Gbx2 and Fgf8 interact to position and maintain a mid-hindbrain organizer. Curr Opin Cell Biol. 12, 736-741 (2000).
- Tam, E. W. Y., Benders, M. J. N. L., Heine, V. M. Cerebellar Development-The Impact of Preterm Birth and Comorbidities. Fetal and Neonatal Physiology. , (2017).
- Muguruma, K., Nishiyama, A., Kawakami, H., Hashimoto, K., Sasai, Y. Self-organization of polarized cerebellar tissue in 3D culture of human pluripotent stem cells. Cell Rep. 10, 537-550 (2015).
- Pasca, A. M., et al. Functional cortical neurons and astrocytes from human pluripotent stem cells in 3D culture. Nat Methods. 12, 671-678 (2015).
- Holmes, D. B., Heine, V. M. Simplified 3D protocol capable of generating early cortical neuroepithelium. Biology Open. 6, 402-406 (2017).
- Chen, J. K., Taipale, J., Cooper, M. K., Beachy, P. A. Inhibition of Hedgehog signaling by direct binding of cyclopamine to Smoothened. Genes Dev. 16, 2743-2748 (2002).
- Chen, J. K., Taipale, J., Young, K. E., Maiti, T., Beachy, P. A. Small molecule modulation of Smoothened activity. Proc Natl Acad Sci U S A. 99, 14071-14076 (2002).
- Dahmane, N., Ruiz-i-Altaba, A. Sonic hedgehog regulates the growth and patterning of the cerebellum. Development. 126, 3089-3100 (1999).
- Borghesani, P. R., et al. BDNF stimulates migration of cerebellar granule cells. Development. 129, 1435-1442 (2002).
- Kelava, I., Lancaster, M. A. Stem Cell Models of Human Brain Development. Cell Stem Cell. 18, 736-748 (2016).
- Kadoshima, T., et al. Self-organization of axial polarity, inside-out layer pattern, and species-specific progenitor dynamics in human ES cell-derived neocortex. Proc Natl Acad Sci U S A. 110, 20284-20289 (2013).
- Englund, C., et al. Pax6, Tbr2, and Tbr1 are expressed sequentially by radial glia, intermediate progenitor cells, and postmitotic neurons in developing neocortex. J Neurosci. 25, 247-251 (2005).
- Warlich, E., et al. Lentiviral vector design and imaging approaches to visualize the early stages of cellular reprogramming. Mol Ther. 19, 782-789 (2011).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены