Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Рентгенофлуоресцентного капиллярного электрофореза масс-спектрометрии для метаболомики одноклеточных в жить лягушки (Xenopus laevis) эмбрионов
В этой статье
Резюме
Мы описать шаги, которые позволяют быстро в situ выборки небольшой части отдельной ячейки с высокой точностью и минимальным вторжением, используя капиллярно основе микро выборки, для облегчения химических характеристик снимка метаболической активности в живой эмбрионов, с помощью заказных одноклеточного капиллярного электрофореза и масс-спектрометрии платформы.
Аннотация
Количественная оценка малых молекул в одиночных клетках порождает новые возможности для лучшего понимания основных процессов, которые лежат в основе развития эмбриона. Чтобы включить одноклеточных расследований непосредственно в жить эмбрионов, новые аналитические подходы необходимы, особенно те, которые чувствительны, селективный, количественных, надежных и масштабируемых размеров различных клеток. Здесь мы представляем протокол, который позволяет проводить анализ в situ метаболизма в одиночных клетках в свободно развивающихся эмбрионов Южной Африки когтистые лягушки (Xenopus laevis), мощная модель в клетке и биологии развития. Этот подход использует капиллярную рентгенофлуоресцентного аспирационная определенную часть от одного выявленных клеток эмбриона, оставляя нетронутыми для последующего анализа соседние клетки. Содержимое ячейки собранных анализируемой микромасштабной капиллярного электрофореза электроспрей ионизации (CE-ESI) интерфейса в сочетании с высоким разрешением тандемные масс-спектрометр. Этот подход является масштабируемой для различных размеров ячеек и совместимы с сложной трехмерной структуры развивающихся эмбрионов. В качестве примера мы показываем, что рентгенофлуоресцентного одноклеточных CE-ЭСИ-MS позволяет разяснения метаболизм клеток неоднородность, которая разворачивается как прогениторных клеток приводит к потомкам во время развития эмбриона. Помимо клеток и биологии развития анализ одноклеточных протоколы, описанные здесь поддаются других размеров ячеек, типов клеток или Животные модели.
Введение
Полное понимание эмбрионального развития требует характеристика всех молекулярных изменений, которые разворачиваются в каждой клетке организма развивающихся. Во время следующего поколения виртуализации с молекулярной усиления позволяет глубокое измерение1 одной ячейки transcriptomes в разработке систем2,3, значительно меньше известно о набор мелких молекул производится в одном эмбриональных клеток, включая белки и, особенно, метаболитов (молекулярная масса < да ~ 1500). Быстрый и динамичный ответ на внутренние и внешние события метаболом служит мощным дескрипторов молекулярной состояния клеток. Метаболом одноклеточных, таким образом, повышает потенциал для отслеживания развития пространственной и временной гетерогенности клеток в раннего эмбриона и выявления новых молекул для функциональных исследований. Однако без молекулярной усилители для этих молекул, обнаружение метаболом требует исключительной чувствительности с помощью масс-спектрометрия (МС), который является технология, которая выбирается для анализа метаболит.
Одноклеточных MS — это совокупность технологий с достаточной чувствительностью, чтобы измерить метаболитов в одиночных клетках (см. обзоры 4,5,6,,78,9 ,10,11,12,13,14,15). Воспроизводимость проб клеток и эффективного экстракции метаболитов важны для успешного обнаружения метаболитов в одиночных клетках. Рассечение поклеточного выявленных клеток от зародыши Xenopus позволил характеристика малых молекул и пептиды16. Другие подходы использовать micropipettes для выборки отдельных живых клеток, после обнаружения с помощью электроспрей ионизации (ESI) МС. Например метаболитов были измеряется в завод или mammalian клеток одноклеточных видео MS17, зонд давления18, один зонд19и оптимизированных силы микроскопии20, среди других методов21, 22,23,24. Кроме того включение химического разделения до ионизации в рабочий процесс MS одноклеточных эффективно упрощает метаболом, облегчая потенциальных помех во время Ион поколения до обнаружения. Важно отметить, что разделение также предоставляет соединение специфичной информации для оказания помощи в молекулярной идентификации. Капиллярный электрофорез (CE) был использован для обнаружения метаболитов в один расчлененный25,26 или microsampled27нейронов, захватив мелкомолекулярных различия между нейрон фенотипов. Недавно мы адаптировали CE ESI тандем MS для включения трассировки уровня обнаружение сотен метаболитов в отдельных клетках, которые были расчленены от ранних зародыши Xenopus laevis16,28. Эти исследования показали удивительно метаболических различия между эмбриональных клеток на ранней стадии развития и привели к открытию метаболитов с ранее неизвестных последствий развития16.
Здесь мы предоставляем протокол, что включено обнаружение метаболитов в одиночных клетках непосредственно в жить позвоночных эмбриона с помощью микрозондирования одноклеточных CE-ЭСИ-MS29,30. Модельный организм выбрали является 8-к-32-клеток эмбриона X. laevis , хотя подход применяется также в более поздних стадиях развития и другие виды модельных организмов. Этот протокол использует заостренный капилляров с поступательной управления многоосных под руководством системой с высоким разрешением изображений для аспирационная ~ 10 nL часть выявленных клетки в situ в морфологически комплекс развивающегося эмбриона. Этот рентгенофлуоресцентного масштабируется для мелких клеток и действует в течение нескольких секунд, который достаточно быстро, чтобы отслеживать линий клеток эмбриона. После извлечения полярных или apolar малых молекул, таких как метаболиты и пептиды, из собранных образцов в ~ 4-5 мкл экстракции раствор, ~ 10 nL полученный экстракт анализируется в заказных платформе CE через дефис масс-спектрометр для ESI. Строительства и эксплуатации платформы CE-ЭСИ-МС основывается на протоколы, описанные в других местах. 31 , 32 co-axial CE-ESI интерфейс построен как описано в других местах. 31 в конус Джет напыления режима для достижения уровня трассировки чувствительность с возможностью для количественной оценки через динамический диапазон журнала порядка 4-5 (относительная28,29,30 поддерживается эта платформа или абсолютной16). CE-ЭСИ-MS платформа предлагает 60-amol нижний предел обнаружения с 8%, относительная стандартное отклонение (ОСБ) в количественный проверенных диапазоне 10 Нм до 1 мкм для малых молекул16, которые являются достаточными для характеристики эндогенного метаболитов в X. laevis клеток. Microprobed клетки продолжают делить как зародыш прогрессирует через развитие30, позволяющие решить височно и пространственно анализ клеточного метаболизма. Действительно одноклеточных CE-ЭСИ-MS может использоваться для поиска метаболических различия между ячейками, которые занимают спинной вентральный16,29, животных растительный16и слева направо28 развития осей, а также клетки которые формируют суждено дорсальной линии нервной ткани от общей прародитель ячейки в X. laevis30. Кроме запроса метаболических различия между отдельными эмбриональных клеток на разных этапах своего развития эмбриона X. laevis 30, мы ожидаем, что протоколы, описанные здесь, применимы к широкому кругу биомолекул и отдельные клетки microsampled от различных стадий эмбрионального развития, а также другие типы клеток и модельных организмов. Кроме того рентгенофлуоресцентного может использоваться для microsampling, в то время как различные платформы, совместим с незначительной образцы могут быть использованы для разделения и/или характеристика биомолекул.
протокол
Все протоколы, связанные с поддержанием и обработки Xenopus laevis были утверждены институциональный уход животных и использования Комитетом в университете Джорджа Вашингтона (IACUC нет. A311).
1. подготовка проб инструменты, средства массовой информации, растворители и блюда
- Подготовить 1 x Стейнберга решение (СС), растворяя следующие соли в ультрачистая вода (~18.2 MΩ.cm при 25 ° C) в следующем порядке и в указанных концентрациях, после стандартного протокола33: натрия хлорид (58.2 мм), хлорид калия ( 0,67 мм), нитрат кальция (0,34 мм), сульфат магния (0,83 мм), трис гидрохлорида (4.19 мм) и Tris база (0,66 мм). 0.5 x СС в два раза, и 0.1 x СС по десять раз разрежения, 1 x СС, используя ультрачистая вода.
- Готовить блюда выборки, первые приготовления 2% агарозы в 1 x SS. автоклавированием при температуре 120 ° C 20 мин распустить. Хотя по-прежнему жидкость, пальто нижней чашки Петри 60 мм с решением. После того, как гель агарозы охлаждается и затвердела, пламя к концу пипетки Пастера шесть дюймовый до тех пор, пока она образует шар и слегка касаясь подогревом конца запечатлеть 5-10 скважин, глубиной, ~ 1 мм в агарозном.
Примечание: Эти колодцы используются для иммобилизации эмбрионов во время выборки. - Подготовьте метаболит экстракции растворителем. Портной физико-химических свойств растворителя (например, полярности и рН) в классы молекул, которые представляют интерес в исследовании.
Примечание: например, мы используем 40% метанола и 40% Ацетонитрил в воде LC-MS-класс как открытие подход целевой главным образом полярных метаболитов и несколько apolar метаболитов и пептиды28. - Сделайте волосы петли, используя чистые волосы и пипетки Пастера как описано33 для нежно перемещение эмбрионов в чашках Петри с минимальными возмущений.
- Изготовить конический наконечник micropipettes, как показано на рисунке 1a.
- Во-первых, тянуть боросиликатное капилляров (1000/500 мкм внешний/внутренний диаметр) в тип Браун-Огненный капиллярного съемник со следующими параметрами: тепла = 355; Вытяните = 65, скорость = 80; время = 150.
- Далее брейк от оконечности вытащил микропипеткой, используя пару тонкой острые щипцы для получения капиллярных наконечник, наружный диаметр ~ 20 мкм. выполнять этот шаг под стереомикроскопом помощи точность и воспроизводимость.
Примечание: Капилляров с небольшая заметка подвержены засорению во время стремление вязкой цитоплазмы. Хотя капилляров с большие чаевые, безусловно, поможет избежать засорения и аспирационная больше клеточного содержания, большой диаметр капилляров может ставят во время выборки мелких клеток и возможно повреждение клеток для последующего отбора проб. Тщательной регулировки давления и времени аспирации может частично облегчить эти проблемы. Мы находим micropipettes с наружным диаметром ~ 20 мкм идеально подходит для работы, представленные здесь.
2. Microsampling сингл клеток и экстракции метаболитов
- Получения эмбрионов (оплодотворенные яйца) через гонадотропин индуцированной природных спаривания взрослых Xenopus laevis или через в пробирке оплодотворение, как описано в других протоколах33,34.
Примечание: Природных спаривания гарантирует, что эмбриональной стадии развития расположены в шахматном порядке в то время как эмбрионы, полученные путем оплодотворения в пробирке являются более надежными в поставках. Однако в пробирке оплодотворение требует, жертвуя взрослых мужчин лягушка. - Свеже подготовить хвоща dejellying раствор 2% путем растворения 4 g цистеина в 200 мл воды сверхчистого и отрегулировать каплям раствор для рН 8 с помощью 10 N раствора гидроксида натрия.
- Снять пальто желе, окружающих эмбрионы, как они начинают прилепится в стадии 2-элементный следующим: пусть эмбрионов отдых в dejellying растворе для 2 мин, затем аккуратно водоворот их для дополнительных 2 мин для предотвращения эмбрионов от присоединения к поверхности коллекции блюдо.
- Аккуратно вылить содержимое блюдо в чистый стакан и быстро декантируют dejellying решение от стакан. Немедленно покрыть яйца с 0.1 x СС, чтобы смыть оставшиеся dejellying решение, слегка взболтать, а затем декантируют раствор. Повторите этот шаг четыре раза, чтобы тщательно вымыть эмбрионов.
Примечание: Ограничить воздействие эмбрионов dejellying решение 4 мин для обеспечения жизнеспособности. Всеобъемлющий протоколы для удаления желе пальто доступны в других местах33. - Передача dejellied эмбрионов в 1 x СС в чашке Петри. Чтобы свести к минимуму скученность в тарелки, место ~ 100 эмбрионов на 100 мм блюдо33.
Примечание: Блюда, содержащие эмбрионы могут храниться между 14-18 ° C, чтобы замедлить развитие и получения эмбрионов в шахматном порядке этапы развития от тех же родителей. Дополнительные руководящие принципы по температурной зависимости экономического роста и развития публикуются на Xenbase и в других местах33,35,,3637. - Сортировка, рассекая эмбрионы на стадии 2-клеток в отдельную посуду в которой стереотипных пигментации уверенно знаменует спинной вентральный оси, со ссылкой на установленных клеток судьба карты38,39,40.
- Определить правильно расщепления эмбрионов, обеспечивая, что bisects первой борозды расщеплении, который разграничивает среднесагиттальную плоскость, мрачно (вентральной) и слегка (спинной) пигментированные животных полюс таковы, что две половинки зеркальных изображений41.
- Смонтируйте сфабрикованные микропипеткой на многоосных микроманипулятор (ручной или дистанционно управляемый). Подключите микропипеткой к microinjector.
- Использование пипетки пластиковые передачи аспирационная ~ 5 8-клеток эмбрионов и передавать их в блюдо выборки, содержащий 0,5 x СС.
Примечание: Определите ячейки, основанные на пигментацию и положение эмбриона, со ссылкой на ячейку судьба карты38,,3940.
Примечание: К примеру, мы регулярно аспирационная ~ 10-15 nL тома из ячейки путем применения импульсов ~ 3-30 ПСИ капилляра. Этот весь шаг длится ~ 5 s для аспирации30.
- Плотно закройте флакон для предотвращения испарения и место флакон обратно в ведро льда 4 ° C до завершения отбора проб. Выбросите используется микропипеткой в Шарпс контейнер для предотвращения опасности иглой.
Примечание: Чтобы определить объем содержимого ячейки без наддува, придать аспирата минеральное масло, где оно получает сферическую форму. Диаметр этой сферы может быть измерена с помощью микроскопа. Рассчитать объем без наддува: V = 4/3 π r3, где V — объем, а r -Радиус сферы.
3. CE-ЭСИ МС измерение
- Подготовка стандартов и решений для CE-ЭСИ MS
- Подготовьте солевого фона (BGE), состоящий из 1% муравьиной кислоты в воде класса LC-MS.
- Приготовляют раствор оболочка содержит 50% метанола в LC-MS класс воды и 0,1% муравьиной кислоты.
- Подготовьте 50 Нм решение ацетилхолина в решении оболочка для ежедневной оценки производительности системы CE-ЭСИ-MS.
- Подготовьте раствор натрия хлорида 150 мм стандартно массы калибровки для низких m/z диапазона в режиме положительных ионов. Массы (m/z) точность < рекомендуется 10 ppm. Следуйте инструкциям производителя масс-спектрометр для выполнения этого шага.
Примечание: в качестве альтернативы, другие стандарты с известными m/z значения могут использоваться для массового калибровки в масс-спектрометр.
- Строительство платформы CE-ESI
- Конструкция платформы инъекции CE, способных быстрой вертикальной перевод этапа проведения BGE флакона и образец загрузки microvial. Для строительства и эксплуатации платформы обратитесь к детали в ссылку31.
- Соберите CE-ESI интерфейс (рис. 1 c) следующим образом. Смонтируйте электроспрей металла излучатель (130/260 мкм внутренний/внешний диаметр и ~ 35 мм длины) в 3-портовый T-союз. Кормить разделения CE капиллярные (40/105 мкм внутренний/внешний диаметр и ~ 100 см длиной) через электроспрей эмиттера, позволяя ему выступать ~ 40-100 мкм за кончик эмиттера. Работа под стереомикроскопом помощи точности.
- Подключите оболочка решения капиллярные (75/360 мкм внутренний/внешний диаметр и ~ 100 см длиной) к разъему оставшиеся поставлять решения электроспрей. Использовать соответствующие рукава и палец Затяните соединения для работы без утечки интерфейса CE-ESI. Обратитесь к предыдущей протоколы31,32 для деталей на Ассамблею и неисправностей этого интерфейса.
Примечание: Размеры капиллярные влияет на отношение сигнал шум (S/N) и продолжительность разделения. Например узкие родила и короткие капилляров облегчить быстрый цветоделение с использованием выше разделения напряжение42,43. Кроме того в зависимости от типов молекул, которые представляют интерес в исследовании, свести к минимуму и избежать нежелательных молекулы капиллярной стенки взаимодействия44могут наноситься разделения капилляров.
- Подключите оболочка решения капиллярные (75/360 мкм внутренний/внешний диаметр и ~ 100 см длиной) к разъему оставшиеся поставлять решения электроспрей. Использовать соответствующие рукава и палец Затяните соединения для работы без утечки интерфейса CE-ESI. Обратитесь к предыдущей протоколы31,32 для деталей на Ассамблею и неисправностей этого интерфейса.
- С помощью пластины держателя, смонтировать CE-ESI интерфейс на этап 3 оси вращения и Расположите наконечник излучатель электроспрей ~ 2 мм от масс-спектрометр отверстия (рис. 1С).
- Для чистых компонентов интерфейса промывайте, поставляя BGE через CE разделения капиллярного и электроспрей оболочка решения через электроспрей излучатель в 1 мкл/мин. Используйте шприц насосы кормить растворителей с постоянной скоростью.
- Промойте CE разделения капиллярного перед каждым измерением, подключив шприца до конца входного отверстия. Используйте достаточно большие шприцы для сведения к минимуму пополнение и грунтовка жидкостной линии.
Примечание: Эксперименты обычно используют газонепроницаемой шприцев 1мл поставлять электроспрей оболочка растворителя и 500 мкл шприц для очистки капилляров разделения.
- Проверка платформы CE-ЭСИ MS и измерение метаболитов
Примечание: Цель этого шага является подтвердить Аналитическая чувствительность CE-ЭСИ-MS инструмент ежедневно до анализа сингл клеточных экстрактов.
- После ополаскивания разделения капиллярного ~ 5 мин, передачи его входе в раствор BGE, расположенный в пузырек из нержавеющей стали.
- Расположите наконечник излучатель электроспрей ~ 2 мм от масс-спектрометр отверстия и штраф отрегулировать это расстояние, используя стадии перевода для создания электроспрей стабильного режима конус Джет контролируя спрей с помощью стереомикроскопом (см. ссылки 31,45). Контролировать стабильность всего Ион текущего (TIC) ~ 30-45 мин для обеспечения стабильной работы.
- Применить ~ 20 кв для BGE флакона, постепенно наращивая потенциал более ~ 15 s, как правило генерации ~7.5 МКА текущей через разделение капилляра с использованием 1% муравьиной кислоты как Булак ДжиИПи Инжиниринг. Перед каждым измерением обеспечить стабильность системы, мониторинг ТИЦ профиль ~ 5-10 мин и затем поэтапно ниже разделение (CE) потенциал 0 V (заземление).
Примечание: Частично автоматизировать этот процесс, мы используем заказ программное обеспечение для удаленного управления питания высокого напряжения питания CE31. Если платформе CE-ЭСИ-МС является неустойчивым, тщательно оценить источник нестабильности путем тестирования платформы CE-ЭСИ-MS сначала в режиме только для ESI и затем в оперативном режиме CE-ESI как рекомендовал других31. Кратко для тестирования платформы в режиме только для ESI, выключите CE высокого напряжения и мониторинг ТИЦ ~ 30 мин в конус реактивного распыления режима. При необходимости, выполните следующие действия в адрес ошибки: (i) проверить соединения на герметичность; (ii) Очистите электроспрей излучатель с водой, изопропиловый спирт, воду и метанола; (iii) де газ растворителей; (iv) флеш излучатель для ~ 25 мин до тестирования снова. Если платформе CE-ESI найден стабильной в режиме только для ESI, но становится нестабильным во время разделения CE, проверить систему для Джоуль Отопление и/или электролиза: (i) флеш разделения капиллярного с BGE ~ 25 мин и повторить эксперимент; (ii) используйте нижнего разделения потенциалы для поддержания линейной омического ответ (то есть, линейные CE текущего против разделения кривой напряжения); (iii) осмотрите CE капилляра для потенциальных убытков, такие как трещины и при необходимости заменить капилляра. - Анализировать ~ 6 nL образца следующим образом:
- Пипетка 1 мкл стандартного раствора ацетилхолина в пробирку инъекций.
- Передача разделения капиллярного от BGE флакона в инъекций флакон.
- Поднимите стадии инъекции CE 15 см в 1s.
- Провести этап повышенных для 60 s придать эжекции ~ 6 nL образца в капиллярной разъединения.
- Впоследствии перевод этапе вернуться к начиная уровни (в соответствии с капиллярной розетки).
- Аккуратно переместите конец входного отверстия в Булак ДжиИПи Инжиниринг.
- Сразу же после, нарастить CE напряжения для начала электрофоретического разделения.
- МС начала сбора данных.
Примечание: Производительность системы может быть охарактеризована с использованием любого химического стандарта. CE-ЭСИ-МС обеспечивает одну ячейку ниже пределов обнаружения на ~ 10 Нм (~ 60 amol) для ацетилхолина, метионина и гистидина16. Объем инъекции (Vinj), в капилляр в nL, зависит разница в высоте (H, см) во время инъекции, плотность (ρ, g cm-3) и вязкость (η, кг м-1s-1) из Булак ДжиИПи Инжиниринг, длина (L, m) и радиус (r, мкм) CE капилляр и продолжительность впрыска (injt, s). Эта связь выражается по следующей формуле, где ускорение свободного падения g (m s-2):
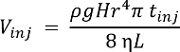
- После того, как был обнаружен стандарт, остановить сбор данных, ниже разделение напряжения ступенчатой 0 V (земли), а затем получить излучателя до 2 см от сопла. Промойте разделения капиллярного за 5 мин до анализа выдержки клетки.
- Мера 10 nL одноклеточных экстракт, повторив шаги 3.3.1-3.3.5 с помощью 90 s придать эжекции образца.
Примечание: Цель обработки данных – для выявления и количественного определения соединений между одиночных клеток. Одноклеточных CE-ЭСИ-MS протокол создает узкие electropherographic пики с типичной базовый шириной в несколько секунд. Путем выполнения анализа данных полу вручную, это можно найти молекулярные особенности (уникальный m/z значения с уникальными миграции раз) выполните следующие действия. Для выбора определенных метаболитов в рисунке 2aпоказана представитель разделения.
- Масса откалибрируйте файлов необработанных данных пост сбора данных.
Примечание: Мы используем сигналы от натрия Формиат кластеры, которые создаются во время разделения ионов натрия в изобилии от образца, которые изначально присутствуют в клетках или извлеченные из эмбриона культуры средств массовой информации. Цель этого шага – для повышения метаболит идентификации в последующих шагах обеспечивая точность высокой массы (m/z), желательно < 5 mDa, или < 10 ppm, между m/z 50-1, 000. Здесь, сообщение данных приобретение калибровки позволяет регулярно получения массового точности < 1 mDa, или < 2 ppm для m/z 50-500. - С помощью сценария обработки, Поиск молекулярные особенности различных обнаруженных массовых. Средняя массового спектры через каждый пик для определения точной массы и запишите их соответствующее время миграции. Для идентификации низкой массы метаболитов в диапазоне 50-500 m/z , используйте окно шаг 500 mDa для мониторинга молекулярные особенности с S/N > 3.
- Интегрируйте пик площадь под кривой для каждой функции молекулярной вручную или автоматически. Результирующие значения области используются как мера метаболит изобилия.
- Выявить молекулярные особенности, представляющие интерес с высокой степенью уверенности следующим образом (см. рис.
- Во-первых Сравните Точная масса молекулярные особенности против метаболит базы данных (например, Метлин46 и HMDB47) с точностью 10 ppm для получения списка предполагаемых массовых матчей.
- Далее, оценить эти массовые матчи, сравнивая их тандем массовых спектр, полученные из ячейки экстракты данными, имеющимися в базах данных метаболит или массовых спектр тандем измеряется для соответствующего химического стандарта.
- Наконец проверить эти назначения, сравнивая время миграции молекулярные особенности записан в клеточных экстрактов с связанной с химическим стандартам, проанализированы и того же инструмента CE-ЭСИ-MS.
Примечание: Для расширения экспериментальной пропускную способность, мы обычно идентифицировать только молекулярные компоненты, которые статистически значительно отличаются между экспериментальных условий или типов клеток. Представитель идентификаций показаны на рисунке 2. Для выявления метаболитов с высокой точностью массы, мы рекомендуем внешне калибровки в масс-спектрометр ежедневно, в реальном времени рекалибровки во время каждого измерения с использованием внутреннего стандарта, или внешне массы калибровка каждого измерения рекомендуется использовать файл данных после приобретения (например, для кластеров Формиат натрия здесь).
Примечание: В наших экспериментах, Интернет программное обеспечение платформ47 были использованы для выполнения всех этапов последующего анализа данных, включая следующие меры: i) фильтрация молекулярные особенности с появлением в по меньшей мере 50% каждой выборки (например, ячейку тип); II) нормализация данных; III) статистики (например, т-тест) и анализа многомерных данных, например анализ главных компонент (СПС) и иерархический кластерный анализ (HCA). Мы используем p < 0,05 (Студенческая t-тест) чтобы пометить статистической значимости и фолд изменения ≥ 1,5 отметить биологическое значение.
Результаты
Мы недавно занятых рентгенофлуоресцентного одноклеточных CE-ЭСИ-МС для характеристики метаболитов в отдельных определенных ячеек в свободно развивающиеся зародыши Xenopus laevis 29,30. Рентгенофлуоресцентного позволяет быстро (~ 5 сек/cell), ...
Обсуждение
Рентгенофлуоресцентного CE-ЭСИ-MS позволяет прямой характеристика метаболитов в одиночных клетках в прямом эфире, свободно развивающихся эмбрионов. В центре подхода находятся два технических подкомпонентов, а именно в situ капиллярного microsampling и высок чувствительности CE-ЭСИ-г-жа по ?...
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Эта работа была поддержана национальными институтами здравоохранения грантов GM114854 (чтобы п.н.) и CA211635 (для п.н.), Арнольд и Мейбл Бекман фонд Бекман молодой следователь предоставить (п.н.), премия DuPont молодой профессор (чтобы п.н.), Американское общество для массы Спектрометрия исследований премии (п.н.) и космос клуб фонд стипендий (R.M.O. и E.P.P.). Мнения и выводы, содержащиеся в настоящей публикации являются исключительно мнениями авторов и не обязательно отражают официальную точку зрения источников финансирования.
Материалы
| Name | Company | Catalog Number | Comments |
| Reagents for Embryo Culture Media | |||
| Potasium chloride | Fisher Scientific | BP 366-1 | |
| Magnesium sulfate | Fisher Scientific | M 65-3 | |
| Calcium nitrate | Sigma Aldrich | C1396 | |
| Cysteine | MP Biomedicals | 101444 | |
| Trizma hydrochloride | Sigma Aldrich | T3253 | |
| Trizma base | Sigma Aldrich | T1503 | |
| Sodium chloride | Fisher Scientific | 5641-212 | |
| Name | Company | Catalog Number | Comments |
| Metabolite Extraction Solvents | |||
| Acetonitrile (LC-MS-grade) | Fisher Scientific | A955 | |
| Methanol (LC-MS-grade) | Fisher Scientific | A456 | |
| Water (LC-MS-grade) | Fisher Scientific | W6 | |
| Name | Company | Catalog Number | Comments |
| Solvents and Standards for CE-ESI-MS | |||
| Formic acid (LC-MS-grade) | Fisher Scientific | A11710X1-AMP | |
| Methanol (LC-MS-grade) | Fisher Scientific | A456-4 | |
| Water (LC-MS-grade) | Fisher Scientific | W6 | |
| Sodium chloride | Fisher Scientific | 5641-212 | |
| Acetylcholine chloride | Acros Organics | 159170050 | |
| Name | Company | Catalog Number | Comments |
| Microprobe Fabrication Setup | |||
| Micropippette puller | Sutter Instrument Co. | P-1000 | |
| Borosilicate capillaries | Sutter Instrument Co. | B100-50-10 | |
| Fine sharp forceps: Dumont #5, Biologie/Dumoxel | Fine Science Tools (USA) Inc | 11252-30 | Corrosion resitant and autoclavable. |
| Name | Company | Catalog Number | Comments |
| Microprobe Sampling Setup | |||
| Micromanipulator | Eppendorf, Hauppauge, NY | TransferMan 4r | |
| Stereomicroscope | Nikon | SMZ18 | Should be vibrationally isolated. |
| Illuminator e.g. Goosenecks | Nikon | C-FLED2 | |
| Microinjector | Warner Instrument, Handem, CT | PLI-100A | |
| Transfer pipettes (Plastic, disposable) | Fisher Scientific | 13-711-7M | |
| Petri dish 60 mm and 80 mm | Fisher Scientific | S08184 | |
| Glass Pasteur Pipets ( Borosilicate, disposable) | Fisher Scientific | 13-678-20A | |
| Centrifuge | Thermo Scientific | Sorvall Legend X1R | |
| Name | Company | Catalog Number | Comments |
| CE-ESI-MS Setup | |||
| High voltage power supply | Spellman | CZE1000R | The HVPS may be controlled remotely using a low-voltage program generated by a personal computer. Caution: High voltage presents electrical shock hazard; all connective parts must be grounded or carefully shielded to prevent users from accidental exposure. |
| Syringe pumps (2) | Harvard Apparatus | 704506 | |
| Stereomicroscope | Amscope | SM-3BZZ | Stereomicroscope capable of 4.5× magnification, equipped with an illuminator to monitor the spraying mode of the CE-ESI interface. |
| XYZ translation stage | Thorlabs | PT3 | |
| XYZ translation stage | Custom-built | This platform is capable of loading nanoliter-amounts of sample into the separation capillary via hydrodynamic injection and supplying the BGE for CE. Both interfaces described in this work were able to inject 6–10 nL of sample within 1 min into a 1 m separation capillary | |
| Stainless steel sample vials | Custom-built | ||
| Stainless steel BGE vial | Custom-built | ||
| Fused silica capillary (40 µm/105 µm ID/OD; 100 cm) | Polymicro technologies | TSP040105 | |
| Fused silica capillary (75 µm/360 µm ID/OD; 100 cm) | Polymicro technologies | TSP075375 | |
| Stainless steel emitter with blunt tips (130/260 µm ID/OD) | Hamilton Co. | 21031A | For better performance, laser-cleave and fine-polish the emitter tip. |
| Syringes (gas-tight): 500 - 1000 µL | Hamilton Co. | 1750TTL | |
| Digital multimeter | Fluke | Fluke 117 | |
| High-resolution Mass Spectrometer | Bruker Daltonics | Maxis Impact HD | High-resolution tandem mass spectrometer equipped with an atmospheric-pressure interface configured for ESI |
| Tunning mixture for mass spectrometer calibration | Agilent technologies | ESI-L G1969-85000 | |
| Data Analysis ver. 4.3 software | Bruker Daltonics | ||
| Name | Company | Catalog Number | Comments |
| Ancillary Equipment | |||
| Vacuum concentrator capable of operation at 4–10°C | Labconco | 7310022 | |
| Analytical microbalance (XSE105DU) | Fisher Scientific | 01911005 | |
| Freezer (-20 °C) | Fisher Scientific | 97-926-1 | |
| Freezer (-80 °C) | Fisher Scientific | 88300ASP | |
| Refrigerated Incubator | Fisher Scientific | 11475126 | |
| Vortex-mixer | Benchmark | BS-VM-1000 |
Ссылки
- Tang, F. C., Lao, K. Q., Surani, M. A. Development and applications of single-cell transcriptome analysis. Nat. Methods. 8 (4), S6-S11 (2011).
- Veselovska, L., et al. Deep sequencing and de novo assembly of the mouse oocyte transcriptome define the contribution of transcription to the DNA methylation landscape. Genome Biol. 16 (209), (2015).
- Tran, D. A., Bai, A. Y., Singh, P., Wu, X. W., Szabo, P. E. Characterization of the imprinting signature of mouse embryo fibroblasts by RNA deep sequencing. Nucleic Acids Res. 42 (3), 1772-1783 (2014).
- Wang, D. J., Bodovitz, S. Single cell analysis: the new frontier in 'omics'. Trends Biotechnol. 28 (6), 281-290 (2010).
- Svatos, A. Single-cell metabolomics comes of age: new developments in mass spectrometry profiling and imaging. Anal. Chem. 83 (13), 5037-5044 (2011).
- Rubakhin, S. S., Romanova, E. V., Nemes, P., Sweedler, J. V. Profiling metabolites and peptides in single cells. Nat. Methods. 8 (4), S20-S29 (2011).
- Bodenmiller, B., et al. Multiplexed mass cytometry profiling of cellular states perturbed by small-molecule regulators. Nat. Biotechnol. 30 (9), 858-889 (2012).
- Rubakhin, S. S., Lanni, E. J., Sweedler, J. V. Progress toward single cell metabolomics. Curr. Opin. Biotechnol. 24 (1), 95-104 (2013).
- Kleparnik, K., Foret, F. Recent advances in the development of single cell analysis: A review. Anal. Chim. Acta. 800, 12-21 (2013).
- Zenobi, R. Single-cell metabolomics: Analytical and biological perspectives. Science. 342 (6163), 1243259 (2013).
- Gholipour, Y., Erra-Balsells, R., Nonami, H. In situ pressure probe sampling and UV-MALDI MS for profiling metabolites in living single cells. Mass Spectrom (Tokyo). 1 (1), A0003 (2012).
- Comi, T. J., Do, T. D., Rubakhin, S. S., Sweedler, J. V. Categorizing cells on the basis of their chemical profiles: progress in single-cell mass spectrometry. J. Am. Chem. Soc. 139 (11), 3920-3929 (2017).
- Lombard-Banek, C., Portero, E. P., Onjiko, R. M., Nemes, P. New-generation mass spectrometry expands the toolbox of cell and developmental biology. Genesis. 55, e23012 (2017).
- Yang, Y. Y., et al. Single-cell analysis by ambient mass spectrometry. Trac-Trends Anal. Chem. 90, 14-26 (2017).
- Lanni, E. J., Rubakhin, S. S., Sweedler, J. V. Mass spectrometry imaging and profiling of single cells. J. Proteomics. 75 (16), 5036-5051 (2012).
- Onjiko, R. M., Moody, S. A., Nemes, P. Single-cell mass spectrometry reveals small molecules that affect cell fates in the 16-cell embryo. Proc. Natl. Acad. Sci. U. S. A. 112 (21), 6545-6550 (2015).
- Mizuno, H., Tsuyama, N., Harada, T., Masujima, T. Live single-cell video-mass spectrometry for cellular and subcellular molecular detection and cell classification. J. Mass Spectrom. 43 (12), 1692-1700 (2008).
- Nakashima, T., et al. Single-cell metabolite profiling of stalk and glandular cells of intact trichomes with internal electrode capillary pressure probe electrospray ionization mass spectrometry. Anal. Chem. 88 (6), 3049-3057 (2016).
- Pan, N., et al. The single-probe: A miniaturized multifunctional device for single cell mass spectrometry analysis. Anal. Chem. 86 (19), 9376-9380 (2014).
- Guillaume-Gentil, O., et al. Single-cell mass spectrometry of metabolites extracted from live cells by fluidic force microscopy. Anal. Chem. 89 (9), 5017-5023 (2017).
- Saha-Shah, A., Green, C. M., Abraham, D. H., Baker, L. A. Segmented flow sampling with push-pull theta pipettes. Analyst. 141 (6), 1958-1965 (2016).
- Hu, J., et al. Synchronized polarization induced electrospray: Comprehensively profiling biomolecules in single cells by combining both positive-ion and negative-ion mass spectra. Anal. Chem. 88 (14), 7245-7251 (2016).
- Zhang, L. W., Vertes, A. Energy charge, redox state, and metabolite turnover in single human hepatocytes revealed by capillary microsampling mass spectrometry. Anal. Chem. 87 (20), 10397-10405 (2015).
- Zhang, L. W., et al. In Situ metabolic analysis of single plant cells by capillary microsampling and electrospray ionization mass spectrometry with ion mobility separation. Analyst. 139 (20), 5079-5085 (2014).
- Lapainis, T., Rubakhin, S. S., Sweedler, J. V. Capillary electrophoresis with electrospray ionization mass spectrometric detection for single-cell metabolomics. Anal. Chem. 81 (14), 5858-5864 (2009).
- Nemes, P., Knolhoff, A. M., Rubakhin, S. S., Sweedler, J. V. Metabolic differentiation of neuronal phenotypes by single-cell capillary electrophoresis electrospray ionization mass spectrometry. Anal. Chem. 83 (17), 6810-6817 (2011).
- Aerts, J. T., et al. Patch clamp electrophysiology and capillary electrophoresis mass spectrometry metabolomics for single cell characterization. Anal. Chem. 86 (6), 3203-3208 (2014).
- Onjiko, R. M., Morris, S. E., Moody, S. A., Nemes, P. Single-cell mass spectrometry with multi-solvent extraction identifies metabolic differences between left and right blastomeres in the 8-cell frog (Xenopus) embryo. Analyst. 141 (12), 3648-3656 (2016).
- Onjiko, R. M., Plotnick, D. O., Moody, S. A., Nemes, P. Metabolic comparison of dorsal versus ventral cells directly in the live 8-cell frog embryo by microprobe single-cell CE-ESI-MS. Anal. Methods. , (2017).
- Onjiko, R. M., Portero, E. P., Moody, S. A., Nemes, P. In situ microprobe single-cell capillary electrophoresis mass spectrometry: Metabolic reorganization in single differentiating cells in the live vertebrate (Xenopus laevis) embryo. Anal. Chem. 89, 7069-7076 (2017).
- Nemes, P., Rubakhin, S. S., Aerts, J. T., Sweedler, J. V. Qualitative and quantitative metabolomic investigation of single neurons by capillary electrophoresis electrospray ionization mass spectrometry. Nat. Protoc. 8 (4), 783-799 (2013).
- Knolhoff, A. M., Nemes, P., Rubakhin, S. S., Sweedler, J. V., Wevers, R., Lutz, N., Sweedler, J. V. . Methodologies for Metabolomics. , 119-139 (2013).
- Sive, H. L., Grainger, R. M., Harland, R. M. . Early development of Xenopus laevis: a laboratory manual. , (2000).
- Moody, S. A. Cell lineage analysis in Xenopus embryos. Methods Mol Biol. 135, 331-347 (2000).
- Bowes, J. B., et al. Xenbase: a Xenopus biology and genomics resource. Nucleic Acids Res. 36, D761-D767 (2008).
- Karpinka, J. B., et al. Xenbase, the Xenopus model organism database; new virtualized system, data types and genomes. Nucleic Acids Res. 43 (D1), D756-D763 (2015).
- James-Zorn, C., et al. Xenbase: expansion and updates of the Xenopus model organism database. Nucleic Acids Res. 41 (D1), D865-D870 (2013).
- Moody, S. A. Fates of the blastomeres of the 16-cell stage Xenopus embryo. Dev. Biol. 119 (2), 560-578 (1987).
- Moody, S. A. Fates of the blastomeres of the 32-cell-stage Xenopus embryo. Dev. Biol. 122 (2), 300-319 (1987).
- Dale, L., Slack, J. M. W. Fate map for the 32-cell stage of Xenopus laevis. Development. 99 (4), 527-551 (1987).
- Klein, S. L. The first cleavage furrow demarcates the dorsal-ventral axis in Xenopus embryos. Dev. Biol. 120 (1), 299-304 (1987).
- Rollman, C. M., Moini, M. Ultrafast capillary electrophoresis/mass spectrometry of controlled substances with optical isomer separation in about a minute. Rapid Commun. Mass Spectrom. 30 (18), 2070-2076 (2016).
- Moini, M., Martinez, B. Ultrafast capillary electrophoresis/mass spectrometry with adjustable porous tip for a rapid analysis of protein digest in about a minute. Rapid Commun. Mass Spectrom. 28 (3), 305-310 (2014).
- Huhn, C., Ramautar, R., Wuhrer, M., Somsen, G. W. Relevance and use of capillary coatings in capillary electrophoresis-mass spectrometry. Anal. Bioanal. Chem. 396 (1), 297-314 (2010).
- Nemes, P., Marginean, I., Vertes, A. Spraying mode effect on droplet formation and ion chemistry in electrosprays. Anal. Chem. 79 (8), 3105-3116 (2007).
- Zhu, Z. J., et al. Liquid chromatography quadrupole time-of-flight mass spectrometry characterization of metabolites guided by the METLIN database. Nat. Protoc. 8 (3), 451-460 (2013).
- Wishart, D. S., et al. HMDB 3.0 The Human Metabolome Database in 2013. Nucleic Acids Res. 41 (D1), D801-D807 (2013).
- Liu, J. X., Aerts, J. T., Rubakhin, S. S., Zhang, X. X., Sweedler, J. V. Analysis of endogenous nucleotides by single cell capillary electrophoresis-mass spectrometry. Analyst. 139 (22), 5835-5842 (2014).
- Hubrecht, L., Nieuwkoop, P. D., Faber, J. . Normal table of Xenopus laevis (Daudin). A systematical and chronological survey of the development from the fertilized egg till the end of metamorphosis. , (1967).
- Grant, P. A., Herold, M. B., Moody, S. A. Blastomere explants to test for cell fate commitment during embryonic development. J. Vis. Exp. (71), (2013).
- Sellick, C. A., Hansen, R., Stephens, G. M., Goodacre, R., Dickson, A. J. Metabolite extraction from suspension-cultured mammalian cells for global metabolite profiling. Nat. Protoc. 6 (8), 1241-1249 (2011).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены