Method Article
Смешанных иерархических изображений последовательных секций для нахождения конкретных клеточных мишеней в больших объемах
В этой статье
Резюме
Этот протокол нацелен на конкретных клеток в тканях для изображений на наноуровне резолюции с помощью сканирующего электронного микроскопа (SEM). Большое количество последовательных секций от смолы встроенный биологического материала сначала отражаются в световой микроскоп для идентификации цели и затем в иерархически в SEM.
Аннотация
Ориентации конкретных ячеек на ультраструктурные резолюции в популяцию смешанных клеток или тканей может быть достиган иерархических изображений, используя сочетание света и электронной микроскопии. Образцы, встроенные в смоле секционного в массивы, состоящий из ленты сотен ультратонких секций и хранение на куски кремниевой пластины или кондуктивно покрытием coverslips. С низким разрешением, используя цифровые потребителей как смартфон камеры или световой микроскоп (LM) для быстрого большая площадь обзора или широкое поле флуоресцентным микроскопом (световой микроскопии флуоресцирования (FLM)) после маркировки с флуорофоров отражаются массивы. После после окрашивания с тяжелыми металлами, массивы отражаются в сканирующий электронный микроскоп (SEM). Выбор целей возможен из 3D реконструкций, порожденных FLM или 3D реконструкций, сделанные из SEM стеки изображений на промежуточных резолюции, если не флуоресцентные маркеры доступны. Ультраструктурные анализа, выбранных целей наконец записываются в SEM в с высоким разрешением (несколько пикселей изображения нанометр). Лента обработке инструмент, который может быть установлена на любой ultramicrotome продемонстрировал. Он помогает с массив производство и удаление подложки из резания ножа лодки. Программная платформа, которая позволяет автоматическое создание образов массивов в SEM обсуждается. По сравнению с другими методами генерации большого объема EM данных, такие как последовательный блок лицо SEM (SBF-SEM) или целенаправленного ионного пучка SEM (FIB-SEM), этот подход имеет два основных преимущества: (1) смолы встроенный образец сохраняется, хотя и в версии нарезанный вверх. Может быть пятнами различными способами и образы с различными разрешениями. (2) как разделы могут быть окрашены пост, нет необходимости использовать образцы сильно блок окрашенных с тяжелыми металлами, ввести контраст для SEM изображений или визуализации тканей блоков проводящие. Это делает метод применяется широкий спектр материалов и биологических вопросов. Особенно префиксом материалов например, биопсия банков и лаборатории патологии, можно непосредственно встроенные и реконструирован в 3D.
Введение
Для реконструкции больших объемов ткани на ультраструктурные резолюции целый ряд различных изображений подходов, основанных на SEM были используется1: всеобъемлющие обзоры являются имеющиеся например., SBF-SEM2, Компания FIB-SEM3и массив Томография (в)4. Хотя для последнего метода образец материала сохраняется как массив последовательных секций на подложке, SBF-SEM и FIB-SEM являются разрушающими методами, работает на блоке образца и потребляющих его во время визуализации. Благодаря зарядки смолы в SEM, они также зависят от сильно металлизированной образца блоков5.
С другой стороны выявления определенных ячеек или структуры интереса в образец ткани может воспользоваться особенно коррелятивных света и электронной микроскопии (Клем)6,,78. С помощью FLM для ориентации исключает применение большого количества тяжелых металлов, так как это бы утолить флуоресценции сигнала9. Для таких лишь слегка металлизированной образцов AT является методом выбора, поскольку массивы могут быть легко пост окрашенных с тяжелых металлов после LM изображений. Кроме того почти любой тип образца могут быть использованы для AT, даже обычные образцы из патологоанатома сокровище грудь10.
Другим большим преимуществом на это потенциал для иерархических11 или множественным разрешением изображений12: это не нужно все в с высоким разрешением изображения, как целевые показатели могут быть выбраны в различной модальности (например, FLM) или в SEM изображения с низким разрешением. Imaging только интересных регионов ткани или клетки населения в высоким разрешением экономит пространство для хранения цифровых данных и производит меньше наборов данных изображения, которые проще в обращении. Здесь, в рабочий процесс проявляется с использованием довольно слабо металлизированной выборки: высокого давления замороженных корни растений (Arabidopsis thaliana) встроенный в гидрофильной смолы.
Объяснил, как массивы готовятся, витражи и отражаться в FLM и SEM, и как стеки изображений зарегистрированы. Кроме того как 3D-реконструкции FLM тома может использоваться для выбора конкретных ячеек для изображений в SEM в наноразмерных резолюции свидетельствует.
протокол
Примечание: Образец блоки должны быть полимеризуется и содержат некоторые хэви-метал. Фиксации и внедрение протоколов для двух выборок, показано на рисунке 1A-B были описаны в другом месте11. Короче говоря пример, показанный на рисунке 1A химически зафиксирована, окрашенных комплектно первый с 1% OsO4, затем с 1% уранила ацетат и встроенный в Spurr в смоле. Пример, показанный в Рисунок 1B был заморожен высокого давления, заморозить замещенных с 0,4% ацетат уранила в ацетоне и встроенных в Lowicryl HM20 смолы. Используйте неопудренные перчатки для следующих этапов подготовки.
1. Создание массивов
- Обрезка блока выборки
Примечание: Всегда завинчивайте винты хорошо при вставке частей.- Вставьте блок выборки в держатель образца ultramicrotome, установите держатель в блоке обрезки и задвиньте его в нижней стадии ultramicrotome.
- Трим прочь смолы вокруг встроенных ткани с лезвием бритвы, оставив лишь небольшой ОПРАВЫ смолы вокруг образца. Обрезать сверху, пока не будет достигнута цель.
Примечание: Форму блок лица может быть трапеции или прямоугольной (мы успешно использовал обе фигуры). Важно использовать больше сторон прямоугольника как ведущий и задней кромкой для обеспечения охвата большой площади, смесь клея, стабилизации ленты. - Вставьте держатель образца в руку ultramicrotome и заменить блок обрезки в нижней стадии держателя ножа. Обрезать ножом алмаз (обычно 45°), вставьте держатель ножа. Совместите точно параллельно к краю обрезки нож блок лицо.
Примечание: Производить точно параллельных ведущих (внизу) и конечные (сверху) края, повернуть или переместить только нож, чтобы обрезать противоположной стороны. Для больших объемов (более чем на несколько сотен разделы) выгодно обрезать ножом 90°. - Гладкие все четыре стороны, а затем повернуть держателя образца, так что ведущих и задний край теперь находятся в горизонтальном положении.
- Тщательно покройте начальные и конечные стороны блока с клеевой смесью. Используйте щетку крошечные, формируется из нескольких волосков, крепится к зубочистку13. Быстро выполняйте этот шаг, потому что растворителя этой смеси испаряется в течение нескольких секунд. Не загрязняет блок лицо с этой смесью. Пусть покрытые образец блока сухая для 5-10 мин.
Примечание: для большего числа разделов (> 200), она может быть лучше пальто передний край только, потому что со временем, может строить на задней кромке выпуклость клея и потенциально тянуть обратно разделы над ножа.
- Подготовка субстрата
- Вырежьте куски кремниевых пластин до размера, который вписывается в лодке нож (примерно 2 х 2,5 см2 для Jumbo нож). При необходимости, Марк штук Вафля (цифры или буквы) с алмазной Чертилка перед чисткой, или с постоянным маркером после очистки. Очистите кремниевой пластины вручную с изопропанол и ворса ткани.
Примечание: Для корреляционного изображений используйте Индий Оксидно оловянные (ИТО)-покрытием стекла coverslips. Они должны быть обработаны очень тщательно, и дополнительной очистки не является необходимым. - Исправьте субстрата к одному концу несущей плиты, используя съемный клей.
Примечание: в качестве альтернативы, края подложки может быть закреплен вниз параллельно ножа, с использованием двух полос клейкой ленты. - Плазмы активировать (тлеющий разряд) субстрат с воздуха для получения гидрофильные поверхности. Это должно быть сделано таким образом, что капля воды помещаются субстрат распространяется на очень тонкой пленки (низкий угол контакта, рис. 2 c, D). Гидрофилизации параметры зависят от плазмы устройство, используемое; для параметров, используемых здесь см. Таблицу материалов.
Примечание: Плазменная Активация является весьма неустойчивым, так выполнить это непосредственно перед использованием субстрата. - Вставьте перевозчика в зажим субстрата владельца, с навесные субстрат ближе к ножа для достижения смачивания подложки в лодке, нож.
Примечание: Подробное описание держателя субстрата, включая чертежи компьютерного проектирования (CAD), приводится в Wacker и др. 11
- Вырежьте куски кремниевых пластин до размера, который вписывается в лодке нож (примерно 2 х 2,5 см2 для Jumbo нож). При необходимости, Марк штук Вафля (цифры или буквы) с алмазной Чертилка перед чисткой, или с постоянным маркером после очистки. Очистите кремниевой пластины вручную с изопропанол и ворса ткани.
- Секционирование подготовка
- Вставьте держатель ножа Jumbo Алмазный нож, установите задний угол (0° для Jumbo нож) и заполнить нож лодка с дистиллированной водой. Подход нож на расстоянии 1 – 2 мм для образца.
- Опустите субстрата в воду с помощью винтов 1 – 3 (рисунок 2A) держателя субстрата. Проверьте, что ватерлинии расположен в верхней трети субстрата.
Примечание: Проверьте, что клей между субстрата и несущая плита хорошо лечится подталкивая субстрат чистым пинцетом. Он не должен двигаться. - Потому что это трудно увидеть Дорожный просвет при использовании кремниевой пластины, меньше субстрата до тех пор, пока вы чувствуете его касаться пола. Теперь поднимите субстрата небольшую сумму. Убедитесь, что субстрат ни перевозчик затрагивает нож лодке во время резки.
- Использование шприца или пипетки для регулировки уровня воды в лодку. Во время просмотра через бинокль, добавьте или удалите воду до тех пор, пока полная площадь водной поверхности показывает однородных отражением верхнего света освещение ultramicrotome.
- Включите свет нижней ultramicrotome. Убедитесь, что рука находится в среднем положении и не в опровержение, с использованием маховика ultramicrotome. Подход нож образца до тех пор, пока отражение ножа виден на лице блок.
- Используйте параметры настройки ultramicrotome для выравнивания образец к ножу. Первый поворот нож, а затем поверните и наклоните образца.
Примечание: Это должным образом выравнивается если полоса света, который можно увидеть в зазор между образцом и нож, параллельных краям (прямо параллельных линий и не клин формы). - Проверьте наклонение образца: Убедитесь, что светлая полоса не стать толще или тоньше, двигаясь вверх и вниз в образце. При необходимости, используйте дуги регулировочный винт исправить это. Переместите нож ближе к образцу, до тех пор, пока он чуть выше блок лицо (но не трогать).
- Установите раздел толщина (корма), резка скорость и резки окно на блок управления.
- Начало секционирование. При необходимости ждать, пока первый полный раздел вырезается. Вырезать некоторые разделы, чтобы убедиться что они слипаются в форме ленты (в противном случае клей должен применяться снова). Начните с высокой стоимостью кормов (максимум 200 Нм для Ultra нож) до тех пор, пока первый полный раздел вырезается. Затем установите требуемое значение канала. Для адекватного ленты стабильности, секции толщиной 100 Нм и скорость резки 1 мм/s является хорошей отправной точкой. Низким достижимые раздел толщина составляет около 60 Нм, в зависимости от качества образца.
- Остановите секционирование. Удалите все ненужные разделы (частично отрезока) от ножа и лодка с помощью кошки ресниц волос. Если есть много небольших частиц мусора плавающей вокруг, удалите воду полностью с пипетки и заполнить лодка с пресной водой. Теперь процесс готова для первого производственного ленты.
- Секционирование
- Начало секционирование. После того, как ряд разделов (фактическое число зависит от размера секций и субстрата) была сокращена, остановить процесс резания и освободить ленты от ножа, осторожно поглаживая над ножа с ресниц14 или еще лучше, с очень мягкие волосы от кошачьего меха.
- Манипулировать (Тяни/Толкай) ленты с ресниц к подложке и прикрепить первой секции к подложке.
Примечание: Необходимо осторожно нажмите на ленте до тех пор, пока он прилипает к сухой части субстрата. - Продолжать секционирование и присоединение ленты к подложке. Начать с одной стороны и двигаться постепенно более на другой, с каждой новой лентой.
Примечание: Избегайте движения массивные воды во избежание ослабления уже вложенных ленты. То же самое верно для воздушных течений. Используйте щит дыхание, поставляется с ultramicrotome. В неблагоприятных условиях окружающей среды вольер для ultramicrotome рекомендуется15. - Когда субстрат полностью покрыты с лентами (обычно 4-5 ленты осуществимо), осторожно Лифт из субстрата нож лодка с помощью винтов микроманипулятор держателя субстрата.
Примечание: Подходит движения являются: Поднимите вверх по вертикали (винт 1) и поворот/наклон, (винт 3), или комбинация обоих. - Пусть сухой перед его сохранением в среде пыли массив ленты. После высыхания, удалите клей навесные субстрата как можно скорее от перевозчика (в тот же день, иначе может быть слишком трудно удалить субстрат или даже может сломаться во время демонтажа).
2. Окрашивание для LM изображений
Примечание: Различные методы окрашивание маркировки возможно, включая протоколы иммунофлуоресценции. Здесь прямой, довольно неспецифические пятно выбирается наметить клеточной стенки.
-
Окрашиванию пропидий йодидом
- Покрыть дно большой стакан Петри (диаметр 30 см) с парафина и линии края блюдо с мокрой ткани для построения влажной камере.
- Используйте примерно 300-500 мкл раствора на coverslip. Поместите одну каплю для каждого coverslip на парафина и положите стекло вниз на падение, так что разделы находятся в контакте с окрашивание жидкости. Обложка блюдо и оберните его с алюминиевой фольги для защиты образцы от света. Проинкубируйте образцы для 16 h при 4 ° C.
- Удалите coverslip пинцетом и мыть его, перемещая его вверх и вниз в 100-мл стакан, наполненный 80 мл дистиллированной воды. Повторите этот шаг в другой стакан с пресной водой. Сухой coverslip тщательно с сжатым воздухом.
3. запись стека изображений в FLM
- Место coverslip на сцене общей FLM поля.
- Выберите соответствующий фильтр (Таблица материалов) для флуоресценции соблюдаться.
- С подходящим объектива, принимать изображения объекта в каждом разделе: попытаться заполнить поле зрения и поддержания постоянной ориентации. Для кончика корня был использован 40 X воздушные цели.
Примечание: Если ленты не идеально прямой, вращающейся сцене может помочь переориентировать разделы при принятии изображений. Если возможно центр изображения на конкретной функции или держать функцию как краю раздела на равном расстоянии к краю записанные изображения. - Если возможно используйте 16 бит ограничить насыщенных пикселей и поддерживать постоянной времени экспозиции.
4. Регистрация FLM стека изображений
- Импорт изображения серии в Фиджи16 как виртуальный стек.
- Открытие нового TrakEM17 (пустой) из меню файл.
- Щелкните правой кнопкой мыши в области изображения и импортировать стека в TrakEM как «Один срез в слое».
- Выровнять слои (щелкните правой кнопкой мыши в поле изображения), задайте диапазон (сначала изображение до последнего) и выберите нет в качестве ссылки. Для всех параметров используйте значения по умолчанию и выберите жесткие желаемого преобразования.
- Когда регистрация закончена и удовлетворительным, сохранить соответствие набора данных, щелкните правой кнопкой мыши и выберите экспорт. Сделать плоское изображение, установите диапазон от первого до последнего изображения и пусть показать результирующий стек программного обеспечения. Сохраните стек в формате tif.
5. Окрашивание и крепления для SEM изображений
Примечание: Для подготовки окрашивание решения смотрите Таблицу материалов. Решения могут храниться при температуре 4 ° C на срок до 12 месяцев, защищенном от света и воздуха.
Предупреждение: Цитрата и уранила ацетат свинца содержат тяжелые металлы, которые являются токсичными. Надевайте перчатки и распоряжаться отходов согласно инструкции местных властей.
- Покрыть дно большой стакан Петри (диаметр 30 см) с парафина и линии края блюдо с мокрой ткани для построения влажной камере.
Примечание: Важно, что несколько гранулы NaOH расположены в Петри вблизи окрашивание капли для предотвращения чрезмерных осадков цитрата свинца. -
Уранила ацетат пятнать
- Центрифуга ацетата раствор уранилнитрата на 2680 x g за несколько секунд, чтобы мелкие частицы отложений.
- Используйте примерно 300 – 500 мкл раствора на coverslip. Поместите одну каплю для каждого coverslip на парафина и положите стекло вниз на падение, так что разделы находятся в контакте с окрашивание жидкости.
- Проинкубируйте втечение 10 мин при комнатной температуре и обложка блюдо во время окрашивания.
- Удалить coverslip с щипцами и мыть, перемещая его вверх и вниз в стакан наполнен дистиллированной воды (см. шаг 2.1.3).
-
Привести цитрат пятнать
- Во время инкубации уранила ацетат приготовляют раствор цитрата свинца.
Примечание: Свинец цитрат всегда должны быть отфильтрованы непосредственно перед применением, чтобы удалить любые осадков. Также центрифуги цитрата свинца на 2680 x g в течение нескольких секунд, как в шаге 5.2.1. - Используйте примерно 300 – 500 мкл раствора на coverslip. Поместите одну каплю для каждого coverslip на парафина непосредственно перед стиркой coverslips после окрашивания уранила ацетат и положите стекло вниз на падение, так что разделы находятся в контакте с окрашивание жидкости. Место капель (300 – 500 мкл) на парафина непосредственно перед стиркой coverslips после окрашивания уранила ацетат.
Примечание: Чтобы избежать образования осадка, не дышать на капельки цитрат свинца. - Место промывают coverslip вниз на падение (нет необходимости сушить).
- Инкубировать в течение 5 мин при комнатной температуре и обложка блюдо во время окрашивания.
- Удалите coverslip пинцетом и мыть его, как описано выше в стакан с пресной водой (шаг 5.2.4).
- Во время инкубации уранила ацетат приготовляют раствор цитрата свинца.
- Сухой coverslip тщательно с сжатым воздухом.
-
Установка образцов для SEM изображений
- Смонтируйте кремниевых пластин на алюминиевых заглушки с липкой углерода площадку.
Примечание: Ито покрытием coverslips могут быть установлены с помощью Серебряная краска и Cu ленты — убедитесь, что поверхности проводящей подключен к заглушки — или с колодки углерода как указано выше. В этом случае проводящих от поверхности Ито на заглушку можно соединение с капелькой Серебряная краска.
- Смонтируйте кремниевых пластин на алюминиевых заглушки с липкой углерода площадку.
6. иерархическая изображений в SEM
Примечание: В области выбросов SEM, выбрать низкий первичной энергии (3 кв и ниже), луч, тока в диапазоне от 50 до 800 ПА, чтобы избежать зарядки и подходящее рабочее расстояние для эффективного сбора вторичных и/или обратно рассеянном электронов. Выбор тока луча зависит от свойств образца (например., встраивание смолы); дозы электронов также будет компромиссом между небольшой ток (менее вредных для образца) и высокий ток, который является полезным для визуализации скорость и таким образом снижает время приобретения всего изображения. Выделенный для обратно рассеянном электронов обеспечивают хороший контраст, менее чувствительны к зарядки образца и Показать меньше образца поверхности артефактов (складки, следы ножа). Яркость и контрастность следует скорректировать таким образом, что гистограмма выравнивается по центру.
-
SEM изображений
- Сначала определите на четырех углах массива, захватывая изображение каждого угла при низком увеличении, о 100 x. Создайте область интереса (ROI), включающего весь массив. Назначение изображений протокол со следующими параметрами: Используйте детектор средних электронов (SE), который позволяет для высокой скорости обработки изображений на большие изображения Размер пикселя (например 1000 Нм) и время короткого пребывания (например, 0,2 µs).
Примечание: Преодолеть электрона оптического ограничения на большой сканирования поля зрения (FOV), которые могут привести к искажениям на периферии изображения, используйте выделенный малое увеличение режимов (предоставляется большинством производителей SEM) или использовать средний, 1 к 2 k сканирования поля для отдельные изображения. - Создайте раздел, установить, создав ROI, изложением только ткани в первом разделе. Клонировать его для всех последующих разделах, используя инструмент «Штамп». Вращайте трансформирования, когда требуется, чтобы вместить изогнутой ленты.
- Запись изображения серии, используя промежуточный размер (около 50 Нм) и выдержки времени достаточно долго, чтобы определить и признать в целевой структуре. Используйте ПЗ для одного изображения в диапазоне 6-10 k пикселей.
Примечание: Атлас 5 программное обеспечение может автоматически собирать мозаика состоит из смежных изображений для покрытия больших территорий ROI/раздел через последовательный секций. - Создание сайта в этот раздел набор, содержащий целевой структуры для более высокой резолюции SEM воображения. Сделайте ROI достаточно большой счет для стадии точности. Проверка и регулировка позиции сайтов.
Примечание: Важно поместить ROIs таким образом, что центр, где будет выполняться автофокусом и autostigmation, не сидеть на «пустой» материала без структурных деталей, например., вакуоли. - Определение параметров автофокуса и проверить производительность в течение по крайней мере длина ленты (т.е., длинная дистанция, что сцена имеет путешествовать) на небольшой ROI рядом с сайта, который будет воспроизведен образ.
- Определите изображений протокол для высокого разрешения приобретения SEM. Чтобы увидеть мембраны отсеков, выберите размер пикселя изображения 3-5 Нм. Выберите время задержки в зависимости от детектора, так что изображение не слишком шумно.
- Прежде чем начать приобретение, определите значения фокус на по крайней мере в первом разделе каждой ленты, с помощью параметра протокол проверки.
- Начните автоматическое создание образов SEM целый ряд целевых ROIs.
- Экспортируйте полученные данные в виде серии изображений, предпочтительно в формате tif.
- Сначала определите на четырех углах массива, захватывая изображение каждого угла при низком увеличении, о 100 x. Создайте область интереса (ROI), включающего весь массив. Назначение изображений протокол со следующими параметрами: Используйте детектор средних электронов (SE), который позволяет для высокой скорости обработки изображений на большие изображения Размер пикселя (например 1000 Нм) и время короткого пребывания (например, 0,2 µs).
7. Регистрация стека изображений SEM
- Импорт изображения серии в Фиджи как виртуальный стек.
Примечание: Эти будут большие файлы данных в диапазоне нескольких ГБ в зависимости от количество секций и размер ROI. - Обрезать изображение SEM стек для дальнейшей обработки в район как можно ближе к структуре интерес как можно и настроить яркость и контрастность.
- Открытие нового TrakEM17 (пустой) из меню файл.
- Щелкните правой кнопкой мыши в области изображения и импортировать стека в TrakEM как «Один срез в слое».
- Выровнять слои (щелкните правой кнопкой мыши в области изображения), выбрать наименьших квадратов как режим, задайте диапазон (сначала изображение до последнего) и выберите нет в качестве ссылки. Для параметров используйте значения по умолчанию и выбрать жесткий желаемого преобразования.
- Когда регистрация завершена и удовлетворительным, сохранить соответствие набора данных, щелкните правой кнопкой мыши и выберите экспорт. Сделать плоское изображение, установите диапазон от первого до последнего изображения и пусть показать результирующий стек программного обеспечения. Сохраните стек в формате tif.
Результаты
Рабочий процесс описано здесь (рис. 1) начинается с образцом, встроенные в блоке смолы. В ходе подготовки пробы некоторых тяжелых металлов должно вводиться в ткани, но это не обязательно использовать протоколы, оптимизированный для довольно сильные металлизации. Рисунок 1A показывает корень растения (кресс-салат) блок окрашенных условно с 1% OsO4 и уранила ацетат 1%, в то время как арабидопсис корень на рисунке 1B только слабо металлизированная с помощью уранила ацетата 0,5%. Последний образец типа лучше всего подходит для корреляционного подходов, как некоторых тяжелых металлов, как правило, утолить флуоресценции. С держателем выделенный субстрата (рис. 2), массивы из нескольких сотен разделов могут быть произведены (рис. 1 c). После люминесцентные маркировки, такие массивы отражаться в стандартной FLM поля (рис. 1 d), то окрашенные растворами хэви-метал и отражаться в SEM в разных разрешениях (GРисунок 1E–).
Важными инструментами для воспроизводимых поколения массивов, особенно при размещении нескольких лент из лодки ножа микротома на подложке, являются субстрат держателя (рис. 2A, специально разработанных в лаборатории авторов) и Jumbo алмазов нож с лодки достаточно большим, чтобы вместить Микроскоп слайды (Рисунок 2Б). Плоский мениска, позволяя хорошее замечание ленты, является необходимым и может быть достигнуто путем плазменная очистка субстрата: мелких капель дистиллированной воды следует не образуют структуру объектив как на подложке, как показано на рисунке 2 c (необработанных субстрата), но тонкой пленки (Рисунок 2D, субстрат плазменной активации). В этих условиях ленточек сухой части Ито покрытием coverslip являются легко визуализировать (Рисунок 2E) и могут быть замечен и контролируется во время подъема из субстрата из воды.
Например массивы, окрашенных с пропидий йодидом маркировать стены клетки растений были образы с стандартной широкое поле FLM (рис. 3A). Поскольку разделы являются лишь 100 Нм, толстые, даже чрезмерно окрашивание, как показано здесь вводит немного размытия. После регистрации, были отобраны две клетки, полностью заключен в том реконструированный из стека изображений (рис. 3B) с высоким разрешением изображений в 3D (см. также Дополнительные фильм S1). После дополнительных окрашивание с уранила ацетат и свинца цитрат, массивы были образы в SEM. Рисунок 3 C показывает обзор, записанный с 60 пикселей изображения Нм; темный квадрат в центре изображения указывает на позицию, где были казнены функции автофокусировки, и дополнительные дозы привело к незначительное загрязнение. Соответствующие ROIs в этих последовательных секций (ломтики 51 до 248 435 ломтики в общей сложности) содержащий два целевых ячеек, выбранных в стеке FLM были затем записаны с 5 размер пикселя изображения Нм (3D рисунок; см. также Дополнительные фильм S2).
Автоматизированный иерархических изображений массивов в SEM, описанные здесь было сделано с программно аппаратные платформы решения ZEISS Атлас 5. Во-первых, обзор всего массива был создан с использованием SE детектор, с очень большой (1000 Нм) изображения пикселов и очень низкая продолжительность (рис. 4A). Руа, изложением только ткани был сделан на первой секции и распространяются на всех остальных разделов массива. Затем этот раздел набор был записан с 60 пикселей изображения Нм, используя более длительное время жить (Рисунок 4B). Наконец, набор сайт, содержащий две целевые клетки плюс один «слой» окружающих клеток для учета стадии неточность, был создан со следующими параметрами: ESB (селективный обратное рассеяние энергии) детектор, 5 Нм изображения останавливаться пикселей, очень долго (40 МКС) время ( Рисунок 4 c). Увеличение такого изображения показывает субцеллюлярные детали (рис. 4 d) вакуоли (V), митохондрии (M), ядро (N) и эндоплазматического ретикулума (стрелки). Смотрите также Дополнительные фильм S3 для масштабирования обзор всего массива субцеллюлярные деталей одной целевой ячейки.
Массив, показанный здесь (200 секции) плюс дополнительные, которую один из 250 разделов занимает около 8 ч производить, одну ночь пятно для LM и один день для записи (вручную) на FLM. После окрашивания занимает около 1-2 ч в общей сложности, в зависимости от количества отдельных массивов. Для записи SEM, через несколько часов необходимо установить до запуска Атлас, и автоматизированных запись была 3-4 ч для промежуточных резолюции (размер пикселя 60 Нм) Секция набора (450 x 200 µm2, 200 секций) и примерно в 5 дней для высокого разрешения (размер пикселя 5 Нм) ROI содержит две целевые клетки (200 секций, 55 x 30 мкм2). Обратите внимание, что благодаря низким металлосодержанием пример, показанный здесь, очень медленный скорость сканирования должны были быть использованы для достижения хороший сигнал шум обнаружения, которая подразумевает (имеющихся в настоящее время детектор) продолжительность 40 МКС для высокого разрешения ROI.
Есть несколько шагов в процессе всего подвержены опасности: в идеале ленты должна быть более или менее прямые и помещены в правильном порядке (рис 5A). Однако часто производятся Бент (Рисунок 5B), изогнутые (рис. 5 d) или даже сломанной ленты. Это может привести, из-за неправильного обрезки (ведущий и края не параллельны), или неравномерно прикладной клей, но и от асимметричной или неравномерно проникли образца. Особенно трудным образцы содержащие компоненты мягкие и очень трудно. Последние компоненты могут быть трудно проникнуть как клеточной стенки корни растений, показанный здесь (рис. 5 c). В этом случае складки (стрелок) может легко быть вызвано переменной сжатие и отдыха при резании. Для автоматической обработки изображений в SEM, изогнутой ленты не являются большой проблемой, поскольку трансформирования может поворачиваться для размещения кривизны ленты.
Еще один важный шаг в протоколе окрашивание: неадекватные Стиральная может привести к остатков на секции (Рисунок 5E, F) и в худшем случае, охватывают области наиболее интересные (круг на один из двух целевых ячеек в рисунке 5F). Кроме того, пыли (рис. 5 d, сильно светорассеивающих частицы) введена в лодке нож, например, с грязной субстрата перевозчика, может вызвать серьезные проблемы: В FLM, пыль может быть весьма флуоресцентные (см. Некоторые фрагменты в Дополнительные фильм S1) до такой степени, что некоторые алгоритмы регистрации не работают. Однако, функцию «Выровнять» в TrakEM17 может обрабатывать такие стеки, как показано в Дополнительные фильм S1.
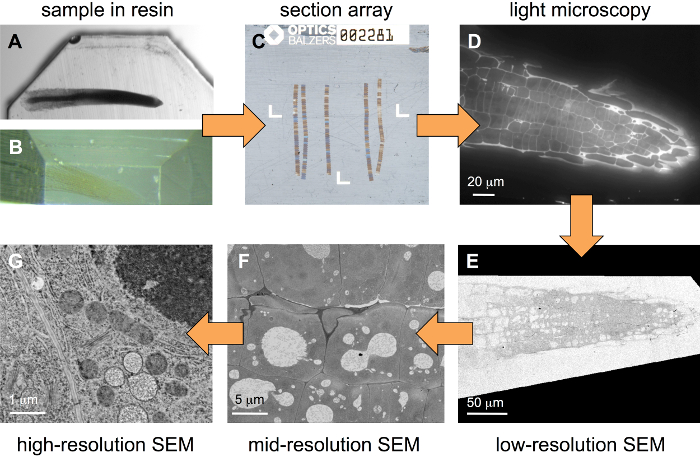
Рисунок 1: рабочий процесс для корреляционного иерархических изображений. Начиная от образца встроенных в блоке смолы (A, сильно металлизированной образца), образец первой обрезанных (B, слабо металлизированной образца) и затем массивов, состоящий из нескольких лент последовательных секций (C), здесь размещены на Ито покрытием coverslip, производится с помощью ultramicrotome. После окрашивания с флуоресцентной краской, стеки изображений записываются в FLM поля (D). После того, как дальнейшее окрашивание раундов с метал солей, стеки отражаются в SEM (GE–) в различных разрешениях (размеры пикселей изображения). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 2: инструменты для подготовки массивов. Субстрат держатель собранный из микроманипуляторов семь оси движения прилагается к стандартным ultramicrotome (A): винты, выделены с кругами, являются вертикальные (1) и горизонтальные (2) движения и наклона (3) субстрат перевозчика . Джамбо Алмазный нож с негабаритных лодка для размещения больших поверхностей (стрелка), здесь с куском плазмы активированный кремниевой пластины крепления на слайд размера алюминиевый перевозчика (B). 20 мкл капель дистиллированной воды размещены на необработанных кремниевой подложки пластин (C) или на подложке плазмы активированный (D). Четыре ленты, плавающие в лодке, нож, прикреплены к coverslip Ито покрытием их нижние концы. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
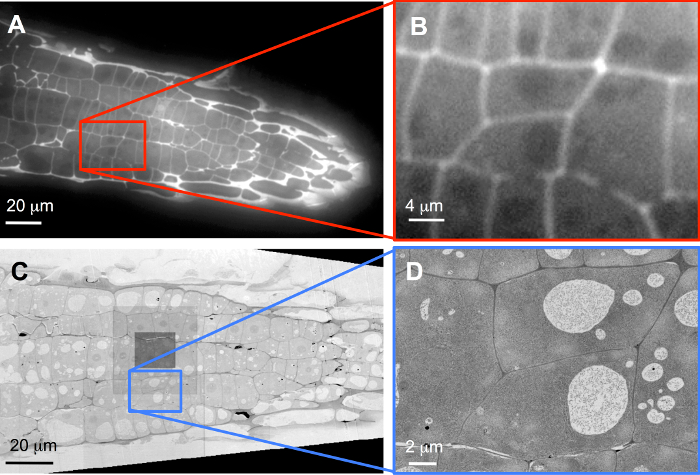
Рисунок 3: корреляция LM данных с данными SEM. Обзоры (A, C) и клеток-мишеней (B, D), записанный с FLM (A, B) и SEM (C, D). (B) это программное обеспечение зум, и исходные данные были записаны с 40 X объектив на чип камеры 1,388 x 1040 пикселей, в то время как (C) записывается с 60 Нм размер пикселя изображения и (D) с 5 размер пикселя изображения Нм, иллюстрирующие истинный увеличение резолюции в SEM. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 4: иерархических изображений в SEM, используя ZEISS 5 Атлас у. Обзор массива записал с 1000 пикселей изображения Нм, используя SE детектор (A). Раздел устанавливает с ROI на ткани в каждом разделе и записал с пикселей изображения 60 Нм (B). Сайта устанавливает с последовательным ROI на клетки-мишени и записал с 5 пикселей изображения Нм (C). При масштабировании в такие изображения с высоким разрешением (D), внутриклеточные мембраны отсеков вакуолей (V), ядро (N), митохондрии (M) и эндоплазматического ретикулума (стрелки) становятся видимыми. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
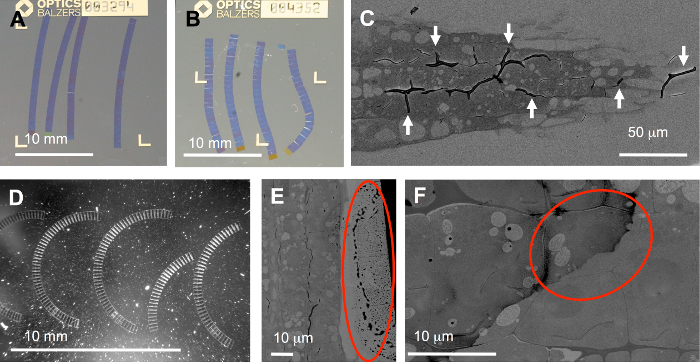
Рисунок 5: типичные проблемы. 1. вытекающие из процесса резания: ленты, на Ито покрытием coverslips являются идеально прямой (A), но нерегулярно сжатия при резании может вызвать Бент (B) или изогнутой ленты (D) или даже складки (C). 2. вызванные обработка субстрата и ленты в воде, например, при резании и окрашивание: рассеяния частиц на подложке (D) света, ОПРАВА капельки на секции (круг в E), или грязь смазывается вне над ткани из-за неадекватной Мойка после окрашивания (F). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Дополнительные фильм S1: стек изображений FLM. 435 изображения выравниваются в Фиджи16 с помощью TrakEM17 и сохраняется как файл фильма (.avi). Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительные фильм S2: стек изображений SEM. 210 изображения выравниваются в Фиджи16 с помощью TrakEM17. Исходный стек (300 изображений) этого набора данных был 15 ГБ. Чтобы сократить в стеке от 3,3 ГБ (после выравнивания и обрезка с только две целевые клетки), он был масштабируется в x и y на коэффициент 0,2 с помощью Фиджи и затем сохраняется как .avi фильм. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительные фильм S3: масштабирование с помощью уровнях различные резолюции в SEM. Фильм создан в и экспортированных из Atlas 5 программного обеспечения в формате .mp4. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Был продемонстрирован рабочий процесс для ориентации конкретных ячеек в пределах ткани по мультимодальной иерархических AT: смола встроенный образец нарезанный в массивы последовательных секций, которые размещаются на токопроводящих субстрата, используя специально разработанный субстрат держателя. После маркировки с Флюорофор и визуализации в FLM, восстановленный том используется для выбора целевых ячеек. После дополнительных пятнать раундов с тяжелыми металлами, ввести контраст, эти цели отражаются на несколько сотен разделов на наноуровне резолюции в SEM, используя платформу автоматизированного программного обеспечения.
Для производства плотно упакованных массивов с несколькими длинные ленты, необходим держатель субстрата, похож на описанный здесь. Квалифицированных и терпеливый человек может быть возможность прикрепить несколько лент на кремниевой подложке, частично погруженные в лодке, нож и получить массив, постепенно понижая уровень воды до тех пор, пока ленты, сидя на подложке. Однако, на наш опыт, существует тенденция разрушить формирования касатьясь субстрат любую часть лодки нож (см. Примечание в 1.3.2 в протоколе). Кроме того, эта процедура является гораздо более сложным с покрытием ITO подложки: (1) благодаря прозрачности стекла ITO, трудно увидеть край воды, где концы ленты должны быть прикреплены; и (2) потому что Ито покрытием поверхности гораздо грубее, чем высоко полированного кремниевой пластины, ленты, как правило, перерыв во время подъема и более мелкие фрагменты, состоящий из нескольких секций может плавать, таким образом разрушая порядка разделов.
Весь рабочий процесс также возможна без корреляции FLM данных. В этом случае сбор данных в SEM может потребоваться выполнить в нескольких сеансах. Первоначальный 3D-реконструкции или по крайней мере оценки данных с низким или средним разрешением может быть необходимо определить цели. Кроме того могут применяться обычные гистологические пятна для brightfield LM (не требующих FLM). Конечно другие варианты6,7,8 , антитела маркировки на массивах, как уже показали в первоначальный документ на18, или генетически закодированный флуоресцентных белков (XFP) или предварительно внедрение маркировки с сохранением флуоресценции во время подготовки проб.
Общее ограничение обсуждались метода является использование секций определенной толщины и результате дискретных выборки 3D-объем: резолюции в Z может быть только так хорошо, как толщина секций с SEM собирает только данные из раздела поверхности (d epending на выбранных энергии первичной энергии и посадки). Это означает, что результирующая 3D-объем анизотропной вокселей, например., 5 x 5 x 100 Нм3 если 100 Нм секций и размер пикселя изображения 5 Нм используются. Для очень малых и средних предприятий в диапазоне размеров ниже 1 мкм это не может быть достаточно для истинной ультраструктурных описание. Более техническим ограничением является точность этапа используется в SEM для автоматической обработки изображений. Благодаря этому необходимо выбрать ROI, больше, чем спецификации точности этап гарантировать, что образ полной целевой области.
По сравнению с SBF-SEM и FIB-SEM методы визуализации блок лицо, корреляционного AT имеет окончательное недостаток анизотропной вокселей, как описано выше. С FIB-SEM изотропным вокселей 5 x 5 x 5 Нм3 могут быть получены при коррекции надлежащего дрейф в месте.
Пробелы в реконструированных объем из-за потери разделов при подготовке массивов может быть озабоченность тем, что не встречается с SBF-SEM или FIB-SEM. С хорошим ленты стабилизации клеем, обычно это только проблема для последнего раздела ленты: он может быть поврежден при освобождении его от ножа, используя ресниц. Однако по нашему опыту, потеря одной секции в каждом разделы 20 – 50 не влияет регистрации изображения.
С другой стороны возможность после пятно массивов дает хороший сигнал и контрастность для SEM изображений, даже на слабо металлизированной образцы таких высокого давления замороженных корень советы, показанный здесь. Таким образом нет необходимости идти на компромисс оптимального ультраструктурных сохранения многочисленных химических фиксации и металлизации шаги. Кроме того обычные образцы из лаборатории патологии с промежуточной степени металлизации доставить10отличные данные. После внедрения контрастным усилением возможна не для SBF-SEM и FIB-SEM в целом. Кроме того, так как эти методы являются разрушительными, т.е., потребляя образца во время визуализации, иерархические изображений в различных резолюциях и сайты или повторяющихся изображений на более поздних этапах в времени невозможно. В принципе неограниченное количество томов, состоящий из большого FOVs (например, до нескольких миллиметров для всего мыши мозги в connectomics) созданный шить мозаики, и огромное количество секций может быть приобретена в то время как в FIB-SEM, FOVs за пределами 100 мкм x 100 мкм довольно трудно достичь с помощью обычных инструментов.
Дальнейшая автоматизация описанных AT-рабочего процесса будет определенное преимущество, поскольку вышеупомянутые методы SBF-SEM и FIB-SEM выполняют секционирование и изображений в пределах того же инструмента в полностью автоматическом режиме. Существует один вид автоматизации резании: ATUMtome12 может создавать и собирать тысячи секций, но использование Kapton ленты как субстрат делает такие массивы трудно изображение в FLM. На coverslips Ито покрытием, используемый здесь даже супер-резолюции изображений должно быть возможным. Кроме того, весьма желательно мишенью для автоматизации будет запись FLM стеков данных. С другой стороны, автоматизации может быть дорогим и за исключением держателя субстрата, рабочего процесса, представленные здесь зависит (с точки зрения оборудования) только приборы обычно доступны в обычной EM лаборатории ядро учреждении или, что делает его низкой уровень доступа.
Раскрытие информации
KIT получил возмещение по Boeckeler инструментов для поставки функциональной модели держателя субстрата. Марлен Талер является сотрудником ZEISS микроскопии GmbH, производителя систем Микроскоп, упоминалось в этой статье. Кроме того ZEISS предлагает определенные решения, такие как пакеты решений ZEISS Атлас для широкого спектра применений в большой площади, 3D визуализация для SEM и FIB-SEM инструментов. Все другие авторы имеют ничего не разглашать.
Благодарности
Эта работа была поддержана Грант FKZ 13GW0044 от немецкого федерального министерства для образования и научных исследований, проект MorphiQuant-3D. Мы благодарим Каролин Бартельс за технической поддержкой.
Материалы
| Name | Company | Catalog Number | Comments |
| Instrumentation | |||
| Ultramicrotome | RMC | PT-PC | Alternative: Leica UC7 |
| Substrate holder | RMC | ASH-100 | Alternative: home built |
| Plasma cleaner | Diener | Zepto 40kHz | Alternatives: Ted Pella Pelco or other benchtop plasma cleaner Example Parameters for Diener Zepto with 40kHz generator (0-100W); 0.5 mbar, 5 sccm (Air), 10% performance |
| Widefield fluorescence light microscope | Zeiss | Axio Observer.Z1 | Alternatives: Leica, Nikon, Olympus |
| Fluorescence filter set | Zeiss | 43 HE (Cy3/DsRed) | |
| Objective lens | Zeiss | Zeiss Neofluar 40x | 0.75 NA |
| Decent workstation able to handle GB-sized image data | |||
| FESEM | Zeiss | Ultra 55 | Alternatives: FEI, Jeol, Hitachi, TESCAN |
| Name | Company | Catalog Number | Comments |
| Sectioning | |||
| Razor blades | Plano | T585-V | |
| Diamond knife for trimming 45° | Diatome | DTB45 | |
| Diamond knife for trimming 90° | Diatome | DTB90 | |
| Jumbo diamond knife for sectioning | Diatome | DUJ3530 | |
| Silicon wafer (pieces) | Si-Mat | Custom Made | Doping: P/Bor, orientation: <100>, thickness: 525 ± 25 µm, resistivity: 1-30 Ω-cm http://si-mat.com/silicon-wafers.html |
| ITO-coated coverslips | Balzers | Type Z | 22 × 22 × 0.17 mm https://www.opticsbalzers.com/de/produkte/deckglas-fenster/corrslide.html |
| Aluminium carrier | Custom Made | 76 × 26 mm | |
| Wafer forceps | Ideal-tek | 34A.SA | |
| Stubs forceps | Dumont | 0103-2E1/2-PO-1 | Dumoxel-H 2E 1/2 |
| Diamond scriber | Plano | T5448 | |
| Eyelash/very soft cat's hair | Selfmade | Alternative: Plano | |
| Brush | Selfmade | ||
| Pattex contact adhesive | Pattex | PCL3C | Kraftkleber Classic (the yellowish one) |
| Fixogum | Marabu | 290110001 | for fixing substrate to carrier |
| Adhesive tape | 3M | 851 | for fixing substrate to carrier |
| Isopropanol | Bernd Kraft | 07029.4000 | |
| Xylene | Carl Roth | 4436 | thinner for glue mixture |
| Rotihistol | Carl Roth | 6640 | alternative, limonene based thinner |
| Name | Company | Catalog Number | Comments |
| Software | |||
| Image processing | Open source | Fiji (http://fiji.sc/#download) | |
| Image acquisition | Zeiss | Atlas 5 AT (module for Zeiss SEM) | Alternative for automated image acquisition: WaferMapper: https://software.rc.fas.harvard.edu/lichtman/LGN/WaferMapper.html |
| Name | Company | Catalog Number | Comments |
| Staining | |||
| Propidiumiodide | Sigma-Aldrich | P4170 | Stock solution: 1.5 mM in 0.1 % sodium azide |
| Uranylacetate | Science Services | E22400 | |
| Lead(II) Nitrate | Merck | 107398 | |
| Tri Sodium Citrate Dihydrate | Merck | 106448 | |
| NaOH pellets | Merck | 106469 | |
| 1M NaOH solution | Bernd Kraft | 01030.3000 | |
| Glass petri dish | Duran | 23 755 56 | |
| Name | Company | Catalog Number | Comments |
| Mounting | |||
| Stubs | Plano | G301F | |
| Carbon pads | Plano | G3347 | |
| Copper tape | Plano | G3397 | double-sided adhesive, conductive |
| Silver paint | Plano | G3692 | Acheson Elektrodag 1415M |
| Name | Company | Catalog Number | Comments |
| Solutions/mixtures | |||
| Adhesive mixture for coating blocks | Pattex contact adhesive /xylene as thinner, ratio 1:3. (Alternative for xylene: Rotihistol) | ||
| Reynolds lead citrate | 50 mL: Dissolve 1.33 g of lead(II) nitrate in 10 mL of dH2O. Dissolve 1.76 g of tri-sodium citrate dihydrate in 10 ml dH2O. Mix both and add 1 M sodium hydroxide until the solution is clear. Fill up with dH2O to 50 mL. | ||
| Propidium iodide staining solution | Prepare 1:1500 dilution from stock in dH2O. Vortex for adequate mixing. | ||
| Aqueous uranyl acetate | Dissolve 3 % uranyl acetate in dH2O (mix thoroughly). |
Ссылки
- Peddie, C. J., Collinson, L. M. Exploring the third dimension: Volume electron microscopy comes of age. Micron. 61, 9-19 (2014).
- Wanner, A. A., Kirschmann, M. A., Genoud, C. Challenges of microtome-based serial block-face scanning electron microscopy in neuroscience. J Microsc. 259 (2), 137-142 (2015).
- Kizilyaprak, C., Daraspe, J., Humbel, B. Focused ion beam scanning electron microscopy in biology. J Microsc. 254 (3), 109-114 (2014).
- Wacker, I., Schröder, R. R. Array tomography. J Microsc. 252 (2), 93-99 (2013).
- Tapia, J. C., Kasthuri, N., Hayworth, K. J., Schalek, R., Lichtman, J. W., Smith, S. J., Buchanan, J. High-contrast en bloc staining of neuronal tissue for field emission scanning electron microscopy. Nat protoc. 7 (2), 193-206 (2012).
- Lucas, M. S., Günthert, M., Gasser, P., Lucas, F., Wepf, R. Bridging Microscopes: 3D Correlative Light and Scanning Electron Microscopy of Complex Biological Structures. Methods Cell Biol. 111, 325-356 (2012).
- De Boer, P., Hoogenboom, J. P., Giepmans, B. N. Correlated light and electron microscopy: ultrasructure lights up!. Nat Methods. 12 (6), 503-513 (2015).
- Verkade, P., Müller-Reichert, T. . Methods in Cell Biology Correlative Light and Electron Microscopy III. 140, 1-352 (2017).
- Gibson, K. H., Vorkel, D., Meissner, J., Verbavatz, J. -. M. Fluorescing the Electron: Strategies in Correlative Experimental Design. Methods Cell Biol. 124, 23-54 (2014).
- Wacker, I., Schröder, R. R., Schroeder, J. A. Pathology goes 3D: Exploring the potential of array tomography versus FIB nanotomography for a CADASIL sample. Ultrastruct Pathol. 41 (1), 114-115 (2017).
- Wacker, I., Spomer, W., Hofmann, A., Thaler, M., Hillmer, S., Gengenbach, U., Schröder, R. R. Hierarchical imaging: a new concept for targeted imaging of large volumes from cells to tissues. BMC Cell Biol. 17 (1), 38 (2016).
- Hayworth, K. J., Morgan, J. L., Schalek, R., Berger, D. R., Hildebrand, D. G. C., Lichtman, J. W. Imaging ATUM ultrathin section libraries with WaferMapper: a multi-scale approach to EM reconstruction of neural circuits. Front Neural Circuits. 8, (2014).
- Micheva, K. D., O'Rourke, N., Busse, B., Smith, S. J. Array Tomography: Production of Arrays. Cold Spring Harb Protoc. 11, 1267-1269 (2010).
- Fahrenbach, W. H. Continuous serial thin sectioning for electron microscopy. J. Elec. Microsc. Tech. 1 (4), 387-398 (1984).
- Harris, K. M., et al. Uniform serial sectioning for transmission electron microscopy. J Neurosci. 26 (47), 12101-12103 (2006).
- Schindelin, J., Arganda-Carreras, I., Frise, E., Kaynig, V., Longair, M., Pietzsch, T., Preibisch, S., Rueden, C., Saalfeld, S., Schmid, B., Tinevez, J. -. Y., White, D. J., Hartenstein, V., Eliceiri, K., Tomancak, P., Cardona, A. Fiji: an open-source platform for biological-image analysis. Nat Methods. 9 (7), 676-682 (2012).
- Cardona, A., Saalfeld, S., Schindelin, J., Arganda-Carreras, I., Preibisch, S., Longair, M., Tomancak, P., Hartenstein, V., Douglas, R. J. TrakEM2 software for neural circuit reconstruction. PLoS ONE. 7 (6), e38011 (2012).
- Micheva, K. D., Smith, S. J. Array Tomography: A new tool for imaging the molecular architecture and ultrastructure of neural circuits. Neuron. 55 (1), 25-36 (2007).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены