Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Репликация Ordered, неизбыточной библиотека штамма PA14 Transposon вставки мутантов синегнойной палочки
* Эти авторы внесли равный вклад
В этой статье
Резюме
Pseudomonas aeruginosa инфекция вызывает значительные заболеваемости в уязвимых хостов. Неизбыточной transposon вставки мутант библиотека штамм P. aeruginosa PA14, как PA14NR набор, облегчает анализ гена функциональность в многочисленных процессах. Представленные здесь — это протокол для создания высококачественных копий PA14NR набор мутант библиотеки.
Аннотация
Pseudomonas aeruginosa является фенотипически genotypically разнообразной и гибкой грамотрицательные бактерии, повсеместно в окружающей среде. P. aeruginosa способен формировать биоплёнки, развивать устойчивость к антибиотикам, производят Факторы вирулентности и быстро развиваться в течение хронической инфекции. Таким образом P. aeruginosa может вызвать как острый и хронический, трудных для лечения инфекций, что приводит к значительным заболеваемости в некоторых популяциях пациентов. Штамм P. aeruginosa PA14 — изолированный человека клинических с сохранение генома структурой, которая поражает разнообразием млекопитающих и nonvertebrate узлов, делая PA14 штамма привлекательным для изучения этого патогена. В 2006 году был создан неизбыточной transposon вставки мутант библиотеки, содержащей 5459 мутантов, соответствующий 4596 предсказал PA14 генов. С тех пор распространение PA14 библиотеки позволила исследовательского сообщества лучше понять функции отдельных генов и сложные пути P. aeruginosa. Поддержание целостности библиотеки через процесс репликации требует надлежащей обработке и точных методов. С этой целью эта рукопись представлены протоколы, которые подробно шаги, участвует в репликации Библиотека, Библиотека контроля качества и надлежащего хранения отдельных мутантов.
Введение
Pseudomonas aeruginosa является фенотипически genotypically разнообразной и гибкой грамотрицательных бактерий, присутствующих в почве, воде и большинство человеческих средах, а также микрофлоры кожи. По сравнению с многих видов бактериальных, P. aeruginosa имеет сравнительно большой геном 5.5-7 Mbp с высоким G + C контента (65-67%). Кроме того значительную долю своих генов участвуют в метаболических адаптируемость и являются частью регулирования сети, что позволяет большую гибкость в ответ на экологического стресса1. P. aeruginosa выражает множество факторов вирулентности, проявляет склонность к форме биопленки, обладает способностью координировать ответы через несколько кворум зондирования пути и отображает заметный способность вырабатывать устойчивость к антибиотикам и терпимости2,3,4,5,6,,78. Эти атрибуты представляют серьезные проблемы для лечения инфекций, вызванных P. aeruginosa.
Хронический P. aeruginosa инфекции может произойти в многочисленных положениях заболеванием. Кистозный фиброз (CF), генетическое заболевание, вызванное мутаций гена Муковисцидоза регулятор трансмембранной проводимости (МВТР) , приводит к inspissated, инфицированных выделениями в дыхательные пути, прогрессивное расширение бронхов и, в конечном счете, смерть от9дыхательной недостаточности. В зрелом возрасте большинство пациентов с CF хронически инфицированы P. aeruginosa, который играет ключевую роль в заболеваемости и смертности, связанных с этой болезнью10. Кроме того у больных с тяжелой сжечь травм11, tracheostomies12, совместные замены13или пребывает катетеры14 подвергаются риску инфекции P. aeruginosa , связанные с способность бактерий в форме биоплёнки побег принимающей воспалительных реакций и15. Кроме того колонизация происходит без конкуренции после многолетних антибиотикам или терпимая(ый) населения выбирается путем широкого спектра, последовательные антимикробного лечения12,16,17 , 18. лучшее понимание патогенеза P. aeruginosa будет иметь значительные последствия для многих государств болезни.
Несколько клинических изолятов P. aeruginosa , включая штаммы, PAO1, PA103, PA14 и Пак, были широко изучены расследовать различные особенности патогенеза P. aeruginosa . Штамм PA14 является клинической изолировать, который принадлежит к одной из наиболее распространенных во всем мире19,клоновых группы20 и не были широко пассированной в лаборатории. Высоко вирулентным в позвоночных модели инфекции, с заметным эндотоксинов PA14is профиль21, пили структуры22, патогенности острова23, тип III секреторной системы (TTSS), цитотоксичность на млекопитающих клетки24 и профили в антибиотикам сопротивление и сохранение25. Кроме того, PA14 также высоко вирулентным в многочисленных системах модель хост патогена, включая завод лист инфильтрации модели26,27,Caenorhabditis elegans инфекции моделей28, 29, насекомое модели3130,, а также мыши пневмонии моделей32,33 и ожог кожи модели34.
Геном всей мутант библиотеки являются коллекции isogenic мутантов в несущественные генов, которые представляют собой очень мощные инструменты, чтобы понять биологии организма, позволяя анализ функции гена в геномной масштабе. Две transposon вблизи насыщения вставки мутант библиотеки построено в P. aeruginosa в настоящее время доступны для распространения. Вставки сайты транспозонов были определены для обеих библиотек. Эти так называемые неизбыточной библиотеки облегчения исследования генома общесистемной бактериальных штаммов, значительно уменьшив время и затраты в uncharacterized скрининга мутантов случайных transposon. P. aeruginosa PAO1 transposon мутант Библиотека, построенный в MPAO1 изолировать штамм PAO1 с помощью транспозонов ISphoA/ Ба иlacZ/ ха35, куратор Манойл лаборатории, Университет Вашингтона. Библиотека состоит из последовательности проверить коллекцию 9,437 transposon мутантов, обеспечивает генома широкий охват и включает в себя два мутантов для большинства генов36. Информация о библиотеке мутантов transposon P. aeruginosa PAO1 доступна на сайте Лаборатории Манойл общественности, доступной через Интернет на http://www.gs.washington.edu/labs/manoil/libraryindex.htm. P. aeruginosa штамм PA14 неизбыточной transposon вставки мутант библиотека (значение PA14NR) построена в штамм PA14 с использованием MAR2xT7 и Tn транспозоновphoA37 распространяется в настоящее время кафедра педиатрии в массачусетской больницы. Набор PA14NR включает в себя коллекцию из более чем 5800 мутантов с одной transposon вставок в несущественные генов37. Сведения о строительстве комплекса PA14NR описаны в общественности, доступной через Интернет сайт http://pa14.mgh.harvard.edu/cgi-bin/pa14/home.cgi?section=NR_LIB, который также содержит целый ряд онлайн поиск инструментов для облегчения использования PA14NR Набор.
Оригинальный набор PA14NR включает 5459 мутантов, выбранных из всеобъемлющей библиотеки около 34000 мутантов вставки случайных transposon, которые соответствуют 4596 предсказал PA14 генов, представляющие 77% всех предсказал PA14 генов37. Поскольку строительство библиотеки в 2006 году были добавлены новые мутанты, и в настоящее время набор PA14NR включает в себя более чем 5800 мутантов38 , которые представляют около 4600 PA14 генов. Большинство transposon мутантов PA14 были созданы в дикого типа фона37. Подробности, касающиеся каждого члена мутант библиотеки, включая генетический фон, доступны через поиск онлайн базы данных, либо загрузив таблицу неизбыточной Библиотека, обе функции, доступные на веб-сайте PA14 (http:// pa14.MGH.Harvard.edu/CGI-BIN/pa14/Home.CGI). Большинство из мутантов были созданы с помощью MAR2xT7 transposon (MrT7), с небольшим набором, созданные с помощью transposon TnPhoA (phoA)37. Каждый transposon имеет антибиотикорезистентности кассету, которая позволяет для мутантов выделение с помощью гентамицин (MrT7) или канамицин (phoA). PA14NR набор мутантов хранится в шестьдесят три 96-луночных пластины и включает в себя два дополнительных управления 96-луночных пластины, которые состоят из дикого PA14 привиты и uninoculated скважин интеркалированного в подготовленного узора. Формат 96-луночных пластины, в паре с онлайн поиск инструментов значительно облегчает пользовательских развития скрининговых анализов, которые позволяют пользователям легко идентифицировать гены, связанные с мутант фенотипов. Онлайн Поиск инструменты также облегчают поиск и отбор дополнительных соответствующих мутантов, необходимых для дальнейших исследований.
PA14 и PAO1 transposon мутант библиотеки являются очень важные глобальные ресурсы для научного сообщества, и они дополняют друг друга в проверке функции неизвестных генов и пути этого бактериальных патогенов. Кстати поскольку строительство библиотеки PAO1 и PA14 transposon мутации, полный геном анализ последовательности ДНК многих P. aeruginosa изолятов показал, что PAO1 и PA14 принадлежат к различным основным субкладов P. aeruginosa филогении7,,3940,41. Потому что клинических P. aeruginosa изолирует находятся распределены по всему филогения, тот факт, что PAO1 и PA14 принадлежат к различным P. aeruginosa подгруппы повышает значение двух transposon мутации библиотек для сравнительных исследования.
Публикаций, описание конструкции и скрининг бактериального мутант библиотек, включая, P. aeruginosa библиотек3537,42, легко доступны в литературе. Однако в меру наших знаний, не опубликованные протоколы, описывая подробные процедуры и методы, используемые для репликации, техническое обслуживание и проверки бактериальных мутант библиотек доступны.
Методологии, изложенной в настоящем издании описывает набор из трех протоколов, которые облегчают использование и обслуживание комплекса PA14NR. Первый протокол описывает репликации библиотеки, как рекомендовано получателям набора PA14NR. Второй протокол включает руководящие принципы для полос, выращивания и хранения отдельных мутантов, определены с использованием набора PA14NR. Третий протокол описывает методы контроля качества, включая ПЦР-амплификация фрагментов из transposon мутантов и последующего последовательности для подтверждения личности мутантов. Этот набор протоколов также может быть адаптирована для репликации и поддержание других бактериальная мутант библиотек или коллекций. Репликацию бактериальных мутант библиотек или коллекции настоятельно рекомендуется сохранить целостность «оригинал» (оригинал получил). Репликация нескольких копий набор PA14NR для использования обычной лаборатории минимизирует вероятность загрязнения осреднения мастер-копии.
протокол
Предупреждение: Использовать стандартные меры безопасности BSL-2 при обработке P. aeruginosa, человеческий патоген. Если вы человек с ослабленным иммунитетом или медицинское состояние, что увеличивает ваши восприимчивости к бактериальной инфекции, принимайте особую осторожность при работе с P. aeruginosa. Проконсультироваться с Управлением по биобезопасности в вашем учреждении и получить одобрение от вашего врача перед началом работы с PA14 NR набор или мутант библиотек бактериальных патогенов.

Рисунок 1: Обзор протокола I: репликации PA14NR. День 1: Реплицировать замороженных мутант культур от «оригинал» комплекса PA14NR в СМИ LB агар и расти мутантов на ночь при 37 ° C. День 2: Передать глубокую хорошо блоков, содержащих LB жидкий бульон мутант роста от LB агар СМИ, растут на ночь при 37 ° C при встряхивании в 950 об/мин. День 3: Смешать ночи фунтов культур с глицерином, а затем передать 96-луночных назначения пластины для длительного хранения. Место 96-луночных плит квартиру в морозильник-80 ° С. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Рисунок 2: Рекомендуемые установки. Стерильность и плавный рабочий процесс следует сохранить с помощью надлежащих мер предосторожности. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
1. Протокол I: репликации PA14NR набор
Примечание: Репликации библиотеки может достигаться путем деления PA14NR, посреди четырех подмножеств шестнадцать плит каждый которые могут быть обработаны в четырех недель подряд. Поколение 1 до 6 копий придерживается загрузок рабочего процесса, изложенные в таблице 1, в то время как поколение более чем 6 копий следует за рабочего процесса, изложенные в таблице 2. Чтобы создать 12 копии набора PA14NR, прививок же подмножество PA14NR в жидких сред фунтов на 2 день и снова на 3 день (из того же набора плиты агара, реплицируются на 1 день) и передачи на ночь мутантов культур в копию пластин на день 3 и 4 день соответственно.
| День 0 | 1 день | День 2 | День 3 |
| Подготовка день | Рост PA14NR набор мутантов на LB агар СМИ | Рост PA14NR набор мутантов в жидких средах LB | Передача PA14NR набор мутант культур назначения пластин |
Таблица 1: расписание репликации копии 1-6 PA14NR набор. Репликация небольшое количество копий могут придерживаться загрузок рабочего процесса.
| День 0 | 1 день | День 2 | День 3 | День 4 |
| Подготовка день | Рост PA14NR набор мутантов на агаре LB | Расти PA14NR набор мутантов в жидких средах LB | Передача день 3 Мутантный культур для создания 1-й сет 6 копий комплекса PA14NR | Передача 4 день мутантов культур для создания второй набор 6 копий комплекса PA14NR |
| Рост PA14NR набор мутантов в жидких средах LB |
Таблица 2: расписание репликации до 12 экземпляров набора PA14NR. Репликация большего числа копий потребует наслаивать в рабочем процессе загрузок.
- День 1: Рост PA14NR набор мастер-копия на плитах агара LB
- Надевайте перчатки, лабораторный халат и маска для обработки набора PA14NR.
- Очистить скамейке и протрите поверхность с 70% этиловом спирте.
- Подготовить LB агар СМИ43 и стерилизовать в автоклаве прохладно СМИ 25 мин до 55 ° C в воде ванны и добавить либо гентамицин 15 мкг/мл, для мутантов, содержащий MAR2xT7 transposon вставки, или 200 мкг/мл канамицин, мутанты, содержащих TnphoA вставки.
- Залейте расплавленный агар фунтов в прямоугольной пластины с помощью примерно 60 мл СМИ на пластину. Сухой плиты в стерильных капот для примерно за 1 ч до использования. Убедитесь, что есть нет конденсации воды на поверхности агара. Хранить пластины на 4 ° C, при необходимости.
- Создайте стерильные поле с помощью горелки Бунзена на этанол протереть стендовые и созданы контейнеры с соответствующие решения для репликации ПИН стерилизации (см. шаг 1.1.9). Используйте открытые пластиковые контейнеры (5,25" L x 4,25 «W x 1,75 «приблизительный размер H) для стерилизации репликатор PIN-код. Автоклав пластиковые контейнеры перед использованием.
Примечание: Тепла пламени горелки Бунзена создает ток, конвекции, которая нагревает пространство над пламенем и поднимает любые частицы в воздухе и от прохладного воздуха под, сохраняя стерильные области работы. - Извлеките максимум четыре PA14NR набор клише из морозильной камеры-80 ° C (чтобы избежать ненужных оттаивания) и разместить их на сухой лед в 4 Л льда Пан.
- Принять необходимые для стерилизации репликатор контактов (приблизительно 3-4 мин) (см. шаг 1.1.8) 96-луночных мастер пластины должны быть реплицированы с сухим льдом и поместить его на скамейке разрешить краткие оттаивания, который займет время. Отметьте положение координаты А1 на пластину агар до тиснения. Совместите Мастер и агар крышку с A1 координата обе пластины в левом верхнем углу.
- Стерилизуйте репликатору «контакты», выполните действия, описанные ниже. Слегка коснитесь репликатор после каждого шага, чтобы удалить лишнюю жидкость.
- Погружать булавки в 250 мл 0,3-0,5% гипохлорита натрия (10% бытовые отбеливающие средства) для 30 секунд. Свести к минимуму контакт с раствор гипохлорита натрия, как это может привести к повреждению контактов. Погружать булавки в 250 мл стерильного ddH2O или стерильной ультрачистая вода на 10 секунд, затем в 250 мл 70% этанол 30 секунд, а затем в 250 мл этанола 95% за 2 мин.
- Пламенем стерилизовать репликатор булавки Холдинг репликатор перпендикулярно к пламени горелки Бунзена, медленно приближается к пламени, пока этанол воспламеняется, а затем сразу же снимает его от пламени. Пламя погаснет после всех этанола ожоги от. Держите крышку или подобный контейнер рядом задушить Сжигание этанола, при необходимости.
Примечание: Используйте крайнюю осторожность при работе с этанолом вблизи пламени. НЕ держите replicator непосредственно над пламенем. - Прохладный булавки, закрепляя на неиспользованные стерильные прямоугольной пластины, содержащих агар LB СМИ за 30 секунд.
- Кратко теплых алюминиевых печать от PA14NR набор мастер пластины с рукой до пилинг покинуть. Это можно сделать во время охлаждения репликатор булавки. Удаление алюминий уплотнение тщательно, чтобы предотвратить печать от ретуши пластину. Использование пинцета слезает любые остатки алюминия печати.
- Вставьте репликатор штифта в главной пластины, осторожно нажав и размахивая репликатор во всех четырех направлениях для обеспечения того, чтобы контакты контакт с замороженных бактериальных культур в каждом из скважин-96. Обратите особое внимание на скважин, расположенных в внешнего края пластины, нажав репликатор булавки против замороженных культур в скважины, расположенной на краю пластины.
- Осторожно поместите репликатор булавки на поверхность плиты агара. Перемещение репликатор небольшие круговые движения в форме мини газоны примерно 4-5 мм для каждого мутантный штамм. Избегайте возможности того, что мини газоны могут перекрываться, чтобы избежать перекрестного загрязнения.
- Уплотнение PA14NR набор мастер пластины с новым уплотнением стерильные алюминия. Не прикасайтесь клейкой стороне алюминиевых печати в любой момент, чтобы избежать загрязнения. Убедитесь, что каждый хорошо и края плиты полностью опечатаны с помощью ролика плиты. Возвращение 96-луночных пластины для обработки сухим льдом.
- Повторите процедуру для каждой главной пластины.
- Протрите все рабочие поверхности с 70% этанола после обработки набора PA14NR.
- Передача реплицируются плиты агара для инкубатора 37 ° C и инкубировать на ночь.
- День 2: Рост PA14NR набор мастер-копия в жидкий бульон LB
- Подготовьте LB жидкий бульон43 содержащего гентамицин либо 15 мкг/мл, для мутантов, содержащий MAR2xT7 transposon вставки, или 200 мкг/мл канамицин, мутанты, содержащих TnphoA вставок.
- Очистить Ламинарный шкаф ненужного оборудования и включите вентилятор вытяжки минимум 10 минут перед началом работы. Протрите поверхности вытяжки и любые элементы, помещенные в вытяжку на 70% спирте.
- Залейте 2 мл штанхглубинных блоков 525 мкл LB жидкий бульон, содержащий соответствующие антибиотики в Ламинарный шкаф с использованием 50-1200 мкл 12-канальный электронных дозаторов. Затем передачи медиа заполнены штанхглубинных блоков для этанола протереть стендовые. Повторное использование советы, до тех пор, как стерильные условия сохраняются.
- Надевайте перчатки, лабораторный халат и маска для обработки PA14NR набор.
- Очистить скамейке и протрите поверхность с 70% этиловом спирте.
- Принесите Стендовые плиты агара с ночи выросли мутантных штаммов.
- Создайте стерильные поле с помощью горелки Бунзена на этанол протереть стендовые и созданы контейнеры с соответствующие решения для репликации ПИН стерилизации (см. следующий шаг).
- Стерилизуйте репликатор» контакты» действий, описанных ниже. Слегка коснитесь репликатор после каждого погружения, чтобы удалить лишнюю жидкость.
- Погружать булавки в 250 мл 0,3-0,5% гипохлорита натрия на 30 секунд. Минимуму репликатор ПИН контакт с раствор гипохлорита натрия, как это может привести к повреждению контактов. Затем погрузите булавки в 250 мл стерильного ddH2O или ультрачистая вода для 10 секунд, затем в 250 мл 70% этанола на 30 секунд, а затем в 250 мл этанола 95% за 2 мин.
- Пламя стерилизовать репликатор булавки, а затем прохладной булавки, закрепляя в неиспользуемые прямоугольной пластины, содержащих агар LB СМИ за 30 секунд.
Примечание: Используйте крайнюю осторожность при работе с этанолом вблизи огня (см. 1.1.8).
- Аккуратно место репликатор булавки на пластине агар, содержащие мутант роста и проверьте, что контакты соприкасаются все 96 мутантов на табличке, агар, а затем погружаться булавки в глубоких скважинах содержащих LB жидкий бульон. Не прикасайтесь к бокам скважин с контактами.
- Печать глубинно блок с стерильных дышащая мембрана герметизации. Используйте пластина ролика чтобы убедиться, что каждый хорошо должным образом опечатаны.
- Повторите процедуру для каждой плиты агара.
- Протрите все рабочие поверхности с 70% этанола после обработки набора PA14NR.
- Растут привитых жидких культур для 15-16 ч при 37° C на 950 об/мин, с использованием высокой скорости шейкер, если таковые имеются.
Примечание: Если шейкере высокая скорость не доступен, инкубации глубинно блоков в шейкер на 250-300 об/мин является осуществимым. Однако есть больше шансов небольшая колония варианты (КСМ)25 новых условиях низкой оксигенации. Таким образом это весьма желательно, чтобы держать инкубации раз под 15-16 h, при выращивании культур в глубоких скважин блоков на более низких скоростях шейкер. Нежелательного распространения КСМ в мутанта скважин может изменить мутант фенотипов, при использовании библиотеки для выполнения генетических экраны.
Некоторые скважины в наборе PA14NR содержат медленно растущих/не растущих мутантов, пропавших без вести клоны, или содержать uninoculated СМИ. Расположение этих скважин был записан и можно найти в файле дополнительная информация PA14NR набор скважин с этой публикацией.
- День 3: Передача PA14NR набор ночи культур в назначения пластин
- Очистить Ламинарный шкаф и включите вентилятор вытяжки минимум 10 минут перед началом работы. Протрите поверхности вытяжки и любые элементы, помещенные в вытяжку на 70% спирте.
- Печать этикетки водонепроницаемый (см. файл дополнительные PA14NR набор меток для шаблона). Удаление 96-луночных пластины из пластика обернуть внутри Ламинарный шкаф. Плиты пил офф этикетке и поместите его вдоль края пластины ближе к A1 до H1 скважин назначения плиты. Слегка поднимите крышку пластину назначения и поместите метку на нижней кромке для отображения метки, когда плита покрыта с крышкой.
- Подготовьте 3,5 Л 60% глицерина (v/v) и стерилизуют 20 мин в автоклаве.
- Надевайте перчатки, лабораторный халат и маска для обработки PA14NR набор. Удаление глубинно блоков с высокой скоростью шейкер или регулярные шейкер.
- Передачи блоков глубокой скважины в стерильных Ламинарный шкаф и тщательно удалить уплотнение дышащая мембрана. Замените с печатью алюминия. Спин вниз блоки глубокой скважины на очень низкой скорости для сбора конденсата (30 секунд на 50-150 x g, затем замедление quicky, имея центрифуги тормоз на).
- Передать штанхглубинных блоки обратно в стерильных капот и с использованием 50-1200 мкл 12-канальный электронных дозаторов и стерильного отфильтрованного советы мкл 525 глицерина/LB жидкость отвара смеси (равных частей LB жидкий бульон и 60% глицерола раствор) в каждой скважине. Смешайте нежно закупорить 300 мкл вверх и вниз 3 раза с электронных дозаторов. Коснуться советы в сторону скважины до извлечения советы для предотвращения капала. Извлечь советы и продолжать с следующей строки до тех пор, пока сделано с весь погруженный блок.
- С помощью 12-канальный электронных дозаторов повторяющихся и отфильтрованных советы, чтобы предотвратить осреднения загрязнения во время aliquoting, тянуть до 900 мкл мутант культуры и отказаться от 150 мкл в каждой пластины 96-луночных назначения для создания 6 копий библиотеки пластины. Предотвратить капает, касаясь стены скважин с советами перед началом передачи культуры в назначения пластин. Если не повторить пипетки, используйте многоканальные пипетки отказаться 150 мкл в каждой из шести 96-луночных пластин, используя метод, описанный выше для предотвращения капала.
- Используйте пломбы стерильные Алюминиевые накладки и использовать плиты ролик полностью уплотнение края пластины и все скважины. Убедитесь в том, чтобы не охватывать идентификатор метки с печатью алюминия. Не трясите пластины, как культура может всплеск на сторонах скважин или на алюминий уплотнение.
- Удалите запечатанный пластины из плиты капот и место на плоской поверхности в морозильной камере-80 ° C.
- Протрите все рабочие поверхности с 70% этанола после обработки в библиотеку.
- Выполнение проверок контроля качества, после репликации библиотека и после использования библиотеки для выполнения генетических экраны (см. Протокол III).
2. Протокол II: Обработка и хранение индивидуальных мутантов из набора PA14NR
-
День 1: Полоска мутант интереса
- Определить местоположение мутант интерес через http://pa14.mgh.harvard.edu/cgi-bin/pa14/search.cgi?searchType=SEARCH_PLATE_POSITIONS PA14NR задать ссылку или с помощью файла неизбыточной Library.xls загружен с http:// ссылка pa14.MGH.Harvard.edu/CGI-BIN/pa14/downloads.CGI). Запишите антибиотика, необходимо выбрать каждый особый мутант (гентамицин или канамицин).
- Подготовить LB агар СМИ, стерилизовать в автоклаве для 20-25 мин и охладите до 55 ° C в водяной бане. Добавьте 15 мкг/мл гентамицин для мутантов, содержащие MAR2xT7 transposon вставки и 200 мкг/мл канамицин для мутантов, содержащих TnphoA transposon вставки. Залейте LB агар СМИ на тарелках (круглые или прямоугольные пластины являются адекватными). Сухие пластины в стерильных капот для примерно 30 минут до 1 часа до использования.
- Автоклав все пластик и нестерильные поставок перед использованием.
- Надевайте перчатки, лабораторный халат и маска для обработки PA14NR набор. Очистить скамейке и протрите поверхность с 70% этанол перед началом работы с PA14NR установки.
- Создайте поле стерильные с помощью горелки Бунзена.
- Удалить набор PA14NR 96-луночных пластины с мутант интереса от-80 ° C морозильник и поместите его на сухой лед, Возьмите контейнер сухого льда на скамейке и кратко место 96-луночных пластину поверх скамейке позволяет легким размораживания (примерно 1-2 мин).
Примечание: Учет всех PA14NR набор пластин 96-луночных доступ к подряд отдельных мутантов, как более широкий доступ к библиотеке пластины связан с большим риском для осреднения загрязнения. - Теплые алюминиевые печать с рукой до пилинг покинуть, стараясь предотвратить печать от ретуши пластину. Использование пинцета слезает любые остатки алюминия печати.
- Найдите мутант интерес на 96-луночных пластины. Используйте стерильные деревянной палочкой или стерильной пипеткой подсказка выбрать небольшое количество замороженных культуры от лица, также содержащий мутант интерес.
- Полоса, замороженные культуры агара пластина для одного мутанта колоний следующим: нежно распространение бактерий через раздел пластины для создания полосы 1, используя свежий, стерильные деревянные палки или пипетки подсказка, перетащите через полосу 1 и распространение бактерий над второй раздел пластину, чтобы создать полосу 2. С помощью третьего стерильные деревянные палки или пипетки кончика, перетащите через полосу 2 и распространиться в последнем разделе пластину, чтобы создать полосу 3 бактерий.
- Печать источник пластины с новым уплотнением стерильные алюминия. Не прикасайтесь клейкой стороне алюминиевых печати в любой момент, чтобы избежать загрязнения. Убедитесь, что каждый хорошо и края плиты полностью опечатаны с помощью ролика плиты. Возвращение 96-луночных пластины для сухого льда, а затем-80 ° C морозильник.
- Инкубируйте плита агара в инкубаторе 37 ° C на ночь.
- Протрите все рабочие поверхности с 70% этанола после обработки в библиотеку.
-
День 2: Рост мутант интереса к LB жидкий бульон
- Приготовить жидкий LB бульон, содержащий 15 мкг/мл гентамицин или 200 мкг/мл канамицин, согласно transposon вставки.
- Надевайте перчатки, лабораторный халат и маска для обработки P. aeruginosa.
- Очистить скамейке и протрите поверхность с 70% этиловом спирте. Создайте поле стерильные с помощью горелки Бунзена.
- Передачи 3-5 мл LB отвара с соответствующего антибиотика в стерильных культуры трубу с крышкой.
- С помощью стерильных аппликатор или стерильной пипеткой подсказку, выбрать одного Колония мутантный штамм и инокуляции в LB СМИ.
- На ночь Инкубируйте LB жидкого культур при 37 ° C в шейкере на 225-250 об/мин.
- Протрите все рабочие поверхности с 70% этанола после обработки P. aeruginosa.
-
День 3: Хранить мутант интерес в морозильной камере-80 ° C
- Cryovial метку с именем мутантов, антибиотик добавляется LB отвара и сроки хранения.
- Подготовка 500 мл 50% глицерина (v/v) и стерилизовать в автоклаве.
- Надевайте перчатки, лабораторный халат и маска для обработки P. aeruginosa.
- Очистить скамейке или ламинарного потока капот и протрите поверхность с 70% этиловом спирте.
- Удаление тубы мутант культуры от шейкер.
- Подготовьте небольшой контейнер с сухим льдом.
- Использовать Ламинарный шкаф или создать поле стерильным на этанол протереть стендовые с горелки Бунзена.
- Добавить равное количество бактериальной культуры и 50% глицерина помечены cryovial с использованием стерильных условиях и осторожно смешать с пипеткой (окончательный объем 1-2 мл/флакон в зависимости от размера используемых криопробирки). Место cryovial на сухой лед для quick-freeze.
- Поместите cryovial в поле с меткой в морозильной камере-80 ° С.
- Протрите все рабочие поверхности с 70% этанола после обработки P. aeruginosa.
3. Протокол III: контроль качества PA14NR набора
- Выберите случайный набор мутантов из недавно реплицированных пластины для выявления возможных осреднения загрязнения (тестирование рекомендуется мутантов 30-40).
Примечание: В тех случаях, когда это необходимо для подтверждения личности используется для характеристики конкретных ген мутанта, рекомендуется выполнять амплификаций PCR с использованием гена специфические праймеры для известной последовательности гена, содержащий transposon вставки. Хотя и более сложной, преимущества использования произвольных праймеры PCR, вместо того, чтобы Джин специфические праймеры PCR когда amplyfing ДНК фрагменты из transposon мутантов включают легкость крупномасштабных мутант подтверждения и способность обнаруживать присутствие потенциал загрязнители. Для целей контроля качества не стоит для получения высокого качества ПЦР секвенирования данных для всех случайно выбраны мутантов, до тех пор, как достаточное количество мутантов, проверяются оценить коэффициент ошибок. - Выполните «Протокол II» испещрять и расти мутантных штаммов.
- Автоклав все пластик и нестерильные поставок перед использованием.
- Изолируйте genomic дна, предпочтительным методом. Для анализа, описанный в этой работе геномной ДНК изоляции комплект использовались следующие протоколы производителя. Может быть одновременно исследовано несколько мутантных штаммов.
- Мера геномной ДНК концентрации с использованием microvolume спектрофотометром. Отрегулируйте до примерно 100 нг/мкл геномной ДНК концентрации.
- Геномная ДНК можно используйте в качестве шаблона для запуска «PCR1 реакции», как описано в шаге 1 таблицы 3, генерации Arb1 ПЦР фрагментов (рис. 3). Праймеры для этого шага, перечислены в таблице 4.
- 0.5 мкл 10 x загрузки буфера 5 мкл PCR1 реакции, нагрузки в 1,5-2% гель агарозы и Побегите гель на 80-150 V.
Примечание: Длина конкретный фрагмент или фрагмент диапазон не ожидается, и более чем одна группа может присутствовать как произвольные грунт может связать несколько мест. - Использование ДНК из PCR1 реакции как шаблон для запуска «PCR2 реакции», как описано в шаге 2 таблицы 3, генерации Arb2 ПЦР фрагментов (рис. 3). Праймеры для этого шага, перечислены в таблице 4.
- 0.5 мкл 10 x загрузки буфера 5 мкл PCR2 реакции, нагрузки в 1,5-2% гель агарозы и Побегите гель на 80-150 V.
Примечание: Длина конкретный фрагмент или фрагмент диапазон не ожидается, и более чем одна группа может присутствовать как произвольные грунт может связать несколько мест. - Отправьте PCR2 реакции наряду с соответствующим transposon специфического праймера для виртуализации.
- Анализ последовательности byBLASTing результаты их против полный геном PA14, используя ссылку взрыва представлена на веб-сайте библиотеки PA14NR (http://pa14.mgh.harvard.edu/cgi-bin/pa14/blast.cgi) или непосредственно бризантные их против конкретных генов последовательность мутант интерес.
Примечание: Информация о выбранных мутантов можно найти путем поиска PA14NR набор сайта (Поиск http://pa14.mgh.harvard.edu/cgi-bin/pa14/search.cgi?searchType=SEARCH_PLATE_POSITIONS или скачать неизбыточной Library.xls файл с http:/ ссылка / pa14.mgh.harvard.edu/cgi-bin/pa14/downloads.cgi).
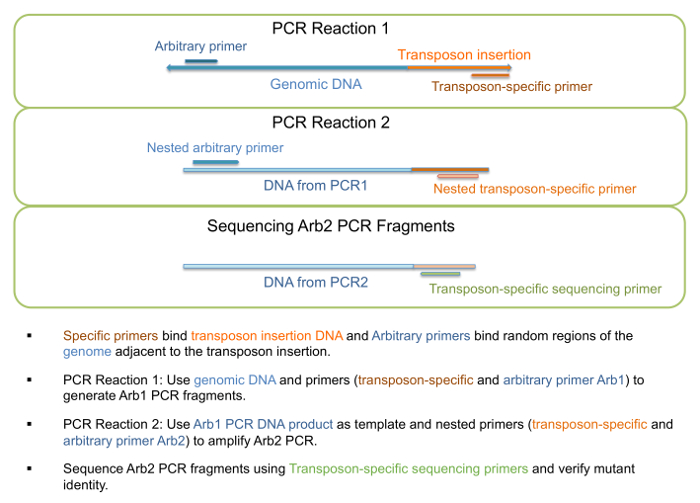
Рисунок 3: PCR амплификация и последовательности вставки мутантов transposon. Схема шагов, участвующих в амплификации PCR и виртуализации для проверки личности мутантов. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
| Настройка реакции PCR | |
| Шаг 1 | Шаг 2 |
| PCR1 реакции: | PCR2 реакции: |
| 23.25 мкл воды (молекулярной биологии класса) | 19.15 мкл воды (молекулярной биологии класса) |
| 3µL 10 x полимеразы Taq буфера | 5 мкл 10 x буфер полимеразы Taq |
| 0.5µL Taq-полимеразы | Полимеразы Taq 0,6 мкл |
| 0,625 20 мкл Arb1D грунтовка мкм (таблица 4) | 0,625 20 мкл Arb2A грунтовка мкм (таблица 4) |
| 0,625 мкл 20 мкм transposon специфического праймера (PMFLGM. ГБ 3a или Tn5Ext) (таблица 4) | 0,625 мл 20 мкм Transposon специфического праймера (PMFLGM. ГБ 2a или Tn5Int2) (таблица 4) |
| 1 мкл дНТФ 10 мм | 1 мкл дНТФ 10 мм |
| 1 мкл геномной ДНК, 100 нг | 5 мкл PCR1 реакция |
| Объем окончательной реакции 30 мкл | Объем окончательной реакции 30 мкл |
| Параметры реакции PCR | |
| PCR1 Термоциклер условия: | PCR2 Термоциклер условия: |
| 95 ° C-2 мин | 95 ° C-2 мин |
| Повторите 5 циклов: | Повторите 30 циклов: |
| 95 ° C-30 s | 95 ° C-30 s |
| 30 ° C – 1 мин | 54 ° C-30 s |
| 72 ° C – 1 мин | 72 ° C – 1.5 мин |
| Повторите 30 циклов: | 72 ° C – 10 мин |
| 95 ° C-30 s | 4 ° C – удержание |
| 45 ° C-30 s | |
| 72 ° C – 1 мин | |
| 72 ° C – 10 мин | |
| 4° C – удержание |
Таблица 3: реакции PCR set-up и Термоциклер условия используется для произвольного ПЦР. Произвольные ПЦР-реакции выполняются последовательно, и фрагменты, созданные во время реакции PCR1 используются в качестве шаблона в PCR2 реакции. Термоциклер конкретные параметры используются для каждого набора реакций.
| Грунтовка имя | Грунтовка последовательность |
| MAR2xT7 Transposon специфические праймеры | |
| PMFLGM. GB-3a | TACAGTTTACGAACCGAACAGGC |
| PMFLGM. GB-2a | TGTCAACTGGGTTCGTGCCTTCATCCG |
| MAR2xT7 Transposon последовательность праймера | |
| PMFLGM. GB-4а | GACCGAGATAGGGTTGAGTG |
| TNphoA Transposon специфические праймеры | |
| Tn5Ext | GAACGTTACCATGTTAGGAGGTC |
| Tn5Int2 | GGAGGTCACATGGAAGTCAGATCCTGG |
| TNphoA Transposon последовательность праймера | |
| Tn5Int | CGGGAAAGGTTCCGTTCAGGACGC |
| Произвольные праймеры | |
| ARB1D | GGCCAGGCCTGCAGATGATGNNNNNNNNNNGTAT |
| ARB2A | GGCCAGGCCTGCAGATGATG |
Таблица 4: список праймеров, используемых в контроле качества Эксперименты. Праймеры используются для амплификации PCR и последовательности вставки мутантов transposon для подтверждения личности мутантов.
Результаты
Двенадцать новых копий комплекса PA14NR были скопированы с использованием протокола I и оценки контроля качества новых копий созданных был проведен с использованием протокола III.
PA14NR набор мутант пластины наряду с управления пластины, ко...
Обсуждение
P. aeruginosa PA14NR набор является ценным ресурсом для научного сообщества. По словам марта 2017 dataset из Clarivate аналитика основные индикаторы науки базы данных, Либерати и др. (2006) 37, который описывает строительства комплекса PA14NR, занимает в верхней 1% публикаций микробиол...
Раскрытие информации
Авторы сообщают без финансовых конфликтов интересов. Eliana Drenkard и Фредерик Ausubel участвовал в создании библиотеки мутант неизбыточной transposon PA14. Брайан Херли и Лаел Yonker в настоящее время дом и распространять библиотеку мутантов в рамках Департамента педиатрии в Massachusetts General Hospital.
Благодарности
Мы хотели бы поблагодарить Лиза Philpotts MGH Тредуэлл виртуальной библиотеки для ее руководства в базе данных поиска. Эта работа была поддержана Фондом кистозный фиброз (YONKER16G0 и HURLEY16G0) и низ NIAID (ДГПЖ и Аде: R01 A1095338).
Материалы
| Name | Company | Catalog Number | Comments |
| Materials for Library Replication | |||
| Sterile 96-well Tissue-culture treated, case of 50 | Corning Life Sciences | 353072 | via Fisher Scientific |
| Sterile 96 Well Clear V-Bottom 2000μL Deep Well Plates, case of 25 | Corning Life Sciences | 3960 | via Fisher Scientific |
| Nunc OmniTray (rectangular plates), case of 60 | Thermo Scientific Rochester | 242811 | via Fisher Scientific |
| Rectangular Ice Pan, Midi (4L) | Corning Life Sciences | 432104 | via Fisher Scientific |
| Secure-Gard Cone Mask, case of 300 | Cardinal Health | AT7509 | via Fisher Scientific |
| AluminaSeal, pack of 100 | Diversified Biotech | ALUM-100 | via Fisher Scientific |
| Breathe-Easy membrane, pack of 100 | Diversified Biotech | BEM-1 | via Sigma-Aldrich |
| Sterile, individually wrapped, 50mL Solution Trough/Reagent Reservoir, case of 100 | Sorenson | S50100 | via Westnet Incorporated |
| Plate roller | VWR | 60941-118 | via VWR |
| Cryo Laser Labels - CRYOLAZRTAG 2.64" x 0.277", pack of 16 sheets | GA International | RCL-11T1-WH | via Labtag.com (template for printing also available from Labtag.com) |
| 96-well replicator | V & P Scientific, Inc. | Custom 407C, 3.18mm pin diameter, 57mm long | via V & P Scientific, Inc. |
| Multitron Pro, 3mm Shaking incubator | Infors HT | l10003P | via Infors HT |
| Picus 12 Channel 50-1200μL Electronic Pipette | Sartorius | 735491PR | via Sartorius |
| Filter Tips 50-1200μL, pack of 960 | Biohit | 14-559-512 | via Fisher Scientific; use electronic multichannel-compatible tips |
| Dry Ice | User-specific vendor | ||
| Materials for Individual Mutant Storage | |||
| Fisherbrand Premium Microcentrifuge Tubes: 1.5mL | Fisher Scientific | 05-408-130 | via Fisher Scientific |
| Pipettes (P1000, P200, P20, P2) | Gilson | F167370 | via Gilson |
| Materials for Quality Control PCR | |||
| Fisherbrand Premium Microcentrifuge Tubes: 1.5mL | Fisher Scientific | 05-408-130 | via Fisher Scientific |
| NanoDrop | Thermo Scientific | ND-2000 | via ThermoFisher |
| PCR Thermocycler | |||
| Omnistrips PCR Tubes with domed lids | Thermo Scientific | AB0404 | via Fisher Scientific |
| ART Barrier low-retention pipette tips (10 uL, 100 uL, 1000 uL) | Molecular BioProducts, Inc. | Z676543 (10 uL), Z676713 (100 uL), Z676802 (1000 uL) | via Sigma-Aldrich |
| Pipettes (P1000, P200, P20, P2) | Gilson | F167370 | via Gilson |
| Fisherbrand Premium Microcentrifuge Tubes: 1.5mL | Fisher Scientific | 05-408-130 | via Fisher Scientific |
| MasterPure DNA Purification Kit | Epicentre | MCD85201 | via Epicentre Technologies Corp |
| GeneRuler 1 kb Plus DNA Ladder, ready-to-use | Thermo Scientific | SM1333 | via ThermoFisher |
| RediLoad Loading Buffer | Invitrogen | 750026 | via ThermoFisher |
| Chemicals | |||
| Chemicals for Library and Individual Mutant Storage | |||
| Glycerol MB Grade, 1L | Sigma Aldrich | G5516 | via Sigma-Aldrich |
| LB Broth | Per 1L dH2O: 10g tryptone, 5g yeast extract, 5g NaCl, 1ml 1N NaOH (Current Protocols in Molecular Biology. Wiley, 1994.) | ||
| Tryptone | Sigma Aldrich | T7293 | via Sigma-Aldrich |
| Yeast Extract | Sigma Aldrich | Y1625 | via Sigma-Aldrich |
| Sodium Chloride | Sigma Aldrich | S7653 | via Sigma-Aldrich |
| Sodium Hydroxide | Sigma Aldrich | S8045 | via Sigma-Aldrich |
| LB agar | See preparation above, add 15g Bacto Agar | ||
| Bacto Agar | Sigma Aldrich | A5306 | via Sigma-Aldrich |
| Gentamicin sulfate, 10g | BioReagent | 1405-41-0 | via Sigma-Aldrich |
| Kanamycin sulfate | Gibco | 11815024 | via ThermoFisher |
| Ethanol, 190 proof | Decon | 04-355-221 | via Fisher Scientific |
| Chemicals for Quality Control PCR | |||
| Primers | User-preferred vendor | See primers listed in Table 3 | |
| Corning cellgro Molecular Biology Grade Water | Corning | 46000CV | via Fisher Scientific |
| Taq Polymerase Buffer | Invitrogen | 10342020 | via ThermoFisher |
| Taq DNA Polymerase, recombinant | Invitrogen | 10342020 | via ThermoFisher |
| dNTPs | Invitrogen | 10297018 | via ThermoFisher |
| Agarose | Sigma | A9539 | via Sigma-Aldrich |
Ссылки
- Moradali, M. F., Ghods, S., Rehm, B. H. Pseudomonas aeruginosa lifestyle: A paradigm for adaptation, survival, and persistence. Front Cell Infect Microbiol. 7, 39 (2017).
- Bleves, S., et al. Protein secretion systems in Pseudomonas aeruginosa: A wealth of pathogenic weapons. Int J Med Microbiol. 300 (8), 534-543 (2010).
- Breidenstein, E. B., de la Fuente-Nunez, C., Hancock, R. E. Pseudomonas aeruginosa: all roads lead to resistance. Trends Microbiol. 19 (8), 419-426 (2011).
- Flynn, K. M., et al. Evolution of ecological diversity in biofilms of Pseudomonas aeruginosa by altered cyclic diguanylate signaling. J Bacteriol. 198 (19), 2608-2618 (2016).
- Hazan, R., Maura, D., Que, Y. A., Rahme, L. G. Assessing Pseudomonas aeruginosa persister/antibiotic tolerant cells. Methods Mol Biol. 1149, 699-707 (2014).
- Klockgether, J., et al. Genome diversity of Pseudomonas aeruginosa PAO1 laboratory strains. J Bacteriol. 192 (4), 1113-1121 (2010).
- Mathee, K., et al. Dynamics of Pseudomonas aeruginosa genome evolution. Proc Natl Acad Sci U S A. 105 (8), 3100-3105 (2008).
- Taylor, P. K., Yeung, A. T., Hancock, R. E. Antibiotic resistance in Pseudomonas aeruginosa biofilms: towards the development of novel anti-biofilm therapies. J Biotechnol. 191, 121-130 (2014).
- Flume, P. A., Van Devanter, D. R. State of progress in treating cystic fibrosis respiratory disease. BMC Med. 10, 88 (2012).
- . Cystic Fibrosis Foundation Patient Registry 2015 Annual Data Report Available from: https://www.cff.org/Our-Research/CF-Patient-Registry/2015-Patient-Registry-Annual-Data-Report.pdf (2016)
- Church, D., Elsayed, S., Reid, O., Winston, B., Lindsay, R. Burn wound infections. Clin Microbiol Rev. 19 (2), 403-434 (2006).
- Sadikot, R. T., Blackwell, T. S., Christman, J., Prince, A. Pathogen-host interactions in Pseudomonas aeruginosa pneumonia. Am J Respir Crit Care Med. 171 (11), 1209-1223 (2005).
- Song, Z., et al. Prosthesis infections after orthopedic joint replacement: the possible role of bacterial biofilms. Orthop Rev (Pavia). 5 (2), 65-71 (2013).
- National Nosocomial Infections Surveillance, S. National Nosocomial Infections Surveillance (NNIS) System Report, data summary from January 1992 through June 2004, issued October 2004. Am J Infect Control. 32 (8), 470-485 (2004).
- Cohen, T. S., Parker, D., Prince, A. . Pseudomonas aeruginosa Host Immune Evasion. 7, 3-23 (2014).
- Fernandes, A., Dias, M. The microbiological profiles of infected prosthetic implants with an emphasis on the organisms which form biofilms. J Clin Diagn Res. 7 (2), 219-223 (2013).
- Khosravi, A. D., Ahmadi, F., Salmanzadeh, S., Dashtbozorg, A., Montazeri, E. A. Study of Bacteria Isolated from Orthopedic Implant Infections and their Antimicrobial Susceptibility Pattern. Res J of Microbiol. 4 (4), 6 (2009).
- Roemhild, R., Barbosa, C., Beardmore, R. E., Jansen, G., Schulenburg, H. Temporal variation in antibiotic environments slows down resistance evolution in pathogenic Pseudomonas aeruginosa. Evol Appl. 8 (10), 945-955 (2015).
- Fischer, S., et al. Intraclonal genome diversity of the major Pseudomonas aeruginosa clones C and PA14. Environ Microbiol Rep. 8 (2), 227-234 (2016).
- Wiehlmann, L., et al. Population structure of Pseudomonas aeruginosa. Proc Natl Acad Sci U S A. 104 (19), 8101-8106 (2007).
- Lam, J. S., Taylor, V. L., Islam, S. T., Hao, Y., Kocincova, D. Genetic and functional diversity of Pseudomonas aeruginosa lipopolysaccharide. Front Microbiol. 2, 118 (2011).
- Choi, J. Y., et al. Identification of virulence genes in a pathogenic strain of Pseudomonas aeruginosa by representational difference analysis. J Bacteriol. 184 (4), 952-961 (2002).
- He, J., et al. The broad host range pathogen Pseudomonas aeruginosa strain PA14 carries two pathogenicity islands harboring plant and animal virulence genes. Proc Natl Acad Sci U S A. 101 (8), 2530-2535 (2004).
- Mikkelsen, H., McMullan, R., Filloux, A. The Pseudomonas aeruginosa reference strain PA14 displays increased virulence due to a mutation in ladS. PLoS One. 6 (12), e29113 (2011).
- Drenkard, E., Ausubel, F. M. Pseudomonas biofilm formation and antibiotic resistance are linked to phenotypic variation. Nature. 416 (6882), 740-743 (2002).
- Rahme, L. G., et al. Common virulence factors for bacterial pathogenicity in plants and animals. Science. 268 (5219), 1899-1902 (1995).
- Rahme, L. G., et al. Use of model plant hosts to identify Pseudomonas aeruginosa virulence factors. Proc Natl Acad Sci U S A. 94 (24), 13245-13250 (1997).
- Kirienko, N. V., Cezairliyan, B. O., Ausubel, F. M., Powell, J. R. Pseudomonas aeruginosa PA14 pathogenesis in Caenorhabditis elegans. Methods Mol Biol. 1149, 653-669 (2014).
- Mahajan-Miklos, S., Tan, M. W., Rahme, L. G., Ausubel, F. M. Molecular mechanisms of bacterial virulence elucidated using a Pseudomonas aeruginosa-Caenorhabditis elegans pathogenesis model. Cell. 96 (1), 47-56 (1999).
- Limmer, S., et al. Pseudomonas aeruginosa RhlR is required to neutralize the cellular immune response in a Drosophila melanogaster oral infection model. Proc Natl Acad Sci U S A. 108 (42), 17378-17383 (2011).
- Miyata, S., Casey, M., Frank, D. W., Ausubel, F. M., Drenkard, E. Use of the Galleria mellonella caterpillar as a model host to study the role of the type III secretion system in Pseudomonas aeruginosa pathogenesis. Infect Immun. 71 (5), 2404-2413 (2003).
- Coleman, F. T., et al. Hypersusceptibility of cystic fibrosis mice to chronic Pseudomonas aeruginosa oropharyngeal colonization and lung infection. Proc Natl Acad Sci U S A. 100 (4), 1949-1954 (2003).
- Pazos, M. A., et al. Pseudomonas aeruginosa ExoU augments neutrophil transepithelial migration. PLoS Pathog. 13 (8), e1006548 (2017).
- Maura, D., Hazan, R., Kitao, T., Ballok, A. E., Rahme, L. G. Evidence for direct control of virulence and defense gene circuits by the Pseudomonas aeruginosa quorum sensing regulator, MvfR. Sci Rep. 6, 34083 (2016).
- Jacobs, M. A., et al. Comprehensive transposon mutant library of Pseudomonas aeruginosa. Proc Natl Acad Sci U S A. 100 (24), 14339-14344 (2003).
- Held, K., Ramage, E., Jacobs, M., Gallagher, L., Manoil, C. Sequence-verified two-allele transposon mutant library for Pseudomonas aeruginosa PAO1. J Bacteriol. 194 (23), 6387-6389 (2012).
- Liberati, N. T., et al. An ordered, nonredundant library of Pseudomonas aeruginosa strain PA14 transposon insertion mutants. Proc Natl Acad Sci U S A. 103 (8), 2833-2838 (2006).
- Feinbaum, R. L., et al. Genome-wide identification of Pseudomonas aeruginosa virulence-related genes using a Caenorhabditis elegans infection model. PLoS Pathog. 8 (7), e1002813 (2012).
- Stewart, L., et al. Draft genomes of 12 host-adapted and environmental isolates of Pseudomonas aeruginosa and their positions in the core genome phylogeny. Pathog Dis. 71 (1), 20-25 (2014).
- Thrane, S. W., et al. The widespread multidrug-resistant serotype O12 Pseudomonas aeruginosa clone emerged through concomitant horizontal transfer of serotype antigen and antibiotic resistance gene clusters. MBio. 6 (5), e01396-e01315 (2015).
- van Belkum, A., et al. Phylogenetic Distribution of CRISPR-Cas Systems in Antibiotic-Resistant Pseudomonas aeruginosa. MBio. 6 (6), e01796-e01715 (2015).
- Lewenza, S., et al. Construction of a mini-Tn5-luxCDABE mutant library in Pseudomonas aeruginosa PAO1: a tool for identifying differentially regulated genes. Genome Res. 15 (4), 583-589 (2005).
- . . Current Protocols in Molecular Biology. , (1994).
- Breidenstein, E. B., Khaira, B. K., Wiegand, I., Overhage, J., Hancock, R. E. Complex ciprofloxacin resistome revealed by screening a Pseudomonas aeruginosa mutant library for altered susceptibility. Antimicrob Agents Chemother. 52 (12), 4486-4491 (2008).
- Musken, M., Di Fiore, S., Dotsch, A., Fischer, R., Haussler, S. Genetic determinants of Pseudomonas aeruginosa biofilm establishment. Microbiology. 156 (Pt 2), 431-441 (2010).
- Schurek, K. N., et al. Novel genetic determinants of low-level aminoglycoside resistance in Pseudomonas aeruginosa. Antimicrob Agents Chemother. 52 (12), 4213-4219 (2008).
- Oumeraci, T., et al. Comprehensive MALDI-TOF biotyping of the non-redundant Harvard Pseudomonas aeruginosa PA14 transposon insertion mutant library. PLoS One. 10 (2), e0117144 (2015).
- Yeung, A. T., et al. Swarming of Pseudomonas aeruginosa is controlled by a broad spectrum of transcriptional regulators, including MetR. J Bacteriol. 191 (18), 5592-5602 (2009).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены