Method Article
Устные бактериальной инфекции и осыпания в Drosophila melanogaster
В этой статье
Резюме
Этот протокол описывает методы устно разоблачить и заразить плодовой мушки Drosophila melanogaster с бактериальных патогенов и измерить количество инфекционных бактерий сарай после инфекции кишечника. Мы далее описывают эффект иммунных мутантов на лету выживание после устного бактериальной инфекции.
Аннотация
Плодовой мушки Drosophila melanogaster — одна из лучших систем разработанной модели инфицирования и врожденного иммунитета. Хотя большинство работа была сосредоточена на системные инфекции, был недавнее увеличение интереса в механизмах кишки туберкулина для патогенов, которые требуют методы устно заразить мух. Здесь мы представляем протокол устно подвергать отдельных мух оппортунистических бактериальных патогенов (Pseudomonas aeruginosa) и природных бактериальных патогенов D. melanogaster (Pseudomonas entomophila). Цель настоящего Протокола заключается в том, предоставить надежный метод, чтобы предоставить мужского и женского пола мух для этих патогенов. Мы предоставляем представитель результаты выживания фенотипов, микроб нагрузок и бактериальных пролить, которое имеет отношение к изучению гетерогенности в передаче возбудителя. Наконец, мы подтверждаем, что Dcy мутантов (отсутствует защитная peritrophic матрицы в эпителии кишечника) и наслаждаться мутантов (отсутствие функционального иммунодефицита (IMD) путь), показать повышенная восприимчивость к бактериальной инфекции ротовой полости. Таким образом, этот протокол описывает надежный способ заразить мух с помощью пероральном инфекции, которая может быть расширена для изучения различных генетических и экологических источников вариации в кишечнике исходы инфекции и бактериального передачи.
Введение
Плодовая муха (также известный как уксус Муха), D. melanogaster, широко используется как модельный организм для инфекция и иммунитет против различных возбудителей1,2. Эта работа предложил основные идеи в физиологические последствия инфекции и также первопроходца в разгадке молекулярные пути, лежащие в основе иммунного ответа против Паразитоид, бактериальных, грибковых и вирусных инфекций. Это знание полезно не только понять врожденный иммунный ответ насекомых и других беспозвоночных, но потому, что многие из иммунных механизмов эволюционно консервируют между насекомых и млекопитающих, дрозофила также стимулировало открытие в млекопитающих, включая человека3основных иммунных механизмов.
Большинство работа на дрозофилы инфекция и иммунитет была сосредоточена на системные инфекции, используя методы прививки, которые поставляют патогены непосредственно в тело насекомого, покалывание или инъекции4,5,6. Преимущество этих методов позволяет доставки контролируемых инфекционных дозы ясно и поддерживается большой объем работы по системных инфекций. Однако многие естественно-происходя бактериальных возбудителей D. melanogaster приобретаются через питаются разлагающихся органических веществ, где кишка туберкулина играет значительную роль в принимающей обороны7,,8, 9 , 10 , 11 , 12 , 13 , 14 , 15. эксперименты, которые используют системные инфекции обойти эти возражения и, таким образом, получить совсем другой картину как насекомых монтировать оборону против естественных патогенов. Это особенно актуально, если цель работы для проверки прогнозов об экологии и эволюции инфекции, где использование природных патогенов и маршруты инфекции является важным16,17. Недавняя работа подчеркнул как маршрут возбудителей значительно влияет на исход заболевания18,19, вызывает собственный иммунитет пути20,21, можно определить защитный эффект наследство endosymbionts16и может даже играть важную роль в эволюции принимающей обороны17.
Другая причина использовать устные маршруты инфекции является то, что расследование вариации в передаче возбудителя, измеряя бактериальных пролить в фекальных экскрецию после инфекции ротовой полости22,23, 24. понимание источники гетерогенности принимающих передачи болезни сложной в природных популяциях25,26, но измерительные компоненты передачи, таких как возбудитель пролития, контролируемых лаборатории условия предлагает полезные альтернативный подход27. Кормления мух бактериями и измеряя бактериальных пролить под различных генетических и экологических контекстов в контролируемых экспериментальных условиях это возможно для выявления источников вариации в передаче между узлами.
Здесь мы описываем протокол для устно заражение D. melanogaster бактериальных патогенов, и для количественной оценки роста бактерий и пролить что следующим образом (рис. 1). Мы опишем этот протокол на двух синегнойной бактерий: вирулентный штамм оппортунистических патогенов P. aeruginosa (PA14) и менее вирулентным штаммом природных летать возбудителя P. entomophila. Псевдомонад общие грамотрицательных бактерий с широким хозяйского диапазона, заражение насекомых, нематоды, растений и позвоночных животных и находятся в большинстве сред4,6. Кишечные инфекции дрозофилы P. aeruginosa и P. entomophila приводит к патологии кишечного эпителия12,13,14,15, 28. Хотя мы сосредоточиться на этих двух бактериальных патогенов, описанные здесь методы могут в принципе применяться для любых бактериальных патогенов интерес с незначительными изменениями. После перорального воздействия мы измерить послеоперационные инфекции выживания и измерить микробной нагрузки в пределах отдельных мух и жизнеспособных микробов пролить в окружающую среду, выраженная в колонии, образуя единиц (CFUs). Наконец потому, что кишки туберкулина результаты от комбинации эпителиальных барьер и гуморальные ответы, мы также измерить выживания летать линии, где нарушена эти возражения. В частности, Drosocrystallin (Dcy) мутанты были ранее показали, чтобы быть более восприимчивы к устной бактериальной инфекции из-за матрицы обедненного peritrophic в кишечнике29. Мы также измерить выживания в приправы (Rel) мутант, который препятствует от производства антимикробных пептидов против грамотрицательных бактерий через путь IMD30.
протокол
1. поддерживать мух
- Поддерживать мух в 23 мл пластиковых флаконах, содержащих 7 мл свежеприготовленной Льюис среды (изменение от ссылки31; тройной 1 Л дистиллированной H2O, 6.1 g агар, 93,6 г коричневого сахара, 68 g кукурузы, 18.7 g мгновенные дрожжи, 15 мл Tegosept противогрибковый агент) в инкубаторы при температуре 25 ± 1 ° C в 12 h:12 h свет: темные цикл с ~ 60% влажности. Подключите флаконы с не абсорбент ваты.
- После каждые 14 дней передачи 20 – 30 взрослых новый флакон пищи, с мгновенный, сухие дрожжи, добавлены к поверхности, для 2-3 дней, чтобы позволить Яйцекладка происходит. После этого периода времени убедитесь, что яйца видны на поверхности пищи. Удаление взрослых мух.
Примечание: Это держит мух в ампул как одного поколения, соответствует возрасту населения. - Оставьте яйца, чтобы развиваться.
Примечание: При 25 ° C, взрослых мух начинают Эклоз от куколок на 11 день и продолжаться в течение 12 – 14 дней.
2. подготовить экспериментальный мух
- Собирать яйца родительского поколения в клетке коллекции населения/эмбриона на тарелке яблоко агар 75 мл (1 Л тройной противогрибковый агент Tegosept 7 мл, дистиллированной H2O, 33 г сахарозы, 330 мл яблочного сока, 30 g агар) с распространение пасты дрожжей (смесь сухих дрожжей с вода до консистенции арахисовое масло подобных). Добавьте водянистыми ваты в клетке, чтобы обеспечить влаги.
Примечание: Чтобы избежать смешанные эффекты, вызванные различиями в личиночной молодняка плотность, важно что экспериментальной мух в разных флаконах выращиваются в аналогичных плотности. Чтобы избежать смешанные эффекты выполняется шаг выше. - Инкубировать в течение 24 ч при 25 ° C в час 12 h:12 свет: темные цикл до тех пор, пока яйцекладка произошла. Если есть слишком мало яиц после 24 ч, обеспечивают более длительный период привыкания. Заменить плиты яблоко агара и позволяют Яйцекладка происходит еще 24 часа.
- Взять яйцо Ладена яблоко агар пластины от населения клетке. Удалите оставшиеся пасты дрожжевых и любой мертвые мухи от поверхности агара.
- Опускайте агар в 20 мл 1 x фосфат амортизированное saline (PBS) и аккуратно выбить яйца от apple агар с тонкой кистью. В то время как приостановлено в PBS, передавать яйца 50 мл пластиковых пробирок и оставить на 5 мин, чтобы яйца опускаться на дно.
Примечание: Большинство яйца находятся на внешнем краю агара. - Удаление путем разрезания нижней 4 мм подсказки отфильтрованного пипеткой p1000 и использовать наконечник пипетки рисовать 1 мл раствора, взятые из нижней части 50 мл пластиковых пробирок. Передать это пробки microcentrifuge 1,5 мл и позволить ему поселиться.
Примечание: Когда закупорить вверх яйца, snap выпуская поршень является более эффективным чем нежный релиз. - Удаление путем разрезания нижней 4 мм кончика p20 отфильтрованных пипеткой. Установить требуемый объем пипетки и извлечь из нижней части пробки microcentrifuge.
Примечание: С практикой, объем 5 мкл содержит примерно 100 яиц. - Распределять собранные яйца на продовольствие и оставить их разработать необходимое количество времени.
3. Бактериальная культура
- Выращивать культуры P. entomophila и P. aeruginosa , прививать 10 мл бульона Бертани Лурия (LB) с 100 мкл замороженных бактериальных запасов при 30 ° C (P. entomophila) и 37 ° C (P. aeruginosa), соответственно. На ночь погрозит 150 об/мин. Убедитесь, что Бактериальная культура достигает этапа насыщения.
- Для обеспечения бактерии, используемые для прививки мух в экспоненциальной фазе и быстро репликации, прививать ночь культуры в новой субкультуры, нужного тома, следующим утром. Убедитесь, что перед посевным материалом 10% от общего объема субкультура культуры.
Примечание: Устные инфекции требует высокой. Именно поэтому необходимо расти значительный объем бактериальной культуры, так, что достаточно прививка культуры могут быть изготовлены для требуемой дозы и экспериментальной размер. Рассчитать, сколько субкультура необходим для выработки необходимых инфекционных доз, используя уравнение MsVs = M,яVя, где M представляет культуру оптическая плотность измеряется в 600 Нм (600OD) значение и V представляет его объем. Индекс буквы обозначают ли культура используется как субкультура (s) или инфекционные дозы (i). - Растут этой субкультуры в коническую колбу 2 Л в томе, таким образом, что субкультуры поверхности падает (в большинстве) чуть выше в начале склона колбу. Не наливайте выше этой марки, как он будет трюк рост бактерий.
- Убедитесь, что бактерии в этой субкультуры в фазы экспоненциального роста путем измерения ОД каждые 30 мин.
Примечание: Это происходит после 3 – 5 ч, где субкультура достигает600 ОД между 0,6 – 0,8. - Налить равных объемах этой субкультуры через 50 мл пробирок и спина субкультуры в 2500 x g 15 мин при 4 ° C для пеллет бактерий. После гранулированных, удалить и затем спина супернатант снова в вышеуказанных условий для подтверждения удаления подавляющего большинства бактерий.
Примечание: Пелле незначительный размер (меньше, чем 1 мм в высоту) подтверждает это. - Объединить бактериальных гранулы отдельных труб путем повторного приостановления их в 5 мл субкультуры супернатанта и комбинирование этих решений в единый 50 мл трубки. Спина этот концентрированный культуры на 2500 x g 15 мин при 4 ° C для пеллет бактерий.
- Удалить супернатант и вновь приостановить окончательное бактерий Пелле в водный раствор 5% сахарозы. Проверьте ОД и приспособиться к желаемой инфекционных дозы (OD600 = 100 для P. entomophila8 и ОД600 = 25 P. aeruginosa16,28), приостановив повторно гранулы в 5% Сахароза водный раствор для объема.
Примечание: Количество сахарозы 5% водного раствора для добавления могут рассчитываться с использованием уравнения в шаге 3.2.1 (MsVs = M,яVя).
4. устно заражение мух
- Для обеспечения инфекции ротовой полости, голодать мух для 2-4 ч до воздействия бактерий путем передачи мух стандартных агар флаконов (тройной 1 Л дистиллированной H2O, 84 г коричневого сахара, 20 г агар, 7 мл Tegosept противогрибковый агент).
- Подготовьте инфекции пузырьки, пока летит изголодались. Сделать синегнойной инфекции флакон, дозирования 500 мкл стандартных сахара агар в крышку 7 мл образца и оставьте его для просушки. Поместите диск фильтровальной бумаги в крышке и Пипетка 100 мкл бактериальной культуры непосредственно на диск фильтр. Для управления инфекции замените бактериальной культуры с такой же объем сахарозы 5% водного раствора на фильтровальной бумаге.
- Добавить один мух образец трубки и оставить для 18 – 24 часа.
- Подтверждения инфекции ротовой полости, сначала поверхности стерилизуйте мухи сразу же после бактериального заражения, помещая их в 100 мкл 70% этанола для 20 – 30 s. удалить этанола и добавить 100 мкл тройной дистиллированной воды для 20-30 s перед удалением воды. 100 мкл ПБС и гомогенизации лету.
- Передать в верхнем ряду плиту 96-луночных огневки и 90 мкл ПБС каждой скважине ниже.
- Серийно разбавляют этот образец, чтобы различать значения диапазона кое. Взять 10 мкл огневки в верхней хорошо и добавить это к значительно ниже. Повторите этот шаг с второй, передачи 10 мкл третьего и так далее, для как много серийных разведений при необходимости.
Примечание: Важно, что новые наконечники используются для каждого набора разведениях. - Пластина серийных разведений на плите питательный агар фунтов в 5 мкл капли, чтобы убедиться, что все капли остаются дискретных.
- Инкубируйте плиты агара фунтов на ночь на 30 ° C до 37 ° C P. entomophila и P. aeruginosa, соответственно и количество видимых CFUs.
Примечание: Хотя микробами кишечник дрозофилы требуется собственный рост анаэробных условий, селективной среде, например среднего изоляции Pseudomonas (PIM), может использоваться для убедитесь, что учитываются только Pseudomonas CFUs. - Рассчитайте количество CFUs в лету, подсчитывая количество колоний на серийный разрежения где 10 – 60 CFUs, четко видны. Затем умножьте на коэффициент разбавления, чтобы вычислить количество бактерий на лету.
- Выполнение статистического анализа. При необходимости, превратите CFUs в лету для нормального распределения. Сделать это путем преобразования журнала. После преобразования, используйте обобщенные линейные модели (GLMs)30,,3132 для тестирования, как лечение групп отличаются в CFUs на лету (с помощью общедоступных статистических пакетов как R33).
Примечание: Оставшиеся летать огневки может использоваться для измерения экспрессии генов путем анализа ПЦР (RT-ПЦР) количественные обратной транскрипции. Исправьте огневки в 50 мкл Реагента изоляции РНК, извлечь РНК и количественную оценку конкретных генов иммунной титры по RT-ПЦР (см., например,16 Гупта и Вале для подробного протокола). Выражение конкретных генов иммунной стенограммы следует нормализовать уровень Транскрипт гена уборки (например, rp49) и выразил как раз изменить относительно управления мух с помощью 2−ΔΔCt метод31, 32,,33-34.
5. запись выживаемости после инфекции
- Устно, как описано в шаге 4.2 заразить мух.
- Передача ВИЧ-инфицированных или управления мух от их соответствующих инфекции пузырьки в стандарт Льюис ампул и держать в инкубаторе при 25 ° C в час 12 h:12 свето тени цикла (или желаемых условий). Держите мух, до тех пор, пока они мертвы.
- Подсчитать количество живых или мертвых мух в каждом флаконе каждый день, или как часто, как требуется.
- Передать мух новых флаконах каждые 5 дней чтобы избежать застрять в пищу мух.
- Представить эти данные в виде кривых выживания Каплана-Мейера (км) или среднее ± SE пропорциональной выживания сюжетов. Для анализа влияния ряда факторов и/или их соответствующих взаимодействия друг с другом использовать статистический пакет (например, пакет «выживания» в R33) для запуска анализа выживания, например кокс пропорционально опасности модель35.
6. Измерение бактериальной нагрузки
- В нужный момент передать пробки microcentrifuge стерильные 1,5 мл одного инфицированного мухи.
- Поверхность стерилизовать мух, как описано в шаге 4.4.
- Однородный лету и количественно бактериальной нагрузки, используя протокол, описанные в шагах 4.5 – 4.10.
7. мера бактериальных пролития
- Измерьте пролития наряду с внутренней нагрузки.
- После заражения передачи одной мухи до 1,5 мл microcentrifuge пробирки, содержащие ~ 50 мкл Льюис среднего за 24 ч.
- Удаление мух для измерения внутренней нагрузки (см. шаг 6) и промойте трубы с 100 мкл ПБС, vortexing сильно для 3 s.
- Измерьте CFUs в это мыть покрытие на LB питательный агар, используя тот же протокол, как описано в шагах 4,6-4,8.
- После заражения передачи одной мухи до 1,5 мл microcentrifuge пробирки, содержащие ~ 50 мкл Льюис среднего за 24 ч.
- Передачи мух в новых microcentrifuge пробирки, содержащие ~ 50 мкл Льюис среды для дальнейшего 24 h. мыть загрязненных трубки с 100 мкл ПБС, vortexing сильно для 3 s.
- Измерьте CFUs в это мыть покрытие на LB питательный агар, используя тот же протокол, описанные в шагах 4,6-4,8.
- Повторите пункты 7.2 и 7.3 и записи летать смертности на каждой передаче.
Результаты
Здесь мы представляем наглядные результаты экспериментов, где D. melanogaster устно инфицированных P. aeruginosa или P. entomophila. Рисунок 2 демонстрирует успешный устные инфекции мух после периода воздействия 12 ч или 24 ч в бактериальных культурах ОД600 = 25 и 100 для P. aeruginosa (рисунок 2A) и P. entomophila (Рисунок 2Б C), соответственно. Рисунок 2B иллюстрирует важность использования более концентрированной культуры P. entomophila, подтверждается увеличением бактериальной нагрузки, когда мух подвергаются воздействию бактериальных культур более оптической плотности. Мужские и женские мух Орегон R (Орер) очистить инфекции P. aeruginosa по той же ставке (рис. 3) и пролить одинаковое количество P. aeruginosa CFUs (рис. 4A). Когда инфицированных P. entomophila однако, мужские и женские Орер мух отличаются количество бактерий сарай, в манере, которая изменяется с течением времени (рис. 4В). Мужчины и женщины умирают от P. aeruginosa (Рисунок 5A) и P. entomophila (Рисунок 5B) с разной скоростью. Мы также видим, что Dcy мутантов, (которых нет защитного peritrophic матрицы в эпителии кишечника) и приправы мутантов (которые не хватает функциональной иммунной путь IMD), показывают снижение выживаемости после P. entomophila и P. aeruginosa устные инфекции (рис. 5 c).
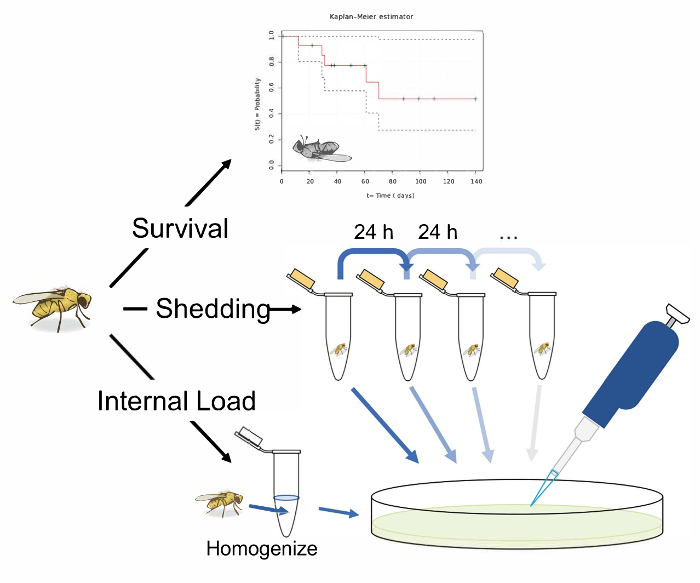
Рисунок 1: Схема обзор протоколов для измерения выживаемости, проливая и внутреннюю бактериальной нагрузки после инфекции ротовой полости в Drosophila melanogaster. Иллюстрация 3 потенциальных экспериментов после устные инфекции D. melanogaster. Измерьте «выживание» путем передачи одной мухи флаконов и записи их зараженных жизни. Мера «сброс» путем передачи одной мухи 1,5 мл microcentrifuge трубы с 50 мкл Льюис среды в кепке. После 24 часов в пробке удалите лету и вихревой трубе с 100 мкл ПБС. Удалите и тарелка это решение на питательный агар LB для вычисления бактериальных пролить. Измерьте пролития в том же ходу продольно, передачи мух свежие трубы с среднего Льюис в крышку после 24 ч и мытье и покрытие теперь загрязненных трубки. Муха «внутренней нагрузки» может быть измерен принимая зараженных летать, поверхности стерилизации его и гомогенизации до наконец покрытие огневки на питательный агар фунтов. Это может быть выполнена после пролить был измерен для вычисления как «внутренней нагрузки» и осыпания коррелируют. Муха иллюстрации, используемые в этом рисунке первоначально была нарисована B. Nuhanen36. Авторы были изменены его сопровождать пример Каплана-Мейера кривой, которая берется из37Викисклада. Все другие иллюстрации являются оригинальными. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
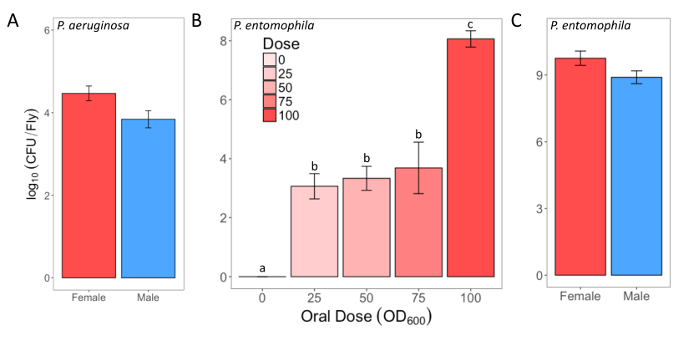
Рисунок 2: доза инфекционных бактерий, после инфекции ротовой полости. (A) инфекционные доза мужского и женского пола Орегон-R летит после воздействия на культуру P. aeruginosa (OD600 = 25) для 12 h. Среднее и SE были рассчитаны из 3 кобеля и 3 суки. (B) инфекционные доза outcrossed одичал тип женщины, после контакта с одним из четырех P. entomophila культур (OD600 = 100, 75, 50 и 25) или 5% раствора сахарозы для 24 h. Статистическая разница (F3,76 18.567, p = < 0,001) инфекционные дозы между воздействием процедуры обозначается различных букв выше баров. Средства были рассчитаны из 5 мух для ОД600 = 0 доза и 18-20 для всех других доз. (C) инфекционные дозы мужского и женского пола Орегон-R летит после воздействия на культуру P. entomophila (ОД600 = 100) за 24 ч. Среднее и SE были рассчитаны из 20 мужчин и 20 женщин. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
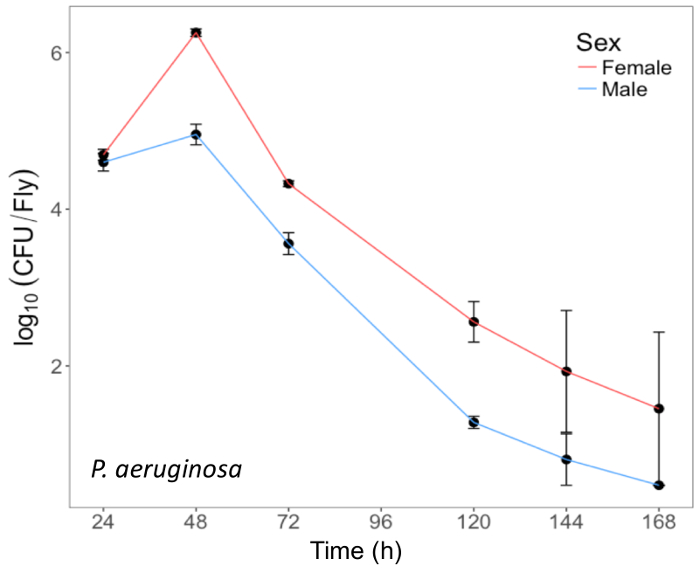
Рисунок 3: Внутренняя P. aeruginosa нагрузки в мух после инфекции ротовой полости. Среднее ± SE бактериальной нагрузки мужского и женского пола Орегон-r выполняет рейсы следующие устные инфекции с P. aeruginosa (OD600 = 25) вплоть до 168 h послеоперационные инфекции. Среднее и SE каждой точки времени рассчитываются от 3 лица. Муха внутреннюю бактериальной нагрузки значительно изменяется с течением времени (p < 0,001). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
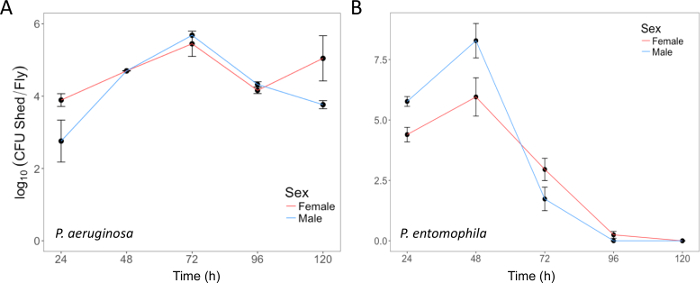
Рисунок 4: бактериальных, проливая следующие устные инфекции. (A) P. aeruginosa пролить мухами же используется на рисунке 3, вплоть до 120 h послеоперационные инфекции. Среднее и SE были рассчитаны из 3 кобеля и 3 суки. (B) P. entomophila пролить от мужского и женского пола Орегон-R выполняет рейсы следующие устные инфекции с P. entomophila (ОД600 = 100) вплоть до 120 h послеоперационные инфекции. Среднее и SE были рассчитаны из 34 мужчин и 38 женщин. P. aeruginosa и P. entomophila, со временем значительно меняется количество CFUs сарай, Муха (p < 0,001). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
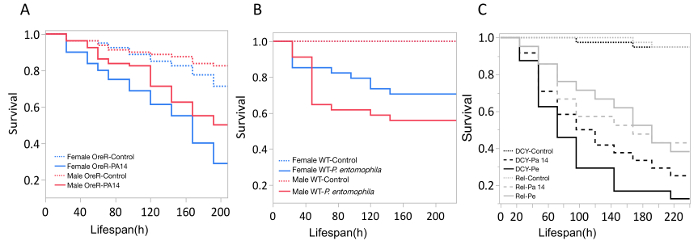
Рисунок 5: выживание после бактериальной инфекции ротовой полости мух. Кривых выживания Каплана-Мейера (км) (A) Орегон-R мужского и женского летит следующие устные инфекции с P. aeruginosa (OD600 = 25) или 5% раствора сахарозы. Кривая выживания км была рассчитана из 4 флаконы 20 мух в группе лечения. (B) Орер мужского и женского пола летит после инфекции ротовой полости с P. entomophila (ОД600 = 100). Кривая выживания км была рассчитана из 4 единого управления мух и 34 зараженных мух для мужчин и женщин. (C) иммунной мутантов: Dcy (Drosocrystallin-peritrophic матрица мутант) и Rel (Смак-IMD мутант), подвержены P. entomophila (Pe), P. aeruginosa (Pa14) или 5% раствором сахарозы управления. Все инфицированные группы умереть значительно быстрее, чем элемент управления мухи (p < 0,001). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Обсуждение
Мы представляем протокол для надежно устно заражение D. melanogaster бактериальных патогенов. Мы сосредоточены на P. aeruginosa и P. entomophila, но этот протокол может быть легко адаптирована для включения инфекции других бактериальных видов, например, Serratia marcescens7. Ключевые аспекты этого протокола будет варьироваться между бактериальных видов. Соответственно наиболее эффективным инфекционных дозы, соответствующей вирулентности и принимающих генотип восприимчивости должны все быть рассмотрены и идеально испытаны в экспериментальных исследованиях. Подвергая мух в бактериальных культурах диапазон оптических плотностей и измерения их инфекционных дозы и выживание является соответствующей отправной точкой при работе с новым бактериальных видов или летать линии.
Протокол шаги такие как летать голода до кормления и повторного приостановления бактериальных окатышей в растворе сахарозы 5% являются обычным явлением в инфекции ротовой полости и увеличить надежность бактериальной инфекции во время экспозиции7,8, 9 , 10. Однако, важно отметить, что во время экспозиции, летит по существу живут на поверхности бактериальной культуры. В процессе ходить на этой культуры, бактерии будут застрять на лету поверхности, особенно на кутикулу или вокруг щетина24. Эти epicuticular бактерий, не отражает успешный кишечную инфекцию, но по-прежнему будут обнаружены летать гомогенизации и обшивки. Чтобы уменьшить вероятность ложных срабатываний, важно для поверхности стерилизовать летит через погружение в 70% этанол до 1 мин.
При рассмотрении бактериальных пролить ставки, устные инфекции имеет важное значение. Количество патогенных микроорганизмов, которые хост высвобождения в окружающую среду часто трудно измерить и внутренней нагрузки часто воспринимается как прокси для тяжести инфекции и поэтому передача26,27. Измеряя бактериальной нагрузки наряду с бактериальной пролить позволяет изучение взаимосвязи между этими двумя важными компонентами тяжести и распространение болезней38. Одним из ограничений метода представил, что опробование внутреннюю бактериальной нагрузки мух требует разрушительной выборки. Это делает его трудно расследовать продольной тенденции роста возбудителя и разминирования в рамках того же лица. Однако это можно преодолеть это ограничение, деструктивно выборки когорты лиц на разных стадиях инфекции, в предположении, что средняя микробной нагрузки в каждом когорте отражает динамику продольной возбудителя в течение любого заданного Индивидуальные. Бактериальные пролить не страдают от те же ограничения, и мы предлагаем примеры как пролить может быть определена количественно в поперечного сечения образца, или продольно расследовать как пролить изменения внутри человека с течением времени.
Многие черты хост и возбудителя совместно определяют индивидуума склонность для передачи болезни25,26,39. Хотя значение этих черт, вероятно, колеблется между хост возбудитель системами, пролить, вероятно, основным фактором, определяющим фекально оральным механизмом передачи. Возможность измерения бактериальных пролить открывает возможность проверить это предположение. Охарактеризовав хост возбудитель динамика в желаемой группы летать линии, экспериментаторов может устно заразить людей и поместите их вместе с незараженным, подвержены хостов их инфекционных периоды. Эти «получателя» мухи может затем assayed для внутреннего бактериальной нагрузки в различные моменты времени как способ передачи измерительных непосредственно.
Благодарности
Эта работа была поддержана стратегического награду от Уэллком траст для центра иммунитет, инфекции и эволюция (http://ciie.bio.ed.ac.uk; Грант Справочник № 095831). PFV была поддержана Branco Weiss стипендий (https://brancoweissfellowship.org/) и стипендий канцлера (школа биологических наук, Эдинбургский университет); JASJ была поддержана НКРЭ E3 АКДС PhD студенчества.
Материалы
| Name | Company | Catalog Number | Comments |
| Vials | Sarstedt Ltd. | 58.490 | Polystyrene flat base tube 75mm x 23.5mm, 23ml |
| Agar | Sigma-Aldrich | A7002 | Agar, ash 2.0-4.5% |
| Brown sugar | Bidvest | 66032 | Light brown soft sugar |
| Maize | Dove's Farm | Organic maize flour | |
| Fermipan yeast | Bidvest | 96360 | Dry, instant yeast |
| Methyl-4-hydroxybenzoate | Sigma-Aldrich | H5501 | >=99.0%, crystalline |
| Sucrose | Sigma-Aldrich | 84097 | Sucrose BioUltra, for molecular biology, >=99.5% (HPLC) |
| Petri dishes | Fisher Scientific UK Ltd. | 15788517 | X600 Petri Dish 90 X 16.2MM Sterile Triple Vent |
| Falcon tubes (50ml) | Greiner Bio-one Inc | 210261 | Centrifuge tube, 50ml, skirted, bagged, sterile |
| Eppendorf tube (0.5ml) | Sarstedt Ltd. | 72.699 | Sarstedt Micro Tube Conical Base Push Cap 0.5ml Standard Neutral |
| Eppendorf tube (1.5ml) | Sarstedt Ltd. | 72.690.001 | Sarstedt Micro Tube Conical Base Push Cap 1.5ml Standard Neutral |
| Ethanol | VWR International Ltd. | 20821.33 | ETHANOL ABSOLUTE ANALAR NP ACS/R.PE - Analytical Grade |
| 2 L Conical Flask | VWR International Ltd. | 214-0038 | Narrow neck, 2 L Erlenmeyer flask |
| Sterile filter paper | Fisher Scientific UK Ltd. | 1001-020 | Plain circle and sheets; Particle Retention: greater than11um; Filtration speed: 150 herzberg; Air flow: 10.5s/100mL/in2; Medium porosity; Smooth surface; Grade 1; Type: circle; Dia: 20mm |
| Bijou sample container | Fisher Scientific UK Ltd. | 129A | 7ml polystyrene sample container |
| Pseudomonas isolation agar | Sigma-Aldrich | 17208 | Contains agar 13.6 g/L, magnesium chloride 1.4 g/L, peptic digest of animal tissue 20g/L, potassium sulfate 10g/L, triclosan 0.025g/L |
| LB broth, Miller | Fisher Scientific UK Ltd. | BP1426 | Contains 10g tryptone, 5g yeast extract, 10g sodium chloride per litre |
| Large Embryo Collection Cages | Scientific Laboratory Supplies Ltd. | 59-101 | Flystuff- fits 100mm petri dish |
| TRI reagent solution | Life Technologies | AM9738 | |
| 96-well microplate | Scientific Laboratory Supplies Ltd. | 353072 | Falcon 96 Well Clear Flat Bottom TC-Treated Polystyrene Cell Culture Microplate with Lid Sterile |
| Pestle | Fisher Scientific UK Ltd | 12649595 | Pestle, Presterilized; Axygen; Tissue grinder; Blue; Inert polypropylene construction; Fits 1.5 and 2.0mL centrifuge tubes; Individually wrapped; 100/Pk |
| Glycerol | Scientific Laboratory Supplies Ltd. | CHE2068 | Glycerol A.R. 99.5% 2.5 L |
| Cotton wool- non absorbent | Cowens Ltd | ABL | Non Absorbent Large quantity 20 bags x 500 |
| Cotton wool- absorbent | Cowens Ltd | ABS | BP small quantity 20 bags x 500 |
| Vortex | Fisherbrand | Whirlimixer 75W 50-6-Hz 220-240V | |
| Orbital incubator | Gallenkamp | INR-200-010V | 220 V, 50 Hz, 5 A. Nominal temperature: 70ºC. Shaking frequency: 0...400 rpm. |
| Absorbance Microplate Reader | Biotek Instruments Ltd | ELx808™ Absorbance Microplate Reader | |
| Gen 5 Microplate Reader and Imager Software | Biotek Instruments Ltd | For Absorbance Microplate Reader | |
| Centrifuge | Beckman Coulter | 392304 | Allegra X-12R Benchtop Centrifuge, refridgerated 50Hz 230V |
| Step One Plus Real Time qPCR System | Thermofisher Scientific | 4376600 | Applied biosystems Step One Plus real time qPCR system |
| Step One Software 2.3 | Thermofisher Scientific | For Stepone and SteponePlus real time qPCR systems | |
| R Statistical Software | https://cran.r-project.org/ | ||
| 10 µL pipette tips | Greiner Bio-one Inc | 741015 | Easlyload gilson-style. Graduated, clear, refill, 960 pcs |
| 200 µL pipette tips | Greiner Bio-one Inc | 741065 | Easlyload gilson-style. Graduated, clear, refill, 960 pcs |
| 1000 µL pipette tips | Greiner Bio-one Inc | 741045 | Easlyload gilson-style. Graduated, clear, refill, 960 pcs |
| 20 µL filtered pipette tips | Greiner Bio-one Inc | 774288 | Filter tip gilson-style. Clear, rack blue, single packed, R/Dnase free, 10 racks of 96pcs |
| 200 µL filtered pipette tips | Greiner Bio-one Inc | 739288 | Filter tip gilson-style. Clear, rack blue, single packed, R/Dnase free, 10 racks of 96pcs |
| 1000 µL filtered pipette tips | Greiner Bio-one Inc | 740288 | Filter tip gilson-style. Clear, rack blue, single packed, R/Dnase free, 10 racks of 60pcs |
Ссылки
- Hoffmann, J. A. The immune response of Drosophila. Nature. 426 (6962), 33-38 (2003).
- Buchon, N., Silverman, N., Cherry, S. Immunity in Drosophila melanogaster - from microbial recognition to whole-organism physiology. Nat Rev Immunol. 14 (12), 796-810 (2014).
- Bergman, P., Seyedoleslami Esfahani, S., Engström, Y. Drosophila as a Model for Human Diseases-Focus on Innate Immunity in Barrier Epithelia. Curr Top Dev Biol. 121, 29-81 (2017).
- Apidianakis, Y., Rahme, L. G. Drosophila melanogaster as a model host for studying Pseudomonas aeruginosa infection. Nat Protoc. 4 (9), 1285-1294 (2009).
- Khalil, S., Jacobson, E., Chambers, M. C., Lazzaro, B. P. Systemic Bacterial Infection and Immune Defense Phenotypes in Drosophila Melanogaster. JoVE J Vis Exp. (99), e52613-e52613 (2015).
- Neyen, C., Bretscher, A. J., Binggeli, O., Lemaitre, B. Methods to study Drosophila immunity. Methods San Diego Calif. 68 (1), 116-128 (2014).
- Nehme, N. T., et al. A Model of Bacterial Intestinal Infections in Drosophila melanogaster. PLOS Pathog. 3 (11), e173(2007).
- Bou Sleiman, M. S., Osman, D., Massouras, A., Hoffmann, A. A., Lemaitre, B., Deplancke, B. Genetic, molecular and physiological basis of variation in Drosophila gut immunocompetence. Nat Commun. 6, 7829(2015).
- Buchon, N., Broderick, N. A., Lemaitre, B. Gut homeostasis in a microbial world: insights from Drosophila melanogaster. Nat Rev Microbiol. 11 (9), 615-626 (2013).
- Kuraishi, T., Hori, A., Kurata, S. Host-microbe interactions in the gut of Drosophila melanogaster. Front Physiol. 4, (2013).
- Ha, E. -M., Oh, C. -T., Bae, Y. S., Lee, W. -J. A Direct Role for Dual Oxidase in Drosophila Gut Immunity. Science. 310 (5749), 847-850 (2005).
- Limmer, S., et al. Pseudomonas aeruginosa RhlR is required to neutralize the cellular immune response in a Drosophila melanogaster oral infection model. Proc Natl Acad Sci U S A. 108 (42), 17378-17383 (2011).
- Apidianakis, Y., Pitsouli, C., Perrimon, N., Rahme, L. Synergy between bacterial infection and genetic predisposition in intestinal dysplasia. Proc Natl Acad Sci U S A. 106 (49), 20883-20888 (2009).
- Vodovar, N., et al. Drosophila host defense after oral infection by an entomopathogenic Pseudomonas species. Proc Natl Acad Sci U S A. 102 (32), 11414-11419 (2005).
- Chugani, S. A., Whiteley, M., Lee, K. M., D'Argenio, D., Manoil, C., Greenberg, E. P. QscR, a modulator of quorum-sensing signal synthesis and virulence in Pseudomonas aeruginosa. Proc Natl Acad Sci. 98 (5), 2752-2757 (2001).
- Gupta, V., Vasanthakrishnan, R. B., Siva-Jothy, J., Monteith, K. M., Brown, S. P., Vale, P. F. The route of infection determines Wolbachia antibacterial protection in Drosophila. Proc R Soc B. 284 (1856), 20170809(2017).
- Martins, N. E., Faria, V. G., Teixeira, L., Magalhães, S., Sucena, É Host Adaptation Is Contingent upon the Infection Route Taken by Pathogens. PLoS Pathog. 9 (9), (2013).
- Chambers, M. C., Jacobson, E., Khalil, S., Lazzaro, B. P. Thorax Injury Lowers Resistance to Infection in Drosophila melanogaster. Infect Immun. 82 (10), 4380-4389 (2014).
- Gupta, V., Stewart, C., Rund, S. S., Monteith, K., Vale, P. F. Costs and benefits of sublethal Drosophila C virus infection. J Evol Biol. , (2017).
- Ferreira, ÁG., Naylor, H., Esteves, S. S., Pais, I. S., Martins, N. E., Teixeira, L. The Toll-Dorsal Pathway Is Required for Resistance to Viral Oral Infection in Drosophila. PLoS Pathog. 10 (12), (2014).
- Buchon, N., Broderick, N. A., Poidevin, M., Pradervand, S., Lemaitre, B. Drosophila Intestinal Response to Bacterial Infection: Activation of Host Defense and Stem Cell Proliferation. Cell Host Microbe. 5 (2), 200-211 (2009).
- Wayland, M. T., et al. Spotting the differences: Probing host/microbiota interactions with a dedicated software tool for the analysis of faecal outputs in Drosophila. J Insect Physiol. 69, 126-135 (2014).
- Hori, A., Kurata, S., Kuraishi, T. Unexpected role of the IMD pathway in Drosophila gut defense against Staphylococcus aureus. Biochem Biophys Res Commun. 495 (1), 395-400 (2018).
- Ren, C., Webster, P., Finkel, S. E., Tower, J. Increased Internal and External Bacterial Load during Drosophila Aging without Life-Span Trade-Off. Cell Metab. 6 (2), 144-152 (2007).
- Ezenwa, V. O., et al. Host behaviour-parasite feedback: an essential link between animal behaviour and disease ecology. Proc R Soc B. 283 (1828), 20153078(2016).
- McCallum, H., et al. Breaking beta: deconstructing the parasite transmission function. Phil Trans R Soc B. 372 (1719), 20160084(2017).
- Vale, P. F., Choisy, M., Little, T. J. Host nutrition alters the variance in parasite transmission potential. Biol Lett. 9 (2), 20121145(2013).
- Mulcahy, H., Sibley, C. D., Surette, M. G., Lewenza, S. Drosophila melanogaster as an Animal Model for the Study of Pseudomonas aeruginosa Biofilm Infections In Vivo. PLoS Pathog. 7 (10), e1002299(2011).
- Kuraishi, T., Binggeli, O., Opota, O., Buchon, N., Lemaitre, B. Genetic evidence for a protective role of the peritrophic matrix against intestinal bacterial infection in Drosophila melanogaster. Proc Natl Acad Sci. 108 (38), 15966-15971 (2011).
- Myllymäki, H., Valanne, S., Rämet, M. The Drosophila Imd Signaling Pathway. J Immunol. 192 (8), 3455-3462 (2014).
- Lewis, E. A new standard food medium. Cold Spring Harb Protoc. 2014 (9), pdb.rec081414(2014).
- Bolker, B. M., et al. Generalized linear mixed models: a practical guide for ecology and evolution. Trends Ecol Evol. 24 (3), 127-135 (2009).
- R Core Team. R: A Language and Environment for Statistical Computing. , R Foundation for Statistical Computing. Vienna, Austria. (2015).
- Schmittgen, T. D., Livak, K. J. Analyzing real-time PCR data by the comparative CT method. Nat Protoc. 3 (6), 1101-1108 (2008).
- Kalbfleisch, J. D., Prentice, R. L. The Statistical Analysis of Failure Time Data. , 2nd Edition, Wiley-Blackwell. Hoboken, N.J. (2002).
- Nuhanen, B. Drosophila melanogaster, drawing.SVG. , Available from: https://commons.wikimedia.org/wiki/File:Drosophila-drawing.svg (2007).
- Accountalive. Example of a survival curve estimated by Kaplan-Meier method including 95% confidence limits. , Available from: https://commons.wikimedia.org/wiki/File:Kaplan-Meier-sample-plot.svg (2011).
- Susi, H., Vale, P. F., Laine, A. -L. Host Genotype and Coinfection Modify the Relationship of within and between Host Transmission. Am Nat. 186 (2), 252-263 (2015).
- Fellous, S., Duncan, A. B., Quillery, E., Vale, P. F., Kaltz, O. Genetic influence on disease spread following arrival of infected carriers. Ecol Lett. 15 (3), 186-192 (2012).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены