Method Article
Характеристика гликопротеины с складке иммуноглобулина рентгеноструктурного анализа и биофизических методов
В этой статье
Резюме
Мы представляем подходы для биофизических и структурные характеристики гликопротеины с складке иммуноглобулина biolayer интерферометрии, изотермические титрования калориметрии и рентгеноструктурного анализа.
Аннотация
Гликопротеинов на поверхности клеток играют решающую роль в клеточных функций, включая сигнализации, адгезии и транспорта. На лейкоциты некоторые из этих гликопротеинов обладают складки иммуноглобулина (Ig) и центральную роль иммунного распознавания и регулирование. Здесь мы представляем платформу для дизайна, выражения и биофизические характеристики внеклеточного домена рецептора CD22 B клеток человека. Мы предлагаем, что эти подходы широко применяются для характеризации ectodomains млекопитающих гликопротеин, содержащий Ig доменов. Два подвеска человеческих эмбриональных почек (ГЭС) клеточных линий, HEK293F и HEK293S, используются для выражения гликопротеинов, укрывательство комплекс и высокой маннозы гликаны, соответственно. Эти рекомбинантных гликопротеинов с различными glycoforms позволяют расследования эффект glycan размера и состава на Связывание лиганда. Мы обсуждаем протоколы для изучения кинетика и термодинамика гликопротеина привязки биологически соответствующих лигандов и терапевтических антител кандидатов. Рекомбинантных гликопротеинов, производимых в HEK293S клетках поддаются кристаллизации вследствие однородности glycan, снижение гибкость и восприимчивость к endoglycosidase H лечения. Мы представляем методы для замачивания гликопротеина кристаллы с тяжелых атомов и малых молекул для этапа определения и анализа Связывание лиганда, соответственно. Экспериментальные протоколы обсудили здесь перспективны для характеристики млекопитающих гликопротеинов дать проницательность в их функции и исследовать механизм действия терапевтических средств.
Введение
Поверхностные белки играют решающую роль в клеточных функций. Через их внеклеточных доменов эти мембранных белков может модулировать ячеек взаимодействий, адгезии, транспорта и сигнализации1,2. Внеклеточные локализации этих белков делает их привлекательной цели для развития терапии для лечения широкого спектра заболеваний, включая рак и аутоиммунные заболевания3,4,5 , 6 , 7. одним из наиболее распространенных складки человека мембранных белков ectodomains является иммуноглобулина как раз (Ig), который формируется семь или более β-стренги аранжированы в двух β-листы8,9. Как правило Ig содержащих гликопротеинов являются мульти доменных структур с доменами Ig, последовательно расположенных на внеклеточные часть мембранных белков10. Было показано, что столб-поступательные изменения этих белков клетк поверхности, особенно связанных с N и O гликозилирования, играть существенную роль в их регулирования, складывающиеся, секреции и функции11. Для улучшения нашего понимания их функции и лучше дизайн терапии, которые можно ориентировать их, требуются методы, позволяющие их подробные молекулярная характеристика. Здесь мы представляем сочетание методов, которые позволяют для биофизических (biolayer интерферометрии (BLI) и изотермические титрования калориметрии (ЦМТ)) и структурных (рентгеноструктурного) Характеристика внеклеточного домена Ig содержащих мембранных гликопротеинов, самостоятельно и в комплексе с их биологически соответствующих лигандов и терапевтические молекулы (рис. 1).
N-связаны гликозилирования является одним из наиболее распространенных изменения после перевода на млекопитающих белки и происходит во время созревания белка в эндоплазматический ретикулум и аппарат Гольджи12,13. Клеточных линий, таких как 293 клеток человеческого эмбриона почек (ГЭС), были разработаны для рекомбинантных выражение большого количества гликозилированного млекопитающих белки14,15. Эта линия клетки был разработан в формате подвеска, который позволяет для удобства наращивания производства белок в больших количествах по сравнению с линии адэрентных клеток. Здесь, мы используем две линии клетки HEK293: HEK293F и HEK293 Gnt я- / - (HEK293S), которые отличаются отсутствием трансферазы N-acetylglucosaminyl I (Gnt я) в последнем. В свою очередь производство сложных гликанов (как увидено в HEK293F) не представляется возможным и вместо высоких маннозы тип гликанов (преимущественно человек5GlcNAc2) проживают в N-связаны glycan сайты18,19,20 . Использование этих двух клеточных линий параллельно позволяет изучать влияние glycan размера и сложности на биологические функции и терапевтические ориентации. Действительно гликопротеинов, производимых в HEK293F клетках будет иметь более крупных, более сложных гликаны, по сравнению с же гликопротеин, производимых в HEK293S клетках. Гликопротеины, производимых в HEK293S клетках больше поддаются кристаллизации, из-за сокращения химических и конформационные неоднородности их N-связаны гликанов. Для дальнейшего повышения crystallizability, гликопротеинов, производятся в HEK293S (но не HEK293F) клетки можно лечить с помощью фермента endoglycosidase Ч (Endo), что приводит к декольте высокой маннозы гликанов такие, что только один N-acetylglucosamine (GlcNAc) остаток остается на каждый сайт гликозилирования связанные N21,22. Другие методы также может использоваться для ограничения потребления ресурсов обработкой N-glycan внутри клетки, такие как добавление ингибиторов гликозилтрансферазы во время выражения гликопротеин, включая kifunensine23. Альтернативные подходы включают выражения родной гликопротеинов (в HEK293F клетках) на ферментативную deglycosylation, используя пептиды N-гликозидазы F (PNGaseF). Однако deglycosylation с PNGaseF было показано, быть менее эффективной в родной условиях и увеличивает агрегации в некоторых белков; в тех случаях, когда белок остается растворимых после лечения, он приобретает негативные расходы на его поверхности из-за deamidation аспарагин остаток аспарагиновой кислоты24, которая может быть пагубным для его кристаллизации. Предсказал N-гликозилирования сайты могут также быть мутировал, чаще всего аланина или глютамина остатков, для предотвращения связанных с N гликозилирования на этих сайтах и генерировать гликопротеина образцы высокой однородности. Кроме того гликопротеины может производиться в других эукариотических клеточных культурах, включая дрожжей, насекомое и систем растений или других млекопитающих клеточных линий, например китайского хомяка яичников (Чо) клетки16,17.
Многие векторы млекопитающих выражения, включая pHLsec, позволяют секрецию рекомбинантных гликопротеин ectodomains в клетки средних25. Секрецию гликопротеинов из HEK293 клеток позволяет для быстрой и легкой очистки без необходимости лизис клеток. Добавление тегов очистки (например, его тег, Strep тег, флаг тег, Myc-, ха тег) N или C конечной цели гликопротеина позволяет очистки хромотографией сродства пошагово. Впоследствии гель-проникающей хроматографии размера может использоваться для принести монодисперсных образца для биофизических и структурных характеристик.
Очень чистые и однородные гликопротеина образца при соответствующих условиях может привести к хорошо Дифрагирующая кристаллов. После получения набора данных полный дифракции рентгеновских лучей от таких кристаллов начальные этапы должны определяться для расчета плотности электронов гликопротеина. Благодаря все большее количество структур в банк данных белков (PDB) наиболее часто используемый метод для постепенного на сегодняшний день стала молекулярной замены (MR), который использует структуру соответствующих белков для получения начальных этапов26. Однако когда Мистер не удается решить проблему фазы, как иногда случае для мульти Ig домена гликопротеинов27,28,29, требуются альтернативные методы. В этой статье мы подробно метод замочить кристаллы с тяжелых атомов (HA) для постепенного, который необходим для решения структуры CD22 ectodomain28. Выявление право HA для постепенного это итеративный процесс, который зависит от реактивности HA, доступные атомов в гене гликопротеина в иной кристаллической решетки и кристаллизации раствора30,31. В качестве альтернативы атомы естественным серы в метионина и цистеина остатков может быть использован для поэтапного Если присутствующие на достаточно высокий коэффициент для других атомов в гене гликопротеина, и если рентгеновская дифрактометрия данные могут быть собраны с достаточно высокой избыточности32, 33.
Биологические функции мембранных гликопротеинов часто опосредовано белок белковых взаимодействий или взаимодействий протеин лиганд, такие как углеводы. Когда лигандом является достаточно небольшим, чтобы диффундируют из решения на сайт связывания гликопротеина в кристаллической решетке, замачивания экспериментов может быть успешным для получения совместного Кристаллическая структура гликопротеин лиганд лучше понять лигандом признание.
Протоколы, представленные здесь также актуальны для понимания взаимодействия поверхностных гликопротеинов с синтетических лечебная лигандам34,35 и антитела терапии36,37. В сочетании с структурной информацией, привязка кинетика и термодинамика может быть мощным, чтобы понять и усовершенствовать их механизмы действий. Один метод, который позволяет для кинетического анализа терапевтических антител, привязка к гликопротеин — BLI38,39. BLI использует биодатчики с иммобилизованными лигандом для измерения кинетики ассоциации и диссоциации с партнером привязки, в конечном счете определить константу равновесия диссоциации (DK). BLI является привлекательным подход, потому что небольшое количество гликопротеинов требуются (< 100 мкг), эксперимент время быстро (~ 10-15 мин на запуск), и он может быть автоматизирован. ЦМТ также полезна для изучения сходства между гликопротеинов и привязки партнеров40,,4142,43. Хотя ЦМТ больше времени и реагента интенсивный, можно получить ценную информацию относительно Термодинамика взаимодействия (ΔG, ΔH, ΔS и стехиометрии). ЦМТ также очень полезно для изучения слабых взаимодействий, которые часто связаны с временной привязкой поверхностных гликопротеинов с лигандами. Кроме того эти методы можно использоваться совместно оценить привязки различных конструкций и оценить эффект различных связанных с N glycoforms, полученные от выражения гликопротеина в различных клеточных линий. Выполнение BLI и МТЦ с гликопротеинами производится в HEK293F, HEK293S и относились с Endo H может обеспечить углубленный обзор роли гликанов в биологической активности и терапевтические взаимодействия.
Мы успешно применяются эти протоколы характеризовать внеклеточного домена (ECD) человека CD2228, гликопротеин, членом семьи лектинов (Siglecs) Ig подобных сиаловая кислота привязки, который необходим для поддержания гомеостаза B-клеточной44 . Мы выступали углубленного конструкция конструкция для облегчения кристаллизации и постепенно рентгеновского dataset путем замачивания с Hg HA. Мы также пропитанной CD22 кристаллы с его лиганда сиаловая кислота (α2-6 sialyllactose) для получения структура комплекса иммунной рецептор лиганд и таким образом обеспечили чертежи для разработки структуры руководствуясь glycan mimetics45,46. Кроме того, мы создали связывание антигена фрагмент (ФАБ) epratuzumab терапевтических антител анти CD22 - терапевтические кандидат в настоящее время фазы III клинических испытаний для неходжкинской лимфомы47- определить его сродство к BLI и ЦМТ дифференциально гликозилированного CD22 ECD конструкции. Эти исследования выявили важную роль для N-связаны гликозилирования в epratuzumab взаимодействия, потенциальные последствия для распознавания CD22 на неблагополучных клетки B.
протокол
1. построить дизайн для гликопротеина ECD
- Оценивать аминокислотной последовательности человека CD22 (Uniprot) использование серверов InterPro и Phyre2 для идентификации элементов предсказал домена и границ расположен в пределах48,белка49.
- Клонировать последовательности человека CD22, отсутствует сигнал пептида, трансмембранного и цитозольной домены (остатки 20-687, далее CD22 внеклеточного домена, CD22 РДРВ) в25 pHLsec вектор млекопитающих выражение с помощью энзимов ограничения АИОД и KpnI ( Рисунок 2 A) 50.
Примечание: Вектор pHLsec оптимизирована для гиперэкспрессия водорастворимые, секретируемые белки в mammalian клетках25. Этот вектор содержит секрецию сигнал для внеклеточного секрецию растворимых гликопротеинов. pHLsec содержит тег6 x C-терминал (его) для облегчения очищение сродства от supernatants клетки, с использованием иммобилизованных метал близость методов хроматографии. - Клонировать усеченного конструкции CD22 РДРВ с последовательного удаления C-терминал Ig доменов: домены 1-6 (остатки 20-687), домены 1-5 (остатки 20-592), домены 1-4 (остатки 20-504) и домены 1-3 (остатки 20-330) (цифры 2B и 2 C)50 .
- Оцените первичной последовательности CD22 РДРВ с помощью сервера NetNGlyc для выявления предсказал гликозилирования N-связанных сайтов, присутствующих в конструкции51.
- С помощью сайта направленного мутагенеза, стандартные протоколы52 или наложением ПЦР53, мутировать каждого сайта предсказал гликозилирования связанные с N (Asn для Gln или Asn для Ала) для создания конструкций CD22 РДРВ, которые содержат один или несколько N-связаны гликозилирования мутации.
- После проверки последовательности клонированных конструкций, превратить в сведущее Escherichia coli DH5α клетки54 и макси prep ДНК (согласно инструкциям производителя) для подготовки к трансфекции.
2. HEK293F и HEK293S клеток создание
Примечание: Все манипуляции HEK293F или HEK293S клеток с необходимые реагенты и оборудование должны быть выполнены в объекте 2-го уровня биобезопасности в подходящей биобезопасности кабинета. Внешней поверхности всех элементов должны быть простерилизованы с 70% этанола раствор или эквивалентные реагента.
- Получить HEK293F и HEK293S подвеска клетки (см. Таблицу материалы) и хранить при температуре-80 ° С до готовности для использования.
- Теплый СМИ (см. Таблицу материалы) за 1 ч в ванну воды 37 ° C. Трансфер 24 мл утепленные СМИ в 125 мл озадачен клетки культуры колба с крышкой вентилируемые.
- Получите 1 мл клеток аликвота от-80 ° C и передачи в лед.
- Инкубируйте клетки в ванну воды 37 ° C приблизительно 1 мин, чтобы частично оттепель клетки. Передача 1 мл клеток из флакона в колбу культуры озадачен клетки 125 мл, содержащие средства массовой информации.
- Закройте колбу культуры клеток с вентилируемые крышку и место колбу в шейкере, 37 ° C, 130 об/мин, влажность 70% и 8% CO2.
3. HEK293 Ячейки обслуживание
Примечание: Плотность клеток и жизнеспособность клеток должно быть проверено около 24 ч после оттаивания. Этот шаг гарантирует, что клетки восстанавливаются после прививки; первоначальный жизнеспособности должно быть > 80%.
- Тщательно удалить 10 мкл клеток из 125 мл флакон, содержащий свежие подвеска клетки и перевести его в стерильных 1,5 мл микропробирок. Закройте колбу и вернуть его в инкубаторе.
- Пипетка 10 мкл раствора Трипановый синий в 1,5 мл микропробирок, содержащие клетки, тщательно перемешать и передачи 10 мкл в палату подсчета слайдов.
- Положите подсчета слайдов в счетчик автоматическое клеток и получения значений для плотность клеток (в единицах клетки мл-1) и жизнеспособность клеток (в процентах).
- Рассчитайте объем ячейки, которые должны будут прививать культуру свежий 200 мл на окончательной плотности ~0.8 x 106 клеток мл-1 с помощью следующих уравнений:
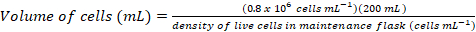 (1)
(1)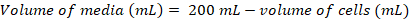 (2)
(2)
Примечание: Это может занять ~ 5 d получить подходящую ячейку плотность для прививки в культуру, 200 мл. - После плотность клеток является достаточным для инокуляции 200 мл культуры, СМИ прогрева за 1 ч при 37 ° C воды ванна и передавать утепленные СМИ в кабинете биобезопасности.
- Необходимый объем средств массовой информации (рассчитывается в уравнение 2) тщательно используя Серологические Пипетки, перевести в 500 мл озадачен клетки культуры колба с крышкой вентилируемые.
- С помощью Пипетки серологические, передача необходимый объем подвеска клеток (рассчитывается в уравнении 1) в колбу культуры озадачен клеток 500 мл, содержащие средства массовой информации.
- Cap новых фондовых обслуживания 200 мл и вернуть его в инкубаторе. Рост клеток к плотности примерно 3 х 106 клеток мл-1. Проход клетки на плотность 0,8 x 106 клеток мл-1 каждые 2-3 d для поддержания стабильной культуры клеток (как описано в разделе 3.4-3.7). Не позволяют клеткам превышает плотность ~ 4 х 106 клеток мл-1.
4. transfection клетки HEK293 гликопротеин выражения
- Рассчитать объем клеток и средств массовой информации, которая требуется для 200 мл культуры для transfection 0,8 x 106 клеток мл-1 (с помощью уравнения 1 и 2 из раздела 3.4).
Примечание: Количество 200 мл transfections, которые могут быть выполнены зависит плотность клеток поддержание запасов. - Передача необходимый объем средств массовой информации и клетки для transfection в новой колба культуры клеток 500 мл с вентилируемые крышку и возвращение ячейки запаса в инкубатор.
- Инкубируйте клетки за 1 ч до трансфекции разрешить клетки для акклиматизации следующие расщепления.
- Передача 50 мкг ДНК в стерильных 50 мл Конические трубки и разбавляют 5 мл средств массовой информации. Вакуумный фильтр разреженных ДНК с помощью системы фильтрации 0,22 мкм в другой стерильную пробирку.
- Смесь разбавляют, фильтруют ДНК в соотношении 1:1 Масса: объем с реактивом transfection. Аккуратно водоворот ДНК: трансфекции реагент решение смешивать и инкубировать решение при комнатной температуре в течение 10 мин.
- ДНК: трансфекции реагент решение добавьте непосредственно к клеткам. Инкубируйте transfected клеток при 37 ° C, 130 об/мин, влажность 70%, 8% CO2 в шейкер для 5-7 d.
5. Оптимизация условий Transfection клетки
Примечание: Для оптимизации условий transfection клетки для максимальной гликопротеина урожайности, transfect клеток на различных плотностей первоначальная клеточная и оценить урожайность белка во времени (рис. 3А). Transfect клетки, как описано в разделе 4, при плотностях первоначальная клеточная, начиная от 0,5 x 106 -2 х 106 клеток мл-1 55. Пробная transfections может быть уменьшен до общего объема 25 мл (в 125 мл озадачен клетки культуры колбу) с 6 мкг ДНК для экономии места и реагенты. Количество ДНК также может быть оптимизирован55.
- После трансфекции каждый день (1-7 дней), передача 500 мкл Алиготе из клеточной культуры в стерильных 1,5 мл микропробирок (в кабинете биобезопасности).
- Спина aliquoted клеток на 12000 g x 5 мин в microcentrifuge сразу же после сбора. Передавать супернатант новый 1,5 мл микропробирок и хранить при 4 ° C до тех пор, пока на всех образцах получены.
- Quantitate секретируемые гликопротеин, денситометрия
- Получив все образцы, аликвота 20 мкл каждого образца в новой Микропробирка 1.5 мл и смешать с 6 мкл-сокращение 4 буфера выборки x Laemmli.
- Сварите образцы для 5 мин при 95 ° C в термо блоке. Спиновые образцов за 1 мин на 12000 x g в microcentrifuge.
- Загрузите 20 мкл каждого образца в скважину в градиента геля SDS-PAGE 10-Ну 4-15%. Включать одной полосы для белка размер маркеров. Побегите гель на 250 V на 20 мин в буфер Tris/глицин/СДП.
- После завершения выполнения, передачи гель Кумасси пятна (см. Таблицу материалы) на 20 мин де пятна геля ddH2O 20 мин гель изображения.
- Выполняют денситометрия с ImageJ, следуя стандартным протоколам57,58.
- Компилировать и печати данных с «дней после трансфекции» на оси x и «денситометрия значения» на вертикальной оси (рис. 3А).
Примечание: в качестве альтернативы, если выражение протеина является недостаточным для визуализации на SDS-PAGE, методы, такие как Западный blotting может быть используемые56.
- Quantitate секретируемые гликопротеин, BLI
- С помощью Ni-НТА биодатчики, quantitate количество выделяется гликопротеин с помощью BLI59.
- Компилировать и печати данных с «дней после трансфекции» на оси x и «концентрацию белка (мкг/мл)» на вертикальной оси (рис. 3А).
6. Очистка растворимых гликопротеина от HEK293 супернатант
- Урожай клетки центрифугированием при 6,371 g x 20 мин при 4 ° C. Сохранить супернатанта, содержащие секретируемые CD22 РДРВ и фильтр с помощью фильтра 0.22 мкм.
- Загрузить супернатант в 4 мл мин-1 на предварительно уравновешенной (20 мм трис рН 9,0, 150 мм NaCl, 5 мм имидазола) Ni-НТА столбец (5 мл тома) с помощью системы хроматографии benchtop.
Примечание: Другие методы очистки на основе сходства могут использоваться, основанный на схожести теги, включены в дизайн конструкции в разделе 1. - После супернатанта погрузки, промойте колонку сходства с 3-4 столбца томов (CV) мыть буфера (20 мм трис рН 9,0, 150 мм NaCl, 5 мм имидазола).
- Элюировать очищенный гликопротеина из столбца с использованием градиента 4-100% (4 CVs) буфера (20 мм трис рН 9,0, 150 мм NaCl, 500 мм имидазола) во время сбора фракций (рис. 3B).
- Бассейн фракций, содержащих eluted пик в устройство центробежной фильтрации с 10 кДа номинального молекулярного веса предел (NMWL) и концентрата центрифугированием на 4000 x g при 4 ° C для 15 минут или до тех пор, пока образец достигает объем 500 мкл.
- Привнести концентрированной гликопротеина в 500 мкл пример цикла и нагрузки на 0,5 мл мин-1 на предварительно уравновешенной (20 мм трис, рН 9,0, 150 мм NaCl) высокой производительности размер исключение колонка (примерно 24 мл тома) на быстрый протеин жидкостной хроматографии (ПСОК) система при 4 ° C во время сбора фракций (рис. 3C).
- Побегите гель SDS-PAGE eluted фракций для выявления фракций, содержащих гликопротеин и бассейн соответствующей фракции. Геля SDS-PAGE может запускаться как описано в разделе 560.
7. Deglycosylation очищенный гликопротеина
- Измерить концентрацию очищенный протеин после гель-проникающей хроматографии размер с помощью поглощения в 280 Нм разделить на коэффициент вымирания (например, 1.418 M-1 см-1 CD22 РДРВ).
Примечание: Теоретические вымирания коэффициент протеинов интереса могут рассчитываться с использованием серверов, таких как ExPASy ProtParam61. - Инкубируйте очищенный протеин с Endo H за 1 ч при 37 ° C, в соотношении 1 мг очищенного белка до 10 мкл коммерческих фермента в 1 X Endo H буфера (согласно инструкциям производителя).
Примечание: Endo H расщепляет высокой маннозы гликанов производится в HEK293S оставив одну группу GlcNAc на каждый сайт гликозилирования21. Endo H не прилепится гликанов на белки, производимых в HEK293F клетки22, однако другие ферменты могут быть использованы для этой цели (например,PNGaseF24). - Концентрат deglycosylated РДРВ в 500 мкл и запустить гель хромотографии фильтрации по столбцу исключения высокой производительности размер (примерно 24 мл тома) на 0,5 мл мин-1 на ПСОК для удаления Endo H и отдельные любые результирующие агрегатов.
- Храните deglycosylated белков на 4 ° C до использования в нижнем течении экспериментов.
8. кристаллизация гликопротеинов
Примечание: Выполнение процессов кристаллизации, использование коммерчески доступных экранов и настроить сидя падение эксперименты с использованием робота кристаллизации.
- Концентрат чистый, deglycosylated ECD-10 мг мл-1 с помощью центробежной фильтрации устройства с 10 кДа NMWL на 4000 x g (4 ° C) до получения желаемой концентрации.
- Определить концентрацию белка с помощью поглощения в 280 Нм и разделить на коэффициент вымирания.
- Центрифуга образца на 12000 g x 5 минут при температуре 4 ° C до испытания кристаллизации, чтобы удалить нежелательные пыли и других загрязнений из образца.
- Заполните резервуар скважин 96-луночных сидя падение кристаллизации пластины с 80 мкл кристаллизации раствора с экрана коммерческих кристаллизации.
Примечание: Мы используем разреженных матриц коммерческих экраны, которые были разработаны на основе самых успешных условий кристаллизации в отношении структуры в PDB. - С помощью робота кристаллизации, отказаться от капель в колодец кристаллизации пластины с общее падение объемом 200 nL в соотношении очищенный белок: кристаллизации раствора 1:1.
- После того, как вся плита обошелся, уплотнение пластину с лентой и место в тарелку тепловизор для осмотра видимым и ультрафиолетовым светом.
- Осмотрите кристаллизации пластины сразу же после установки и в течение следующих недель, используя как видимые, так и ультрафиолетового света для определения условий, которые дают начальный гликопротеина кристалл хитов.
- Дальнейшей оптимизации кристаллы, полученные из первоначального кристаллизации хитов с помощью тонкой экраны, основанные на состоянии кристалл хит или случайная матрица микро сидинга методы62,63,64,65.
- Крио защищать любые кристаллы не хватает достаточного крио Протравитель в состояние кристаллизации путем замачивания кристалл в мать ликера решение дополнить раствором глицерина 20% (v/v) (или эквивалентные крио Протравитель, например этиленгликоль или Полиэтиленгликоль 400).
- Гора кристаллы в cryoloops и вспышки заморозить их в жидком азоте до сбора данных на домашней источник дифрактометр или с использованием синхротронного излучения.
9. поэтапное использование тяжелых Atom деривации
Примечание: Перед любой манипуляции HA соединений, аспекты безопасности должны быть рассмотрены. HA соединений, используемых в кристаллография протеина выбраны для их сильное сродство для биологических молекул и представляют риски для здоровья человека от длительного воздействия. Принять меры безопасности для соединений ха, как упомянуто в их листы данных безопасности материалов.
- Для тестирования различных соединений HA, концентрации и инкубации раз, воспроизводить хорошо Дифрагирующая кристаллы, полученные в разделе 8 в 24-ну кристаллизации пластину, используя метод диффузии паров висит падение66.
- Решить, какие HA будет использоваться для деривации кристалл. Серверы (например, тяжелых атом базы данных системы67) может помочь с ха составные отбора, обеспечение того, что они подходят для состояния белков и кристаллизации.
Примечание: HA экраны также доступны коммерчески легко отбора наиболее эффективных HA соединений для постепенного. Набор «магия семь» HA соединений были ранее описал имеют высокую вероятность успеха для HA деривации68. - Настройка Рабочая станция для HA замачивания (рис. 4A). С помощью cryoloop, быстро передавать кристаллы 0,2 мкл падение на 22 мм крышка выскальзования, содержащие HA раствор разбавляют в состоянии кристаллизации, таким образом, что конечная концентрация HA колеблется от 1-20 мм. Печать падение и проинкубируйте различных промежутков времени (рис. 4B). Хорошей отправной точкой является 5, 10, 60 и 90 мин, так и на ночь.
- Осмотрите кристаллы с световой микроскоп для выявления возможных трещин или изменения цвета, который может указывать отрицательные эффекты гликопротеина кристалл или кристалл деривации.
- Крепление кристаллов в cryoloops и кристаллы обратно замочить на 30 s в трех последовательных 0.2 мкл капли содержащий мать ликер раствор с 20% (v/v) глицерина (или альтернативного крио Протравитель)69. Обратно замачивание кристаллы удаляет HA составные неспецифически был связан и уменьшает частичное размещение, вызванные слабым HA привязки. Флэш-кристаллы замораживание в жидком азоте (Рисунок 4B).
- Для сбора данных, обработки, структура решения и изысканности используйте ранее описанные протоколы26,70,,7172.
10. замачивания гликопротеина кристаллы с его лиганда
- Воспроизведение хорошо Дифрагирующая кристаллы, полученные в разделе 8 в 24-ну кристаллизации пластине с помощью метода диффузии пара подвески падение.
- Подготовьте Стоковый раствор 50 мм лиганд в 20 мм трис, рН 9,0, 150 мм NaCl.
Примечание: Концентрация лигандом должен быть подготовлен согласно близость к его гликопротеина. Если соответствия неизвестно, может потребоваться использовать метод как ЦМТ (раздел 12,2) для определения схожести до начала замачивания экспериментов. Убедитесь, что лигандом растворим в нужной концентрации в буфере необходимые. - Добавьте различной концентрации лигандом падение кристаллов содержащий РДРВ и уплотнение падение для инкубации на время длины в диапазоне от 5 мин до 5 d.
- Визуально отслеживать кристаллы с световой микроскоп для выявления возможных изменений в морфологии.
- Монтажа кристаллов в cryoloops и крио-защищать их в маточный раствор ликер с 20% (v/v) глицерина (или другие крио Протравитель например этиленгликоль или низкой молекулярной массой полиэтиленгликоля 400)69.
- Для сбора данных, обработки, структура решения и изысканности используйте ранее описанные протоколы73,74,75.
11. производство фрагмент антигена привязки (ФАБ)
- Subclone генов, которые соответствуют потрясающий тяжелой цепи (HC) и лёгкие цепи (LC) последовательности антител анти ECD, например,epratuzumab.
Примечание: в качестве альтернативы, IgG может быть расщепляется, Фермент папаин для создавать ВСБ фрагменты76. - Transfect клетки, как описано в разделе 4, со следующими изменениями:
- Использование общей массы ДНК для transfection Fab фрагментов 90 мкг на 200 мл культуры.
- Transfect HC и LC плазмид в соотношении 2:1, чтобы уменьшить количество LC димер формирования.
- После 7 d инкубации урожай клетки, сохраняют супернатант и фильтр с устройством вакуум управляемой фильтрации 0,22 мкм.
- Сбалансировать анти LC (Каппа или лямбда) сродство столбцов в буфере PBS с помощью системы хроматографии benchtop.
Примечание: Если образование димера LC является проблемой во время очистки, белок G хромотографию сродства может использоваться как альтернатива очищение сродства LC Каппа/лямбда. - Загрузить супернатант на соответствие столбца 4 мл мин-1. После загрузки образца, промойте колонку с 3-4 CVs PBS.
- Элюировать белка из столбца с помощью Изократические элюирование с 100 мм глицин, pH 2.2, немедленно нейтрализации eluted фракций с 10% (v/v) 1 М трис, рН 9,0 в каждой фракции.
Примечание: Eluted Fab может быть неразделимая ионообменной хроматографии и/или размер гель-проникающей хроматографии с использованием ПСОК при 4 ° C.
12. характеристика ВСБ и малые молекулы, привязка к гликопротеина
- Biolayer интерферометрия
- Подготовка 50 мл 1 x кинетики буфера (ПБС, 0,002% (v/v) Tween-20, 0,01% (w/v) BSA).
- Гидрат шесть биодатчики Ni-НТА в 200 мкл 1 x кинетики буфера для 10 мин в пластине предварительного смачивания.
- Разбавьте его с тегами РДРВ в 1 мл буфера кинетики 1 x в конечной концентрации 25 нг мкл-1. Пипетка серийных разведений очищенный Fab в 200 мкл 1 x кинетики буфера, с высокой концентрацией 500 Нм и последующие серийных разведений 250 Нм, 125 Нм и 62,5 Нм.
- Аликвота реагенты в черный плоское дно полипропиленовые 96-луночных микропланшетов как показано на рис. 5A, где каждый хорошо содержит 200 мкл указанного решения.
- Сбор данных с помощью анализов кинетики в программное обеспечение для сбора данных, как описано ранее38,,3977 (рис. 5A).
- Вкратце, передачи биодатчики в скважины, содержащие 1 x кинетики буфер для базовой для 60 s перед загрузкой 25 мкл нг-1 гликопротеина для 240 s (или до порога 1.0 Нм достигается) при 1000 об/мин.
- После второго базового плана 60 s в 1 x кинетики буфера, передачи биодатчики в скважины, содержащий последовательный разрежения ФАБ. Стадии ассоциацию 180 s впоследствии следуют 180 s диссоциации шагом в 1 x кинетики буфера.
Примечание: Биодатчики можно повторно использовать если вышеупомянутый Протокол следуют регенерации шаг, который состоит из трех циклов стирки биодатчики в зачистки буфера (PBS с 500 мм имидазола) для 5 s следуют 5 s в 1 x кинетики буфер для нейтрализации. Биодатчики можно повторно использовать до ~ 10-20 раз в тот же день, или до бедных данных наблюдается качества.
- Анализировать данные с помощью программного обеспечения для анализа (рис. 5A):
- Под вкладку 1, импорта и выбрать данные.
- На вкладке 2, шаг 1: Выбор данных, выберите «Выбор датчика» и выделите ссылку скважин (строк, E и F, рис. 5A), щелкните правой кнопкой мыши и набор ссылок хорошо. В разделе Шаг 2: Вычитание, выберите «ссылка скважин». В разделе Шаг 3: Выровнять оси y, выберите диапазон времени от 0.1 до 59,8 «Базовый» s. В разделе Шаг 4: Интер шаг коррекции, выберите «Выровнять по диссоциации.» В разделе Шаг 5: Процесс, выберите «Савицкий-Голея фильтрации» и печати данных процесса.
- В 3 вкладки выберите «Ассоциации и диссоциации» под шаг для анализа с помощью модели 1:1. Выберите «Глобальные установки» и «Группа по цвету». Щелкните правой кнопкой мыши кривые, выберите «Изменить цвета», установите все кривые в цвет по вашему выбору. Выберите «Подходят кривые». Если данные хорошо оборудованы, можно экспортировать отчет, выбрав «Сохранить отчет».
- Повторите эксперимент с гликопротеина производится в HEK293F и HEK293S клеток (раздел 5) и после лечения Endo H (раздел 7), чтобы оценить эффект, если таковые имеются, о различных glycoforms на Fab признания. Кроме того повторите эксперимент с РДРВ усечения обеспечить понимание доменов связаны ФАБ.
- Изотермическая титрования калориметрии ФАБ гликопротеина взаимодействия
Примечание: ЦМТ эксперименты, описанные здесь выполняются с использованием автоматизированных инструментов ЦМТ. Эксперименты проводятся в 1 мл вокруг нижней 96-луночных блока.- Dialyze РДРВ и Fab в один стакан 4 L 20 мм трис, рН 8,0, 150 мм NaCl при 4 ° C на ночь с баром перемешать.
- Концентрат dialyzed РДРВ и Fab 5 мкм и 50 мкм, соответственно, с помощью центробежного фильтра с 10 кДа NMWL, обеспечивая мыть концентратор мембраны три раза с 5 мл диализа буфера на 4000 x g за 5 мин при 4 ° C перед использованием.
Примечание: Любые несоответствия в буфер между выборками в клетке и шприц может привести к нежелательным тепла будет выпущен в ходе эксперимента ЦМТ и результат в данных низкого качества. - Для эксперимента 1: добавить 400 мкл РДРВ, чтобы быть загружены в ячейку A1 и 120 мкл Fab хорошо А2, чтобы быть загружены в шприц. Ну A3 пустым вернуться смешанного образца следующий эксперимент завершения. Каждый последующий эксперимент могут быть добавлены к пластине в том же порядке (то есть, эксперимент 2: клетки - A4, шприц - A5, пустой колодец - A6; Рисунок 5 B).
Примечание: Включить буфера в буфер элементов управления (для подтверждения документа ведет себя хорошо) в начале и конце каждого выполнения, а также лиганда (в шприце) в буфере (в ячейке) элементы управления для вычисления тепла разрежения для образца в шприц. Этот вычисляемый тепла разбавления затем должны быть вычтены из сырья экспериментальные данные при анализе данных (рис. 5B). - Запуск в общей сложности 16 инъекции с объемом 2,5 мкл для каждой инъекции. Продолжительность впрыска составляет 5 сек, с 180 s интервалы между инъекциями. Установите температуру ячейки до 25 ° C, с перемешивания скорость 750 об/мин и фильтра период 5 s.
Примечание: На основе сходства и термодинамика взаимодействия ECD:Fab, это может быть необходимо изменить образец концентрации, количество инъекций или температура камеры. - Анализировать данные с помощью анализа программного обеспечения, как описано ранее40,,4143 (рис. 5B).
- Повторите эксперимент по крайней мере в дубликаты, расчета среднего значения KD и стандартные ошибки. Повторите эксперимент с РДРВ различных glycoforms (разделы 5 и 6) для оценки эффекта, если таковые имеются, от glycoforms на Термодинамика взаимодействия Fab: гликопротеина.
- Для изотермических титрования калориметрии лиганд гликопротеина взаимодействий настройте ЦМТ эксперимента, как описано в разделе 12.2, со следующими изменениями:
- Dialyze РДРВ в 4 Л диализа буфера на ночь. Растворите лиганда с помощью диализа буфера, после завершения гемодиализа.
- Выполните эксперименты ЦМТ в значительно более высокие концентрации, чтобы иметь возможность обнаруживать низкого сродства взаимодействий. РДРВ и лигандом взаимодействия выполняют эксперименты ЦМТ в концентрациях 100 мкм РДРВ в клетке и 1 мм лиганд в шприц.
Результаты
Несколько конструкций CD22 РДРВ были успешно клонирован в векторные выражения pHLsec и оверэкспрессировали в млекопитающих HEK293F и HEK293S клеточных линий (рис. 2 и 3а). Все конструкции были очищенный до однородности размер размер гель-проникающей хроматографии и принесли очень чистый образец для исследования кристаллизации (рис. 3B и 3 C). Конструкция CD22, что привело к хорошо Дифрагирующая кристаллы был что усечение d1-d3 (остатки 20-330), с пяти из шести мест предсказал гликозилирования связанные N мутировал от Asn Ала (N67A, N112A, N135A, N164A и N231A), производимых в HEK293S клетки, такие, что только гликозилирование сайт на позиции N101 был сохранен (Эта конструкция называется CD2220-330, 5А). Кристаллы были получены в нескольких условий разреженные матрицы экрана MCSG-1, но лучшие кристаллов из состояния, содержащий 30% (w/v) полиэтиленгликоль 4000, лития хлорид 0,2 М и 0,1 М трис, рН 8,5. Эти родной кристаллы дифрагированных 2.1 Е резолюции; с помощью известных структур Ig доменов родственных белков Siglec не дали каких-либо решений в поисках MR.
Для приобретения фазирования информацию, мы пропитанной родной кристаллы с группой HA соединений, которые включали Hg, Pt, ОС, Ta и Br в концентрациях от 1-20 мм га комплекса для инкубации время от 5 мин до 1 d (рис. 4). Мы контроль кристаллов для изменения в морфологии и обнаружил, что кристаллы пропитанный HA соединения на 20 мм привело к быстрой крекинга и растворения кристаллов. Мы замерли в общей сложности 63 кристаллов, которые сохранили свою форму, после набора инкубации раз, которые были пропитывается кластера Бромид тантала, хлорид платины, ртутный ацетат и mercuric хлорид. Кристаллы пропитанной с 7 мм mercuric хлорида 30 мин, показал аномальных сигналов на проверку флуоресценции в канадской источника света (CLS) 08-BM излучение (Саскатун, Канада) и позволили мульти волны аномальных рассеяния рентгеновского сбора данных на одном кристалл. Эти наборы данных позволил нам решить ртути каркаса CD2220-330, 5А, который показал один ртути атом обязан бесплатно цистеина в позиции C308 и в конечном итоге позволило нам строить структуру CD2220-330, 5А в поэтапный Карта плотности электронов с использованием автосборки78.
После того, как структура unliganded была решена, мы были заинтересованы в решении проблемы структуры CD22 обязан его лиганда, α2-6 siallylactose. Мы сначала рассчитывается сродство CD22 к α2-6 sialyllactose с использованием ЦМТ для характеристики привязки Термодинамика взаимодействия. Мы сродство ~ 280 мкм и использовать эту информацию для определения начальной концентрации (~ 100 x KD) из лигандом для замачивания нашей родной CD2220-330, 5А кристаллов. Мы пропитанной CD2220-330, 5А кристаллы с siallylactose 25 мм для 5 мин, 2 ч, 14 ч, 40 h и 5 d и мониторинг изменений в морфологии кристаллов. В общей сложности кристаллов ~ 75 были заморожены из различных моментов времени и отправлены в CLS Синхротронное излучение 08-ID (Саскатун, Канада) для удаленных данных в коллекции. В общей сложности шесть наборов данных рентгеновского были собраны из хорошо Дифрагирующая кристаллов. Структура из каждого набора данных рентгеновского была решена MR, используя unliganded CD2220-330, 5А структуры как модель начального поиска. Результате плотности электронов для всех наборов данных затем был проинспектирован положительных плотности на карте Fo-Fc, который соответствовал бы связаны α2-6 sialyllactose в пределах привязки сайта CD22. Удивительно все наборы данных собраны, даже те из кристаллов, пропитанной после того, как только 5 минут время инкубации, содержатся позитивные плотности, соответствующий лиганд в привязки сайта. Общей структуры unliganded и liganded CD22 были весьма схожи с минимальными конформационные изменения, которые могли бы объяснить успех замачивания экспериментов с α2-6 sialyllactose.
Мы далее охарактеризовал поверхности антигенные CD22, признанные терапевтических антител epratuzumab в экспериментах BLI и ЦМТ (рис. 5). Кинетика и термодинамика профили epratuzumab Fab привязки CD22 конструкции с различными glycoforms показали все большее сродство CD22 с сокращением связанных с N glycan размер, с до четырнадцатикратное улучшение сродство для небольших гликанов (327 Нм против 24 Нм в BLI; 188 Нм против 58 Нм в ЦМТ). Ограничение доступа связаны CD22 N glycan антитела к его epitope была определена путем с использованием одной точки мутантов CD22 BLI и решения epratuzumab Fab-CD22 d1-d3 Сопредседатель кристалл структуры28.
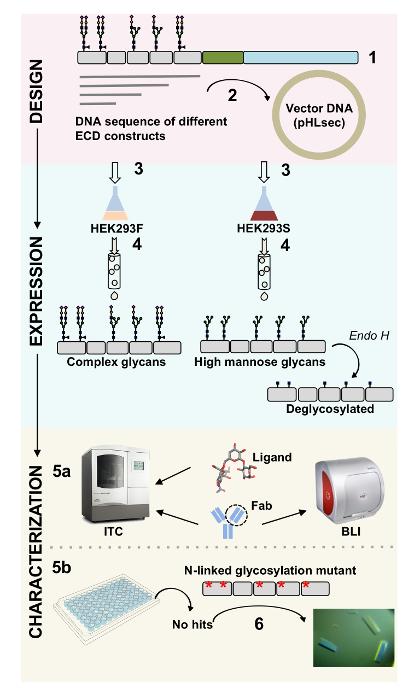
Рисунок 1 . Обзор характеристик гликопротеина от проектирования конструкции для биофизических и структурных характеристик. (1) первичной последовательности анализ представительных гликопротеина. В сером, внеклеточного домена (ECD); в зеленом, трансмембранного сегмент (TM); и в синем, цитозольной области гликопротеина. Предсказал N-связаны гликанов помечены. (2) клонирование ECD конструкций. (3) выражение ECD конструкций в mammalian клетках. (4) гликопротеина очистки. В то время как белки, выраженная в HEK293F будет содержать комплекс гликаны, белки, выраженная в HEK293S будет иметь высокие маннозы гликанов. Ферментативная обработка гликопротеинов производится в HEK293S клетках с Endo H результаты в гликопротеины с только GlcNAc части молекулы на участках N-связаны гликозилирования. (5А) гликопротеинов тестируются для их привязки к антителам biolayer интерферометрии (BLI) и изотермические титрования калориметрии (ЦМТ). Близость к небольшой лигандов также может измеряться в ЦМТ. испытания (5б) кристаллизации гликопротеины с однородной гликаны, N, связанных, например, выраженная в HEK293S и deglycosylated с Endo ч. (6) в некоторых случаях мутации связаны N гликозилирования сайтов необходима для получения кристаллов. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 2 . Дизайн ectodomain CD22 ДНК конструкции для выражения в mammalian клетках. A) представление плазмида pHLsec, используется для переходных трансфекции CD22 ECD конструкций. АИОД и KpnI сайтов, используемых для клонирования обозначаются красным коробки. B) CD22 ECD содержит семь Ig доменов (d1-d7) и 12 предсказал гликозилирования N-связанных сайтов (в синем). Были разработаны четыре конструкции с CD22 РДРВ. C) гель агарозы 1% показаны ПЦР ампликонов CD22 РДРВ конструкции для клонирования в вектор млекопитающих выражение pHLsec. Первый переулок содержит 1 kb ДНК маркера. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
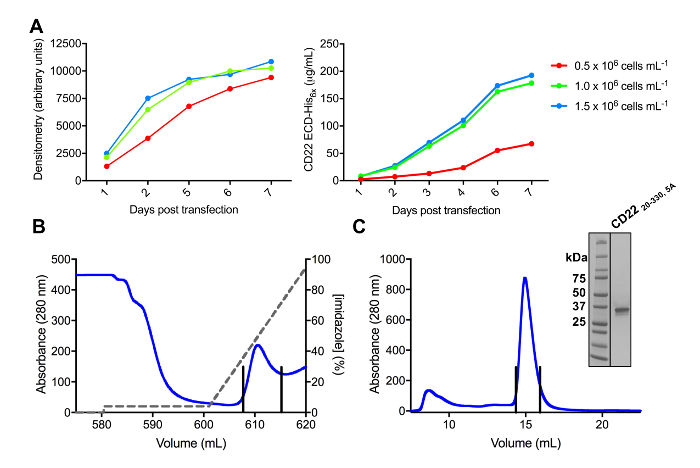
Рисунок 3 . Выражение и очищение гликопротеинами. A) эффект плотность клеток на выражение урожайности. Transfected гликопротеина выражение в небольших 25 мл культуры клеток HEK293F подвеска, используя три различных начальной плотности клеток (0,5 х 106 клеток мл-1, 1.0 x 106 клеток мл-1и 1,5 х 106 клеток мл -1). Количественная оценка выполняется путем денситометрия с SDS-PAGE в левой панели и количественных BLI в правой панели. Значения являются репрезентативными одной подготовка гликопротеина. B) Хроматограмма первой ступени очистки для построения CD2220-330, 5А от 600 мл супернатанта, используя столбец сходства Ni-НТА. Гликопротеин был этого eluted используя градиент имидазола (серая линия), где 100% соответствует Элюирующий буфер, который содержит 500 мм имидазола. Обобщённые фракций изображены с вертикальными линиями. C) размер исключение Хроматограмма для построения CD2220-330, 5А с помощью высокопроизводительных гель фильтрации столбца. Пула дроби от пика элюции изображены с вертикальными линиями. Врезные: Витражи Кумасси SDS-PAGE гель показаны чистоту гликопротеина. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 4 . Кристалл, замачивания тяжелых атомов. A) образец Рабочая станция для замачивания родной кристаллы с ха соединений. Все необходимые инструменты помечены. B) шаги последовали за замочить кристаллы построить CD2220-330, 5А с ха соединений. Шаг 1, открытое, хорошо содержащие кристаллов и передачи кристаллы с помощью цикла на 0.2 мкл падение на крышку выскальзования, содержащие HA раствор разбавляют в состоянии кристаллизации, таким образом, что конечная концентрация HA колеблется от 1-10 мм. Шаг 2, печать падение в пластину кристаллизации и инкубировать кристаллы с HA составные для различных периодов времени. Шаг 3, смонтировать пропитанной кристалл в цикле и обратно замочить на 30 s в трех последовательных 0.2 мкл капли, содержащие маточный раствор ликер, дополнена глицерина 20% (v/v), обойтись на крышку выскальзования. Шаг 4, вспышки заморозить кристалла, установленный на петлю с жидким азотом и поместите его в шайбу для отправки Синхротронное излучение. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
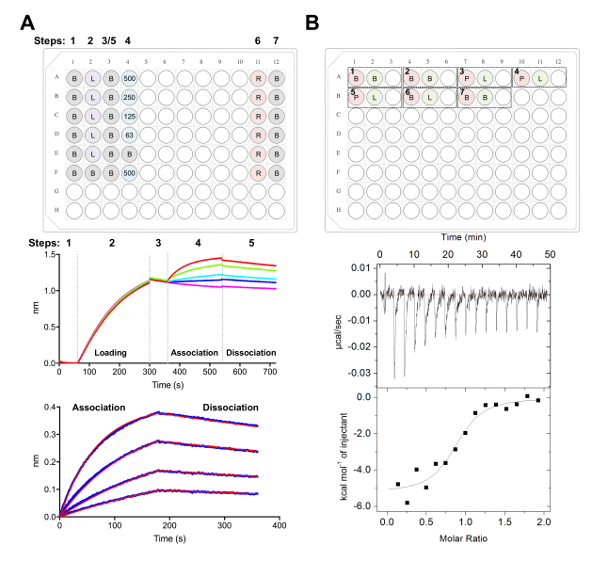
Рисунок 5 . Biolayer интерферометрии и изотермический титрования калориметрии измерения. A) представитель BLI эксперимент. Верхняя панель: пример установки пластины для кинетики эксперимента, где обозначены следующие: 1 x кинетики буфера (B), его6 x-тегами гликопротеина загрузки (L), представитель ВСБ концентрации (500, 125, 250, 62,5 Нм), PBS + 500 мм регенерации буфер (R) и 1 x кинетики нейтрализации буфера (B). Каждый хорошо содержит 200 мкл раствора. Шаг номер для эксперимента, кинетика указывается в верхней части плиты. Ближнем Группа: Представитель необработанные данные BLI эксперимент с помощью Ni-НТА биодатчики и табличке, описанной в верхней панели. Шаг номера соответствуют базовой (1), его6 x гликопротеина загрузки (2), базового (3), ассоциации в серийный разрежения Fab (4) и диссоциации (5). Регенерация шаги не являются представлены (шаги 6-7). Нижняя панель: Представитель проанализированы данные, показывающие сырье ассоциации и диссоциации (синяя линия) с соответствующим 1:1 подходят (красная линия). B) верхняя панель: представитель плиты установки для одно МТЦ работать на автоматизированный инструмент ЦМТ с семь экспериментов в 96-луночных раунд внизу блока. Каждый эксперимент состоит из трех скважин. Первая скважина (красный) соответствует образца для ячейки (400 мкл), второй скважины (зеленый) — пример для шприца (120 мкл). Третья также остается пустым, и смешанных образцов будет возвращен это хорошо после завершения эксперимента. Эксперименты, 1, 2 и 7 являются буфера в буфер элементы управления. Эксперименты 3-5 представляют тройные эксперименты с гликопротеина (P) в клетки и Fab или лиганда (L) в шприц. Эксперимент 6 представляет лигандом теплового контроля разбавления и должны быть вычтены из экспериментов 3-5 во время анализа данных. Нижняя панель: Представитель сырья (вверху) и обработанные (внизу) МТЦ данных показаны Fab (epratuzumab), привязка к CD22 ECD производится в HEK293F клетках. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Обсуждение
Якорь мембранных гликопротеинов имеют решающее значение для функции клеток и привлекательным терапевтических целей. Здесь мы представляем протокол для структурного и биофизические характеристики ECD мембранных гликопротеинов, как самостоятельно, так и в комплексе с малых молекул лигандов и Fab фрагментов. Мы успешно использовали этот протокол для определения кристаллической структуре трех доменов N-терминал большинство Ig внеклеточного части человеческого CD2228, критических ко-рецептор на B клеток, участвующих в поддержании гуморального иммунитета в проверить79. Мы также характеризуется сайт связывания CD22 с его естественным ligand α2-6 sialyllactose и определен режим распознавания терапевтических антител к человеческой CD22. Эти результаты обеспечивают понимание структуры функция отношения ключевым членом семьи Siglecs, которая ограничила выражение B клеток и молекулярные дорожную карту к развитию новых CD22 целевых малые молекулы и на основе антител терапии. Хотя этот протокол был успешно использован для Ig содержащих B-клеточный рецептор, мы предлагаем, что наш подход может быть применен для структурного и биофизические характеристики любого мембраны гликопротеин с собственный домен организации. В таких случаях Постройте дизайн и комбинаторные N-связаны glycan мутации (либо Gln или Ала) может оцениваться найти конструкция подходит для роста кристаллов и высоким разрешением дифракции.
Получение однородной и чистой гликопротеина образец имеет решающее значение для роста кристаллов и дифракции рентгеновских лучей, а также ниже по течению биофизические характеристики. N-связаны гликанов на гликопротеинов неразрывно разнородные и может вызвать конформационные и химической неоднородности в пределах гликопротеин, который может сдерживать формирования кристалла. Чтобы уменьшить этот микро неоднородность, стратегии, которые вводят точечные мутации для удаления остатков Asn, предсказал гавань гликанов N-связаны, или с помощью мутант клеточных линий (например, HEK293S) следуют лечение с endoglycosidases (например, Эндо) может значительно улучшить кристаллизации успех15,21,22. В этом протоколе мы обсуждаем очистки растворимых гликопротеинов и фабрики, которые сделаны секретным в ячейку супернатант. Гликопротеин секрецию обеспечивает сравнительно простой маршрут к чистоте, без необходимости для лизиса клеток или добавления агрессивных химикатов или моющие средства. Клетки супернатанта, полученные следующие ячейки уборки затем запускается непосредственно над столбцом, который имеет сродство для протеина интереса (например, Ni-НТА для его меткой гликопротеинов, или LC сродство для Fab фрагментов). Однако в зависимости от столбце использования и условий супернатанта ячейки (например, рН), возможность привязки протеина интереса к столбцу могут быть затронуты. Если это так, это может быть необходимо сосредоточиться и буфера обмена ячейки супернатанта улучшить привязки к столбцу. Кроме того настоятельно рекомендуется, что меры контроля качества во время очистки использоваться чтобы помочь оценить чистоту белка. Запуск геля SDS-PAGE или западную помарку всех образцов (до, во время и после очистки шагов) может дать понимание того, подходит ли схема предлагаемой очистки для протеина интереса. Если загрязняющие полос видны на SDS-PAGE, или если несколько видов получаются во время очистки (например, несколько пиков на размер исключения), следует рассмотреть шаги дополнительной очистки, например, ионообменной хроматографии, чтобы получить в чистоту и увеличить шансы течению кристаллизации80.
Для высокомолекулярных кристаллизации часто решающее значение для получения высоких урожаев протеина интереса для скрининга большое количество потенциальных условий кристаллизации в концентрациях, высоким содержанием белка позволяет найти подходящие кристалл хитов. Как правило HEK293 клеточных линий, обсуждали здесь (HEK293F и HEK293S) являются надежной выражение систем и может быть легко масштабируется производить больше образца при необходимости. Однако вполне возможно, что протеин интереса не могут достаточно выразить в пределах этих клеточных линий. В этих случаях других клеточных линий, таких как клетки Expi293,8182, были найдены показать улучшенный уровень экспрессии белков и следует рассматривать как альтернативу.
Если упорядоченной, Дифрагирующая кристаллы не получаются после тестирования нескольких конструкций протеина интереса несмотря на высокой чистоты, это может быть необходимо расширить кристаллизации методов для поощрения формирования кристалла. Было показано, что Fab фрагментов антитела и nanobodies может быть отличным кристаллизации усилители и содействовать упорядоченной кристалл упаковки83,,8485. Эти фрагменты можно выразил и очищен до однородности и используется в комплексе с белками, представляющих интерес для поощрения кристаллизации. Важно отметить, что Fab фрагментов, как описано в разделе 10 может иметь тенденцию сформировать нефункциональные LC димеры86. Эти димеры являются и должны быть удалены во время очистки. В нашем опыте LC димеры часто имеют разные удержания тома на размер изоляции, или элюировать как собственный пик на ионообменной хроматографии и таким образом, могут быть удалены от Fab очистки -, однако это не всегда так. Если эти методы являются недостаточными для удаления димеры LC от Fab очистки, методы дополнительной очистки, такие как белок G очищение сродства, могут быть использованы для улучшения чистоты.
Альтернативой co комплексообразованию с Fab фрагментов, хорошо документированных методов, таких как случайная матрица microseeding может повысить шансы получения упорядоченного кристаллы63,70. Этот метод включает в себя добавление небольшое количество измельченных, субоптимальный кристаллов в состояние кристаллизации, обеспечивая кристалл nucleate для поощрения роста кристалла. Это можно выполнить с использованием кристаллов протеина интереса, или те, с аналогичными архитектуры и третичные структуры доменов. Кроме того случайная матрица microseeding может выполняться в попытках кристаллизации белка самостоятельно или в комплексе с Fab-фрагмент или малые молекулы интерес. Последние достижения в крио электронная микроскопия также делают эту технику привлекательной альтернативой рентгеноструктурного анализа для получения высокого разрешения структурной информации для молекул с соответствующей функции87,88, 89,,9091.
Когда поэтапного дифракции рентгеновских лучей наборов данных не удается, MR, замачивания ха может быть необходимо решить проблему этапа аномальных дисперсии или Изоморфное замены. Инспекция по аминокислотной последовательности белка может предоставить подсказки о стратегии для деривации га, в том числе оптимальный рН для привязки. В частности непарные которым внутри белка конкретно можно привязать HA соединений, содержащих ртуть. Замачивания родной кристаллы с ха соединений является итеративный процесс для определения личности оптимальный комплекс HA, его концентрация и время необходимые инкубации. Если первоначальные попытки замачивания не дают хорошо Дифрагирующая кристаллы, содержащие HA, подходящих для постепенного, это может быть необходимо ввести аминокислотных замен для повышения вероятности HA привязки и улучшения аномальных сигналов. Примеры включают мутации включить бесплатно хвоща остатков для эффективной привязки Hg, Au, Pt или Pb. экспрессия белков для аномального поэтапно селено метионина дополнены СМИ в E. coli широко используется для аномального поэтапного, однако Аналогичная система, которая надежно включает селено метионина не доступны для mammalian клеток в подвеска92,93и область будущего развития.
Получив unliganded структура гликопротеина интерес, замачивания кристаллы с малых молекул лигандов может выполняться для получения структура комплекса иммунной рецептор лиганд. Эти данные служат основой для рациональной разработки более конкретными и высокоспецифичные лиганды, которые могут использоваться как мелкомолекулярных терапии, а также обеспечивает высокое разрешение понимание биологической функции гликопротеина. При попытке отдохнуть гликопротеин кристаллы с малых молекул лигандов интерес, инспекции unliganded Кристаллическая структура может указывать ли замачивания должно быть возможным. Если закрыть кристалл упаковка контакты находятся вокруг лиганд привязки сайта или вокруг областей, пройти конформационные изменения после лигандом привязки, замачивание может быть проблематичным. В этом случае должны быть выполнены другие методы, такие как сопредседатель кристаллизации белка лиганд комплекса.
Раскрытие информации
Авторы заявляют не конкурирующие интересы.
Благодарности
Рентгеновской дифракции эксперименты, описанные в этом документе были проведены с использованием излучение 08-ID и 08-BM в канадской источник света, который поддерживается Канадский фонд для инноваций, естественных наук и инженерных исследований Совета Канады, Саскачеванский университет, правительство Саскачевана, Западной экономической диверсификации Канады, Национальный исследовательский совет Канады и канадской институтов медицинских исследований. Мы хотели бы признать структурных и биофизических Core объекта, больница для больных детей, для доступа к документам, ЦМТ и BLI. J.E.O. поддержал, Banting докторантура стипендий БНФ-144483 от канадской институтов медицинских исследований. Т.с. является получателем из Канады выпускник стипендию магистра премии и Ванье Канада выпускник стипендию от канадской институтов медицинских исследований. Эта работа была поддержана действующих грантов PJT-148811 (J.-P.J.) из канадского институтов здравоохранения исследования. Это исследование было проведено, в частности, благодаря финансированию из Канады научно-исследовательскими кафедрами программы (J.-P.J.).
Материалы
| Name | Company | Catalog Number | Comments |
| 0.22 μm Steritop filter | EMD Millipore | SCGPS02RE | |
| 10 well 4-15% gradient SDS-PAGE gel | Bio-Rad | 4561084 | |
| 10x glycobuffer 3 | New England Biolabs | P0702S | Comes with Endo H reagent |
| 10x Kinetics Buffer | PALL FortéBio | 18-1092 | |
| 10x Tris/Glycine/SDS Buffer | Bio-Rad | 1610732 | |
| 1 mL round bottom 96 well block | ThermoFisher | 260251 | |
| 22 mm cover slip | Hampton research | HR3-231 | |
| 4x Laemmli Sample Buffer | Bio-Rad | 1610747 | |
| 96-3 well INTELLIPLATE low volume reservior | Art Robbins Instruments | 102-0001-03 | |
| AgeI | New England Biolabs | R0552S | |
| ÄKTA Pure | GE Healthcare | ||
| ÄKTA Start | GE Healthcare | ||
| Amicon Ultra 15 centrifugal filtration device 10KDa MWCO | Millipore | UFC901008 | |
| Amicon Ultra 4 centrifugal filtration device 10KDa MWCO | Millipore | UFC801008 | |
| Auto-iTC200 | Malvern | ||
| Axygen MaxyClear Snaplock 1.5 mL microtubes | Fisher Scientific | MCT150C | |
| Countess Cell Counting Chamber Slides | Thermo Fisher Scientific | C10228 | |
| CryoLoop 18 x 0.05-0.1 mm | Hampton research | HR4-945 | |
| CryoLoop 18 x 0.1-0.2 mm | Hampton research | HR4-947 | |
| CryoLoop 18 x 0.2-0.3 mm | Hampton research | HR4-970 | |
| Digital Dry Bath | Bio-Rad | 1660562EDU | |
| E. coli DH5α | Invitrogen | 18258012 | |
| Endo H | New England Biolabs | P0702S | |
| Erlenmeyer flask (baffled base), polycarbonate, sterile, 500 mL, DuoCAP | TriForest Labware | FBC05000S | |
| Erlenmeyer flask 125 mL (baffled base), polycarbonate, sterile, 125 mL with vented cap | VWR | 89095-258 | |
| Falcon Disposable sterile serological pipet, non-pyrogenic, 10 mL | Greiner Bio-One | 607180 | |
| Falcon Disposable sterile serological pipet, non-pyrogenic, 25 mL | Greiner Bio-One | 760180 | |
| Falcon Disposable sterile serological pipet, non-pyrogenic, 5 mL | Greiner Bio-One | 606180 | |
| Falcon Disposable sterile serological pipet, non-pyrogenic, 50 mL | Greiner Bio-One | 768180 | |
| FectoPRO DNA Transfection Reagent, Polyplus | VWR | 10118-842 | |
| Freestyle 293F cells | Thermo Fisher Scientific | R79007 | |
| Freestyle Expression medium | Thermo Fisher Scientific | 12338001 | |
| Heavy Atom Screens Au | Hampton research | HR2-444 | |
| Heavy Atom Screens Hg | Hampton research | HR2-446 | |
| Heavy Atom Screens M1 | Hampton research | HR2-448 | |
| Heavy Atom Screens M2 | Hampton research | HR2-450 | |
| Heavy Atom Screens Pt | Hampton research | HR2-442 | |
| HEK 293S | ATCC | ATCC CRL-3022 | |
| HisTrap Affinity Column | GE Healthcare | 17525501 | |
| HiTrap KappaSelect Affinity Columns | GE Healthcare | 17545811 | |
| HiTrap LambdaSelect Affinity Columns | GE Healthcare | 17548211 | |
| KpnI | New England Biolabs | R0142S | |
| MCSG-1 Crystal Screen 1.7 mL block | Anatrace | MCSG-1 | |
| MCSG-2 Crystal Screen 1.7 mL block | Anatrace | MCSG-2 | |
| MCSG-3 Crystal Screen 1.7 mL block | Anatrace | MCSG-3 | |
| MCSG-4 Crystal Screen 1.7 mL block | Anatrace | MCSG-4 | |
| Mercuric chloride | Sigma | 1044170100 | |
| Microplate, 96 well, polypropelene, flat bottom, black | Greiner Bio-One | 655209 | |
| Minstrel DT UV | Formulatrix | ||
| Multitron Pro shaker | Infors HT | MP25-TA-CO2HB | |
| Nanodrop 2000/2000c Spectrophotometer | Thermo Fisher Scientific | ND-2000 | |
| Nanosep 3K Omega centrifugal device | PALL Life Science | OD003C33 | |
| Ni-NTA biosensors | PALL FortéBio | 18-5102 | |
| Octet RED96 | PALL ForteBio | ||
| Oryx 4 crystallizaiton robot | Douglas Instrument | ORY-4/1 | |
| Platinum chloride | Sigma | 520632-1g | |
| Precision Plus Protein Standard | Bio-Rad | 161-0374 | |
| PureLink HiPure Plasmid Maxiprep Kit | Invitrogen | K210006 | |
| Quick Coomassie Stain | Protein Ark | GEN-QC-STAIN-1L | |
| Steriflip Sterile 50 mL Disposable Vacuum Filtration System 0.22 µm Millipore Express | EMD Millipore | SCGP00525 | |
| Superdex 200 Increase 10/300 GL | GE Healthcare | 28990944 | |
| Superose 6 10/300 GL | GE Healthcare | 17517201 | |
| Tantalum bromide cluster | Jena bioscience | PK-103 | |
| Top96 Crystallization Screen | Rigaku Reagents | 1009846 | |
| Tryphan Blue | Thermo Fisher Scientific | T10282 | |
| VDX 24-well with sealant | Hampton research | HR3-172 | |
| α2-6 sialyllactose | Sigma Aldrich | A8556-1mg |
Ссылки
- Sachs, J. N., Engelman, D. M. Introduction to the membrane protein reviews: The interplay of structure, dynamics, and environment in membrane protein function. Annu Rev Biochem. 75 (1), 707-712 (2006).
- Cournia, Z., et al. Membrane protein structure, function, and dynamics: A perspective from experiments and theory. J Membr Biol. 248 (4), 611-640 (2015).
- Macauley, M. S., et al. Antigenic liposomes displaying CD22 ligands induce antigen-specific B cell apoptosis. J Clin Invest. 123 (7), 3074-3083 (2013).
- Hyde, C. A. C., et al. Targeting extracellular domains D4 and D7 of vascular endothelial growth factor receptor 2 reveals allosteric receptor regulatory sites. Mol Cell Biol. 32 (19), 3802-3813 (2012).
- Tai, W., Mahato, R., Cheng, K. The role of HER2 in cancer therapy and targeted drug delivery. J Control Release. 146 (3), 264-275 (2010).
- Zarei, O., Benvenuti, S., Ustun-Alkan, F., Hamzeh-Mivehroud, M., Dastmalchi, S. Strategies of targeting the extracellular domain of RON tyrosine kinase receptor for cancer therapy and drug delivery. J Cancer Res Clin Oncol. 142 (12), 2429-2446 (2016).
- Rosman, Z., Shoenfeld, Y., Zandman-Goddard, G. Biologic therapy for autoimmune diseases: an update. BMC Med. 11 (1), 88(2013).
- Lander, E. S., et al. Initial sequencing and analysis of the human genome. Nature. 409 (6822), 860-921 (2001).
- Barclay, A. N. Membrane proteins with immunoglobulin-like domains - A master superfamily of interaction molecules. Semin Immunol. 15 (4), 215-223 (2003).
- Barclay, A. N. Ig-like domains: evolution from simple interaction molecules to sophisticated antigen recognition. Proc Natl Acad Sci. 96 (26), 14672-14674 (1999).
- Aebi, M. N-linked protein glycosylation in the ER. Biochim Biophys Acta - Mol Cell Res. 1833 (11), 2430-2437 (2013).
- Ohtsubo, K., Marth, J. D. Glycosylation in cellular mechanisms of health and disease. Cell. 126 (5), 855-867 (2006).
- Lodish, H., Berk, A., Zipursky, S., Al, E. Glycosylation in the ER and Golgi complex. Mol Cell Biol. (4), Section 17.7 (2000).
- Thomas, P., Smart, T. G. HEK293 cell line: A vehicle for the expression of recombinant proteins. J Pharmacol Toxicol Methods. 51 (3), 187-200 (2005).
- Lee, J. E., Fusco, M. L., Ollmann Saphire, E. An efficient platform for screening expression and crystallization of glycoproteins produced in human cells. Nat Protoc. 4 (4), 592-604 (2009).
- Betenbaugh, M. J., Tomiya, N., Narang, S., Hsu, J. T. A., Lee, Y. C. Biosynthesis of human-type N-glycans in heterologous systems. Curr Opin Struct Biol. 14 (5), 601-606 (2004).
- Yang, Z., et al. Engineered CHO cells for production of diverse, homogeneous glycoproteins. Nat Biotechnol. 33 (8), 842-844 (2015).
- Bláha, J., Kalousková, B., Skořepa, O., Pažický, S., Novák, P., Vaněk, O. High-level expression and purification of soluble form of human natural killer cell receptor NKR-P1 in HEK293S GnTI-cells. Protein Expr Purif. 140, 36-43 (2017).
- Bláha, J., Pachl, P., Novák, P., Vaněk, O. Expression and purification of soluble and stable ectodomain of natural killer cell receptor LLT1 through high-density transfection of suspension adapted HEK293S GnTI- cells. Protein Expr Purif. 109, 7-13 (2015).
- Chaudhary, S., Pak, J. E., Gruswitz, F., Sharma, V., Stroud, R. M. Overexpressing human membrane proteins in stably transfected and clonal human embryonic kidney 293S cells. Nat Protoc. 7 (3), 453-466 (2012).
- Chang, V. T., et al. Glycoprotein structural genomics: Solving the glycosylation problem. Structure. 15 (3), 267-273 (2007).
- Davis, S. J., Crispin, M. Solutions to the glycosylation problem for low- and high-throughput structural glycoproteomics. Funct Struct Proteomics Glycoproteins. , 127-158 (2011).
- Elbein, A. D., Tropea, J. E., Mitchell, M., Kaushal, G. P. Kifunensine, a potent inhibitor of the glycoprotein processing mannosidase I. J Biol Chem. 265 (26), 15599-15605 (1990).
- Zheng, K., Bantog, C., Bayer, R. The impact of glycosylation on monoclonal antibody conformation and stability. MAbs. 3 (6), 568-576 (2011).
- Aricescu, A. R., Lu, W., Jones, E. Y. A time- and cost-efficient system for high-level protein production in mammalian cells. Acta Crystallogr Sect D Biol Crystallogr. 62 (10), 1243-1250 (2006).
- Adams, P. D., et al. The Phenix software for automated determination of macromolecular structures. Methods. 55 (1), 94-106 (2011).
- May, A. P., Robinson, R. C., Vinson, M., Crocker, P. R., Jones, E. Y. Crystal structure of the N-terminal domain of sialoadhesin in complex with 3' sialyllactose at 1.85 Å resolution. Mol Cell. 1 (5), 719-728 (1998).
- Ereño-Orbea, J., et al. Molecular basis of human CD22 function and therapeutic targeting. Nat Commun. 8 (1), 764(2017).
- Yu, X. -L., et al. Crystal structure of HAb18G/CD147: implications for immunoglobulin superfamily homophilic adhesion. J Biol Chem. 283 (26), 18056-18065 (2008).
- Garman, E., Murray, J. W. Heavy-atom derivatization. Acta Crystallogr - Sect D Biol Crystallogr. 59 (11), 1903-1913 (2003).
- Agniswamy, J., Joyce, M. G., Hammer, C. H., Sun, P. D. Towards a rational approach for heavy-atom derivative screening in protein crystallography. Acta Crystallogr Sect D Biol Crystallogr. 64 (4), 354-367 (2008).
- Rose, J. P., Wang, B. C., Weiss, M. S. Native SAD is maturing. IUCrJ. 2 (20), 431-440 (2015).
- Olieric, V., et al. Data-collection strategy for challenging native SAD phasing. Acta Crystallogr Sect D Struct Biol. 72 (3), 421-429 (2016).
- Rillahan, C. D., et al. Disubstituted sialic acid ligands targeting Siglecs CD33 and CD22 associated with myeloid leukaemias and B cell lymphomas. Chem Sci. 5 (6), 2398-2406 (2014).
- Mesch, S., et al. From a library of MAG antagonists to nanomolar CD22 ligands. ChemMedChem. 7 (1), 134-143 (2012).
- Chiu, M. L., Gilliland, G. L. Engineering antibody therapeutics. Curr Opin Struct Biol. 38, 163-173 (2016).
- Elgundi, Z., Reslan, M., Cruz, E., Sifniotis, V., Kayser, V. The state-of-play and future of antibody therapeutics. Adv Drug Deliv Rev. 122 (2016), 2-19 (2017).
- Yang, D., Singh, A., Wu, H., Kroe-Barrett, R. Determination of high-affinity antibody-antigen binding kinetics using four biosensor platforms. J Vis Exp. (122), e55659(2017).
- Kamat, V., Rafique, A. Designing binding kinetic assay on the bio-layer interferometry (BLI) biosensor to characterize antibody-antigen interactions. Anal Biochem. 536, 16-31 (2017).
- Brautigam, C. A., Zhao, H., Vargas, C., Keller, S., Schuck, P. Integration and global analysis of isothermal titration calorimetry data for studying macromolecular interactions. Nat Protoc. 11 (5), 882-894 (2016).
- Duff, M. R., Grubbs, J., Howell, E. E. Isothermal titration calorimetry for measuring macromolecule-ligand affinity. J Vis Exp. (55), e2796(2011).
- Livingstone, J. R. Antibody characterization by isothermal titration calorimetry. Nature. 384 (6608), 491-492 (1996).
- Freyer, M. W., Lewis, E. A. Isothermal titration calorimetry: Experimental design, data analysis, and probing macromolecule/ligand binding and kinetic interactions. Methods Cell Biol. 84, 79-113 (2008).
- Macauley, M. S., Crocker, P. R., Paulson, J. C. Siglec-mediated regulation of immune cell function in disease. Nat Rev Immunol. 14 (10), 653-666 (2014).
- Zaccai, N. R., et al. Structure-guided design of sialic acid-based Siglec inhibitors and crystallographic analysis in complex with sialoadhesin. Structure. 11 (5), 557-567 (2003).
- Pantophlet, R., et al. Bacterially derived synthetic mimetics of mammalian oligomannose prime antibody responses that neutralize HIV infectivity. Nat Commun. 8 (1), 1601(2017).
- Leonard, J. P., et al. Epratuzumab, a humanized anti-CD22 antibody, in aggressive non-Hodgkin's lymphoma: phase I/II clinical trial results. Clin Cancer Res. 10 (16), 5327-5334 (2004).
- Finn, R. D., et al. InterPro in 2017-beyond protein family and domain annotations. Nucleic Acids Res. 45, 190-199 (2017).
- Kelley, L. A., Mezulis, S., Yates, C. M., Wass, M. N., Sternberg, M. J. E. The Phyre2 web portal for protein modeling, prediction and analysis. Nat Protoc. 10 (6), 845-858 (2015).
- Lessard, J. C. Molecular cloning. Methods Enzymol. 529, 85-98 (2013).
- Gupta, R., Jung, E., Brunak, S. NetNGlyc: Prediction of N-glycosylation sites in human proteins. , (2004).
- Liu, H., Naismith, J. H. An efficient one-step site-directed deletion, insertion, single and multiple-site plasmid mutagenesis protocol. BMC Biotechnol. 8, 91(2008).
- Heckman, K. L., Pease, L. R. Gene splicing and mutagenesis by PCR-driven overlap extension. Nat Protoc. 2 (4), 924-932 (2007).
- Froger, A., Hall, J. E. Transformation of plasmid DNA into E. coli using the heat shock method. J Vis Exp. (6), e253(2007).
- Akula, I., Julien, J. -P. Optimization of glycoprotein expression by transient transfection in HEK293 F/S suspension cells. , Available from: https://www.polyplus-transfection.com/wp-content/uploads/2015/09/FectoPRO-Technical-Note-031716.pdf (2015).
- Taylor, S. C., Berkelman, T., Yadav, G., Hammond, M. A defined methodology for reliable quantification of western blot data. Mol Biotechnol. 55 (3), 217-226 (2013).
- Tan, H. Y., Ng, T. W. Accurate step wedge calibration for densitometry of electrophoresis gels. Opt Commun. 281 (10), 3013-3017 (2008).
- Gassmann, M., Grenacher, B., Rohde, B., Vogel, J. Quantifying Western blots: pitfalls of densitometry. Electrophoresis. 30 (11), 1845-1855 (2009).
- Jonnalgadda, K., Markley, L., Estes, S., Prajapati, S., Takkar, R., Kumaraswamy, S. Rapid, reliable quantitation of Fc-fusion protein in cell culture supernatants. , Available from: https://www.fortebio.com/documents/ForteBio_App_Note_13.pdf (2018).
- JoVE Science Education Database. Basic methods in cellular and molecular biology: Separating protein with SDS-PAGE. J Vis Exp. , (2018).
- Wilkins, M. R., et al. Protein identification and analysis tools in the ExPASy server. Methods Mol Biol. 112, 531-552 (1999).
- Till, M., et al. Improving the success rate of protein crystallization by random microseed matrix screening. J Vis Exp. (78), e50548(2013).
- Obmolova, G., Malia, T. J., Teplyakov, A., Sweet, R., Gilliland, G. L. Promoting crystallization of antibody-antigen complexes via microseed matrix screening. Acta Crystallogr Sect D Biol Crystallogr. 66 (8), 927-933 (2010).
- D'Arcy, A., Bergfors, T., Cowan-Jacob, S. W., Marsh, M. Microseed matrix screening for optimization in protein crystallization: What have we learned. Acta Crystallogr Sect F, Struct Biol Commun. 70 (9), 1117-1126 (2014).
- Luft, J. R., et al. Efficient optimization of crystallization conditions by manipulation of drop volume ratio and temperature. Protein Sci. 16 (4), 715-722 (2007).
- Dessau, M. A., Modis, Y. Protein crystallization for X-ray crystallography. J Vis Exp. (47), e2285(2011).
- Sugahara, M., Asada, Y., Ayama, H., Ukawa, H., Taka, H., Kunishima, N. Heavy-atom Database System: A tool for the preparation of heavy-atom derivatives of protein crystals based on amino-acid sequence and crystallization conditions. Acta Crystallogr D Biol Crystallogr. 61 (9), 1302-1305 (2005).
- Boggon, T. J., Shapiro, L. Screening for phasing atoms in protein crystallography. Structure. 8 (7), 143-149 (2000).
- Vera, L., Stura, E. A. Strategies for protein cryocrystallography. Cryst Growth Des. 14 (2), 427-435 (2014).
- Pichlo, C., Montada, A. A., Schacherl, M., Baumann, U. Production, crystallization and structure determination of C. difficile PPEP-1 via microseeding and Zinc-SAD. J Vis Exp. (118), e55022(2016).
- Leslie, A. G. W., et al. Automation of the collection and processing of X-ray diffraction data - a generic approach. Acta Crystallogr Sect D Biol Crystallogr. 58 (11), 1924-1928 (2002).
- Pike, A. C. W., Garman, E. F., Krojer, T., Von Delft, F., Carpenter, E. P. An overview of heavy-atom derivatization of protein crystals. Acta Crystallogr Sect D Struct Biol. 72 (3), 303-318 (2016).
- Cooper, D. R., Porebski, P. J., Chruszcz, M., Minor, W. X-ray crystallography: Assessment and validation of protein-small molecule complexes for drug discovery. Expert Opin Drug Discov. 6 (8), 771-782 (2011).
- Hassell, A. M., et al. Crystallization of protein-ligand complexes. Acta Crystallogr Sect D Biol Crystallogr. 63 (1), 72-79 (2006).
- Muller, I., et al. Guidelines for the successful generation of protein-ligand complex crystals. Acta Crystallogr Sect D Struct Biol. 73 (2), 79-92 (2017).
- Zhao, Y., et al. Two routes for production and purification of Fab fragments in biopharmaceutical discovery research: Papain digestion of mAb and transient expression in mammalian cells. Protein Expr Purif. 67 (2), 182-189 (2009).
- Shah, N. B., Duncan, T. M. Bio-layer interferometry for measuring kinetics of protein-protein interactions and allosteric ligand effects. J Vis Exp. (84), e51383(2014).
- Terwilliger, T. C., et al. Iterative model building, structure refinement and density modification with the PHENIX AutoBuild wizard. Acta Crystallogr Sect D Biol Crystallogr. 64 (1), 61-69 (2008).
- Walker, J. A., Smith, K. G. C. CD22: An inhibitory enigma. Immunology. 123 (3), 314-325 (2008).
- Gräslund, S., et al. Protein production and purification. Nat Methods. 5 (2), 135-146 (2008).
- Jain, N. K., et al. A high density CHO-S transient transfection system: Comparison of ExpiCHO and Expi293. Protein Expr Purif. 134, 38-46 (2017).
- Fang, X. T., Sehlin, D., Lannfelt, L., Syvänen, S., Hultqvist, G. Efficient and inexpensive transient expression of multispecific multivalent antibodies in Expi293 cells. Biol Proced Online. 19 (1), 11(2017).
- Löw, C., et al. Nanobody mediated crystallization of an archeal mechanosensitive channel. PLoS One. 8 (10), 77984(2013).
- Hunte, C., Michel, H. Crystallization of membrane proteins mediated by antibody fragments. Curr Opin Struct Biol. 12 (4), 503-508 (2002).
- Ereño-Orbea, J., Sicard, T., Cui, H., Carson, J., Hermans, P., Julien, J. -P. Structural basis of enhanced crystallizability induced by a molecular chaperone for antibody antigen-binding fragments. J Mol Biol. 430 (3), 322-336 (2018).
- Spooner, J., et al. Evaluation of strategies to control Fab light chain dimer during mammalian expression and purification: A universal one-step process for purification of correctly assembled Fab. Biotechnol Bioeng. 112 (7), 1472-1477 (2015).
- Elmlund, D., Le, S. N., Elmlund, H. High-resolution cryo-EM: The nuts and bolts. Curr Opin Struct Biol. 46, 1-6 (2017).
- Merk, A., et al. Breaking cryo-EM resolution barriers to facilitate drug discovery. Cell. 165 (7), 1698-1707 (2016).
- Bai, X. C., McMullan, G., Scheres, S. H. W. How cryo-EM is revolutionizing structural biology. Trends Biochem Sci. 40 (1), 49-57 (2015).
- Wlodawer, A., Li, M., Dauter, Z. High-resolution cryo-EM maps and models: A crystallographer's perspective. Structure. 25 (10), 1589-1597 (2017).
- Bartesaghi, A., et al. 2.2 Å resolution cryo-EM structure of β-galactosidase in complex with a cell-permeant inhibitor. Science. 348 (6239), 1147-1151 (2015).
- Hendrickson, W. a, Horton, J. R., LeMaster, D. M. Selenomethionyl proteins produced for analysis by multiwavelength anomalous diffraction (MAD): A vehicle for direct determination of three-dimensional structure. EMBO J. 9 (5), 1665-1672 (1990).
- Walden, H. Selenium incorporation using recombinant techniques. Acta Crystallogr Sect D Biol Crystallogr. 66 (4), 352-357 (2010).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены