Method Article
Анализ функции бета клеток с использованием одной ячейки резолюции кальция визуализации в Zebrafish островков
В этой статье
Резюме
Бета клеток функциональность имеет важное значение для гомеостаза глюкозы в крови, который вычисляется в резолюции одной ячейки с помощью генетически закодированный репортер для притока кальция.
Аннотация
Бета клеток поджелудочной железы ответ на повышение концентрации глюкозы в крови путем секреции гормона инсулина. Дисфункция бета клеток приводит к гипергликемии и тяжелых, угрожающих жизни последствий. Понимание как бета клетки действуют в физиологических условиях и какие генетические и экологические факторы могут привести к их дисфункции может привести к более вариантов лечения для больных сахарным диабетом. Возможность измерять уровень кальция в бета клетки служит важным показателем функции бета клеток, как притока ионов кальция триггеры инсулина выпуска. Здесь мы описываем протокол для мониторинга кальция, глюкозы стимулирует приток в zebrafish бета клеток с помощью GCaMP6s, генетически закодированный датчик кальция. Метод позволяет мониторинга динамики внутриклеточного кальция с резолюцией одноклеточных в ex vivo монтируется островков. Глюкоза оперативность бета-клеток в иле же может быть захвачен одновременно под концентрации различных глюкозы, которая предполагает наличие функциональной неоднородность данио рерио бета клеток. Кроме того метод обеспечивает высокую временнóго и пространственного разрешения, который раскрывает колебательный характер притока кальция при стимуляции глюкозы. Наш подход открывает двери для использования данио рерио как модель для изучения вклада генетических и экологических факторов в функции бета клеток и дисфункции.
Введение
Наши глюкозы в крови поддерживается в узком диапазоне, в значительной степени благодаря функции эндокринной поджелудочной железы. Эндокринных роль поджелудочной железы осуществляется островки Лангерганса, которые содержат гормон секретирующих клеток. Секреции инсулина бета клетки отвечают за снижение уровня глюкозы в крови после еды, содержащих углеводы. Неадекватными инсулин секрета из бета клеток может привести к диабета1, который характеризуется постоянной высокой-глюкозы в крови. Тип 1 и тип 2 диабета, который в настоящее время затрагивает более чем 400 миллионов человек во всем мире, приводит к2заболеваемости и смертности. Исследуя молекулярных и экологические факторы, которые способствуют дисфункции бета клеток, мы сможем лучше понять как диабет типа 2 начинается и прогрессирует. Кроме того способности различать стволовых клеток человека в функциональных бета клетки в пробирке может стать источником новых бета-клеток для клеток-терапии в диабета 1 типа. В этой связи важно изучить функции бета клеток и созревания в организмах генетическая модель, чтобы получить необходимые знания для создания функциональных бета клетки в блюдо.
Бета клеток функциональность может контролироваться на уровне всего островок количественного общее количество инсулина, секретируемых в ответ глюкозы стимуляции. Этот кумулятивный подход исследования островок как единая группа клеток без дифференциации отдельных свойств ячеек. Однако анализ ответов глюкозы отдельных бета-клеток показали разнообразие функциональных свойств бета-клеток и присутствие неоднородность3. Для оценки функции отдельных бета клеток, можно контролировать внутриклеточные изменения, которые приводят к секреции инсулина4. Секреции инсулина предшествуют проникновение глюкозы в бета клетки. Глюкозы, который входит в бета клетки быстро метаболизируется в СПС. Выше внутриклеточной концентрации ATP уменьшение открытой вероятность АТФ чувствительных калия ионных каналов приводит к деполяризации бета клеток. Деполяризации открывает каналы иона кальция напряжения чувствительных и увеличивает внутриклеточного кальция. В свою очередь кальция вызывает экзоцитоз инсулина, который выходит в тираж и снижает уровень глюкозы путем поощрения утилизации глюкозы5,6,7.
Несколько стратегий были применены для изучения функции бета клеток, включая мониторинг мембранный потенциал8, прямая визуализация инсулина и везикулы экзоцитоз9и количественная оценка внутриклеточных Ca2 + приток как прокси для глюкозы оперативность10. Среди них изображений внутриклеточных Ca2 + обеспечивает преимущество расширения масштабов анализа в несколько отдельных ячеек в пределах же островок11,12, что позволяет для прямого сравнения глюкозы-реакции между Индивидуальные бета клетки. Внутриклеточные Ca2 + концентрации может контролироваться с помощью флуоресцентных красителей кальция чувствительных13 или генетически закодированный кальция показателей (GECIs)14. В то время как кальций индикатор красители отсутствие камерного типа конкретности, GECIs может быть выражено в определенной ячейке тип конкретных промоутеров. Кроме того новое поколение GECIs, например GCaMP6, обеспечивает лучшее соотношение сигнал шум наряду с быстрее временная динамика15. Здесь мы описываем полезности нового поколения GECIs, в частности GCaMP6s, чтобы визуализировать кальция в бета клетки в одной ячейки резолюции. Мы применяем этот метод к первичной островок данио рерио как наша модель выбора. В ходе эмбрионального развития бета клетки в первичной островок происходят из дорсальной и вентральной поджелудочной железы почки16. Основная островок находится в стереотипных анатомическом положении в пределах данио рерио поджелудочной железы, что позволяет его легко идентифицировать и изоляции. Бета клетки в первичной островок необходимы для глюкозы регулирования, как их генетические абляции приводит к гипергликемии17,18. Кроме того эти бета клетки становятся глюкозы реагировать во время раннего развития данио рерио19. Этот протокол может применяться также для визуализации вторичных островков, которые формируют на Постэмбриональное этапах. Протокол позволяет изображения бета клетки ex vivo, на более поздних стадиях развития и под определенными глюкозы концентрации.
протокол
Все процедуры, включая животных темы были утверждены Закон о благосостоянии животных и с разрешения Landesdirektion Sachsen, Германия (AZ 24-9168.11-1/2013-14, T12/2016).
1. Подготовка
Примечание: Этот протокол предназначен для ex vivo изображений данио рерио первичной островок с двойной трансгенных тг (ins:nls-Renilla-mKO2; cryaa:CFP); TG (ins:GCaMP6s; cryaa:mCherry) 19 данио рерио. В этой трансгенные линии, промоутер инсулина (ins) диски бета клеток конкретное выражение двух трансгенов: nls-Renilla-mKO2, который знаменует ядре бета клеток с мономерных Kusabira оранжевый 2 (mKO2) флуоресценции; и GCaMP6s15, который излучает зеленый флуоресценции в ответ на увеличение уровня внутриклеточного кальция. Бета клетки конкретным выражением GCaMP6s позволяет изучать деятельность глюкозы бета клеток без помех от изменения кальция в окружающих типы клеток.
- Подготовьте свежие фибриноген фондовой (10 мг/мл), растворяя 10 мг говядину фибриногена в 1 мл Ca2 +/Mg2 +-содержащих Hanks сбалансированного солевого раствора (HBSS) в пластиковых пробирок 1.5 мл. Вихрь энергично до тех пор, пока фибриноген порошок растворяется полностью. Держите решение при комнатной температуре по крайней мере 15 минут больше.
Примечание: Запас может храниться при комнатной температуре на 2-3 ч. отмены акции, если решение начинает для полимеризации и становится вязким. - Подготовьте рабочий раствор фибриногена (3,3 мг/мл) путем разбавления фибриноген фондовой трехкратное в HBSS. Например смесь 300 мкл фибриноген акций в 600 мкл HBSS подготовить 900 мкл рабочего раствора фибриногена.
- Приготовляют раствор тромбина (10 ед/мл), растворяя 10 единиц тромбина в 1 мл HBSS или фосфата буфер солевой раствор (PBS).
Примечание: Это решение может быть подготовлен заранее, aliquoted в 50 мкл частей и замороженные при температуре-20 ° C. - Подготовка 200 мм D-глюкозы раствор путем растворения 1.8 g D-глюкозы в 50 мл воды. Храните при 4 ° C для длительного хранения.
- Подготовка 300 мм раствор KCl растворяют 1,1 г KCl в 50 мл воды. Храните при 4 ° C для длительного хранения.
- Закупать стекло дно блюда диаметром 35 мм для монтажа островки.
- Для вскрытия и монтажа островок, использовать стерео микроскоп с люминесцентная лампа и красный фильтр куб (TRITC: возбуждения: 532 – 554 Нм, выбросов: 570 – 613 Нм; или Техас-красный: возбуждения: 540-580 Нм, выбросов: 592-667 Нм).
- Для визуализации приток кальция в бета клетки, использование Перевернутый Конфокальный микроскоп (Zeiss LSM 780 или аналогичные) с 20 X (0.8 NA) оснащены пластина держателя для стекло дно посуды диаметром 35 мм и воздушные цели.
- Подготовьте раствор tricaine метан сульфонат (MS222) 200 мг/Л для euthanizing рыбок данио.
- Закупать Петри 90 мм для данио рерио рассечение.
2. данио рерио первичной рассечение островок и монтаж
- Усыпить рыбы с помощью длительного инкубации в MS222. Для этого осторожно удалите рыбу из аквариума с помощью рыболовную сеть и проинкубируйте его в чашку Петри, содержащие MS222 решение, до тех пор, пока животное показывает не opercular (жабры) движение; как правило это занимает 5 минут передачи рыбы на чашку Петри, содержащие HBSS решение с Ca2 +/Mg2 +.
-
Под микроскопом стерео с люминесцентная лампа и красный фильтр куб вскрыть кожи, охватывающих в правой части брюшной полости животного, чтобы изолировать поджелудочной железы.
- Для этого вырежьте кожу данио рерио от устья до анального плавника, используя острые щипцы. Удаляйте вырезать кожу подвергать живота; Это ножницы предоставляет внутренние органы. С помощью красной флуоресценции mKO2 выражение в бета клетки, установите местонахождение островки путем визуального осмотра под микроскопом. При необходимости удалите долей печени, как они могли бы охватывать островок, что делает его трудно найти.
Примечание: Основная островок находится недалеко от передней части живота, как правило, на правой стороне.
- Для этого вырежьте кожу данио рерио от устья до анального плавника, используя острые щипцы. Удаляйте вырезать кожу подвергать живота; Это ножницы предоставляет внутренние органы. С помощью красной флуоресценции mKO2 выражение в бета клетки, установите местонахождение островки путем визуального осмотра под микроскопом. При необходимости удалите долей печени, как они могли бы охватывать островок, что делает его трудно найти.
- Чистой первичной островок, тщательно удалив окружающие ткани, такие как печень и адипоцитов. Принять меры предосторожности, чтобы не травмировать или мешке островок; После очистки в окружающие ткани, отдельные клетки на поверхности островок становится заметной.
- Пипетка 30 мкл капля HBSS на центр стекло дно блюдо. Расчлененный островок передать это падение.
- Тщательно вымойте островок раз с HBSS и один раз 30 мкл рабочего раствора фибриногена (3,3 мг/мл). Убедитесь в том избежать высыхания островок во время стирки шаги потому, что неспособность сделать это приводит к гибели клеток.
- Медленно и осторожно 10 мкл раствора тромбина (10 ед/мл). Оставьте блюдо и островок нетронутой на 15 – 20 мин наблюдать, что падение тромбина Фибриноген станет вязкой и слегка непрозрачным на данный момент.
3. Ex Vivo жить изображений GCaMP интенсивности флуоресценции в островки первичной данио рерио
- 200 мкл HBSS поверх плесень и поместите блюдо тщательно на пластины держателя конфокального микроскопа. Используйте 20 X, 0.8 NA, воздушные цели для конфокальная томография. Найдите островок с помощью параметра brightfield.
- Использование фильтра для красной флуоресценции для просмотра ядерных mKO2 флуоресценции в бета клетки, сосредоточиться на островке. Индивидуальных ядрах должна быть отчетливо видна.
- Найдите плоскость четких изображений, вручную изменив фокальной плоскости конфокального микроскопа с тем, чтобы двигаться по толщине островок вдоль его оси z. Убедитесь, что плоскости изображения содержит достаточное число (50-100) бета-клеток для изображений, и яркости флуоресценции ядерных mKO2 универсальна, особенно в центре островок.
- Настройка последовательного приобретения для GCaMP6s и mKO2 флуоресценции, используя следующие параметры в «Смарт-меню»: GCaMP6s, возбуждения: 488 нм, выбросов: 500 – 555 Нм, false цвет: зеленый (выберите «ГФП»); mKO2, возбуждения: 561 Нм (mCherry), выбросов: 570 – 630 Нм, false цвет: красный (выберите «mCherry»).
Примечание: С этой настройкой, красный канал будет записать позицию бета клеточных ядер, в то время как зеленый канал будет записывать интенсивности флуоресценции GCaMP. - В «приобретение» режиме установить разрешение изображения 1024 x 1024 пикселей, скорости в 10 и в среднем на 1. Инициировать непрерывной записи, выбрав вариант «Ряды» и установив «Продолжительность» для 500 циклов, с приблизительно 2 s приобретение время в кадре.
Примечание: Первые 50 кадров время серии соответствуют активность бета клеток при концентрации глюкозы 5 мм. Это базовый ответ. Ответивших бета клеток покажет воском и ослабление интенсивности зеленого флуоресценции со временем. Мы заметили, что несколько (1 – 5%), бета-клетки колебаться на 5 мм глюкозы. -
Держите глаза на цикл обработки изображений. После первых 50 кадров, повышают концентрацию глюкозы окружающих решения до 10 мм без остановки записи.
- Не нарушается захвата изображений, нежно Пипетка 5 мкл 200 мм D-глюкозы раствор поверх геля, держа на островок. Приобрести 150 кадры на 10 мм глюкозы.
Примечание: Увеличение концентрации глюкозы увеличит количество бета клетки проходят GCaMP флуоресцентные колебания в зелёном канале. - Убедитесь, что ядер клеток остаются стабильными во время процесса. Если островок широко тряску при приобретении и ядра движутся из фокальной плоскости, отказаться от образца (при необходимости).
- Подождите достаточный период времени для включения полимеризации тромбина Фибриноген прессформы для того, чтобы обеспечить стабильность последующих выборок.
- Не нарушается захвата изображений, нежно Пипетка 5 мкл 200 мм D-глюкозы раствор поверх геля, держа на островок. Приобрести 150 кадры на 10 мм глюкозы.
- На 200 кадров далее увеличить концентрация раствора до 20 мм, нежно закупорить 10 мкл 200 мм D-глюкозы раствор. Приобрести 150 кадры для концентрации 20 мм.
- После 350 кадров depolarize островок, используя 30 мм хлористого калия. Для этого 20 мкл 300 мм раствор KCl. На данном этапе отмечают, что колебания флуоресценции GCaMP6s будет остановить и исправить на высокой интенсивности; бета клетки, которые не реагировать глюкозы может также отображаться увеличение интенсивности зеленого флуоресценции после сложения KCL.
4. Количественная оценка GCaMP флуоресценции трассировку для отдельных бета клетки
Примечание: Для трассировки и количественной оценки реакции отдельных бета клеток на различные уровни глюкозы, количественную оценку интенсивности флуоресценции GCaMP на весь период обработки изображений. Количественная оценка производится на клеточном резолюции. Для этого используйте Фиджи20 для извлечения значения интенсивности флуоресценции GCaMP из изображения (шаги 4.1-4.6) и таблица программного обеспечения или R21 для выполнения анализа (шаги 4,8-4,9).
- Откройте файл изображения в Фиджи с помощью панели «МИС». Для этого выберите «плагин | LSM Toolbox | Показать LSM элементов». В панели «МИС» нажмите кнопку «Открыть LSM» и выберите файл изображения.
Примечание: Для форматов не поддерживается в панели «МИС», преобразуйте их сначала к tiff для анализа. - Экстракт ответы ячейки, используя средство (ROI) региона интерес в Фиджи. Откройте «Диспетчер ROI» в меню «Анализ» в разделе «Инструменты». Вручную извлечь ROI, с помощью «многоугольник выбора инструмента «расположен в панели инструментов.
- Нарисуйте ROI в красный канал, в котором видны бета клеточных ядер. Выберите ROI, таким образом, что она охватывает области, больше, чем ядро клетки для того чтобы включить некоторые из цитоплазмы клеток. Убедитесь, что ROI позиция согласуется между кадрами и при необходимости отрегулируйте положение.
- Добавьте выбранные ROIs «менеджер ROI», нажав на кнопку «Add [t]». Выберите и добавьте несколько ROI рентабельность инвестиций для получения данных на несколько ячеек.
- Далее из меню «Анализ», выберите «Задать измерения». Выберите «Комплексной плотность» для задания извлечения всего флуоресценции интенсивности в пределах области.
- Переход зеленый канал, содержащий флуоресценции GCaMP и выберите пункт «Multi меру» в «ROI менеджер».
Примечание: Это обеспечит измерения интенсивности для клеток на протяжении всего времени серии. - В случае, если ROI позиция должна быть скорректирована за счет движения островок, компилировать вручную измерения интенсивности в разных кадрах. Скопируйте и вставьте значения в отдельную таблицу.
- Получения отметки времени рамки изображения от «LSM Toolbox». Использование «применять марки | Применять t марки | Имя файла | Свалка в текстовый файл» для получения отметки времени. Сохранить отметки времени, с помощью параметра «Сохранить как», или скопировать их в электронную таблицу.
- После компиляции значения интенсивности для всех ячеек, выполните анализ одной ячейки на время или автоматически (например, с помощью формул Excel или R).
-
Анализ отдельных ячеек в два этапа.
- На первом шаге Рассчитайте интенсивность флуоресценции над базовой линией. С этой целью вычисления интенсивности флуоресценции базовых (F0) как среднее по интенсивности флуоресценции для первых 50 кадров (глюкозы 5 мм). Затем вычесть из всего времени серии базовых (0F) (F-F0).
Примечание: несколько клеток может показать ясно GCaMP колебания под базальную глюкозы, которые обычно продолжают следуя стимуляции с более высокой концентрации. Для таких ячеек это возможно только для оценки F0 , принимая средней интенсивности первоначальных рамок, в которых клетки показали снижение в флуоресцировании. - На втором этапе анализа получения окончательной интенсивности флуоресценции GCaMP путем нормализации интенсивности флуоресценции.
Примечание: Это выполняется для устранения различия между островами от разных животных. Отдельные островки отображать различные уровни выбросов флуоресценции после стимуляции глюкозы. - Нормализовать интенсивности флуоресценции, разделив его с самым высоким значением интенсивности. Для этого, вычислить пика интенсивности (FМакс – F0) и разделить вычитается базовые значения пика интенсивности для получения окончательной интенсивности флуоресценции GCaMP (F-F0) / (FМакс – F0).
- На первом шаге Рассчитайте интенсивность флуоресценции над базовой линией. С этой целью вычисления интенсивности флуоресценции базовых (F0) как среднее по интенсивности флуоресценции для первых 50 кадров (глюкозы 5 мм). Затем вычесть из всего времени серии базовых (0F) (F-F0).
- Выбросите клетки, которые не демонстрируют изменения в интенсивности, после стимуляции KCl, как они могут быть нездоровым или повреждены.
- Для проведения анализа (шаги 4.9 – 4.10) в R, используйте сценарий R (plotcelltrace. R) представил с этой рукописи.
Результаты
Используя протокол, описанные выше, были проанализированы ответы глюкозы бета-клеток в островок zebrafish 45 дней после оплодотворения (dpf). Для этого основная островок был расчлененный Усыпленных животных и монтируется в тромбина Фибриноген плесень в стекло дно блюдо. Островок был погружен в HBSS, содержащие глюкозу 5 мм. Концентрация глюкозы была увеличена на основе поэтапного до 10 мм и 20 мм. Были записаны ответы бета клеток на повышение концентрации глюкозы. Наконец бета клетки были деполяризованный с помощью 30 мм KCl (рис. 1). С помощью KCl деполяризации индуцирует вход кальция в здоровых бета клеток.
Используя программное обеспечение для анализа данных и Фиджи, GCaMP6s интенсивность флуоресценции отдельных бета-клеток извлекается и нормализуется (рис. 2). Как видно из трассировки интенсивности флуоресценции, отдельные бета клетки отображения колебаний в GCaMP6s флуоресценции после стимуляции глюкозы, который останавливается после стимуляции KCl. Метод обеспечивает сотовой разрешение бета клетки глюкозы оперативность и окно в их функциональность.
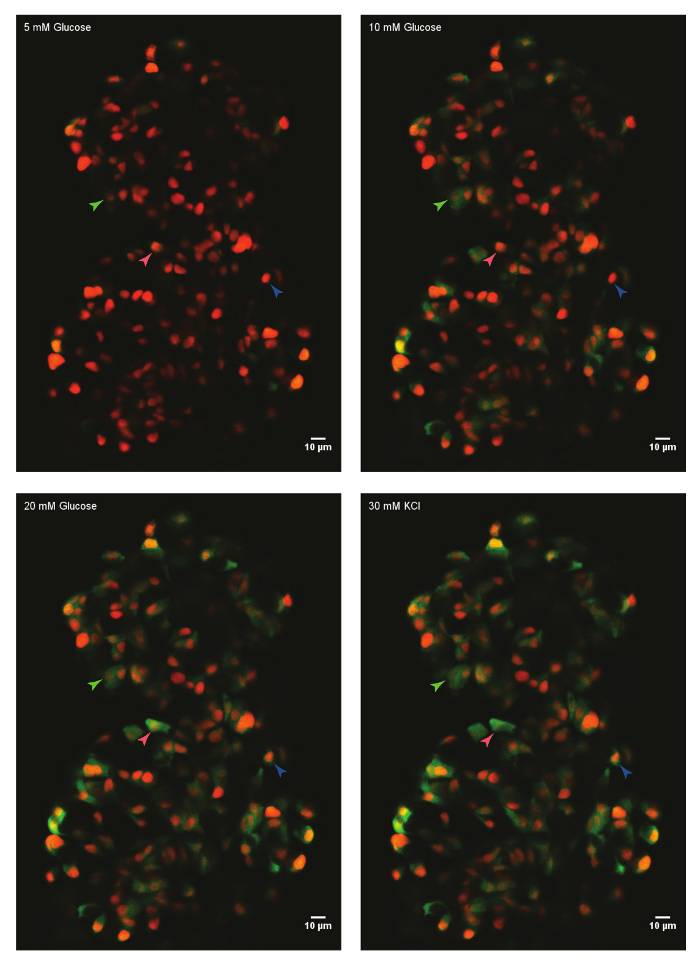
Рисунок 1: Ex vivo жить изображений притока кальция, с помощью GCaMP6s бета-клетках данио рерио. Основной остров от Tg(ins:nls-Renilla-mKO2); TG(INS:GCaMP6s) данио рерио (45 dpf) монтируется в тромбина Фибриноген плесени и инкубировали с глюкозой 5 мм (базальный). Бета клетки были помечены красной ядерной маркер, в то время как GCaMP6s флуоресценции присутствует в зелёном канале. Островок был стимулируется с глюкозы рампа, состоящий из последовательной инкубации с 10 мм и 20 мм D-глюкозы и деполяризованный через добавление 30 мм, KCl. стрелок Марк отдельных бета клетки, деятельность которых была проанализирована. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
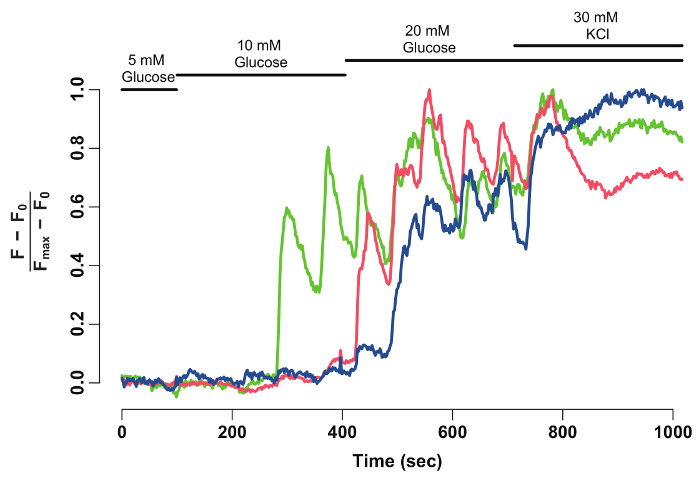
Рисунок 2: нормированный GCaMP6s флуоресценции интенсивности трассировку для отдельных бета клетки. Нормализованное след интенсивности GCaMP6s флуоресценции для бета клетки, отмеченные стрелки на рисунке 1. Ось x указывает время в секундах. В верхней бары изображают концентрация глюкозы и хлористого калия в HBSS среде. Ось y обозначает нормализованные флуоресценции интенсивности во времени серии. Для этого базовые интенсивности (0F) рассчитывается как средняя интенсивность во время инкубации в глюкозу 5 мм. Это вычитается из всего ряды данных (F - F0). Интенсивность за базовый нормируется максимальной интенсивности, отображаемые в ячейке (F - F0) / (FМакс- F0). Нормализованное трассировки показывает колебательной реакции бета-клеток в глюкозу, которая стабилизирует когда клетки являются деполяризованный с 30 мм KCl. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Обсуждение
Здесь мы продемонстрировать технику для количественной оценки реагирования глюкозы бета клеток в одной резолюции. Это стало возможным путем мониторинга внутриклеточной концентрации кальция с помощью индикатора генетически закодированный кальция, GCaMP6s. Активность бета клеток является захваченных ex vivo , монтируя островок в тромбина Фибриноген плесень. Важнейшим шагом протокола является стабильность формы. Необходимо достаточное время для фибриноген раствориться в HBSS решения. Без этого плесень не полимеризоваться достаточно обеспечить стабильность во время визуализации сессии. Островок монтируется в тромбина Фибриноген плесени и погружен в СМИ культуры клеток может оставаться жизнеспособным для по крайней мере неделю (данные не показаны). Альтернативы тромбина Фибриноген плесени, таких как температура расплава агарозы, могут быть использованы для монтирования островок22. Другой критический параметр — рассечение островок. Во время этого шага тканей, окружающих островок необходимо удалить без ранив или тыкать островок. Умелыми дисекция приходит с практикой.
Ограничение визуализации протокола является ограничение в одной плоскости конфокальный островок. Это делается для захвата динамики приток кальция в пределах отдельных бета клеток. Z-стека по всей толщине островок приводит к низкой скорости и потери колебательного сигнала от отдельных клеток. Это ограничение может быть улучшено с помощью быстрее средства конфокальный изображений например микроскопии спиннинг диск, чтобы включить захват кальция динамика в 3 измерениях. Еще одна граница будет в vivo кальция изображений12. Прозрачный характер zebrafish эмбриона или использование пигмент менее штаммов данио рерио взрослых23 может открыть возможность для в vivo изображений в будущем.
Визуализация активности бета клеток с высоким пространственным и временным разрешением позволяет исследовать функциональные гетерогенность среди отдельных бета клеток. Этот подход может помочь пролить свет на наличие бета клеток подгрупп населения. Недавно несколько исследования показали наличие подгрупп населения номинально однородных бета клетки24,25,26. Ex vivo изображений могут быть объединены с генетическими журналистами, чтобы характеризовать суб населения реакции на глюкозу. Кроме того объединяя изображения установки с фармакологическими стимуляции может позволить для проверки соединений, которые могли бы улучшить функциональность бета клеток.
В резюме представленные здесь методика позволяет количественная оценка и сравнение глюкозы реагирования для отдельных бета клеток. Это обеспечивает прямой окно в бета клетки функциональность, важным параметром в развитие диабета.
Раскрытие информации
Авторы заявляют не конкурирующих финансовых интересов.
Благодарности
Мы благодарим членов Нинов лаборатории для комментариев на рукописи, члены центра восстановительной терапии Дрезден (КГПОГ) рыбы и микроскопии фонда для оказания технической помощи. Н.н. поддерживается путем финансирования от DFG-КГПОГ, кластер передового опыта на ту-Дрезден, Немецкий исследовательский фонд (DFG) и немецкий центр для исследования мочеизнурения (DZD).
Материалы
| Name | Company | Catalog Number | Comments |
| Transgenic Zebrafish line: Tg(ins:nls-Renilla-mKO2; cryaa:CFP); Tg(ins:GCaMP6s; cryaa:mCherry) | By request from authors | ||
| Stereo microscope | ZEISS | 495015-0001-000 | SteREO Discovery.V8 |
| Fluorescence lamp | ZEISS | 423013-9010-000 | Illuminator HXP 120 V |
| Red Filter Cube | ZEISS | 000000-1114-462 | Filter set 45 HQ TexasRed |
| Confocal Microscope | ZEISS | LSM 780 | |
| Bovine fibrinogen | Sigma | F8630 | |
| HBSS (Hanks' Balanced Salt solution) | ThermoFisher | 14025092 | |
| Thrombin | Sigma | T4648 | |
| D-Glucose | Sigma | G8270 | |
| KCl | Sigma | P9333 | |
| 35 mm diameter glass-bottom dishes | ThermoFisher | 150680 | |
| tricaine methane sulfonate | Sigma | E10521 | |
| Fine Forceps | Fine Science Tools | 11445-12 | |
| FIJI, using ImageJ Version: 2.0.0-rc-43/1.50e | https://fiji.sc/ | ||
| R, version 3.2.4 | https://www.r-project.org/ | ||
| RStudio | https://www.rstudio.com/ | ||
| plotcelltrace.R | A custom script provided with the manuscript |
Ссылки
- Kahn, S. E. The relative contributions of insulin resistance and beta-cell dysfunction to the pathophysiology of Type 2 diabetes. Diabetologia. 46 (1), 3-19 (2003).
- Ogurtsova, K., et al. IDF Diabetes Atlas: Global estimates for the prevalence of diabetes for 2015 and 2040. Diabetes Res Clin Pract. 128, 40-50 (2017).
- Pipeleers, D. G. Heterogeneity in pancreatic beta-cell population. Diabetes. 41 (7), 777-781 (1992).
- MacDonald, P. E., Joseph, J. W., Rorsman, P. Glucose-sensing mechanisms in pancreatic beta-cells. Philos Trans R Soc Lond B Biol Sci. 360 (1464), 2211-2225 (2005).
- Hellman, B., et al. Glucose induces oscillatory Ca2+ signalling and insulin release in human pancreatic beta cells. Diabetologia. 37, S11-S20 (1994).
- Bergsten, P., Grapengiesser, E., Gylfe, E., Tengholm, A., Hellman, B. Synchronous oscillations of cytoplasmic Ca2+ and insulin release in glucose-stimulated pancreatic islets. J Biol Chem. 269 (12), 8749-8753 (1994).
- Wollheim, C. B., Pozzan, T. Correlation between cytosolic free Ca2+ and insulin release in an insulin-secreting cell line. J Biol Chem. 259 (4), 2262-2267 (1984).
- Pace, C. S., Price, S. Electrical responses of pancreatic islet cells to secretory stimuli. Biochem Biophys Res Commun. 46 (4), 1557-1563 (1972).
- Ohara-Imaizumi, M., Nakamichi, Y., Tanaka, T., Ishida, H., Nagamatsu, S. Imaging exocytosis of single insulin secretory granules with evanescent wave microscopy: distinct behavior of granule motion in biphasic insulin release. J Biol Chem. 277 (6), 3805-3808 (2002).
- Soria, B., Martin, F. Cytosolic calcium oscillations and insulin release in pancreatic islets of Langerhans. Diabetes Metab. 24 (1), 37-40 (1998).
- Kenty, J. H. R., Melton, D. A. Testing pancreatic islet function at the single cell level by calcium influx with associated marker expression. PLoS One. 10 (4), e0122044 (2015).
- Speier, S., et al. Noninvasive in vivo imaging of pancreatic islet cell biology. Nat Med. 14 (5), 574-578 (2008).
- Bootman, M. D., Rietdorf, K., Collins, T., Walker, S., Sanderson, M. Ca2+-sensitive fluorescent dyes and intracellular Ca2+ imaging. Cold Spring Harb Protoc. 2013 (2), 83-99 (2013).
- Grynkiewicz, G., Poenie, M., Tsien, R. Y. A new generation of Ca2+ indicators with greatly improved fluorescence properties. J Biol Chem. 260 (6), 3440-3450 (1985).
- Chen, T. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Hesselson, D., Anderson, R. M., Beinat, M., Stainier, D. Y. R. Distinct populations of quiescent and proliferative pancreatic beta-cells identified by HOTcre mediated labeling. Proc Natl Acad Sci U S A. 106 (35), 14896-14901 (2009).
- Pisharath, H., Rhee, J. M., Swanson, M. A., Leach, S. D., Parsons, M. J. Targeted ablation of beta cells in the embryonic zebrafish pancreas using E. coli nitroreductase. Mech Dev. 124 (3), 218-229 (2007).
- Curado, S., Stainier, D. Y. R., Anderson, R. M. Nitroreductase-mediated cell/tissue ablation in zebrafish: a spatially and temporally controlled ablation method with applications in developmental and regeneration studies. Nat Protoc. 3 (6), 948-954 (2008).
- Singh, S. P., et al. Different developmental histories of beta-cells generate functional and proliferative heterogeneity during islet growth. Nat Commun. 8 (1), 664 (2017).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat Methods. 9 (7), 676 (2012).
- R Core Team. . R: A Language and Environment for Statistical Computing. , (2016).
- Friedman, R. S., et al. An evolving autoimmune microenvironment regulates the quality of effector T cell restimulation and function. Proc Natl Acad Sci. 111 (25), 9223-9228 (2014).
- White, R. M., et al. Transparent adult zebrafish as a tool for in vivo transplantation analysis. Cell Stem Cell. 2 (2), 183-189 (2008).
- Bader, E., et al. Identification of proliferative and mature β-cells in the islets of Langerhans. Nature. 535 (7612), 430-434 (2016).
- Dorrell, C., et al. Human islets contain four distinct subtypes of β cells. Nat Commun. 7, 11756 (2016).
- Johnston, N. R., et al. Beta Cell Hubs Dictate Pancreatic Islet Responses to Glucose. Cell Metab. 24 (3), 389-401 (2016).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены