Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Оценка синаптических интерфейса первичного человека Т-клеток в периферической крови и лимфоидной ткани
В этой статье
Резюме
Протокол описывает метод для изучения первичного поликлональных человеческих клеток T способность образовывать синаптических интерфейсов с использованием Вселенский липидных бислоев. Мы используем этот метод, чтобы показать возможности формирования дифференциального синапса человека первичной Т-клеток, полученных из лимфатических узлов и периферической крови.
Аннотация
Нынешнее понимание динамики и структурных особенностей T-клетки синаптической интерфейсов был во многом определяется с помощью стекла поддерживает планарные бислоев и в пробирке-производных Т-клеток клоны или линии1,2 ,3,4. Как эти выводы касаются первичных человеческих клеток T изолированы от крови или лимфоидной ткани, отчасти из-за значительных трудностей в получении достаточное количество клеток для анализа5не известно. Здесь мы решить эту путем разработки методики использования многоканальных потока слайды для создания Вселенский липидных бислоев содержащие активации и сцепления молекул. Низкая высота слайды потока способствует седиментации быстрого клеток для синхронизации клеток: бислой вложения, тем самым позволяя исследователей для изучения динамики формирования синаптических интерфейс и кинетика гранулы релиза. Мы применяем этот подход для анализа синаптических интерфейс как мало, как 10-4 до 105 первичных криоконсервированных Т-клетки изолированы от лимфатических узлов (LN) и периферической крови (PB). Результаты показывают, что роман Вселенский липидного бислоя техника позволяет Исследование биофизических свойств первичного человека Т-клеток, полученных из крови и тканей в контексте здоровья и болезни.
Введение
Научные знания о структурных особенностей Т-клеток иммунной синапсов и их связь с функциональной активности Т-клеток была сформирована главным образом от изучения клеточных линий и клоны производным от PB. В какой степени эти выводы относятся к основной Т-клетки получены из крови или лимфоидной ткани человека остается неясным, как до настоящего времени не были проанализированы синаптических интерфейсов Т-клеток, проживающих в лимфоидных и других тканях. Главное новые данные показывают, что ткани резидентов и лимфоидных орган производные Т-клетки могут иметь значительные различия в их фенотипа и функциональной активности по сравнению с теми в PB6,7. Это дальнейшее затвердевших необходимость лучше понять особенности синаптических интерфейса Т-клеток в первичных человеческих клеток T.
С этой целью мы разработали подход Роман мини-масштаб использования липидных бислоев встроены в многоканальный потока слайды, что позволяет нам выполнять изображений T-клеток/бислой интерфейсов с менее чем 105 первичных Т-клетки изолированы от человеческого PB и LN. Этот роман техника позволяет Исследование биофизических свойств первичных человеческих Т-клеток синаптических интерфейсов для лучшей модели и понять в естественных условиях взаимодействия ячеек.
протокол
Это исследование было проведено в соответствии с Хельсинкской декларации. Письменное информированное согласие было получено от всех участников, и с одобрения Совета организационного обзора в университете штата Пенсильвания (СИБ #809316, IRB # 815056) были приобретены образцы крови и лимфатических узлов. Все человеческие субъекты были взрослых. Образцов пуповинной крови были любезно предоставлены родов кафедры акушерства и гинекологии в Университете Томаса Джефферсона. Все образцы были обезличенных.
1. изоляция CD4 клеток+ T для анализа изображений
-
Размораживание 1 мл Алиготе, содержащие 107 замороженные периферической крови одноядерных клеток (получения) или лимфатических узлов мононуклеарных клеток (LNMCs) из собранных образцов. В стерильные капот добавьте талой клетки 9 мл RPMI, дополненная пенициллина/стрептомицина и глутамина.
- Центрифугировать клетки для 10 мин на 300 x g при 4 ° C, аспирационная супернатанта и Ресуспензируйте клетки в 5 мл дополнениями RPMI, содержащие 10% FBS (полный средний). Инкубировать клетки на ночь в инкубатор CO2 при 37 ° C.
- Следующий день, очищают CD4 клеток+ T негативные иммуномагнитная сортировки, используя набор коммерчески доступных согласно инструкции производителя.
- Чтобы измерить количество свежий очищенный CD4+ T клетки, смешать 5 мкл суспензии клеток с равным объемом раствора Трипановый синий. Загрузить Горяева с клетки Трипановый синий смеси и количество живых клеток внутри 5 секций Горяева.
- Возьмите среднего количества клеток и определить количество клеток в оригинальной суспензию клеток: количество клеток/1 мл = среднее количество x 2 x 10-4. Если общее количество изолированных клеток слишком мал, используют клетки как без подсчета.
- Центрифуга клетки на 300 x g 10 мин и Ресуспензируйте их в assay buffer (20 мм HEPES, рН 7,4, 137 мм NaCl, 2 мм Na2HPO4, 5 мм D-глюкозы, 5 мм KCl, 1 мм MgCl2, 2 мм CaCl2и 1% человеческого сывороточного альбумина) 105 < /C13 > клеток/50 мкл или меньше и сохранить клетки на 4 ° C (для 1-2 ч) до готовых к использованию в экспериментах.
- Утилизация всех биологических отходов согласно соответствующих институциональных руководящих принципов.
- При желании как популяции клеток управления, подготовить активированные CD8 Т-клетки из пуповинной крови КСДОР, место 107 клеток в полной среды в колбе культуры T25 покрыты смесь антител анти CD3 и анти CD28 на 10 мкг/мл и 1 мкг/мл 5 мл , соответственно.
- Следующий день, удалить активированный пуповинной крови клеток из колбы, мыть их 1 x со свежими завершить среднего и расширить клетки присутствии рекомбинантного ИЛ-2 (100 ед/мл) за 2 недели.
- Очищение крови шнура CD8+ T-клеток негативные иммуномагнитная сортировки с помощью коммерчески доступных комплекта согласно инструкции производителя. Подсчитать количество ячеек и обмена СМИ в Пробирной буфер, как описано в шагах 1.3-1.6 для LN и PB CD8+ T клетки.
2. компоненты для подготовки Вселенский липидных бислоев
- Подготовка 3 вида липосомы, как описано в других разделах5: (a) 0,4 мм DOPC (1,2-dioleoyl -sn- glycero-3-фосфохолин) липосомы, (b) 0,4 мм DOPC липосомы, содержащие 33 моль % собак-НТА (1,2-dioleoyl -sn- glycero - 3-[(N-(5- амино-1-carboxypentyl) хелатный иминодиацетатный кислота) succinyl] (соли аммония)) липиды, (c) 0,4 мм DOPC липосомы, содержащие 4 моль % Biotinyl-Cap-PE (1,2-dioleoyl -sn- glycero-3-фосфоэтаноламина - N-(Кап biotinyl) (натриевая соль)).
-
Готовят раствор 5% казеин как описано5.
- Растворяют 5 г порошка казеина в 100 мл ультрачистая вода и 350 мкл гидроксида натрия 10 М. Перемешать все на регулярные магнитную мешалку на медленной скорости согласно шкале доступен, при комнатной температуре на 2 часа и затем на ночь при 4 ° C. Отрегулируйте пэ-аш 7.3 и ультрацентрифугирования решение для 2 ч в 100,000 x g при 4 ° C. Фильтр супернатант с 0,22 мкм стерильным фильтром и хранить решение в аликвоты-80 ° c.
Предупреждение: раствор гидроксида натрия может вызвать химические ожоги и может побудить постоянную слепоту после контакта с глазами. Используйте резиновые перчатки, одежду и средства защиты глаз при обработке этого химического вещества или его решений.
- Растворяют 5 г порошка казеина в 100 мл ультрачистая вода и 350 мкл гидроксида натрия 10 М. Перемешать все на регулярные магнитную мешалку на медленной скорости согласно шкале доступен, при комнатной температуре на 2 часа и затем на ночь при 4 ° C. Отрегулируйте пэ-аш 7.3 и ультрацентрифугирования решение для 2 ч в 100,000 x g при 4 ° C. Фильтр супернатант с 0,22 мкм стерильным фильтром и хранить решение в аликвоты-80 ° c.
-
Антитела анти CD3 этикетки с биотина производить моно bionylated молекулы антитела с ранее описанный подход8.
- Приготовляют раствор биотин-PEO4-ГСЗ в диметилсульфоксида (ДМСО) на 0,1 мг/мл. Мкл 3.7 биотин-PEO4-NHS решения 1 мг антител в 0,5 мл фосфат амортизированное saline (PBS) содержащий бикарбонат натрия 100 мм.
- Инкубируйте смесь для 2 ч при комнатной температуре. Приготовляют раствор эфира Alexa Fluor 488 ГСЗ в 10 мг/мл в ДМСО. Добавьте решение Эстер Alexa Fluor 488 NHS антитела, обозначены биотин-PEO4-NHS в десятикратного Молярная избыток.
- Инкубируйте смесь для 1 ч при комнатной температуре с медленно помешивая на регулярной магнитной мешалкой. Отдельный несвязанный краситель, используя размер-гель-проникающей хроматографии.
- Определение концентрации антитела путем измерения оптической плотности раствор антител на 280 Нм (280). Измерение оптической плотности обозначенные антитела на 577 Нм (577).
- Определите коэффициент краситель антитела, используя следующее уравнение:
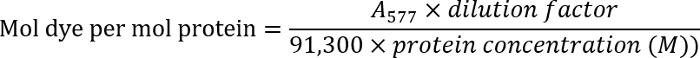
Примечание: Найти дополнительные подробности в протоколе производителя.
-
Экспресс рекомбинантный растворимый белок ИКАМ-1 в системе выражения дрозофилы , как описано ранее,3,4,9,10.
- Клон, с cDNA кодирования, ectodomain ИКАМ-1 в выражение дрозофилы вектор ПЛТ/V5-его с индуцибельной металлотионеина промоутер для получения рекомбинантных белков, с его добавлением6 тег на конце C-терминала.
- Совместное transfect S2 клетки с результате содержащие плазмида ИКАМ-1 и вектора выражения G418. Выберите стабильный transfectants носители Шнейдера дрозофилы , дополненная 10% плода телячьей сыворотки (FCS) и 0,5 мг/мл G418 за 3 недели. Разверните клеток в сыворотке бесплатно Насекомое среднего и побудить выражение протеина с 0,5 мм CuSO4 для 3 d.
- Сосредоточиться на культуру супернатанта 10 x и dialyze против PBS через концентратор тангенциальном потоке как описано11.
- Применять концентрированные культуры супернатанта столбец, содержащий Sepharose с ковалентно иммобилизованных моноклональных антител анти ICAM-1 и элюировать привязанного ИКАМ-1 с буфером 50 мм глицин, pH 3.0. Немедленно нейтрализовать eluted ИКАМ-1 белок с буфером 2 М трис, рН 8.0.
- Dialyze eluted материал против PBS, рН 8.0 и добавить dialyzed материал для столбца содержащие Ni-НТА агарозы. Элюировать растворимых ИКАМ-1 с 200 мм имидазола, рН 8.0. Dialyze eluted материал против PBS буфер, рН 8.0.
- Метки очищенной ИКАМ-1 с Эстер Cy5 NHS согласно инструкции производителя.
Примечание: Лучший окончательный краситель белка соотношение составляет 1:1.
- Производят Fab фрагменты из антител анти CD107a, папаин пищеварения и очищения Fab фрагментов хромотографией ионного обмена, как описано выше3. Метка, Fab фрагменты с Эстер Alexa Fluor 568 NHS согласно инструкции производителя.
3. формирование бислоев стекла поддерживает планарные липидов
- Приготовляют раствор свежие кислой пираньи, смешивая 140 мл концентрированной серной кислоты и 60 мл 30% перекиси водорода. Мойте стекло coverslips для потока слайдов путем замачивания их в растворе кислоты Пиранья для 30 min. удерживать coverslip стекло пинцетом полипропиленовые ножничного типа.
Предупреждение: Пираньи решение является чрезвычайно сильный окислитель. Не забывайте носить защитные очки или защитные очки или анфас щит вместе с толстые резиновые перчатки во все времена при обработке решение. Работаете только с пиранья решения под вытяжного шкафа. Избегайте Отопление, транспортировки или покачивая его в любое время во время использования, как он может взорваться. Сбор отходов пираньи в стеклянной бутылке с отверстием, содержащих свинец. Обратитесь институциональные Комитета по безопасности о надлежащей утилизации отходов. -
Полоскания мыть coverslips 7 x с ультрачистая вода последовательно перечислив их в стаканах, содержащие пресной воды. Набор, который мокрой coverslips сторону, чтобы остальные воды скатываются чистого стекла, оставляя сухой стекла.
- Кроме того Используйте наконечник пипетки придает вакуумный насос тщательно удалить оставшиеся капли воды из coverslips.
- В стерильные капот выполняют разведения различных липиды для получения липосом смесь для приготовления бислоев. Во-первых объединить 37 мкл DOPC липосом и 3 мкл Biotinyl-Cap-PE липосом. Во-вторых Смешайте 14 мкл DOPC липосом и 15 мкл собак-НТА липосом. В-третьих добавьте 1 мкл первый микс 29 мкл второй смеси для изготовления смеси окончательный липосом.
-
В стерильные капот настроить рабочую область с сухим coverslips рядом. Аликвота 2 мкл окончательного липосом смеси (см. шаг 3.3) точно в центре канала самоклеящиеся слайд. Сразу же и очень точно выровнять чистой и сухой coverslip с слайд и осторожно опустите coverslip на липкой стороне слайда.
- Если более чем один слайд, работаете на одном слайде в то время, так как липосом смесь быстро испаряется. Переверните слайд и использовать внешнее кольцо полипропиленовые ножничного типа щипцы для применения мягкое давление к периферической контакта coverslip с горкой, убедившись, что скольжения плотно подключен на слайд, чтобы не допустить утечки.
Примечание: Не нажимайте против каналы слайд чтобы избежать ломки или трещин coverslip. - Переверните слайд снова и отметьте положение сформированных бислой, который выглядит как падение между coverslip и канала слайд, рисунок 4 точками с постоянным маркером вокруг бислой на стороне внешней слайд Ассамблеи.
- Если более чем один слайд, работаете на одном слайде в то время, так как липосом смесь быстро испаряется. Переверните слайд и использовать внешнее кольцо полипропиленовые ножничного типа щипцы для применения мягкое давление к периферической контакта coverslip с горкой, убедившись, что скольжения плотно подключен на слайд, чтобы не допустить утечки.
- До первой инъекции жидкости в канал назначить один порт канала входного отверстия и другие, как порт выхода и поддерживать это обозначение на протяжении всего эксперимента.
- Чтобы избежать образования пузырьков, вставьте конец кончика пипетки непосредственно в порт вход канала. Медленно залейте 50 мкл теплой каналы слайда (по крайней мере комнатной температуре) аналитического буфера (см. шаг 1,5 для буфера композиции).
- Подготовьте раствор хлорида nickel(II) 0,5 М. Оттепель Алиготе 2 мл раствора казеина в водяной бане при 37 ° C за 30 минут и дополнить его с раствором хлорида никеля в конечной концентрации 200 мкм.
- Вымойте бислоев сначала инъекций 100 мкл раствора казеина в порту въезда канала и затем сразу удаляя 100 µL из порта выхода на слайде, закупорить. Блокировать бислоев с тем же решением путем инъекций 100 мкл раствора казеина в порт входа каждого канала и инкубации слайд для 45 мин при комнатной температуре.
- Оттепель аликвоты Cy5-ICAM-1-его6 и стрептавидина белков. Объединить белков в assay buffer конечная концентрация 2 мкг/мл каждый. Центрифуга решение для 30 мин на 20000 x g и 4 ° C для удаления любых агрегатов.
- Удалите остальные блокирования решения от порта выхода канала слайд, закупорить. Придать 100 мкл раствора, содержащего ИКАМ-1 и стрептавидина порту въезда.
- Инкубируйте слайд для 45 мин при комнатной температуре. Удалите излишки раствора белка из порта выхода. Вымойте бислой 2 x сначала инъекций 100 мкл аналитического буфера в порту въезда канала и затем немедленно удалить 100 µL из порта выхода.
- Разбавьте антитела анти CD3 Alexa-фтор-488-маркировку с Пробирной буфера до конечной концентрации 2 мкг/мл. Привнести 100 мкл раствор антител в порт въезда слайда и проинкубируйте 45 мин при комнатной температуре. Удалите излишки раствора белка из порта выхода. Вымойте бислой 2 x с 100 мкл аналитического буфера как шаг 3.11.
4. визуализация взаимодействия клеток T с планарной бислоя
-
Разогрейте сцену и цель микроскопом конфокальный или полного внутреннего отражения флуоресцирования (TIRF), до тех пор, пока температура является достижение равновесного уровня при 37 ° C. Настройка слайд с bilayer(s) на сцене с подогревом. Переместить сцену в соответствующей позиции согласно чернила марки и сосредоточиться на бислой, используя флуоресценции Cy помечены ИКАМ-1 молекул.
- Используйте 61 X цель для confocal микроскопа, или 100 X цель для TIRF микроскопа, с параметрами соответствующий фильтр.
-
Для гранул релиз изображений на TIRF микроскопии, добавить Alexa-фтор-568-помечены анти CD107a антитела Fab фрагментов в суспензию клеток в конечной концентрации 4 мкг/мл до инъекции клеток в порты входа.
- Ресуспензируйте подготовленный CD4+ T клетки изолированы от LN или PB или шнура крови и вставляют 50 мкл суспензии клеток входного отверстия канала слайд, содержащий бислоя.
- Выберите нужное количество полей и записи изображения каждого поля 1 x каждые 2 мин за 30 мин после инъекции.
- Эксплуатировать ярко поле, отраженного света и флуоресцентные каналов (Alexa 488 и Cy5) конфокального микроскопа для получения изображения. Используйте режим TIRF Alexa-фтор-488 и Alexa-фтор-568 флуоресценции и widefield для флуоресценции Cy5, а светлые области изображения, TIRF микроскопа.
5. анализ
- Анализ полученных изображений, с помощью соответствующего программного обеспечения. Наблюдать за морфологии клеток в передаваемых легкие образы и исключить кластерного и видимые повреждения или apoptotic клетки из анализа. Включите в анализ только те ячейки, которые плодотворно взаимодействовать с поверхностью бислой (то есть, клетки накапливают флуоресценции Alexa-фтор-488 (антитела анти CD3) в интерфейсе).
- Определите размер области адгезии клеток в 20 мин после начала взаимодействия клеток бислоя.
Примечание: Адгезии область является темной разработан в интерфейсе ячейки бислой на вмешательство отражение микроскопии (IRM) изображения. - Наблюдать за любое накопление флуоресценции Cy5-ICAM-1 и формирование перекрестка Кольцевой молекулами сегрегированных Cy-ICAM-1 на клетки бислой интерфейс. Если накопленная ИКАМ-1 молекулы сформировали кольцо Джанкшен адгезии на по крайней мере два последовательных изображений, назначить такие клетки клетки, развитие периферийных супрамолекулярные активации кластера (pSMAC)12.
- Оцените релиз гранул путем измерения интенсивности флуоресценции Alexa-фтор-568 в интерфейсе Т клеток бислой флуоресценции фон за пределами области контакта в непосредственной близости к ячейке. Назначьте клетки с соотношением Alexa-фтор-568 сигнала к фон по меньшей мере 1,3 degranulating клетки.
Результаты
Во-первых, мы сравнили структуре синаптических интерфейса, образованный активированные CD8 пуповинной крови, полученных+ T клетки подвергаются липидных бислоев построен либо в традиционных крупномасштабных потока системы клеток (см. Таблицу материалов ...
Обсуждение
Роман метод, описанный здесь использует аналогичные реагентов, необходимых для построения плоской бислоев в поток обычных клеток5 и может успешно применяться для выполнения визуализации первичных человеческих клеток T – бислой интерфейсов3,4 <...
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Эта работа была поддержана грантом R01AI118694 низ для Майкл р. Беттс, которая включает премию суб 566950 Юрий Sykulev. Мы благодарим Сидни Киммел рак центра Bioimaging общий ресурс за их прекрасную поддержку.
Материалы
| Name | Company | Catalog Number | Comments |
| CD4 T cell isolation kit, human | Miltenyl Biotec | 130-096-533 | |
| CD8 T cells Isolation Kit, human | Miltenyl Biotec | 130-096-495 | |
| DOPC | Avanti Polar Lipids | 850375C | |
| DOGS NTA | Avanti Polar Lipids | 790528C | |
| Biotinyl Cap PE | Avanti Polar Lipids | 870273C | |
| Human Serum Albumin | Octapharma USA | NDC 68982-643-01 | |
| sticky-Slide VI 0.4 | ibidi | 80608 | |
| Coverslips for sticky-Slides | ibidi | 10812 | |
| Bioptech FCS2 Chamber | Bioptech | 060319-2-03 | |
| anti-CD3 antibody | Thermo Fisher Scientific | 16-0037-81 | OKT3 clone, hybridoma cells are available from ATCC |
| anti- CD28 antibody | Genetex | GTX14664 | 9.3 clone |
| Casein | Sigma | C5890 | |
| Biotin-PEO4-NHS | Thermo Fisher Scientific | 21329 | |
| DMSO | Sigma | D2650-5 | |
| Alexa Fluor 488 protein labeling kit with column for labeled protein purification | Thermo Fisher Scientific | A10235 | |
| Alexa Fluor 568 protein labeling kit with column for labeled protein purification | Thermo Fisher Scientific | A10238 | |
| Amersham Cy5 NHS Ester | GE Life Science | PA15101 | |
| pMT/V5-His A, B, C Drosophila Expression Vectors | Thermo Fisher Scientific | V412020 | |
| pcopneo, G418 Drosophila expression vector for positive selection | ATCC | 37409 | |
| Serum free Drosophial media Insect-XPRESS | Lonza | 12-730Q | |
| Hybridoma YN1/1.7.4 | ATCC | CRL1878 | The hybridoma secrets antibody against ICAM-1. |
| Cyanogen bromide-activated-Sepharose 4B | Sigma-Aldrich | C9142 | Utilized for preparation of Sepharose with covelently bound anti-ICAM antibody. |
| MasterFlex tangential flow concentrator | Cole-Parmer | 77601-60 7592-40 | Used for ICAM-1 containing supernatant concentration and dialysis of ICAM-1 containing supernant |
| Centramate Lab Tangential Flow Systems | Pall Laboratory | FS002K10 OS010T12 FS005K10 | Used for ICAM-1 containing supernatant concentration and dialysis of ICAM-1 containing supernant |
| Ni-NTA Agarose | QIAGEN | 30210 | |
| Dialysis tubing | Spectra/Por | 131384 | |
| Papain from papaya latex | Sigma | P3125 | |
| mouse anti-human antibody against CD107a | BD Bioscences | 555798 | Clone H4A3 |
| Ansell Natural Blue Gloves | Fisher Scientific | 19-014-539 | |
| Nalgene Polypropylene Scissor-Type Forceps | Thermo Fisher Scientific | 6320-0010 | |
| Streptavidin | ProZyme | SA10 | |
| Confocal microscope | Nikon | Nikon TiE inverted microscope equipped with PFS for long-term image stability control, 60X oil objectives, 4 lasers with excitation lines at 405, 458, 488, 514, 561, and 640 nm, 2 GaAsP detectors and 2 high sensitivity PMTs, DIC transmitted light, Programmable X,Y,Z stage for multiple positions and stitching of large areas, time lapse functions, Tokai-Hit temperature and CO2-controlled chamber for live imaging, and anti-vibration isolation table | |
| TIRF microscope | Andor | Andor Revolution XD system equipped with Nikon TIRF-E illuminator, Lasers with 405,488,561 and 640 lines, DIC transmitted light, Yokogawa CSU-X1 spinning disk head for confocal imaging, 100/1.49 NA objective, Andor iXon X3 EM-CCD camera, objective heater, and a piezoelectric motorized stage with Perfect Focus System (PFS) | |
| MetaMorph Premier Image Analysis Software | Molecular devices |
Ссылки
- Grakoui, A., et al. The immunological synapse: a molecular machine controlling T cell activation. Science. 285, 221-227 (1999).
- Somersalo, K., et al. Cytotoxic T lymphocytes form an antigen-independent ring junction. Journal of Clinical Investigation. 113, 49-57 (2004).
- Beal, A. M., et al. Protein kinase C theta regulates stability of the peripheral adhesion ring junction and contributes to the sensitivity of target cell lysis by CTL. The Journal of Immunology. 181, 4815-4824 (2008).
- Beal, A. M., et al. Kinetics of early T cell receptor signaling regulate the pathway of lytic granule delivery to the secretory domain. Immunity. 31, 632-642 (2009).
- Dustin, M. L., Starr, T., Varma, R., Thomas, V. K. Supported planar bilayers for study of the immunological synapse. Current Protocols in Immunology. , (2007).
- Reuter, M. A., et al. HIV-Specific CD8(+) T Cells Exhibit Reduced and Differentially Regulated Cytolytic Activity in Lymphoid Tissue. Cell Reports. 21, 3458-3470 (2017).
- Buggert, M., et al. Limited immune surveillance in lymphoid tissue by cytolytic CD4+ T cells during health and HIV disease. PLoS Pathogens. 14, e1006973 (2018).
- Carrasco, Y. R., Fleire, S. J., Cameron, T., Dustin, M. L., Batista, F. D. LFA-1/ICAM-1 interaction lowers the threshold of B cell activation by facilitating B cell adhesion and synapse formation. Immunity. 20, 589-599 (2004).
- Anikeeva, N., et al. Distinct role of lymphocyte function-associated antigen-1 in mediating effective cytolytic activity by cytotoxic T lymphocytes. Proceedings of the National Academy of Sciences of the United States of America. 102, 6437-6442 (2005).
- Steblyanko, M., Anikeeva, N., Campbell, K. S., Keen, J. H., Sykulev, Y. Integrins Influence the Size and Dynamics of Signaling Microclusters in a Pyk2-dependent Manner. The Journal of Biological Chemistry. 290, 11833-11842 (2015).
- Anikeeva, N., Lebedeva, T., Sumaroka, M., Kalams, S. A., Sykulev, Y. Soluble HIV-specific T-cell receptor: expression, purification and analysis of the specificity. Journal of Immunological Methods. 277, 75-86 (2003).
- Monks, C., Freiberg, B., Kupfer, H., Sciaky, N., Kupfer, A. Three-dimensional segregation of supramolecular activation clusters in T cells. Nature. 395, 82-86 (1998).
- Riddell, S. R., Greenberg, P. D. The use of anti-CD3 and anti-CD28 monoclonal antibodies to clone and expand human antigen-specific T cells. Journal of Immunological Methods. 128, 189-201 (1990).
- Lin, S. J., Yu, J. C., Cheng, P. J., Hsiao, S. S., Kuo, M. L. Effect of interleukin-15 on anti-CD3/anti-CD28 induced apoptosis of umbilical cord blood CD4+ T cells. European Journal of Haematology. 71, 425-432 (2003).
- Anikeeva, N., Sykulev, Y. Mechanisms controlling granule-mediated cytolytic activity of cytotoxic T lymphocytes. Immunologic Research. 51, 183-194 (2011).
- Huppa, J. B., et al. TCR-peptide-MHC interactions in situ show accelerated kinetics and increased affinity. Nature. 463, 963-967 (2010).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены