Method Article
Минимально инвазивная эндоскопическая внутримозговая эвакуация кровоизлияния
В этой статье
Резюме
В этой статье подробно описывается хирургический протокол минимально инвазивной эндоскопической внутримозговой эвакуации с использованием техники SCUBA.
Аннотация
Внутримозговое кровоизлияние (ICH) является подтипом инсульта с высокой смертностью и плохими функциональными исходами, в основном потому, что нет научно обоснованных вариантов лечения этого разрушительного процесса заболевания. За последнее десятилетие появился ряд минимально инвазивных операций для решения этой проблемы, одной из которых является эндоскопическая эвакуация. Стереотаксическая аспирация подводной крови ICH (SCUBA) - это новый эндоскопический метод эвакуации, выполняемый в заполненной жидкостью полости с использованием аспирационной системы для обеспечения дополнительной степени свободы во время процедуры. Процедура SCUBA использует всасывающее устройство, эндоскоп и оболочку и разделена на две фазы. Первая фаза включает в себя максимальное стремление и минимальное орошение для снижения нагрузки на сгустки. Вторая фаза включает в себя увеличение орошения для видимости, уменьшение силы аспирации для целенаправленной аспирации без нарушения стенки полости и прижигание любых кровоточащих сосудов. Используя эндоскоп и аспирационную палочку, этот метод направлен на максимизацию эвакуации гематомы при минимизации сопутствующего повреждения окружающего мозга. Преимущества техники SCUBA включают использование низкопрофильной эндоскопической оболочки, минимизируя разрушение мозга, и улучшенную визуализацию с заполненной жидкостью полостью, а не заполненной воздухом.
Введение
Внутримозговое кровоизлияние – это кровотечение, которое возникает в паренхиме головного мозга и является самым разрушительным подтипом инсульта с точки зрения смертности иинвалидности. Во всем мире заболеваемость ICH составляет примерно 24,6 на 100 000 человек, причем от 40 000 до 67 000 случаев происходят каждый год в США1,2. Внутримозговое кровоизлияние является неотложной медицинской помощью, требующей быстрой диагностики и лечения. Исторически сложилось так, что исходы были мрачными, с показателями смертности 40% через 1 месяц, 51-54% через 1 год и 71% в 5 лет3,4,5,6. Ключевой причиной такого плохого прогноза является то, что нет научно обоснованных методов лечения этого процесса заболевания. Предыдущие клинические испытания (STICH I и II) не продемонстрировали улучшенных результатов операции по сравнению с консервативным медицинским лечением7,8. Предлагаемая гипотеза о неудаче краниотомии заключается в том, что любая польза, полученная от эвакуации сгустка, перевешивается обширной черепно-мозговой травмой, вызванной инвазивным характером процедуры. В результате за последнее десятилетие был разработан ряд минимально инвазивных методов, чтобы попытаться решить эту проблему, каждый из которых имеет свои преимущества и недостатки. Методики можно сгруппировать в две категории: стереотаксическая аспирация с тромболизисом и активная эвакуация. Первый включает в себя аспирирование сгустка через отверстие заусенца, введение тромболитического агента и дренирование остаточного сгустка через катетер в течение нескольких дней. Этот метод в настоящее время тестируется в клинических испытаниях MISTIE и используется клиницистами в Китае с иглой краниопунктурыYL-1 9,10. Активная эвакуация, с другой стороны, включает в себя аспирирование всего сгустка за одну процедуру без необходимости дренажного катетера.
Также проводится ряд клинических испытаний этой методики, в том числе ENRICH, в которой используется система NICO BrainPath для транссульковой эвакуации с помощью эндопорта; испытание INVEST11,которое представляет собой технико-экономическое обоснование одной руки с использованием систем Penumbra Apollo или Artemis для эндоскопической эвакуации; и исследование MIND, которое представляет собой многоцентровое рандомизированное клиническое исследование, оценивающее эндоскопическую эвакуацию с использованием устройства Artemis. Эндоскопическая эвакуация является перспективным методом, поскольку она имеет рабочий канал самого низкого профиля для минимизации травмы головного мозга12. В этой статье описывается конкретный эндоскопический метод, описанный как стереотаксическая ICH подводная аспирация крови (SCUBA)13. Первая фаза фокусируется на дебулокации гематомы с использованием максимальной аспирации при работе в конце оболочки. Вторая фаза использует высокую скорость орошения для аспирации остаточных сгустков и прижигания любых кровоточащих сосудов целенаправленным образом.
В процедуре SCUBA используются три устройства: оболочка (6,33 мм), эндоскоп и аспирационная система. Аспирационная система состоит из хирургической палочки (2,6 мм), предназначенной для установки внутрь рабочего канала эндоскопа, который вставляется в оболочку. Палочка способна аспирация и, нажатием кнопки на ручке, морцелляцию. Компонент морцелляции устройства представляет собой вращающийся бидент на кончике всасывающей трубки, который вращается при активации. Всасывание активируется путем покрытия отверстия в большом пальце на ручке, а бидент активируется нажатием крепко на кнопку. Активация всасывания в этом отношении аналогична обычным нейрохирургическим всасывающим инструментам.
протокол
До выполнения этого протокола было получено необходимое институциональное одобрение и согласие пациента. Все процедуры были одобрены больницей Маунт-Синай.
1. Критерии включения
- Включите пациентов, которые соответствуют всем следующим критериям: возраст > 18 лет, базовая модифицированная шкала Ранкина (mRS) < 4, представляющая шкалу комы Глазго (GCS) > 4, представляющая шкалу инсульта NIH (NIHSS) ≥ 6, симптомы начала < 24 часа до первоначального КТ-сканирования (минимально инвазивная эвакуация ICH может быть выполнена в течение 72 часов после ictus), супратенториальное расположение ICH, объем ICH > 20см3,стабильность объема ICH, измеренная на двух КТ-сканированиях с расстоянием в 6 часов, систолическое артериальное давление контролируется до < 160 мм рт.ст. в течение не менее 6 часов до операции.
2. Критерии исключения
- Исключить пациентов, которые соответствуют одному или нескольким из следующих критериев: КТ демонстрирует расширяющееся кровоизлияние; точечный знак на снимке CTA; основное, незащищенные поражения(например, артериовенозный мальформация, аневризма, опухоль); геморрагическое превращение острого ишемического инсульта; инфратенториальное расположение ICH; большое внутрижелудочковое кровоизлияние, требующее лечения в результате массового эффекта или сдвига; расширение кровоизлияния в средний мозг; абсолютная потребность в длительной антикоагуляции; коагулопатия; количество тромбоцитов < 100 000клеток/мм3; INR > 1.4; повышенное активированное частичное тромбопластиновое время (аПТТ); наличие ГКС < 4, высокий риск развития ишемического инсульта; возникает необходимость хирургической декомпрессии; невозможность дать согласие на процедуру; беременна, кормит грудью или показывает положительный тест на беременность; признаки активной инфекции; или любое сопутствующее заболевание или состояние, которое, как ожидается, поставит под угрозу выживание.
3. Позиционирование и планирование
- Ввести общую анестезию пациенту с использованием стандартных методик.
- Поддерживайте стерильные условия на протяжении всей процедуры, стерильно подготавливая кожу и драпируя хирургическую область.
- Спланируйте траекторию эвакуации с помощью предоперационной объемной визуализации, чтобы провести линию вдоль длинной оси гематомы до внешней поверхности черепа, так что кончик оболочки будет находиться на 1-2 см от дистального конца гематомы.
ПРИМЕЧАНИЕ: Важно иметь в виду при планировании траектории, чтобы свести к минимуму разрушение мозговой ткани (особенно красноречивых структур) и избежать любой сосудистой системы, видимой на неинвазивной визуализации. Планирование траектории выполняется на стереотаксическом навигационном программном обеспечении, которое варьируется в зависимости от учреждения. Сравнение широко используемых навигационных систем при эвакуации ICH доступно в медицинской литературе14. - Поместите пациента в правильное анатомическое положение в зависимости от расположения гематомы.
ПРИМЕЧАНИЕ: Большинство случаев (80%) выполняются лежа на спине, а меньшинство выполняется лежа (15%) или лежа на спине с повернутой головой (5%).
4. Открытие
- Сделайте линейный горизонтальный разрез вдоль кожи вдоль естественной складки кожи 2 см.
- Откройте череп с помощью краниэктомии диаметром от 1 до 1,2 см с помощью высокоскоростного сверла с режущим заусенцом диаметром 5 мм. Попытайтесь выровнять краниэктомию с длинной осью гематомы, но избегайте структур средней линии и красноречивых территорий мозга.
ПРИМЕЧАНИЕ: Перфоратор больше, чем необходимо, особенно если дефект находится на лбу. - Если траектория не идеально перпендикулярна черепу, просверлите цилиндр в кости по запланированной траектории, чтобы обеспечить оптимальную подвижность оболочки и эндоскопа в рамках краниэктомии, но имейте в виду, что пересечение с твердой мозговой оболочкой не будет перпендикулярным.
- Используйте костный воск, гелевую пену в тромбине и биполярное прижижение для достижения гемостаза.
- Визуализируйте подлежащую гематому с помощью ультразвука для подтверждения ее размера и положения.
ПРИМЕЧАНИЕ: Качество ультразвука является самым высоким при использовании датчика отверстия заусенца во влажном поле перед дуротомией. - Откройте цевную оболочку крестообразным способом и прижмите дуральные листья с радиусом до миллиметра от края кости.
ПРИМЕЧАНИЕ: Избегайте крупных вен или артерий. - Перед прижигаем пиа-матер 1 см лезвием No11. Если вы получаете биопсию мозга, это идеальное время. Используйте опухолевые щипцы или конец чашки инструмента Penfield 1. Избегайте прижиживая до тех пор, пока не будет получена биопсия.
- Прижигнут разрез пиальной кии и нижележающую кору биполярным прижижением.
5. Эвакуация фазы 1
- Вставьте оболочку интродьюсера по запланированной траектории с навигационным стилем, расположенным внутри оболочки. Stylet обеспечивает живую обратную связь о местоположении подсказки.
ПРИМЕЧАНИЕ: Учитывая небольшой размер 1 см краниэктомии, «транссулькальный» подход часто невозможен; поэтому пиа разрезается и вводится в несосудисосудиное пространство непосредственно под краниэктомией. - Если сгусток особенно волокнистый и встречается сопротивление, сделайте небольшую корректировку оболочки, чтобы достичь целевой точки.
- Удалите интродьюсер и навигационный зонд, как только целевая точка будет достигнута, на 1-2 см от дистального конца гематомы.
ПРИМЕЧАНИЕ: Некоторые операторы предпочитают использовать стереотаксическую навигацию, зарегистрированную на эндоскопе, а не опознаватель оболочки для непрерывной навигации. - Обратите внимание на положение оболочки, отметив ее на уровне кожи.
ПРИМЕЧАНИЕ: Если давление внутри гематомы высокое, жидкость может вытечь из оболочки во время этого этапа. - Подготовьте эндоскоп, активировав предпочтительные настройки, включая баланс белого, яркость, фильтр и интенсивность света.
- Прикрепите оросительную трубку из соляного мешка 2 л на высоте плеча к левому рабочему порту и установите скорость потока примерно на 25% на эндоскопе. Откройте правый порт эндоскопа на всем пути, что позволит вытекать оросительную жидкость.
- Вставьте эндоскоп в оболочку. Вставьте палочку внутрь рабочего канала эндоскопа и удерживайте палочку доминирующей рукой.
ПРИМЕЧАНИЕ: Для этой фазы процедуры поддерживайте эндоскоп и палочку в конце оболочки, примерно на 0,5-2 см от конца оболочки. - Используйте указательный палец для буферизации расстояния между эндоскопом и ручкой палочки, чтобы поддерживать постоянную осведомленность о расположении кончика устройства в оболочке.
- Установите прочность всасывания системы аспирации на 100% и установите низкий расход орошения (~25%).
- Аспирировать любую жидкую гематому, которая появляется на конце оболочки, сохраняя палочку в пределах дистального 1 см оболочки.
ПРИМЕЧАНИЕ: Когда гематома аспирирована, полость будет разрушаться внутрь из-за уменьшенного эффекта массы. Постоянное орошение поддерживает структуру полости во время фазы 2 эвакуации. - Если встречается твердый сгусток, который не аспирируется только с помощью всасывания, активируйте бидент внутри палочки, чтобы переварить сгусток.
- Если кусочек сгустка слишком большой или волокнистый для всасывания и прилипает к кончику палочки, выньте весь эндоскоп и палочку вместе со сгустком, заботясь о том, чтобы не выбить сгусток из палочки.
ПРИМЕЧАНИЕ: Это называется техникой ADAPT (A Direct Aspiration First Pass Technique), ссылаясь на практику удаления внутрисосудистого тромба во время тромбэктомии при остром ишемическом инсульте15. - Если кусок сгустка особенно велик с волокнистой капсулой и предыдущие два метода не работают, используйте рабочий канал эндоскопа в качестве дополнительного всасывания.
- Для этого прикрепите обычное хирургическое всасывание ко второму порту эндоскопа (обычно к пути оросительного оттока) с закрытым, но готовым к активации клапаном. Втяни большой кусок сгустка в конец оболочки с помощью палочки. Закройте порт притока орошения и откройте выходной порт, чтобы активировать максимальное хирургическое всасывание. Сгусток теперь застрял на кончике палочки, эндоскопе и оболочке. Снимите палочку, эндоскоп, оболочку и сгусток вместе.
ПРИМЕЧАНИЕ: Это называется техникой двойного ADAPT.
- Для этого прикрепите обычное хирургическое всасывание ко второму порту эндоскопа (обычно к пути оросительного оттока) с закрытым, но готовым к активации клапаном. Втяни большой кусок сгустка в конец оболочки с помощью палочки. Закройте порт притока орошения и откройте выходной порт, чтобы активировать максимальное хирургическое всасывание. Сгусток теперь застрял на кончике палочки, эндоскопе и оболочке. Снимите палочку, эндоскоп, оболочку и сгусток вместе.
- Если сгусток имеет фиброзную капсулу и его трудно отделить от мозговой ткани, используйте кончик оболочки в качестве тупого диссектора.
ПРИМЕЧАНИЕ: Это называется техникой рассечения оболочки. - После аспирации исследуйте полость на той же глубине, осторожно поворачивая оболочку в сторону, пока на этой глубине не останется остаточного сгустка.
- Отодерживаем оболочку на 1 см и повторяем шаги аспирации фазы 1 до тех пор, пока оболочка не достигнет проксимальной стенки полости.
6. Эвакуация фазы 2
- Уменьшить всасывание палочки до 25% и увеличить орошение до 100% для улучшения видимости в полости. Исследуйте остаточную гематому и выявляйте кровоточащие артерии.
ПРИМЕЧАНИЕ: Во время этой фазы крайне важно свести к минимуму силы всасывания на перикаусти мозговой ткани. - Аспирировать любую остаточную гематому целенаправленно с низкой аспирационной мощностью, заботясь о том, чтобы не повредить окружающее мозговое вещество, которое может вызвать дополнительное кровотечение или вызвать травму стенки полости.
ПРИМЕЧАНИЕ: Продукты крови могут изначально мешать оптимальной визуализации, но полость будет очищаться при постоянном орошении пациента. Если полость не очищается, выявляют и прижижают кровоточащие сосуды. - Контролируйте наличие любых кровоточащих сосудов и обращайтесь к ним соответствующим образом с помощью следующих шагов:
- Если небольшие кровоточащие сосуды трудно визуализировать, направьте постоянный поток орошения к сосуду, немедленно зависая над местом кровотечения с оболочкой и вытягивая прицел обратно от кончика. Как только сосуд будет лучше визуализирован, прижигайте сосуд.
ПРИМЕЧАНИЕ: Это называется техникой наведение оболочки. - Орошайте полость до достижения гемостаза
- Нанесите давление, используя конец оболочки, если чистое орошение не работает.
- Используйте биполярное прижижание, если предыдущие два метода не работают.
- Аспирируют любую остаточную гематому по бокам или в щелях полости.
ПРИМЕЧАНИЕ: Этот шаг становится проще, как только кровоточащие сосуды будут устранены, что позволяет получить четкую визуализацию.
- Если небольшие кровоточащие сосуды трудно визуализировать, направьте постоянный поток орошения к сосуду, немедленно зависая над местом кровотечения с оболочкой и вытягивая прицел обратно от кончика. Как только сосуд будет лучше визуализирован, прижигайте сосуд.
- Убедитесь, что полость очищена от всех видимых гематом и кровоточащих сосудов.
ПРИМЕЧАНИЕ: Если есть тонкий слой свежего сгустка от интраоперационного кровотечения, остерегайтесь вызывать больше кровотечения при попытке аспирации этого тонкого слоя свежей крови. Аспирируйте осторожно или оставьте свежую кровь на месте. Дифференциация сгустков от стенки полости является серьезной проблемой в процедуре.
7. Оценка и закрытие
- Медленно вынимайте эндоскоп и оболочку, а эндоскоп на кончике оболочки осматривает стенки тракта при выходе, чтобы контролировать дополнительное кровотечение.
ПРИМЕЧАНИЕ: Некоторые операторы выступают за введение тромбина в полость в этот момент, либо путем добавления тромбина непосредственно в ирригационную жидкость, либо путем введения желатина, смешанного с тромбином, через эндоскоп. Это разумный вариант, но инъекция желатина, смешанного с тромбином, сделает ультразвуковую визуализацию невозможной. - Используйте ультразвук отверстия заусенцев для оценки остаточной гематомы или активного кровотечения.
ПРИМЕЧАНИЕ: Ультразвук полезен для урегулирования сомнений в любых сомнительных областях, а также для обнаружения любых больших областей остаточной гематомы, которые могли быть пропущены при прямой визуализации. - Выполните интраоперационное сканирование Dyna-CT, если это возможно, чтобы оценить степень эвакуации.
ПРИМЕЧАНИЕ: Целью процедуры является получение не менее 80% эвакуации. Если осталось более 20% гематомы, перезапустите фазу 2 эвакуации, прежде чем переходить к следующим шагам. - Нанесите гемостатическую гелевую пену в отверстие заусенцев над поверхностью мозга.
- Накройте краниэктомию титановой пластиной и закрепите ее титановыми винтами.
- Закройте галею и подкожные слои с помощью 3-0 полиглактина 910 швов.
- Закройте кожу с помощью 4-0 полигликапрона 25 подкутикулярных швов с последующим закрытием кожи хирургическими ленточными полосками.
Результаты
Метод эвакуации SCUBA был описан у 47 пациентов, перенесших эндоскопическую эвакуацию ICH в период с декабря 2015 года по сентябрь 2017 года. Средний объем дооперационного ICH был указан как 42,6см3 (стандартное отклонение = 29,7 см3;средний послеоперационный объем ICH = 4,2 см3, SD 6,6 см3),в результате чего средняя скорость эвакуации составила 88,2% (SD 20,8%)(таблица 1). Пример предоперационной и послеоперационной компьютерной томографии показан на рисунке 1. В 23 (48,9%) случаях были выявлены активные кровоточащие сосуды, а в 12 (52,2%) из этих случаев кровотечение исходило из более чем одногососуда (табл. 2). Кровотечение было устранено с помощью только орошения в 5 случаях (10,6%) и электрокоагреи в 18 случаях (38,3%)(таблица 2). Послеоперационное кровотечение было выделено только в одном случае (2,1%), в котором обычная КТ головы, выполненная на послеоперационный день 1, продемонстрировала, что эвакуационная полость была заполнена кровоизлиянием, которое, по-видимому, возникло из поверхностного галайного сосуда, кровоточащего в доступ и полость(таблица 2). При этом обследование пациента не ухудшилось, и ему не потребовалась дополнительная операция.
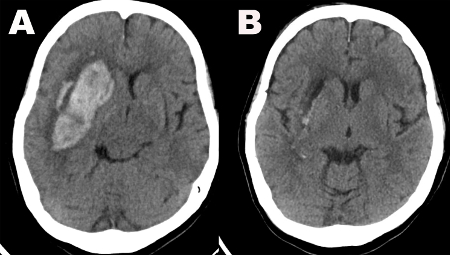
Рисунок 1:Компьютерная томография. (A) Предоперационное КТ изображение головы демонстрирует большое кровоизлияние в правые базальные ганглии. (B) КТ-изображение головы, выполненное на послеоперационный день 1, демонстрирует почти полную эвакуацию гематомы. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
| Переменная | Значить | Стандартное отклонение |
| Предоперационный объем | 42.6 | 29.7 |
| Послеоперационный объем | 4.2 | 6.6 |
| Процент эвакуации | 88.2% | 20.8% |
Таблица 1: Подробная информация об эвакуации. Объемы ICH и скорости эвакуации для процедуры SCUBA.
| Переменная | Число | Процент |
| Всего пациентов | 47 | - |
| Выявлено активное кровотечение | 23 | 48.9% |
| Одиночные суда | 11 | 23.4% |
| Несколько судов | 12 | 25.5% |
| Орошение | 5 | 10.6% |
| Электрокоагретехника | 18 | 38.3% |
| Послеоперационное кровотечение | 1 | 2.1% |
Таблица 2: Оперативные данные. Оперативные детали (в частности, кровоточащие сосуды), встречаемые во время процедуры SCUBA.
Обсуждение
Существует несколько передовых оперативных практик, которые необходимо изучить и внедрить во время эндоскопической эвакуации ICH. Прежде всего, важно свести к минимуму разрушение мозговой ткани, когда это возможно. Достижение этого начинается с оптимизации хирургической траектории, чтобы оболочка проходила кратчайший возможный курс, избегая при этом красноречивых структур. Для супратенториального ICH красноречивые структуры включают дополнительную двигательную область, первичную моторную и сенсорную кору, левую верхнюю височную и угловую извилину и первичную зрительную кору. Кроме того, траектория должна совпадать с продольной осью гематомы. Преимущества этой стратегии включают в себя максимизацию визуализации полости, минимизацию силы крутящего момента на мозг, прилегающую к доступу к тракту, увеличение вероятности возможности просмотра крайностей полости и создание кратчайшей возможной траектории к сгустку, тем самым сводя к минимуму черепно-мозговую травму.
Помимо минимизации разрушения мозговой ткани, важно также минимизировать искажение полости гематомы. Аспирация в закрытой полости может искажать упругое мозговое вещество так же, как и сжимающие силы с равным повреждением. Чтобы этого избежать, сила всасывания должна быть на минимально возможном уровне, необходимом для эффективной аспирации тромбовка. Это особенно важно, если кончик палочки выдвинут за пределы кончика оболочки. Единственный раз, когда прочность всасывания должна быть высокой, это во время фазы 1, когда наконечник находится в непосредственном контакте со сгустком. Прочность всасывания должна уменьшаться по мере продвижения процедуры.
Сообщалось о неблагоприятных исходах, когда орошение во время эндоскопической внутрижелудочковой эвакуации гематомы приводит к повышению внутричерепного давления16. Процедура SCUBA позволяет избежать этого, эвакуируя гематому в фазе 1, которая снижает давление в полости, и последующее орошение в фазе 2. В фазе 2 эндоскоп имеет второй порт доступа, который позволяет орошать отток, тем самым избегая чрезмерного растяжения полости гематомы и повышенного внутриполостного давления. Кроме того, оболочка и тракт не образуют водонепроницаемого уплотнения и вокруг оболочки теряется оросительная жидкость.
Достижение и поддержание гемостаза во время фазы 2 является важнейшим требованием для успешной эвакуации SCUBA. Важно тщательно контролировать каждую стенку полости на наличие кровоточащих сосудов и обращаться к ним соответственно с помощью непрерывного орошения или биполярного прижигания. Достижение идеального гемостаза гарантирует минимальный риск послеоперационного повторного кровотечения.
Поскольку четкая, прямая визуализация остаточной гематомы в полости не всегда возможна во время процедуры, лучше всего проверить эвакуацию с помощью интраоперационной визуализации после фазы 2. Было несколько случаев, когда прямое эндоскопическое исследование показало, что полость была прозрачной, но остаточная гематома была обнаружена либо на интраоперационном УЗИ, либо на КТ DYNA, что привело к еще одному проходу с оболочкой в полость и дополнительной эвакуации гематомы.
На этой ранней стадии разработки этой процедуры имеются достаточно убедительные доказательства, чтобы предположить, каким должен быть нижний предел процента эвакуации остаточного объема сгустка. Хотя в настоящее время нет исследований, оценивающих исходы для процентов эвакуации эндоскопической процедуры, модели на животных и исследование MISTIE предполагают, что увеличение эвакуации являетсяпредпочтительным 9. У мышей, индуцированных ICH, молекулы в крови, такие как железо, оказали токсическое действие на окружающую ткань мозга, в то время как хелаторы железа уменьшали повреждение17. Исследование MISTIE II показало, что объем перигематомального отека был наименьшим, когда процент эвакуации превышал 65%, большим, когда процент эвакуации варьировался от 20-65%, и наибольшим, когда процент эвакуации составлял менее 20%18. Эти данные также свидетельствуют о том, что результат может улучшиться при более высоком проценте эвакуации, но исследование не было проведено для оценки этой особенности. Испытания MISTIE фазы III, ENRICH, INVEST и/или MIND могут пролить свет на этот вопрос.
Одной из областей, которую еще предстоит решить, является сроки процедуры. Многие протоколы пропагандируют эвакуацию в течение 72 часов и после 6-часового сканирования стабильности, чтобы убедиться, что гематома стабильна. Многие врачи выбирают этот курс действий, так как небольшое исследование 2004 года сообщило об осложнениях, повторном кровотечении и плохих результатах у небольшой серии пациентов, которые подверглись краниотомии для ультра-ранней хирургии19. Более поздние исследования минимально инвазивной эндоскопической эвакуации сообщили о хороших результатах с ультра-раннейэвакуацией20,21. Рукописи, сообщающие об эндоскопической эвакуации, предполагают, что кровотечение идентифицируется и контролируется при ультра-ранней эвакуации. Протокол исследования ENRICH требует эвакуации в течение 24 часов после ictus и не требует сканирования стабильности. Ультрасровая хирургия может быть вариантом в будущем, но необходимы дополнительные исследования для оценки рисков и преимуществ ультра-ранней эвакуации.
Процедура SCUBA представляет собой минимально инвазивную технику эвакуации внутримозгового кровоизлияния, которая включает в себя эндоскоп с использованием аспирационной системы. Предварительные данные свидетельствуют о том, что техника SCUBA может быть выполнена безопасно и надежно, что приводит к высокому проценту эвакуации. Необходимы дальнейшие исследования для оценки влияния этой процедуры на функциональные результаты.
Раскрытие информации
Кристофер Келлнер получил образовательный грант от Penumbra на курс CME для обучения эндоскопической минимально инвазивной внутримозговой эвакуации кровоизлияния. J Mocco является одним из главных исследователей в исследовании INVEST, которое является технико-экономическим обоснованием для оценки эндоскопической минимально инвазивной внутримозговой эвакуации кровоизлияния, финансируемой Penumbra. Джей Мокко является инвестором и консультантом Rebound Therapeutics.
Благодарности
Это исследование было частично поддержано грантом от Арминио и Люсины Фрага и грантом от г-на и г-жи Дуркович.
Материалы
| Name | Company | Catalog Number | Comments |
| Artemis Device 2.8mm | Penumbra Inc. | AP28 | Cannula Outer Diameter: 2.8mm. Cannula Length: 27cm. Aspiration Tubing Length: 9.5ft; The Food and Drug Administration (FDA) approved the Apollo System in 2014 for use in intraventricular hemorrhage (IVH) evacuation but its indication now includes ICH and the Artemis System was approved for the same IVH and ICH evacuation in 2017. |
| Artemis Device 2.1mm | Penumbra Inc. | AP21 | Cannula Outer Diameter: 2.1mm. Cannula Length: 26cm. Aspiration Tubing Length: 9.5ft |
| Artemis Device 1.5mm | Penumbra Inc. | AP15 | Cannula Outer Diameter: 1.5mm. Cannula Length: 27cm. Aspiration Tubing Length: 9.5ft |
| MAX Canister | Penumbra Inc. | APCAN2 | |
| Pump MAX 110V | Penumbra Inc. | PMX110 | |
| 19-French Sheath | Aesculap USA | FH604SU | Outer Diameter: 6.33mm |
| Storz Lotta 3-port Endoscope | Karl Stortz | 28164 LA / 28164 LS | Outer Diameter: 6.1mm. Two ports for irrigation/suction (1.6mm). One working channel (2.9mm) |
| Medtronic AxiEM | Medtronic | UC201403939 | An advantage of the Medtronic AxiEM system is it does not require pinning or line-of-site navigation. |
| High-speed drill with 5-mm cutting burr | Medtronic | 9BA60 | |
| Bone Wax | Ethicon | W31 | |
| Hemostatic Gel Foam with Thrombin | J&J Healthcare | 2994 | |
| Bipolar Cautery | State of the Art | 401102 | |
| Aloka burr hole ultrasound transducer | Aloka | UST-52114P | |
| 11-blade | Bard Parker | 372611 | |
| Penfield 1 instrument | Sklar Corp | 47-2255 | |
| AxiEM stylet | Medtronic | 9735428 | |
| Titanium plate | Depuy Synthes | 04503023/04503024 | |
| Titanium screws | Depuy Synthes | 0450310301/0450310401 | |
| DYNA CT on the Artis Q | Siemens Healthineers | A91AX-01343-33C1-7600 | |
| 3-0 Vicryl sutures | Ethicon | J416 | |
| 4-0 monocryl subcuticular stitches | Ethicon | Y426 | |
| Steri-Strips | 3M | R1547 |
Ссылки
- van Asch, C. J. J., Luitse, M. J. A., Rinkel, G. J. E., vander Tweel, I., Algra, A., Klijn, C. J. M. Incidence, case fatality, and functional outcome of intracerebral haemorrhage over time, according to age, sex, and ethnic origin: a systematic review and meta-analysis. Lancet Neurology. 9 (2), 167-176 (2010).
- Qureshi, A. I., Mendelow, A. D., Hanley, D. F. Intracerebral haemorrhage. Lancet. 373 (9675), 1632-1644 (2009).
- Aguilar, M. I., Freeman, W. D. Spontaneous intracerebral hemorrhage. Seminars in Neurology. 30 (5), 555-564 (2010).
- Broderick, J., et al. Guidelines for the management of spontaneous intracerebral hemorrhage in adults: 2007 update: a guideline from the American Heart Association/American Stroke Association Stroke Council, High Blood Pressure Research Council, and the Quality of Care and Outcomes in Research Interdisciplinary Working Group. Circulation. 116 (16), 391-413 (2007).
- Caceres, J. A., Goldstein, J. N. Intracranial hemorrhage. Emergency Medicine Clinics of North America. 30 (3), 771-794 (2012).
- Poon, M. T. C., Fonville, A. F., Al-Shahi Salman, R. Long-term prognosis after intracerebral haemorrhage: systematic review and meta-analysis. Journal of Neurology, Neurosurgery, and Psychiatry. 85 (6), 660-667 (2014).
- Mendelow, A. D., Gregson, B. A., Rowan, E. N., Murray, G. D., Gholkar, A., Mitchell, P. M. Early surgery versus initial conservative treatment in patients with spontaneous supratentorial lobar intracerebral haematomas (STICH II): a randomised trial. Lancet. 382 (9890), 397-408 (2013).
- Mendelow, A. D., et al. Early surgery versus. initial conservative treatment in patients with spontaneous supratentorial intracerebral haematomas in the International Surgical Trial in Intracerebral Haemorrhage (STICH): a randomised trial. Lancet Neurology. 365 (9457), 387-397 (2005).
- Hanley, D. F., et al. Safety and efficacy of minimally invasive surgery plus alteplase in intracerebral haemorrhage evacuation (MISTIE): a randomised, controlled, open-label, phase 2 trial. Lancet Neurology. 15 (12), 1228-1237 (2016).
- Wang, W. -. Z., et al. Minimally invasive craniopuncture therapy vs. conservative treatment for spontaneous intracerebral hemorrhage: results from a randomized clinical trial in China. International Journal of Stroke. 4 (1), 11-16 (2009).
- Fiorella, D., Arthur, A. S., Mocco, J. D. The INVEST Trial: A Randomized, Controlled Trial to Investigate the Safety and Efficacy of Image-Guided Minimally Invasive Endoscopic Surgery With Apollo vs ..... Neurosurgery. , (2016).
- Fiorella, D., Arthur, A., Bain, M., Mocco, J. Minimally Invasive Surgery for Intracerebral and Intraventricular Hemorrhage: Rationale, Review of Existing Data and Emerging Technologies. Stroke. 47 (5), 1399-1406 (2016).
- Kellner, C. P., et al. The Stereotactic Intracerebral Hemorrhage Underwater Blood Aspiration (SCUBA) technique for minimally invasive endoscopic intracerebral hemorrhage evacuation. Journal of NeuroInterventional Surgery. , (2018).
- Chartrain, A. G., et al. A review and comparison of three neuronavigation systems for minimally invasive intracerebral hemorrhage evacuation. Journal of NeuroInterventional Surgery. , (2017).
- Turk, A. S., et al. ADAPT FAST study: a direct aspiration first pass technique for acute stroke thrombectomy. Journal of NeuroInterventional Surgery. 6 (4), 260-264 (2014).
- Trnovec, S., Halatsch, M. -. E., Putz, M., Behnke-Mursch, J., Mursch, K. Irrigation can cause prolonged intracranial pressure elevations during endoscopic treatment of intraventricular haematomas. British Journal of Neurosurgery. 26 (2), 247-251 (2012).
- Wu, H., Wu, T., Xu, X., Wang, J., Wang, J. Iron toxicity in mice with collagenase-induced intracerebral hemorrhage. Journal of Cerebral Blood Flow & Metabolism. 31 (5), 1243-1250 (2011).
- Mould, W. A., et al. Minimally invasive surgery plus recombinant tissue-type plasminogen activator for intracerebral hemorrhage evacuation decreases perihematomal edema. Stroke. 44 (3), 627-634 (2013).
- Morgenstern, L. B., Demchuk, A. M., Kim, D. H., Frankowski, R. F., Grotta, J. C. Rebleeding leads to poor outcome in ultra-early craniotomy for intracerebral hemorrhage. Neurology. 56 (10), 1294-1299 (2001).
- Nishihara, T., et al. Newly developed endoscopic instruments for the removal of intracerebral hematoma. Neurocritical Care. 2 (1), 67-74 (2005).
- Nagasaka, T., Inao, S., Ikeda, H., Tsugeno, M., Okamoto, T. Inflation-deflation method for endoscopic evacuation of intracerebral haematoma. Acta Neurochirurgica. 150 (7), 685-690 (2008).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены