Method Article
Диссипативных Microgravimetry для изучения динамики привязки фосфолипидного связывая протеин Annexin A2 в твердой поддержке липидов бислоев с помощью кварцевого резонатора
* Эти авторы внесли равный вклад
В этой статье
Резюме
Здесь мы представляем экспериментальный протокол, который может использоваться для определения привязки сродства и режим взаимодействия лейбл бесплатно фосфолипидов связывающий белок annexin A2 с иммобилизованными твердой поддержке бислоев (БВУ), одновременно измеряя массового поглощения и вязкоупругие свойства белка annexin A2.
Аннотация
Диссипативных кварцевый микровзвешивания техника представляет собой простой и бесплатный этикетки подход к измерить одновременно массового поглощения и вязкоупругие свойства массы всасывается иммобилизованных на поверхности сенсора, позволяя измерений взаимодействия белков с поддерживаемых твердых поверхностей, таких как липидных бислоев, в режиме реального времени и с высокой чувствительностью. Аннексины являются весьма сохраненных группой фосфолипидов связывающих белков, которые обратимо взаимодействовать с отрицательно заряженных headgroups через координацию ионов кальция. Здесь мы описываем протокол, который был нанят для количественного анализа привязку annexin A2 (AnxA2) на Вселенский липидных бислоев подготовлен на поверхности кварцевых датчика. Этот протокол оптимизирован для получения надежных и воспроизводимых данных и включает в себя подробное пошаговое описание. Этот метод может применяться к другим мембраны связывающих белков и бислой композиции.
Введение
Клеточные мембраны являются высоко динамичных и сложных структур. Составные смеси липидов мембран, вместе с периферически или органически связанного мембранных белков, собрать в форме microdomains. Скоординированного темп пространственной организации эти мембраны microdomains участвует в основных физиологических процессов1. Мембрана microdomain динамика движет взаимодействие мембранных липидов, а также способности периферийных мембранных белков признать и взаимодействовать с липидами, обогащенный microdomains. Набор белков для конкретных липидов является часто достигается через липидов признание модулей, таких как pleckstrin гомологии (PH) или C2 домены2,3. Биофизические аналитических методов, с помощью модели мембраны являются ключом к пониманию основных принципов, регулирующих этих процессов на молекулярном уровне.
Аннексины, большой multigene семьи, хорошо известны за их способности связать к отрицательно порученному мембранных липидов, преимущественно фосфатидилсерина (PS), в Ca2 +-контролируется способом2. Второй отличительной чертой annexin семьи является присутствие сохраняется структурная сегмента, annexin повторить, то есть настоящий четыре или восемь раз и гаваней Ca2 +- и фосфолипидов привязки сайтов4. Ca2 +-зависимых липидов взаимодействия помещает Аннексины в идеальном положении, чтобы ощутить и передать Ca2 +-опосредованной сигнализации для целевой мембраны. Последовательно Аннексины способны вызвать образование microdomains, обогащенный холестерина, фосфатидилинозитол-4,5-Бисфосфат (2P PI (4,5)) и PS, оба в сотовой или искусственные мембраны систем5. Этот протокол описывает подход для анализа взаимодействия annexin мембраны, с помощью7,6,кварцевый микровзвешивания диссипация (QCM-D)8.
Основным компонентом в этом микровзвешивания является осциллируя кристалл, который служит в качестве поверхности датчика. Адсорбция или связывания молекул на поверхности датчика снижает частоту резонанса (f) пропорциональное увеличение массы. Если поверхность равномерно покрытые пленкой, привязки дополнительных веществ может мешать структурной целостности этого слоя, и дополнительно может контролироваться такие изменения в вязкоупругости (энергии тангенса D). Это широко методика для изучения взаимодействия белков с липидных бислоев. В этом подходе липидов везикулы поглощаются на поверхность соответствующим покрытием датчика. Липидного бислоя формирование благоприятных материалов на основе силики9,10, как пузырьки часто не разорваться на других поверхностях гидрофильных, таких, как золото11 окисленные после воздействия УФ озона, TiO212или Аль 2O313. Разрыву коалесцирующего везикулы выпускает водяной участок, приводит к характерным изменениям в массы и диссипации. Поколение поддерживает твердых бислоев (БВУ), сплавливание vesicle является простой и надежной и может быть использован для создания сложных моделей, которые имитируют клеточных мембран.
Диссипативных кварцевый микровзвешивания является свободной этикетки и чувствительной техники. Основным преимуществом является возможность покрыть любой материал, который генерирует достаточно тонкой пленки на поверхности, обеспечивая широкий спектр применения в различных научно-исследовательских областях. Взаимодействия протеина мембраны наблюдается в режиме реального времени, и результаты могут быть проанализрованы непосредственно. Одной и той же поверхности датчика может использоваться в последующих измерениях (после выполнения минимальная очистка как описано в настоящем протоколе), таким образом позволяя для точных механизмов внутреннего контроля и сопоставимости между аналитов.
протокол
Примечание: Буферы должны быть отфильтрованы с помощью фильтра 0.22 мкм и дегазации в вакууме за 1 час.
1. липидов везикул подготовка
- Используйте 2-мл стеклянных трубок. Распустить каждый липидов, 1,2-dioleoyl-sn-glycero-3-phosphocholine (DOPC), 1-palmitoyl-2-oleoyl-sn-glycero-3-phosphocholine (POPC), 1-palmitoyl-2-oleoyl-sn-glycero-3-phospho-L-serine (СОЗ) и холестерина (Чхоль), в смесь хлороформ / метанол (50: 50 v/v) для приготовления раствора липидов ясно 5 мм. Растворяют 1,2-dioleoyl-sn-glycero-3-phospho-(1'-myo-inositol-4',5'-bisphosphate) (2P PI (4,5)) в смеси метанола, хлороформ, воды (20:9:1 v/v).
- Объединить растворенного липидов в желаемой молярное соотношение POPC/СОЗ (80/20), POPC/PI (4,5) P2 (95/5), POPC/СОЗ/Чхоль (60/20/20), POPC/СОЗ/PI (4,5) P2/Chol (60/17/3/20) и /Chol (37/20/20/3/20) (POPC/DOPC/СОЗ/PI (4,5) P2 Таблица 1) в 10-мл стеклянных трубок.
Примечание: Окончательная сумма всего липидов является 500 мкг. - Испарения органических растворителей, используя поток сухого азота. Оставьте смесь липидов на систему высокого вакуума (лиофилизации) за 3 ч до удаления любых следов растворителей.
Примечание: Это приводит к сухой прозрачная пленка. - Ресуспензируйте липидной пленки в 1 мл буфера цитрата (10 мм-цитрат натрия, 150 мм NaCl, рН 4,6). Инкубируйте 30 мин в ванну с водой и вихрь подвеска липидов при 60 ° C (температура-около 10 ° C выше температуры стеклования фазы высоким плавления липидов в смеси) он энергично каждые 5 мин.
Примечание: Это приводит к образованию крупных, multilamellar пузырьки (MLVs). Держите подвеска выше температуры стеклования. - Разогрейте экструдера (при 60 ° C, в данном случае) оснащены поликарбоната размер поры мембраны диаметром 50-Нм выше температуры стеклования (который здесь 40-50 ° C) за 30 мин.
- Загрузить MLV подвеска в разогретой экструдера и мягко пройти 31 x смесь через мембрану из поликарбоната для формирования мелких однослойных везикул (внедорожники)14. Поддерживайте температуру выше температуры стеклования.
- Передача Внедорожников подвеска 2 мл пластиковых реакции судна и добавить буфера цитрата (см. шаг 1.4) довести окончательный объем до 2 мл.
Примечание: Это даст окончательный липидные концентрации 250 мкг/мл.
2. обработка кварц датчики
Примечание: Всегда обрабатывать кварц датчиков с пинцет.
- Инкубировать четырех датчиков вставляется в держатель политетрафторэтилена в 2% раствор SDS для мытья ≥ 30 мин их широко с ультра-чистой воды, чтобы полностью удалить ПБ и дайте им высохнуть, с помощью потока сухого аргона и азота.
- Использование плазменной очистки системы для полного удаления любых загрязнений. Вставьте сухой датчики в камере очистки плазмы, эвакуировать палата и смыть 3 x с кислородом. Поверните плазмы чистых на. Используйте следующие параметры процесса: 1 x 10-4 мм.рт.ст давления, высокой радиочастотного (RF) мощности и 10 минут времени процесса. Выключите компьютер и выньте датчиков.
3. микровзвешивания операции
Примечание: Системы микровзвешивания с четырех камер контролируемой температурой потока в параллельной конфигурации, подключенных к Перистальтический насос и установите скорость потока 80 мкл/мин, был использован. В режиме открытого потока буфера был накачкой из фидера водохранилища в принимающем бак. В режиме цикла принимающий танк был связан с подачи водохранилища для создания замкнутой. Температура было присвоено 20 ° C.
- Тщательно закрепите плазмы Уборка датчики в 4 потока камеры, с помощью пинцета. Избегайте каких-либо давление на или кручения камер и трубы, которые могут вызвать утечку.
- Потолочные системы с буфера цитрата (10 мм-цитрат натрия, 150 мм NaCl, рН 4,6) в режиме открытого потока за 10 мин.
Примечание: Это требует точно 3,2 мл буфера, но желательно использовать избыток буфера (10 мл). - Запустите программу. Начать запись любые изменения в частоте и диссипации первых основных тона (n = 1) и окраски (n = 3-13) с помощью программного обеспечения, до тех пор, пока частота и диссипации исходных данных являются стабильными (это займет около 40-60 мин).
Примечание: Уровень шума частоты (пик пик) должна быть меньше, чем 0,5 Гц и рассеяния, ниже, чем 0.1·10-6, с Максимальная дрейф (в растворе) 1 Гц/ч частота и 0.3·10-6час в диссипации. - Когда базовые показатели являются стабильными, применять Внедорожников подвеска в буфере цитрат (2 мл в небольшой трубки). С помощью реакции судна, удалите 1,5 мл мертвого объема. Затем закройте систему в режиме цикла потока. Рекорд частоты/рассеяния сдвиг еще 10 минут.
Примечание: В это время, везикулы будет распространяться на поверхность2 SiO и предохранитель сформировать непрерывный бислой15,16 (шаг 2 на рисунках 1, рис. 2и рис. 3). Внедорожники адсорбции на поверхности датчика 2 фазовые и типичная частота минимальная и максимальная в диссипации. Стабильные новые базовые показатели частоты/рассеяния с характерной частоты сдвига (в зависимости от состав липидов) от 26-29 Гц (см. таблицу 1) указывает непрерывный бислой на поверхности. - Когда ЦГЯ стабильным (см. шаг 3.4), сбалансировать системы с работающей буфера (10 мм HEPES, 150 мм NaCl, рН 7,4) на требуемый Ca2 + концентрации (от 50 мкм до до 1 мм CaCl2, в зависимости от эксперимента) в режиме открытого потока для 40 мин.
- Добавить белка (здесь, AnxA2) для запуска буфера содержащие Ca2 + (см. шаг 3.5). Выполните приложение белка в режиме цикла потока до тех пор, пока состояние устойчивого равновесия достигается (шаг 3 на рисунке 1, рис. 2и рис. 3).
Примечание: Концентрация белка может варьироваться от 1 до 400 Нм. Адсорбции белка приводит к концентрации-зависит от частоты сдвига, отражающие адсорбции массы (белка). - Отделить связанные белком, хелатирующие Ca2 + ионов с 5 мм EGTA в буфере работает в режиме открытого потока (шаг 4 на рисунках 1 и 2 рис).
Примечание: Восстановление частоты и рассеивания для базовой SLB указывает общая реверсивность связывания белков. Ассоциация диссоциации циклов может быть повторен для сравнения различных концентраций или белков.
4. Очистка микровзвешивания
Примечание: Процедура минимальной очистки после каждого измерения.
- Восстановление системы микровзвешивания с 50 мл ddH2O в режиме непрерывного открытого потока, вынуть ёмкость для воды трубы и пусть система работать всухую.
- Тщательно удалить датчик кристалл и очистить его с 2% SDS решения с помощью держателя политетрафторэтилена (см. шаг 2.1).
- Сухие видимые части потока модуль интерьер, где был помещен датчик.
Примечание: Выполните интенсивная процедура очистки после серии 10 измерений. - Чистая системы с SDS 2% раствор (50 мл) при 40 ° C (Установка программного обеспечения) в режиме непрерывного потока открытой (труба), используя скорость потока 20 мкл/мин для длительного контакта с моющим средством.
- Очистите с 250 мл ddH2O в режиме непрерывного открытого потока со скоростью потока 160 мкл/мин.
Примечание: После 4 месяцев, выполняют обширные очистки процедура согласно инструкции производителя.
Результаты
Снижения резонансной частоты (Δf) коррелирует в линейной форме адсорбированных массой (Δm), как определено Соэрбри уравнения. 17
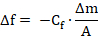
Здесь f — резонансная частота, Cf — это константа, которая зависит от геометрических и физических характеристик данного кварца и резонансной частоты, а A — площадь поверхности датчика.
В большинстве приложений адсорбированных слой не полностью жесткой, но вязкоупругих. Результирующий гашения колебаний датчика кварц называют диссипация (D). Мониторим диссипации изменения (ΔD) коррелируют с вязкоупругие свойства привязанного массового18 и определены следующим8.
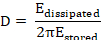
Здесь Eрассеялись энергии, потерял в период одного колебания, и Eхранится это полная энергия свободно осциллируя датчика.
Для анализа и количественной оценки параметров привязки, частота изотермы являются производными путем построения равновесия частота смены (eΔΔf) против концентрации белка. ΔΔfe определяется как

Здесь Δft1 представляет начало белка адсорбции и Δf вt2 состояния равновесия. Нелинейной кривой могут выполняться с помощью Хилл расширение уравнение Ленгмюра следующим образом6,8.
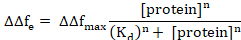
Здесь, ΔΔfМакс ΔΔfe концентрации белка, что приводит к привязке максимум (насыщения), Kd является очевидным диссоциации константа для сложных мембранных белков, и n — коэффициент Хилл.
Коэффициент Хилл (n) описывает кооперативность привязки. Для n = 1, модель адсорбции Хилл является простой изотерма Ленгмюра (равных привязки сайтов и все молекулы связать независимо друг от друга липидного бислоя). Если n ≠ 1, связанных лигандов изменения привязки сродство для других лигандов мембраны, либо увеличение (n > 1, позитивные кооперативность) или уменьшение (n < 1, отрицательные кооперативность) близость.
На рисунке 1 показана схема экспериментальной рабочего процесса, используемые в нашей лаборатории для измерения изменений в резонанс и частоты при Ca2 +-зависимые привязки и выпуск AnxA2 к липидному в жидкой фазе. Образцовое запись показана на рисунке 2. Рисунок 2 A показывает запись частоты кривой иB Рисунок 2показывает диссипации смены. Видные снижение частоты при добавлении липосомы (рис. 2A [шаг 1]) указывает их адсорбции. Потому что пузырьки, заполненные буфера не жесткой, но вязкоупругих, диссипация увеличивается (рис. 2B [шаг 1]). Впоследствии поглощающий везикулы разрыв. Сопутствующие освобождения буфера внутри везикул уменьшается адсорбированных массы до достижения стабильного плато (рис. 2A [шаг 2]). Следует отметить добавлением везикулы приводит высокий диссипации сдвиг, в то время как сдвиг в ответ на бислой гораздо меньше из-за жесткой однородный характер SLB (рис. 2B [шаг 2]). Шаг 3 на рисунке 2A и 2B записи привязки AnxA2 липиды, которые добавляет массу, как видно ясно частота смены, но не вмешиваться в бислой структуру, как указано только небольшие изменения в диссипации. Когда Ca2 + удаляется хелатных агент EGTA (рис. 1 и 2 рис [шаг 4]), AnxA2 дистанцируется от липидной пленки. Частоты, а также записи рассеивания, переход к уровням с бислой только (Сравните шаги 2 и 4 в рисунок 2A и 2B), указывающее, что привязка AnxA2 является полностью зависит от Ca2 + и что фильм липидов остается неизменным.
AnxA2, как наиболее аннексины, зависит от отрицательно заряженных липиды как PS. Это хорошо видно, когда отсутствует СОЗ в липидный бислой (рис. 3). Рисунок 3 A показывает запись частоты кривой и Рисунок 3B показывает диссипации смены. Обратите внимание, что частота смены стабильной базовой линии-25 Гц, но диссипация не изменены (рис. 3B [шаг 2]), свидетельствует о надлежащей бислой формирования. Однако никаких изменений в частоте (рис. 3А) или распыления (рис. 3B) наблюдаются после добавления AnxA2 присутствии Ca2 + (Рисунок 3А и 3Б [шаг 3]) или EGTA (Рисунок 3А и 3B [шаг 4]), как AnxA2 не может взаимодействовать с липидной пленки.

Рисунок 1 : Графическая модель экспериментального рабочего процесса. Этот рабочий процесс иллюстрирует поглощения пузырьков на поверхности гидрофильных датчик (шаг 1), везикул фьюжн/разрыв приводит к формированию SLB (шаг 2) и Ca2 +-зависимых адсорбции (шаг 3) и EGTA-зависимых десорбции AnxA2 (шаг 4). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
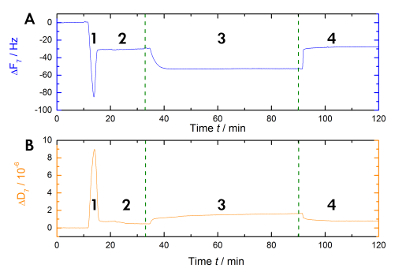
Рисунок 2 : Образцовый запись. Эти панели показывают (A) время зависимых мониторинг 7 призвука частоты резонанса и (B) рассеяния смены датчиков кварц во время измерения. Применения липосом вызывает быстрое снижение базовой частоты, диссипация базовых увеличивает (шаг 1), в то время как. Стабилизации исходных линий указывает на формирование бислой (шаг 2). AnxA2 (200 Нм) адсорбции (в присутствии Ca2 +) на СОЗ содержащие липидного бислоя добавляет массу без значительного изменения рассеивания, указав, что липидной пленки не возмущенных (шаг 3). Восстановление базовой частоты на Ca2 + Хелаты с EGTA указывает общее десорбции белка (шаг 4). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
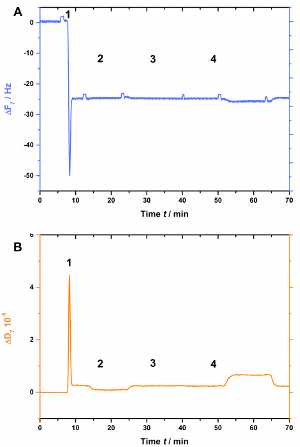
Рисунок 3 : Отрицательный контроль эксперимент, демонстрируя, что AnxA2 не привязан к совершила в отсутствие СОЗ. Эти панели показывают Добавление липосомы и SLB формирования (шаги 1 и 2). Никаких изменений в частоте (A) или (B) рассеяния очевидны после добавления AnxA2 (шаг 3; 200 Нм, при наличии Ca2 +) или EGTA (шаг 4). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
| Состав | ΔΔF/Гц после формирования совершила | ΔΔD * 10-6 после формирования SLB |
| POPC/СОЗ (80: 20) | 26.3 ± 0,2 | 0.26 ± 0,03 |
| POPC/PI (4,5) P2 (95: 5) | 26.5 ± 0,5 | 0,31 ± 0,02 |
| POPC/СОЗ/Чхоль (60: 20: 20) | 29.2 ± 0,2 | 0,45 ± 0,09 |
| POPC/СОЗ/Пи (4,5) /Chol2P (60: 17: 3:20) | 29.6 ± 0,6 | 0,43 ± 0.10 |
| POPC/DOPC/СОЗ/Пи (4,5) /Chol2P (37: 20: 20: 3:20) | 29,4 ± 0,4 | 0.39 ± 0,14 |
Таблица 1: липидный состав и формирования данных ЦГЯ 7 .
Обсуждение
Для ответа на вопросы, касающиеся связи структура функции клеточных мембран и на основе количественных и качественных прибыли биологии клетки больш от использования биофизических подходов на основе устоявшихся и широко используются методы , включая атомной силовой микроскопии (АСМ), поверхностного плазмон резонанс (СРП), и метод QCM-D работающих здесь. Мы показали в предыдущих исследованиях, которые annexin белки связывают в Ca2 +-зависимым образом иммобилизованных мембраны с высоким сродством. Мы используем частоты и диссипации смены из 7-й обертон (Δf7) потому, что это представляет собой наилучший компромисс обнаружения чувствительность и осцилляции стабильности.
Этот метод также позволяет количественное описание взаимодействия мембраны белка. AnxA2 привязки к мембране характеризуется позитивным кооперативность, что при посредничестве annexin основного домена и зависит от наличия холестерина. Количественные данные, полученные для AnxA2 и AnxA8 сообщается в других местах подробно6,8.
Существует много важных шагов в этом протоколе. Использовать липосомы немедленно; в противном случае небольшие пузырьки могут предохранитель в большие пузырьки с меньше поверхностное натяжение, приводит к ингибированию формирования липидного бислоя. Поддерживать постоянную температуру во время измерения. Каждое небольшое отклонение температуры приводит к не незначительной сдвиг частоты и диссипации. Избегайте пузырьков воздуха; в противном случае система неустойчива и не будет установить базовые показатели.
Уравнение Соэрбри позволяет прямое преобразование наблюдаемая частота изменения изменений в массы и, следовательно, широко используется. Однако предположение о линейной корреляции между изменением частоты резонанса и увеличения массы только справедливо для компонентов, образуя жесткую и единообразных пленку на поверхности датчика. Соэрбри уравнение не может использоваться для адсорбентов вязкоупругих таких вод богатые белком фильмов, липидные слои включены водой, или даже адсорбированные клетки. Здесь требуются более сложные математические модели. Таким образом чрезвычайно важно одновременно контролировать изменения в частоте и диссипации. Для выявления структурных изменений во время измерения, могут быть отображены ΔD против Δf коэффициенты, с прямой линии, указывающие не конформационные изменения.
Основным преимуществом этого метода является возможность использовать весьма широкий спектр материалов в качестве субстратов. Кроме того это надежный и прямой способ изучить широкий спектр макромолекулярных взаимодействий, как надлежащее формирование пленок нанесения покрытий (например, SLB), а также дальнейшего взаимодействия белково липидные, может контролироваться онлайн.
Этот протокол может быть применен в других взаимодействующих мембранных белков, например, Бар домен белков19, ERM (Эзрин, radixin и moesin) белка семьи, которая имеет важную роль в Цитоскелет мембраны связь20,21 ,22, или белки, содержащие C2 или PH доменов. Кроме того широкий спектр применения этой методики изучения биологических материалов был успешно опубликован, таким образом устанавливая QCM как хорошо подходит экспериментальной платформы для изучения взаимодействия более сложных макромолекулярных сборок или даже клетки2423,.
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Эта работа была поддержана Deutsche Forschungsgemeinschaft под грантов SFB 858/B04, EXC 1003, SFB 1348/A04 и SFB 1348/A11.
Материалы
| Name | Company | Catalog Number | Comments |
| Chemicals | |||
| Calciumchloride | Merck | 017-013-00-2 | 99% |
| Chloroform | Roth | 4432.1 | 99% |
| DOPC | Avanti | 850375P | |
| EGTA | PanReac AppliChem | A0878 | 99% |
| HEPES | PanReac AppliChem | A1069 | |
| Methanol | PanReac AppliChem | A3493 | |
| PiP2 | Avanti | 850155P | |
| POPC | Avanti | 850457P | |
| POPS | Avanti | 840034P | |
| Sodiumchloride | PanReac AppliChem | A1149 | |
| SDS | Roth | 183 | |
| Trisodium citrate | PanReac AppliChem | A3901 | |
| Equipment | |||
| Extruder Liposofast | Avestin | ||
| Qsense E4 Analyzer | Qsense | ||
| QSense Dfind | Qsense | ||
| Pump IPC 4 | Ismatec | ISM 930 | |
| QSX 303 SiO2 Silicon dioxide 50nm | Qsense | QSX 303 | |
| PC Membranes 0.05μm | Avanti polar lipids | 610003 | |
| OriginPro | OriginLab Corporation | Version 8 and 9 |
Ссылки
- Simons, K., Toomre, D. Lipid rafts and signal transduction. Nature Reviews Molecular Cell Biology. 1 (1), 31-41 (2000).
- Gerke, V., Creutz, C. E., Moss, S. E. Annexins: linking Ca2+ signalling to membrane dynamics. Nature Reviews Molecular Cell Biology. 6, 449-461 (2005).
- Mim, C., Unger, V. M. Membrane curvature and its generation by BAR proteins. Trends in Biochemical Science. 37, 526-533 (2012).
- Rescher, U., Ruhe, D., Ludwig, C., Zobiack, N., Gerke, V. Annexin 2 is a phosphatidylinositol (4,5)-bisphosphate binding protein recruited to actin assembly sites at cellular membranes. Journal of Cell Science. 117, 3473-3480 (2004).
- Gerke, V., Moss, S. E. Annexins: from structure to function. Physiological Reviews. 82, 331-371 (2002).
- Heitzig, N., et al. Cooperative binding promotes demand-driven recruitment of AnxA8 to cholesterol-containing membranes. Biochimica et Biophysica Acta (BBA) - Molecular and Cell Biology of Lipids. 1863 (4), 349-358 (2018).
- Drücker, P., Grill, D., Gerke, V., Galla, H. J. Formation and characterization of supported lipid bilayers containing phosphatidylinositol-4,5-biphosphate and cholesterol as functional surfaces. Langmuir. 30, 14877-14886 (2014).
- McConnell, H. M., Watts, T. H., Weis, M. R., Brian, A. A. Supported planar membranes in studies of cell-cell recognition in the immune system. Biochimica et Biophysica Acta - Reviews on Biomembranes. 864, 95-106 (1986).
- Anderson, T. H., et al. Formation of supported bilayers on silica substrates. Langmuir. 25, 6997-7005 (2009).
- Pfeiffer, L., Petronis, S., Koper, I., Kasemo, B., Zach, M. Vesicle adsorption and phospholipid bilayer formation on topographically and chemically nanostructured surfaces. Journal of Physical Chemistry B. 114, 4623-4631 (2010).
- Cho, N. J., Jackman, J. A., Liu, M., Frank, C. W. pH-Driven assembly of various supported lipid platforms: a comparative study on silicon oxide and titanium oxide. Langmuir. 27, 3739-3748 (2011).
- Jackman, J. A., Tabaei, S. R., Zhao, Z., Yorulmaz, S., Cho, N. J. Self-Assembly formation of lipid bilayer coatings on bare aluminium oxide: overcoming the force of interfacial water. ACS Applied Materials & Interfaces. 7, 959-968 (2015).
- Olson, F., Hunt, C. A., Szoka, F. C., Vail, W. J., Papahadjopoulos, D. Preparation of liposomes of defined size distribution by extrusion through polycarbonate membranes. Biochimica et Biophysica Acta(BBA) - Biomembranes. 557 (1), 9-23 (1979).
- Richter, R., Mukhopadhyay, A., Brisson, A. Pathways of lipid vesicle deposition on solid surfaces: a combined QCM-D and AFM study. Biophysical Journal. 85 (5), 3035-3047 (2003).
- Richter, R. P., Bérat, R., Brisson, A. R. Formation of solid-supported lipid bilayers: an integrated view. Langmuir. 22 (8), 3497-3505 (2006).
- Sauerbrey, G. Verwendung von Schwingquarzen zur Wägung dünner Schichten und zur Mikrowägung. Zeitschrift für Physik A Hadrons and Nuclei. 155 (2), 206-222 (1959).
- Rodahl, M., Höök, F., Krozer, A., Brzezinski, P., Kasemo, B. Quartz crystal microbalance setup for frequency and Q-factor measurements in gaseous and liquid environments. Review of Scientific Instruments. 66 (7), 3924-3930 (1995).
- Drücker, P., Pejic, M., Grill, D., Galla, H. J., Gerke, V. Cooperative binding of annexin A2 to cholesterol-and phosphatidylinositol-4, 5-bisphosphate-containing bilayers. Biophysical Journal. 107 (9), 2070-2081 (2014).
- Galic, M., et al. External push and internal pull forces recruit curvature-sensing N-BAR domain proteins to the plasma membrane. Nature Cell Biology. 14 (8), 874-881 (2012).
- Fehon, R. G., McClatchey, A. I., Bretscher, A. Organizing the cell cortex: the role of ERM proteins. Nature Reviews Molecular Cell Biology. 11 (4), 276-287 (2010).
- Braunger, J. A., Kramer, C., Morick, D., Steinem, C. Solid supported membranes doped with PIP2: influence of ionic strength and pH on bilayer formation and membrane organization. Langmuir. 29 (46), 14204-14213 (2013).
- Bianco, M., et al. Quartz crystal microbalance as cell-based biosensor to detect and study cytoskeletal alterations and dynamics. Biotechnology Journal. , 1700699(2018).
- Chen, J. Y., Penn, L. S., Xi, J. Quartz crystal microbalance: Sensing cell-substrate adhesion and beyond. Biosensors and Bioelectronics. 99, 593-602 (2018).
- Bragazzi, N. L., et al. Quartz-Crystal Microbalance (QCM) for Public Health: An Overview of Its Applications. Advances in Protein Chemistry and Structural Biology. Donev, R., et al. 101, Academic Press. 149-211 (2015).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены