Method Article
Поколение 3D легкое человека тканевых культур (3D-LTCs) для моделирования заболевания
* Эти авторы внесли равный вклад
В этой статье
Резюме
Здесь мы представляем собой протокол для подготовки заполнены агарозы легкое человека точности надреза кусочки от резекции тканей пациента которые подходят для создания 3D легких тканевых культур для модели человека легочных заболеваний в биологических и биомедицинских исследований.
Аннотация
Перевод романа открытий для болезней человека ограничено наличием человека модели, основанные на ткани, заболевания. Точность cut легких ломтиками (PCLS) используется как 3D легких культур тканей (3D-LTCs) представляют собой элегантное и биологически высокоактуально 3D ячеечная модель культуры, весьма напоминающие на месте ткани из-за их сложности, биомеханика и молекулярной композиция. Нарезка ткани широко применяется в различных моделях животных. 3D-LTCs производным от человека PCLS может использоваться для анализа ответов на роман наркотиков, которые далее могут помочь лучше понять механизмы и функциональных последствий употребления наркотиков в тканях человека. Подготовка PCLS от образцов ткани хирургической резекции легких пациентов, которые испытали Лобэктомия легких, повышает доступность больными и перитуморальной ткани. Здесь мы описываем подробный протокол для поколения человека PCLS от хирургической резекции мягкий эластичный больного легочной ткани. Агарозы была введена в бронхоальвеолярной пространство resectates, таким образом сохраняя структуру легких и увеличение жесткости ткани, которая имеет решающее значение для последующей нарезки. из блока ткани с vibratome были подготовлены 500 мкм толщиной ломтиками. Биопсия пуансонов, взяты из PCLS обеспечить сопоставимые ткани, размер выборки и дальнейшее увеличение количества образцов ткани. Сгенерированный легких культур тканей может применяться в различных исследований в биологии человека легких, включая патофизиологии и механизмов различных заболеваний, таких как фиброзных процессов на ее лучших на (суб-) клеточном уровнях. Наибольшую выгоду 3D-LTC ex vivo модели является ее закрыть представительство на местах человеческих легких архитектуры 3D ткани, клетки типа разнообразия и Анатомия легких, а также потенциал для оценки ткани от отдельных пациентов, которые имеет отношение к дальнейшей разработки новых стратегий для точности медицины.
Введение
Хронические и острые легочные заболевания являются одной из основных причин заболеваемости и смертности во всем мире1. Для пациентов с хроническими заболеваниями легких как обструктивная болезнь легких (ХОБЛ)2, тяжелой формой астмы3, рак легких4 и Паренхиматозный легких диффузных заболеваний5лечебной терапии в настоящее время не доступны. Хотя исследования на животных моделях для легочных заболеваний углубили понимание болезни Патомеханизмы6 и привели к выявлению потенциальных роман терапевтических целей7,8,9, Эти модели демонстрируют соответствующие биологические и физиологические различия по сравнению с10людьми. Чтобы преодолеть эти расхождения между мышиных и человеческой биологии, а также анатомии человека ex vivo 3D легких тканевой культуры (3D-LTC) системы используются в различных областях биомедицинских исследований. Эти 3D-LTC культуры системы основаны на легких точности cut ломтики (PCLS). Поколение PCLS ex vivo позволяет анализа третьего пространственных размерности, которая позволяет для расследования пространственная и функциональная отношений клеток в весь альвеолы и airways11, а также интерстиция, сосудистую и мезотелия. В частности PCLS ex vivo модели многоклеточных, означает, что они содержат большинство функциональных клеток на месте легких, таким образом, тесно, представляющие клетки родной биологической среды и таким образом, преодоление ограниченных ячеек и ячеек матрицы взаимодействия в большинстве 2D клеточные культуры подходов. До теперь, ex vivo мышиных PCLS были использованы для моделирования легочных заболеваний, как ХОБЛ12, фиброз легких13, рак легких14, вирусные инфекции15,16, бронхолегочной дисплазии17, и астма18. Однако, значительная часть романа лекарственной терапии в человека легочных заболеваний, которые были расследованы в клинических испытаниях не переводят в клинику из-за их отсутствия эффективность или безопасность, повидимому из-за еще значительные различия между человеком и мышиных биологии и болезни19,,2021.
В течение нескольких лет человеческого PCLS основном были использованы для оценки легких токсичность химических веществ и наркотиков. Лишь недавно человека легочной ткани был использован от пациентов с ХОБЛ22,23, астма24и фиброза легких25, чтобы преследовать патофизиологические и фармакологические исследования. С помощью материала резецированный больного органа и генерации PCLS, один можно резюмировать основные болезни клейма в сложных 3D ткани среды22 представляющих и поддержание большинство родной сотовой разнообразия органа. Кроме того больные ткани, применяемых в различных экспериментальных установок было показано для имитации болезни как изменения в печени, кишечника и почек26,27,,2829.
Однако обработка легочной ткани остается сложным по нескольким причинам. В отличие от твердых тканей паренхимы легких родной стремится свернуть без вентиляции и экспонаты ниже жесткость ткани. Эти свойства препятствуют нарезки ткани. Таким образом заполнение airways и альвеолярного пространства с легкоплавких точки агарозы сохраняет структуру собственных легких и обеспечивает жесткость, необходимые для точности надреза нарезки из мышиных и человеческих легких30. Resectates легкое человека, пожертвовал для исследовательских целей являются по своей природе анатомически, генетически и физиологически весьма разнообразны, представляя таким образом часто высокая изменчивость между пациента при выполнении экспериментов25. В отличие от всей доли или всей легких эксплантов, легких образцы резецируется посредством торакальной хирургии не обязательно следовать анатомические сегментов и, таким образом, требуют специальной подготовки. В этой статье мы предоставляем подробную и оптимизированный протокол для поколения человека PCLS от резекции легочной ткани и их последующего выращивания и экспериментального использования в модели легочных заболеваний.
протокол
Использование тканей человека был одобрен Комитетом по этике Людвиг Максимилиан Университет [Мюнхен, Германия (проект № 455-12)]. Резекции опухоли бесплатно человека легких были предоставлены Asklepios биобанке для легочных заболеваний (номер проекта Gauting, Германия, 333-10).
Примечание: Все процедуры производства человеческого PCLS (рис. 1) выполняются под капотом стерильных ламинарного потока.
1. Подготовка инструментов и материалов
-
Подготовьте все материалы для инфляции легочной ткани с агарозы, как описано ниже.
- Подготовка среды культивирования: Дульбекко изменение средних орла (DMEM) F-12 с L-глютамина, HEPES, 10000 IE пенициллин, 10000 IE стрептомицина и плода бычьим сывороточным 0,1% (v/v).
Примечание: Средний используется при 37 ° C. - Подготовьте стерильные металлический лоток покрыты папиросной бумаги. Поместите блюдо культуры клеток стерильные 15 см на лоток.
- Заполните клетки культуры блюдо с 15 мл среды культивирования.
- Приготовляют раствор 3% (w/v) агарозы, растворяя соответствующее количество легкоплавких точки агарозы в минимум 30 мл среды культивирования.
- Решение в микроволновой Нагрейте до кипения. Прохладный агарозы решение до 42 ° C на водяной бане. Держите решение жидкого агарозы, хранящиеся в водяной бане.
- Подготовьте несколько 50 мл конические трубы заполнены с жидкой агарозы.
- Подготовка среды культивирования: Дульбекко изменение средних орла (DMEM) F-12 с L-глютамина, HEPES, 10000 IE пенициллин, 10000 IE стрептомицина и плода бычьим сывороточным 0,1% (v/v).
2. резецированный легочной ткани
- Хранить свежие опухоли бесплатно легочной ткани лобэктомии resectates сразу же после резекции в среде DMEM F-12 на 4 ° C до шага 3.
- Не превышайте время холодной ишемии 4-8 ч до их обработки.
3. Проверка и подбор резекции тканей до наполнения агарозы
- Поднимите ткани с носителя с помощью пинцета. Для того, чтобы избежать повреждения ткани, особенно в плевру, обработки ткани с помощью пинцета в дыхательных путях только.
- Оценка качества ткани по критериям оценки легких агарозы заполнения определены в таблице 1.
- Если качество ткани оценивается выше или равен 72, перейдите к шаг 4. Если качество ткани забил ниже 60, не продолжать далее с заполнением агарозы.
Примечание: Если оценка ткани между 60 и 68, агарозы наполнения и ткани нарезки еще может производить удовлетворительные результаты, и окончательное решение для продления эксперимент должен быть сделан дело к делу. Однако легочной ткани, которые не отвечают вышеупомянутым требованиям, главным образом не в агарозном наполнения.
4. легких тканей инфляции, заполнив агарозы
- Поднимите ткани от носителя и слейте излишки средств массовой информации из ткани. Перенесите легочной ткани в 15 см культуры блюдо, приготовленное в 1.1.2.
- Заполните 30 мл шприц с легкоплавких агарозы точки от 1.1.3.
- Подготовить периферического венозного катетера, удалив затвора и прикрепить его к 30 мл шприц
- Идентифицировать бронха (0,5-3 мм в диаметре) в ткани, которая вентиляционное нетронутыми часть ткани (см. Рисунок 2).
- Вставьте канюлю в выбранном бронха (0,5-3 мм в диаметре).
- Аккуратно вставьте канюлю осторожно вперед, насколько это возможно.
- Уплотнение бронха вокруг канюли, сжимая бронхиальной стенки вокруг канюли с щипцами, идеально пережатия любого прилегающих легочной артерии в то же время.
- Загородить другие дополнительные airways с хирургический зажим для предотвращения агарозы, протекает через эти airways.
- Поднимите ткани с щипцами от культуры блюдо.
- Вручную залить агарозы шприц не быстрее, чем 0,3 мл/сек. Скорость заполнения агарозы могут отличаться между приблизительно 0,05 и 0,3 мл/сек из-за разнородных сопротивления дыхательных путей и/или ателектаз.
-
Если наблюдается высокое сопротивление во время заполнения или агарозы, утечка из ткани, повторите всю процедуру с другой бронхов от шага 4.4. Устранения неполадок, как описано ниже.
Примечание: Степень наполнения агарозы сильно зависит положение катетера в ткани и глубокое проникновение результатов катетер в агарозном заполнения малого конуса как регионы (*) легочной ткани (рис. 2 c).- В случае высокого сопротивления попробуйте позиционирования катетер приводит к надлежащего заполнения большинства регионов ткани (#) (Рисунок 2D).
- Как вилки ранних затвердевших агарозы в проксимальном бронхов или других сократимость, препятствия (стрелка) может привести к неполной наполнения тканей (Рисунок 2E) не применяйте силу агарозы наполнения, как это может привести к дефектам в заполненной области, но не в заполнении затрудненные ткани частей.
- Респираторные дерево, производный от канюлированной бронха при повреждении во время резекции и агарозы, заполнение результатов в постоянные протечки жидкого агарозы (стрелка в рисунке 2F), вставьте катетер в более периферической частью системы дыхательных путей Заполните по крайней мере небольшую часть ткани (*) (Рисунок 2 g). Кроме того уплотнение повреждения периферических дыхательных путей с хирургический зажим (стрелка) (Рисунок 2 H).
- Применить агарозы, до тех пор, пока легочной ткани заполняется полностью. Не чрезмерно надуть ткани как это может вызвать необратимые повреждения структуры ткани и ее ячеек.
- Зажим бронха, который был использован для заполнения немедленно. Удалите канюлю до зажима.
- Инкубируйте ткани в питательной среды на 4 ° C на 30 мин для обеспечения агарозы затвердевания.
- Если резекции тканей бронхов несколько записей, повторите шаг 4.2 для 4.13 до тех пор, пока все части ткани заполнены с агарозы.
- Храните в разделах ткани легких агарозы заполнены в холодной среде 4 ° C до нарезки.
5. точность надреза легких нарезки
-
Определите регионы в легочной ткани, которые прочно заполнены с агарозы. Прочно заполненных областей не рухнет, когда они нажимаются мягко с помощью пинцета, против нижней части клетки культуры блюдо.
- Акцизный 1-1,5 см3 блок регионов, описанных в разделе 5.1, в то время как одна сторона по-прежнему должны быть покрыты плевры.
- Прикрепите каждый блок индивидуальных ткани с плевральной стороной связаться держатель vibratome, используя Цианакрилатный клей.
Примечание: Плевра слегка упругой и поэтому препятствует резки с vibratome лезвием. Размещены на держатель ткани, плевра не будет вмешиваться с огранкой и, главное, образует естественный барьер между Цианакрилатный клей и ткани паренхимы, позволяя для минимального распространения клея. - Нарежьте легочной ткани с vibratome со следующими параметрами: толщина: 500 мкм, частота: 100 Гц, амплитуда ножа: 1,2 мм, вперед скорость лезвия 3-12 мкм/s, который зависит от жесткости ткани. Уменьшите выступ скорость лезвия, если фрагмент не режется неправильно, или если сам блок ткани начинает вибрировать.
- Аккуратно передачи фрагмента, подняв ее с щипцами из лотка vibratome в колодец 12-ну пластины, заполнены с выращивания среднего. Наконец Инкубируйте легких ломтики в инкубаторе в условиях культуры стандартной ячейки.
- Остановить нарезки когда 2-3 мм блока ткани остаются нефрагментированного поскольку Цианакрилатный клей может поставили под угрозу целостность ткани этого региона.
6. Создание PCLS ударов
- Передать легких фрагменты из одной скважины пустой 10 см блюдо.
- Место биопсии панчер 4 мм ортогонально к верхней поверхности PCLS и начать двигаться панчер в вращения по часовой стрелке и против часовой стрелки.
- Заполните клетки культуры среднего в скважины 96-луночных плиты. Поднимите удары ткани с щипцами и передачи ударов в скважины 96-луночных плиты. Наконец Инкубируйте легких ударов, погруженной в среде, подготовленном в 1.1.1. в инкубатор культуры клеток в стандартных условиях (21% (v/v) кислорода, углекислого газа и 95% влажности 5% (v/v), при 37 ° C).
7. Культура ткани и выборки для сбора урожая
- Культура PCLS и штампов на ночь в инкубаторе в условиях культуры стандартной ячейки.
- Культура PCLS и штампов под изложенные условия для максимум 120 часов после их поколения для обеспечения жизнеспособности клеточной и функции.
- Для уборки белка, а также РНК, мыть PCLS и штампов три раза в-фосфатный буфер (PBS), передавать их в криопробирки и оснастки замораживание в жидком азоте.
-
Пример среднего супернатант культивировали PCLS ударов для анализа секретируемые белки.
- Для гистологического анализа мыть PCLS и штампов три раза с PBS и исправить их с параформальдегида 4% по инкубации на 30 минут при 37 ° C. Наконец магазин PCLS в PBS на 4 ° C для дальнейшего течению пятнать.
Результаты
PCLS поколение
Поколение PCLS могут быть разделены на четыре основных этапа: хирургические легких тканей резекции, агарозы наполнения, на основе vibratome PCLS поколение и культуры PCLS. Резекции легочной ткани наполнен легкоплавких точки агарозы, который добавляет необходимые жесткость легочной ткани для нарезки и сохраняет структуру собственных легких и архитектуры. Следует отметить, PCLS поколение очень много времени, таким образом часто ночи хранения заполненные легочной ткани в среде DMEM F-12 могут быть включены в качестве дополнительного шага и PCLS поколение запущен на следующий день. В зависимости от следующих экспериментальной установки созданный PCLS можно инкубированы всю ночь в среде культуры стандартной ячейки, содержащие 0,1% (w/v) плода бычьим сывороточным, прежде чем экспериментальные условия применяются. 3D-LTCs были жизнеспособными и выставлены клеточных функций (таких как белка секрецию сурфактанта) для до 120 h22 в условиях культуры, изложенные в настоящем Протоколе (рис. 1) и могут быть оптимизированы на дальнейшее совершенствование их.
Заполнение агарозы
Для заполнения агарозы ткани, канюли периферического венозного катетера с диаметром 1,3 мм придает агарозы заполненный шприц был вставлен в бронх на поверхности среза ткани (рис. 2A). Бронхов часто локализуются недалеко от легочной артерии. В то время как артерии имеют более тонкие стенки и имеют тенденцию к краху, бронхов выставлена хорошо видно просвета. В зависимости от целостности тканей катетер может быть достигнуто через несколько поколений дыхательных дерева в периферии легкого. Вторглись бронха опечатали вокруг канюли, используя пинцет (рис. 2B). Легочной артерии может быть зажат с помощью пинцета в то же время. Впоследствии поднял ткань и жидкость агарозы нежно воплощено в дыхательных путях.
В зависимости от положения катетера большинство ткани может быть заполнен жидким агарозы (Рисунок 2D). При необходимости конус как части легочной ткани, которые отражают паренхимы легких, вентилируемые, вторглись бронха, может получить заполнены с агарозы (рис. 2 c). В обоих сценариях, может наблюдаться характерный узор ткани прочно заполненных областей: во-первых, большая часть ткани заполняется в клинья (Рисунок 2D), или во-вторых, меньше выступающих вокруг области тщательно заполненный ткани регионах появляются ( Рисунок 2 c). Если части дыхательных путей препятствовать агарозы сгустки или другими причинами, частей ткани может не быть заполнены должным образом агарозы. Таким образом только части ткани могут быть применимы для нарезки. В случае утечки в ходе агарозы, заполняя процедура части заполненные дыхательных дерева может получить перфорированные и заполнение легочной ткани получает практически невозможно, однако, возможные обходные пути включают заполнение через более периферийных бронха, глубже проникновение канюли в дистальной airways (рис. 2 g), или потенциального пережатия области утечки (Рисунок 2 H).
Точность cut легких нарезки
Блоков ткани в длину и ширину 1-1,5 см были вырезан из ткани регионов, которые были полностью заполнены с затвердевшей агарозы ()на рисунке 3A-3B). Далее отдельные ткани блоки были приклеены на держатель ткани vibratome (рис. 3 c). 500 мкм толщиной PCLS были получены, в то время как ткани блока на vibratome продвигается вперед со скоростью между 3-12 мкм/s. (рис. 3D-3F). Наконец PCLS были погружены в среде культуры клеток, содержащих 0,1% (w/v) плода бычьим сывороточным и культивировали в условиях культуры стандартных ячеек, как описано шаг 7.
Экспериментальная отсчетов человека 3D-LTC после 48 ч культивирования
Представитель иммунофлюоресценции окрашивание, как описано ранее,25Alsafadi et al., показано в рисунке 4A-4 C. Immunolabeling фибронектина (красный) и клеточных ядер (DAPI, синий), допускается для визуализации альвеолярной структуры сохранились в человека 3D-LTC ex vivo. Лечение человека PCLS пробивает с profibrotic цитокина коктейль (включая преобразование фактор роста бета 1, фактор роста тромбоцитов, полученных AB, lipophosphatidyl кислота и фактора некроза опухоли альфа) за 48 ч привело к изменениям фиброз как в человека 3D-LTCs. ПЦР наблюдалось значительное индукции фиброз соответствующих внеклеточного матрикса компоненты коллаген типа 1 и фибронектин генов в 3D-LTC ударов после лечения с profibrotic коктейль (рис. 4 d). Кроме того уровни белка из мезенхимы маркер виментин были обнаружены upregulated в 3 из 4 больных после лечения 3D-LTC пуансонов (Рисунок 4E).
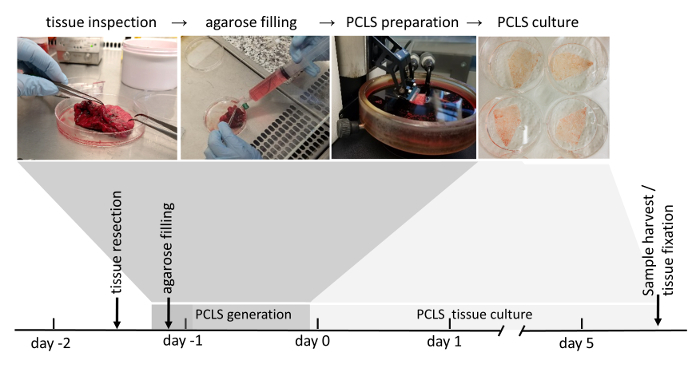
Рисунок 1: процесс формирования PCLS. Опухоль свободно OBLASTей резекций легких тщательно проверяется за счет их целостности тканей. Если ткань забил пригодных для дальнейшего использования (озвучивание подробно в разделе материал и методы), далее он заполнен жидким агарозы. Блоков ткани, заполнены с затвердевшей агарозы впоследствии нарезанный с vibratome. Погружен в среде культуры клеток, 3D-LTC являются культивируемых до 120 h после их поколения. Вниз по течению анализ 3D-LTCs включать выражения протеина или РНК, живой ткани флуоресценции изображений, а также иммунофлюоресценции, пятнать после фиксации ткани. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
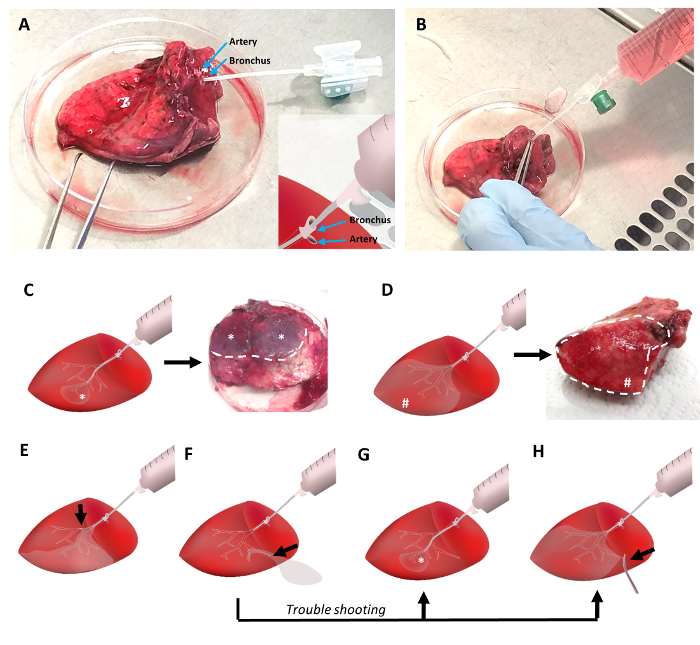
Рисунок 2: заполнение легочной ткани с легкоплавких точки агарозы. Легочной ткани является канюлированной с периферического венозного катетера, который вставляется в бронх, прилегающих к легочной артерии (рисунок 2A). Пинцеты используются исправить канюли в бронхов и зажим легочной артерии, чтобы избежать утечки жидкого агарозы. Жидкий агарозы при 42 ° C заливается в легочной ткани с 30 мл шприц (рис. 2B). Дистальная позиционирования канюлю во время наполнения приведет к в небольших районах заполненные ткани (рис. 2 c), проксимальной позиционирования обеспечит наполнение большего объема ткани (Рисунок 2D). Любые препятствия авиалинии приведет к сокращению объема ткани тома, которые могут быть заполнены (Рисунок 2E). В случае утечки агарозы, дистальной канюля позиционирования и/или зажима утечки стороны позволяет надлежащего агарозы заполнения легочной ткани ()Рисунок 2F-2 H). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 3: точность надреза легких нарезки. Успешно агарозы заполнены легочной ткани используется для акцизных кусок ткани блока (1 x 1,5 см x 1 см) с помощью скальпеля (рис. 3A). Далее блок подакцизным тканей клеится держатель ткани, шкалы бар показывает 1 см (рис. 3B). Предпочтительно тканей клеится с его плевральной поверхности на поверхности ткани держатель, как показано на рисунке 3 c. 500 мкм толщиной ломтиками вырезаны vibratome с ножом сапфир в 10-15° угол относительно ткани (рис. 3D и 3E). Процедуры резки приводит к 2-3 см3 большими нетронутыми легких ломтиками, шкалы бар = 5 мм (Рисунок 3F). Кроме того с помощью биопсии панчер, может создаваться небольшие воспроизводимые пробойники диаметром 4 мм. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
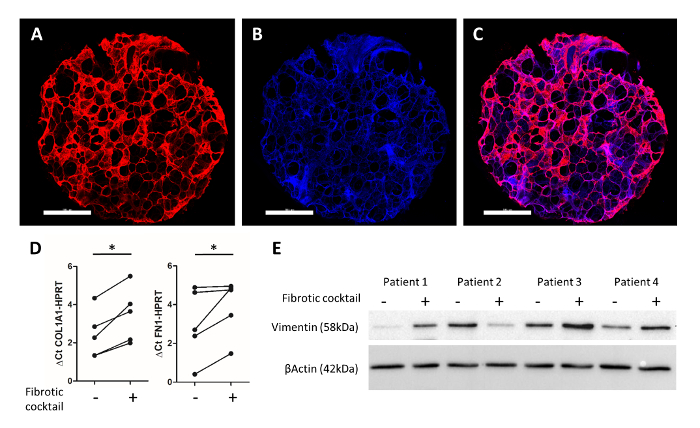
Рисунок 4: экспериментальная отсчетов человека 3D-LTCs после 48 ч культуры. Удар человека 3D-LTC диаметром 4 мм был immunostained для фибронектина (в красном) и DAPI (в синем) ()на рисунке 4A-4C). Масштаб баров = 1000 мкм. 4 c рисунок показывает объединенное изображение. Анализ РНК PCLS путем количественного RT-PCR показывает значительное увеличение экспрессии генов COL1A1 и FN1 коктейль profibrotic25. 4E рисунок отображает immunoblot общий белок лизатов PCLS, которых лечили фиброзных коктейль25. Зондирование виментин и β-актина продемонстрировал увеличение белков мезенхимальных маркера (виментин) после лечения с profibrotic факторов в пациента примеры 1, 3 и 4. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
| Критерий | Очки |
| Образец ткани имеет нетронутыми плевральной поверхность. | 20 |
| Образец ткани кажется макроскопически нетронутыми, не хватает разрезов, давя, разрывов и искажений. | 20 |
| Образец ткани содержит по крайней мере один бронха с диаметром > 1 мм. | 20 |
| Не содержит образец ткани или только маленькое количество крови. | 4 |
| Образец ткани полностью сохраняются в среде и без очевидных признаков ателектаз. | 4 |
| В течение последних четырех часов был резецируется образца ткани. | 4 |
| Образец ткани больше, чем его крупнейших диаметром 5 см. | 4 |
| Оценка в целом: |
Таблица 1: агарозы легких наполнения оценка. Оценка наполнения агарозы легких (LAFS) коррелирует с успеха для заполнения резекции тканей с агарозы для его последующего производства на основе vibratome PCLS. Оценка подводит итог всех точек критериев ткани. LAFS равна или выше 72 предсказывает хорошо агарозы, заполнение свойства, оценка ниже 60 предсказывает весьма вероятного отказа агарозы наполнения тканей.
Обсуждение
Протокол, описанный в этой рукописи охватывает поколения PCLS из resectates ткани легких человека, заполнив его с жидким агарозы и последующего vibratome нарезка. Поколение кусочков ткани был продемонстрирован перед несколько органов, как печень и мозг, тогда как присущие жесткость этих органов допускается прямое нарезка без каких-либо изменений ткани. Следует отметить первоначальный надлежащей подготовки легочной ткани является наиболее важным шагом в создании PCLS. Агарозы наполнение легких является методом выбора для стабилизации ее мягкой и эластичной характер и для обеспечения однородной и воспроизводимые PCLS поколения. Большие airways резецированный легочной ткани являются канюлированной предоставлять доступ мелких дыхательных путей, а также паренхимы легких нетронутыми. Отсутствие нетронутыми плевры, что делает практически невозможным агарозы наполнения, является одной из основных причин, почему легочной ткани главным образом не пригоден для нарезки легких. Проспективно синтетические плевры, первоначально предназначенные для выполнения функциональных эксперименты на decellularized леса потенциально могут применяться для достижения успешного агарозы заполнения эксплантов, которым недостает нетронутыми плевры31. Резекция приводит в кусок ткани легкое человека с нетронутыми плевры имеют важное значение для создания блоков ткани для нарезки. Резекции тканей из-за свободных опухолевых тканей от резекции рака более доступными, чем полностью нетронутыми лопастями или эксплантов целом легких пациентов, перенесших трансплантации легких.
Обычно, для производства PCLS используются две системы: Krumdieck ткани среза15 и вибрационный Микротомы (vibratomes). Срезы тканей генерировать фрагменты, передав блока ткани через металлический сосуд, который режет PCLS на 90° в конце этого судна. Vibratomes генерировать PCLS, перемещая вибрирующих нож горизонтально над якорь блока ткани, который погружен в ванне охлаждения среднего, который по сравнению с Тесак Krumdieck оказывает меньше силы сдвига на ткани. Это приводит к менее жестокого обращения ткани до выращивания. С другой стороны vibratome резки это больше времени и много работы. В наших руках vibratome, нарезка включено производство максимум 100 PCLS или 500 PCLS ударов в один день, достаточно для самых экспериментальных исследований. PCLS может быть культивировали различными способами: (а) придает транс Уэллс, создавая таким образом воздух жидкий интерфейс системы (Али), (b) как динамический органной культуры (DOC), или (c) погруженной в среде культуры клеток в условиях культуры стандартной ячейки. Культивирование в деталях PCLS был ранее описанных22,,2325; Однако до сих пор отсутствует общий стандарт условий выращивания между их использования в различных лабораториях во всем мире. В частности, время культуры может быть критическим: как в мышиных PCLS, потеря SFTPC позитивные альвеолярного 2 типа клеток наблюдается после 144 ч, но не после 120 h22. Кроме того метаболической активности, как представляется, остаются стабильными в мышиных22 и человека PCLS25 для 120 h.
Существует несколько технических ограничений для генерации PCLS: количество и размер resectates меняется с течением времени; эффективность агарозы заполнения, который зависит от наличия нетронутыми плевры в пределах полученных ткани, определяет конечный успех PCLS поколения; и разрушение тканей, вызванных патологических изменений в рамках полученных (больной) легочной ткани могут помешать подготовке PCLS. Дыхательные пути препятствия и фиброзных тканей, не хватает нетронутыми альвеолярного пространства препятствуют с агарозы наполнения и таким образом сделать Фрагментирование фиброзных тканей сложной задачей. Emphysematous тканей как по направлению заболеваний таких как ХОБЛ или дефицита альфа-1-анти трипсин может не выдержать давление наполнения агарозы и приведет к разрыву альвеолы и архитектурных памятников. В этих случаях использование агарозы низкой концентрации, например, 1% (w/v), может быть полезным для снижения давления и скорости во время наполнения агарозы. В целом болезненное состояние тканей может резко ограничить использование ткани для PCLS поколения. Все эти параметры определяют количество PCLS, которые могут быть сгенерированы из легочной ткани, а также количество времени, необходимое для производства PCLS. Дальнейшие ограничения PCLS являются несоответствия между различными легких ломтики в отношении размера или ткань содержание, которое требует дальнейшего шаги нормализации для экспериментов. Чтобы преодолеть это, могут создаваться биопсии пробойники подобных регионов же фрагмента. Эта процедура уместна снизить изменчивость ткани и, как дополнительное преимущество, увеличить количество PCLS проб, которые могут быть использованы для экспериментов.
В заключение, культур тканей человека 3D легких от агарозы заполнены PCLS представляют собой комплекс человека модель для изучения физиологии легких и болезни. Протокол содержит подробное описание подготовки PCLS от резекции легочной ткани и их выращивания и Кроме того рассматриваются проблемы заполнения агарозы резекций легких человека и как их преодолеть.
Раскрытие информации
Все авторы заявляют не конкурирующих финансовых интересов.
Благодарности
Авторы благодарны Marisa Неймана для экспертной технической помощи. Все легочной ткани были любезно представил на КПК-М био-Архив. Эта работа была поддержана Немецкий центр исследования легких (DZL), Гельмгольца и КПК Исследовательская школа грантов.
Материалы
| Name | Company | Catalog Number | Comments |
| Vibratome Hyrax V50 | Zeiss | - | |
| Hyrax CU 65 | Zeiss | - | |
| Vasofix Braunüle 18 G | B. Braun Melsungen AG | 4268130B | |
| 30 mL NORM-INJECT | Henke Sass Wolf | 4830001000 | |
| Guarded disposable scalpels, sterile | Swann-Morton | ||
| Loctite 406 | Henkel | LOCTITE 406 | |
| Synthetic Single Crystal Sapphire | Delaware Diamond Knives | - | |
| Dulbecco's Modified Eagle Medium F-12 Nutreient Mixture (Ham) + L-Glutamine + 15mM HEPES | Gibco | 31330-038 | |
| Penicillin Streptomycin | Gibco by Life Technologies | 15070-063 | |
| Special process fetal bovine serum (Sera Plus) | Pan Biotech | P30-3702 | |
| Disposable Biopsy Punch | pfm medical | 48401 | |
| 96 Well, Black/Clear, Tissue Culture Treated Plate, Flat Bottom with Lid, sterile | Falcon / Corning | 353219 | |
| Agarose, low geling temperature | Sigma | A9414-100G |
Ссылки
- Lozano, R., et al. Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010: a systematic analysis for the Global Burden of Disease Study. Lancet. 380 (9859), 2095-2128 (2010).
- Rosenberg, S. R., Kalhan, R., Mannino, D. M. Epidemiology of Chronic Obstructive Pulmonary Disease: Prevalence, Morbidity, Mortality, and Risk Factors. Seminars in Respiratory and Critical Care Medicine Med. 36 (4), 457-469 (2015).
- Hekking, P. P., et al. The prevalence of severe refractory asthma. The Journal of Allergy and Clinical Immunology. 135 (4), 896-902 (2015).
- Woodard, G. A., Jones, K. D., Jablons, D. M. Lung Cancer Staging and Prognosis. Cancer Treatment and Research. 170, 47-75 (2016).
- Ley, B., Collard, H. R., King, T. E. Clinical course and prediction of survival in idiopathic pulmonary fibrosis. American Journal of Respiratory and Critical Care Medicine. 183 (4), 431-440 (2011).
- Burgstaller, G., et al. The instructive extracellular matrix of the lung: basic composition and alterations in chronic lung disease. European Respiratory Journal. 50 (1), (2017).
- Degryse, A. L., Lawson, W. E. Progress toward improving animal models for idiopathic pulmonary fibrosis. The American Journal of the Medical Sciences. 341 (6), 444-449 (2011).
- Fricker, M., Deane, A., Hansbro, P. M. Animal models of chronic obstructive pulmonary disease. Expert Opinion on Drug Discovery. 9 (6), 629-645 (2014).
- Sagar, S., Akbarshahi, H., Uller, L. Translational value of animal models of asthma: Challenges and promises. European Journal of Pharmacology. 759, 272-277 (2015).
- Williamson, J. D., Sadofsky, L. R., Hart, S. P. The pathogenesis of bleomycin-induced lung injury in animals and its applicability to human idiopathic pulmonary fibrosis. Experimental Lung Research. 41 (2), 57-73 (2015).
- Cooper, P. R., et al. Formoterol and salmeterol induce a similar degree of beta2-adrenoceptor tolerance in human small airways but via different mechanisms. British Journal of Pharmacology. 163 (3), 521-532 (2011).
- Skronska-Wasek, W., et al. Reduced Frizzled Receptor 4 Expression Prevents WNT/beta-Catenin-driven Alveolar Lung Repair in Chronic Obstructive Pulmonary Disease. American Journal of Respiratory and Critical Care Medicine. 196 (2), 172-185 (2017).
- Lehmann, M., et al. Senolytic drugs target alveolar epithelial cell function and attenuate experimental lung fibrosis ex vivo. European Respiratory Journal. 50 (2), (2017).
- Koch, A., et al. Murine precision-cut liver slices (PCLS): a new tool for studying tumor microenvironments and cell signaling ex vivo. Cell Communication and Signaling. 12, 73 (2014).
- Ebsen, M., et al. Infection of murine precision cut lung slices (PCLS) with respiratory syncytial virus (RSV) and chlamydophila pneumoniae using the Krumdieck technique. Pathology - Research and Practice. 198 (11), 747-753 (2002).
- Kennedy, J. L., et al. Effects of rhinovirus 39 infection on airway hyperresponsiveness to carbachol in human airways precision cut lung slices. The Journal of Allergy and Clinical Immunology. 141 (5), 1887-1890 (2018).
- Royce, S. G., et al. Airway Remodeling and Hyperreactivity in a Model of Bronchopulmonary Dysplasia and Their Modulation by IL-1 Receptor Antagonist. American Journal of Respiratory Cell and Molecular Biology. 55 (6), 858-868 (2016).
- Donovan, C., et al. Rosiglitazone elicits in vitro relaxation in airways and precision cut lung slices from a mouse model of chronic allergic airways disease. American Journal of Physiology-Lung Cellular and Molecular Physiology. 309 (10), L1219-L1228 (2015).
- Zscheppang, K., et al. Human Pulmonary 3D Models For Translational Research. Biotechnology Journal. 13 (1), (2018).
- Fisher, R. L., et al. The use of human lung slices in toxicology. Human & Experimental Toxicology. 13 (7), 466-471 (1994).
- Wang, L., et al. Differences between Mice and Humans in Regulation and the Molecular Network of Collagen, Type III, Alpha-1 at the Gene Expression Level: Obstacles that Translational Research Must Overcome. International Journal of Molecular Sciences. 16 (7), 15031-15056 (2015).
- Uhl, F. E., et al. Preclinical validation and imaging of Wnt-induced repair in human 3D lung tissue cultures. European Respiratory Journal. 46 (4), 1150-1166 (2015).
- Switalla, S., et al. Natural innate cytokine response to immunomodulators and adjuvants in human precision-cut lung slices. Toxicology and Applied Pharmacology. 246 (3), 107-115 (2010).
- Banerjee, A., et al. Trichostatin A abrogates airway constriction, but not inflammation, in murine and human asthma models. American Journal of Respiratory Cell and Molecular Biology. 46 (2), 132-138 (2012).
- Alsafadi, H. N., et al. An ex vivo model to induce early fibrosis-like changes in human precision-cut lung slices. American Journal of Physiology-Lung Cellular and Molecular Physiology. 312 (6), L896-L902 (2017).
- Westra, I. M., Oosterhuis, D., Groothuis, G. M., Olinga, P. Precision-cut liver slices as a model for the early onset of liver fibrosis to test antifibrotic drugs. Toxicology and Applied Pharmacology. 274 (2), 328-338 (2014).
- Vatakuti, S., Schoonen, W. G., Elferink, M. L., Groothuis, G. M., Olinga, P. Acute toxicity of CCl4 but not of paracetamol induces a transcriptomic signature of fibrosis in precision-cut liver slices. Toxicology in Vitro. 29 (5), 1012-1020 (2015).
- Poosti, F., et al. Precision-cut kidney slices (PCKS) to study development of renal fibrosis and efficacy of drug targeting ex vivo. Disease Models & Mechanisms. 8 (10), 1227-1236 (2015).
- Li, M., de Graaf, I. A., Groothuis, G. M. Precision-cut intestinal slices: alternative model for drug transport, metabolism, and toxicology research. Expert Opinion on Drug Metabolism & Toxicology. 12 (2), 175-190 (2016).
- Morin, J. P., et al. Precision cut lung slices as an efficient tool for in vitro lung physio-pharmacotoxicology studies. Xenobiotica. 43 (1), 63-72 (2013).
- Wagner, D. E., et al. Design and Synthesis of an Artificial Pulmonary Pleura for High Throughput Studies in Acellular Human Lungs. Cellular and Molecular Bioengineering. 7 (2), 184-195 (2014).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены