Method Article
Мышь сингенных B-клеточной лимфомы модель для предварительно клинической оценки CD19 автомобилей Т-клеток
В этой статье
Резюме
Здесь мы представляем собой протокол для производства и доклинические испытания мышиных CD19 автомобилей Т-клеток ретровирусной трансдукция и использования в качестве терапии против установленных сингенных A20 B-клеточной лимфомы мышей BALB/c с или без lymphodepleting Предварительное кондиционирование.
Аннотация
Удивительные клинический успех CD19 химерных антигена рецепторов (автомобиль) Т-клеточной терапии привело к утверждения двух второго поколения химерных антигена рецепторов (легковые автомобили) для острый лимфобластный лейкоз (все) и лимфомы (НХЛ). В центре поля находится теперь на подражать эти успехи в других гемобластозами, где наблюдаются менее впечатляющие темпы полный ответ. Дальнейшее Проектирование автомобилей Т-клетки или совместное управление других методов лечения может успешно преодолеть препятствия для успешного лечения в других настройках рака.
Поэтому мы представляем модель, в которой другие могут провести Доклинические испытания CD19 автомобилей Т-клеток. Результаты в этой хорошо протестированные модели B-клеточной лимфомы склонны быть информативным автомобилей Т-клеточной терапии в целом.
Этот протокол позволяет воспроизводимое производство мыши автомобиля Т-клетки через фосфат кальция трансфекции Plat-E Производитель клеток с MP71 ретровирусной конструкции и pCL Эко упаковка плазмида следуют коллекции секретируемые ретровирусные частицы и трансдукция с использованием рекомбинантного человеческого фибронектин фрагмент и центрифугирования. Проверка ретровирусной трансдукции и подтверждение автомобилей Т-клеток возможность убить целевой Лимфома клетки ex vivo, с помощью проточной цитометрии, luminometry и иммуноферментного анализа (ИФА), также описан.
Описаны lymphodepleted сингенных мышей, с учетом установленных, системного лимфомы и протоколы для тестирования автомобилей Т-клеток в естественных условиях в lymphoreplete. Противораковое действие контролируется биолюминесценции и болезнь прогрессии в естественных условиях . Мы показываем типичные результаты ликвидации установленных B-клеточной лимфомы, при использовании 1st или 2-го поколения автомобили в сочетании с lymphodepleting предварительного кондиционирования и меньшинство мышей, достижение долгосрочной перспективе ремиссии при использовании автомобилей T клетки, выражая Ил-12 lymphoreplete мышей.
Эти протоколы могут быть использованы для оценки CD19 автомобилей Т-клеток с различных дополнительных изменений, комбинации автомобилей Т-клеток и других терапевтических агентов или адаптированы для использования автомобилей Т-клетки против различных целевых антигенов.
Введение
Химерных антигена рецепторов (автомобиль) Т-клеточной терапии показал поразительные клинический успех в лечении CD19+ злокачественных опухолей, ведущим к утверждению tisagenlecleucel прогрессировании острый лимфобластный лейкоз1 и axicabtagene ciloleucel для прогрессивного большой B-клеточной неходжкинской лимфомы2 , в 2017 году.
Важность взаимодействия между раком и иммунной системы в прогрессирования заболевания и терапевтические механизмы становится все более широкое признание3,4,5. Например хорошо документированы, что микроокружения опухоли (ТМЕ) купается с факторами, которые могут подавить эффекторных функций иммунокомпетентных клеток6,,78. В качестве альтернативы грунтование эндогенного иммунных клеток и распространения epitope может быть ключом в ликвидации опухоли и долгосрочная устойчивость к опухоли вызов9,10. Оба эти явления не могут оцениваться в культивированная модели, которые не имеют иммунной системы. Аналогичным образом системы использования трансгенных белки не точно отражает проблему нарушения иммунной толерантности, который необходим для эпитопов распространение11,12. Таким образом, модель сингенных с полностью функциональной иммунной системы имеет первостепенное значение для моделирования этих важных аспектов болезни рака прогрессии и иммунной терапии.
Важный нюанс автомобилей Т-клеточной терапии является то, что lymphodepleting предварительного кондиционирования для терапевтического успеха13,14. Это обычно достигается в больных управляющей химиотерапии до инфузии автомобилей T клетки15,16. Как стандартный метод чтобы имитировать lymphodepletion, используемые в параметре пациента, мы управляем 5 гр тотальное облучение тела (TBI) для достижения lymphodepletion до администрации терапевтических автомобилей Т-клеток с учетом системного A20 B-клеточной лимфомы мышей.
Хотя lymphodepleting предварительного кондиционирования не является проблемой для большинства больных, токсичность, которая поставляется с химиотерапевтических агентов означает, что пациенты низкой производительности статуса автомобилей Т-клеточной терапии не подлежат. Чтобы создать тест-системы, представляющий непригодной для lymphodepletion пациентов, мы создали lymphoreplete мышь сингенных модель, в которой мы модели автомобилей Т-клеточной терапии лимфомы. В этой модели, мы показали, что секрецию Ил-12 от внутри автомобиля Т-клеток может привести к ликвидации установленных лимфомы с успех скоростью ~ 25%17. Кроме того мы показали, что эндогенного иммунные клетки были вовлечены в искоренение рака.
Здесь мы подробно описать протокол для производства автомобилей Т-клеток мыши, установление лимфомы в сингенных мышей и лечение лимфомы с автомобилей Т-клеток с или без использования предварительного кондиционирования lymphodepleting. Это может использоваться для исследования сочетание автомобилей Т-клеток с другими агентами, тестирование автомобилей Т-клеток с другими трансгенов или для использования других приемных клетки терапии или иммунотерапии стратегий борьбы с лимфомой.
протокол
Все эксперименты на животных были проведены под эгидой Закон 1986 года о животных (научные процедуры) и под Великобритании Координационного комитета для исследований рака руководящих принципов. Все исследования на животных были проведены в институте CRUK-Манчестер и одобрены местных животных и этики обзор тела (CRUK-ми AWERB).
1. Подготовка
- Maxiprep pMP71 ретровирусной построить плазмиды и pCL эко ретровируса упаковки плазмид18.
Примечание: pMP71 кодирует mCherry и автомобиль, разделенных FMDV2A последовательности. Это взаимозаменяемы с другими ретровирусной конструкции. pCL эко кодирует кляп, ГСМ и ecotropic конверт белков. - Подготовка среднего полного Т-клеток (TCM) для культивирования клеток мыши T с помощью RPMI 1640 средних, 10% FCS, 1% 100 x пенициллин стрептомицином глютамин (ПСЖ).
Примечание: Решение содержит 100 МЕ/мл пенициллин, 100 мкг/мл стрептомицина и 2 мм L-глютамин), 50 мкм β-меркаптоэтанол и 25 мм 4-(2-hydroxyethyl)-1-piperazineethanesulfonic кислота (HEPES). - Культура клетки A20 RPMI 1640, 10% FCS и β-меркаптоэтанол 0.05 мм при 37 ° C, 5% CO2.
- Культура клетки платины-Е Plat-Е в среде полного Дульбекко модифицированных орла (DMEM) (DMEM с 10% плода телячьей сыворотки (FCS), 2 мм L-глютамином, 1 мкг/мл puromycin и 10 мкг/мл blasticidin) при 37 ° C, 5% CO2.
Примечание: Плат-E клетки являются производными от 293T клеток и выразить кляп, ГСМ и ecotropic конверт ретровирусной белков. - Подготовьте трансфекции медиа решения 1 и 2 непосредственно перед transfection. Готовят раствор 1 (рН 7,9) содержат DMEM + 10% FCS + 25 мм HEPES, решение 2 (рН 7,1) содержат DMEM + 25 мм HEPES.
- Подготовка 10 мкг/мл рекомбинантного человеческого фибронектин фрагмент решения путем разбавления с стерильных фосфат амортизированное saline (PBS) и хранить при температуре от-20 ° C до использования.
- Стерильными фильтр все средства массовой информации через 0,2 мкм фильтры до использования (за исключением рекомбинантного человеческого фибронектин фрагмент).
2. антиретровирусные трансдукции Т-клеток
- День 1: Подготовка к трансфекции
- Семя 7,5 х 106 Platinum-Е (Plat-E) клетки в 15 см2 культуры ткани блюда в 18 мл полного DMEM и инкубировать на ночь при 37 ° C, 5% CO2.
- День 2: Transfection Plat-E ретровирусной упаковки клеточной линии
- Подготовьте 20.4 мкг pcl Эко упаковка вектора ДНК, 39,6 мкг плазмида ДНК кодирования ретровирусной конструкции автомобиля и 150 мкл CaCl 1 М2 заключительный объемом 3 мл раствора трансфекции 2 за 15 см2 блюдо transfected. Вортекс для 10 s и отдыха за 5 мин
- Удаление DMEM СМИ от 15 см2 блюда и заменить 12 мл раствора 1 transfection.
Предостережение При изменении средства массовой информации, 15 см2 блюда можно высушить в центре. Это может привести к существенной смерти transfected клеток Plat-E. Работать быстро и извлеките из всего 1-2 плиты одновременно. - Добавьте 3 мл трансфекции решение 2, содержащий ДНК и CaCl2 к каждому блюду 15 см2 каплям, равномерно через каждую пластину. Осторожно покачайте пластины с бокового движения для 10 s. инкубировать при 37 ° C, 5% CO2 на ночь.
- День 3: Подготовка вирус содержащих супернатанта для трансдукции
- Заменить СМИ transfected клеток пластины-E с 18 мл завершить TCM и вернуться в инкубатор.
Предостережение Когда изменение средств массовой информации 15 см2 блюда можно высушить в центре. Это может привести к существенной смерти transfected клеток Plat-E. Работать быстро и извлеките из всего 1-2 плиты одновременно.
- Заменить СМИ transfected клеток пластины-E с 18 мл завершить TCM и вернуться в инкубатор.
- День 3: Изоляции и в пробирке активация Т-клеток мыши селезеночной
- Удаление селезенки из 6-8-week-old мышей BALB/c, как описано ранее, Паркинсона и др. 19 и погрузить их в стерильные, ледяной, PBS в 50 мл Конические трубки.
- Используйте щипчики для передачи селезенки пробки microcentrifuge 1,5 мл и гомогенизации, с помощью пестика с минимальной силой.
- Использование пипетки 1000 мкл и ~ 800 мкл PBS передать стрейнер клеток поры 100 мкм, проставленный на тюбик 50 мл, содержащие 5 мл PBS для достижения одной ячейки подвеска огневки. Повторите шаг 2.4.2 для дополнительной селезенки. Не превышать 3 селезенки в трубку.
Предостережение Splenocytes прошло через фильтр могут образовывать сгустки, если осталось. Вручную, вихревой трубы с перерывами, если обработка нескольких селезенки во избежание слипания клеток. Остальные фрагменты на ячейки фильтра может быть далее пюре с использованием плунжера от 5 мл шприц, с использованием минимальной силы. - Топ 20 мл с PBS. Слой 20 мл суспензии клеток нежно на 20 мл градиента плотности СМИ (Таблица материалов) в 50 мл трубки. Центрифуга для результирующей обложил подвеска на 800 x g 20 мин с не на педаль.
- Урожай клетки на уровне интерфейса, используя стерильные пипетки Пастера и передачи 50 мл трубки. Топ до 50 мл с PBS и центрифуги на 800 x g за 10 мин, чтобы мыть. Отменить супернатант и вновь приостановить клетки в полной TCM.
- Подсчитать количество ячеек с помощью Горяева.
- Культура клетки на плотности тарелок 5 x 106 клеток/мл в полной TCM с 30 нг/мл антитела анти CD3ε (клон 145-2 C 11), 30 нг/мл антитела анти CD28 (клон 37.51), 100 ед/мл рекомбинантного человеческого IL-2 и 2 нг/мл рекомбинантной мышиных IL-7. Используйте настой соответствующего размера культуры ткани для объема клетки собирают.
Примечание: Антиген–представляющие клетки необходимы для активации Т-клеток, CD3 и CD28 антител, если работы с очищенной клетки T он необходим для пальто плит с антителами, или использовать магнитные шарики (Таблица материалов) - Инкубируйте splenocytes мыши при 37 ° C, 5% CO2 на ночь.
- День 3: Подготовка пластин для трансдукции
- Слой тканевой культуры 6-ну пластины с 2 мл 10 мкг/мл рекомбинантного человеческого фибронектин фрагмент и инкубировать на ночь при 4 ° C.
- День 4: Трансдукции клеток мыши T
- Передавать рекомбинантного человеческого фибронектин фрагмент из пластины с покрытием свежие пластины 6-ну тканевой культуры. Инкубируйте эти пластины на ночь при 4 ° C для круглые 2 трансдукции.
- Добавить 2 мл ТКМ в каждой скважине оригинальных пластин с покрытием фрагмент содержит рекомбинантного человеческого фибронектина и оставить на 30 минут при комнатной температуре блокировать неспецифической привязки.
- Урожай ретровируса содержащих супернатант из transfected клеток Plat-E 15 см культуры ткани блюда и заменить 18 мл полной TCM.
Предостережение Работе быстро, чтобы избежать высыхания Plat-E клеток.
Примечание: Успех transfection может быть проверена на данном этапе по микроскопии флуоресцирования, если использование флуоресцентных маркеров ген как mCherry (рис. 1). - Фильтр ретровируса содержащих супернатант через 0.45 мкм фильтр для удаления мусора ячейки. Удалить TCM из рекомбинантного человеческого фибронектин покрытием фрагмент 6-ну плит и добавить 2,5 мл отфильтрованных ретровируса содержащих супернатант или для каждой скважины (использование полное TCM для макет трансфекции). Этикетке каждого также добавлением ретровируса или макет СМИ.
- Центрифуга пластины на 1200 x г за 30 мин при комнатной температуре.
- Хотя пластин спиннинг, собирать активированные Т-клеток и рассчитывать, с помощью Горяева.
- Трансдукция осуществляется с 5 х 106 активировано splenocytes в общей сложности 5 мл/хорошо. Пелле требуемое количество splenocytes для МОК/трансдукции в отдельных труб центрифугированием на 500 g x 5 мин.
- Вновь приостановите splenocytes на плотности тарелок 5 x 106 клеток на 2,5 мл отфильтрованных ретровируса содержащих супернатант из шага 2.6.4 или TCM как отрицательный контроль. Добавьте рекомбинантный человеческий Ил-2 (hIL-2) и мышь рекомбинантного ИЛ-7 (mIL-7) в конечной концентрации 200 МЕ/мл и 4 нг/мл соответственно.
- Собирать 6-ну пластины из центрифуги на завершения шага 2.6.5 и добавить 2,5 мл/а вновь приостановлено splenocytes в соответствующие скважин, чтобы сделать окончательный объем 5 мл/Ну и конечная концентрация 100 ед/мл Хиль-2 и 2 нг/мл mIL-7.
- Центрифуга пластины на 1200 g x 90 мин при комнатной температуре. После центрифугирования Инкубируйте пластины при 37 ° C, 5% CO2 на ночь.
- День 5: Раунд 2 трансдукция
- Соберите рекомбинантного человеческого фибронектин фрагмент из пластин, как это может быть повторно использован. Повторите шаги 2.6.2 - 2.6.5.
- Хотя пластин спиннинг, соберите клетки от 1st раунд трансдукция с помощью пипетки Пастера. Промойте каждую лунку с 2 мл PBS, вихрем и собирать любые оставшиеся ячейки в каждой скважине.
Примечание: Пипетка вверх и вниз, чтобы вновь приостановить отложившейся клетки. Собирайте каждой группы управления/трансдукции в отдельных труб. - Пробирок на 500 x g для 5 минут вновь приостановить ячеек в 2,5 мл на хорошо трансдукция с 200 МЕ/мл Ил-2 и 4 нг/мл IL-7. Повторите шаги 2.6.7 - 2.6.8.
- Удаление ячеек из центрифуги и инкубировать при 37 ° C, 5% CO2 на 4 ч собирают преобразованы клетки как шаги 2.7.2-2.7.3.
- Подсчет количества ячеек, центрифуги на 500 x g 5 минут и вновь приостановить в полной TCM на плотности 1 х 106 клеток/мл с 100 ед/мл Хиль-2 и 2ng/мл mIL-7. Трансфер в колбе подходящего размера культуры и инкубировать при 37 ° C, 5% CO2.
- Добавить свежие средства массовой информации TCM, содержащих 100У/мл Хиль-2 и 2ng/мл mIL-7 каждые 2 дня, поддержание плотность клеток 1 х 106 клеток/мл.
Примечание: Собранный splenocytes содержат различные типы клеток. В этих условиях культуры не Т-клетки отмирают в течение 2-3 дней. После ~ 4 дней в культуре клеток, количество клеток T эквивалентно обычно общее количество собранного splenocytes день 0.
3. Измерение эффективности трансдукция
- На 4 день пост трансдукции Соберите образец transduced или не преобразованы Т-клеток (примерно 3 x 105 клеток). Центрифуга суспензию клеток на 500 x g 5 минут, удалить супернатант, Вымойте гранулированных клетки один раз с PBS и центрифуги снова.
- Отменить супернатант и добавить 100 мкл PBS, содержащий подходящие Амин реактивной краситель (например, жить/мертвые пятна, 1 100 разрежения) за хорошо. Инкубируйте 15 мин при комнатной температуре в темноте.
- Мыть дважды с PBS и центрифуги на 500 g x 5 мин удалить супернатант и проинкубируйте с 50 мкл буфера СУИМ, содержащий CD16/CD32 антитела анти мыши для Fc рецептор, блокирование (1 100 разрежения). Проинкубируйте втечение 10 мин при 4 ° C.
- Сразу добавьте 50 мкл антитело пятная мастер смеси, содержащие анти мыши CD4 BV786 и CD8-BV711 антител (конечная концентрация 1 мкл/скважины в буфере СУИМ). Инкубируйте 30 мин при температуре 4 ° C в темноте. Повторите шаг мыть 3.3. Вновь приостановить клеток в 1% PFA буфера и держать в темноте при температуре 4 ° C до анализа подачей cytometry.
- Анализ клеток с эквивалентной подходит цитометр, используя BV711, BV785 и mCherry флуоресценции в качестве маркеров CD4 и CD8 подмножества и автомобиль выражения, соответственно, память, как показано на (рис. 2).
4. в vitro проверки автомобилей Т-клеток деятельности
- Семян сингенных целевых CD19+ опухолевых клеток с или без Люцифераза выражение на плотности 1 х 104 клеток в 100 мкл TCM/хорошо в 96-Ну U-нижней плиты культуры ткани.
- Добавьте 1 х 104 CD19 автомобилей T клетки/колодец в объеме 100 мкл/хорошо для достижения эффекторных целевой (E:T) соотношение 1:1.
Примечание: E:T коэффициенты должны устанавливаться для каждого автомобиля и целевой линии клеток. - Использование T клетки только и только как негативный контроль опухолевые клетки и Т-клетки под воздействием phorbol миристат ацетат (PMA) (50 нг/мл) и ionomycin (1 мкг/мл) как положительный контроль для интерферона гамма (IFNγ) выпуска. Совместное культуры клеток при 37 ° C, 5% CO2 для 16-24 ч.
- После совместного культуры центрифуга пластины на 500 g x 5 мин и собирать супернатант для дальнейшего анализа IFNγ и Ил - 12 p 70 ELISA.
Примечание: Это может храниться при температуре-80 ° C. - Вновь приостановите клеток окатышей в 100 мкл PBS, содержащих Люциферин (конечная концентрация 1,5 мг/мл). Инкубировать пластины для 10 минут при 37 ° C. Затем измерения люминесценции от каждой скважины с подходящей люминометра.
Примечание: Время экспозиции должны быть оптимизированы для клеточных линий и плотности. Представитель результаты показаны на рисунке 3a. Ex vivo цитотоксичность автомобилей Т-клеток могут быть изменены Экспресс люциферин Сопредседатель культуры с клеточных линий, выражая цель антигена. Как автомобиль Т-клетки убить клетки-мишени, выпустила люциферин, поэтому снижение luminometry сигнала соотносится с убить клетки. Non преобразованы клетки часто может иметь влияние на жизнеспособность клеток цели, особенно на длительный инкубационный период. Измерьте концентрацию мышиных IFNγ и Ил - 12p 70 в надосадке согласно производителя ELISA протоколы. Представитель результаты отображаются в (рис. 3b и 3 c). Ex-vivo активации автомобилей Т-клеток, Сопредседатель культуры с клеточных линий, выражая цель антигена можно assayed анализируя супернатанта содержимое с помощью ИФА. Отношение автомобилей Т-клеток в клетки-мишени и продолжительность периода совместного культуры должны быть оптимизированы для каждой конструкции автомобилей, целевой ячейки линии и исследуемое вещество. PMA и ionomycin лечение может использоваться как позитивный элемент управления для подтверждения качества Т-клеток и их способности реагировать.
5. оценить деятельность анти-рак у мышей
-
Протокол 1
- Выполните 100 мг/кг внутривенно (IV) доставки циклофосфамид в мышей BALB/c 6-8 недель. Это позволяет приживления опухоли без значительных lymphodepletion17 (рис. 4).
Примечание: Создание A20 лимфомы может занять более 2 месяцев с частотой субоптимальные принять. Это может быть улучшена путем использования циклофосфамида 1 день до доставки клеток лимфомы. С целью изучения lymphoreplete мышей, мы определили дозы циклофосфамид, которые могли бы повысить эффективность лимфомы не вызывая lymphodepletion. - Следующий день, придать 100 мкл 5 x 105 сингенных A20 B-клеточной лимфомы клеток изменения выразить Люцифераза и Зеленый флуоресцентный белок (ГПУП) мышей при внутривенном (IV).
- Разрешить мышей для разработки системных лимфомы для ~ 17 дней.
- Подтвердите наличие системных лимфомы, внутрибрюшинного введения (IP) в 100 мкл люциферин 30 мг/мл и изображений с помощью биолюминесценции в естественных условиях , системы.
- Используйте разделители, чтобы избежать распространения сигнала в прилегающих мышей. Разоблачить мышей за 1 мин на вентральной стороне с постоянным размером региона интерес.
- Отображение относительных единицах света (RLU) как фотоны в секунду (p/s). Параметры должны быть оптимизированы для каждой модели опухоли; Использование воздействия, что может забрать раннего выявления опухолей, но не привести к насыщенности, как опухоли достичь конечных точек.
- Запись всего RLU для каждой мыши с постоянным размером области интереса. (Рисунок 5a и b).
- Придать разовая доза 1 х 106 автомобилей Т-клеток, IV инъекции в lymphoreplete мышей с учетом установленных лимфомы.
Примечание: (важно) Дозирование уровнях должны создаваться для каждого автомобиля построить, используя график эскалации дозы для обеспечения любых возможных токсичность, вытекающих из автомобилей Т-клетки характеризуются и могут быть решены. Хотя анти мыши CD19 автомобилей Т-клетки не отображать токсичность, автомобилей Т-клеток может привести к неожиданным токсичность. Там, где несколько автомобилей конструкции и электромеханической эффективности не идентичны, общее количество Т-клеток, ведении следует равных путем добавления Т-клеток, не преобразованы в ячейку препаратов. - Контролировать прогрессирование заболевания еженедельно через IP инъекции 100 мкл люциферин 30 мг/мл и изображений с помощью биолюминесценции в естественных условиях , визуализации системы (рис. 5 c).
- Внимательно следить за мышей признаки токсичности и усыпить мышей, которые показывают первые признаки задних конечностей паралич (ГВУ) или патологических опухоли бремя до любого страдания могут возникнуть.
Примечание: Токсичность от A20 лимфомы могут включать паралич задних конечностей через прорастание опухоли мозговых оболочек. Регулярно проверяйте для ранних признаков измененных походки. Кроме того большие опухоли IP могут возникнуть, что может привести к дискомфорту, свидетельствует измененное поведение. - Следить за выживание мышей для 60-100 дней (рис. 5 d). Выполняют euthanasia методом график-1 после завершения эксперимента.
- Выполните 100 мг/кг внутривенно (IV) доставки циклофосфамид в мышей BALB/c 6-8 недель. Это позволяет приживления опухоли без значительных lymphodepletion17 (рис. 4).
-
Протокол 2
- Доставить циклофосфамида 200 мг/кг 6-8 - неделя старый мышей BALB/c впрыской хвост вен в 100 мкл PBS на мышь.
- На следующий день придать 5 x 105 сингенных A20 B-клеточной лимфомы клеток выразить Люцифераза и гена GFP в 100 мкл PBS через хвост инъекции Вену.
- Разрешить мышей для разработки системных лимфом для ~ 7-14 дней
- Подтвердите системных лимфомы, IP инъекции 100 мкл люциферин 30 мг/мл и изображений с помощью биолюминесценции в естественных условиях , визуализации системы.
- Выполните 5 гр тотальное облучение тела (TBI) 0,02 гр/мин для lymphodepletion.
Примечание: Пациенты проходят лечение автомобилей Т-клеток пройти целый ряд схем для достижения lymphodepletion, прежде чем администрация автомобилей Т-клеток, которые значительно увеличивает приживления из восприимчивую переведены автомобилей Т-клеток. Это может быть воспроизведена в мышей с облучение всего тела (TBI) (рис. 6). - На следующий день придать 1 х 106 автомобилей Т-клеток в 100 мкл PBS через хвост вен инъекции в мышей с учетом установленных опухолей.
- Сбор проб крови через хвост вен кровоточит после 7 дней.
- Добавьте буфер lysis клетки красного каждого образца крови, а затем подготовить для проточной цитометрии, как описано в разделе 3. Анализ автомобилей T сохранение клеток в циркуляции подачей cytometry (рис. 2).
Примечание: Добавление подсчета бусины непосредственно перед цитометрии позволяет определять количество автомобилей Т-клеток на миллилитр крови. - Ходом болезни, как описано в шагах 5.1.5 - 5.1.8 (рис. 7).
Результаты
Для высокой эффективности трансдукции Т-клеток необходимых для получения свежих ретровирусные частицы. Transfection клеток линии Plat-E с pCL эко продюсер плазмиды и pMP71 плазмиды ретровируса приводит к секреции ретровирусные частицы в ячейку супернатант. Когда гена флуоресцентных маркеров, например mCherry, кодируется в ретровируса, успешно transfection может быть подтверждено микроскопии флуоресцирования (рис. 1). Вирус содержащих супернатант из transfected клеток Plat-E используется для передают Т-клеток, которые через 2 раундов спин fection на фибронектин фрагмент покрытием пластин. 4 дней после передачи через проточной цитометрии может определяться эффективность трансдукции. Успешно transduced клеток выразить маркер ген закодированы в ретровируса (рис. 2). Трансдукция эффективность варьируются от ~ 50-90% эффективности с первого поколения рецепторов к ~ 10-40% с автомобилем конструкции близко к антиретровирусным упаковки емкости. В то время как маркер экспрессии генов показывает успешной антиретровирусной трансдукции, крайне важно, чтобы показать функциональность автомобиля Т-клеток после взаимодействия с клетками что Экспресс целевой антигена на их поверхности. Целевой клеточных линий, чтобы выразить Люцифераза может использоваться в Люцифераза анализов для проверки степени клеток убивать клетки T автомобилей напрямую (рис. 3A). Релиз цитокинов эффекторных от автомобилей Т-клеток при сотрудничестве культуры с клеток-мишеней, определяется ELISA, может также использоваться в качестве косвенной мерой цитотоксичности клетки T автомобиля (рис. 3B и 3 C).
Т-клетки автомобиля производится в этот протокол может быть оценен в lymphoreplete мышей путем создания системного A20 лимфомы с дозы 100 мг/кг Циклофосфамид (вводят внутривенно), за 1 день до IV инъекции 5 x 105 A20 клеток (рис. 4). IP инъекции с люциферин и изображения захвата с помощью томографа биолюминесценции в естественных условиях может использоваться для мониторинга бремя опухоли, используя постоянное время ROI и воздействия всей (Рисунок 5A-C). Т-клетки автомобиля изменен для Экспресс Ил-12 способны ликвидации системных лимфомы с lymphodepleting предварительного кондиционирования, давая безрецидивной выживаемости в около 25% мышей (рис. 5 d). Lymphodepleting предварительной подготовки, достигнутые 5 гр TBI за 1 день до IV администрации автомобилей Т-клеток, значительно улучшает приживления (рис. 6). В этой модели первого поколения автомобилей Т-клетки способны ликвидации системных A20 лимфомы, обычно вызывающих болезни свободной выживание в 100% мышей (рис. 7).
Рисунок 1. Подтверждение успешного transfection клеток Plat Е. Transfected клеток плат-E с ретровирусной конструкции автомобилей и pMP71 и pcl Эко упаковка вектор плазмиды. Успешное трансфекции показано экспрессии гена флуоресцентные маркер mCherry. A) микроскопии светлые области, B) микроскопии флуоресцирования и C) объединенного изображения отображаются. Увеличение = 50 X. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 2. Определение эффективности электромеханической подачей cytometry. Проточной цитометрии используется для определения эффективности трансдукции клеток мыши T на 4 день пост трансдукции, используя зомби УФ жить/мертвых, mCherry, BV711 и BV785 для обнаружения живого, автомобиль построить, CD4 и CD8 клетки, соответственно. Представитель результаты A) Non преобразованы, B) mCherry.αmCD19.mCD3z и C) mCherry.αmCD19.mCD3z.mIL12 отображаются с стробирования 1) фуфайки 2) живой клетки 3) 4) и 5) Оценка mCherry позитивных клеток, выражая автомобиль CD4 и CD8. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
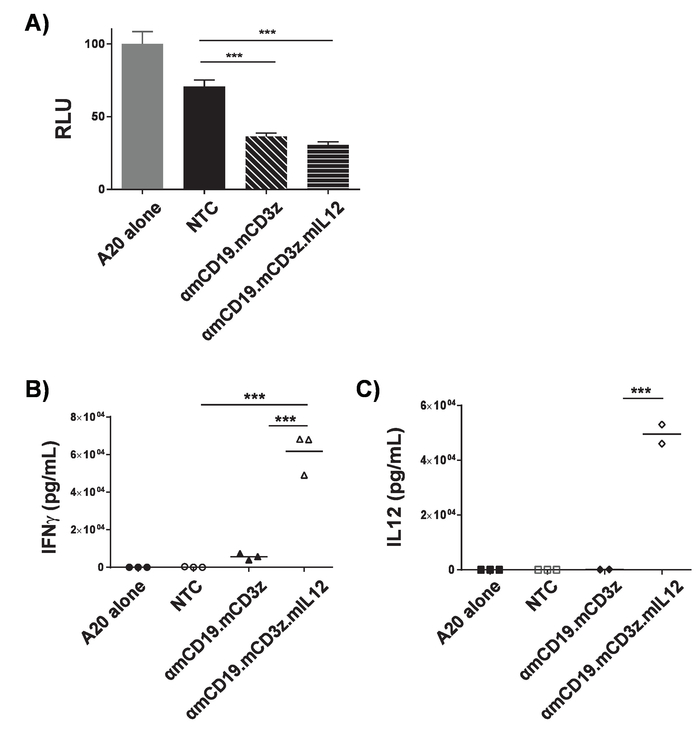
Рисунок 3. Проверка автомобилей Т-клеточной активности. ΑmCD19 автомобилей Т-клетки были совместно культивируемых с A20 лимфоидные клетки, чтобы выразить Люцифераза (1 х 104: 1 x 10-4) для 16 h в пластине U-дно 96-луночных. После совместного культуры клетки были гранулированных и была собрана супернатант. A) клетки были вновь приостановлено в PBS и luminometry была использована для оценки жизнеспособности клеток-мишеней. Супернатант от совместного культуры оценивали наличие IFNγ (B) и (C) Ил-12. Отношение автомобилей Т-клеток в клетки-мишени и продолжительность периода совместного культуры должны быть оптимизированы для каждого автомобиля и целевой линии клеток. PMA и ionomycin лечение может использоваться как позитивный элемент управления для подтверждения качества Т-клеток и их способность клеток реагировать. Планки погрешностей Показать SD. Статистический анализ проводился с помощью односторонней ANOVA. p < 0,001). Этот рисунок был изменен с17. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
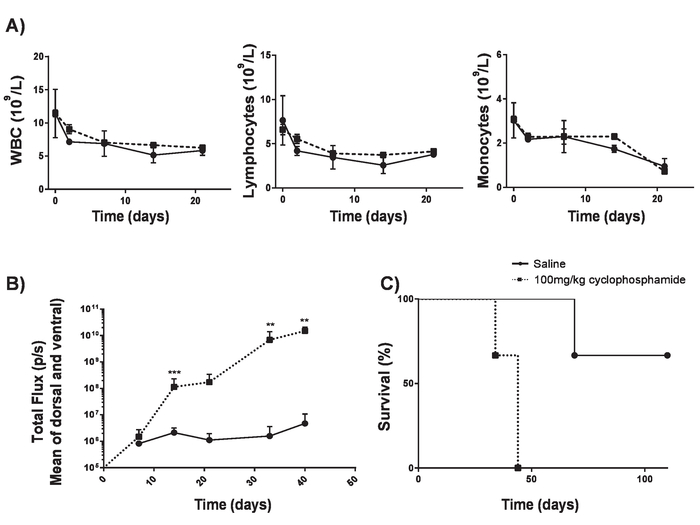
Рисунок 4. Создание A20 лимфомы без lymphodepletion. Циклофосфамид можно повысить эффективность лимфомы индукции не вызывая lymphodepletion. A) количество крови в 6-8-week-old мышей BALB/c после доставки IV циклофосфамид 100 мг/кг. Планки погрешностей Показать SD B) лимфомы бремя 6-8-week-old мышей BALB/c после IV доставка 100 мг/кг циклофосфамид или физиологического раствора в день -1 и IV Доставка 5 x 105 A20 клеток на день 0, измеряется с помощью люминометра. Выживание C) мышах в B). Планки погрешностей Показать SD. Статистический анализ проводился с помощью 2-полосная ANOVA. ** p < 0.01, *** p < 0,001). Этот показатель был изменен с Kueberuwa и др. 17. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
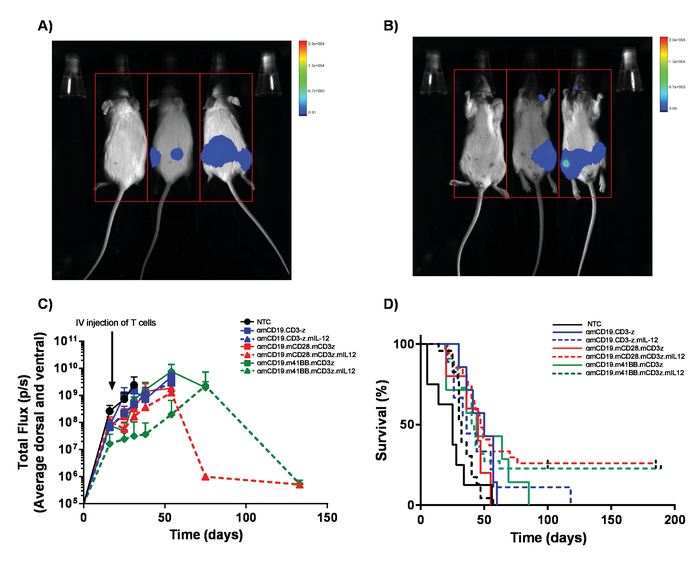
Рисунок 5. Наблюдение за лимфомы бремя и выживания. Мышей, принимая A20 лимфомы, выражая Люцифераза получают 100 мкл внутрибрюшинной инъекции (IP) 30 мг/мл люциферин и были образы с помощью биолюминесценции в естественных условиях , визуализации системы. A) мышей были воздействию за 1 мин на вентральной стороне и немедленно перевернул изображение спинной подобрать опухолевые массы по обе стороны от тела (B). C) представитель результаты бремени лимфомы мышей BALB/c, получение различной αmCD19 автомобилей Т-клетки без lymphodepletion. Планки погрешностей Показать SEM. D) выживаемость же мышей. Этот показатель был изменен с Kueberuwa и др. 17. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
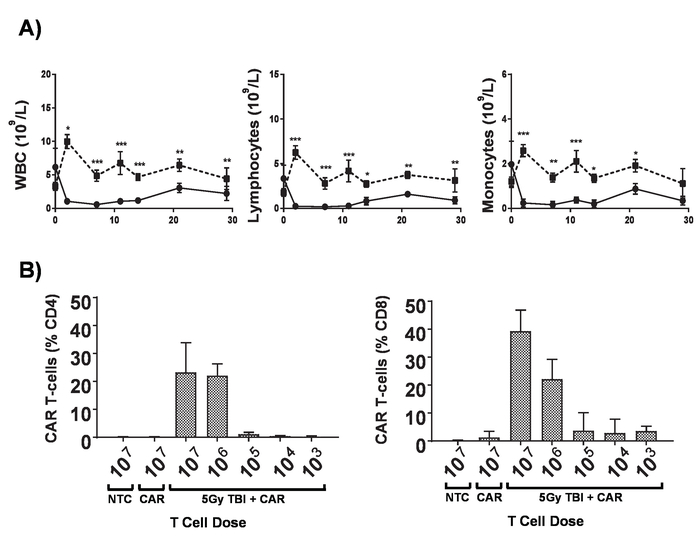
Рисунок 6. Эффекты lymphodepletion. A) количество крови в 6-8-week-old мышей BALB/c после получения 5 гр TBI на дозы 0,02 гр/мин; планки погрешностей Показать ур. Статистический анализ по двусторонней ANOVA. p < 0,05, ** p < 0.01, *** p < 0,001. B) CD8 и мониторинга CD4+ + автомобилей T клеток в периферической крови мышей подачей cytometry для администрации гена пост 7 дней mCherry маркер. Планки погрешностей Показать ур. Этот показатель был изменен с Kueberuwa и др. 17. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
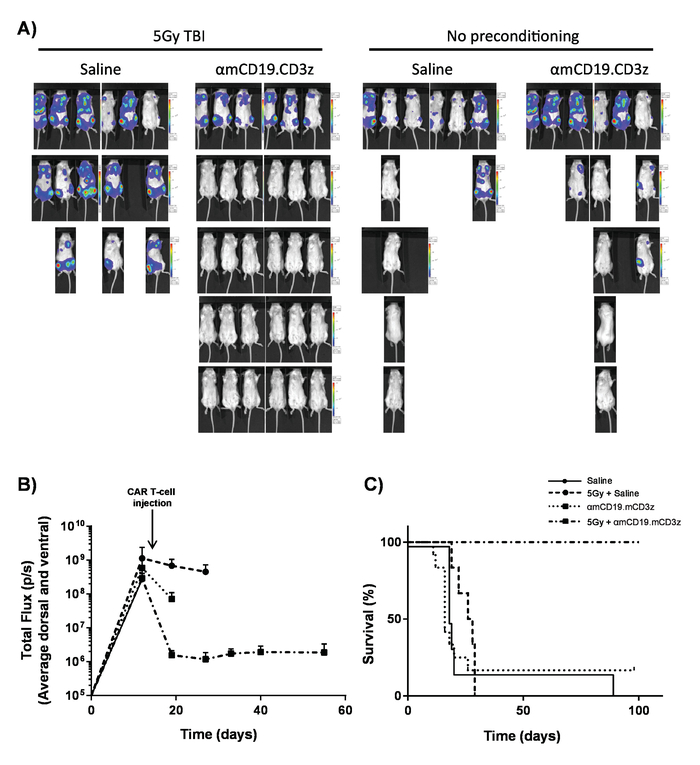
Рисунок 7. Активность клеток T автомобилей с предварительного кондиционирования lymphodepleting. Типичные результаты показаны эффект 5 гр TBI в день, предшествующий администрации автомобилей Т-клеток. A) изображений и (B) Дисплеи графические изображения мышей после 100 мкл внутрибрюшинной инъекции (IP) люциферин 30 мг/мл, используя биолюминесценции в естественных условиях , системы. Планки погрешностей Показать SEM. C) выживания же мышей. Эта цифра была модифицированных fromKueberuwa и др. 17. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Обсуждение
Мышь сингенных модели позволяют тестирование прогрессирования заболевания и терапии при сохранении неповрежденной иммунной системы. Это имеет первостепенное значение, когда дело доходит до лечения, которые взаимодействуют с иммунной системой и в частности для иммунотерапевтических агентов.
Протокол, описанные здесь имеет два критических рабочие потоки, первый генетического изменения мыши Т-клеток выразить автомобили. Это требует 7 дней от начала до проверки трансдукции. Наряду с производством автомобилей Т-клеток является создание системных лимфомы мышей. Следует не производства клеток T автомобиль, или качества жизни недостаточно, существует правило не достаточно времени, чтобы производить замену клетки до мышей поддаваться лимфомы. Поэтому важно, что исследователи, используя эти модели точно выполнять исследования прогрессии опухоли дозирования и болезни для того, чтобы успешно время производства автомобилей Т-клеток для терапевтической администрации.
Типичные причины низкой эффективности трансдукции Т-клеток включает эффективность бедных трансфекции продюсер клеток, как правило, вызванных плохой плазмида чистоты или неточное определение рН трансфекции СМИ. Рекомендуется проверить эффективность transfection клетки продюсер прежде чем с полным Протоколом как бедных трансфекции будет ограничивать эффективность трансдукции Т-клеток. Рекомбинантный человеческий фибронектин фрагменты могут быть собраны и хранятся при температуре-20 ° C для повторного использования, однако, несколько замораживания оттепели результат снижение электромеханической эффективности. Свифт обработки мыши селезенки после того, как коллекция также имеет важное значение для получения высокой урожайности жизнеспособных Т-клеток.
Следует отметить, что протокол, описанные здесь использует ячейки A20, выражая Люцифераза. Это является предпочтительным, как она обеспечивает возможность измерения системного опухоли бремя у Вообразимый биолюминесценции. Однако при наличии функциональной иммунной системы, ответы на Люцифераза может исказить результаты. Ранее мы проверили иммунной реакции живых мышей маркер трансгенов17. Это ключ к повторить основные эксперименты с использованием A20 клетки бесплатно трансгенов для проверки, что они не играют значительную роль в ликвидации опухоли клетки иммунной системы.
Хотя клинические агентов может быть только используемые в vivo иммунный дефицит мышей, использование автомобилей Т-клеток мыши против раковых клеток мыши позволяет нам оценить вклад иммунной системы в терапевтической эффективности или болезнь прогрессии. Этот протокол может использоваться для предварительно клинической оценки Автомобили B-клеточной лимфомы или другие автомобили с дополнительными изменениями, например секрецию Ил-12 как описано здесь. Необходимо отметить, что хотя взаимосвязь между иммунные клетки может быть оценен в сингенных мыши модели, они могут не напомнить точно взаимодействия людей в естественных условиях. Особое внимание, человека и мыши автомобили будут варьироваться в структуре, которая может иметь последствия вниз по течению; оптимальные условия активации и клетки культуры для роста клеток T являются различные20, ткани распределение целевых антигена выражение может варьироваться между людьми и мышей и опытных токсичности может быть радикально отличаются. Поэтому важно использовать ex vivo и культивированная модели для подтверждения результатов.
В целом сингенных lymphodepleted и lymphoreplete модель лимфомы пилки больных с и без предварительного химиотерапии/радиотерапии. Это обеспечивает модель системы, в которой для имитации клинические параметры, чтобы разрешить тестирование ряда терапевтических стратегий, которые будут иметь важное значение с ближайшие волна новых агентов иммунной терапии.
С использованием предварительного кондиционирования следует отметить, что все мыши обычно ясно лимфомы. С до 90% полный ответ ставки в организме человека, это представитель. Однако, проблемы для автомобилей CD19 Т-клеточной терапии будет зависеть от предотвращения высокая частота рецидивов отметил, что зачастую CD19. Рецидивы не наблюдались в этой модели до и часто за 100 дней. Модификации для имитации рецидивы, видели в клинике может помочь с будущих задач CD19 автомобилей Т-клеточной терапии.
Раскрытие информации
Дэвид Гилхэм работает на Celyad, который участвует в производстве автомобилей Т-клеток. Остальные авторы имеют ничего не разглашать.
Благодарности
Мы хотели бы поблагодарить Bloodwise за финансирование этого исследования (Грант 13031) и CRUK Манчестер биологических ресурсов блок, изображений и цитометрии и молекулярной биологии основные средства для поддержки этой работы.
Материалы
| Name | Company | Catalog Number | Comments |
| 0.2 µm syringe filter | Appleton Woods | FC121 | |
| 0.45 µm syringe filter | Appleton Woods | FC122 | |
| 1.5ml pestle and microtube | VWR | 431-0098 | |
| 100X penicillin-streptomycin-glutamine (PSG) | Gibco | 10378016 | |
| 2-Mercaptoethanol (50 mM) | Gibco | 31350-010 | |
| Blasticidine S hydrochloride | Sigma- Aldrich | 15205 | |
| Bottle Top Filter (0.2 µm) | Scientific Laboratory Supplies | FIL8192 | |
| Brilliant Violet 711 anti-mouse CD8a Antibody | BioLegend | 100759 | 1 in 100 staining dilution. Clone 53-6.7 |
| Brilliant Violet 785 anti-mouse CD4 Antibody | BioLegend | 100552 | 1 in 100 staining dilution. Clone RM4-5 |
| Calcium chloride dihydrate | Sigma- Aldrich | C7902 | |
| Cell counting beads – CountBright absolute counting beads | Molecular Probes | C36950 | |
| Cell Strainer 100μm | VWR | 734-0004 | |
| Cyclophosphamide Monohydrate | Merck | 239785-1GM | |
| Dulbecco’s Modified Eagle medium (DMEM) - High Glucose | Sigma Aldrich | D6546 | |
| Dynabeads | Gibco | 11131D | |
| Ficoll Paque Plus | GE Healthcare | GE17-1440-03 | Sold by Sigma- Aldrich |
| Flow cytometer - LSR Fortessa x20 | BD Biosciences | 658222R1 | |
| Foetal Bovine Serum | Gibco | 10270 | |
| Haemacytometer | Appleton Woods | HC001 | |
| HEPES solution | Sigma- Aldrich | H0887 | |
| IL-12 p70 Mouse Uncoated ELISA Kit | Invitrogen | 88-7121-76 | |
| IL2, Proleukin | Novartis | PL 00101/0936 | |
| in vivo bioluminescence imaging system – in vivo xtreme II imaging system | Bruker | T149094 | |
| Ionomycin Calcium Salt | Sigma- Aldrich | I0634 | |
| Live/dead stain - Zombie Violet Fixable Viability Kit | BioLegend | 423114 | 1 in 100 staining dilution |
| Luminometer - Lumistart Omega | BMG Labtech | 415-301 | |
| Murine IFN-γ ELISA kit | Diaclone | 861.050.010 | |
| Paraformaldehyde | Sigma- Aldrich | 16005 | |
| pCL-Eco | Novus Biologicals | NBP229540 | |
| Phorbol 12-myristate 13-acetate (PMA) | Sigma- Aldrich | P8139 | |
| Platinum E cell line | Cell Biolabs | RV-101 | (RRID:CVCL_B488) |
| Purified NA/LE Hamster Anti-Mouse CD28 | BD Biosciences | 553294 | Clone 37.51 |
| Purified NA/LE Hamster Anti-Mouse CD3ε | BD Biosciences | 553057 | Clone 145-2C11 |
| Purified Rat Anti-Mouse CD16/CD32 (Mouse BD Fc Block) | BD Biosciences | 553142 | 1 in 100 staining dilution. Clone 2.4G2 |
| Puromycin Dihydrochloride | Sigma- Aldrich | P8833 | |
| Recombinant human fibronectin fragment - RetroNectin Reagent | TaKaRa | T100B | |
| Recombinant Mouse IL-7 (carrier-free) | BioLegend | 577806 | |
| Red cell lysis buffer | eBioscience | 004-4333-57 | |
| RPMI 1640 Medium | Lonza | BE12-167F | |
| Trypsin - EDTA solution | Sigma- Aldrich | T3924 | |
| XenoLight D-Luciferin | Perkin Elmer | 122799 |
Ссылки
- . Food and Drugs Administration Biologics Licence Application Approval letter Available from: https://www.fda.gov/downloads/BiologicsBloodVaccines/CellularGeneTherapyProducts/ApprovedProducts/UCM574106.pdf (2017)
- . Food and Drugs Administration Biologics Licence Application Approval letter Available from: https://www.fda.gov/downloads/biologicsbloodvaccines/cellulargenetherapyproducts/approvedproducts/ucm581259.pdf (2017)
- Liu, Y., Zeng, G. Cancer and Innate Immune System Interactions: Translational Potentials for Cancer Immunotherapy. Journal of Immunotherapy. 35 (4), 299-308 (2012).
- Janssen, L. M. E., Ramsay, E. E., Logsdon, C. D., Overwijk, W. W. The immune system in cancer metastasis: friend or foe. Journal for ImmunoTherapy of Cancer. 5 (1), 79 (2017).
- Pandya, P. H., Murray, M. E., Pollok, K. E., Renbarger, J. L. The Immune System in Cancer Pathogenesis: Potential Therapeutic Approaches. Journal of Immunology Research. 2016, 13 (2016).
- Vinay, D. S., et al. Immune evasion in cancer: Mechanistic basis and therapeutic strategies. Seminars in Cancer Biology. 35, S185-S198 (2015).
- Gajewski, T. F., Meng, Y., Harlin, H. Immune Suppression in the Tumor Microenvironment. Journal of Immunotherapy. 29 (3), 233-240 (2006).
- Munn, D. H., Bronte, V. Immune suppressive mechanisms in the tumor microenvironment. Current opinion in immunology. 39, 1-6 (2016).
- Vanderlugt, C. L., Miller, S. D. Epitope spreading in immune-mediated diseases: implications for immunotherapy. Nature Reviews Immunology. 2, 85 (2002).
- Hardwick, N., Chain, B. Epitope spreading contributes to effective immunotherapy in metastatic melanoma patients. Immunotherapy. 3 (6), 731-733 (2011).
- Makkouk, A., Weiner, G. Cancer Immunotherapy and Breaking Immune Tolerance-New Approaches to an Old Challenge. Cancer research. 75 (1), 5-10 (2015).
- Jackson, S. R., Yuan, J., Teague, R. M. Targeting CD8(+) T-cell tolerance for cancer immunotherapy. Immunotherapy. 6 (7), 833-852 (2014).
- Brentjens, R. J., et al. Lymphodepletion and tumor burden govern clinical responses in patients with B-cell malignancies treated with autologous, CD19-targeted T cells. Journal of Clinical Oncology. 29 (15_suppl), 2534 (2011).
- Brentjens, R. J., et al. Safety and persistence of adoptively transferred autologous CD19-targeted T cells in patients with relapsed or chemotherapy refractory B-cell leukemias. Blood. 118 (18), 4817 (2011).
- Hay, K. A., et al. Kinetics and Biomarkers of Severe Cytokine Release Syndrome after CD19 Chimeric Antigen Receptor-modified T Cell Therapy. Blood. 130, 2295-2306 (2017).
- Zhang, T., et al. Efficiency of CD19 chimeric antigen receptor-modified T cells for treatment of B cell malignancies in phase I clinical trials: a meta-analysis. Oncotarget. 6 (32), 33961-33971 (2015).
- Kueberuwa, G., Kalaitsidou, M., Cheadle, E., Hawkins, R. E., Gilham, D. E. CD19 CAR T Cells Expressing IL-12 Eradicate Lymphoma in Fully Lymphoreplete Mice through Induction of Host Immunity. Molecular Therapy - Oncolytics. 8, 41-51 (2018).
- Engels, B., et al. Retroviral vectors for high-level transgene expression in T lymphocytes. Human Gene Therapy. 14 (12), 1155-1168 (2003).
- Parkinson, C. M., et al. Diagnostic Necropsy and Selected Tissue and Sample Collection in Rats and Mice. Journal of Visualized Experiments: JoVE. (54), e2966 (2011).
- Kueberuwa, G., et al. CCR7(+) selected gene-modified T cells maintain a central memory phenotype and display enhanced persistence in peripheral blood in vivo. Journal for Immunotherapy of Cancer. 5, 14 (2017).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены