Method Article
Высоким разрешением узорной биопленки осаждения с pDawn-Ag43
В этой статье
Резюме
Мы демонстрируем метод для депонирования бактериальных биопленок Escherichia coli в произвольные пространственные закономерности с высоким разрешением с помощью оптических стимуляции генетически закодированный адгезию поверхности конструкции.
Аннотация
Пространственная структура и кучность играют важную роль в бактериальные биопленки. Здесь мы показываем, доступный метод для культивирования кишечной биопленки в произвольных пространственных моделей с высоким пространственным разрешением. Техника использует конструкцию генетически закодированный optogenetic — pDawn-Ag43 — это пары биопленки в E. coli оптических стимуляции, синий свет. Мы подробно процесс преобразования кишечной палочки с pDawn-Ag43, подготовка необходимых оптических set-up и протокол для культивирования узорной биоплёнки с помощью pDawn-Ag43 бактерий. Используя этот протокол, можно узорной биоплёнки с пространственным разрешением ниже 25 мкм на различных поверхностях и сред, включая замкнутые камеры, не требуя микротехнологий, чистота-услуги или подготовка поверхности. Метод является удобным и подходящим для использования в приложениях, которые исследовать эффект биопленки структуры, обеспечивая настраиваемый контроль над биопленки кучность. Более широком смысле он также имеет потенциальные применения биоматериалов, образования и био Арт.
Введение
Биоплёнки являются придает поверхности сообществ микробов и хорошо известны за их сильные структуры функция сцепления. Пространственной геометрии и кучность биоплёнки играют важную роль в общей функции сообщества (и наоборот)1. Малая длина шкалы участвует в структуре биопленки — порядка десятков мкм2— сделать настраиваемый и удобный контроль над биопленки, кучность является сложной проблемой. Здесь мы показываем, протокол, который позволяет для биоплёнки быть точно рисунком в произвольной геометрии, основанный на оптические освещения.
Представленные здесь протокол использует pDawn-Ag433, optogenetic конструкцию, что пары биопленки бактерий E. coli оптическое освещение, ведя выражение Ag43 (принимает ген, ответственный за поверхности сцепления и биопленки формирование) под контролем pDawn4 (транскрипционный анализ регулятор, контролируемых оптическое освещение). Этот метод удобно использовать и может биоплёнки шаблон на различные поверхности средах, в том числе закрытых (прозрачный) культуры камер. По сравнению с существующими методами осаждения ячейки, например осаждения на основе капли5 или поверхности prepatterning/лечения6, pDawn-Ag43 не требует микротехнологий или чистый номер Услуги и не требуют материалов, помимо тех, которые доступно для типичного микробиологической лаборатории. Она способна узор с пространственным разрешением ниже 25 мкм, приближается к пространственные размеры microcolonies естественно существующих биоплёнки2. В целом этот метод обеспечивает возможность манипулировать биопленки структура, которая затем открывает много возможностей для изучения микробиоценоза в бактериальных сообществ7. Кроме того узорные биоплёнки может предоставить удобную платформу для инженер полезные биоматериалов8,9. В этой статье мы обсуждаем основной протокол, необходимые для структурирования биоплёнки с помощью pDawn-Ag43 и устранения потенциальных изменений и устранения неполадок, связанных с методом.
протокол
1. Подготовка pDawn-Ag43 штаммов бактерий
- PDawn-Ag43 Превратите штамм E. coli интерес (рис. 1).
- Расти штамм клонирования, хостинг плазмида pDawn-Ag43 (доступный из репозитория плазмида) путем прививки штамм в LB отвара дополнена 50 мкг/мл спектиномицин (LB + спецификации) в трубу культуры (ночевка в тряску инкубатор на ~ 250 об/мин, 37 ° C). Затем используйте набор алкалический урожай плазмида очищенный pDawn-Ag4310.
- Выберите штамм E. coli интерес к быть сделанный по образцу. До сих пор было проверено pDawn-Ag43 для работы в MG16553 и BW25113.
- Использовать протокол для создания компетентных (например, химически компетентным11 или12electrocompetent) запасов выбранного штамм E. coli (например, MG1655).
- Трансформировать плазмида pDawn-Ag43 в компетентные бактерий11,12, следуют восстановления 1 h и пластины на LB + плиты спектра агара. Разрешить колоний расти на ночь при 37 ° C.
- Магазин pDawn-Ag43 преобразован штаммов.
- Прививок одной колонии pDawn-Ag43 от фунтов + спец плита агара в LB + спец бульон в трубке культуры и расти в тряску инкубатора (на ~ 250 об/мин, 37 ° C) для экспоненциальной фазе (OD600 ~0.4 - 0,8).
- Подготовьте складе для хранения штамм pDawn-Ag43 превращается в-80 ° C долгосрочный, смешивая 1 мл культуры с 1 мл 50% стерильный глицерина в крио трубка для получения 25% глицерина морозильник складе. Храните это в морозильной камере-80 ° С.
- Если дополнительные плазмид (например, флуоресцентный репортер плазмид) должны быть преобразованы, создание компетентных клеток11,12 от pDawn-Ag43 превращается деформации и повторите процесс трансформации11 , 12 для дополнительных плазмид, по мере необходимости.
Примечание: Если с помощью электропорации8, возможна cotransform несколько плазмидов (включая pDawn-Ag43) одновременно; Однако одновременное преобразование не рекомендуется использование методов химического преобразования, как большой размер (> 10 КБ) pDawn-Ag43 означает, что уменьшается эффективность преобразования.
2. Подготовка Set-up оптический проектор для освещения бактерий
- Получения бактериальной инкубатор с непрозрачными стенами и отверстие для передачи кабели, портативный проектор, способных установки и функционирования внутри бактериальной инкубатора, и ноутбук оснащен программным обеспечением для презентации проекции (см. таблицы Материалы). При выборе проектора и инкубатор, убедитесь, что это меньше, чем внутренняя высота инкубатора расстояние минимальный фокусировки проектора.
- Расположить проектор внутри инкубатора внизу, с апертурой указывая прямо вверх, на потолок, где находится камера культуры биопленки прилагается (рис. 2).
- Исправление, проектор в месте, создав set-up с оптическим макет базового подключен к вертикальной пост, в свою очередь подключены к горизонтальной пост какие винты в проектор (рис. 2). Обратите внимание, что эта настройка может быть изменен в зависимости от проектор/доступных частей. В конечном счете ключевым требованием является, что проектор прочно фиксируется в нижней части инкубатора, с диафрагмой, указывая вверх.
- Подключите ноутбук через кабель дисплея (например, HDMI) к проектору внутри инкубатора.
- Если поверхности — особенно потолок — внутренних дел инкубатора являются Светоотражающий (например, полированной поверхности металла), накрыть их темные матовые поверхности, чтобы свести к минимуму размышления.
- Используйте ленту для присоединения пустой «Макетные» культуры блюдо к потолку инкубатора. Обратите внимание, что, как с проектором, есть несколько приемлемых способов приложить культуры блюдо; Убедитесь, что поверхность прозрачной нижней палаты культуры, где происходит освещение, не покрыта.
- Отрегулируйте фокус на проекторе, поворачивая ручки фокусировки, так что плоскости фокусировки совпадает с нижней поверхностью биопленки культуры блюдо (например, хорошо пластины) прикреплены к потолку инкубатора (рис. 2). Проектор должен осветить резкий, не размытые изображения на нижней части культуры блюдо. Удалите «Макетные» культуры блюдо после того, как проекция была оптимизирована.
- С помощью программного обеспечения ноутбук, прямые проектор для освещения полное поле зрения с максимальной синей подсветкой (например, RGB = [0, 0, 255]), представляя полный синий слайд.
- Измерьте интенсивность подсветки проектор, используя Измеритель оптической мощности, поместив головку фотоприемника в инкубатор потолок и чтения интенсивности на соответствующей мощности метр калиброван легкие волны 460 Нм. Следуйте инструкциям по подключению и калибровке Фотоэлемент для конкретных ваттметр используется.
- Уменьшения освещенности (например, выключить свет номер, или разместить инкубатор вдали от источников света) насколько это возможно, до принятия измерения интенсивности освещения.
- Регулировать интенсивность освещения, с помощью регулируемой нейтральной плотности фильтра размещены на проектор диафрагмы. Поверните фильтр для регулировки освещенности измеряется измеритель мощности, до тех пор, пока интенсивность освещения в центре региона прогнозируемых синий свет читает 50 мкВт/см2.
Примечание: Хотя это можно регулировать интенсивность освещения с помощью нижней голубой RGB-значений на конце программного обеспечения, используя фильтр, в то время как максимальное значение синий RGB имеет преимущество максимального оптического контраст системы между освещенной vs. темные области. - Рисовать произвольные шаблоны, используя программное обеспечение презентации/проектор на ноутбуке и отображать эти шаблоны на потолке инкубатора, с использованием проектора.
Примечание: Биопленки формирование регионов следует использовать с максимальной синей подсветкой (например, RGB = [0, 0, 255]), не образуя биопленки регионов с без подсветки (например, RGB = [0, 0, 0]).
3. культивирование узорной биопленки
- До освещения Подготовьте pDawn-Ag43 бактерий, начиная от глицерина морозильник акций, таким образом, чтобы они надежно индуцированной в конце фазы экспоненциального роста для освещения (рис. 3A).
- Полоска из глицерина запасов на LB + плиты спектра агара штамм pDawn-Ag43. Разрешить колоний расти на ночь (37 ° C).
Примечание: Здесь до освещения культуры шаг, убедитесь, клетки остаться в темноте как можно больше — короткие периоды на окружающего освещения (например, для subdilution) являются приемлемыми. - Прививок колонии pDawn-Ag43 бактерий из агар пластины в LB + спец бульон и расти культура на ночь для стационарной фазы (в тряску инкубатор ~ 250 об/мин 37 ° C, ~ 16 ч).
- Subdilute культура в соотношении 1:1,000 с LB + спец бульон (например, добавить 1 мкл ночь культуры в 1 мл свежего LB + спецификации).
- Разрешить subdiluted культуры расти до конца экспоненциального/начале стационарной фазы (ОД ~ 1.0, ~ 6 h в тряску инкубатор на ~ 250 об/мин, 37 ° C).
- Время ожидания для культуры расти, подготовить M63 СМИ с 1 x M63 соли, 1 мм MgSO4, 0,2% раствор глюкозы, 0,1% casamino кислот и спектиномицину 50 мкг/мл в воде (обеспечение составные части стерильны).
- Subdilute конце экспоненциальной фазе культуры в соотношении 1: 100 с M63 СМИ дополнена 50 мкг/мл спектиномицину. Затем ввести разрежения в биопленки культуры блюдо (например, Пипетка разреженных образца в хорошо плиту).
Примечание: Объемы, необходимые для этого масштаба 1: 100 subdilution зависит от культуры блюдо используется (например, при использовании полистирола 6-Ну хорошо плиты [не ткани Культура лечение], один образец потребует добавления 20 мкл культуры 2 мл M63 + спецификации, как Стандартный хорошо объем 6-ну плиты составляет ~ 2 мл).
- Полоска из глицерина запасов на LB + плиты спектра агара штамм pDawn-Ag43. Разрешить колоний расти на ночь (37 ° C).
- Поскольку образцы теперь готовы для освещения, лента культуры блюдо к потолку инкубатора, обеспечивая что поверхность в нижней части блюдо является прозрачным для освещения снизу проектора.
Примечание: Это важно для обеспечения того, чтобы потолок инкубатора не отражающей способностью, чтобы свести к минимуму бродячих освещения. Бродячих освещения можно также уменьшить, используя черный стенками пластин как культура блюда, хотя это не является строго необходимым — если с помощью таких плит, обеспечить нижней поверхности является прозрачным. - Разрешить биоплёнки к культуре в инкубаторе на ночь (16 h с не встряхивания, при 37 ° C). Обратите внимание, что некоторые Проекторы становятся менее надежными при более высоких температурах. Если это так, культуры при более низких температурах (например, 30 ° C), имея в виду, что время инкубации может потребоваться увеличить, в зависимости от штамма кишечной палочки .
4. изображений узорной биопленки
- После ночи роста образцов биопленки удалите культуры блюдо из инкубатора. Блюдо будет иметь биопленки бактерий, прилагается к его нижней поверхности, где он осветил, а также планктонных бактерий, диспергированных в жидких средах выше.
- Выбросите планктонных клетки путем удаления жидких сред из культуры блюдо (например, от нежно аспирационных с пипеткой).
- Промойте образца 2 x с раствором фосфат амортизированное saline (PBS), чтобы удалить оставшиеся планктонных клеток (рис. 3B), осторожно дозирование в PBS, следуют аспирации.
- Если клетки дневно меткой, непосредственно изображения образцов с помощью флуоресцентной микроскопии13 (например, поля13, 3-D конфокальный14, и т.д.).
Примечание: Флуоресцентные биоплёнки могут также сохраняться с помощью ЖСС монтажа средних. Нанесите одну каплю монтажа СМИ образец биопленки, накрыть стеклянной coverslip, стараясь не захватить любые пузыри под и позволить ему затвердеть на ночь перед изображений. - Если используются бактериальные клетки не помечены дневно, примените Фиолетовый Кристалл пятно техника15 (рис. 3B) для повышения контраста биопленки до изображений.
5. Протокол изменений/альтернативы
- Растут pDawn-Ag43 бактерий на различных поверхностях.
- Стекла или поли диметил силоксановые (PDMS) купоны (например, coverslips или тонкой полоски PDMS) в хорошо пластины перед добавлением бактериальной образца/освещение и следить за тот же протокол как раньше для модели pDawn-ag43 биопленки на стекле и PDMS.
- Растут pDawn-Ag43 бактерий внутри культуры транспарентного, замкнутые камеры.
- Создания плесени палаты культуры для PDMS.
- Основные культуры камеры генерировать формы Подключив жесткий, Прямоугольные призмы к плоской поверхности (призму станет полости в PDMS, который служит в качестве палаты культуры после литые формы). Обратите внимание, что более сложные формы палаты культуры могут быть изготовлены с помощью мягкой литографии16.
- Литой PDMS полости, наливая PDMS в плесень и позволяя его вылечить (протокол подробный мягкой литографии, см. в JoVE на науки образования базы данных16).
- После отверждения, обрезать любой избыток PDMS, punch впускных/выпускных каналов в камеру полости/культура и облигаций полости на плоской поверхности (например, стекло/Полистирол) с усилием нажать PDMS на плоскую поверхность, оставляя полости между поверхностью и PDMS потолок в зале культуры биопленки.
Примечание: Можно также использовать более постоянного связывания на основе плазменной обработки16 , но затем фишки не будет повторно. - Следуйте протоколу культуры, как прежде, используя шприц с тупым кончик иглы (вместо пипетки) ввести бактериальных образца в культуре камеры/полоскания с PBS буфера (рис. 3 c).
- Если временно кабального полости, используйте только отрицательное давление тянуть жидкости в сутки камеры, обеспечить что полости не стали несвязанных от подстилающей поверхности стекла/полистирол.
- Создания плесени палаты культуры для PDMS.
- Растут pDawn-Ag43 бактерий с помощью фильм фотошаблонов для структурированного освещения.
- Дизайн-шаблон биопленки, с использованием САПР совместимы со службой печати принтер photomask фильм. Photomask фильм дизайн должны быть ясными в регионах, где биопленки предназначен для печати и черный/непрозрачный других. Когда заполните, отправьте файл photomask обслуживание принтера/печати и ждать возвращения физического photomask.
- Поручить проектор для освещения полное поле зрения с максимальной синей подсветкой (например, RGB = [0, 0, 255]) с помощью программного обеспечения ноутбук.
- Вырежьте из региона интерес со стороны крупных photomask фильм и ленты, он прямо к нижней части биопленки культуры блюдо перед представляя бактериальных образца для ночного освещения (рис. 3D). Культура биоплёнки как раньше и удалить photomask после культивирования, до изображений.
Результаты
Как показано на рисунке 4A, pDawn-Ag43 бактерии были использованы для создания биоплёнки узорной в хорошо плит с проектор освещения (проектор был установлен для освещения шаблон горошек), образы через brightfield микроскопии с кристаллом фиолетовые пятна контрастного вещества, и микроскопии флуоресцирования, с использованием красного флуоресцентный белка выражая бактерий. Флуоресцентный биопленки образцы можно также образы с помощью конфокальной микроскопии14 для получения изображения биопленки в 3-D (рис. 4В). В рисунке 4 cмы иллюстрируем разрешением патронирования можно с помощью фильм фотошаблонов для узорной освещения в образце биопленки. Наконец, в рисунке 4 d и 4E, мы показываем примеры кучность на стекла и PDMS поверхностей, а также закрытых камерах PDMS культуры — они иллюстрируют различные типы сред, где может применяться кучность pDawn-Ag43.
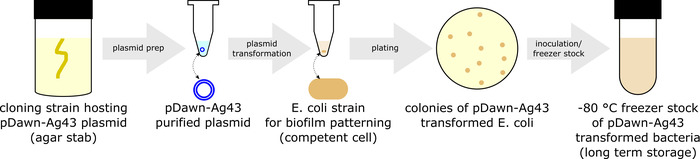
Рисунок 1: подготовка pDawn-Ag43 бактерий (протокол раздел 1). Подготовка pDawn-Ag43 бактерий, способных света регулируемых биопленки включает очистки pDawn-Ag43 плазмиду с хоста клонирование штамм, превращая его в штамм E. coli интереса и создание фондовой бактериальных морозильник для долгосрочного хранения. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
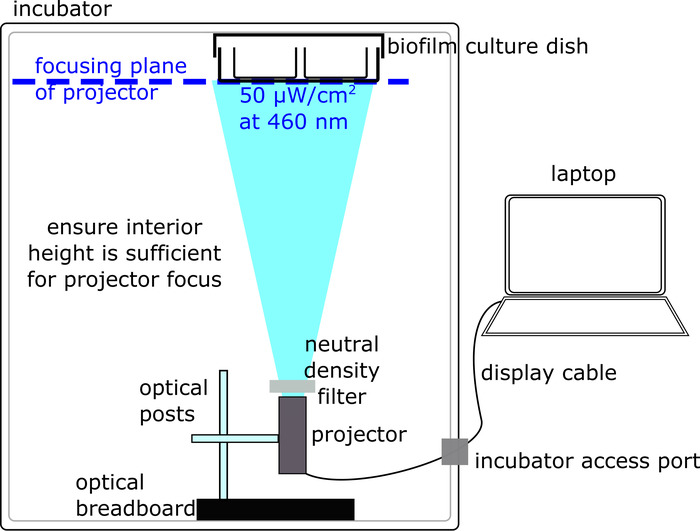
Рисунок 2: подготовка оптический настройки для освещения образца биопленки (протокол раздел 2). Оптических set-up расположен внутри бактериальной инкубатора и состоит из компьютер подключен проектор, освещающая образец биопленки. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
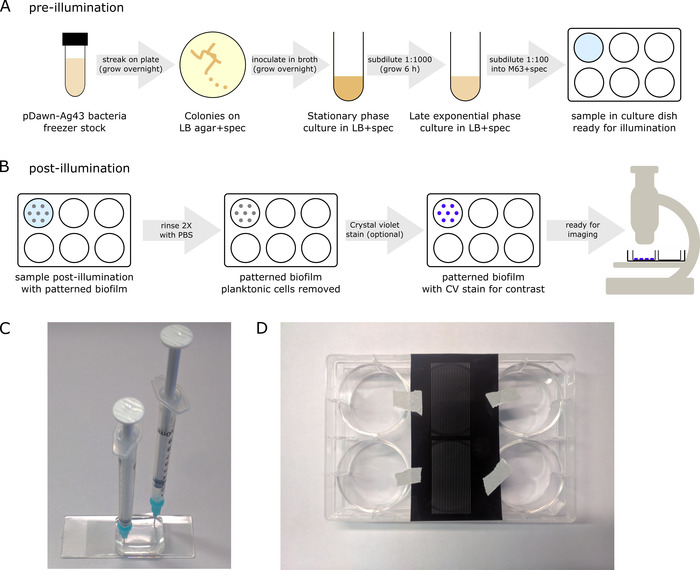
Рисунок 3: Культура протокол для структурирования биоплёнки (протокол раздел 3). (A) до их освещения, pDawn-Ag43 бактерии готовят до кучность таким образом, что они надежно наведены на этапе надлежащего роста. (B) после того, как ночь освещается рост, узорные биофильмов будет присутствовать в нижней части культуры блюдо, наряду с планктонных клетки в жидких средах, и после некоторых дальнейшей обработки, биопленки готова к визуализации. (C) как альтернатива хорошо пластины, биопленки можно культивировали в закрытых культуры камер как литьевые полости PDMS. В этом случае шприцы, прилагается к тупым кончик иглы может использоваться для внедрения образца и промойте жидкости из камеры. (D) как альтернатива шаблонов на основе проектор освещения, шаблоны могут создаваться лентой фильм фотошаблонов непосредственно к нижней палаты культуры биопленки. В этом случае следует настроить проектора загорается синий свет через полное поле. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 4: представитель результаты биоплёнки узором, с помощью pDawn-Ag43. Все результаты были получены с помощью штамм E. coli MG1655 узла. (A) pDawn-Ag43 бактерии были использованы для создания биоплёнки узорной в хорошо плит с проектор освещения (проектор был установлен для освещения шаблон горошек), образы через brightfield микроскопии с Фиолетовый Кристалл пятно как контрастное вещество и микроскопии флуоресцирования, с использованием красного флуоресцентный белка выражая бактерий. (B) флуоресцентных биопленки образцы отражаются с помощью конфокальной микроскопии для получения объемного изображения биопленки. (C) с высоким разрешением биопленки можно узорной с фильма фотошаблонов для узорной освещения в образце биопленки. (D) биопленки можно узором на поверхности PDMS и стекла. Биоплёнки (E) можно узором в закрытых культуры камер. Эта цифра была адаптирована из предыдущей работы3. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
| Проблема | Возможные причины/решения |
| Tranforming pDawn-Ag43 в хост-штамм - нет колонии | Низкая концентрация плазмида - проверить плазмида концентрация на спектрометре. Типичный алкалический pDawn-Ag43 должна принести по крайней мере 100 нг/мкл; Используйте до 10-100 нг для преобразования |
| Проверка/римейк сведущие клетки: сведущие клетки должны иметь эффективность преобразования по крайней мере 10 ^ 6 кое/мкг, проверяются с помощью стандартного плазмида например pUC19 - если нет, римейк сведущие клетки | |
| Неправильно (уровень) антибиотик на табличке агар LB - не забудьте использовать 50 мкг/мл спектиномицин для выбора | |
| Проектор освещения превращает off / несовместимыми на ночь | Отключение проблемных программного обеспечения таких как: автоматическое обновление программного обеспечения/OS в ночь, ночь время синий свет фильтр |
| Проектор может перегрев - набор инкубатор для низкой температуры, а проектор включен (например 30 ° C вместо 37 ° C) - Примечание проектор как источник тепла может перегреться инкубатор после застывания | |
| Удалите ненужные источники влажности из инкубатора, как они могут повлиять на проектор-Электроника | |
| No/низкий уровень биопленки формируется после ночного освещения, рост не планктонных клетки либо (т.е. жидкость ясно) | Антибиотик неправильно (уровень) - не забудьте использовать 50 мкг/мл спектиномицин |
| Проверьте, что все должным образом добавляется M63 рецепт | |
| No/низкий уровень биопленки формируется после ночного освещения, только планктонные клетки (т.е. жидкость мутная) | Проверьте свет уровень, проектор должен осветительные синий свет на 50 мкВт/см ^ 2 в 460 Нм длины волны |
| Попробуйте позволить бактерии растут на короткий/длительный срок после 1: 1000 фунтов subdilution шаг перед добавлением M63 | |
| Restreak бактерий на табличке LB, начать с свежие колонии для создания культуры ночи стационарной фазы | |
| Обеспечить проектор работает последовательно на ночь - см. выше пункт | |
| Нечетких биопленки шаблоны, высокий уровень фонового шума | Уменьшить рассеянный свет от системы оптического освещения, отражающей поверхности на интерьер инкубатора |
| Рассмотрите возможность использования на основе фотошаблонов (в отличие от проектора основе) структурированного освещения | |
| Убедитесь, что проектор должным образом ориентирован на поверхности нижней палаты культуры биопленки |
Таблица 1: Общие, устранение неполадок.
Обсуждение
С учетом необходимости исследовательских инструментов, которые позволяют биопленки структуры управления мы представили это easy-to-use протокол для структурирования бактериальных биопленок, с помощью конструкции optogenetic pDawn-Ag43. С этой техникой кишечной биопленки можно оптически узором на различные поверхности среды, включая замкнутые камеры, с пространственным разрешением ниже 25 мкм.
В целом, этот протокол может быть разбита на четыре основных раздела: (1 Подготовка бактерий, pDawn-Ag43, (2 Подготовка оптического и аппаратные настройки культуры, (3 шаги предварительной освещения рост бактерий и (4 после освещения полоскания и изображений.
Важной частью раздела 1 является успешное превращение плазмида pDawn-Ag43 в штамм E. coli интерес. Этому способствует изоляции высокого качества очищенные плазмид и создания компетентных клеток высокого качества для преобразования (Таблица 1, устранение неполадок).
Важной частью раздела 2 является оптимизация проектора set-up так что освещенности корректируется до 50 мкВт/см2 на длине волны 460 Нм, и проектор правильно ориентирован на высоте образца биопленки. Обратите внимание, что в настоящем Протоколе, мы описываем set-up Перевернутый освещения, где проектора излучает свет снизу, вверх к биопленки образца. Преимущество этой настройки является, что свет только нужно пройти через нижнюю часть культуры блюдо до достижения поверхности образования биопленки. Подсветка сверху означает, что свет будет путешествовать через жидких сред над поверхностью биопленки, который, в ходе роста, получает облачно с планктонных клеток. Помимо этих проблем, это также важно для сведения к минимуму рассеянного света в оптической системы как можно больше, например, путем покрытия до отражающих поверхностей на интерьер инкубатора — это помогает получить резким рисунком биопленки. На соответствующую записку острее биопленки шаблоны можно также получить с помощью фотошаблонов для управления освещением патронирования (3D рисунок, Рисунок 4 c). Общие вопросы, требующие устранения неполадок включают вопросы надежности проектора при более высоких температурах (например, 37 ° C), которые могут быть уменьшиты инкубации биопленки роста при более низких температурах (например, 30 ° C), а также компьютерного программного обеспечения, Причины обновления операционной системы или синий свет, фильтрации во время ночи роста (Таблица 1). Важно также отметить, что, в зависимости от модели проектора и инкубатор используется, это также возможно, что тепла от проектора приведет к более высокой температуры внутренних чем инкубатора установить температуру, которая может потребоваться исправить.
Важной частью раздела 3 является получение надежные и повторяемые бактериальные образцы, прежде чем они индуцированных освещения. По этой причине мы рекомендуем вам получить клоновых колоний бактерий, pDawn-Ag43, мелирование их вне на плите агар и затем с помощью жидкого культуры шаги для обеспечения того, чтобы бактерии освещенные индуцированной в конце фазы экспоненциального роста в повторяемые образом.
Наконец важнейшей частью раздела 4 является тщательно, но также осторожно, смыть планктонных клеток, оставшихся после биопленки, кучность протокола; Таким образом рекомендуется выполнить несколько шагов нежно полоскания с PBS.
По сравнению с существующими методами для клеток патронирования5,6, оптические биопленки, кучность на основе pDawn-Ag43 имеет достаточно низкий барьер входа для использования, в том, что она не требует микротехнологий, чистота помещений, комплекс Химия, или подготовка поверхности, пока еще в состоянии картины с высоким разрешением (25 мкм), обычно связанные с микротехнологий методов. Этот метод расширяет предыдущие работы на бактериальных фотолитографии для контроля ген выражение17. В настоящее время pDawn-Ag43 плазмиды ограничивается E. coli, как он использует на основе МПУЕ происхождения репликации, но pDawn и Ag43 являются совместимыми в других (грамотрицательные) бактериальных видов. Генетические методы доступны для потенциально представляя свет регулируемых биопленки различных видов бактерий и представляет возможные направления будущих исследований. Другим потенциальным ограничением методики является, что она работает путем увеличения биопленки в штаммов с слабой родной биопленки (например, MG1655 E. coli). Однако штаммы с сильным родной биопленки имеют форму биоплёнки независимо от условий освещения, исключающие узорной биопленки, с помощью pDawn-Ag43 как описано здесь; еще optogenetic методы по-прежнему может оказаться применимым в регулировании биопленки. Мы отмечаем, что в других контекстах, альтернативные методы структурирования биопленки могут быть доступны, например через оптические c ди GMP модуляции18.
В целом, pDawn-Ag43 на основе структурирования будет подходящим для использования в приложениях, которые исследовать эффект биопленки структуры на функция1 и, таким образом, могли бы воспользоваться перестраиваемый контроль над биопленки патронирования — особенно актуально Пример для выделения является изучение микробной экологии в биопленке2. Будущие направления деятельности включают в себя рисунком биоматериалов8,9 и/или структурированные бактериальных сообществ. Альтернативные приложения этот доступ протокола также включают в себя био искусства19, учитывая ясно эстетический потенциал, а также науки о жизни формального и неформального образования20,21,22. С образовательной точки зрения, протокол, описанные здесь сочетает в себе многие соответствующие методы (бактериальной культуры, преобразование, оптика/Оптогенетика) и также модульно удлиняемым (например, включать микрофлюидика).
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Авторы благодарят D. стекла, H. Ким, N. Cira, A. Choksi, S. Раджан и б. ключи за их полезные предложения и в Spormann лабораторию для доступа к их конфокального микроскопа. Кроме того авторы признают поддержки от Стэнфорда био-X Bowes и Сенти PGS стипендии, Национальный институт здравоохранения (R21-Ай-139941) и американского общества рака (RSG-14-177-01).
Материалы
| Name | Company | Catalog Number | Comments |
| DH5alpha/pDawn-Ag43 | Addgene | 107742 | DH5alpha cloning strain hosting pDawn-Ag43 plasmid - plasmid needs to be moved to E. coli strain of interest prior to use |
| MG1655 E. coli | Coli Genetic Stock Center - Yale University | CGSC #6300 | MG1655 was used as E. coli strain of interest in this paper's representative results |
| RFP expression plasmid | iGEM biobricks | J04450-pSB4K5bb | Many options exist to obtain fluorescent bacteria - if using plasmid, ensure backbone does not conflict with colE1 ori of pDawn-Ag43 |
| Plasmid miniprep kit | Qiagen | 27104 | |
| LB broth powder | Affymetrix | 75852 | Add 20 g/L to water, autoclave, add 50 μg/mL spectinomycin to get sterile LB+spec |
| LB agar powder | Affymetrix | 75851 | Add 35 g/L to water, autoclave, add 50 μg/mL spectinomycin, pour into petri dishes to get sterile LB+spec plates |
| Petri dishes | Fisherbrand | 431760 | |
| Spectinomycin hydrochloride pentahydrate | abcam | ab141968 | Make 1000x stock 50mg/mL in water, filter sterilize and dilute into media as needed |
| Glycerol | Sigma-Aldrich | G5516 | Mix at 1:1 ratio with water, sterilize by autoclave or filter to obtain 50% glycerol |
| M63 media salts 5X solution | Bio-world | 705729 | Add cas-amino acids, glucose and MgSO4, bring to 1X salts concentration by adding sterile water |
| Casamino acids | Amresco | J851 | Make 20% stock in water, filter sterilize and add to M63 as supplement (final concentration 0.1%) |
| D-glucose | Sigma-Aldrich | G8270 | Make 20% stock in water, filter sterilize and add to M63 as supplement (final concentration 0.2%) |
| Magnesium sulfate | Sigma-Aldrich | M7506 | Make 1 M stock in water, autoclave and add to M63 as supplement (final concentration 1 mM) |
| Crystal violet | Acros organics | 212120250 | Dilute to 0.1% in water prior to use |
| Self-hardening mounting media (Shandon immumount) | Thermo Scientific | 9990402 | Use to preserve samples over long term for fluorescence imaging |
| Phosphate buffered saline (PBS) solution | Gibco | 10010023 | Can also use PBS prepared from powder / tablets |
| 6 well plate | Fisherbrand | 351146 | Used as biofilm culture dish for representative results |
| PDMS kit | Dow | SYLGARD 184 | Can be used to make enclosed microchamber cavities using soft lithography |
| 1 mL syringe | BD syringe | 309659 | For use with liquid handling with enclosed microchambers |
| Blunt tip needle | CML supply | 901-23-050 | Attaches to 1 mL syringe |
| Lab tape | Fisherbrand | 15-901 | Use to attach culture chamber to incubator ceiling |
| Bacterial incubator | Sheldon Manufacturing | SMI6 | Ensure interior height of incubator is tall enough to focus projector at the ceiling |
| Portable projector | Ivation | IV-PJ-PRO-4-1 | Many portable projector models exist, pDawn-Ag43 has been tested with multiple models including LED/laser based, with blue light channel ranging from 450-460nm central wavelength |
| Optical breadboard base | ThorLabs | MSB6 | Base for optical setup to hold projector - many other setups possible, just need to hold projector firmly at bottom of incubator, pointing upwards |
| Optical post | ThorLabs | TR8 | 2 posts needed - one to be set up vertically extending out of breadboard base, one horizontally attached via right-angle clamp |
| Optical post right-angle clamp | ThorLabs | RA90 | Connects vertical and horizontal posts |
| Mounting base | ThorLabs | BA1S | Connects optical breadboard base and vertical post |
| 1/4"-20 screw | ThorLabs | SH25S050 | Attaches vertical post to mounting base, mounting base to breadboard base |
| 1/4"-20 set-screw | ThorLabs | SS25E63D | Connects horizontal post to projector via tripod screw-hole |
| Optical power meter | Newport | 840 | Use with power meter detector to measure projector illumination intensity - many power meter models exist, using one that has extendable detector will facilitate measurement |
| Optical power meter detector | Newport | 818-UV | Connects to power meter (above) - UV detector not strictly necessary as blue light is within visible range |
| Adjustable ND filter | K&F Concept | SKU0689 | Adjustable (by rotating) neutral density filter - place above projector aperture |
| Presentation-projector software | Microsoft | Powerpoint | Any software that allows drawing / presentation will suffice |
| CAD software | Autodesk | AutoCAD | Used for designing photomasks, many mask printing services are compatible with AutoCAD files |
| Film photomask | Fineline Imaging | n/a | Many photomask printer services exist for high resolution (>30000DPI) film photomask printing |
Ссылки
- Costerton, J. W., Lewandowski, Z., Caldwell, D. E., Korber, D. R., Lappin-Scott, H. M. Microbial Biofilms. Annual Review of Microbiology. 49 (1), 711-745 (1995).
- Christensen, B. B., Haagensen, J. A. J., Heydorn, A., Molin, S. Metabolic commensalism and competition in a two-species microbial consortium. Applied and environmental microbiology. 68 (5), 2495-2502 (2002).
- Jin, X., Riedel-Kruse, I. H. Biofilm Lithography enables high-resolution cell patterning via optogenetic adhesin expression. Proceedings of the National Academy of Sciences of the United States of America. 115 (14), 3698-3703 (2018).
- Ohlendorf, R., Vidavski, R. R., Eldar, A., Moffat, K., Möglich, A. From dusk till dawn: one-plasmid systems for light-regulated gene expression. Journal of Molecular Biology. 416 (4), 534-542 (2012).
- Xu, T., et al. Construction of high-density bacterial colony arrays and patterns by the ink-jet method. Biotechnology and Bioengineering. 85 (1), 29-33 (2004).
- Gu, H., Hou, S., Yongyat, C., Detore, S., Ren, D. Patterned Biofilm Formation Reveals A Mechanism for Structural Heterogeneity in Bacterial Biofilms. Langmuir: the ACS Journal of Surfaces and Colloids. 29 (35), 11145-11153 (2013).
- Davey, M. E., O'Toole, G. A. Microbial biofilms: from ecology to molecular genetics. Microbiology and Molecular Biology Reviews: MMBR. 64 (4), 847-867 (2000).
- Nguyen, P. Q., Botyanszki, Z., Tay, P. K. R., Joshi, N. S. Programmable biofilm-based materials from engineered curli nanofibres. Nature Communications. 5, 4945 (2014).
- Chen, A. Y., et al. Synthesis and patterning of tunable multiscale materials with engineered cells. Nature Materials. 13, 515-523 (2014).
- JoVE Science Education Database. Basic Methods in Cellular and Molecular Biology. Plasmid Purification. Journal of Visualized Experiments. , (2018).
- JoVE Science Education Database. Basic Methods in Cellular and Molecular Biology. Bacterial Transformation: The Heat Shock Method. Journal of Visualized Experiments. , (2018).
- JoVE Science Education Database. Basic Methods in Cellular and Molecular Biology. Bacterial Transformation: Electroporation. Journal of Visualized Experiments. , (2018).
- JoVE Science Education Database. General Laboratory Techniques. Introduction to Fluorescence Microscopy. Journal of Visualized Experiments. , (2018).
- Pawley, J. . Handbook of Biological Confocal Microscopy. , (2010).
- O'Toole, G. A. Microtiter Dish Biofilm Formation Assay. Journal of Visualized Experiments. 47, e2437 (2011).
- JoVE Science Education Database. Bioengineering. Soft Lithography. Journal of Visualized Experiments. , (2018).
- Levskaya, A., Weiner, O. D., Lim, W. A., Voigt, C. A. Spatiotemporal control of cell signalling using a light-switchable protein interaction. Nature. 461 (7266), 997-1001 (2009).
- Huang, Y., Xia, A., Yang, G., Jin, F. Bioprinting Living Biofilms through Optogenetic Manipulation. ACS Synthetic Biology. 7 (5), 1195-1200 (2018).
- Kac, E. . Signs of Life: Bio Art and Beyond. , (2007).
- Lee, S. A., et al. Trap it!: A Playful Human-Biology Interaction for a Museum Installation. Proceedings of the 33rd Annual ACM Conference on Human Factors in Computing Systems. , 2593-2602 (2015).
- Cira, N. J., et al. A Biotic Game Design Project for Integrated Life Science and Engineering Education. PLOS Biology. 13 (3), e1002110 (2015).
- Bybee, R. W. The next generation science standards and the life sciences. Science and Children. 50 (6), 7 (2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены