Method Article
Трехмерная тимическая культурная система для генерации Murine индуцированных Плюрипотентные стволовые клетки полученных Опухолевые антигена конкретных Тимических эмигрантов
* Эти авторы внесли равный вклад
В этой статье
Резюме
В этой статье описывается новый метод для создания опухолевых антигенов-специфических индуцированных плюрипотентных стволовых клеток полученных тимических эмигрантов (iTE) трехмерной (3D) тимской культуры системы. iTE - это однородное подмножество Т-клеток, тесно связанных с наивными Т-клетками с способностью к пролиферации, формированию памяти и подавлению опухолей.
Аннотация
Наследование предварительно переставленных Т-клеточных рецепторов (ТКР) и их эпигенетическое омоложение делают индуцированные плюрипотентные стволовые клетки (iPSC) т-клеток перспективным источником для приемной Т-клеточной терапии (ACT). Однако классические методы in vitro для производства регенерированных Т-клеток из iPSC приводят либо к врожденной, либо неизлечимо дифференцированным Т-клеткам, которые фенотипически и функционально отличаются от наивных Т-клеток. Недавно была разработана новая трехмерная (3D) система тимской культуры для создания однородного подмножества CD8-- антиген-специфических Т-клеток с наивным Т-клеточным функциональным фенотипом, включая способность к распространению, формированию памяти , и подавление опухоли в vivo. Этот протокол позволяет избежать аномальных урядов развития, что позволяет для генерации клинически значимых IPSC полученных Т-клеток, назначенных как iPSC полученных тима эмигрантов (iTE), а также предоставление мощного инструмента для выяснения последующих функций, необходимых для созревания Т-клеток после выбора тимии.
Введение
Приемная Т-клеточная терапия (ACT) может быть эффективным лечением для некоторых пациентов с запущенным раком. К сожалению, многие пациенты не испытывают регрессии опухоли, и переданные клетки не сохраняются после инфузии. Это может быть связано с качеством настояний Т-клеток. Модель мыши ACT показала, что по сравнению с наивными или менее дифференцированными центральными клетками памяти Т, неизлечимо дифференцированные клетки-эффекторы менее мощные из-за плохой настойчивости in vivo1, наблюдение также поддерживается клиническими данными2, 3.
В целях повышения эффективности текущего ACT, Т-клеток, полученных индуцированных плюрипотентных стволовых клеток (T-iPSC) были изучены широко4,5. Когда Т-клетки перепрограммируются в T-iPSC и вновь дифференцированы в Т-клетки, перестроенная конфигурация генов TCR наследуется T-iPSC, а затем и повторно дифференцированных Т-клеток. Таким образом, способность T-iPSC пройти неограниченное расширение in vitro позволяет эффективное размножение незрелых Т-клеток, несущих неоантиген-специфические Т-клеточные рецепторы (TCR), когда такие клетки разработаны из опухолевых антиген-специфических Т-клеток6 ,7. Тем не менее, точный метод дифференциации T-iPSC в зрелые Т-клетки, которые позволили бы производство рака антиген-специфических Т-клеток с менее дифференцированным фенотипом и лучшей противоопухолевой потенцией, еще предстоит выяснить.
T-iPSC дифференциации с использованием совместной культуры OP9 мурин стромальных клеток чрезмерного выражения человека Notch ligand DLL1 является устоявшимся методом для производства Т-клеток в пробирке6,7. У мышей и людей, эта система совместной культуры может последовательно дифференцировать iPSC, тем самым реквалитулируя события развития от стадии бластоциста до незрелой линии Т-клеток стадии6,7. Несмотря на эти биотехнологические достижения, физиологическая дифференциация после этапа CD4иCD8и двойного положительного (DP) этапа по-прежнему трудно достичь. Одна из причин заключается в том, что in vivo CD4иCD8- и CD4-CD8- одиночные положительные (SP) Т-клетки генерируются в тимусе, органе, ответственном за созревание и отбор Т-клеток, которые имеют чужую антиген-специфичность, но не автореактивность8. Эти селективные процессы определяются как положительный и отрицательный отбор, соответственно. Тем не менее, большинство молекулярных механизмов, необходимых для созревания Т-клеток в тимусе до сих пор полностью не изучены, что затрудняет реконструкцию этого процесса в пробирке. В попытке преодолеть это физиологическое препятствие, несколько групп стимулировали комплекс TCR с использованием анти-CD3 антител или агонист пептидов. Эти методы in vitro генерируют клеточные продукты, которые выражают ключевые маркеры Т-клеток, такие как CD3, CD8, TCR и CD62L, сохраняя при этом специфичность опухолевых антигенов. К сожалению, Т-клетки, генерируемые этими экстрагимичными методами, представляют собой широкую неоднородную популяцию клеток, характеризующуюся неполным положительным отбором, врожденными особенностями, неспецифическим убийством TCR, неспособностью к формированию памяти и непостоянные противоопухолевыеэффекты in vivo 8,9,10,11. Эти аномалии вызвали опасения, что такие клетки могут вызвать различные побочные эффекты, в том числе лимфомы и кожи и костной аномалии, если используется для терапевтических приложений12,13,14 .
Чтобы воссоздать физиологические сигналы, отсутствующие в текущих системах дифференциации in vitro, антиген-специфический T-iPSC опухолевого антигена были дифференцированы с помощью собранного тимуса. Классическая система органов тимуса плода (FTOC), которая была разработана для изучения внутритимического развития Т-клеток, была усовершенствована с помощью 3D-системы культуры, которая успешно производила Т-клетки, которые завершили тимическое образование. Эти пост-тимические Т-клетки, которые были обозначены как iPSC полученных тимских эмигрантов (iTE), выставлены наивные свойства15. iTE показал пролиферацию, формирование памяти и адекватные противоопухолевые эффекты в мышиной модели против установленных опухолей меланомы B16. Эта статья подробно описывает протокол этой новой системы FTOC с использованием 3D-системы культуры(рисунок 1).
протокол
Все эксперименты на животных были одобрены Институциональными комитетами по уходу за животными и использованию Национального института рака (NCI) и проведены в соответствии с руководящими принципами NIH.
1. Подготовка клеток OP9/DLL1 для совместной культуры с iPSC
- Культурные клетки OP9/DLL1 в op9-носителях (-минимальная необходимая среда »-MEM» - 20% ненагретная инактивированная сыворотка крупного рогатого скота (FBS) 1x пенициллин-стрептомицин , аскорбиновая кислота (50 нг/мл) и моно-тиоглицерол (100 нм) при 37-c. Когда op9/DLL1 клетки достигают 80-95% конфлюкс, мыть один раз с 1x магния, кальция и фенола красный свободный фосфат буферный солен (в дальнейшем называют PBS).
- Добавьте 4 мл 0,05% трипсина и инкубировать в течение 5 мин при 37 градусах Цельсия. Затем добавьте 4 мл носителей OP9, разъедините клеточный слой, прокладывая трубку, чтобы сделать одноклеточное суспензию.
- Перенесите суспензию клетки в коническую трубку 50 мл через 100 мкм-ситечко. Центрифуга при 300 х г в течение 5 мин при 4 градусах По Цельсию, аспирируй супернатант и повторно приостанавливай 12 мл носителей OP9.
- Плита 2 мл OP9/DLL1 клеточной подвески на новый 10 см клеточной культуры Петри блюдо и добавить дополнительные 8 мл OP9 средств массовой информации. Повторите проход каждые 2-3 дня.
ПРИМЕЧАНИЕ: Качество FBS и культурные условия имеют решающее значение для поддержания расширения OP9/DLL1 ячеек, не теряя при этом их способности поддерживать дифференциацию iPSC. Поэтому рекомендуется предварительно оценить много FBS и проход последовательно на 80% confluency для предотвращения клеточной дифференциации и сенесценции. Важно также, чтобы сделать достаточно замороженных запасов OP9/DLL1 клеток и оттаивать новый запас каждые 4-6 недель.
2. В экстракорпорании Дифференциация iPSC в незрелые Т-клетки
-
На 0 день, начните iPSC совместной культуры на OP9/DLL1 конфлированные блюда.
- Урожай iPSC в виде одноклеточной подвески путем трипсинизации (5 мин в 0,05% трипсина при 37 градусах Цельсия), собирать клетки, и центрифуги на 300 х г в течение 5 мин при 4 градусах Цельсия.
- Приготовьте супернатант и отдохните клетки на уровне 1,0 х 105 iPSC на 10 мл носителей OP9. Плита 1.0 x 105 iPSC на соплокую тарелку OP9/DLL1 10 см.
ПРИМЕЧАНИЕ: Посуда OP9/DLL1 10 см используется для дифференциации iPSC, когда они достигают 90-100% выпуклости. Различия в стоечности могут повлиять на эффективность дифференциации iPSC.
- На 3-й день, аспирируйте старые носители и заменить 10 мл свежих носителей OP9.
-
На 6-й день, проходные камеры.
- Вымойте каждый 10 см сливаOPили OP9 блюдо с 10 мл PBS. Добавьте 3 мл 0,05% трипсина на блюдо и инкубировать в течение 3-5 мин при комнатной температуре (RT).
- Добавьте 4 мл носителей OP9 и соберите ячейки нежным пипеттингом. Пройдите клетки через 100 мкм ячейки ситечко и центрифуги на 300 х г в течение 5 минут при 4 градусах Цельсия. Откажитесь от супернатанта.
- Resuspend клетки в 10 мл дифференциации средств (OP9 СМИ с 5 нг /мл мыши Flt3 лиганд "FLT3L" и 5 нг /мл мыши IL-7) и пластины ячейки подвески на новый 10 см OP9/DLL1 слияние блюдо.
- На 9-й день, аспирации старых носителей и заменить 10 мл свежих средств дифференциации.
-
На 11 день, когда кардиомиоциты наблюдаются в колониях iPSC, механически отсоединяют неадекторные клетки путем пипетки и процеживают через 100 мкм клеточный ситечко. Спин при 300 х г в течение 5 мин при 4 градусах По цельсию.
- Аспирация супернатанта и resuspend в 24 мл дифференциации средств массовой информации. Плита iPSC в сливочную 6-колодую пластину OP9/DLL1 (4 мл/колодец).
-
На 15 день, собрать все неприсоединения клеток и фильтр через 40 мкм ячейки ситечко.
- Спин при 300 х г в течение 5 мин при 4 градусах По цельсию.
- Продолжайте пропускать неприсоединения клетки каждые 3-4 дня, повторяя шаг 2.5.1.
3. 3D Тимский орган культуры для создания iTE
- Урожай мыши плода тимических долей и развертывания эндогенных лимфоцитов по дезоксигуанозина (dGUO) лечение, как ранее описано16.
- На 7-й день лечения dGUO, возьмите четыре новых 10 см блюд и заполнить каждый с 20 мл полных средств массовой информации (Россвелл Парк Мемориальный институт Сми 1640 "RPMI 1640" (MEM-NEAA) - 1x пенициллин-стрептомицин - 1:1000 2-меркапто этанол).
- Перенесите все мембраны нитроцеллюлозы с тимическими долей в одну 10-сантиметровую тарелку. Отсоедините отдельные доли от мембраны щипками, что позволяет их погружать в носители. Отбросьте мембраны. Инкубировать 1 ч на RT.
- Перенесите тимичные доли в новую 10-сантиметровую тарелку с полным носителем и инкубину в течение 1 ч на RT. Повторите этот шаг еще 2 раза.
- Используя щипцы, исправить тимьяна доли блюдо (по одному в то время), а с другой стороны сделать 100-200 мкм глубокий разрез в центре и расширение половины диаметра доли для облегчения Т-клеток-прародителей миграции в доле.
- Перенесите тимичные доли в новую 10-сантиметровую тарелку, наполненную полной дифференциацией (полные носители: 5 нг/мл мыши IL-7 , 5 нг/мл мыши FLT3L 5 нг/мл SCF).
- Дополнительно, при использовании 3D-культурных пластин с сетками нижнего и верхнего уровня, заполните обе сетки стерильными PBS, чтобы предотвратить испарение и сушку висячих капель.
- Передача 30 злицита полных носителей, содержащих одну дГУообработанную тимику с шага 3,6 в каждую скважину 3D-культурной пластины.
- Сбор неприсоединения T линии клеток (iPSC полученных незрелых Т-клеток) от OP9/DLL1 совместной культуры (дни 16-21) (шаг 2,6,2) и resuspend на 2-5 х 103 T линейных ячеек на 20 мульти-медиа.
- Добавьте 20 ЗЛ суспензии тлинейных клеток к каждой тимической доле в 3D-культуре пластины. Инкубировать на ночь при 37 градусах Цельсия с 5% CO2.
- Установите P200 pipet до 30 Зл и аспирировать средства массовой информации после pipetting несколько раз из каждого колодца, чтобы удалить все клетки, окружающие тимские доли. Отбросьте мультимедиа и добавьте 30 кл. полного носителя. Повторите эту процедуру 5-7 раз, чтобы удалить любые дополнительные незрелые Т-клетки, которые не мигрируют в доли. Изменение 25-30 Зл средств массовой информации ежедневно после этого.
- Подтвердите образование ореола тимических эмигрантов (iTE) по липучне, полученного в iTE, вокруг долей, начиная с 4-5 дня, с помощью световой микроскопии.
- Собирайте iTE ежедневно путем пипетки средств массовой информации без нарушения доли. Изменяйте носители каждый день и продолжайте сбор примерно до 12 дней.
- Собранные iTE готовы к использованию для молекулярного анализа(рисунок 2, Рисунок3, Рисунок 4, и Рисунок 5) или in vivo экспериментов по трансплантации.
4. Подготовка антигенных клеток (APC)
- Пожертвуйте мышью C57BL/6 путем вывиха шейки матки и поместите на лабораторный коврик, как описано выше.
- Удалите селезенку и поместите ее на 100 мкм ячейки ситечко. Сжать селезенку на ситечко с помощью 12 мл шприц поршень, чтобы сделать одну ячейку подвески.
- Перенесите суспензию клетки через стерильный 40 мкм-ситечко. Centrifuge подвески на 300 х г в течение 5 минут при 4 кв С, чтобы гранулы клеток.
- Усилите супернатант и повторно ежеклеточные гранулы в 2 мл лиза аммония-хлорида (ACK), чтобы исключить эритроциты (РБК). Инкубировать в течение 5 мин на RT.
- Утолить буфер lysis ACK, добавив 10 мл PBS. Пелле клетки центрифугации при 300 х г в течение 5 мин при 4 градусах Цельсия.
- Аспирировать супернатант и resuspend клеточной гранулы в 10 мл полного носителя и передачи 10 см стерильной чашке Петри.
- Облучение спленоцитов с помощью 3500 рад с помощью облучения устройства (я-излучения) для предотвращения пролиферации клеток.
- Немедленно верните облученные клетки в инкубатор и культуру 37 градусов по Цельсию на ночь.
- Используйте облученные ячейки в качестве БТР или замораживание в ячейке банкира.
5. Пульсирующий БТР с антигеном
- Граф жить облученных БТР с помощью гемоцитометра Нойбауэр и trypan синий краситель. Инкубировать APC с пептидами (hgp100) или нуклеопротеином в течение 30 мин при 37 градусах Цельсия.
- Вымойте APC дважды с 10 мл PBS, чтобы удалить любой дополнительный пептид.
- Подсчитайте iTE и смешайте с БТР в соотношении 1:1 в полных носителях с 100 МЕ Ил-2 и 5 нг/мл Ил-7. Aliquot 100 л смеси клеток (общая концентрация: 1 х 106 клеток/мл) в каждую скважину ультра-низкой привязанности U bottom 96 хорошо пластины и культуры для 48 ч при 37 градусов по Цельсию.
- После 48 ч, передача клеток на новую пластину с помощью многоканального пипетки и проход каждые 2-3 дней после этого.
-
На 3-й день проанализируйте профиль секреции цитокинов, окрашивая клетки внутриклеточными антителами и анализируйте с помощью цитометрии потока(рисунок 3).
- Добавьте 0,67 л/мл ингибитора переноса белка (например, GolgiStop) и инкубировать при 37 градусах По цельсии в течение 6 ч для усиления внутриклеточного накопления цитокинов. Вымойте 10 мл PBS.
- Приостановите работу клеток в 3 мл холодного (4 кВ) PBS и медленно добавьте 1 мл холодного 4% параформальдегида (PFA).
- После 10 мин, спина вниз клетки на 300 х г в течение 5 мин при 4 кв С, отбросить супернатант и вымыть с 10 мл PBS.
- Переплетить клетки в 1 мл PBS - 1% FBS - 0,1% неионического сурфактанта, и поместить в 4 кв. м в течение 10-15 мин.
- Добавить антитела, защитить образцы от света и поместить в 4 градуса по Цельсию в течение 30 мин.
- Спин вниз клетки на 300 х г в течение 5 минут при 4 кв С, отбросить супернатант, и мыть с 10 мл PBS.
- Спин вниз клетки на 300 х г в течение 5 минут при 4 КС и resuspend клеток в 1 мл PBS. Клетки готовы к анализу в цитометре потока.
Результаты
Co-культурные тимы плода были разделены для анализа ли iPSC полученных T линии клетки могут мигрировать в тимачных долей. Unseeded контрольные доли были ткани архитектуры характеризуется астроцитов, как тимский эпителиальной сети17, развернутые эндогенных КЛЕТОк CD3. С другой стороны, тимические доли, посеянные с immature T-клетками, полученными iPSC, были заселены моноядерными клетками CD3 и, что указывает на миграцию незрелых Т-клеток, полученных iPSC, в доли (рисунок2A).
Т-клетки, которые мигрировали и созрели в тимской микросреде, впоследствии выбыли как iTE. Чтобы проверить их фенотипической характеристики, поток цитометрического анализа C57BL6 тимоцитов, Pmel iPSC полученных незрелых Т-клеток (экстратимные), и клетки, которые выйти из тимических долей (iTE) было выполнено. Экстратимные Т-клетки на OP9/DLL1 показали CD4иCD8 (DP) Т-клетки и Т-клетки CD8'SP без выражения положительного маркера отбора MHC-I, в то время как iTE имела четкую популяцию CD8'SP MHC-Iи Т-клеток фенотипа, указывая на их успешный проход через положительный отбор до выхода из тимических долей. iTE последовательно выражают MHC-I и CD62L, которые являются маркерами, связанными с высокой пролиферативной компетентности, производством цитокинов, периферийным выживанием и лимфоидным самонаведением18,19,20. Этот фенотип согласуется с M2 SP тимоцитов, которые являются наиболее зрелой популяции одного положительных Т-клеток в тимуса20, что свидетельствует о том, что iTE перешли через нормальную тимическую программу развития (Рисунок 3). Для контроля эффективности генерации iTE были выделены клетки, выпавшие из отдельных тимических долей. На 7-й день, тимики доли генерируется в среднем 1 х 103 жить CD8SP CD45.1CD3 cd3iTE в день (рисунок3B). Аналогичный уровень производства iTE наблюдается со дня 6 до дня 12 3D тимской ко-культуры.
Антиген-зависимая активация и секреция цитокинов были проанализированы для наблюдения за функциональными свойствами тимически образованных незрелых Т-клеток, полученных от iPSC. При наличии нерелевантного пептида (нуклеопротеина) Пмель-иТЕ не высвобождавал значительное количество ТНФ-З, ИЛ-2 или ИФН-З. При стимуляции с коньячным пептидом для клеток Pmel T (hgp100), Пмель-iTE выпустила надежное количество ТНФ-Я и IL-2, а также производит небольшое количество IFN-Я (Рисунок 4), что свидетельствует о том, что тимически образованных iTE может распознать их коньяк пептид и секретный эффектор цитокинов с профилем, напоминающим профиль естественных недавних тимских эмигрантов (RTE).
Для изучения транскрипционных различий между iPSC-полученных T линейных клеток дифференцированных на OP9/DLL1 с или без тимического образования (т.е. iTE против экстратимных Т-клеток), РНК-сек анализ был выполнен на этих двух популяций и по сравнению к клеткам линии DP T, дифференцированным с помощью OP9/DLL1 (DP) и первичных наивных CD8и Pmel T-клеток. Выражение 102 генов, которые играют решающую роль в Т-клеток онтогена, тимоцитов активации, и формирование памяти были проанализированы15,20,21,22. Основной компонент анализа этих четырех изученных популяций показал, что экстратимически генерируемые DP и CD8SP T-клетки сгруппированы вместе, в то время как iTE сгруппированы ближе к наивным Т-клеткам(рисунок 5). В совокупности эти данные показывают, что iTE имеет фенотип ближе к наивным Т-клеткам, чем т-линии клеток, генерируемых экстратимическими методами.
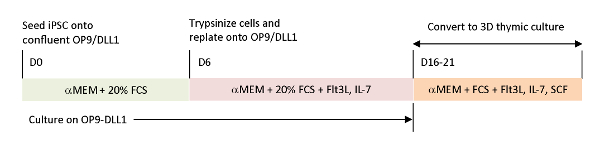
Рисунок 1 : Схематический обзор дифференциации iPSC к iTE с использованием OP9/DLL1 и 3D тимической культуры. Протокол включает в себя три отдельных шага дифференциации; (Слева) от клеток iPSC к гематопоитетической линии клеток на OP9/DLL1 (день от 0 до 6), (Средний) от гематопоиетических клеток линии до незрелых Т-клеток на OP9/DLL1 с цитокинов (день 6 до 16-21), и (справа)от незрелых Т-клеток (день 16-21) до iTE с использованием 3D тимической системы культуры. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
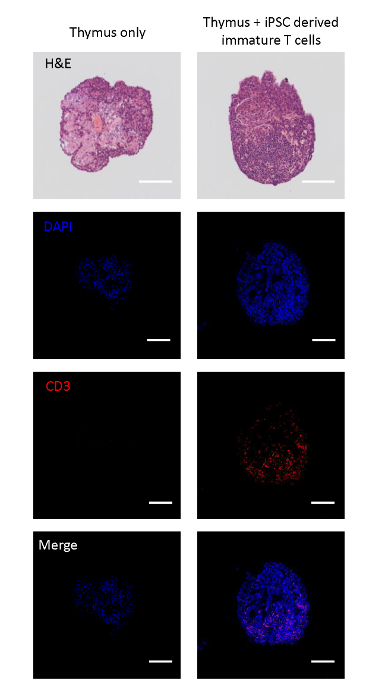
Рисунок 2 : Иммуногистохимия тимических долей, посеянных с незрелыми Т-клетками, полученными iPSC. Вверху: H и E окрашивание тимической доли с и без посева iPSC полученных незрелых Т-клеток. От второго сверху вниз: конфокальные изображения разделенных долей, окрашенных DAPI (ядро), CD3 (T ячейка), и слияния. Шкала баров 100 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
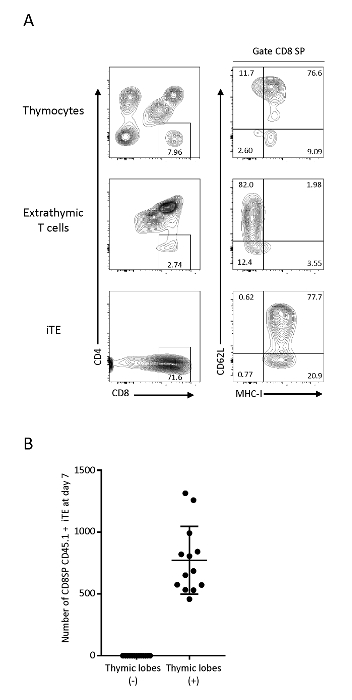
Рисунок 3 : iTE показывает посттимичный фенотип Т-клеток. (A) АНАЛИЗы FACS тимоцитов, экстрагимических Т-клеток (система сокультуры OP9/DLL1) и Pmel-iTE. Клетки в живых клетках были закрыты на конгенивных CD45. Популяции CD8 SP были дополнительно проанализированы для выражения CD62L и MHC-I. (B) Среднее количество CD8SP CD45.1 iTE производится на ночь на доли 7 дней после предварительного посева. Данные были собраны в ходе 12 независимых экспериментов. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
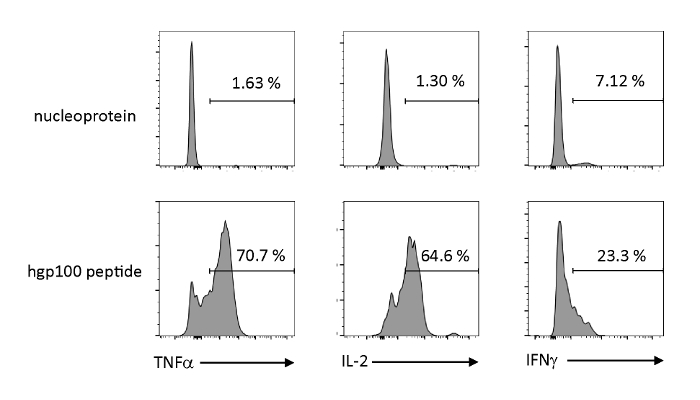
Рисунок 4 : iTE производят различные цитокины путем антиген-специфической стимуляции. FACS анализирует внутриклеточную выработку цитокинов iTE. iTE были совместно культивированы с БТР предварительно загружены нерелевантных (нуклеопротеин) или коньяк (hgp100) пептид в течение трех дней. Цифры, показанные в верхних правых квадрантах, указывают на проценты iTE, производящего цитокин. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
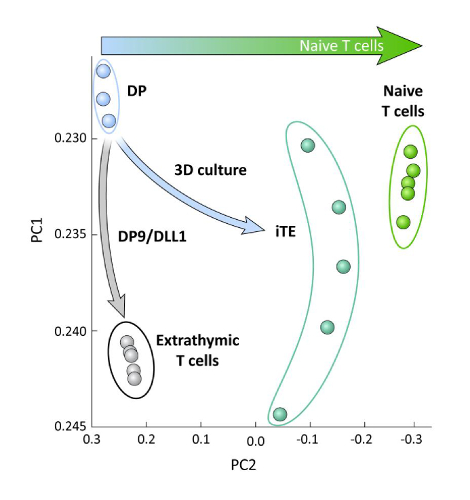
Рисунок 5 : Анализ всего транскриптома показывает сдвиг в экспрессии гена iTE в сторону наивного CD8 + T-клеточная программа. Принцип анализа компонентов (PCA) данных РНК-сек из DP, экстратимических CD8 SP, iTE и наивных Т-клеток. (Анализ 102 генов, связанных с тимической дифференциацией с использованием общедоступной базы данных GSE105110) 15. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Обсуждение
Использование T-iPSC для регенерации опухолевых антиген-специфических Т-клеток может преодолеть многие из нынешних препятствий ACT путем создания молодых клеток с улучшенной настойчивостью. Хотя несколько методов с использованием OP9/DLL1 совместной культуры системы, как сообщается, генерировать CD8 SP-клеток6,7,10,13, которые выражают CD8 молекул и опухолевых антигенов конкретных TCRs, глобальный ген шаблоны выражения и функциональный анализ показывают, что эти экстратимически регенерированные клетки CD8 SP отличаются от наивных Т-клеток(рисунок 4). Здесь мы описываем 3D тимическую систему культуры, которая может генерировать iPSC полученных тимических эмигрантов (iTE) с высокой точностью и однородность из murine T-iPSC. iTE напоминают наивные Т-клетки в глобальной модели экспрессии генов и в функциональности, таких как формирование памяти и противоопухолевый эффект in vivo против установленной опухоли15.
Классическая система FTOC является способом повторения тимического отбора in vitro. Он был использован для изучения внутритимического развития тимоцитов23, и Есть несколько сообщений fTOC используется для создания RTE24. Тем не менее, система FTOC имеет ряд ограничений. Для того чтобы отсутсвие кислорода в искусственничной культуре органа, несколько групп использовали или semi-сухую культуру основанной мембраны23,или системы культуры субмерии кислорода25. Однако никакие современные методы не могут постоянно генерировать однородную популяцию посттимических Т-клеток. Чтобы преодолеть ограничения классической системы FTOC, мы разработали 3D тимическую систему культуры, которая обеспечивает технические усовершенствования по сравнению с обычными методами15. Например, использование нашего метода 3D тимической культуры, максимального обмена кислородом и отсутствия поверхностно-логов механического стресса держать тимские доли в более физиологической среде. Кроме того, долгосрочная культура позволяет зрелым Т-клеткам естественным образом выйти из тимических долей. Наконец, наблюдение в реальном времени и микроманипуляции позволяют обмениваться средствами массовой информации и постоянной коллекции iTE без физического нарушения тимических долей. Таким образом, метод 3D тимической культуры обеспечивает значительные технические усовершенствования, а также возможность изучения тимически выбранных наивных Т-клеток, которые ранее не были доступны.
Есть несколько ключевых моментов для успешного поколения iTE с помощью этой 3D тимской системы культуры. Качество УСЛОВИй FBS и культуры имеет решающее значение для поддержания расширения OP9/DLL1 ячеек, не теряя при этом их способности поддерживать дифференциацию iPSC. Поэтому мы рекомендуем предварительной оценки fbS много, а также последовательно прохождения на 80% confluency для предотвращения клеточной дифференциации и сенесценции. Кроме того, культура слияния OP9/DLL1 необходима для дифференциации iPSC в незрелые Т-клетки, так как различия в выпуклости могут повлиять на их эффективность. Наконец, эмбриональный возраст тимических долей имеет решающее значение для поколения iTE. Рекомендуем использовать E14.5 - 15,5 тыс. долей.
Как и в случае с любым новым протоколом, этот метод имеет ограничения и подлежит совершенствованию. Представленная здесь техника культуры в течение двух недель составляет около 1000 iTE на тимическую мебу. Увеличение генерации iTE может быть возможно с дальнейшими изменениями, включая оптимизацию концентрации кислорода, объема мультимедиа и типа 3D-культурной пластины. Добавление или удаление цитокинов, а также изменения концентрации цитокинов, также может способствовать повышению урожайности iTE.
Учитывая, что 3D тимическая система культуры, представленная здесь, может генерировать тимических эмигрантов в полностью ex vivo системы, этот метод может быть применен к различным иммунологических и приемных клеток передачи научно-исследовательских проектов, включая, но не ограничивайтесь T дифференциация клеток, посттимичное созревание Т-клеток и генерация антиген-специфических Т-клеток гематопоиетического прародителя или стволовых клеток. Хотя этот метод непосредственно не применим к пробам человека, iTE и система 3D тимской культуры имеют большой потенциал для выяснения молекулярных механизмов положительного и отрицательного отбора и могут способствовать созданию системы культуры, которая позволяет поколение клинически релевантных опухолевых антигенов конкретных наивных Т-клеток для АКТ.
Раскрытие информации
Авторы Рауль Визкардо, Николас Д. Клемен и Николас. Рестифо являются изобретателями на рассмотрении международной патентной заявки PcT/US2017/65986, поданной 13 декабря 2017 года под названием Методы подготовки изолированного или очищенного населения тимических эмигрантских клеток и методы лечения с использованием того же ".
Благодарности
Мы благодарим Хироси Кавамото и Кёко Масуда за любезное предоставление линии клеток OP9/DLL1. Мы благодарим Алана Б. Хуферинга и Эрину З. Он за графическую помощь. Это исследование было поддержано Intramural исследовательской программы Национального института рака США (ЗИА BC010763) и рак Moonshot программы для Центра клеточной терапии в NCI, NIH. Работа также была поддержана Фондом семьи Мильштейнов.
Материалы
| Name | Company | Catalog Number | Comments |
| Chemicals, Peptides and Recombinant Proteins | |||
| 2-deoxyguanosine | Sigma-Aldrich | 312693-72-4 | |
| 2-Mercaptoethanol (1,000x) | Thermo Fisher Scientific | 21985-023 | |
| ACK Lysing Buffer | Gibco | A1049201 | |
| Ascorbic acid | Sigma-Aldrich | A8960 | |
| Blasticidin | Thermo Fisher Scientific | R21001 | |
| FBS | Gemini | 100-500 | |
| Flt-3 ligand | R&D Systems | 427-FL | |
| GlutaMAX (100x) | Thermo Fisher Scientific | 35050-061 | |
| hgp100 | Genscript | 282077-1, KVPRNQDWL | |
| Interleukin-2 | R&D Systems | 402-ML | |
| Interleukin-7 | R&D Systems | 407-ML | |
| MEM Non-Essential Amino Acids Solution | Gibco | 11140050 | |
| MEM powder | Gibco | 61100061 | |
| Monothioglycerol | Sigma-Aldrich | M-6145 | |
| Nucleoprotein | Global Peptides | ASNENMETM | |
| Penicillin/streptomycin | Thermo Fisher Scientific | 15140-122 | |
| Phosphate buffered saline pH 7.4 (1x) | Thermo Fisher Scientific | 10010-023 | |
| Puromycin | Thermo Fisher Scientific | A1113803 | |
| RPMI 1640 | Gibco | 11875093 | |
| Sodium Pyruvate | Thermo Fisher Scientific | 11360-070 | |
| Stem Cell Factor (SCF) | R&D Systems | 455-MC | |
| Stemfactor LIF, Mouse Recombinant | STEMGENT | 03-0011-100 | |
| Trypsin-EDTA (0.05%), phenol red | Thermo Fisher Scientific | 25300-062 | |
| Cell Culture Vessels and others | |||
| 10 cm dish | Corning, Inc. | 353003 | |
| 12 mL Syringe | Covidien Monoject | 22-652-090 | |
| 6 well plate | Corning/Coster | 3516 | |
| Cell strainer 100 μm | Fisher Scientific | 22-363-549 | |
| Cell strainer 40 μm | Fisher Scientific | 22-363-547 | |
| Forceps | DUMONT | 0108-5PO | |
| Lab soaker mat | Versi-Dry | Cat. EF2175CX 74018-00 | |
| Membrane filters ( 0.8 μm, 47diam) | Whatman | WHA7408004 ALDRICH | |
| Perfecta3D Hanging Drop Plate | Sigma-Aldrich | HDP1096 | |
| U Bottom 96 well plate | Corning/Coster | 3799 | |
| Experimental Cell lines | |||
| CD3-iPSC | Vizcardo et al., Cell Report 2018 | N/A | |
| MEF-iPSC | Vizcardo et al., Cell Report 2018 | N/A | |
| Mouse Embryonic Fibroblasts (MEF) | ATCC | SCRC-1040; RRID:MGI:5007926 | |
| OP9/N-DLL1 | Riken Bioresource center | Cat# RCB2927; RRID:CVCL_B220 | |
| Pmel-iPSC | Vizcardo et al., Cell Report 2018 | N/A | |
| Experimental mouse models | |||
| B6.SJL-PtprcaPepcb/BoyCrCrl | Charles River | Strain Code 564; RRID:IMSR_CRL:564 | |
| C57BL/6N | NCI/Charles River | N/A | |
| Pmel-1 mice | Overwijk et al. | J Exp Med 198(4):569-80 | |
| Antibodies | |||
| Anti-aTCR | Biolegend | 109202; RRID:AB_313425 | |
| Anti-CD3 | abcam | ab11089; RRID:AB_369097 | |
| Anti-CD4 | BD Biosciences | 553730; RRID:AB_395014 | |
| Anti-CD44 | BD Biosciences | 559250; RRID:AB_398661 | |
| Anti-CD45.1 | BD Biosciences | 553775; RRID:AB_395043 | |
| Anti-CD45.2 | BD Biosciences | 553772; RRID:AB_395041 | |
| Anti-CD62L | BD Biosciences | 560516; RRID:AB_1645257 | |
| Anti-CD69 | BD Biosciences | 552879; RRID:AB_394508 | |
| Anti-CD8a | BD Biosciences | 557959; RRID:AB_396959 | |
| Anti-CD8b | BD Biosciences | 550798; RRID:AB_393887 | |
| Anti-H-2Kb | BD Biosciences | 553570; RRID:AB_394928 | |
| Anti-IFN-g | BD Biosciences | 557998; RRID:AB_396979 | |
| Anti-IL-2 | BD Biosciences | 554428; RRID:AB_395386 | |
| Anti-TCRb | Thermo Fisher Scientific | 35-5961-81; RRID:AB_469741 | |
| Anti-TCRVb13 | BD Biosciences | 553204; RRID:AB_394706 | |
| Anti-TNFa | BD Biosciences | 557644; RRID:AB_396761 |
Ссылки
- Gattinoni, L., et al. Wnt signaling arrests effector T cell differentiation and generates CD8+ memory stem cells. Nature Medicine. 15 (7), 808-813 (2009).
- Rosenberg, S. A., et al. Durable complete responses in heavily pretreated patients with metastatic melanoma using T-cell transfer immunotherapy. Clinical Cancer Research. 17 (13), 4550-4557 (2011).
- Singh, N., Perazzelli, J., Grupp, S. A., Barrett, D. M. Early memory phenotypes drive T cell proliferation in patients with pediatric malignancies. Science Translational Medicine. 8 (320), 320-323 (2016).
- Crompton, J. G., Clever, D., Vizcardo, R., Rao, M., Restifo, N. P. Reprogramming antitumor immunity. Trends of Immunology. 35 (4), 178-185 (2014).
- Takahashi, K., Yamanaka, S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell. 126 (4), 663-676 (2006).
- Vizcardo, R., et al. Regeneration of human tumor antigen-specific T cells from iPSCs derived from mature CD8(+) T cells. Cell Stem Cell. 12 (1), 31-36 (2013).
- Nishimura, T., et al. Generation of rejuvenated antigen-specific T cells by reprogramming to pluripotency and redifferentiation. Cell Stem Cell. 12 (1), 114-126 (2013).
- Takada, K., Kondo, K., Takahama, Y. Generation of Peptides That Promote Positive Selection in the Thymus. Journal of Immunology. 198 (6), 2215-2222 (2017).
- Yamagata, T., Mathis, D., Benoist, C. Self-reactivity in thymic double-positive cells commits cells to a CD8 alpha alpha lineage with characteristics of innate immune cells. Nature Immunology. 5 (6), 597-605 (2004).
- Themeli, M., et al. Generation of tumor-targeted human T lymphocytes from induced pluripotent stem cells for cancer therapy. Nature Biotechnology. 31 (10), 928-933 (2013).
- Serwold, T., Hochedlinger, K., Inlay, M. A., Jaenisch, R., Weissman, I. L. Early TCR expression and aberrant T cell development in mice with endogenous prerearranged T cell receptor genes. Journal of Immunology. 179 (2), 928-938 (2007).
- Lei, F., et al. In vivo programming of tumor antigen-specific T lymphocytes from pluripotent stem cells to promote cancer immunosurveillance. Cancer Research. 71 (14), 4742-4747 (2011).
- Maeda, T., et al. Regeneration of CD8alphabeta T Cells from T-cell-Derived iPSC Imparts Potent Tumor Antigen-Specific Cytotoxicity. Cancer Research. 76 (23), 6839-6850 (2016).
- Serwold, T., et al. T-cell receptor-driven lymphomagenesis in mice derived from a reprogrammed T cell. Proceedings of the National Academy of Sciences of the United States of America. 107 (44), 18939-18943 (2010).
- Vizcardo, R., et al. Generation of Tumor Antigen-Specific iPSC-Derived Thymic Emigrants Using a 3D Thymic Culture System. Cell Reports. 22 (12), 3175-3190 (2018).
- Jenkinson, W., Jenkinson, E., Anderson, G. Preparation of 2-dGuo-treated thymus organ cultures. Journal of Visualized Experiments. (18), (2008).
- Hamazaki, Y., Sekai, M., Minato, N. Medullary thymic epithelial stem cells: role in thymic epithelial cell maintenance and thymic involution. Immunological Reviews. 271 (1), 38-55 (2016).
- Vivier, E., et al. Innate or adaptive immunity? The example of natural killer cells. Science. 331 (6013), 44-49 (2011).
- Rosen, S. D. Ligands for L-selectin: homing, inflammation, and beyond. Annual Review of Immunology. 22, 129-156 (2004).
- Hogquist, K. A., Xing, Y., Hsu, F. C., Shapiro, V. S. T Cell Adolescence: Maturation Events Beyond Positive Selection. Journal of Immunology. 195 (4), 1351-1357 (2015).
- Best, J. A., et al. Transcriptional insights into the CD8(+) T cell response to infection and memory T cell formation. Nature Immunology. 14 (4), 404-412 (2013).
- Schmitz, I., Clayton, L. K., Reinherz, E. L. Gene expression analysis of thymocyte selection in vivo. International Immunology. 15 (10), 1237-1248 (2003).
- Nitta, T., Ohigashi, I., Takahama, Y. The development of T lymphocytes in fetal thymus organ culture. Methods in Molecular Biology. 946, 85-102 (2013).
- Ueno, T., et al. Role for CCR7 ligands in the emigration of newly generated T lymphocytes from the neonatal thymus. Immunity. 16 (2), 205-218 (2002).
- Watanabe, Y., Katsura, Y. Development of T cell receptor alpha beta-bearing T cells in the submersion organ culture of murine fetal thymus at high oxygen concentration. European Journal of Immunology. 23 (1), 200-205 (1993).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены