Method Article
Использование рекомбинантных Fusion белков в платформу Assay флуоресцентные протеазы и их выемка в гель
В этой статье
Резюме
Здесь мы представляем детальную процедуру использования N-терминальный hexahistidine/мальтоза связывающий белок и флуоресцентный белок кварцевое рекомбинантных субстратов, придает поверхности никель Нитрилотриуксусная платформы пробирного недавно разработанных протеазы бисер кислоты магнитные агарозы. Последующие-гель анализ образцов отделены электрофорезом геля натрия Додециловый сульфат полиакриламидных также представлен.
Аннотация
Протеаз являются интенсивно изучали ферментов из-за их важную роль в нескольких биологические пути живых организмов и в патогенезе; Таким образом они являются важным лекарственных препаратов. Мы разработали платформу магнитные агарозы шарик-на основе анализа для расследования протеолитической активности, которая основана на использовании рекомбинантных синтеза белка субстратов. Чтобы продемонстрировать использование этой системы анализа, протокол представлен на примере тип вируса иммунодефицита человека 1 (HIV-1)-протеазы. Введено Пробирная платформы могут быть использованы эффективно в биохимической характеристике протеаз, включая измерений активности фермента в мутагенеза, кинетические, ингибирование или специфика исследования, и это может быть подходящим для высокой пропускной способности Субстрат скрининга или могут быть адаптированы для других протеолитических ферментов.
В этой системе пробирного прикладной субстраты содержат N-терминала hexahistidine (его6) и мальтоза связывания белков (MBP) Теги, расщепление сайтов для табака etch вирус (TEV) и протеаз ВИЧ-1 и C-терминал флуоресцентный белок. Субстрата может производиться эффективно в клетках Escherichia coli и легко очищается с помощью никеля (Ni) - хелатной - покрытая бисером. В ходе анализа протеолитического расщепления шарик придает субстратов приводит к освобождению флуоресцентные расщепления фрагментов, которые могут быть измерены флуориметрия. Кроме того могут быть проанализированы реакции расщепления натрия Додециловый сульфат полиакриламидный гель-электрофорез (SDS-PAGE). Протокол для в гель выемка пробирного компонентов также описано, как частичная выемка флуоресцентных белков позволяет их обнаружения на основе молекулярного веса и флуоресценции.
Введение
Протеолитических ферментов принадлежат к группам наиболее интенсивно исследованных фермента ввиду их важности в метаболических и промышленного применения, а также. Их ключевой роли в вирусных заболеваний, регулирование свертывания крови, рак и сердечно-сосудистой и нейродегенеративные заболевания делает протеаз выдающихся показателей в области лекарственных препаратов. Таким образом подробная характеристика субстратная специфичность и профилирование ингибитор протеазы (PR) интерес стержневые и предпочтительно выполняется быстрое, экономически эффективных и надежных биохимических анализов на1,2, 3.
В настоящее время, подавляющее большинство анализов в пробирке протеазы применяются в области лекарств для составных профилирования являются однородной, флуоресцентный пептид основе и высок объём скрининг (HTS)-совместимые платформы4. Кроме того помечены пептиды подходят не только для библиотеки скрининга, но они также предлагают большие инструменты для определения фермента кинетических параметров выбранной подложки. В других случаях, где маркировка субстрата не возможно, на основе разделения анализов может обеспечить возможное решение для оценки кинетических свойств протеолитических реакций3.
Как правило, в пробирке протеазы анализы основаны на использовании двух типов субстрата: короткие пептиды или всего белки. В тех случаях, где расщепления последовательности коротких пептида недостаточно отражают свойства расщепления, применяются следующие стандартные подходы: i изучение стандартных белка субстратов например окисленных инсулина B-цепи, (ii) тестирование коммерчески доступные субстратов других протеаз, (iii) скрининг синтетических и дневно обозначенные пептид библиотеки, созданные Комбинаториальная химия, или (iv) использование генетических методов, например, биологических дисплей технологии5, 6. Помимо обычных классификации, другие Роман платформы также доступны для субстрата поколения (например, формирование протеома производные пептид библиотек7 или специальные подтипы генетических методов, как рекомбинантной фьюжн на основе белковых субстратов8,9,10,,1112).
Все типы вышеупомянутых субстрата и анализов имеют свои преимущества и ограничения, и в разработке форматов пробирного объединения и/или улучшения преимущества известных платформ до сих пор пользуется спросом. Здесь мы описываем протокол для assay на основе разделения флуоресцентные протеазы, который использует рекомбинантных субстратов. Эти протеины сплавливания состоят из его6 и MBP Теги сливается на сайт управления расщепления ТэВ PR, который сопровождается субстрат последовательность интереса, который непосредственно подключен к C-терминал флуоресцентный белок (FP) (рис. 1A). Клонирование последовательности ДНК кодирования для расщепления сайта интерес в «клонирование кассеты» может осуществляться одной лигирование реакции в плазмиду выражение, который был ранее линеаризованных с эндонуклеазами ограничения.
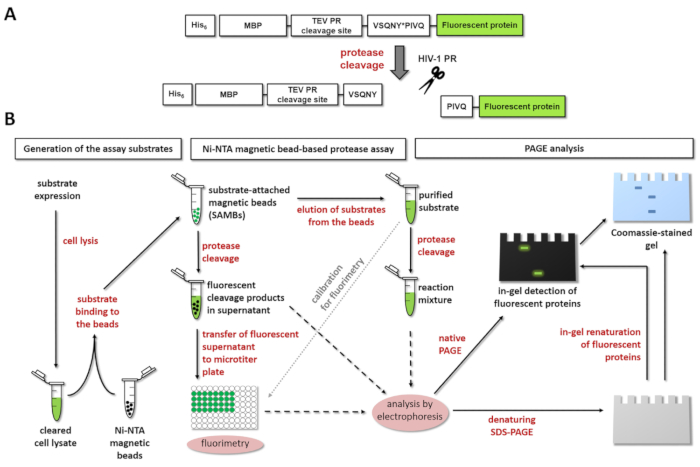
Рисунок 1: Принцип люминесцентные протеазы assay. Показано протеазы (A) схематическое представление флуоресцентные субстрат и его расщепления от вируса иммунодефицита человека типа 1 (HIV-1). Стрелка указывает позицию расщепления в пределах последовательности сайте расщепления матрица/капсид протеаз ВИЧ-1 (VSQNY * PIVQ). (B) люминесцентная субстратов может использоваться для анализа ферментативных реакций, Ni-НТА магнитный шарик-на основе анализа и электрофорезом геля полиакриламида, а также, как показано на схеме рабочего процесса. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Хотя протеолитических анализов с использованием аналогичных рекомбинантных белков, субстраты содержащие тег сродство, сайт протеолитического расщепления и флуоресцентный белок иметь уже были описаны8,9,10, система представленные здесь намеревается интегрировать и совершенствовать на преимущества этих методов. Важным отличием является, что синтез белка субстратов в этой платформе пробирного оснащены ПМБ для повышения растворимости белка13 и содержат расщепления сайт элемента управления для TEV PRs. Кроме того субстраты содержат новое поколение флуоресцентных белков, которые очень стабильны и обладают односегментную форму для предотвращения агрегации субстрата. Помимо ранее опубликованного приложения mTurquoise2 и mApple наплавочные формы14здесь мы также покажем результаты, учитывая с использованием рекомбинантного субстрата, содержащего мономерных Улучшено тег Флуоресцентный желтый флуоресцентный белок (mEYFP). Настоящим мы продемонстрировать совместимость системы с другими флуоресцентных белков и представляют некоторые общие типы результатов, которые могут быть приобретены в assay протеазы.
Рекомбинантных синтез белков выражаются в клетках E. coli BL21(DE3) и используются в качестве подложки для assay в никель Нитрилотриуксусная кислота (Ni-НТА)-покрытием магнитные агарозы шарик придает форму. Продукты расщепления C-терминала будут освобождены от поверхности шарик в надосадке после расщепления протеазы интерес. После разделения супернатант (содержащие энзим и продукты расщепления) от магнитной бусины флюоресценция может быть измерена для определения свойства расщепления фермента. В отличие от ранее описанных методов в системе, представленные здесь, количество субстрата и C-терминала расщепления продуктов являются однозначно количественно основанные на процедуре калибровки подробный субстрата. Система анализа могут быть поддержаны SDS-PAGE анализ образцов; последующих флуоресцентные визуализации в гель может применяться сразу же после электрофореза или выемка в гель nondenatured и денатурированные флуоресцентные компонентов, соответственно14.
Гибкость и структура «клонирование кассеты» позволяют время и экономически эффективного вставки широкий спектр последовательности в конструкцию и, таким образом, способствует генерации субстрата библиотек. Поскольку все шаги пробирного автоматизации - и HTS-совместимые, система может быть особенно привлекательным для, например, протеазы специфика измерения и исследования мутагенеза или это могут быть эффективно использованы для скрининга ингибитор протеазы промышленных и/или разработки противовирусных препаратов, а также.
Кинетические параметры фермента (кошкаk, Km) может определяться развитых на основе разделения assay; Таким образом это может быть подходящим для выполнения отдельных фермента Кинетические измерения, таких как время курс, субстрат зависимых и ингибирование исследования. Это доказывает, что рекомбинантных фьюжн белковых субстратов обеспечивают хорошие альтернативы для часто используемых синтетических пальмитоила субстраты, и из-за их высокой сходство с polyprotein субстратов, они представляют собой естественные фермент субстрат взаимодействия более точно.
протокол
1. поколение плазмид выражение субстрата кодирование
- Линеаризации pDest его6- MBP-FP выражение плазмида с эндонуклеазами ограничения Голд и NheI. Для генерации pDest его6- MBP-FP смотрите Бозоки et al.14.
- Добавить 1500-2000 мкг pDest его6- MBP-FP выражение плазмида, 2 мкл каждого Голд и NheI эндонуклеазами ограничения, 10 мкл 10 x буфер (см. Таблицу материалы) и свободной от нуклеиназы воды (НЗФ) до 100 мкл в пробки microcentrifuge.
- Инкубируйте реакционной смеси при 37 ° C в течение 1 ч.
- 20 мкл 6 x ДНК фиолетовый загрузки красителя в реакционной смеси и отдельные продукты расщепления электрофорезом, используя гель агарозы 1%. Применять 1 kB ДНК лестница в стандартной комплектации.
- Промойте гель 15 мин в 20 мл TAE буфера (40 мм трис, 20 мм уксусной кислоты, 1 мм ЭДТА, рН 8,5) содержащий 20 мкл раствора SYBR зеленый и акцизных полосе линеаризованного плазмида из геля агарозы, используя острым инструментом.
Примечание: При освещающей гель с темно чтение голубой transilluminator (DRBT), линеаризованных pDest его6- MBP-FP плазмида появляется как дискретных, так и яркие группы на около 7-8 КБ. - Очищайте линеаризованного выражение плазмиды от геля фрагмента, используя набор для извлечения геля согласно инструкциям производителя.
- Вставка подложки последовательности в плазмиду выражение линеаризованного pDest его6- MBP-FP.
- Отжиг вперед (FWD передний) и обратный праймеры олигонуклеотида, оптимизированный кодон (REV) E. coli , кодирования для субстрата последовательность интереса.
Примечание: Обожженных праймеров будет окружении сплоченной концы, соответствующий Голд и NheI расщепление эндонуклеазы (рис. 2).- Смесь 150 нг линеаризованного выражение плазмида с 200 нг передний и 200 нг REV олигонуклеотида грунтовки 0,2 мл полимеразной цепной реакции (ПЦР) трубки и отрегулируйте громкость до 17 мкл, добавив НЗФ.
- Инкубируйте смесь при 65 ° C для 2 мин и, затем, при температуре 4 ° C для по крайней мере 2 мин.
- Выполните вставку обожженных праймеров в линеаризованного плазмида, перевязки.
- Добавьте 2 мкл буфера лигаза T4 (10 x) и 1 мкл лигаза T4 для смеси, содержащей линеаризованного плазмида и обожженных праймеров.
- Инкубируйте лигирование смеси на 16 ° C для 16 h.
- Отжиг вперед (FWD передний) и обратный праймеры олигонуклеотида, оптимизированный кодон (REV) E. coli , кодирования для субстрата последовательность интереса.

Рисунок 2 : Праймеры олигонуклеотида кодирования для протеолитического расщепления сайт последовательности. Вперед и назад грунтовки кодировать VSQNY * PIVQ расщепление сайта последовательность ВИЧ-1 пр. После отжига праймеры олигонуклеотида взаимодополняющих, короткие двуцепочечной ДНК содержит липкие концы, соответствовать эндонуклеазами ограничения Голд и NheI. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
- Преобразования 100 мкл BL21(DE3) компетентных клеток по 5 мкл лигирование смеси и распространилась на плиты агара lysogeny бульон (LB), содержащий ампициллина ячейки.
Примечание: Флуоресцентные белки будет в тот же кадр открытом чтения с N-терминальный фьюжн теги только после успешного перевязки. Через несколько дней после преобразования, колоний (содержащие выражение плазмида кодирования для вставленных расщепления сайта интересов) будет показывать видимый флуоресценции или даже без использования DRBT. - Подготовьте фондовой глицерина из изображенных колоний.
- Вымойте дискретных колонии в центрифуге Тюбик 50 мл, содержащие 5 мкл LB носитель, содержащий ампициллина (в конечной концентрации 100 мкг/мл).
- Инкубировать при 37 ° C за 8 ч при постоянно тряски на 220/мин.; затем урожай клетки центрифугированием на 1000 x g 5 мин при комнатной температуре.
- Осторожно приостановить клеток в 1 мл раствора глицерина 80% (разбавляют дистиллированной воды) и 500 мкл 10 мм MgCl2 решения к приостановлению.
- Передача подвеска для замораживания труб и хранить запасы в 70 ° C.
- Проверьте последовательность созданных плазмида секвенирования ДНК.
- Добавьте 10 мкл глицерина запас (подготовлен на шаге 1.7) в 5 мл LB носитель, содержащий 100 мкг/мл ампициллин в 50 мл пластиковых пробирок.
- Инкубировать подвеска при 37 ° C для 16 h при постоянно тряски на 220/мин.; затем урожай клетки центрифугированием в 2000 x g 10 мин при 4 ° C.
- Изолировать плазмида выражение из клеток Пелле, плазмида алкалический комплекта (см. Таблицу материалы) согласно инструкциям изготовителя и использовать очищенные плазмид для секвенирования ДНК.
Примечание: для последовательности, 5'-GATGAAGCCCTGAAAGACGCGCAG-3' (вперед) и 5'-GCAAGGCGATTAAGTTGGGTAACGC-3' праймеры олигонуклеотида (обратный) могут быть использованы.
2. выражение флуоресцентные субстратов
- Подготовьте закваски.
- Добавьте 10 мкл глицерина запас (подготовлен на шаге 1.7) в 5 мл LB носитель, содержащий 100 мкг/мл ампициллин в 50 мл пластиковых пробирок.
- Инкубируйте подвеска при 37 ° C 15 ч при постоянно тряски на 220 об/мин.
- Передача бактериальной культуры (5 мл) до 50 мл свежего LB среды, содержащие 100 мкг/мл ампициллин в стерильную колбу Эрленмейера 500 мл.
- Рост клеток при 37 ° C для поглощения 0,6-0,8 на длине волны 600 Нм, при этом постоянно тряски на 220 об/мин.
Примечание: Если тетрациклинов лечение должна применяться на этапе 2.5, не рекомендуется выращивать клетки для поглощения более 0,6 на 600 Нм. - Добавьте изопропиловый β-D-1-тиогалактопиранозид (IPTG) 1 mM концентрации выпускных побудить выражения протеина.
- Если не применяется для лечения тетрациклин, инкубировать культуры за 3 ч при 37 ° C при постоянно тряски на 220 об/мин и продолжить протокол с шагом 2.6. Если тетрациклинов лечение применяется, по-прежнему протокол с шаги 2.5.1-2.5.3.
Примечание: Некоторые FPs, производимые в клетках E. coli могут иметь больше времени созревания (см. предыдущие работы)1716,; в этих случаях перевод белка может быть дополнительно арестован тетрациклинов лечение, для того чтобы увеличить урожайность флуоресцентные раствора субстрата.- Инкубировать суспензию клеток для 2 ч при 37 ° C при постоянно тряски на 220/мин.; Затем добавляют раствор тетрациклина (в конечной концентрации 200 мкг/мл).
- Инкубации клеточной культуры согласно созревания время флуоресцирующего белка выбора при 37 ° C, непрерывно встряхивания на 220 об/мин.
- Передача 2 x 25 мл культуры для очистки 50 мл пробирок и урожай клетки центрифугированием в 4000 x g 15 мин при 4 ° C.
- Отменить супернатант и хранить бактериальной клетке окатышей на-70 ° C для по крайней мере 1 час.
Примечание: Клетки, содержащие выраженной флуоресцентные субстратов Показать видимые флуоресценции или даже без использования DRBT.
3. клетки нарушения
- Место Пелле замороженных клеток на льду и пусть это оттепель за 15 мин.
- Добавить 2 мл буфера lysis (50 мм NaH2PO4, 300 мм NaCl, 10 мм имидазола, 0,05% 20 анимации, рН 8) гранулы и приостановить клетки.
- Добавьте 10 мкл раствора ингибитор протеазы свежеприготовленный phenylmethanesulfonyl фторид (PMSF) (8.7 мг/мл, растворяется в этиловом спирте) подвеска.
- Добавить 2 мг лизоцима и 20 единиц DNase подвеска и приостановить его.
- Инкубировать подвеска на льду за 15 мин и вихрь он иногда.
- Передача 2 x 1 мл суспензии для 1.5 мл пробирок microcentrifuge и sonicate суспензий на 3 мин, в раундов 10 s sonication и 5 s отдыха.
- Центрифуга для трубы на 10000 x g 20 мин при комнатной температуре; Затем осторожно выньте флуоресцентные супернатант (очищенное бактериальной клетке lysate) из каждой трубки и передать новые microcentrifuge трубы.
Примечание: Очищается лизатов, содержащие флуоресцентные субстрата Показать видимые флуоресценции или даже без использования DRBT и может храниться при температуре 4 ° C на срок до 2 недель. НЕ заморозить ее. Очищенное лизатов могут быть использованы непосредственно для пробоподготовки в assay протеазы (см. раздел 4.1) или также может быть использован для очистки субстрата (см. шаг 4.5.1).
4. Ni-НТА магнитный шарик на основе-протеазы пробирного
Примечание: Благодаря гибкости пробирного платформы, это могут быть оптимизированы для различных типов исследований. По этой причине и из-за разницы в уровень активности ферментов выбор некоторые из параметров пробы (где оно обозначается) не могут быть описаны явно, но должны быть оптимизированы для индивидуальных целей и опытно-конструкторских. Как руководство параметры некоторых типов исследований, обозначаются на конкретные шаги.
- Подготовка образца
- Поколение субстрата придают магнитные бусы
- Место закрытой 2 мл низким белка привязки (см. Таблицу материалы) microcentrifuge трубка содержащий новый или восстановленный (см. раздел 4.7) Ni-НТА магнитные агарозы бусины в магнитных частиц концентратор (ПДК).
Примечание: Прикладной бусины подвеска сумма устанавливается на основании на экспериментальный дизайн. Мы использовали 1 мл раствора магнитный шарик (5%, v/v) в каждом эксперименте. - Бисер может прилипнуть к стене или в крышке пробки microcentrifuge; Таким образом Переверните MPC в каждом направлении, чтобы убедиться, что все из бисера собираются.
- Супернатант снимите и выбросьте его.
- Бисер для очистки буфера lysis.
- Добавление 1.8 мл буфера lysis бисер и удаление закрытых трубки от MPC.
- Приостановите бисер в трубе, встряхивания и/или поворота трубы вверх вниз, до тех пор, пока образец является полностью однородным.
- Установите трубку обратно в MPC и переверните его собирать шарики.
- Откройте трубки и удалить супернатант.
- Добавить 1,0-1,8 мл очищенной lysate (подготовленных на шаге 3.7) бисер и снять трубку от MPC.
- Переверните закрытой трубку до тех пор, пока бисер полностью однородной и медленно вращать трубу, ротатор при комнатной температуре за 30 мин.
- Поместите его в MPC и удалить свободные lysate клетки из бисера и из крышки.
Примечание: Очищается lysate клетки могут быть отброшены или сохранить для дальнейшего использования (см. Примечание после шага 3.7). - Добавить 1% 20 (рН 7) анимации в субстрат придают магнитные бусы (SAMBs).
Примечание: SAMBs Показать видимые флуоресценции или даже без использования DRBT.
- Место закрытой 2 мл низким белка привязки (см. Таблицу материалы) microcentrifuge трубка содержащий новый или восстановленный (см. раздел 4.7) Ni-НТА магнитные агарозы бусины в магнитных частиц концентратор (ПДК).
- Мойка SAMBs
- Положите трубку с САМБ подвеска в MPC и удалить супернатант.
- Мыть SAMBs 3 x с каждого буфера: i) 1.8 мл 1% Tween-20 (рН 7); II) 1.8 мл Отмывающий буфер (50 мм NaH2PO4, 300 мм NaCl, 5 мм имидазола, 0,05% 20 анимации, рН 7); III) 1.8 мл расщепления буфера (50 мм NaH2PO4, 300 мм NaCl, 0,05% 20 анимации, pH 7).
Примечание: Для стирки процедуры, смотрите шаг 4.1.1.4. Расщепление буфера могут быть изменены согласно экспериментальной потребности, но мы рекомендуем вам проверить руководство Ni-НТА магнитные бусы для определения совместимости.
- Подготовка САМБ Стоковый раствор
- Добавьте буфер расщепления промывают SAMBs для создания САМБ Стоковый раствор.
Примечание: После добавления буфера, не поколебать или поверните трубку вверх вниз. Объем буфера расщепления зависит от индивидуальных экспериментальный дизайн и должны быть рассчитаны на количество магнитных шариков (см. шаг 4.1.1.1) и на томах, которые будут использоваться в шаге 4.1.4.2. Для 2 мл пробирок, прикладной объем-до 1900 мкл (см. таблицу 1). Рекомендуется магнитный шарик плотность САМБ Стоковый раствор составляет 2% - 10% (v/v).Тип исследования Объем буфера расщепления (мкл) S-зависимых измерений (рис. 4) 1600 Время курс измерения (рис 5A) 1600 Ингибирование исследование (рисунок 5B) 1900 исследование зависимости pH (рис 6) 1400
Таблица 1: Объем расщепления буфера, используемого для подготовки САМБ Стоковый раствор в различных типах измерений. - Удаление закрытых трубки из MPC. САМБА акций решение использовать сразу или хранить при 4 ° C до 24 ч.
- Добавьте буфер расщепления промывают SAMBs для создания САМБ Стоковый раствор.
- Поколение образцов с использованием САМБ Стоковый раствор
Примечание: Подробности этой части assay сильно зависит от индивидуального экспериментальный дизайн (образец типы представлены в таблице 2).Тип образца Примечания Образец реакции (R) -используется для оценки свойства расщепления
-содержит фермент и субстрата в расщеплении буфераСубстрат пустой образец (B) -используется для оценки спонтанное субстрата диссоциации (см. шаг 4.6.2)
-содержит только субстрата в буфере расщепленияПример элемента управления субстрата (C) -для detemining концентрации субстрата (см. шаг 4.6.3)
-содержит только субстрата в Элюирующий буфер
Таблица 2: Пример типы пробирного магнитный шарик на основе-протеазы Ni-НТА.- Готовить 2 мл низкой белка привязки microcentrifuge трубок для образцов.
Примечание: Другие низкопротеиновое привязки пластиковые изделия может также использоваться. Используйте трубы круглого или плоским дном для обеспечения свободного передвижения SAMBs. Увидите рекомендуемое количество труб в таблице 3.Тип исследования R B C S-зависимых измерений (рис. 4) 5 5 2 Время курс измерения (рис 5A) 6 6 2 Ингибирование исследование (рисунок 5B) 7 7 1 исследование зависимости pH (рис 6) 5 5 1
Таблица 3: Количество требуемых 2 мл microcentrifuge трубок для каждого типа образца показали исследования. - Приостановить САМБ Стоковый раствор до однородности и передавать количество субстрата анализируемым в реакциях сразу в образце флаконы. Рекомендуемый объем 25-300 мкл, но это необходимо установить согласно индивидуальным экспериментальный дизайн (Таблица 4).
Примечание: Проверьте, если все SAMBs были измерены в нижней части трубы. SAMBs может прилипнуть к стенкам трубы, который может исказить результаты анализа. Если разные тома должны оцениваться последовательно, запустите aliquoting с высоким объемом и стараются свести к минимуму изменения пипетки и/или Пипетка советы.Тип исследования R B C S-зависимых измерений (рис. 4) 25 – 50 – 100 – 150 – 250 25 – 50 – 100 – 150 – 250 25 Время курс измерения (рис 5A) 25 25 25 Ингибирование исследование (рисунок 5B) 120 120 120 исследование зависимости pH (рис 6) 100 100 100
Таблица 4: Объем раствора САМБ измеряется в образец флаконов каждого образца типа в показали исследования. - Поместите образец пробирки, содержащие aliquoted подвеска Самба в MPC и слегка двигаться MPC взад и вперед.
- Тщательно удалить супернатант из SAMBs и отменить его.
- Удаление трубы от MPC и добавьте вычисляемый объем буфера реакции (расщепление или Элюирующий буфер [100 мм ЭДТА, 0,05% 20 анимации, pH 7]) тщательно SAMBs.
Примечание: Вычислите объем буфера согласно индивидуальным экспериментальный дизайн (Таблица 5). Для 2 мл пробирок Рекомендуемый конечный объем реакционной смеси (объем буфера реакции будут добавлены в этот шаг + объем раствора будут добавлены в шаге 4.2.3) является 50-150 мкл. Убедитесь, что все SAMBs промывают в буфере добавлен. Элюирующий буфер используется вместо расщепления буфера в случаях субстрата управления (C) образцов. Для ингибирования исследования добавляемый на этом этапе рекомендуется ингибитор выбора.Тип исследования Объем буфера реакции (мкл) S-зависимых измерений (рис. 4) Расщепление 68 мкл буфера Время курс измерения (рис 5A) Расщепление 68 мкл буфера Ингибирование исследование (рисунок 5B) 67.3 мкл буфера декольте + 0,7 мкл ингибитор складе решения * исследование зависимости pH (рис 6) Расщепление 69,5 мкл буфера **
Таблица 5: объем буфера реакции в показали исследования. * Ампренавира была решена в диметилсульфоксида; Ампренавир фондовых решения (начиная от 1 Нм до концентрации 1 мкм) были применены для тормозной исследования (см. Рисунок 5B). ** PH буфера прикладной расщепления, варьировались от pH 6.0-8.5. - Закройте крышки трубы. В настоящее время образцы готовы для assay.
Примечание: Образцы можно хранить при 4 ° C до 24 часов, но хранения применяется, только если Стоковый раствор САМБ был использован сразу же после подготовки (см. шаг 4.1.3.2).
- Готовить 2 мл низкой белка привязки microcentrifuge трубок для образцов.
- Поколение субстрата придают магнитные бусы
- Начало протеолитических реакций
- Приготовляют раствор протеолитического фермента экспериментальной нужд.
Примечание: Рекомендуется использовать буфер расщепления распустить или разбавлять фермент. Протоколы для очистки ВИЧ-114 и18 ТРВ PRs были опубликованы ранее. - Установите греющую агитации ставка (600 об/мин) и температуры инкубации (Таблица 6).
Тип исследования Инкубация температура (° C) S-зависимых измерений (рис. 4) 37 Время курс измерения (рис 5A) 37 Ингибирование исследование (рисунок 5B) 37 исследование зависимости pH (рис 6) 30
Таблица 6: температура инкубации, применяемых в исследовании различных типов. Для PR ВИЧ-1 37 ° C рекомендуется, хотя 30 ° C рекомендуется для TEV PR. - Добавьте решение фермента в реакции образцы для инициализации протеолитических реакций.
Примечание: В случае пустого субстрата (B) и C образцы, добавьте расщепления (фермент буферу) и Элюирующий буфер, соответственно. Объем-рассчитывается в соответствии с индивидуальными потребностями экспериментальной (Таблица 7). Для 2 мл пробирок Рекомендуемый конечный объем реакционной смеси (объем буфера реакции, добавленной на шаге 4.1.4.5 + объем раствора будут добавлены в этот шаг) составляет 50-150 мкл.Тип исследования Объем буфера/Элюирующий буфер фермента в решение/фермента (мкл) S-зависимых измерений (рис. 4) 2 Время курс измерения (рис 5A) 2 Ингибирование исследование (рисунок 5B) 2 исследование зависимости pH (рис 6) 0.5
Таблица 7: Объем фермента решения/фермента буфера/Элюирующий буфер добавляются во время инициализации образцов в случае исследования показали. - Пошевелить вверх шарики тщательно осторожно передвигая трубы и поместите трубки непосредственно в уже пожимая греющую.
Примечание: Прекращение ручной выборки (см. раздел 4.3) занимает больше времени, чем возбуждение; Таким образом зарегистрированные задержки по крайней мере 2 мин рекомендуется между посвящений реакции. - Проинкубируйте образцы согласно экспериментальный дизайн (Таблица 8).
Тип исследования Инкубации время (мин) S-зависимых измерений (рис. 4A) 7 S-зависимых измерений (рис. 4B) 120 Время курс измерения (рис 5A) 0 – 2,5 – 5 – 10 – 15 – 20 Ингибирование исследование (рисунок 5B) 10 исследование зависимости pH (рис 6) 60
Таблица 8: Инкубации раз применяется для образцов различных измерений.
- Приготовляют раствор протеолитического фермента экспериментальной нужд.
- Termination протеолитических реакций
- Взять образец из шейкер, 30 s перед конце инкубации и спина его незамедлительно.
- Поместите трубку на ПДК, дать постоять 15 s, и слегка двигаться MPC взад и вперед.
- Откройте крышку и передавать супернатант внимательно плиту или новой трубки.
Примечание: Не прикасайтесь концентрированной бусы с кончика пипетки. Собранные супернатант C образцов и образцов R с высокой степенью расщепление может показать видимые флуоресценции или даже без использования DRBT.
- Флуоресцентный обнаружение
- 2 x 30 мкл отдельный образец supernatants передать черный половине области микроплиты.
- Измерьте флуоресценции, используя соответствующие фильтры возбуждения и выбросов.
Примечание: Измерения основных флуоресценции расщепления буфер и Элюирующий буфер, а также. Фильтр комбинации нужно выбираться на основе измеренных флуоресцентного белка (Таблица 9).Флуоресцентный белок Возбуждения фильтры (Нм) Фильтры выбросов (Нм) mTurqiouse2 355/40 460/25 mEYFP 544/15 590/10 МАПЛ 544/15 590/10
Таблица 9: Возбуждения и выбросов фильтры используется для выявления различных флуоресцентных белков.
- Калибровка
Примечание: Для создания калибровочных кривых в шаге 4.6.1, значения интенсивности флуоресценции, декольте - или Элюирующий буфера решена очищенный субстратов в различных концентрациях должны быть измерены.- Очищайте флуоресцентные субстратов.
Примечание: Для очистки, SAMBs субстрат пустой образцов (B) после того, как assay протеазы могут быть собраны или новый САМБ подвеска может также быть подготовлен (см. разделы 4.1.1 и 4.1.2).- Поместите трубки с SAMBs, приостановлено в 1 мл буфера расщепления (2% - 10%; v/v) для MPC и собирать магнитные бусы, повернув MPC вверх вниз в каждом направлении.
- Откройте трубки и удалите расщепления буфера, как из трубки и крышку.
- Снять трубку от MPC и 400-600 мкл буфера к SAMBs.
- Медленно поверните закрытая трубка с ротатор при комнатной температуре в течение 5 мин.
- Поместите трубку на ПДК и собирать бусы, повернув MPC вверх вниз.
- Удалить супернатант, содержащего очищенный нетронутыми флуоресцентные субстрата (элюата) и передача его в новой низким белка привязки microcentrifuge трубки.
Примечание: Элюата показывает ясно видны флуоресценции или даже без использования DRBT.
- Выполнение параллельных буфера обмена с помощью двух устройств ультрафильтрации 0,5 мл 10K.
- Измерьте половину объем подготовленных элюата (200-300 мкл) в каждом ультрафильтрации устройство.
- После на каждом шаге центрифугирования, разбавьте концентрированный элюата в первой и второй ультрафильтрации устройства Элюирующий буфер и расщепление буфера, соответственно.
- После восстановления Отрегулируйте решена в различные буферы на том же, между 120-200 мкл концентрированного образцы.
Примечание: Теперь содержание белка расщепления субстрата решена буфера идентично Элюирующий буфер решена субстрата; Таким образом это не необходимо определить содержание последний на шаге 4.5.3, протеином, если метод, используемый для измерения концентрации белка мешает с ЭДТА.
- Определить содержание белка субстратов распущен либо в расщепление или Элюирующий буфер путем измерения поглощения в 280 Нм.
Примечание: Другие методы (например, Брэдфорд или bicinchoninic кислоты (BCA) анализов) может также использоваться для измерения концентрации белка, но возможных помех с ЭДТА (присутствует в Элюирующий буфер) или поглощения флуоресцентные субстрат должен быть рассмотрены. Содержание белка первоначальный раствора субстрата в шаге 4.5.4 рекомендуется между 0,4-2,0 мг/мл для того, чтобы генерировать калибровки кривой в соответствующий диапазон. Смотрите таблицу 10 коэффициентами вымирания.Субстрат Молекулярная масса
(Да)Коэффициент вымирания
(M-1 см-1, в 280 Нм измеряется в воде)Его6- MBP-VSQNY * PIVQ-mTurquoise2 72101.7 96845 Его6- MBP-KARVL * AEAM-mTurquoise2 72042.7 95355 Его6- MBP-VSQNY * PIVQ-mEYFP 72367.1 94325 Его6- MBP-VSQNY * PIVQ-mApple 72145.9 105200
Таблица 10: молекулярным весом и коэффициентами вымирания различных рекомбинантных флуоресцентные фьюжн белковых субстратов. - Подготовьте двойной последовательный разрежения в по крайней мере восемь шагов, как от элюции -, так и от расщепления буфера решена субстрата решений, используя элюции или расщепление буфер для разведения, соответственно.
- Передать 30 мкл каждой точки разбавления черный половине области микроплиты.
- Измерения флуоресценции с fluorimeter, с помощью параметра применяется в шаге 4.4.2.
Примечание: Измерения основных флуоресценции расщепления и Элюирующий буфер.
- Очищайте флуоресцентные субстратов.
- Оценка assay
- Участок калибровочных кривых.
- Рассчитайте концентрацию (в мм) очищенного субстрата решений (в шаге 4.5.4), основанный на содержание белка, определяется в шаге 4.5.3.
- Исправьте значения интенсивности относительной флуоресцирования (РФС) точек серийный разрежения, основные ценности РФС прикладной разрежения буфера (расщепление буфер или Элюирующий буфер).
- Участок скорректированные значения РФС против Молярная концентрация декольте - или Элюирующий буфера решена очищенный субстратов и линейной регрессии (силы перехвата до нуля).
Примечание: Высокое значение R2 (˃0.97) означает хорошее линейная корреляция между флуоресценции и концентрация флуоресцентный белок. В этом случае наклон линии регрессии может использоваться для оценки концентрации пробирного компонентов исследуемого диапазона в шагах 4.6.2 и 4.6.3. Экспериментальной ошибки и точки распространения данных могут влиять на надежность калибровки; Таким образом графической оценки может осуществляться с помощью масштабирования графиков (как показано на рис. 3), чтобы проверить ли R2 и склон значения зависят от данных.
- Рассчитайте количество C-терминал флуоресцентные расщепление продукта в образцах реакции.
- Исправьте значения РФС каждого образца R с РФС значениями соответствующего образца B.
- Рассчитать концентрации продуктов расщепления (в мм) в образцах реакции путем деления исправленные значения РФС по склону на основе декольте буфера калибровки кривой (см. шаг 4.6.1.3).
- Вычислите прикладной субстрата концентрации в образцах реакции.
- Исправьте значения РФС C образца с РФС значение основных Элюирующий буфер.
- Рассчитать концентрацию eluted субстрата (в мм) в supernatants образцов C, разделив их исправленные значения РФС по склону на основе Элюирующий буфер калибровки кривой (см. шаг 4.6.1.3).
- Определение концентрации субстрата (в мм) САМБ Стоковый раствор, используемый для создания образцов шаге 4.1.4.2, на основе следующего уравнения:
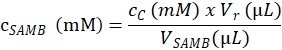
CСАМБ здесь, Молярная концентрация Стоковый раствор САМБ, подготовлен раздел 4.1.3; cC – Молярная концентрация eluted субстрата в образце C, рассчитанные на шаге 4.6.3.3; Vr является объем реакционной смеси, созданный путем добавления в буфер реакции на шаге 4.1.4.5 и фермента буфера в шаге 4.2.3.; и VСАМБ объем САМБ Стоковый раствор в образце C (шаг 4.1.4.2). - Вычислите Молярная концентрация субстрата в каждой пробе R, основанный на Молярная концентрация раствора самба акций (в мм) по объему (в мкл) измеряется в каждую пробирку образца реакции на шаге 4.1.4.2.
- Выполните обработку данных.
Примечание: Анализ данных зависит от цели эксперимента. Видео показывает пример для обработки данных субстрат зависимых кинетические исследования на ВИЧ-1 PR с помощью его6- MBP-VSQNY * PIVQ-mTurquoise2 субстрата. Начальная скорость значения рассчитываются от количество фрагментов расщепления C-терминала и заговор против концентрации прикладной субстрата. Кинетические параметры определяются Михаэлиса-Menten нелинейных регрессионного анализа.
- Участок калибровочных кривых.
- Утилизация магнитные бусы
Примечание: После выполнения assay, магнитные агарозы бусины можно собраны и переработаны.- Собирать используются магнитные бусы с ПДК и удалить супернатант.
- Мыть бусины с 1.8 мл следующих буферов в заданном порядке: регенерации буфера A (0,05% 20 анимации, 0.5 M NaOH), регенерации буфера B (0,05% 20 анимации), регенерации буфера C (0,05% Tween-20, 100 мм ЭДТА, pH 8), регенерации буфера B, регенерации буфера D ( 0,05% анимации 20, 100 мм NiSO4, pH 8), регенерации буфера B и регенерации буфера E (0,5 анимации 20%, 30% этиловом спирте, pH 7).
Примечание: Для стирки процедуры, смотрите шаг 4.1.1.4.
- Мыть бусины с 1.8 мл следующих буферов в заданном порядке: регенерации буфера A (0,05% 20 анимации, 0.5 M NaOH), регенерации буфера B (0,05% 20 анимации), регенерации буфера C (0,05% Tween-20, 100 мм ЭДТА, pH 8), регенерации буфера B, регенерации буфера D ( 0,05% анимации 20, 100 мм NiSO4, pH 8), регенерации буфера B и регенерации буфера E (0,5 анимации 20%, 30% этиловом спирте, pH 7).
- Сохранять восстановленный бусины в буфере E регенерации при 4 ° C.
- Собирать используются магнитные бусы с ПДК и удалить супернатант.
5. страница анализ
-
Подготовка образца
Примечание: После выполнения магнитный шарик-на основе анализа Ni-НТА, пробирного supernatants могут быть проанализированы на странице. В этом случае пропустите шаги 5.1.1 и 5.1.2. Однако это также можно анализировать решение очищенный флуоресцентные субстратов и/или их фрагменты расщепления после переваривания-решение с протеазы интерес. В этом случае продолжить протокол с шагом 5.1.1.- Приготовляют раствор очищенной флуоресцентные субстрата согласно шаг 4.5.1.
- Выполните в решение пищеварение.
- Обмен Элюирующий буфер с буфером расщепления в 0,5 мл 10K ультрафильтрации устройство и Алиготе образцов переваривается в 1,5 мл пробирок microcentrifuge.
Примечание: для анализа страницы, мы aliquoted 68 мкл каждого субстрата, но количество образцов труб и объем раствора субстрата в aliquoted могут быть оптимизированы согласно индивидуальным экспериментальный дизайн. - Фермент решение добавьте образцы.
Примечание: Для анализа страницы, мы применили 2 мкл PR ВИЧ-1, подготовленный, как описано в14Бозоки et al., но объем может быть оптимизированы в соответствии отдельных экспериментальных дизайн. Рекомендуется использовать буфер расщепления распустить или разбавлять фермент. - Проинкубируйте образцы согласно экспериментальный дизайн.
Примечание: Для анализа страницы, мы инкубировали реакционную смесь для 45 минут при 37 ° C, но время инкубации и температуры должны быть установлены согласно экспериментальный дизайн. - Прекратить реакции, выполнив шаг 5.1.3.
- Обмен Элюирующий буфер с буфером расщепления в 0,5 мл 10K ультрафильтрации устройство и Алиготе образцов переваривается в 1,5 мл пробирок microcentrifuge.
- Подготовка образца для страницы.
Примечание: Люминесцентные субстрат содержащих образцы могут быть подготовлены для страницы nondenaturing или денатурируя методом. Для использования nondenaturing или денатурируя условия выполните шаг 5.1.3.1 или 5.1.3.2, соответственно.- Подготовить образец nondenatured: Смешайте 30 мкл пример с 6 мкл 6 x nondenaturing буфер образца загрузки (300 мм трис, 20% глицерина, 0,05% бромфеноловый синий, pH 6.8).
- Подготовить образец денатурированного: Смешайте 30 мкл пример с 6 мкл 6 x денатурируя буфер образца загрузки (300 мм трис, 20% глицерина, 0,05% бромфеноловый синий, 12% SDS, 100 мм β-меркаптоэтанол, pH 6.8) и тепло образцы на 95 ° C в течение 10 мин.
-
Анализ SDS-PAGE
Примечание: При необходимости, если только nondenatured (подготовленные в шаг 5.1.3.1) пробы должны быть проанализированы, родной страница может также быть выполнена. В этом случае пропустите раздел 5.3.- Подготовка геля SDS-полиакриламид (использование отделяя 14% и 4% штабелируя гель) и заполнить бак с буфер электрофореза (2,5 мм трис, 19.2 мм глицин, 0,01% SDS).
- Добавьте образцы (подготовленных на шаге 5.1.3.1 или 5.1.3.2) скважин геля полиакриламида и провести электрофорез на 120 V напряжения.
- Извлеките кассету гель от выполняемый модуль и место в бак стиральной гель.
Примечание: Nondenatured образцы уже видны в геле, даже невооруженным глазом или с DRBT.
-
Выемка в гель и обнаружение флуоресцентных белков
Примечание: Чтобы обнаружить флуоресцентных белков в денатурированном образцов (подготовленных на шаге 5.1.3.2) на DRBT, SDS необходимо быть вымываются из геля, чтобы частично renature белки.- Добавить ~ 100 мл дистиллированной воды в гель и промойте гель по крайней мере за 30 минут.
Примечание: Для улучшения удаления SDS, замените воду каждые 10 минут, или прополоскать до 60 мин. - Визуализируйте флуоресцентных белков с помощью DRBT, или УФ изображений.
- Добавить ~ 100 мл дистиллированной воды в гель и промойте гель по крайней мере за 30 минут.
-
Обычные Окрашивание Кумасси геля
- Пятно гель с Кумасси синим краситель для визуализации nonfluorescent белков.
Результаты
На рисунке 1A показана Схематическая структура субстрата представитель флуоресцентные рекомбинантных белков, которые могут быть обработаны ВИЧ-1 PR на сайте последовательности его конкретных расщепления. Рисунок 1B представляет производства субстрата и их возможного применения в протеазы анализов, включая Ni-НТА магнитный шарик-на основе анализа и/или страницы.
Для получения достоверных данных по флуориметрия, процедура калибровки не требуется, чтобы определить количество флуоресцентные субстратов и продукты расщепления. Для этого значения интенсивности флуоресценции различных субстратов в условиях различных буфера должны быть измерены и нужно быть соотнесена их концентрации в диапазоне Оксиметрический анализ концентрации (рис. 3). Склон значения калибровочных кривых могут применяться для определения сумм субстратов и продуктов расщепления образцов. На склонах калибровочных кривых независимо от последовательности сайте расщепления, вставляется в субстратов (Таблица 11) и потенциально могут быть использованы для серии субстратов, сливается с того же типа флуоресцентный белок. Увеличить в графиках показываются для всех линейных регрессий, чтобы увеличить нижний диапазоны концентраций также (рис. 3). Важно отметить, что калибровка должна выполняться осторожно, потому что правильное распределение точек данных необходима для надежной калибровки. По этой причине двоякой серийный разрежения применяется подготовить образцы для калибровки, поскольку R значение2 указывает на хорошее соотношение между концентрацией флуоресцентный белок и флуоресценции только если достаточное количество точек данных были использованы для покрытия всего концентрация диапазон. Кроме того экспериментальной ошибки может сильно повлиять на точность калибровки; Таким образом графической оценки линии регрессии может быть также необходимо.
Целый ряд ферментных измерений может осуществляться протеазы assay, включая изучение эффекта концентрации субстрата на скорости реакции (рис. 4A). Нелинейной регрессии данные могут использоваться для определения фермента кинетические параметры (например, vМакс и Km). Недостаточно бусины подвеска и дисперсии и прекращение неправильная реакция может вызвать субоптимальные результаты (рис. 4B), которые не пригодны для расчета надежных фермента кинетическая значений.
Зависимость от формирования продукта на время может определяться пробирного (Рисунок 5A) (например, при оптимизации параметров реакции расщепления). Активность фермента в присутствии ингибиторов может также быть расследованы (Рисунок 5B) для определения концентрации активных ферментов и тормозящий константа. Используя ту же методологию, эффекты других ингибиторов может также быть экранируется assay.
Протеазы assay полезна при изучении воздействия рН на активность ферментов, а также. Рисунок 6A представляет зависимость активности ферментов на рН на примере ТэВ PR, который имеет широкий оптимальный рН (рН 6-9). Если учился рН зависимость активности ферментов (или ферментов, с кислой рН оптимум необходимо измерить), это необходимо учитывать, что сродство привязки рекомбинантных субстратов для бисера может быть ограничено в слегка кислой рН. Повышенные диссоциации подложек из бисера (Рисунок 6B) может привести к искажению результатов анализа. Для того, чтобы рассмотреть диссоциации спонтанное субстрат из бисера, значения измеренных образцов реакции необходимо устранить те B образцов.
Рисунок 7 показывает, что nondenatured флуоресцентные белки могут быть дифференцированы в геле, основанный на их цвета, используя синий свет просвечивания (Рисунок 7а). При необходимости определения молекулярным весом субстратов/расщепление фрагментов, денатурации условия могут также использоваться для пробоподготовки, потому что флуоресцентные белки могут быть частично renatured в гель и может быть обнаружено при УФ освещения (Рис. 7B) или Кумасси, окрашивание (рис. 7 c). Если анализируются образцы R, только продукты расщепления C-терминала являются видимыми (рис. 7 c), в то время как фрагменты расщепления N-стержня и uncleaved субстратов остаются прикрепленными к бисер. Иногда белки могут быть частично денатурированный несмотря на использование nondenaturing условия (рис. 7 c), и хотя nondenatured белки более обильные, денатурированные формы обнаруживаются также в образце. Это явление не влияет на обнаружение протеолитического расщепления, но необходимо учитывать в случае количественных денситометрии nondenatured образцов.
Хотя подробное описание отображается только для 2 мл трубки основанные assay, assay может быть адаптирована для 96-луночных пластины-системы на базе (рис. 8), которая уже была успешно опробована в нашей лаборатории (не показан). Формат плиты адаптированных 96-луночных полностью совместим с Флуориметрическое и электрофоретического анализа, а также, и также полученные данные могут оцениваться на основе методов, описанных в данном документе.
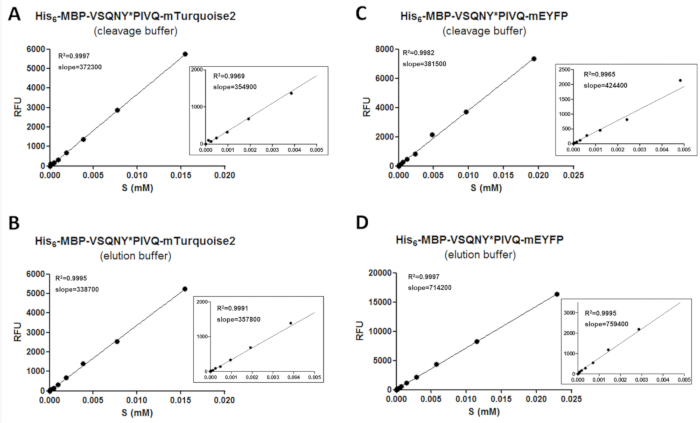
Рисунок 3 : Калибровка кривых. Представитель субстрата калибровочных кривых продемонстрированы на примере двух рекомбинантных субстратов, сливается с другой C-терминал флуоресцентные метки: (A и B) его6- MBP-VSQNY * PIVQ-mTurquoise2 (иC D ) Его6- MBP-VSQNY * PIVQ-mEYFP. Также показано, что масштаб в цифры представляют собой линейную регрессию точек данных в 0-0,005 мм диапазон концентраций субстрата. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
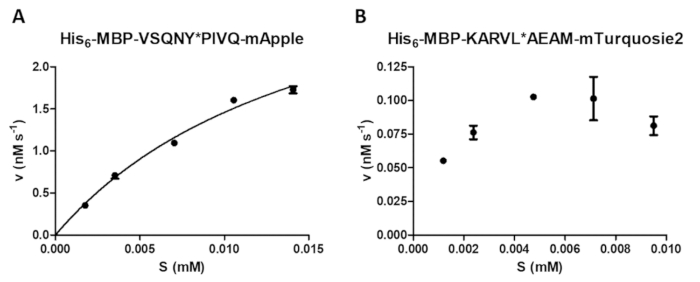
Рисунок 4 : Определение кинетических параметров фермента. Субстрат зависимых Кинетические измерения выполнялись ВИЧ-1 PR (в окончательном активные концентрации 41,2 Нм). Начальная скорость значения были заговоре против концентрации субстрата и был выполнен анализ Михаэлиса-Menten нелинейной регрессии. Планки погрешностей представляют SD (n = 2). (A) A представитель оптимальный результат показан с примером его6- MBP-VSQNY * PIVQ-mApple фьюжн белкового субстрата. (B) представитель неоптимальный результат также показан для его6- MBP-KARVL * AEAM-mTurquoise2 субстрата, где установление надлежащего субстрата концентрации был проблематичным из-за недостаточной гомогенизации САМБ Стоковый раствор , в то время как относительно высокие ошибки были вызваны неправильной реакцией прекращение. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
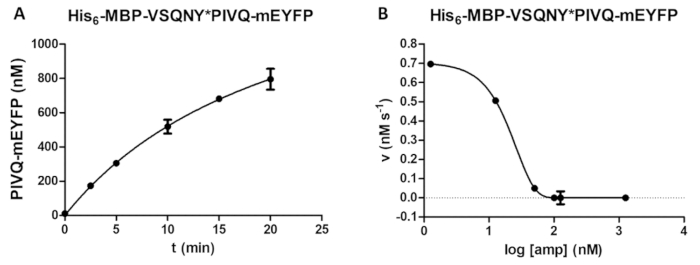
Рисунок 5 : Исследование-курс и тормозящий. (A) Его 6- MBP-VSQNY * PIVQ-mEYFP рекомбинантных фьюжн белкового субстрата (в конечной концентрации 0.00326 мм) был расщепляется на ВИЧ-1 PR (в окончательном активные концентрации 41,2 Нм), и выпуск люминесцентных PIVQ-mEYFP протеолитической фрагментов измерялась в анализ времени курс. Измерения проводились в пяти различных временных точках. Планки погрешностей представляют SD (n = 2). (B) его6- MBP-VSQNY * PIVQ-mEYFP был использован как субстрат (на 0,0015 мм) для определения тормозящий эффект ампренавира на активность PR ВИЧ-1 (при общей концентрации 163,8 Нм). Печать данных, половины максимального ингибирующего концентрации (IC50) может быть оценена и концентрация активных ферментов (конечная концентрация активных 41,2 Нм) из PR прикладной ВИЧ-1 может также рассчитаны на ингибирование кривой. Планки погрешностей представляют SD (n = 3). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
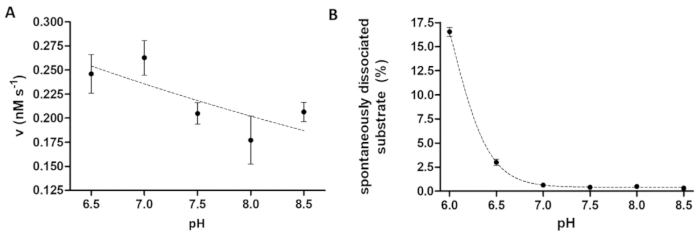
Рисунок 6 : Изучение зависимость активности ферментов и спонтанное субстрата диссоциации по тел. (A) его6- MBP-VSQNY * PIVQ-mTurquoise2 субстрата (в 0,033 мм) был использован для измерения активности фермента ТэВ PR (в окончательной общей концентрации 91.42 Нм) в расщеплении буфером, установленным на различных рН, между спектр 6.5-8.5. Планки погрешностей представляют SD (n = 2). Диаграмме данные были ранее опубликованы14. (B), основываясь на значениях относительной интенсивности флуоресценции субстрата пустых проб, спонтанное диссоциации его6- MBP-VSQNY * субстрата (0,033 мм) PIVQ-mTurquoise2 от магнитной бусины было изучено с помощью расщепления буфера с различных рН, между 6.0-8.5. Диаграмме данные были ранее опубликованы14. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
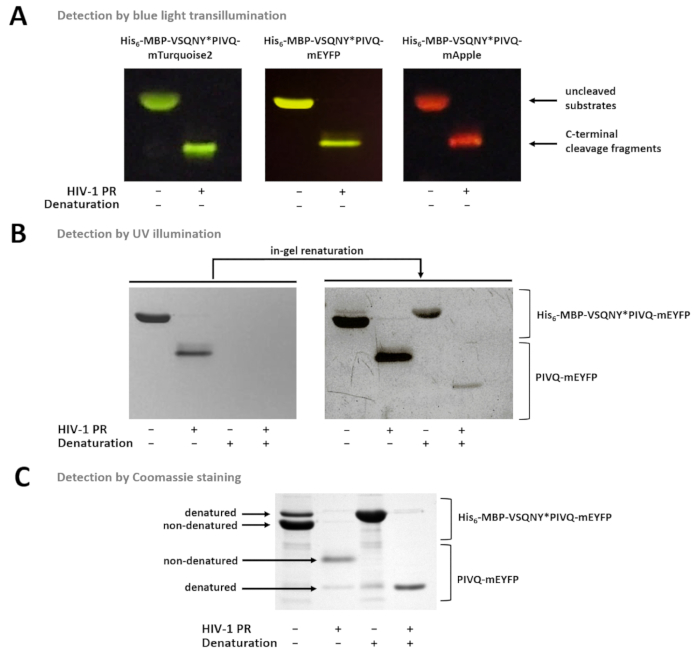
Рисунок 7 : Обнаружение белков в гель различными методами. (A) Uncleaved и ВИЧ-1 PR-переваривается синтеза белка субстраты после nondenaturing пробоподготовки были визуализированное синий свет просвечивания после SDS-PAGE. Реакции расщепления была исполнена пищеварение-решение. (B) сразу же после страницы, только nondenatured белки могут быть обнаружены в гель УФ освещением, после удаления SDS, ранее денатурированного флуоресцентные белки стали частично renatured и обнаружению. Образцы были подготовлены supernatants магнитный шарик-на основе анализа Ni-НТА. (C) Окрашивание Кумасси может также использоваться для обнаружения протеина, после ренатурация в гель. SDS-настоящее в гель Май вызывают частичное денатурация белка родной, но в родной образцов, nondenatured формы более обильные. Образцы были подготовлены supernatants магнитный шарик-на основе анализа Ni-НТА. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 8 : 96-луночных плиты на основе адаптации платформы пробирного. (A) assay может выполняться не только в 2 мл пробирок, но в лунках 96-луночных плиты, а также. Здесь мы покажем схематическое представление для приложения анализа для изучения специфика фиктивные протеаз, используя серии флуоресцентные субстратов, которые могут содержать одичал тип (wt) или мутировавших (mut-1-Мут-4) расщепление сайт последовательности. Для обработки магнитные бусы, 96-луночных совместимый магнитопорошковый концентратор (MPC) должна использоваться в экспериментах. Все указанные объемы связаны с одной скважины. Чтобы сравнить эффективность различных субстратов расщепления, субстрат преобразования можно оценить процент значений РФС в субстрат пустой Исправлена реакция образцов, учитывая субстрат пустой исправлены РФС значения соответствующих Примеры элементов управления в субстрат как 100. (.B) после флуориметрия, разделенных supernatants assay образцы также могут быть проанализированы на страницы и компоненты флуоресцентный белок может быть проанализирован непосредственно или после ренатурация-гель в случае nondenaturing и денатурируя образца подготовка, соответственно. В каждом рисунке также проиллюстрированы три образца типа различных пробирного: C = субстрат управления, B = субстрат пустым и R = реакции. Субстрат контрольные образцы находятся в Элюирующий буфер, а субстрат пустой и образцы реакции расщепления буфера. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
| Буфер | Флуоресцентный белок | ООПС склонов (%) |
| Элюирующий | mTurquoise2 | 6.04 |
| Расщепление | 9.11 | |
| Элюирующий | МАПЛ | 10.92 |
| Расщепление | 12.68 |
Таблица 11: коэффициент дисперсии (ООПС) значения на склонах подложка калибровочных кривых. Чтобы проверить ли флуоресценции субстратов рекомбинантных белков зависит на сайте вставленной расщепления, калибровок были исполнены серии сплавили mApple и mTurquoise2 субстратов (шесть вариантов для каждого, содержащие различные расщепления сайт последовательности протеаз ВИЧ-1), оба в буферы элюции и расщепление. Мы обнаружили, что резюме % склонов значений до 15% во всех случаях, что означает, что калибровка один субстрата могут быть использованы для оценки различных измерений, выполняемых субстрата варианты, содержащих один и тот же флуоресцентные тег.
Обсуждение
Из-за интенсивных промышленных и научных исследований протеолитических ферментов и постоянный спрос на оперативное и доступное HTS-совместимых протеазы пробирного платформ соответственно, мы разработали магнитный шарик на основе-флуоресцентные протеазы анализа. Проба основана на использовании рекомбинантных синтез белков, которые могут быть новые альтернативы широко используются синтетические пептидные субстратов.
В развитых пробирного формате синтеза белка субстратов иммобилизованных на поверхности Ni хелат покрытием агарозы магнитные бусы. Субстрат вложений обеспечивается N-терминальный его6 близости тег синтез белка, который непосредственно сливается с MBP тег для облегчения складывания и повышение растворимости в воде субстрат13. MBP следуют расщепления сайты ТэВ PR и протеазы интерес. Бывший может служить расщепления сайта управления в assay, в то время как последний может быть обработан протеазы должны расследоваться. На сайте расщепления взаимозаменяемы; короткий dsDNA последовательности кодирования для расщепления сайта интересов могут вставляться в гибких клонирования кассеты плазмидной выражение на перевязки. Рекомбинантных синтез протеины содержат тег высокостабильных, мономерных флуоресцентный белок на C-терминала, который позволяет конечной точки обнаружения фермента освобождены, флуоресцентный продукты расщепления C-терминала, освобожден после протеолитического расщепления ( Рисунок 1A). Очищенный флуоресцентные нетронутыми субстратов, решена в различные буферы используются также для калибровки для оценки молярной концентрации субстратов и продукты расщепления. Кроме того после флуориметрия, пробирного компоненты могут быть проанализированы на SDS-PAGE, а также. Как родной (nondenatured) и денатурированные флуоресцентные белки могут быть визуализированы в геле, сразу же после электрофореза или последующих-гель ренатурация, соответственно. Это дополнительные процедуры в сочетании с обычных Кумасси синим окрашивание май быть эффективно использовать для проверки результатов анализа (рис. 1B).
Пробирного процедура состоит из простых, легко выполнить шаги в формате низким объемом, который может быть полностью адаптирована к среде автоматической высокой пропускной способности. Однако независимо от выполнения анализа, либо вручную, либо с системой автоматизации, считаются следующие части assay решающее значение и требуют особого внимания при выполнении процедуры. i) однородность раствора магнитный шарик. Раствором однородной магнитный шарик должен использоваться на протяжении всего assay, очистки и промывки шаги. Особенно надежность протеазы анализов сильно зависит от правильно aliquoting субстрат придает магнитный шарик (Самба) акций решения. В целях повышения эффективности подвески и дисперсия, рекомендуется задать бусина концентрации от 2% до 10% (v/v). Во время подготовки проб, использование буферов, дополненные неионогенных моющего средства (например, «Тритон» X-100 или анимации 20) до 2% может также уменьшить соблюдение магнитные бусы из пластиковых поверхностей. Приверженность бисера стены образца флаконов можно избежать, если шарик суспензий тщательно применяются к днища флаконов вместо на стенах пробоотборные трубки. Однородность магнитные бусы при ферментативной реакции также имеет решающее значение и может быть обеспечена, постоянно встряхивая образцы на 600 об/мин во время инкубации. Бусины должным образом разметаны в округлые или плоскодонной пластиковые изделия, в то время как не рекомендуется использовать флаконы V-снизу. Неоптимальный результат, вызванные неправильным шарик гомогенизации представлена в рисунке 4В. II) прекращение реакции образцов. Еще одним преимуществом метода является, что ферментативной реакции может быть прекращено без использования тепловой денатурации лечения или любой потенциально мешая химических агентов15. Окончания может осуществляться просто разделив магнитные бусы из реакционной смеси, используя концентратор обычных магнитных частиц. В то время как удаленные реакции буфер содержит активный фермент и сгенерированный флуоресцентные расщепления продуктов C-терминала, uncleaved субстратов остаются присоединенными к бисер. Благодаря наличию активного фермента в буфере реакции разделение процедуры необходимо выполнить тщательно для надежной конечной точки обнаружения. Перед укладкой образца флаконов в концентратор, рекомендуется применять короткий спин центрифугирования. После размещения труб в концентратор, обеспечивают по крайней мере 15 s для бусины должны быть собраны. Незначительное движение разделителя туда и обратно может облегчить коллекции из бисера. Учтите, что во время вручную осуществляется разделение, прекращение обычно занимает больше времени, чем начало реакций. Таким образом примерно 2 мин зарегистрирована задержка рекомендуется между посвящений если то же самое время инкубации необходимо применить для всех образцов.
Принцип описанных протеолитических assay является относительно простой; Тем не менее универсальность системы гарантируется структуре гибких и стабильного субстрата. Индивидуальной оптимизации assay может быть ограничена только совместимость шарики сходства с прикладной условий, реагенты и добавки. По согласованию с производителем протокол мы также обнаружили, что сродство привязки субстратов на поверхности шарик Ni-НТА существенно ослабляет при рН ≤ 6,515. Таким образом рекомендуется применять субстрата пустой образцов параллельно образцы реакции, и темпы спонтанного субстрата диссоциации необходимо учитывать при оценке результатов.
В тех случаях, где магнитные шарик-на основе анализов не может быть выполнена из-за использования шарик несовместимых компонентов или низкий рН, пищеварение в раствор очищенной рекомбинантных субстратов могут применяться также. В этих случаях реакция смеси могут быть проанализированы электрофорезом, и белки могут быть визуализированы в геле, основанный на протоколе описаны. Исследовать протеолитической активности, в решение пищеварение и обнаружения в гель белков могут быть также альтернативные инструменты флуориметрия. Новинка разработана субстрата системы является применение в гель выемка шаг после денатурации SDS-PAGE. В то время как родной (nondenatured) флуоресцентных белков сохраняют свои флуоресценции во время электрофореза, флуоресцентные свойства отменяется при денатурации (рис. 7B). Однако флуоресценции денатурированные белки могут быть частично восстановлены путем удаления из геля SDS. Таким образом разделение реакции компонентов с помощью денатурируя условия позволяет не только на основе флуоресценции но идентификации на основе молекулярного веса. Еще одним преимуществом флуоресцентные обнаружения в гель, по сравнению с анализа Кумасси окрашенных гель является что (родной или renatured) флуоресцентные белки могут быть легко идентифицированы в геле, основанный на их флюоресценция (см. Рисунок 7). Это может быть важно, если реакции расщепления выполняются в образцы, содержащие nonfluorescent загрязнений или белки, весьма напоминающие молекулярным весом друг от друга.
Протеазы анализов, аналогичным образом с использованием разработанных субстратов уже были ранее опубликованы8,9,10, и хотя на сайте расщепления интерес в тех случаях, также расположен между тег сходства и флуоресцентный белок, пробирного системы представлены здесь не только повторяет описанные идеи но сочетает в себе различные преимущества предыдущих платформ и также завершает их с дальнейшие улучшения: i использование MBP фьюжн партнера, ii) наличие сайта управления расщепления ТэВ PR, iii) использование новых инженерных мономерных FPs и iv) применение процедуры калибровки уникальный субстрата. Assay сам особенно была разработана чтобы быть полезным для фермента специфичность и кинетические исследования в надежном, время - и экономически эффективным образом, без необходимости в дорогостоящих приборов. Этот метод предназначен для быть подходящим и доступным инструментом для промышленных и научных исследований. Благодаря гибкости «клонирование кассеты» выражение плазмида система может быть подходящим для быстрой и недорогой поколения рекомбинатных субстрата библиотек. Здесь описаны assay является осуществимым инструментом для осуществления субстратная специфичность, фермент мутагенеза, и ингибирование исследования и, Кроме того, предоставить альтернативный инструмент для выполнения Ферментативная кинетика. Пробирного платформа (от разрушения бактериальных клеток для определения кинетических параметров) может быть адаптирована к среде на базе HTS и автоматизации и, потенциально, может применяться в скрининг ингибитор протеазы промышленных и/или противовирусного препарата развития. Кроме того адаптация assay для конкурентных протеолиза является также в будущем сфера нашей лаборатории. В такой конкурентной assay два различных субстратах каждый содержащий разные расщепления сайт сливается с другой C-терминал флуоресцентные тег являются использоваться одновременно в том же реакции расщепления расследовать предпочтение изучал фермент для заданного целевого объекта последовательности. Кроме того использование 96-луночных пластины адаптированы пробирного формы (рис. 8) также будучи оптимизирована для мутации скрининга с помощью серии субстратов с последовательностями сайта модифицированных расщепления в случае хвоща протеаз.
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Эта работа была частично поддерживается GINOP-2.3.2-15-2016-00044 «PHARMPROT объединение» проекта и, Кроме того, финансируется институционального опыта программы высшего образования Министерства человеческого потенциала в Венгрии, в рамках Тематическая программа биотехнологии Университета Дебрецена. Авторы благодарны за членов лаборатории биохимии антиретровирусного лечения для их научной помощи в ходе анализа разработки, а также за их терпение во время съемок assay (особенно для Норберт Kassay, Кристина Joóné Matúz и Ванда Toldi, которые появляются на фоне видео). Авторы хотели бы также сказать отдельное спасибо Гедеон Рихтер Plc., особенно доктор Золтан Urbányi для позволяя Beáta Бозоки работы Кафедра биохимии и молекулярной биологии как гостевой исследователь. Авторы также хотели бы выразить свою признательность Дьёрдь Zsadányi, Балаж Tőgyi, Балаж Pöstényi и Золтан Кирали из мультимедиа и E-learning технический центр Университета Дебрецена за профессиональную помощь в аудио и видео производство.
Материалы
| Name | Company | Catalog Number | Comments |
| 10K Amicon tubes | Merck-Millipore | UFC501096 | |
| 2-Mercaptoethanol (β-ME) | Sigma-Aldrich (St Louis, MO, USA) | M6250 | |
| 40% Acrylamide/Bis solution 37.5:1 | Bio-Rad | 1610148 | |
| Acetic acid | Merck | 100063 | |
| Agarose | SERVA | 11404.04 | |
| Alpha Imager HP gel documentation system | ProteinSimple | ||
| Ammonium persulfate (APS) | Sigma-Aldrich (St Louis, MO, USA) | A3678 | |
| Ampicillin sodium salt | Sigma-Aldrich (St Louis, MO, USA) | A9518 | |
| Beckman Coulter Allegra X-22 centrifuge | Beckman Coulter | 392185 | |
| Black half-area plates | Greiner bio-One | 675086 | |
| Bromophenol blue | Sigma-Aldrich (St Louis, MO, USA) | B0126 | |
| CutSmart buffer (10x) | New England Biolabs | B7204S | For plasmid linearization (step 1.1.1) |
| Dark Reader transilluminator | Clare Chemical Research | DR-45M | |
| DNase I | New England Biolabs | M0303L | |
| Dynamag-2 magnetic particle concentrator | Thermo Fischer Scientific | 12321D | |
| Escherichia coli BL21(DE3) competent cells | Thermo Fischer Scientific (Invitrogen) | C600003 | |
| Ethanol | Merc-Millipore | 100983 | |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma-Aldrich (St Louis, MO, USA) | 798681 | |
| Gel Loading Dye, Purple (6X) | New England Biolabs | B7024S | |
| Glycerol | Merck | 356350 | |
| Glycine | Sigma-Aldrich (St Louis, MO, USA) | G7126 | |
| High-Speed Plasmid Mini Kit | GeneAid | PD300 | |
| Imidazole | Sigma-Aldrich (St Louis, MO, USA) | 56750 | |
| Isopropyl β-D-1-thiogalactopyranoside (IPTG) | Thermo Fischer Scientific (Invitrogen) | AM9464 | |
| Jouan CR 412 centrifuge | Jouan | CR412 | |
| Labinco LD-76 Rotator | Labinco | 7600 | |
| Luria-Bertani (LB) broth | Sigma-Aldrich (St Louis, MO, USA) | L3022 | |
| Lysozyme | Sigma-Aldrich (St Louis, MO, USA) | L6876 | |
| Magnesium chloride | Scharlau | MA0036 | |
| MERCK eurolab ultrasonic bath | MERCK | USR54H | |
| Millifuge Eppendorf spin centrifuge | Millipore | CT10 | |
| Mini-PROTEAN 3 Electrophoresis Cell | Bio-Rad | ||
| N,N,N′,N′-Tetramethylethylenediamine (TEMED) | Sigma-Aldrich (St Louis, MO, USA) | T9281 | |
| NanoDrop 2000 | Thermo Fischer Scientific | ||
| NheI-HF restriction endonuclease | New England Biolabs | R3131L | |
| Nickel(II) sulfate (NiSO4) | Sigma-Aldrich (St Louis, MO, USA) | 656895 | |
| Ni-NTA magnetic agarose beads | Qiagen | 36113 | |
| Orbital shaker | Biosan | OS-20 | |
| PacI restriction endonuclease | New England Biolabs | R0547L | |
| PageBlue Protein Staining Solution | Thermo Fischer Scientific | 24620 | |
| Phenylmethanesulfonyl-fluoride (PMSF) | Sigma-Aldrich (St Louis, MO, USA) | P7626 | |
| Protein Lobind Micro-centrifuge tubes | Eppendorf | 22431102 | |
| QIAquick Gel Extraction Kit | QIAGEN | 28704 | |
| Snijders Press-to-Mix shaker | Gemini | 34524 | |
| Sodium-acetate trihydrate | Sigma-Aldrich (St Louis, MO, USA) | S7670 | |
| Sodium-chloride | Sigma-Aldrich (St Louis, MO, USA) | S9888 | |
| Sodium-hydroxide | Sigma-Aldrich (St Louis, MO, USA) | S5881 | |
| SYBR Green I Nucleic Acid Gel Stain | Thermo Fischer Scientific | S7563 | |
| T4 DNA ligase | Promega | M180A | |
| Thermo shaker | Biosan | TS-100 | with SC-24 accessory block |
| Tris | Sigma-Aldrich (St Louis, MO, USA) | T1503 | |
| Tween 20 | Sigma-Aldrich (St Louis, MO, USA) | P2287 | |
| WALLAC VICTOR2 1420 multilabel counter | Wallac Oy, Turku, Finland |
Ссылки
- Meldal, M. Smart Combinatorial Assays for the Determination of Protease Activity and Inhibition. Molecular Informatics. 24 (10), 1141-1148 (2005).
- Rao, M. B., Tanksale, A. M., Ghatge, M. S., Deshpande, V. V. Molecular and biotechnological aspects of microbial proteases. Microbiology and Molecular Biology Reviews. 62 (3), 597-635 (1998).
- Zhang, G., Sittampalam, G. S., et al. Protease assays. The Assay Guidance Manual. , (2012).
- Woelcke, J., Hassiepen, U., Chen, T. Fluorescence-based biochemical assay formats. A Practical Guide to Assay Development and High-Throughput Screening in Drug Discovery. , (2010).
- Richardson, P. L. The determination and use of optimized protease substrates in drug discovery and development. Current Pharmaceutical Design. 8 (28), 2559-2581 (2002).
- Diamond, S. L. Methods for mapping protease specificity. Current Opinion in Chemical Biology. 11 (1), 46-51 (2007).
- Schilling, O., Overall, C. M. Proteome-derived, database-searchable peptide libraries for identifying protease cleavage sites. Nature Biotechnology. 26 (6), 685-694 (2008).
- Askin, S. P., Morin, I., Schaeffer, P. M. Development of a protease activity assay using heat-sensitive Tus-GFP fusion protein substrates. Analytical Biochemistry. 415 (2), 126-133 (2011).
- Chaparro-Riggers, J. F., Breves, R., Michels, A., Maurer, K. H., Bornscheuer, U. A GFP based assay for the determination of hydrolytic activity and substrate specificity of subtilisins under washing conditions. Journal of Molecular Catalysis B: Enzymatic. 35, 74-77 (2005).
- Patel, D., Frelinger, J., Goudsmit, J., Kim, B. In vitro assay for site-specific proteases using bead-attached GFP substrate. Biotechniques. 31 (5), 1194-1198 (2001).
- Branchini, B. R., et al. Sequential bioluminescence resonance energy transfer-fluorescence resonance energy transfer-based ratiometric protease assays with fusion proteins of firefly luciferase and red fluorescent protein. Analytical Biochemistry. 414 (2), 239-245 (2011).
- Zhou, C., Yan, Y., Fang, J., Cheng, B., Fan, J. A new fusion protein platform for quantitatively measuring activity of multiple proteases. Microbial Cell Factories. 13 (1), 44 (2014).
- Fox, J. D., Waugh, D. S. Maltose-binding protein as a solubility enhancer. Methods in Molecular Biology. 205, 99-117 (2003).
- Bozóki, B., et al. A recombinant fusion protein-based, fluorescent protease assay for high throughput-compatible substrate screening. Analytical Biochemistry. 540-541, 52-63 (2018).
- Mótyán, J. A., Miczi, M., Bozóki, B., Tözsér, J. Data supporting Ni-NTA magnetic bead-based fluorescent protease assay using recombinant fusion protein substrates. Data in Brief. 18, 203-208 (2018).
- Balleza, E., Kim, J. M., Cluzel, P. Systematic characterization of maturation time of fluorescent proteins in living cells. Nature Methods. 15, 47-51 (2018).
- Hebisch, E., Knebel, J., Landsberg, J., Frey, E., Leisner, M. High variation of fluorescence protein maturation times in closely related Escherichia coli strains. PLoS One. 8, e75991 (2013).
- Kapust, R. B., et al. Tobacco etch virus protease: mechanism of autolysis and rational design of stable mutants with wild-type catalytic proficiency. Protein Engineering, Design and Selection. 14, 993-1000 (2001).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены