Method Article
Жить анализа клеток касательное напряжение на синегнойной палочки с помощью автоматизированной системы Microfluidic высшее-пропускная способность
* Эти авторы внесли равный вклад
В этой статье
Резюме
Здесь мы описывают использование биореактор microfluidic более высокой пропускной способности в сочетании с флуоресцентный микроскоп для анализа воздействия касательное напряжение на биоплёнки Pseudomonas aeruginosa , выражая зеленый флуоресцентных белков, включая инструмент Настройка, определение охвата биопленки, темпы роста и морфологических свойств.
Аннотация
Более высокая пропускная способность microfluidic в vitro биореактора, в сочетании с микроскопии флуоресцирования был использован для изучения роста бактериальные биопленки и морфологии, включая синегнойной палочки (P. aeruginosa). Здесь мы будем описывать, как система может использоваться для изучения кинетики роста и морфологических свойств, таких как шероховатость поверхности и текстурные энтропии штамм P. aeruginosa PA01, который выражает расширенной зеленого флуоресцентного белка (PA01-EGFP ). Подробный протокол будет описывать как расти и семян культур PA01-EGFP, как установить микроскоп и автозапуска и проводить анализ изображений для определения темпов роста и морфологических свойств, с помощью различных сдвига, которые находятся под контролем microfluidic устройство. Эта статья даст подробное описание методики для улучшения деятельности по изучению биоплёнки PA01-EGFP, который в конечном итоге может быть применен к другим штаммов бактерий, грибов и водорослей биопленки, используя microfluidic платформа.
Введение
Здесь мы покажем способ измерить эффект касательное напряжение на формирование люминесцентные синегнойной палочки (P. aeruginosa) PA01 биоплёнки с помощью автоматизированных microfluidic более высокую пропускную способность системы.
Биоплёнки являются общины микроорганизмов, таких как бактерии, организованный внеклеточного полимерные вещества, которые прикреплены к поддержке и обычно находятся на уровне интерфейса между жидкой и твердой поверхности1. Эти общины биопленки может быть полезным для окружающей среды, такие, как улучшение качества воды в водопроводных линий и биоремедиации непокорных соединений2,3. Однако биоплёнки также может быть очень вредны для здоровья человека с нежелательными последствиями. К примеру медицинских устройств, таких как бедра и колена имплантатов, являются одним из видов поверхности где накопление биопленки был вызов и вызывает серьезные осложнения4,5. Биопленки можно также ввести природных водных систем, таких как реки и озера и проникнуть трубы водоснабжения, ведущих к загрязнению бактерий в питьевой воде, что приводит к инфекции6,,78. Биопленки, образованная в морской среде придерживаться судов и других искусственных субстратов и представить основных экономических и экологических проблем, как увеличение трения приводит к увеличению потребления топлива9,10. Антимикробных покрытий, например трибутилолова, были разработаны для предотвращения этих проблем, но токсичен для морских обитателей11.
P. aeruginosa это грамотрицательные бактерии с высокими возможностями процветает в различных условиях окружающей среды и nutrimental12. P. aeruginosa является распространенной причиной сообщества и внутрибольничных инфекций и нашли, чтобы быть тесно связанных травм, таких, как тяжелые ожоги и ослабленным хостов, таких как в кистозный фиброз (CF)5,12, 13, СПИД и рак пациентов5,13. Образование биопленки P. aeruginosa наиболее серьезно соединен CF, где хронические легочные инфекции являются основной причиной смерти для этой болезни5.
Ссылка штамм P. aeruginosa, PA01, используется в настоящем докладе и генетически модифицированных выразить расширенной зеленого флуоресцентного белка (ПА-EGFP). EGFP представляет собой мутант форму GFP с большей флуоресценции свойств, которая позволяет в situ биопленки анализа с помощью флуоресцентной микроскопии14,,1516. Этот тип анализа флуоресценции выгодно для изучения биоплёнки потому что GFP не вмешиваться значительно функции17и рост клеток. Например клетки Escherichia coli , которые были помечены с GFP росла непрерывно и хорошо не испытав каких-либо токсических эффектов по сравнению с контроля бактерий17. Другие доклады обоснования этой претензии по18,19,20. Кроме того использование флуоресцентных репортер например EGFP является быстрый и простой, но только живые клетки будут оцениваться, потому что мертвые клетки быстро прекратить флуоресцировать21.
Биопленки можно растут в различных экологических условиях, в том числе с различными ставками. К примеру фильмы могут расти в высокое напряжение сдвига, такие как в реках, где высокая вода потока условия ведут к большей микробного разнообразия22. Наоборот стоячей воды в прудах или устные биоплёнки опыт гораздо ниже сдвига силы23. В дополнение к скорости потока, существуют другие факторы, которые влияют биопленки адгезии, включая шероховатости поверхности и гидрофобность, состав средств массовой информации, и даже бактериальных клеток поверхности1,4,7, 24. условия могут также вызвать изменения в пространственной структуре или морфология биопленки. Это включает в себя экологических условий, таких как напряжение сдвига, оказываемое движущейся жидкости или градиентов в наличия питательных веществ и биологических факторов, таких как вид присутствует в системе, подвижности клеток и специфических белков, присутствующих в внеклеточного полимерные вещества25,,2627. При некоторых условиях, биофильмов будет газон как (гладкая и плоская), хотя в других условиях биопленки будет грубой, пушистые, или даже гриб как28. В то время как качественная разница между биопленки газоны и грибов структур можно ясно увидеть в микроскопических изображений, понимание взаимосвязи между структурой фильм и биологические процессы в фильме требует систематических и количественных методы описания морфологии. Морфологические особенности, предложенная исследователями для изучения включают пористость, фрактальная размерность, диффузионных длина, microcolony района на субстрат, microcolony объем, коэффициент шероховатости и текстурные энтропии29,30 .
Биореакторы используются в исследовании биоплёнки для имитации реальных условий31. Капельного потока реакторов (DFR) представляют собой низкий-при сдвиге среду, где питательные вещества в СМИ медленно потока через клетки, которые придают поверхности со временем сформировать биопленки с высоким клетки плотность32. CDC реакторы являются биореакторов, которые создают высокое напряжение сдвига жидкости среды управления перемешивания стержень, который непрерывно вращается в СМИ заполнены танк33. Эти типы биореакторов проста в настройке, но они ограничены в области из-за относительно низкой выборки, высокое потребление средств массовой информации, большое количество зараженные отходы, образующиеся из СМИ капельного потоков, начиная от 125 мкл в минуту для капельного потока реакторов для более чем 1 мл/мин для CDC реакторов и необходимость в автоклаве большое количество посуды и отходов СМИ34. Биопленок не растут равномерно по всей поверхности в реакторе потока капельного потому что низкий наклон СМИ причины скользящий вдоль крупных конгломератов бактерий P. aeruginosa поэтому, биопленки рост не очень гладко и не может быть неравномерным образцы легко проанализирован с флуоресцентной микроскопии35,36 .
Некоторые общие ограничения биореактор преодолеваются с помощью средне-пропускная способность microfluidic биореактора, где требуются только миллилитров средства массовой информации, и реакция пластины являются небольшими и легко одноразовые после автоклавирования37. Кроме того в зависимости от количество скважин, многие репликации могут быть выполнены в только один реактор, запуска, которая обеспечивает достаточное количество данных для проведения конструктивного статистического анализа. На рисунке 1различных компонентов системы microfluidic микроскопия, которые позволяют контролируемых условиях, в том числе температуры и потока скорость38,,3940, показываются. Реактор в сочетании с микроскопии флуоресцирования визуализировать флуоресценции EGFP тега в PA01 под низко применяется через высокого сдвига условия, которые будут имитировать более реалистичных сценариев, которые встречаются в окружающей среде или в области биомедицины.
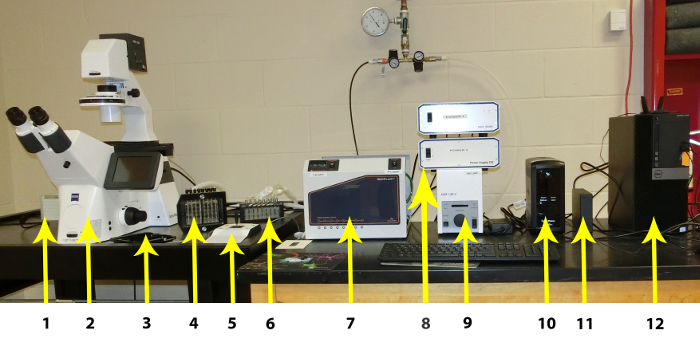
Рисунок 1 : Отдельные компоненты системы Microfluidic. Отдельные компоненты перечислены слева направо: 1. CCD камера, 2. высокой резолюции инвертированный микроскоп с автоматизированной стадии, автоматизированный модуль флуоресценции и автофокусировки модуль, 3. плита этап, 4: Imaging системы интерфейс, 5: руководство микроскопа Управления, 6: Пара ловушку, 7: Imaging системы контроллер (включая температуры), 8: аппаратные контроллеры, 9: флуоресценции контроллер, 10: источники бесперебойного питания, 11: внешний жесткий диск для хранения изображений, 12: ПК. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Отрывок из плиты microfluidic показано на рисунке 2. Наиболее часто используемые плиты состоят из 48 скважин. Один эксперимент требует один вход и один выход скважин, в общей сложности 2 скважин. Это позволяет для 24 одновременных экспериментов, которые могут быть выполнены с различных экспериментальных условиях, таких как бактериальных штаммов, антимикробного лечения и средства массовой информации варьируется от канал и контролируемых сдвига потока для каждого столбца из шести каналов. Экспериментальный температура контролируется также с одной температуры по всей пластине. Microfluidic каналы показывают, что каждый канал имеет змеевик региона оказать достаточное давление задней и контролируемых сдвига.
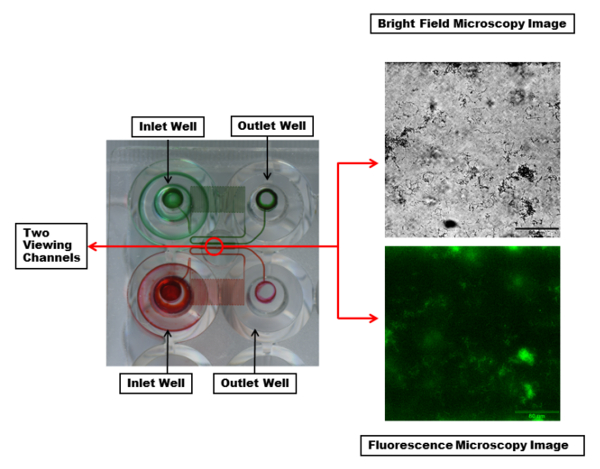
Рисунок 2: визуализация microfluidic каналов и окно просмотра. Два впускных и выпускных скважин с microfluidic каналов, связывающих их выделяются красные и зеленые красители. Краситель делает видимыми серпантином региона в каждом канале, который создает достаточное давление задней и контролируемых сдвига во время потока жидкости. Каждый канал просмотра (внутри красный круг) может быть imaged с желаемой длины волн. Изображены яркие области (вверху) и люминесцентные (внизу) микроскопии изображений одного канала с биопленки PA01-EGFP, используя объектив 20 X. Шкалы бар = 80 мкм. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Шаг за шагом руководство предоставляется пользователям microfluidic биореакторов, которые соединены с флуоресцентной микроскопии для проведения Роман биопленки экспериментов с использованием различных сдвига сред. Этот метод позволит для расширения экспериментов с участием других микроорганизмов, помимо бактерий, грибов и водорослей, которые имеют медицинские и экологические приложения41,42,43. Детальный подход описывает культура PA01-EGFP, прививать 48-ну тарелку и microfluidic устройство и программное обеспечение, настроить флуоресцентный микроскоп и продемонстрировать анализ программного обеспечения для получения покрытия биопленки, темпы роста, и морфологических свойств, таких как шероховатость поверхности.
протокол
1. средства массовой информации подготовка
- Подготовьте минимальный СМИ (мм) с 0,25% глюкозы. Чтобы сделать 1 Л мм с 0,25% раствор глюкозы, добавьте 200 мл стерильного солевого раствора M9, 2 мл стерильного 1 M MgSO4, 100 мкл CaCl стерильных 1 M2и 12,5 мл стерильного глюкозы 20% (w/v) к воде (dH2O) на окончательный объем 1 л.
- Необходимые средства массовой информации передавать стерильные бутылки с использованием стерильных методов. Подготовьте сумма, требуемая в зависимости от количество каналов используется. Как правило каждый канал требует 200 мкл для грунтования, 300 мкл для посева и 1300 мкл для эксперимента 24 h.
- Поместите бутылку в инкубатор или водой ванне в экспериментальной температуры. Средства массовой информации должны быть при температуре эксперимента перед использованием, чтобы избежать пузырьков, образуя в микроканалов.
2. Подготовка ночи и экспериментальных культуры PA01-EGFP.
- 15 мл экспериментальных средств массовой информации в стерильную колбу пистолет и прививать с одним или двумя колониями от плиты агара, прожилками с PA01-EGFP. Расширьте культуру для 12-16 h на таблицу инкубатор/шейкер при 37 ° C и 180-220 об/мин.
- Измерьте ОД600 ночь культуры. Когда ОД600 больше чем 0,80, разбавляют ночь культуры на окончательный ОД 0,8, с использованием свежих мм. место экспериментальную культуру в инкубатор или водяной бане при 37 ° C до тех пор, пока необходимое для заполнения microfluidic каналы. Проверка ОД600 снова непосредственно перед посевом обеспечить, что он существенно не изменилось от цели ОД600, 0,8 в этом случае.
3. Оборудование для запуска
- Настройка станции системы согласно руководству пользователя, аналогичные установки на рисунке 1. Чтобы избежать ошибки в соединении инструмент программного обеспечения, включите прибор в следующем порядке:
ПК
Флуоресценции модуль. Убедитесь, что флуоресценции затвора на (синий свет на кнопку затвора на)
Аппаратные контроллеры
Imaging системы контроллер (см. Таблицу материалы)
CCD камера
Станция обработки изображений (микроскоп)
Примечание: Температура подогревом плиты должны корректироваться до желаемой температуры экспериментальной. - Запустите приложение управления и введите номер расположен на наклейке на стороне пластины.
Примечание: После запуска приложения управления там будет два отдельных приложений windows, один для программного обеспечения, которое контролирует Микроскоп/изображений программного обеспечения и один для модуля управления, который управляет насосом и хорошо плиты интерфейс. Это показано в S1 рисунок, где в меню «Multi мерных приобретение» открыт на верхней и на дне для автозапуска установлен модуль управления.
4. грунтование и заполнения Microfluidic пластины
Примечание: Грунтовки, посев, бактериальных привязанность и роста показано на рисунке 3.
- Снять пластину 48-ну microfluidic из упаковки, убедившись в том, чтобы не коснуться поверхности стекла в нижней части пластины. Очищайте стекла слайд в нижней части пластины с объектива ткани, Линт свободный ткань или низкий Линт wipe.
- Премьер microfluidic каналы, Пипетка 200 мкл 37 ° C мм в выходной, стараясь избежать пузырей. Установите пластину в стадию пластины и протрите интерфейс с этанолом, позволяя высохнуть до герметизации на сцену пластины.
- В Ручном режиме на модуле управления установите жидкости как LB при 37 ° C и Сдвига Max 5.00 Дин/см2. Нажмите вывода скважин для того чтобы активировать поток выходных данных для ввода, грунтовка каналы. После 5 минут грунтовка приостановите поток для подготовки посева. Тщательно удалить пластину от сцены и Пипетка остаточных средств массовой информации от вывода, но не удаление любой из средств массовой информации из внутреннего круга, что приводит к microfluidic каналы.
- Для заполнения экспериментальных каналов, сначала Пипетка 300 мкл мм в вход, хорошо следуют дозирования 300 мкл бактериальной культуры в выходной и в хорошо вывода. Поместите пластины обратно в стадии пластины, убедившись, что Протрите интерфейс перед установкой его на тарелку.
- На модуле управления сосредоточены на одном канале с использованием живой камеры, кормить после размещения стадии пластины на сцену микроскопа. Хотя визуально мониторинга живой корм, возобновите поток на 1,00-2,00 Дин/см2 для приблизительно 2-4 s, чтобы позволить клетки войти экспериментальный канал, но не в змеевик каналы. Оставьте пластину на стадии контролируемой температуре за 1 ч для клеток вложения. В течение 1 ч инкубации модуль управления и монтаж программного обеспечения можно настроить для автозапуска (шаг 5).
Примечание: Количество времени, необходимое для заполнения будет зависеть от средств массовой информации и организм, поэтому он должен тесно контролироваться живой корм пока оптимизированы и используется как общие сроки. Посев по всей пластине может варьироваться, которая потребует больше времени прикладной потока к определенным столбцам каналов для полного заполнения. - После периода вложения аккуратно удалить пластину от сцены и Пипетка бактерии из первых избегая тревожные канал вывода. С новым кончиком пипетки удалите медиафайл из входного скважин.
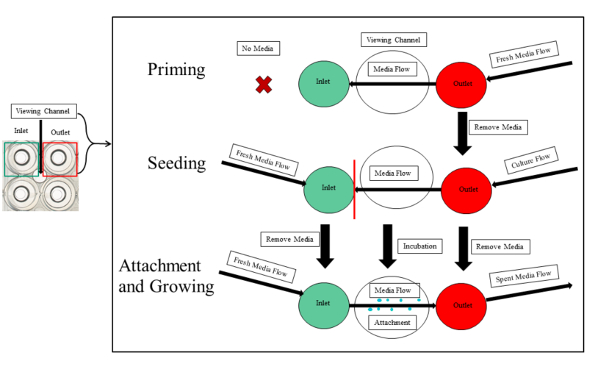
Рисунок 3 : Экспериментальный обзор грунтовки, посева и вложение PA01-EGFP в каналах microfluidic. Изложена грунтовки, посева и вложений. Первый шаг грунтование требует свежие СМИ, представил на выход. Высева предполагает равные объемы средств массовой информации и бактериальные культуры во входных данных и выходных скважин, соответственно. Культура не следует передавать сегмента просмотра экспериментальный канал (красная линия) чтобы избежать засорения серпантином каналы. После инкубационного периода, свежие СМИ непрерывно вытекает из входных данных, для просмотра камеры и в розетку. Это инициирует привязанность и роста бактериальные биопленки. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
5. Установка программного обеспечения
- В программном обеспечении откройте «Несколько размеров приобретения» для контроля изображения приобретение микроскопа. В разделе меню «Main» выберите «Timelapse», «Несколько стадии позиции» и «Нескольких длинах волн» (Рисунок S1A).
- Настройка параметров сохранения , создайте простой Базовое имя, убедившись в том, что проверяется приращения базовое имя, если файл существует . Нажмите кнопку Выбор каталога выберите папку, в которой будут храниться все файлы. Включить основные детали эксперимента в Описание.
- На вкладке Timelapse Отрегулируйте Продолжительность экспериментального время до 24 ч. Для управления как часто приобретаются изображений, задайте Интервал времени таким образом приобретенные изображения каждые 5 минут на протяжении всего эксперимента. Число точек времени автоматически настраивает с заданными параметрами.
- Задайте стадии позиции с использованием живой камеры, кормить в светлых местах Микроскоп, позволяя для правильного размещения и направленности. Начиная с 10 X цели, сосредоточить внимание на центре канала, расположенный выше или ниже номера каналов, выгравированные на плите. Переключитесь на 20 X цели, нахождение оптимального просмотра области и фокальной плоскости в пределах канала. Добавить позицию в список или заменить позицию заданного канала с новыми параметрами.
- В длинах волн меню установите количество длин волн 3. Для волны 1 (W1) выберите CAM 100% FITC с временем экспозиции 10 мс. Для волны 2 (W2), выберите Brightfield 50% CAM 50% VIS с минимальным воздействием время 3 г-жа для волны 3 (W3), установить в качестве фильтра Все закрыты так нет света остается на последний канал между приобретением раз.
- При настройке модуля управления, проверьте, чтобы убедиться, что руководство запуск был остановлен.
- В меню Редактировать автозапуска на вкладке Протокол установки задайте новый протокол для 24 часа продолжительности времени, течет в направлении вперед со скоростью нужный наклон. Скорости сдвига изменяется для изучения эффекта роста биопленки с скорости сдвига. Нажмите кнопку Добавить и Сохранить как протокол.
- На вкладке Последовательности установки создайте новую последовательность, выбрав LB@37degrees как жидкости по умолчанию для всех каналов. В Шаге итерации 1, для каналов 1-12 выберите протокол с желаемой сдвига скорости и включить все каналы. Для каналов 13-24 выберите протокол с второй скорости сдвига желаемого и включить все каналы. Выберите Применить и Сохранить как последовательность.
- В меню автозапуска выберите сохраненную последовательность использоваться для автозапуска.
6. Временный настройки эксперимента биопленки роста
- Пипетка более 1300 мкл стерильных мм в ввод хорошо microfluidic пластины. Поместите пластины обратно на сцену пластины и протрите интерфейс с этанолом, позволяя этанола полностью высохнуть, прежде чем запаечная пластина.
- Размещение плита этап на сцену микроскоп и быть уверены, что протокол(ы) и sequence(s) настроены правильно. Выберите Запуск чтобы запустить автозапуск, быстро последовали, щелкнув получить для начала коллекции изображения микроскопа.
- Отрегулируйте фокус и размещение всех позиций этап между приобретения изображения. Выберите Пауза и, используя режим live изображение в яркие поля волны, выберите Перейти для просмотра каждой стадии позиции. Установите новые параметры, выбрав значение тока. Нажмите кнопку возобновить до следующего запланированного приобретения времени.
7. Обзор и анализ последовательностей изображений после эксперимента по выращиванию приурочен биопленки
- Для рассмотрения каждого канала после 24 ч автозапуска, в программном обеспечении, открыть Обзор многомерные данные, расположенные под Инструменты анализа. Нажмите на выберите базовый файл | Выберите каталог для перехода к папке с последовательностями изображений для эксперимента интерес. В списке наборов данных в папке, которая появляется выберите имя базы данных, представляющих интерес.
- После выбора данных, представляющих интерес, нажмите кнопку Просмотр для обзора этих данных. Выберите длину волны для обзора этих данных под окном волны (Рисунок S2).
- Обзор последовательность изображений для каждого канала, выбрав номер канала под Стадии позиции и используя элементы управления видео для анализа данных для 289 время очка (предполагая, что изображения получаются каждые 5 минут в течение 24 часа времени). Принять к сведению полезной роста данных.
Примечание: В каждом канале, смотреть для развития воздушных пузырьков и деревянные башмаки, которые будут мешать биопленки роста внутри канала, воздействуя на сами данные. Однако если они происходят позже в беге, данных перед эти обстоятельства могут оказаться полезными. - После рассмотрения и выбора нужных данных для анализа, создайте стеки изображений для каждого канала. В меню файл , выберите Открыть специальные | Построение стека | Пронумерованы имена. В окне Построения стека выберите кнопку Выберите первое изображение , затем выберите первое изображение для стека в папке файлов; Выберите кнопку Выбрать Последнее изображение , а затем выберите файл, соответствующий последней изображений в стеке. Нажмите на кнопку ОК , чтобы открыть стека со всеми изображениями канала в хронологическом порядке. Стеки можно сохранить в меню файл выберите Сохранить как как tiff-файлы.
Примечание: Не создавать стеки с пальца изображения. Эти файлы не очень полезны и могут быть удалены, чтобы сэкономить место на жестком диске. Кроме того файлы изображений сохраняются следующим образом:
Базовый NAME_WAVELENGTH_sCHANNEL #_tIMAGE #.
К примеру 07062018_W1FITC 100_s12_t112 предназначен для канала 12, время пункт 112, изображение в первой волны FITC 100% камеры данных с базовым именем «07062018». - Наконец выберите Сохранить как из раскрывающегося меню файл , чтобы сохранить последовательность как tiff стек. Стеки можно также накладными и сохранить как фильм. Этот вопрос рассматривается в шаге 9.
- Перед количественной % поверхности покрытия, калибровка изображения расстояния. Инструменты анализащелкните на Расстояниях калибровки. Выберите соответствующие калибровочные измерения и нажмите кнопку Применить для всех открытых изображений.
- В то время как стек на первое изображение из последовательности, нажмите на кнопку порог . Используйте Автоматический порог для объектов свет порог для флуоресцентного сигнала (FITC волны) и Auto порог для темных объектов порог в светлые области. Настройка порога для охвата, который представляет освещение изображения.
- Для флуоресцентных порогов используют канал с не люминесцентные клеток для установления любого фонового сигнала и установить минимальное пороговое значение для исключения сигнал обнаружен в каналы, содержащие эти не люминесцентные клеток для обеспечения измерения сигнала делает не переоценивать области флуоресценции. Это может отличаться от запуска к запуску так что это хорошая идея, чтобы использовать по крайней мере один, если не больше, каналы для не люминесцентные элементов управления.
- Для светлых местах порогов если все ячейки не охватываются оранжевый порог подписи, Отрегулируйте максимальное пороговое значение, либо через раздвижные панели инструментов или с помощью Порог изображение (находится под Инструменты анализа), так что все клетки покрыты, но исключается любой фон.
Примечание: Хотя в идеале эти пороговые значения будут использоваться для всех изображений внутри стека и для всех каналов, пороговые значения, выбранные для одного изображения/канала не может быть подходящим для других изображений или каналы, поэтому пользователю может понадобиться настроить диапазон порога периодически. По этой причине это хорошая идея, чтобы всегда записывать максимального и минимального порогового значения, используемые при необходимости данных будет рассмотрен позднее.
- Для количественной оценки охвата, под Инструменты анализа, нажмите кнопку Показать область статистики. Убедитесь, что установлен Порог использования , выбрано Изображение целиком и Полученные данные, убедитесь, что выбраны нужные измерения/параметры (порог области, среднее, стандартное отклонение, мин, Макс и порог % Площадь). Нажмите на Открыть журнал и убедитесь, что выбран файл DDE перед нажатием кнопки ОК. Выберите Microsoft Excel и нажмите кнопку ОК. В таблице, которое откроется, нажмите кнопку Данные журнала автоматически Запишите измерения анализируемого изображения.
- Закрывая эту таблицу, используйте тот же лист для сбора всех данных анализа изображения для одного стека. В стеке перейдите к четвертой изображения и порог оптимальные настройки. Нажмите на Данных журнала в окне Показать область статистики и значения заносятся в электронную таблицу. Повторите эту процедуру для анализа изображений каждые 15 мин.
8. другие анализа включая морфологии и поверхности покрытия меру с помощью Python скриптов от биопленки морфология Люкс
- Установите распределение 3.6 Python, которая включает стандартные научных модули с помощью стандартного распределения научных Python как Анаконда, доступны на https://www.anaconda.com/download.
- Получения биопленки морфология Люкс с GitHub в браузере путем перехода к https://github.com/cdwentworth/Biofilm-Morphology-Suite.git, а затем выберите клон или скачать (зеленая кнопка) и Скачать Zip. Разархивируйте файл и переместить папки кода в рабочий каталог.
- Измерить процент показатели охвата путем копирования стека изображений в папку «охвата». Использование окна терминала перейдите к этой папке и затем выполнить скрипт с командой
Python bfCoverage.py tiffStackName.tif
из интерфейса командной строки, где tiffStackName.tif — имя файла, содержащего стек tiff изображений. Текстовый файл, содержащий охвата измерений на каждом этапе будет создан с именем tiffStackName.txt и графический файл с участок покрытия как функцию от времени будет создан с именем tiffStackName.png. - Используйте ту же процедуру, указанной на шаге 8.3 для измерения других морфологических характеристик: биопленки накопления, коэффициент шероховатости и текстурные энтропии. Используйте сценарий bfAcc.py для измерения накопления, roughCoef.py сценарий для измерения шероховатости коэффициент и TEvsTime.py сценарий для измерения текстурные энтропии.
9. другие программные приложения - оверлеев и фильмы
- Если используются несколько длин волн, создания стеков оверлея, включая этих длинах волн. Открыть все стеки интерес и калибровки расстояния, как это сделано в шаге 7,6.
- В разделе Инструменты анализавыберите Наложение изображений. Установите источники как стеки интерес. В стеке FITC нажмите на Радужный круг и выберите зеленый цвет фильтр, чтобы быть добавлены для того, чтобы выделить этой волны.
- Используйте Бал для настройки оверлея, чтобы стек FITC проявляется в изображениях. После того, как были сделаны все корректировки, выберите Все самолеты для обоих стеки и нажмите кнопку Применить. Сохраните пометки таким же образом, как стеки, описанный в шаге 7,5 или как описано в шаге 9.2 фильм.
- Чтобы сохранить стеки или оверлеи как timelapse фильм, под Мм стандарт и стека, нажмите на Сделать фильм. Выберите источник как стек или оверлея, который пожелан. Нажмите кнопку сохранить и сохранить как в Microsoft видео 1 с качеством между 70-80.
Результаты
Рисунок 4 показывает процент показатели области со временем от 24 h на сдвиг потоков 0,2, 0,5 и 1,0 Дин/см2. Биопленки покрытия или % порог площадь поверхности (C [%]) был различных настроек для всех трех сдвига. Биопленки охват был быстрейшим на сдвиг2 1.0 Дин/см, где порог области возросла с 2-5% до 100% после 200 мин роста и достиг стационарной фазы после 400 мин. На 0,5 дин/см2биопленки освещение было отложено и начал расти в 400 мин, достигнув 100% покрытия после 800 мин. Низкие сдвига на 0.2 Дин/см2 четко продемонстрировали медленное увеличение охвата биопленки, где процент охвата начал расти на 500 мин, но никогда не выходит за пределы области 65% порог. Эти результаты показали, что сдвиг имел непосредственное влияние в биопленки поверхности покрытия. Более высокие сдвига, как представляется, быть более оптимальные условия для роста биопленки, возможно, с тем, что средства массовой информации представил бактерий с больше питательных веществ, так что биопленки могут размножаться быстрее.
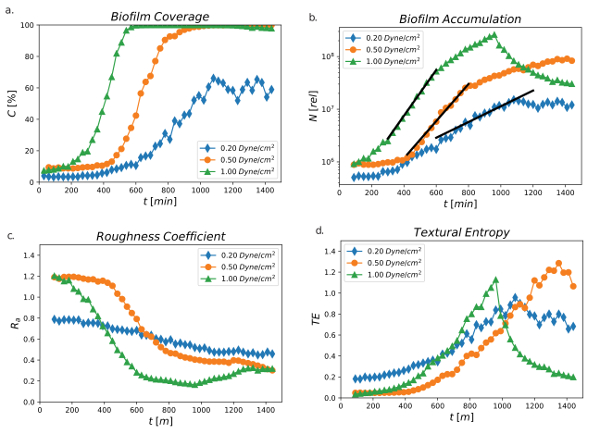
Рисунок 4: пороговое значение % площади, накопление всего биопленки, коэффициент шероховатости и текстурные энтропии. ) Процент порога области (C [%]) с течением времени, используя 0,2, 0,5 и 1,0 Дин/см2 над 24 h период времени. Данные были получены из одного канала для каждого условия сдвига. b) всего биопленки накопления (относительная мера) как функцию от времени, с помощью 0,2, 0,5 и 1,0 Дин/см2 над 24 h период времени. Черные линии являются наименьших квадратов подходит к экспоненциальной модели. Данные были получены из одного канала для каждого условия сдвига. c) шероховатости коэффициент PA01-EGFP с использованием значений напряжения сдвига 0,2, 0,5 и 1,0 Дин/см2 наблюдение за более чем 24 h. данных был получен из одного канала для каждого условия сдвига. d) Текстурные энтропии PA01-EGFP значениями напряжения сдвига 0,2, 0,5 и 1,0 Дин/см2. Данные были получены из одного канала для каждого условия сдвига (Valquier-Флинн, H., Sutlief, а.л., Уэнтуорт, ПД, 2018). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Рисунок 4 b согласуется с выводами, показано на рисунке 4. Биопленки накопления (N[рел]) был измерен основаны на предположении, что GFP сигнала в точке изображения пропорциональна плотности живой клетки в этой позиции. Это показывает, что общее относительное измерение биопленки накопления увеличились как функцию от времени, с помощью 0,2, 0,5 и 1,0 Дин/см2 над 24 h период времени, а темпы роста снизился с высокого напряжения сдвига для низкого напряжения сдвига. Существует четкое время период, давая экспоненциальный рост, от которого темпы количественного роста могут быть рассчитаны.
Рисунок 4 c демонстрирует коэффициент шероховатости (R) на сдвиг потоков 0,2, 0,5 и 1,0 Дин/см2. Шероховатость поверхности, количественно коэффициент шероховатости, измеряет дисперсию в профиль толщины пленки. Официальное определение
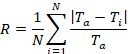
где T,я - я-го измерения толщины, Т -средняя толщина, а N — это количество измерений толщины30. Процедура, описанная в этом расследовании измеряет толщину, связанные с живых клеток. Плоского расположения клеток даст коэффициент шероховатости нуля, хотя значительные вариации толщины от среднего даст больше, чем один коэффициент шероховатости. Аналогично при сдвиге влияние на темпы роста и процент порога освещение фильма, биоплёнки выставлены различных топологий с течением времени. В целом R уменьшилось со временем для всех условий сдвига, указав, что все поверхности стала гладкой. Однако по сравнению с низким сдвига 0.2 Дин/см, более высокие параметры сдвига 0,5 и 1,0 Дин/см2 привело к гладкой поверхности с течением времени, указывающее, что быстрее потока сдвига способствовали более гладкой и более даже поверхность и высокие сдвига 1.0 Дин/см2 опускается ниже 0.2 R.
Гладкость, регулярность или грубость поверхности может также выражаться в текстурные энтропии (TE). TE-это свойство, используемое в анализе изображений для измерения степени случайности в двумерное изображение. Его расчет основан на серый уровне совместного появления матрицы, определяется Хараликом и др., который смотрит на ли значения пикселов в одном месте коррелируются с значений пикселов в другом месте44. Высокая степень корреляции приведет к низкой энтропии. Рисунок 4 d изображает TE на сдвиг потоков 0,2, 0,5 и 1,0 Дин/см2. TE увеличилось со временем для всех условий сдвига, но высоким касательное напряжение в достиг максимальной TE (1.0) раньше, чем нижняя касательные напряжения в 900 мин 1.0 Дин/см. Низкие сдвига 0.2 Дин/см2 имели низкие TE (0,8), достигнув своего максимума после 1000 мин. Однако промежуточные касательное напряжение 0.5 дин/см2 достиг своей максимальной TE (1.2) намного позже, чем условия, высокое или низкое напряжение сдвига.
Коэффициент шероховатости и TE измеряют различные функции. В то время как плоская пленка будет иметь коэффициент низкой шероховатости и низкой энтропии, фильм с значительные различия в толщине будет иметь высокий шероховатости коэффициент, но может все еще быть низкой энтропии, если колебания синусоидального, а не случайных. В этом случае R сократилась с повышенной касательное напряжение и время TE тенденции не связаны непосредственно с сдвига стресс, применяется к биопленки со временем.
Рисунок S1 : Изображение захват управления программным обеспечением windows. Программное обеспечение окно с мерной приобретения мульти меню (вверху). Модуль управления для автозапуска (внизу). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
На рисунке С2 Образ захвата программного обеспечения для обзора данных. Окно приложения после выбора набора данных интерес, используя средство Обзора Multi многомерных данных из меню Инструменты анализа . Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Обсуждение
Процедура анализа системы и изображения microfluidic обсуждали здесь сосредоточена на исполнение microfluidic биопленки экспериментов для определения морфологических свойств, которые не требуют полной трехмерной информации, обычно встречаются от конфокальной Микроскоп исследования. К ним относятся microcolony субстрат покрытия (процент охвата), шероховатость поверхности измеряется коэффициент шероховатости и текстурные энтропии. Метод оценки накопления клеток всего относительной биопленки также представлены от которого темпы роста в журнале фаза может быть рассчитана.
Есть некоторые небольшие, но важные шаги, которые должны быть выделены в этом методе. Вытирая интерфейс с алкоголем помогает избежать заражения других бактерий происходит от эксперимента к эксперимент, но также из скважины в одном эксперименте. Грунтование и заполнения также очень важно, потому что грунтовки позволяет пользователю определить, какие каналы позволяют средства массовой информации через каналы без каких-либо помех или засорения. Каналы также не должна быть нарушена (то есть они должны быть постоянно заполнены СМИ) после грунтования увеличить шансы на Успешный эксперимент без воздушных пузырей или засорения. Высева шаг может изменяться согласно тип бактерий и поэтому должны быть оптимизированы для клеток вложения. Например если ячейки не похоже чтобы прикрепить, поверхностных модификаций придется происходят на пластину microfluidic до посева или может потребоваться более длительное время инкубаций. Важно также, чтобы убедиться, что Микроскоп правильно настроен для получения изображения в фокусе и должно периодически контролироваться на протяжении эксперимента, чтобы заверить, что качество изображения получаются. Если фокус находится вне, Микроскоп могут и должны быть скорректированы, как эксперимент продолжается. Во время приобретения изображений последней волны должно быть присвоено Все закрыты для того, чтобы избежать воздействия фильтров и освещение, чтобы только один канал во время ожидания, что происходит между изображения приобретений. Кроме того анализ изображений, который определяет % поверхности покрытия была разработана в доме, потому что монтаж программное обеспечение руководства явно не излагается процедура. Кроме того с тем чтобы расширить анализ изображений и определить другие характеристики, такие как шероховатости поверхности и др., открытого исходного кода Python45 была разработана в доме и общей на хранилище gitHub. Существуют также ограничения на сколько данных может храниться и управляемых на локальном жестком диске, так как CyVerse46необходим внешний жесткий диск или совместного использования данных в сети.
Обычные биореакторов, как CDC реактора и капельного потока реактор34, требуют много средств массовой информации, предоставляют меньше размера выборки и требуют большого количества стерилизации оборудования. В противоположность этому преимущества этой более высокой пропускной способности платформы включают в себя способность управления сдвига, скорости потока, и предположение, что в пробирке экспериментов тесно напоминают в vivo условий. Недостатки системы включают в себя несколько аксессуары и программное обеспечение, которое требует тщательной настройки, которые необходимо выполнить в правильном порядке событий. Кроме того в руководстве, для оборудования полностью не объяснять каждый шаг экспериментов, и программного обеспечения команд, и следовательно, многие ошибки возникают во время экспериментов, в том числе закупорку каналов, отсутствие роста или вложения, или отсутствие высокого качества микроскопии изображений или фильмов. Сам инструмент и расходные материалы, такие как microfluidic пластины, также являются относительно дорогими с ценой более $ 200 за тарелку и не являются многоразовыми. Таким образом в то время как техника одалживает весомых результатов, технического опыта, необходимых для его использования является относительно высоким и требует повторного обучения экспертов в области. В настоящем докладе предпринимается попытка решить эту проблему, предоставляя руководство по новым пользователям этих биореакторов для изучения характеристик биопленки.
Microfluidic системы, которая способна выполнять клеточного анализа, получила значительное внимание для различных научных методов, таких как в микробиологии, иммунологии, гематологии, онкологии и исследования стволовых клеток. Говоря более конкретно технология привела во многих публикациях, описание темы, которые весьма актуальны для медицинских применений37,47, включая микробной устные адгезии48, определение последствий biosurfactants на синегнойной палочки и золотистого стафилококка49,50, принимающей возбудителя взаимодействий в E. coli51, Streptococcus присоединение52и лечение кистозный фиброз53. Учитывая тот факт, что эта система microfluidic является очень гибким, предполагается, что все больше и больше систем будут распространены во всем мире.
Следует тщательно рассмотреть некоторые конкретные протокол шаги. Средства массовой информации может быть разбавлен до 50% с dH2O, чтобы помочь предотвратить пузыри и засорение, но не требуется, в данном случае. Конкретное значение ОД600 используется для заполнения должны определяться с помощью суда работает роста эксперимента чтобы увидеть, что работает лучше всего для конкретного набора условий. Пузыри в скважинах до уплотнения может привести к пузырей в каналах microfluidic и должны быть удалены путем выскочил или сосать вне с кончиком пипетки. Важно сохранить бактерии из небольшой серпантином каналы. Имея равные объемы средств массовой информации в ввода и вывода во время процесса инициализации, поток из-за давления от объема жидкости будет контролироваться так поток только благодаря приложенное давление из системы. Калибровка расстояния следует настроить во время установки представителем компании. Эти параметры являются специфическими для каждой камеры.
Существует несколько проблем, которые возникают, когда нахождение порог наиболее представительных для изображения. Установка максимального порогового значения может быть трудно, если интенсивность средняя пикселей по регионам фона согласуются не вызвало выбрав стадии позицию, которая не находится в центре канала или от мусора на плите. Мм стандартнажмите на процесс, а затем выберите фон и коррекции затенения инструмент для коррекции этих несоответствий. Однако этот инструмент является как правило только полезно, если пользователь принял изображения каналов перед посевом, которые они могут использовать в качестве исходных образов. Или, если фон/затенение ссылкой изображения недоступен, пользователю будет нужно использовать свои грехи, чтобы задать пороговое значение, которое охватывает наиболее область ячейки без включая фоном для всего изображения. Кроме того выберите представителя областей для измерения, которые исключает регионы несоответствие нажмите Прямоугольную область, Эллипс регионаили Региона трассировки выберите регион и выберите Активную область , вместо того, чтобы весь Изображение на окне Показать область статистики (под Инструменты анализа). Если представитель региона используется для порога светлые области изображения, того же региона должны использоваться для определения соответствующего изображения FITC. Это полезно для записи конкретных пространственная статистика (слева, сверху, Ширина, Высота, площадь, периметр), связанные с представителем региона так же региона будут найдены и измерено на соответствующее изображение FITC.
Для предотвращения накопления данных на жестком диске, что приведет к компьютеру замедляться, можно приобрести внешний жесткий диск для хранения данных. Еще один вариант для хранения данных и облегчения обмена данными является платформой биоинформатики CyVerse. Создайте учетную запись в системе CyVerse, перейдя в http://www.cyverse.org/. После входа в систему запуск обнаружения среды, а затем выберите «Журнал в CyVerse». Выберите «данные» и перейдите к ты папке. Если стек изображений на локальном компьютере, выберите «загрузить», то «Простой загрузки от настольного компьютера». Найдите файл изображения стека и выберите для загрузки. Файл или папка может совместно с сотрудниками, если они имеют CyVerse счета и предоставляются разрешения. Совместное использование папки данных для широкой общественности требует, что метаданные добавлен для каждого файла с помощью CyVerse утвержденных стандартов. Эта процедура не будет обсуждаться здесь, потому что это не в рамках этой работы.
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Эта работа стала возможной благодаря субсидии от национального института для общей медицинской науки (NIGMS) (5P20GM103427), компонент национальных институтов здравоохранения (НИЗ)
Материалы
| Name | Company | Catalog Number | Comments |
| Ammonium Chloride, ACS | VWR | BDH9208-500G | Part of the minimal media composition |
| BioFlux 1000 48 Well Low Shear Plate | Fluxion Biosciences | 910-0047 | |
| BioFlux 1000Z Microfluidic Imaging System | Fluxion Biosciences | BF 1000Z | |
| Calcium Chloride Dihydride, ACD Grade | VWR | 97061-904 | Part of the minimal media composition |
| Dextrose, Anhydrous, ACS | VWR | BDH9230-500G | Part of the minimal media composition |
| Magnesium Sulfate ACS Grade | VWR | EM-MX0070-1 | Part of the minimal media composition |
| Potassium Phosphate Monobasic, ACS Grade | VWR | BDH9268-500G | Part of the minimal media composition |
| Pseudomonas Aeurginosa GFP | ATCC | 15692GFP | Pseudomonas aeurinosa bacterial strain PA01 with GFP modification used for this study. |
| Sodium Chloride, ACS | VWR | BDH9286-500G | Part of the minimal media composition |
| Sodium Phosphate, Monobasic, Anhydrous, Reagent Grade | VWR | 97061-942 | Part of the minimal media composition |
Ссылки
- Donlan, R. M., et al. Model System for Growing and Quantifying Streptococcus pneumoniae Biofilms In Situ and in Real Time. Applied and Environmental Microbiology. 70 (8), 4980-4988 (2004).
- Lührig, K., et al. Bacterial Community Analysis of Drinking Water Biofilms in Southern Sweden. Microbes and Environments. 30 (1), 99-107 (2015).
- Singh, R., Paul, D., Jain, R. Biofilms: implications in bioremediation. Trends in Microbiology. 14 (9), 389-397 (2006).
- Veerachamy, S., et al. Bacterial adherence and biofilm formation on medical implants: A review. Proceedings of the Institution of Mechanical Engineers, Part H: Journal of Engineering in Medicine. 228 (10), 1083-1099 (2014).
- Lyczak, J. B., Cannon, C. L., Pier, G. B. Establishment of Pseudomonas aeruginosa infection: lessons from a versatile opportunist. Microbes and Infection. 2 (9), 1051-1060 (2000).
- Percival, S. L., Knapp, J. S., Edyvean, R., Wales, D. S. Biofilm Development On Stainless Steel In Mains Water. Water Research. 32 (1), 243-253 (1998).
- Percival, S. L., Knapp, J. S., Wales, D. S., Edyvean, R. G. J. The effect of turbulent flow and surface roughness on biofilm formation in drinking water. Journal of Industrial Microbiology and Biotechnology. 22 (3), 152-159 (1999).
- Ling, F., Whitaker, R., LeChevallier, M. W., Liu, W. -T. Drinking water microbiome assembly induced by water stagnation. The ISME Journal. , 1(2018).
- Moss, B. Water pollution by agriculture. Philosophical Transactions of the Royal Society B: Biological Sciences. 363 (1491), 659-666 (2008).
- Schultz, M. P., Bendick, J. A., Holm, E. R., Hertel, W. M. Economic impact of biofouling on a naval surface ship. Biofouling. 27 (1), 87-98 (2011).
- Tornero, V., Hanke, G. Chemical contaminants entering the marine environment from sea-based sources: A review with a focus on European seas. Marine Pollution Bulletin. 112 (1-2), 17-38 (2016).
- LaBauve, A. E., Wargo, M. J. Growth and Laboratory Maintenance of Pseudomonas aeruginosa. Current Protocols in Microbiology. 25 (1), 1-8 (2012).
- He, J., et al. The broad host range pathogen Pseudomonas aeruginosa strain PA14 carries two pathogenicity islands harboring plant and animal virulence genes. Proceedings of the National Academy of Sciences of the United States of America. 101 (8), 2530-2535 (2004).
- Shaner, N. C., Steinbach, P. A., Tsien, R. Y. A guide to choosing fluorescent proteins. Nature Methods. 2 (12), 905-909 (2005).
- Zhang, G., Gurtu, V., Kain, S. R. An Enhanced Green Fluorescent Protein Allows Sensitive Detection of Gene Transfer in Mammalian Cells. Biochemical and Biophysical Research Communications. 227 (3), 707-711 (1996).
- Patterson, G. H., Knobel, S. M., Sharif, W. D., Kain, S. R., Piston, D. W. Use of the green fluorescent protein and its mutants in quantitative fluorescence microscopy. Biophysical Journal. 73 (5), 2782-2790 (1997).
- Chalfie, M., Tu, Y., Euskirche, G., Ward, W. W., Prashert, D. C. Green fluorescent protein as a marker for gene expression. Science. 263 (5148), 802-805 (1994).
- Heim, R., Prasher, D., Tsien, R. Wavelength mutations and posttranslational autoxidation of green fluorescent protein. Proceedings of the National Academy of Sciences of the United States of America. 91, 12501-12504 (1994).
- Bakke, R., Kommedal, R., Kalvenes, S. Quantification of biofilm accumulation by an optical approach. Journal of Microbiological Methods. 44 (1), 13-26 (2001).
- Heydorn, A., et al. Statistical analysis of Pseudomonas aeruginosa biofilm development: impact of mutations in genes involved in twitching motility, cell-to-cell signaling, and stationary-phase sigma factor expression. Applied and Environmental Microbiology. 68 (4), 2008-2017 (2002).
- Wilson, E., et al. Using Fluorescence Intensity of Enhanced Green Fluorescent Protein to Quantify Pseudomonas aeruginosa. Chemosensors. 6 (21), (2018).
- Fang, H., Chen, Y., Huang, L., He, G. Analysis of biofilm bacterial communities under different shear stresses using size-fractionated sediment. Scientific Reports. 7 (1), 1299(2017).
- Saunders, K. A., Greenman, J. The formation of mixed culture biofilms of oral species along a gradient of shear stress. Journal of Applied Microbiology. 89 (4), 564-572 (2001).
- Valquier-Flynn, H., Wilson, C. L., Holmes, A. E., Wentworth, C. D. Growth Rate of Pseudomonas aeruginosa Biofilms on Slippery Butyl Methacrylate-Co-Ethylene Dimethacrylate (BMA-EDMA), Glass and Polycarbonate Surfaces. Journal of Biotechnology & Biomaterials. 7 (4), (2017).
- Trulear, M. G., Characklis, W. G. Dynamics of biofilm processes. Journal (Water Pollution Control Federation). 54 (9), 1288-1301 (1982).
- Machineni, L., Rajapantul, A., Nandamuri, V., Pawar, P. D. Influence of Nutrient Availability and Quorum Sensing on the Formation of Metabolically Inactive Microcolonies Within Structurally Heterogeneous Bacterial Biofilms: An Individual-Based 3D Cellular Automata Model. Bulletin of Mathematical Biology. 79 (3), 594-618 (2017).
- Jiao, Y., et al. Identification of Biofilm Matrix-Associated Proteins from an Acid Mine Drainage Microbial Community. Applied and Environmental Microbiology. 77 (15), 5230-5237 (2011).
- Flemming, H. C., Wingender, J. The Biofilm Matrix. Nature Reviews Microbiology. 8 (9), 632-633 (2010).
- Yang, X., Beyenal, H., Harkin, G., Lewandowski, Z. Quantifying biofilm structure using image analysis. Journal of Microbiological Methods. 39 (2), 109-119 (2000).
- Heydorn, A., et al. Quantification of biofilm structures by the novel computer program COMSTAT. Microbiology. 146 (10), 2395-2407 (2000).
- Azeredo, J., et al. Critical review on biofilm methods. Critical Reviews in Microbiology. 43 (3), 313-351 (2017).
- Goeres, D. M., et al. A method for growing a biofilm under low shear at the air liquid interface using the drip flow biofilm reactor. Nature Protocols. 4 (3), 783-788 (2009).
- Goeres, D. M., et al. Statistical assessment of a laboratory method for growing biofilms. Microbiology. 151, 757-762 (2005).
- Swartz, K., Stephenson, R., Hernandez, M., Jambang, N., Boles, B. R. The use of Drip Flow and Rotating Disk Reactors for Staphylococcus aureus biofilm analysis. Journal of Visual Experiments. (46), e2470(2010).
- Werner, E., et al. Stratified Growth in Pseudomonas aeruginosa Biofilms. Applied and Environmental Microbiology. 70 (10), 6188-6196 (2004).
- Wilson, C., et al. The Quantitative Assessment of Pseudomonas aeruginosa (PA)14 Biofilm Surface Coverage on Slippery Liquid Infused Polymer Surfaces (SLIPS). International Journal of Nanotechnology in Medicine & Engineering. 3 (3), 35-42 (2018).
- Samarian, D. S., Jakubovics, N. S., Luo, T. L., Rickard, A. H. Use of a High-throughput In Vitro Microfluidic System to Develop Oral Multi-species Biofilms. Journal of Visualized Experiments. (94), 52467(2014).
- Rusconi, R., Garren, M., Stocker, R. Microfluidics Expanding the Frontiers of Microbial Ecology. Annual Review of Biophysics. 43, 65-91 (2014).
- Kim, J., Park, H. -D., Chung, S. Microfluidic Approaches to Bacterial Biofilm Formation. Molecules. 17 (8), 9818-9834 (2012).
- Mosier, A. P., Cady, N. C. Analysis of bacterial surface interactions using microfluidic systems. Science Progress. 94 (4), 431-450 (2011).
- Nobile, C. J., Johnson, A. D. Candida albicans Biofilms and Human Disease. Annual Review of Microbiology. 69, 71-92 (2015).
- Chandra, J., Kuhn, D. M., Mukherjee, P. K., Hoyer, L. L., McCormick, T., Ghannoum, M. A. Biofilm Formation by the Fungal Pathogen Candida albicans: Development, Architecture, and Drug Resistance. Journal of Bacteriology. 183 (18), 5385-5394 (2001).
- Vasconcelos, M. A., et al. Effect of Algae and Plant Lectins on Planktonic Growth and Biofilm Formation in Clinically Relevant Bacteria and Yeasts. BioMed Research International. 2014, 9(2014).
- Haralick, R. M., Shanmugam, K., Dinstein, I. Textural Features for Image Classification. IEEE Transactions on Systems, Man, and Cybernetics. 3 (6), 610-621 (1973).
- Wentworth, C. D. Biofilm Morphology Suite. , Available from: https://github.com/cdwentworth/Biofilm-Morphology-Suite.git (2018).
- Cyverse. , Available from: https://user.cyverse.org/services/mine (2018).
- Benoit, M. R., Conant, C. G., Ionescu-Zanetti, C., Schwartz, M., Matin, A. New Device for High-Throughput Viability Screening of Flow Biofilms. Applied and Environmental Microbiology. 76 (13), 4136-4142 (2010).
- Ding, A. M., Palmer, R. J., Cisar, J. O., Kolenbrander, P. E. Shear-Enhanced Oral Microbial Adhesion. Applied and Environmental Microbiology. 76 (4), 1294-1297 (2010).
- Diaz De Rienzo, M. A., Stevenson, P. S., Marchant, R., Banat, I. M. Effect of biosurfactants on Pseudomonas aeruginosa and Staphylococcus aureus biofilms in a BioFlux channel. Applied Microbiology and Biotechnology. 100 (13), 5773-5779 (2016).
- Moormeier, D. E., Bayles, K. W. Staphylococcus aureus Biofilm: A Complex Developmental Organism. Molecular Microbiology. 104 (3), 365-376 (2017).
- Tremblay, Y. D. N., Vogeleer, P., Jacques, M., Harel, J. High-Throughput Microfluidic Method To Study Biofilm Formation and Host-Pathogen Interactions in Pathogenic Escherichia coli. Applied and Environmental Microbiology. 81 (8), 2827-2840 (2015).
- Nobbs, A. H., Lamont, R. J., Jenkinson, H. F. Streptococcus Adherence and Colonization. Microbiology and Molecular Biology Reviews. 73 (3), 407-450 (2009).
- Díez-Aguilar, M., Morosini, M. I., Köksal, E., Oliver, A., Ekkelenkamp, M., Cantón, R. Use of Calgary and Microfluidic BioFlux Systems To Test the Activity of Fosfomycin and Tobramycin Alone and in Combination against Cystic Fibrosis Pseudomonas aeruginosa Biofilms. Antimicrobial Agents and Chemotherapy. 62 (1), 01650-01717 (2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены