Method Article
Первичная культура клеток очищенных ГАМК или глутамергических нейронов, созданных с помощью флуоресценции активированной сортировки клеток
В этой статье
Резюме
Этот протокол описывает метод сортировки клеток для очистки и культуры флуоресцентных ГАМК-нейронов из неокортекса и гиппокампа послеродовых мышей или крыс.
Аннотация
Общая цель этого протокола заключается в генерации очищенных нейронных культур, полученных либо из ГАМК или глутаматергических нейронов. Очищенные нейроны могут быть культивированы в определенных средствах массовой информации в течение 16 дней в пробирке и поддаются любым анализам, обычно проводимым на разрозненных культурах, включая электрофизиологические, морфологические и анализы выживания. Основным преимуществом этих культур является то, что конкретные типы клеток могут быть выборочно изучены в отсутствие сложных внешних воздействий, таких как те, которые возникали из глиальных клеток или других типов нейронов. При планировании экспериментов с очищенными клетками, однако, важно отметить, что нейроны сильно зависят от глии кондиционированных средств для их роста и выживания. Кроме того, глутаматергические нейроны также зависят от глиа-секретных факторов для установления синаптической передачи. Поэтому мы также описываем метод совместного культивирования нейронов и глиальных клеток в бесконтактной договоренности. Используя эти методы, мы выявили основные различия между развитием ГАМК и глутаатергических нейронных сетей. Таким образом, изучение культур очищенных нейронов имеет большой потенциал для дальнейшего нашего понимания того, как развивается и функционирует нервная система. Кроме того, очищенные культуры могут быть полезны для исследования прямого действия фармакологических агентов, факторов роста или для изучения последствий генетических манипуляций на конкретные типы клеток. По мере того как все больше и больше трансгенных животных становятся доступными, маркировка дополнительных конкретных типов клеток интерес, мы ожидаем, что протоколы, описанные здесь будет расти в их применимости и потенциал.
Введение
Сортировка клеток является мощным инструментом для изоляции живых клеток, представляющих интерес, от разнородной смеси клеток. Клетки могут быть отсортированы на основе размера и формы критериев, а также выражение флуоресцентных маркеров1,2. Часто флюорофор-конъюгированные антитела используются для обозначения различныхтипов клеток, ориентируясь на клеточные поверхностные антигены 3,4. Кроме того, трансгенных животных или вирусных систем доставки были разработаны, чтобы выразить флюорофоры под клеток конкретных промоутеров5,6. Исторически разработка трансгенных инструментов и животных была дорогостоящей и трудоемкой. В последнее время сокращение расходов и сокращение технических трудностей привели к резкому увеличению числа имеющихся репортерских линий. По мере того как наличие трансгенных инструментов и животных репортера продолжает сядете, также должно быть полезность и применимость флуоресцентных методов сортировки клеток.
Недавно мы показали, что сортировка клеток от трансгенных животных может быть регулярно применяется для очистки первичных нейронов в рамках подготовки к клеточной культуре7. Путем сортировки клеток от крыс или мышей, мы смогли изолировать и культуры флуоресцентных нейронов, которые выражают флуоресцентные белки репортера конкретно либо ГАМК или глутамерных нейронов6,8,9. Изучая эти очищенные нейронные культуры, мы смогли определить важную разницу в том, как ГАМК и глутамергические нейроны зависят от глиа-секретных факторов для создания синаптической передачи7. Кроме того, путем совместного культивирования скользящих клеток с очищенными нейронами, мы смогли расширить на предыдущих наблюдений, демонстрирующих важную роль, что глиальные клетки играют в росте и выживании нейронов10,11. Таким образом, благодаря сочетанию клеточной сортировки и клеточной культуры, мы смогли изучить не только развитие конкретных типов нейронов в изоляции, но и сследовать влияние глиальных клеток на их функцию.
Мы представляем здесь протокол для очистки и культуры ГАМК и глутамергических нейронов из коры и гиппокампа трансгенных мышей или крыс. Мы также представляем метод бесконтактной кокультуры очищенных нейронов и глиальных клеток, адаптированный из Geissler et al.12. Для того, чтобы генерировать очищенные ГАМК-культуры, мы отсортировали флуоресцентные нейроны из VGAT-Venus-A Wistar крыс8 или VGAT-Venus мышей13, которые избирательно выразить расширенный желтый вариант флуоресцентного белка (Венера) в корковых ГАМК нейронов. Для генерации очищенных глутамерных культур мы отсортировали флуоресцентные нейроны из NexCre; Ai9 мышей6,9, которые выражают tdTomato в корковых глутамерных нейронов. Вся процедура сортировки и культуры может быть выполнена в течение 3-4 ч и может быть использована для создания сотен повторяющих культур, пригодных для электрофизиологического, морфологического и анализа выживаемости клеток. Метод прост, воспроизводим и может производить очищенные нейронные культуры, которые превышают 97% чистой для клеточного типа интереса.
протокол
Все процедуры и содержание животных были выполнены в соответствии с институциональными руководящими принципами, Немецким Законом о защите животных и Директивой Европейского совета 86/609/EEC в отношении защиты животных, при наличии разрешений от местных власти (Lageso Берлин, T-0215/11).
ПРИМЕЧАНИЕ ОТНОсяСЬ к СВЕДЕНИ Этот протокол описывает культуру очищенных нейронов от одной трансгенной мыши или крысиного щенка (послеродовой день 0-2). Все методы должны быть выполнены в стерильных условиях. Все растворы должны быть стерилизованы с помощью фильтра 0,2 мкм (см. Таблицаматериалов). Стеклянные крышки и инструменты вскрытия должны быть стерилизованы в течение 3 ч при температуре 185 градусов по Цельсию.
1. Покрытие стекла крышки с поли-L-лизин
- Подготовка стеклянных покрывало путем размораживания 5 мл аликвот аликот аликот 200 мкг/мл поли-L-лизин (PLL) раствор. Разбавить этот запас раствор до 20 мкг/мл, добавив 45 мл чистой воды инъекционного класса. Фильтр-стерилизовать раствор в новую коническую трубку 50 мл. Пометьте эту трубку как "PLL Стерильный".
ПРИМЕЧАНИЕ ОТНОсяСЬ к СВЕДЕНИ Используйте воду, хранящуюся при комнатной температуре, чтобы ускорить процесс размораживания. - Добавьте 100 стерильных, круглых, 12 мм стеклянных крышки к стерильному раствору PLL. Агитировать трубку каждые 5-10 минут, в течение 2-3 мин, чтобы обеспечить равномерное покрытие. Пальто coverslips таким образом в течение 1 ч.
ПРИМЕЧАНИЕ ОТНОсяСЬ к СВЕДЕНИ Немецкие производства круглые стеклянные крышки (диаметр 12 мм) являются предпочтительными, так как они обеспечивают надежную поверхность культуры и легко помещается в колодцы 24-хорошо пластины культуры клеток. - После 40 минут покрытия PLL, возьмите 2 куска бумаги и положите их плоским в шкаф потока. Стерилизовать бумагу с помощью 70% этанола, затем сгладить, чтобы удалить складки и оставить высохнуть.
- После покрытия стеклянные крышки на 1 ч с PLL, удалить избыток раствора PLL и добавить стерильную воду класса инъекций. Аккуратно агитировать крышки для 2-3 с, чтобы позволить удаление избытка PLL. Повторите этот шаг промывки 2 дополнительных раз.
- Удалить избыток воды, а затем передать крышки на стерильную бумагу ткани. Тщательно отделить каждый coverslip с помощью изогнутых щипц и оставить высохнуть.
ПРИМЕЧАНИЕ ОТНОсяСЬ к СВЕДЕНИ Крышки, которые не легко отделить могут быть отброшены. Кроме того, небольшое количество воды может быть добавлено, чтобы помочь разделения. - После высыхания, передача крышки на 24-хорошо культуры пластины.
ПРИМЕЧАНИЕ ОТНОсяСЬ к СВЕДЕНИ Обложки должны быть готовы примерно 30 мин-1 ч до начала процесса вскрытия. Плиты могут храниться в инкубаторе при 37 градусах Цельсия и 5% CO2 до тех пор, пока это не потребуется.
2. Диссоциация гиппокампа и кортикальных тканей
- Подготовка решений для клеточной культуры
- Для диссоциации нервной ткани, сначала разморозить 40 мл аликот аликот клеточной культуры буфера (композиция (в ММЗ) 116 NaCl, 5.4 KCl, 26 NaHCO3, 1.32PO4, 1 MgSO4no 7H2O, 1 CaCl22H2O, 0.5 EDTA 2На-2H2O и 25 D-глюкозы, рН 7,4). Измерьте 12 мл буфера клеточной культуры к конической трубке 15 мл; ярлык как "BSA". Измерьте из 5 мл буфера культуры клеток к другой трубке 15 мл; ярлык как "папаин". Инкубировать обе трубы в водяной бане в течение 15 минут при 37 градусах Цельсия.
- Фильтр-стерилизовать оставшийся буфер культуры ячейки, ярлык как "Буфер - стерильный" и хранить на 4 кК до тех пор, пока требуется.
- Взвесьте 120 мг крупной сыворотки Альбумина (BSA) и добавьте в трубку с надписью "BSA". Взвесьте 7 мг папаина и добавьте в трубку с надписью "папаин". Верните обе трубы на водяную баню в течение 15 минут.
ПРИМЕЧАНИЕ ОТНОсяСЬ к СВЕДЕНИ Полезно добавить небольшое количество буфера к пару лодки для облегчения передачи порошок папаин. - После того, как все порошки растворяются, фильтр-стерилизовать каждый раствор в свежем 15 мл конической трубки. Для трубки папаин, пометить отфильтрованное решение как "папаин - стерильный". Для трубки BSA разделите стерильный раствор BSA на 3 трубки, каждая из которых содержит 4 мл раствора BSA. Этикетка каждой трубки, как "BSA - стерильные" и либо "1", "2" или "3". Вернуть все трубки обратно в водяную ванну и продолжать инкубировать при 37 градусов по Цельсию до тех пор, пока требуется.
- Препарат для вскрытия тканей
- Возьмите один кусок фильтровальной бумаги 35 мм (см. ТаблицуМатериалов) и стерилизуйте с помощью 70% этанола; оставить высохнуть в крышке 100 мм Петри блюдо, в шкафу потока.
- Выложить ножницы, щипцы, скальпель и шпатель (см. Таблица материалов), необходимых для вскрытия гиппокампа и коры головного мозга.
- Поместите две 35-мм блюда Петри и 100-мм чашку Петри, содержащую стерильную фильтровальную бумагу, в доступном месте в центре шкафа.
- Сбор трансгенных NexCre; Ai9 и VGAT Венера мыши щенки, которые должны быть вскрыты. Используйте флуоресцентную лампу с соответствующими фильтрами возбуждения и выбросов (см. ТаблицаМатериалов), чтобы различать флуоресцентных щенков от диких littermates типа.
- Непосредственно перед вскрытием животных, заполнить каждый 35 мм Петри блюдо с охлажденной, стерильной культуры клеточной культуры буфера.
ПРИМЕЧАНИЕ ОТНОсяСЬ к СВЕДЕНИ Одно блюдо Петри предназначено для очистки инструментов между вскрытиями, а другое предназначено для сбора гиппокампа и коры головного мозга.
- Рассечение тканей
- Как только буфер культуры клетки налит, обезглавить послеродовой день 0-2 трансгенной мыши или щенка крысы используя большие, острые ножницы и используйте стерильное тарелку 100 mm Petri для того чтобы перенести головку в шкаф потока. Используйте щипцы, ножницы и шпатель, чтобы тщательно перенести мозг трансгенного щенка на стерильную фильтровальную бумагу.
- Используйте скальпель типа 22, чтобы вскрыть мозжечок и отделить 2 полушария. Используйте небольшой шпатель, чтобы свернуть полушария боковой. На каждом полушарии, нажмите вниз осторожно, так что кора вступает в контакт с фильтровальной бумагой. Аккуратно перемещать области среднего мозга, чтобы выявить гиппокампа и коры головного мозга.
ПРИМЕЧАНИЕ ОТНОсяСЬ к СВЕДЕНИ Будьте осторожны, чтобы не применять слишком большое давление при нажатии вниз на полушариях или клетки могут стать раздавлены. - Используйте скальпель или шпатель, чтобы отделить гиппокамп и кору от каждого полушария. Перенесите расчлененные ткани в 35-мм чашку Петри, содержащую охлажденный буфер культуры клеток.
ПРИМЕЧАНИЕ ОТНОсяСЬ к СВЕДЕНИ При вскрытии нескольких животных храните стерильный буфер культуры клеток в конической трубке 50 мл на льду. После каждого вскрытия перенесите расчлененные ткани в охлажденный буфер культуры клеток. - После успешного вскрытия ткани кортико-гиппокампа, перенесите стерильный пасинраствор из водяной ванны в шкаф. Используйте 3 мл пастерной пипетки для передачи расчлененных гиппокампа и коры головного мозга на крышку стерильной 35 мм чашки Петри. Чоп в крест-накрест движения, используя плоскую часть типа 22 скальпель, пока ткань не будет на мелких кусочках.
- Используйте небольшое количество папинского раствора для переноса нарезанной ткани из крышки блюда Петри в стерильную папинную трубку. Вернуть трубку папаина на водяную баню и инкубировать ткани при 37 градусов по Цельсию в течение 25 минут.
- Во время папаин инкубации, составляют полное решение флуоресценции средств массовой информации. Разморозить 1 мл аликвот B27, 0,5 мл аликвот алиста Glutamax и 0,5 мл аликвот Алет Пен-Стреп. Aliquot 48.5 ml Hibernate Низкий флуоресценция средств массовой информации до 50 мл конической трубки. Добавьте в решение B27, Glutamax и Pen-Strep. Встряхните решение хорошо, затем фильтр-стерилизовать и этикетки, как "Hibernate полный носитель" (с датой и инициалами). Инкубировать при 37 градусах Цельсия на водяной бане.
- После инкубации папаина перенесите папаин-трубку и стерильные BSA-трубки в шкаф потока. Используйте 1 мл пастерной пипетки, чтобы удалить только ткани кортико-гиппокампа из папинской трубки в BSA-трубку 1.
ПРИМЕЧАНИЕ ОТНОсяСЬ к СВЕДЕНИ Позаботьтесь, чтобы свести к минимуму передачу избыточного решения папаина.
- Диссоциация клеток
- Для того, чтобы разбить любые большие скопления ткани, triturate ткани несколько раз с помощью 1 мл Пастер пипетка. После этого, triturate ткани 7 раз с помощью тонкой наконечник пастерпиец пипетка. Оставьте ткань стоять в течение 30 с, что позволяет большие куски ткани в отложения.
- После 30 с, передача нижней 1 мл раствора и ткани от BSA-трубки 1 в BSA-трубку 2. Triturate ткани в BSA-трубки 2 несколько раз с помощью тонкой наконечник пастера пипетки.
- После трихариаляции, снова передать нижний 1 мл ткани и раствор от BSA-трубки 1, но теперь в BSA-трубку 3. Тритурировать ткани в BSA-трубки 3 несколько раз с помощью тонкой наконечник пастерпиец пипетка.
- После тритурации, передать все растворимые и ткани из труб 2 и 3 в BSA-трубки 1. Тритуруировать еще 2-3 раза и центрифугу при 3000 х г в течение 3 мин.
- Во время центрифугации, составляют полный нейронных базальных средств массовой информации (NBA СМИ). Aliquot 48.5 мл носителей НБА к онической трубке 50 мл и инкубировать при 37 градусов по Цельсию в водяной бане. Этикетка эта трубка "ТОЛЬКО НБА". Кроме того, разморозить 1 мл аликвот B27, 0,5 мл аликвот алиста Glutamax и 0,5 мл аликот Pen-Strep при комнатной температуре.
- После центрифугации, тщательно удалить супернатант из гранулированной ткани и повторно приостановить клетки в 2 мл полных носителей. Используйте пипетку P1000, чтобы тритурировать ткани вверх и вниз 20 раз.
ПРИМЕЧАНИЕ ОТНОсяСЬ к СВЕДЕНИ Позаботьтесь, чтобы не pipette клетки слишком энергично. Если слишком большое давление применяется, клетки могут быть повреждены. - Используйте 1 мл пастерной пипетки для фильтрации клеточной подвески через 30 мкм ячейки сито в пробы трубки образца.
ПРИМЕЧАНИЕ ОТНОсяСЬ к СВЕДЕНИ Если суспензия клетки не проходит сразу через клеточное сито, может потребоваться нажать на верхнее сито стерильной перчаткой, чтобы запустить поток. Этот важный шаг предотвращает засорение сортировки ячейки. - Для сбора нейронов после сортировки подготовьте коллекторские трубки путем пайпетации 300 л полных носителей до необходимого количества полипропиленовых трубок.
- Подвеска ячейки теперь готова к отнесению к сортировке ячейки для сортировки. Возьмите подвеску ячейки, дополнительные трубки сбора и запасные части полного носителя в случае разбавления образца не требуется.
3. Сортировка клеток очищенных ГАМК или глутаматергических нейронов
ПРИМЕЧАНИЕ ОТНОсяСЬ к СВЕДЕНИ Чтобы свести к минимуму вероятность бактериального загрязнения во время сортировки промыть образец трубки сортировки с 70% этанола, по крайней мере 5 мин до сортировки. Параметры детальной сортировки различаются между инструментами, фундаментальные соображения следующие.
- Во время первого сортировки клеток, установить уровни фоновой флуоресценции из немаркированных клеток путем сортировки и сравнения клеток из дикого типа животных.
- Для каждого типа флуоресцентных клеток, которые будут отсортированы, выберите соответствующие фильтры возбуждения и выбросов. Возбуждают белки Venus и TdTomato, используя 488 нм или 531 нм длин волн возбуждения, соответственно. Обнаружить излучаемый свет через наборы фильтров для выбросов 530/40 и 575/30 соответственно.
- Добавьте трубки сбора полипропилена, содержащие 300 л полных носителей, в сортировку клеток для сбора клеток.
- Для высокой чистоты сортируйте ярко обозначенные флуоресцентные клетки (см. рисунок 1B, например, точечные участки отсортированных клеток).
- После сортировки, для достижения оптимальных результатов, выполнить тест чистоты отсортированных клеток для оценки уровня чистоты. Обратите внимание, что типичная скорость восстановления клеток после сортировки составляет от 70 до 80%.
- Запишите количество ячеек, отсортированных в каждой трубке сбора. Это значение дается инструментом сортировки ячейки.
ПРИМЕЧАНИЕ ОТНОсяСЬ к СВЕДЕНИ Сортировка клеток может быть выполнена с помощью 70 мкм сопло (70 psi оболочки жидкости давления) или 100 мкм сопло (20 psi оболочки давления жидкости).
4. Культивирование сортировочных нейронов
- После сортировки ячеек, передача собранных клеток 2 мл круглых нижних центрифуг труб, используя 1 мл Пастер пипетка. Центрифуги клетки на 3000 х г в течение 3 мин, чтобы сформировать клетку гранулы.
ПРИМЕЧАНИЕ ОТНОсяСЬ к СВЕДЕНИ Чтобы помочь определить местоположение клеточной гранулы, сориентируйте круглые нижние центрифуги с шарниром крышки, обращенной наружу, что позволяет клеточной грануле образовываться на задней части центрифуги (т.е. на той же стороне трубки, что и шарнир). - Во время центрифугации добавьте 1 мл B27, 0,5 мл Glutamax и 0,5 мл Pen-Strep к 48,5 мл предварительно разогретых СМИ НБА. Встряхните решение хорошо, затем фильтр стерилизовать и этикетки, как "NBA полный сми" (с датой и инициалами). Вернуться к водяной бане до тех пор, пока требуется.
- После центрифугации, используйте 1 мл Пастер пипетка для передачи супернатанта в другой центрифуги трубки (сохранить супернатант incase клетки гранулы был нарушен). Повторно приостановить клеточные гранулы в необходимом количестве предварительно подогретых полных носителей НБА для достижения плотности клеток 1000 клеток / Л. Повторно приостановить клетки пипеткой вверх и вниз с P200 или P1000 пипетка.
- Чтобы подтвердить наличие разъединенных клеток, проверьте клеточный раствор под микроскопом, используя объектив объективной линзы 4x или 10x. Кроме того, пипетка небольшое количество клеточного раствора на coverslip и проверить под микроскопом. Если большое количество клеток присутствует, супернатант со ступени 4.3 может быть отброшен.
- Перед покрытием клеток, вихрь на средней скорости для 2-3 с, чтобы обеспечить ровную суспензию клетки. После вихря, быстро пипетка 10 злител клеточной подвески в центр каждого coverslip. После трубации клеток, быстро вернуть каждую пластину в инкубатор (5% CO2/37 КК) и инкубировать в течение 1 ч.
ПРИМЕЧАНИЕ ОТНОсяСЬ к СВЕДЕНИ При добавлении клеток в несколько 24-колодцев, обеспечить даже плотность клеток вихревыми клетками между пластинами. - После 1 ч, кормить клетки с 500 Л предварительно нагревается полный НБА средств массовой информации и вернуться в инкубатор.
ПРИМЕЧАНИЕ ОТНОсяСЬ к СВЕДЕНИ При кормлении клеток, важно, чтобы pipette средств массовой информации мягко вниз стороне колодца, чтобы избежать отслоения клеток. Для коротких экспериментов (16 дней) кормление при вышеуказанной плотности не требуется. При покрытии большей плотности клеток могут потребоваться более частые интервалы кормления (см. Обсуждение).
5. Астроцит обогащенные глиальные культуры поддержки
ПРИМЕЧАНИЕ ОТНОсяСЬ к СВЕДЕНИ Производство глиальных культур14 и использование клеточной культуры вставки были описаны ранее12. Короче говоря, астроцит обогащенные культуры глии являются производными от ткани кортико-гиппокампа (с удаляются оболей; P2-P5), которые культивировались в течение одной недели на 20 мкг/мл PLL покрытием 6-колодчатые пластины, в сыворотке добавил DMEM средств массовой информации.
- Для совместной культуры очищенных нейронов и глиальных клеток, проход слияния глиальных клеток к необходимому числу клеточной культуры вставки (0,4 мкм размер пор - см. Таблица материалов). Для прохождения клеток, удалить 6-ну хорошо пластины, содержащие слияние глиальных клеток из инкубатора и мыть 2 колодца, 2 раза, с 2 мл предварительно нагревается (37 градусов по Цельсию) фосфат буферного соливого солифа (PBS).
- Прибавьте к решению PBS и используйте пипетку P1000, чтобы добавить 1 мл предварительно разогретого (37 градусов по Цельсию) трипсина (1,250)/EDTA (0.25%/0.02%) решение для каждого колодца.
- Верните 6-колоднюю пластину в инкубатор и проверьте каждые 2-3 мин на отслоение клеток.
- После того, как значительное отслоение клеток произошло, pipette клетки и клеточный раствор мягко вверх и вниз с помощью тонкой кончик Пастер pipette, чтобы помочь дальнейшему отслоению и разделению отдельных клеток.
- Перенесите клеточный раствор в коническую трубку 15 мл и центрифугу при 3000 х г в течение 3 мин.
- Повторно приостановить клетки с помощью пипетки P1000 в 5 мл предварительно разогретых (37 градусов по Цельсию) НБА полный носителей, мягко пипетки вверх и вниз, пока клетка гранулы в растворе.
- Выполните подсчет клеток с помощью гемоцитометра или автоматизированного счетчика клеток.
ПРИМЕЧАНИЕ ОТНОсяСЬ к СВЕДЕНИ После 7 дней в культуре, около 750000-1,000,000 клеток могут быть собраны из каждого колодца 6-хорошо пластины. - Плита 40000 глиальных клеток для каждой культуры клеток вставить в 500 капель нокл (80 клеток / ЛЛ).
- После того, как клетки должны придерживаться в течение 1 ч, используйте стерильные щипцы для передачи глиальных покрытых клеточной культуры вставки 24-колодские пластины, содержащие очищенные нейроны. Удалите избыток носителя с поверхности вставок клеточной культуры (примерно 300 кЛ).
ПРИМЕЧАНИЕ ОТНОсяСЬ к СВЕДЕНИ Как пузырьки воздуха часто могут попасть в ловушку ниже клеточной культуры вставки, это может быть необходимо, чтобы мягко наклонить вставки, чтобы выбить эти пузыри. Если больше глиальных клеток добавляются к вставке культуры клетки, то более дальнеишее мытье и центрифуга шаги могут быть необходимы для того чтобы извлечь сверхнормальный трипсин, который может быть вредно к выживанию клетки.
Результаты
Диссоциация и клеточная сортировка флуоресцентных нейронов из трансгенной мыши или крысиной кортико-гиппокампальной ткани может быть выполнена примерно в 3-4 ч. Результатом является популяция высокочистых флуоресцентных нейронов, которые могут быть выращены в культуре в течение 16 дней.
Для создания очищенных культур трансгенные животные были впервые идентифицированы с помощью флуоресцентной лампы с соответствующими фильтрующими наборами (примеры флуоресцентных неонатальных VGAT Venus и NexCre; Ai9 мыши щенки показаны на рисунке 1A). После выявления трансгенных животных расчлененная ткань была разобщена, а наиболее сильно флуоресцентные нейроны были отсортированы для получения очищенной популяции клеток. Пример флуоресценции интенсивности точек участков для NexCre; Нейроны мыши Ai9 и VGAT Venus, полученные во время FACS, показаны на рисунке 1B. При оптимизации можно собрать от 500 000 до 800 000 клеток из коры головного мозга и гиппокампа отдельных P0 -2 NexCre; Ai9 или VGAT Венера мышей. Клетки могут быть отсортированы со скоростью свыше 600 событий/ с. Оценки чистоты клеток были выполнены с использованием DAPI в качестве ядерного маркера(рисунок 1С). Путем сортировки сильно положительных клеток, чистота более 97% может быть регулярно достигнута7.
После успешной сортировки, покрые нейроны должны появиться круглые формы, имеют гладкую мембрану и должны быть замечены, чтобы прорасти нейриты примерно после 1 ч в пробирке(рисунок 2A,B). К 7 дням in vitro, хотя некоторая смерть клетки может быть явно, жизнеспособные клетки должны присутствовать в всех условиях культуры(рисунок 2C,D). В 12-16 дней в пробирке, используя цельно-клеточные записи патч-зажима и биоцитина заполнения15, можно исследовать морфологическое и электрофизиологическое развитие очищенных нейронов (Рисунок 3). Анализ очищенных культур показывает, что как глутамерные, так и ГАМК-нейроны смогли расширить аксоны и дендриты из своих клеточных тел(рисунок 3A, B) и сохранить способность генерировать потенциал действия в ответ на надпорог деполяризации текущих инъекций(рисунок 3C, D). Примечательно, однако, после очистки, только ГАМК нейроны получили значительное количество спонтанной синаптической передачи, и глутаматергические нейроны получают очень мало синаптической передачи при отсутствии глиальных клеток (Рисунок 3E , F) 7.
Как мы уже сообщали ранее, клетки в очищенных культурах, как правило, выживают более бедно,чем в несортированных культурах, и имеют значительно меньшие дендриты и аксоны 7. Чтобы преодолеть этот дефицит, мы адаптировали и применили методы поддержки развития очищенных культур глиальными клетками12,14. Сотовый состав наших глиальных поддерживающих культур (DIV7) показан на рисунке 4A. Эти культуры содержали преимущественно глиальный фибрилляционный кислый белок (GFAP) положительные астроциты, но также содержали некоторое скопление молекулдиации дифференциации (CD11b) положительной микроглии и миелина основного белка (MBP) положительных олигодендроцитов. После DIV 7, эти клетки могут быть переданы в клеточной культуры вставки для обеспечения бесконтактной поддержки очищенных нейронов(Рисунок 4B, C). Анализ глиа-нейронных сокультур показывает, что примерно 40 000 глиальных клеток было достаточно для улучшения долгосрочного выживания и роста как очищенных глутамерных, так и ГАМК-нейронов(Рисунок 4D,E)7. Кроме того, электрофизиологический анализ показывает, что глутаматергические нейроны, совместно культивированные с глиальными клетками, были очень активны и сильно увеличили сетевую активность (процент глиальных поддерживаемых глутамерных нейронов, стреляя всплесками действия потенциалы; n No 28; Рисунок 4F , G). Таким образом, глиальная поддержка важна не только для содействия росту и выживанию нейронов, но и для содействия синаптической передаче и налаживанию сетевой активности в глутаметергических культурах.
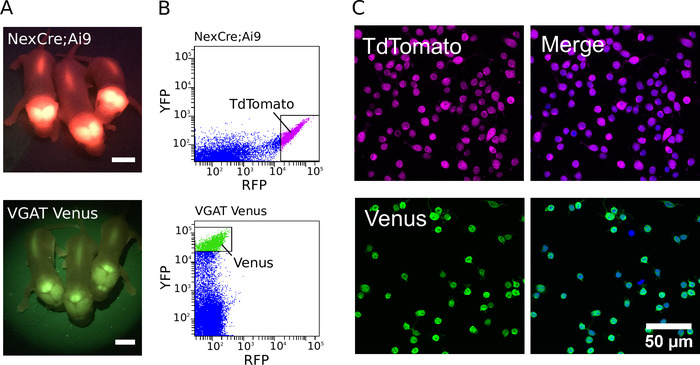
Рисунок 1. Очистка глутамерных и ГАМК-нейронов. (A) Изображения, показывающие флуоресцентный сигнал от трансгенного выражения TdTomato в NexCre; Мыши Ai9 (вверху) и Венера в VGAT Венера мышей (внизу). Шкала баров 5 мм. (B) Интенсивность рассеяния участков TdTomato и Венера флуоресценции кортико-гиппокампа диссоциированных клеток от NexCre; Мыши Ai9 (вверху) и VGAT Венера мышей (внизу). Сильно флуоресцентные tdTomato или Венера нейронов были выбраны для сортировки (показано gating коробки). (C, слева) Конфокальные изображения отсортированных TdTomato (вверху) и Венеры (внизу) положительных нейронов. (C, справа) Слияние изображения, показывающего ячейки, окрашенные совместно с DAPI (синим псевдоцветом). TdTomato флуоресценция является эндогенной и остается сильным, несмотря на фиксацию (в пурпурный псевдоцвет). Выражение Венеры усиливается с помощью комбинации первичных антител, направленных против GFP и Alexa Fluor-488-конъюгированных вторичных антител (зеленым псевдоколором). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
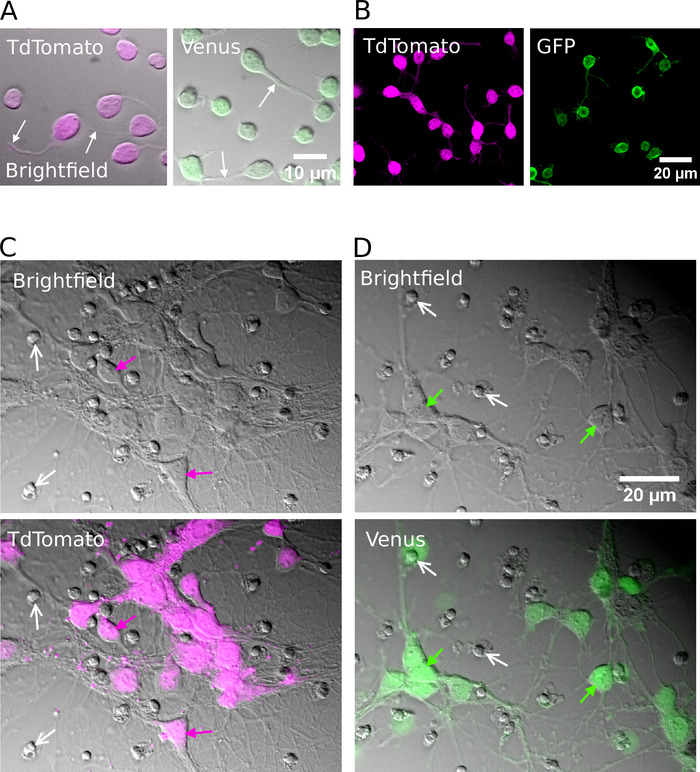
Рисунок 2. Клеточная культура очищенных глутамерных или ГАМК-нейронов. (A) Комбинированные инфракрасные (яркое поле) изображения и наложенный флуоресцентный сигнал от TdTomato (слева) и Венеры (справа) положительные нейроны культивируется в течение 1 ч в пробирке. Белые стрелки указывают на расположение растущих невритов. (B) Конфокальные изображения TdTomato (слева) и Венеры (справа) положительные нейроны культивируется в течение 1 ч в пробирке. (C, D) Яркое поле (вверху) и комбинированные яркие полевые и флуоресцентные изображения (внизу) TdTomato (C) и Венеры положительные нейроны (D) культивируются в течение 7 дней в пробирке (DIV). Белые стрелки показывают расположение сгущенных ядер из мертвых клеток. Цветные стрелки идентифицируют флуоресцентно помеченные нейроны. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
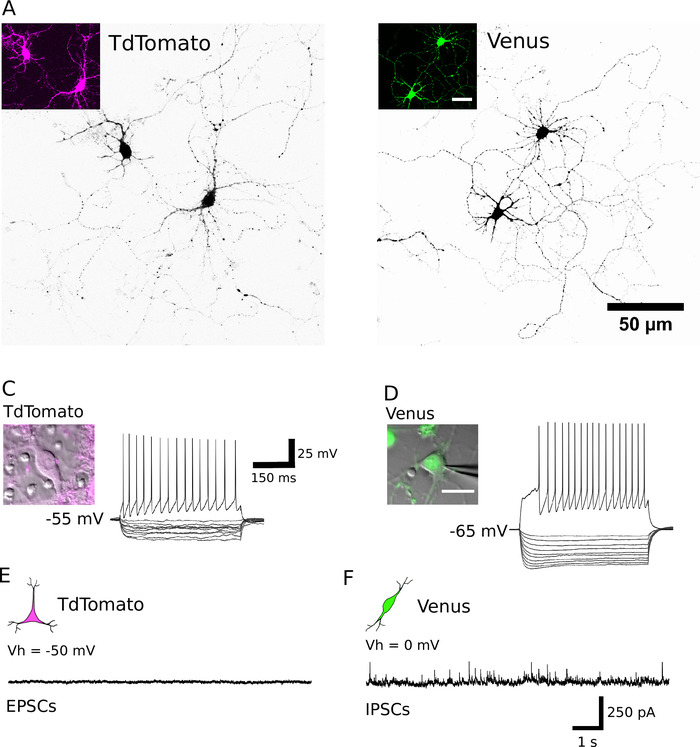
Рисунок 3. Морфологические, электрофизиологические и синаптические свойства очищенных нейронов. (A, B) Конфокальные изображения TdTomato (A) и Венеры положительные нейроны (B) на DIV 13 и DIV 14, соответственно. Клетки представлены в черном цвете с помощью перевернутой таблицы поиска для визуализации неврита. Вставки показывают флуоресцентный сигнал, выраженный идентифицированными нейронами. (C, D) Реакция напряжения от TdTomato (C) и Венеры положительный нейрон (D) для гиперполяризации (200 до -20 pA, в 20 pA шагов) и деполяризации (200 pA) ток импульсов, полученных целыми клетками патч-зажим записей. Вставки показывают соответствующие записанные нейроны. Потенциал покоя мембраны каждой клетки показан слева от следа записи. (E, F) Представитель напряжения-зажим записи (10 с) полученные из TdTomato (E) и Венеры положительных нейронов (F). Спонтанные возбуждающие посты (EPSCs) были записаны от TdTomato положительных нейронов, поддерживается на холдинговом потенциале 50 мВ. Спонтанно происходящие ингибирующие постсинаптические события (IPSCs) были зарегистрированы с Венеры положительные нейроны поддерживается на удержание потенциал 0 мВ. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
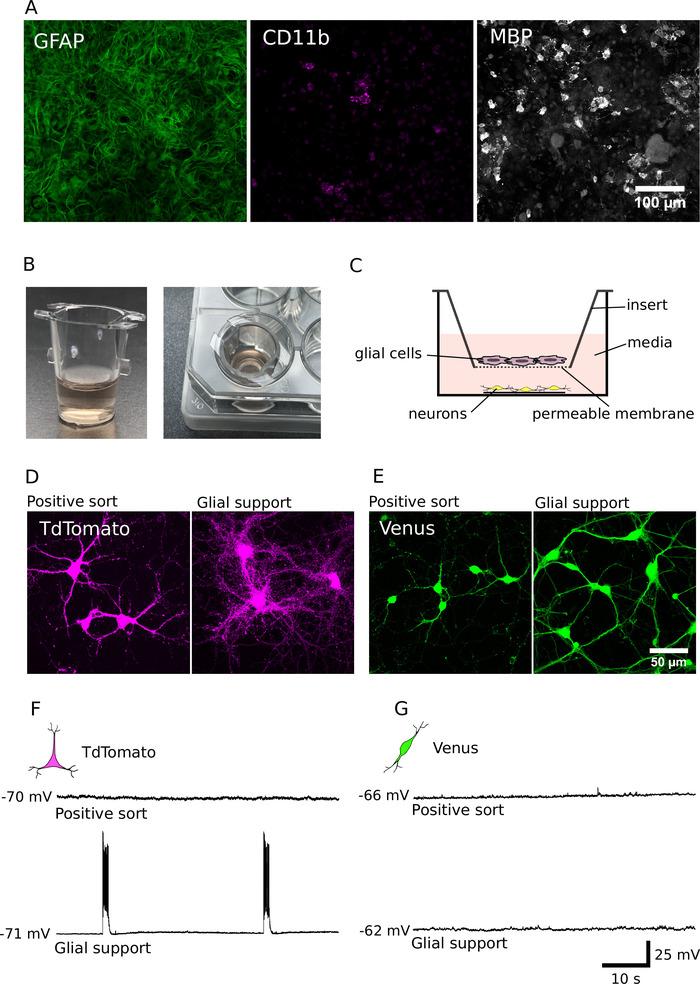
Рисунок 4. Поддержка развития нейронов с глиальной кокультурой. (A) Конфокальные изображения глиальных культур иммуномаркировки для глиальных фибрилляционных кислотных белков (GFAP, слева), кластер молекулы дифференциации (CD11b, средний) и миелин основной белок (MBP, справа). Глиальные клетки культивировались для DIV 7. (B) Изображения клеточной культуры вставки, используемые для совместной культуры глиальных клеток с очищенными нейронами в бесконтактной договоренности. (C) Схема пространственного расположения используется для совместной культуры нейронов и глии. (D, E) Конфокальные изображения TdTomato (D) и Венеры положительные нейроны (E), выросли в течение 14 дней, в отсутствие (слева) или наличие (справа) глиальной поддержки. (F, G) Текущие зажимные записи (60 с) от TdTomato (F) и Венеры положительные нейроны (G) культивируется в течение 14 дней в отсутствие (вверху) или наличие (внизу) глиальной поддержки. Нейроны были записаны на их потенциал упокоения мембраны (представлены слева от каждого следа записи). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Обсуждение
Мы описываем здесь метод, который сочетает в себе сортировку и культивирование первичных нейронов для генерации очищенных нейрональных клеточных культур. Этот метод занимает около 1 ч больше, чем типичный первичный отдельный протокол нейронной культуры, но позволяет для генерации сотен репликационных культур, содержащих конкретные типы нейронов. Очищенные нейроны, которые могут быть выращены в изоляции, по крайней мере 16 дней, продлить аксоны и дендриты и может огонь повторяющихся поездов действия потенциалов(Рисунок 2 и Рисунок 3). Важно отметить, что эти клетки поддаются тем же экспериментальным анализам, что и регулярные первичные разрозненные нейронные культуры, включая электрофизиологические, морфологические и анализы на выживание. Основным преимуществом работы с этими очищенными культурами является то, что развитие конкретных типов клеток может быть изучено изолированно. Для поддержки развития очищенных культур мы также представляем протокол для совместного культивирования очищенных нейронов с глиальными клетками. Как показано ранее, совместное культивирование очищенных нейронов с глиальными клетками улучшает их выживание, рост и может способствовать формированию сети7 (Рисунок 4). Таким образом, мы представляем здесь сочетание методов, которые должны способствовать изучению взаимодействия глиа-нейронов и может оказаться полезным для изучения развития и взаимодействия между другими типами клеток интересов.
Исследования культур очищенных глутамерных нейронов выявили фундаментальное понимание того, как глиальные клетки выделяют факторы, способствующие развитию нейронных сетей и образованию синапсов16,17,18 . В целом, методы очистки конкретных типов нейронов были более успешно применены для изучения развития глутаматергических нейронов, а не ГАМК., нейронов. Это привело к несоответствию в нашем понимании того, как развиваются эти два типа клеток. Учитывая, что ГАМК и глутамергических нейронов значительно отличаются с точки зрения их анатомии, физиологии и развития происхождения, очень важно, что мы изучаем ГАМК нейронов в их собственном праве, чтобы лучше понять их функции и физиологии. Используя протокол, представленный здесь, мы ранее определили важные различия в том, как ГАМК и глутамергические нейроны зависят от глиа-секретных факторов для создания синаптической передачи7. Публикуя этот протокол, мы надеемся, что другие смогут глубже понять важные взаимодействия между нейронами и глиальными клетками.
В этом протоколе мы описываем метод сортировки клеток на основе потока, который мы использовали для очистки ГАМК или глутаметатергических нейронов от различных трансгенных линий грызунов. Венера положительные ГАМК нейроны были отсортированы из VGAT Венера мышей13 или крыс8 и TdTomato положительные глутамергические нейроны были отсортированы из NexCre; Ai9 мышей (выведенные первоначально от NexCre9 и Ai9 репортер линии6, см. Turko et al., 20187). В последние годы, благодаря технологическим достижениям, производство трансгенных животных стало значительно проще. Таким образом, доступность животных, выражающих флуоресцентные молекулы, во многих различных типах клеток, быстро росла. Это, в свою очередь, увеличило использование и применимость флуоресцентной активированной сортировки клеток. В то время как альтернативные методы изоляции клеток, представляющих интерес в настоящее время существуют16,19,20, они несколько мешает их зависимость от наличия подходящих антител к естественной поверхности антигенов. Это ограничивает их универсальность по сравнению с флуоресценцией на основе методов сортировки клеток, которые уже могут быть использованы для сортировки клеток из многих клеток конкретных трансгенных животных репортера, которые уже доступны. Тем не менее, при оптимизации, антитела на основе методов сортировки может быть быстрым и высокой урожайности, и может даже лучше сохранить анатомию клеток, позволяя очистки клеток с их аксонов и дендритов нетронутыми21. Поэтому при принятии решения о стратегии сортировки следует все же учитывать методы сортировки антител. В конечном счете, тип клеток, возраст, в котором клетки должны быть сортированы, наличие трансгенных животных или поверхностных антигенов и количество клеток, необходимых будет определяющих факторов при выборе наиболее подходящей стратегии сортировки.
Хотя сортировка клеток на основе флуоресценции является простым и воспроизводимым методом очистки клеток, следует принимать меры по уходу во время определенных этапов протокола для сохранения качества клеток. Например, после каждого шага центрифугации, важно, чтобы убедиться, что клетка гранулы повторно приостановлено как можно быстрее, и что клетки были успешно восстановлены. Иногда, клеточные гранулы могут быть нарушены при удалении супернатанта. Поэтому рекомендуется, между шагами центрифугации, чтобы проверить наличие клеток под микроскопом, чтобы исключить любые обширные потери клеток. После клеточного покрытия, клетки должны быть разрешены придерживаться, по крайней мере 1 ч перед кормлением. Если клетки подаются слишком рано, некоторые клетки могут выбиться из покрывало, тем самым уменьшая плотность культуры. После 1 ч в культуре, разумно оценить здоровье клеток. Если клетки не кажутся здоровыми (пример здоровых клеток показан на рисунке 2A),или есть значительная гибель клеток, то это может быть признаком проблемы во время диссоциации или процедуры сортировки. Еще одним важным соображением, при культивированиелюбой любой тип клетки, заключается в том, чтобы заботиться при управлении среды клеточной культуры. НБА СМИ содержит фенол красный, который выступает в качестве индикатора рН22. Если носители становятся слишком желтыми по цвету, то это указывает на то, что рН слишком кислой; если носитель становится слишком розовым, то это указывает на то, что решение слишком щелочное. Фондовые решения открыты в течение длительных периодов времени, особенно сми aliquoted в конические трубки, как правило, становятся более щелочной с течением времени. Поэтому рекомендуется составлять свежие полные средства массовой информации НБА каждую неделю и полные средства массовой информации каждые две недели (средние буферы в атмосферных условиях и, следовательно, должны быть более стабильными). Принимая эти моменты во внимание, должно быть возможно установить очищенные культуры клеток в любой лаборатории с доступом к сортировке клеток и оборудованию культуры клеток.
В большинстве наших экспериментов мы производили очищенные культуры из одного животного. Однако при очистке клеток для биохимического анализа может возникнуть необходимость объединить несколько животных для сортировки. Мы успешно сортировали до 8 эмбриональных мышей (эмбриональный день 13 животных) с помощью вышеуказанного протокола (данные не показаны). Однако, если больше животных должны быть отсортированы, это может быть необходимо увеличить объем как папаин и BSA решений (описанных в шагах 2.1.1-2.1.4) для размещения увеличение количества тканей. Кроме того, если больше клеток покрыто культурой, то может потребоваться более частый график кормления. В качестве отправной точки, клетки могут быть поданы каждые 7 дней, удалив 100 л условных носителей и добавив 200 Л свежих полных носителей НБА. Ради жизнеспособности нейронов, если сортировать больше животных, следует подумать, чтобы свести к минимуму время сортировки как можно больше. Это часто требует тщательной оптимизации ниже по течению анализов для эффективного использования очищенных клеток. Мы регулярно сортировали нейроны мыши со скоростью 600 событий / с, до 500000-800000 000 клеток на животное (послеродовой день 0-2). Однако это было без исчерпывающей оптимизации скорости и условий сортировки. Поэтому возможно дальнейшее улучшение скорости сортировки и урожайности.
Очищенные нейроны требуют глиа-кондиционированных средств для их выживания. Это было продемонстрировано ранее культивирование мнокак нейронов и глиальных клеток отдельно, перед лечением нейронов с глиальных условных средств массовой информации10. В наших экспериментах мы решили поддерживать очищенные нейроны, культивируя глиальные клетки на полупроницаемых клеточных вставках, которые помещаются внутри пластины клеточной культуры. Этот метод был успешно применен для изучения глиа-производных внеклеточных матричных белков и их взаимодействия с нейронами12. Бесконтактная, но непрерывная поддержка, предоставляемая этим методом, имеет ряд преимуществ по сравнению с отдельной культурой клеток. Наиболее примечательно, что со-культура глиальных клеток с нейронами позволяет непрерывнорегулировать и кондиционирования средств культуры клетки, которые более близко походят ситуация in vivo. Кроме того, непрерывная сокультура клеток позволяет для потенциальной обратной связи сигнализации между нейронами и глии, которая не возможна в разделенных культурах. В нашем протоколе, при необходимости, непрерывный метод совместной культуры может быть легко опущен и классическое лечение нейронов с глиа-кондиционированных средств массовой информации может быть выполнена.
Таким образом, представленный здесь протокол призван обеспечить читателю прочную основу, из которой они могут создавать свои собственные эксперименты по очищенной культуре клеток. Мы прогнозируем, что доступность трансгенных животных и вирусных конструкций будет продолжать расти в обозримом будущем. Таким образом, методы сортировки клеток, основанные на флуоресценции, вероятно, станут еще более широко используемыми и ценными.
Раскрытие информации
Авторы заявляют, что у них нет конкурирующих финансовых интересов.
Благодарности
Авторы хотели бы поблагодарить за отличную техническую поддержку, оказанную Дженни Кирш и Ана Тейхмюллер в Flow Cytometry Core Facility, Deutsches Rheuma-Forschungszentrum, Берлин. Мы хотели бы поблагодарить Цзе Сон за помощь в анализе выживания. Мы также хотели бы поблагодарить Риту Лурейро за помощь в захвате изображений флуоресцентных мышей и Кристиана Эбнера за критическое чтение протокола. Трансгенные крысы VGAT-Venus были созданы докторами Янагава, М. Хирабаяси и И. Кавагути в Национальном институте физиологических наук, Окадзаки, Япония, с использованием pCS2-Venus, предоставленных д-ром А. Мияваки. Эта работа была поддержана Немецким исследовательским советом (Deutsche Forschungsgemeinschaft, DFG EXC 257 к IV).
Материалы
| Name | Company | Catalog Number | Comments |
| Neural Basal A media (NBA) | ThermoFisher Scientific | 10888022 | Cell Culture Buffer |
| B27 | ThermoFisher Scientific | 17504001 | Culture supplement |
| Glutamax | ThermoFisher Scientific | 35050-038 | Culture supplement |
| Penicillin-Streptomycin (10,000 U/mL) | ThermoFisher Scientific | 15140-122 | Antibiotic |
| Poly-L-Lysine | SIGMA | P1399 | Coverslip coating |
| Papain | SIGMA | P4762-1G | Enzyme |
| Bovine Serum Albumin | SIGMA | A3294-100G | Serum |
| Hibernate A low fluorescence media | Brain Bits Ltd | HALF | Cell Transport media |
| Dulbeccos Modified Eagles Medium (DMEM) | Biochrom | F0435 | Glial Culture Buffer |
| Fetal Calf Serum (FCS) | Biochrom | S0115 | Serum |
| Trypsin/EDTA | Biochrom | L2163 | Enzyme |
| Fine Tip Pasteur Pipette | Neo Labs | - | Used for trituration of cells |
| 24-well plates | BD | 353047 | Culture plate |
| 50 mL Falcon tubes | BD | 352070 | - |
| 15 mL Falcon tubes | BD | 352096 | - |
| Glass coverslips: 12 mm round | Roth | P231.1 | - |
| 35 mm Petri dish | Corning | 353001 | - |
| 100 mm Petri dish | Corning | 353003 | - |
| 30 µm CellTrics Cell Sieve | sysmex | 04-004-2326 | To remove cell clumps before cell sorting |
| Round bottom polystyrene tubes | BD | 352054 | Transport tube for sorted cells |
| Round bottom polypropylyne tubes | BD | 352063 | Collection tube for sorted cells |
| Cell culture inserts – 0.4 µm transparent PET | Falcon | 353 095 | For the co-culture of neurons and glia |
| Extra fine Bonn Scissors | Fine Scientific Tools | 14084-08 | To remove overlying skin and bone of mice |
| Extra narrow Scissors | Fine Scientific Tools | 14088-10 | To remove overlying skin and bone of rats |
| Forceps | Fine Scientific Tools | 11242-40 | To hold the head in place |
| Spatula (130 mm long/5 mm tip width) | Fine Scientific Tools | 3006.1 | To remove the brain to filter paper |
| Scalpel Blades | Swan-Morton | #0308 | To mechanically dissociate neural tissue |
| Haemocytometer (Neubauer Imroved) | Optik Labor | - | To cell count dissociated cells |
| Fluorescent Miners Goggles (excitation light) | Biological Laboratory Equipment Maintenance and Servce Ltd (BLS) | FHS/LS-1G | To excite TdTomato |
| Fluorescent Miners Goggles (emission filter) | Biological Laboratory Equipment Maintenance and Servce Ltd (BLS) | FHS/EF-4R2 | Td Tomato compatible emission filter |
| Fluorescent Miners Goggles (excitation light) | Biological Laboratory Equipment Maintenance and Servce Ltd (BLS) | FS/ULS-02B2 | To excite Venus |
| Fluorescent Miners Goggles (emission filter) | Biological Laboratory Equipment Maintenance and Servce Ltd (BLS) | FS/TEF-3GY1 | Venus compatible emission filter |
| Mouse-Anti-GFP primary antibodies | UC Davis | 75-132 | To enhance Venus signal following fixation |
| Mouse-Anti-GFAP primary antibodies | SIGMA | G-3893 | The identification of reactive astrocytes |
| Rabbit-Anti-CD11b primary antibodies | Southern Biotech | 1561-15 | The identification of microglial cells |
| Rabbit-Anti-MBP primary antibodies | Millipore | AB980 | The identification of oligodendrocyes |
Ссылки
- Radcliff, G., Jaroszeski, M. J. Basics of flow cytometry. Methods in Molecular Biology. 91, 1-24 (1998).
- Feher, K., Kirsch, J., Radbruch, A., Chang, H. D., Kaiser, T. Cell population identification using fluorescence-minus-one controls with a one-class classifying algorithm. Bioinformatics. 30 (23), 3372-3378 (2014).
- Sergent-Tanguy, S., Chagneau, C., Neveu, I., Naveilhan, P. Fluorescent activated cell sorting (FACS): a rapid and reliable method to estimate the number of neurons in a mixed population. Journal of Neuroscience Methods. 129 (1), 73-79 (2003).
- Adan, A., Alizada, G., Kiraz, Y., Baran, Y., Nalbant, A. Flow cytometry: basic principles and applications. Critical Reviews in Biotechnology. 37 (2), 163-176 (2017).
- Guez-Barber, D., et al. FACS purification of immunolabeled cell types from adult rat brain. Journal of Neuroscience Methods. 203 (1), 10-18 (2012).
- Madisen, L., et al. A robust and high-throughput Cre reporting and characterization system for the whole mouse brain. Nature Neuroscience. 13 (1), 133-140 (2010).
- Turko, P., Groberman, K., Browa, F., Cobb, S., Vida, I. Differential Dependence of GABAergic and Glutamatergic Neurons on Glia for the Establishment of Synaptic Transmission. Cerebral Cortex. , (2018).
- Uematsu, M., et al. Quantitative chemical composition of cortical gabaergic neurons revealed in transgenic venus-expressing rats. Cerebral Cortex. 18, 315-330 (2008).
- Goebbels, S., Bormuth, I., Bode, U., Hermanson, O., Schwab, M. H., Nave, K. -. A. Genetic targeting of principal neurons in neocortex and hippocampus of NEX-Cre mice. Genesis. 44, 611-621 (2006).
- Banker, G. A. Trophic interactions between astroglial cells and hippocampal neurons in culture. Science. 209, 809-810 (1980).
- Lindsay, R. M. Adult rat brain astrocytes support survival of both NGF-dependent and NGF-insensitive neurones. Nature. 282 (5734), 80-82 (1979).
- Geissler, M., et al. Primary hippocampal neurons, which lack four crucial extracellular matrix molecules, display abnormalities of synaptic structure and function and severe deficits in perineuronal net formation. Journal of Neuroscience. 33 (18), 7742-7755 (2013).
- Wang, Y., et al. Fluorescent labeling of both gabaergicand glycinergic neurons in vesicular GABA transporter (VGAT)-venus transgenic mouse. Neuroscience. 164 (3), 1031-1043 (2009).
- Höltje, M., et al. Role of Rho gtpasein astrocyte morphology and migratory response during in vitro wound healing. Journal of Neurochemistry. 95 (5), 1237-1248 (2005).
- Booker, S. A., Song, J., Vida, I. Whole-cell Patch-clamp Recordings from Morphologically- and Neurochemically-identified Hippocampal Interneurons. Journal of Visualized Experiments. , e51706 (2014).
- Pfrieger, F. W., Barres, B. A. Synaptic efficacy enhanced by glial cells in vitro. Science. 277 (5332), 1684-1687 (1997).
- Ullian, E. M., Sapperstein, S. K., Christopherson, K. S., Barres, B. A. Control of synapse number by glia. Science. 291, 657-661 (2001).
- Christopherson, K. S., et al. Thrombospondins are astrocyte-secreted proteins that promote CNS synaptogenesis. Cell. 120, 421-433 (2005).
- Berghuis, P., et al. Brain-derived neurotrophic factor controls functional differentiation and microcircuit formation of selectively isolated fast-spiking gabaergic interneurons. European Journal of Neuroscience. 20 (5), 1290-1306 (2004).
- Liddelow, S. A., et al. Activated microglia induce neurotoxic reactive astrocytes via Il-1α, tnfα, and c1q. Nature. 541, 481-487 (2017).
- Tomlinson, M. J., Tomlinson, S., Yang, X. B., Kirkham, J. Cell separation: Terminology and practical considerations. Journal of Tissue Engineering. 4, (2013).
- Brewer, G. J., Torricelli, J. R., Evege, E. K., Price, P. J. Optimized survival of hippocampal neurons in B27-supplemented Neurobasal, a new serum-free medium combination. Journal of Neuroscience Research. 35 (5), 567-576 (1993).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены