Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Agrobacterium tumefaciens и Agrobacterium rhizogenes-опосредованной трансформации картофеля и промоутер активность гена суберин путем окрашивания ГАС
В этой статье
Резюме
Здесь мы представляем два протокола для преобразования растений картофеля. Agrobacterium tumefaciens преобразование приводит к полной трансгенных растений в то время как Agrobacterium rhizogenes производит трансгенных волосатые корни в стрелять дикого типа, который может быть самостоятельной распространенный. Мы затем обнаружить промоутер активность GUS пятнать в преобразованной корни.
Аннотация
Agrobacterium sp. является одним из наиболее широко используемых методов для получения трансгенных растений, поскольку он имеет возможность передачи и интегрировать свой собственный T-ДНК генома растений. Здесь мы представляем два преобразования систем генетически изменить растений картофеля (Solanum tuberosum). В A. tumefaciens трансформации зараженные листья, трансформированных клеток выбираются и новый полный преобразованные завод генерируется с использованием фитогормонов в 18 недель. A. rhizogenes трансформации стебли зараженных инъекционных бактерии с помощью иглы, новых появившихся преобразованные волосатые корни обнаруживаются с помощью маркера красных флуоресцентных и корни-трансформированных удаляются. В 5-6 недель результатом завод представляет собой совокупность дикого типа стрелять с полностью развитой преобразованные волосатые корнями. Для увеличения биомассы, преобразованные волосатые корни можно подакцизным и распространяются самостоятельно. Мы применяли оба методы трансформации Agrobacterium -опосредованной получить корни, выражая GUS Репортер ген обусловлен промоутера суберин биосинтетических генов. GUS пятная процедуру предоставляется и позволяет ячейки локализации промоутер индукции. В обоих методах корни преобразованные картофеля показал, что окрашивание в suberized эндодермы и exodermis и Кроме того, а. rhizogenes преобразован корни активность GUS GUS был также обнаружен в появление боковых корней. Эти результаты показывают, что а. rhizogenes может быть быстро альтернативных инструментом для изучения генов, которые выражаются в корни.
Введение
Помимо экономических интересов поколение трансгенных растений имеет свою собственную значимость в исследованиях продемонстрировать конечной функции генов и лучше понять физиологии растений и развития. Наиболее широко используемый метод для растений ДНК вставки Agrobacterium-опосредованной трансформации. Agrobacterium tumefaciens способен генерировать Корона галлов в инфицированных тканях многих видов растений под действием его опухоль заставить плазмида (Ti). Плазмида содержит область T-ДНК с набором генов, которые будут интегрированы в генома растений и побудить ткани дифференцировке1,2. Обмен этих генов в T-ДНК, трансген позволила поколения изменения конкретных растений, избегая Фенотипическая воздействию3. Для облегчения трансген, клонирование в T-ДНК, регионе T-ДНК был вырезан в независимой плазмида, называемый двоичной плазмида, а остальные гены плазмида Ti были (генов вирулентности, которые позволяют механизмы передачи и вставки T-ДНК) помещены в вспомогательный плазмиды. Для исследования в области биотехнологии растений, преобразование A. tumefaciens имеет ряд преимуществ: она не нужны дорогие устройства, способен генерировать как завод стабильного и переходных преобразований, так и небольшого числа генов, копии интегрированы в хромосома4. Однако для большинства растений, но не арабидопсиса, поколение стабильной трансформантов требует регенерации растений из одного или нескольких клеток с помощью экзогенных фитогормонов, делая этот процесс трудоемкий и требует много времени. A. rhizogenes также возможность изменения генома растений, производства волосатые корни или придаточных корней на сайтах инфекции из-за экспрессию генов рол ( локусовкорень), закодированы в плазмиду вызывая корень (Ri)5. Хотя менее изучены чем A. tumefaciens, а. rhizogenes также используется для получения трансгенных корни. В этом случае, а rhizogenes содержит оригинальные T-ДНК в Ри плазмиды и двоичные плазмида с второй T-ДНК, перевозящих трансген. Когда сайт инфекции в стеблях или гипокотиля, композитный растений могут быть получены, с новой волосатые трансгенных корнями, переживших побеги дикого типа. В качестве альтернативы волосатые преобразованные корни могут расти автономно в пробирке в СМИ с входными данными источника углерода. Использование A. rhizogenes вместо A. tumefaciens производить трансгенной ткани приобретает актуальность, когда корень является органом-мишенью, потому что завод регенерации не требуется, и следовательно это быстрее и менее дорогостоящим. Предыдущие исследования показали эту методологию, ассигнованных для фенотипические характеристики корневого конкретные гены6,,78,9.
Картофеля (Solanum tuberosum) является четвертым наиболее важных сельскохозяйственных культур в мире согласно данным Продовольственной и сельскохозяйственной Организации Объединенных Наций (ФАО), поскольку клубень имеет питания актуальность для потребления человеком за то, что является хорошим источником витаминов и минералов. По этой причине картофель был помещен в центре внимания сельскохозяйственной биотехнологии и также считается хорошим биологической модели для генетических и развития исследований в10,11. Значительный вклад в понимание молекулярных механизмов базовой suberized тканей через характеристика генов, участвующих в суберин и воск биосинтез12,13,14 трансформации картофеля ,,1516,17, суберин мономера транспорт18 и транскрипции правила19. Суберин feruloyl трансферазы генов, FHT, является одним из этих характеризуется биосинтетических генов; его Даунрегуляция порождает сильное ухудшение Перидерма защиты, которая коррелируется с сильным снижением ferulate эфиры суберин и воски в клубни картофеля14. Одновременно в корни и семена Arabidopsis, нокаут своего предполагаемого orthologue (ASFT/RWP1) также продемонстрировал свою роль в производить алкиловые ferulates в суберин20,21. В картофеля линии репортер transcriptional FHT и антитела FHT показал соответственно что промоутер активность и белка расположены в exodermis, эндодермы, phellogen производные и раненых тканей15.
В этой работе мы подробно протокол с помощью A. rhizogenes для производства трансгенных волосатые корней, которые поддерживаются в дикого типа стрелять, генерации растений композитный картофеля или вырезан самостоятельно выращивать в пробирке. Мы также предоставляем протокол, используя A. tumefaciens для получения полного трансгенные картофель растений. В качестве тематического исследования а. rhizogenes и A. tumefaciens преобразована с же бинарный вектор используются для получения корни с FHT промоутер вождения ГАС репортер экспрессии генов. Результаты сообщили и сравнить.
протокол
A. rhizogenes протокол преобразования был адаптирован и изменения из рога et al.7 и тестирование генотипа был S. tuberosum ssp. tuberosum (cv. Дезирэ). A. tumefaciens преобразования протокола был адаптирован и изменения Банерджи et al.22 и генотипов испытания были S. tuberosum ssp. tuberosum (cv. Дезирэ) и S. tuberosum ssp. andigena. Основные этапы обеих процедур резюмируются в Рисунок 1 и 2, соответственно.
Примечание: На всех этапах процедуры, выполнение переводов в vitro сделать это быстро и когда это возможно, поддерживать пластин или горшки закрыты, таким образом минимизируя завод воздействия воздуха, чтобы избежать загрязнения и увядания. Не указано иное, все растение инкубаций были сделаны в шкафах в условиях 12 h 24 ° C свет/12 h 20 ° C темной и 67 мкмоль m-1 s-1. Иное, выполняют все бактерии манипуляции и в vitro растений трансферы в асептических условиях ламинарных капюшоном. Все рецепты СМИ для посева и в пробирке растительных культур приведены в Таблице S1.
ОСТОРОЖНОСТЬЮ: Хранение всех генетически модифицированных бактерий и растений для выделенных контейнер для отходов.
1. Agrobacterium культур, используемых для преобразования
Примечание: Штамм, используемый для преобразования A. rhizogenes был C58C1:Pri15837 (любезно предоставлены доктором Инге Broer) и что для A. tumefaciens был GV2260 (любезно предоставлены доктором Salomé Прат). A. rhizogenes был преобразован с бинарный вектор PK7GWIWG2_II-RedRoot (VIB-кафедра биологии растений в Гент Universiteit; http://gateway.psb.ugent.be), содержащий T-ДНК перевозящих преобразования маркера для мониторинга волосатые корень формирование. Для сравнения преобразованных корни, а. rhizogenes и A. tumefaciens, оба были преобразованы с бинарный вектор pKGWFS7, который содержит T-ДНК, перевозящих FHT промоутер, вождение репортер гена β-glucoronidase (GUS) и канамицин сопротивления ген как выбирается маркер15.
- Выберите колонии Agrobacterium и вырастить его на ночь (O/N) в 5 мл YEB среды с антибиотиками (Таблица S1) в 50 мл пластиковых пробирок на 28 ° C с встряхивания на 200 об/мин.
- Для преобразования A. tumefaciens , измерения оптической плотности, которая должна быть ОД600 = 0,6-1,0.
- Если оптическая плотность выше, сделать субкультуры, опустив ее в ОД600 = 0,3 с свежими СМИ и ждать до тех пор, пока культура достигает600 OD = 0,6-1.
- Центрифуга 1 мл Agrobacterium культуры на 3000 x g в центрифугу скамейка Топ 10 мин при комнатной температуре.
- Удалить супернатант, закупорить и Ресуспензируйте клеток в 1 мл свежего YEB среды без антибиотиков. Повторите этот шаг, чтобы обеспечить полное удаление антибиотиков.
- A. tumefaciens трансформации, в прошлом ресуспендирования добавить соответствующий объем YEB для получения окончательного оптическая плотность OD600 = 0,8.
- Держите клетки на льду при подготовке растения, чтобы быть заражены.
2. растительный материал для преобразования
- Сделать один или два узла стволовых черенками либо содержащие апикальной или вспомогательные почки от стерильного в vitro растений картофеля (доноров растения); выращивать их в средне твердой 2MS в горшках для 3-4 недели (рис. 1A и 2A рисунок).
3. завод преобразования с помощью A. rhizogenes (рис. 1)
Примечание: Эта процедура позволяет получать преобразованные волосатые корней. Чтобы вычислить выражение трансген, отрицательный контроль необходим. Подготовить отрицательный контроль, следуйте процедуре, с помощью штамма A. rhizogenes непреобразованной или преобразованы с пустой вектор, который включает преобразования маркера гена.
- Использовать свежие СМИ пластины; Кроме того плиты может храниться при температуре 4 ° C с крышкой стороной вверх, плотно закрытой с прозрачной пленкой, чтобы избежать обезвоживания СМИ. Подготовить квадратный СМИ пластины, раздвиньте их ~ 15°, заливка с 40 мл МС и пусть они затвердевают. Это позволит свести к минимуму контакт воздушной части завода с носителя.
- Передавать очень тщательно доноров завод от среднего 2MS квадратные пластины 120 x 120 мм.
- Привнести в один стебель internode 3 мкл культуры а. rhizogenes , с помощью иглы хирургические и повторить его два раза в завод в различных междоузлий, когда это возможно.
Примечание: Рассмотрим каждой инъекции как независимое преобразование событие (рис. 1B). - Передавать сразу весь завод квадратные пластины с твердой питательной MS, дополняется acetosyringone 0,1 мм. Разместиться 2 растения на пластину.
Примечание: 1 M acetosyringone Стоковый раствор готовится в ДМСО и может храниться при температуре-20 ° C. - Печать пластину с помощью хирургическая лента и организовать его по вертикали внутри шкафа рост на 4 дня.
- Передача завода на новой площади пластины с MS среднего дополнена Цефотаксим натрия [500 мкг/мл] убить а. rhizogenes.
- После 10-12 дней волосатые корни начнут появляться (рис. 1 c,1 D). Затем акцизный Родные корни растения и передать завод на новой площади пластины с MS среднего дополнена Цефотаксим натрия [500 мкг/мл].
Примечание: Преобразованная волосатые корни могут проверяться красной флуоресценции при использовании DsRed преобразования маркера (рис. 3D). - Для получения составного завод (Рисунок 1E), пусть трансгенных волосатые корни расти на 3-4 недели в среде MS дополнена Цефотаксим натрия [500 мкг/мл] (изменить носитель каждую неделю).
- В зависимости от цели распространение трансгенных волосатые корни и негативный контроль как следовать.
- Передача всей композитный завод гидропонных (Таблица S2) или почвенной среды для массивных развития.
- Индивидуально, распространять преобразованный волосатые корни, с помощью скальпеля отрезать корни, выражая красной флуоресцентной преобразования маркера (DsRed белок) когда они длиной 4-8 см (Рисунок 1E) и перенести их в чашке Петри с твердой питательной Gamborg B5 дополнен с 2% сахарозы и Цефотаксим натрия [500 мкг/мл]. Уплотнение пластины с пластиковой Лаборатория фильм и вырастить их в темноте при температуре 20 ° C.
Примечание: Корни можно манипулировать под стереомикроскопом, оборудованных для обнаружения флуоресценции в стерильных условиях (см. Таблицу материалы). - Для производства биомассы (т.е. анализ выражения гена) сократить длинный волосатая корень 5 см и распространять ее в 150 мл колбу Эрленмейера с 20 мл жидкой среды Gamborg B5 с 2% сахарозы и Цефотаксим натрия [500 мкг/мл]. Растут на 6 недель в темноте при 20 ° C и 60 об/мин.
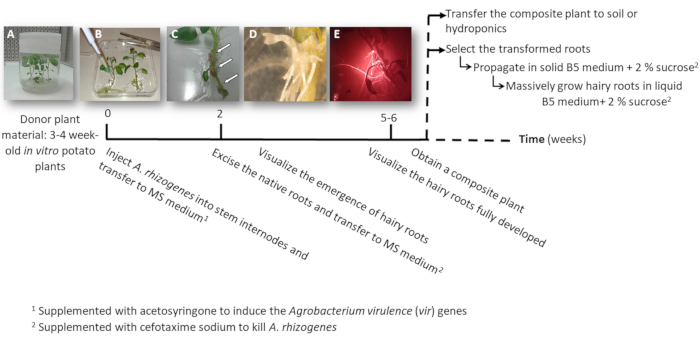
Рисунок 1: Временная шкала для получения картофельного трансгенных волосатые корни, с использованием а. rhizogenes. Показаны совокупные недель для достижения каждого этапа процесса трансформации и последующие шаги расти волосатые корни. Представитель изображения различных этапов изображены: начало процесса с использованием 3-недели старый в vitro растений (A), затем инфекции растений путем инъекций A. rhizogenes (B), формирование пролиферативных ткани (C, стрелки) с возникающих волосатые корни (D) и развитых волосатые корни, выражая красной флуоресцентной преобразования маркера DsRed (E). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
4. завод преобразования с помощью A. tumefaciens (рис. 2)
Примечание: Эта процедура позволяет получать трансформированных растений. Чтобы оценить эффект трансген, отрицательный контроль необходим. Одним из вариантов является следовать процедуре, с помощью A. tumefaciens преобразована с пустой вектор. В качестве альтернативы можно использовать растения дикого типа.
- Вырезать и поместите лист из 3-4-недельных растений (рисунок 2A) в чашку Петри. С помощью скальпеля исключить черешок и поперечных разрезов (1-3 в зависимости от размера листьев) от центра листа к краям, избегая отрезав их (рис. 2B).
- Сразу же месте листа, плавающей на 10 мл свежего 2MS жидких сред в чашке Петри с abaxial стороной вверх и закройте пластины. Повторите шаг, вмещающий до 15 листьев для cv. Дезирэ и 25 листья для ssp.ndigena (в зависимости от размера листьев).
- Сразу же добавить 80 мкл A. tumefaciens культуры в ОД600 = 0,8 в жидких средах и гомогенизации пластины вручную за 1 мин распространить бактериальных решение.
- Тщательно печать с пленки для запайки, накрыть алюминиевой фольгой и инкубировать в течение 2 дней в камере при 24 ° C для преобразования происходят.
- Передача листья, сохраняя abaxial стороне до среднего CIM (рис. 2B) и инкубировать их на одну неделю в росте кабинета.
- Скрип среднего CIM с помощью пинцета, так что листья могут лучше разместиться на средства массовой информации.
- Передача листья, сохраняя abaxial стороне до среднего SIM (рис. 2 c) и инкубировать их в рост кабинета, освежающий носитель каждые 7-10 дней, до тех пор, пока побеги, около 2 см в высоту.
- Царапать среднего SIM с помощью пинцета, так что листья могут быть полностью окружен средств массовой информации. Когда возникла побеги достигают крышку, работать с высокими Петри (100 x 20 мм, высота х диаметр).
Примечание: После 2-3 недели в SIM среднего (Рисунок 2D) и побеги после 6-7 недель (Рисунок 2E) составят каллуса. Побеги будет рассматриваться в качестве независимых преобразования события, когда они выходят из каллуса образуются из независимых раны.
- Царапать среднего SIM с помощью пинцета, так что листья могут быть полностью окружен средств массовой информации. Когда возникла побеги достигают крышку, работать с высокими Петри (100 x 20 мм, высота х диаметр).
- Вырезать три стреляет возникла из каждого каллуса (считается один и то же событие преобразования) (Рисунок 2E), передачи их культуры колбы с мг средний дополнена Цефотаксим натрия [250 мг/Л] чтобы болеть, ярлык подмножество с номером и Инкубируйте в росте, кабинет для 3-4 недели или до тех пор, пока побеги являются энергичные (Рисунок 2F).
Примечание: Когда резка побеги, удалить также каллуса иначе корень будет не образуют.- Повторите столько раз, как независимые линии необходимы. До 5 различных преобразований события могут быть размещены в колбе культуры с диаметром 8 см для работы в полной уверенности, что растения из разных событий не смешиваются.
- Выберите наиболее энергичных завод каждого события, вырезать апикальной сегмент стрелять с 3-4 междоузлий и поместите его в новой культуры колбу с 2MS среднего дополнена Цефотаксим натрия [250 мг/Л].
Примечание: В 3-6 недель, что растение будет расти эффективно, разработке энергичной стрелять и корни.- Вернуть к камере невыбранных побеги до тех пор, пока завод выбран полностью разработаны.
- Вырезать сегменты ствола от завода с по крайней мере один между узлами или верхушечный бутон и передавать их на новый носитель 2MS дополнена Цефотаксим [250 мг/Л]. Инкубируйте их в кабинет роста.
- Реплицируйте каждые 3-4 недель для установления линии в vitro превращается.
Примечание: Цефотаксим натрия необходима в по меньшей мере три последующие переводы 2MS средний чтобы убить A. tumefaciens; Впоследствии если наблюдается разрастание A. tumefaciens , передать растения снова 2MS СМИ дополнена Цефотаксим натрия.
- Реплицируйте каждые 3-4 недель для установления линии в vitro превращается.
- Характеризовать завод фенотип, передачи растений в почву для их полной характеризации или культуре гидропоники для корня инспекции.
- Держите клубни в почве распространять и поддерживать установленные линии.

Рисунок 2: Сроки для получения картофеля преобразован растений с использованием A. tumefaciens. Показаны совокупные недель для достижения каждого этапа процесса трансформации и последующие шаги для выращивания растений. Представитель изображения различных этапов изображены: начало процесса с использованием листья от 3 - неделя старый в vitro растений (A), передача раненых и зараженные листья в CIM СМИ (B), листья при передаче СИМ СМИ (C), Визуализация каллуса вокруг раненых области после 2-3 недели в СМИ (D) SIM, формирование стрелять после 9-11 недель в SIM СМИ (E) и побеги после перевода мг СМИ (F). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
5. гидропонные культуры
- Приготовляют раствор Хоугланд половину численности (0.5 x) (Таблица S2) в ведро 10 Л.
- Погружайте в аквариум насос для поддержания однородности и условий надлежащего кислорода.
- Покрывают стены ведро с алюминиевой фольгой расти корни в условиях темноты.
- Во избежание повреждения корневой, передачи в vitro растений в культуре гидропоники.
Примечание: Удалите любые оставшиеся средства в пробирке из корней, чтобы избежать распространения микроорганизмов во время инкубации встряхнув тщательно корни в воде. - Обложка растений с прозрачной пленки как glasshouse чтобы адекватные акклиматизации и инкубировать в рост палата.
- Сделайте отверстия в фильме после 3 дней и удалить его полностью через одну неделю после.
- Замените свежим СМИ каждые 10 дней.
6. ГАС гистохимические Репортер ген пробирного
Примечание: В нашем случае ГУС был проведен анализ с корнями 2-3 недель, выращенных в гидропоники или в пробирке.
- Исправьте корни ацетоном (v/v) 90% охлажденной и проинкубируйте его за 20 минут на льду.
- Выполняют два мойки с дистиллированной водой.
- Добавить свежие ГАС, окрашивание раствора (Таблица 1) и применить вакуум (-70 Па) за 20 мин.
- Инкубируйте при 37 ° C в темноте, чтобы защитить фоточувствительные GUS за 4 ч или до тех пор, пока синий цвет является видимым.
Примечание: Присутствие и Ферри - Ферроцианид в ГАС решение свести к минимуму распространение продуктов реакции и обеспечивают более точной локализации.
Предупреждение: Использовать вытяжной шкаф и носить защитную одежду при обработке токсичных цианида производные в растворе гусь (калия Гексацианоферрат и Ферроцианид калия). GUS субстрата и утилизации материала должны быть удалены безопасно. - ГУСЬ, окрашивание раствора снимите и выбросьте его в соответствующие контейнеры.
- Выполняют два мойки с этанол 70% (v/v).
- Наблюдать под микроскопом светлые области.
Примечание: ГСУ окрашивание является стабильным в течение нескольких недель; Однако в течение первой недели, GUS сигнал ясно и рассеивает меньше на соседние клетки. Для более длительного хранения печать трубки и хранить при 4 ° C.
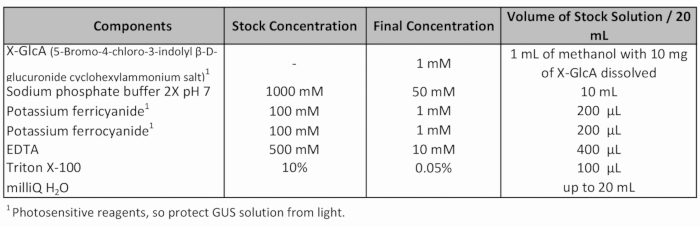
Таблица 1: GUS окрашивание решения рецепт.
Результаты
Agrobacterium rhizogenes -опосредованной трансформации картофеля
В этой рукописи представлена пошаговая процедура для получения преобразованного корень с A. rhizogenes . На рисунке 1 представлен обзор проце...
Обсуждение
В картофеля наиболее распространенной системой для получения стабильной полный трансгенных растений использует преобразование Agrobacterium tumefaciens штаммов, которые требуют органогенеза с помощью экзогенных фитогормонов. Хотя у Agrobacterium на основе протоколов имеет потенциал, чтобы ...
Раскрытие информации
Авторы не имеют никаких конфликтов интересов раскрыть.
Благодарности
Эта работа была поддержана Ministerio de Innovación y науки (AGL2009-13745, ИПИ Грант для PB), y Ministerio де Economía развитию и ФЕДЕР финансирования (AGL2012-36725, AGL2015-67495-C2-1-R) и Жиронского университета (доктор Грант SF, и Грант SING11/1). Авторы благодарны доктором Инге Broer (Институт землепользования, университета г. Росток, Росток, Германия) и доктор Salomé Прат (Centro Nacional де биотехнология, Мадрид, Испания) для обеспечения а. rhizogenes и A. tumefaciens деформации, соответственно и доктор Marçal Солер и д-р Анна Plasencia за помощь и поддержку, полученную в инициировании трансформации экспериментов A. rhizogenes (Университет Тулуза III Поль Сабатье — CNRS, завод лабораторных исследований (LRSV), Castanet Толозан, Франция). Авторы благодарят Сара Гомес (Кафедра де Biologia, UdG, Жирона) за ее ценную помощь в проведении лабораторных работ и забота о растений и Ferran Fontdecaba и Карла Санчес, который помогал с некоторыми из экспериментов, в то время как они делают свои окончательные дипломных проектов.
Материалы
| Name | Company | Catalog Number | Comments |
| Acetone | Panreac | 1.310.071.21 | |
| Acetosyringone | Acros | 115540050 | |
| Aquarium pump | Prodac | MP350 | |
| Autoclave | Ragpa Strelimatic | ||
| Bacteriological agar | Lab Conda | 1800 | |
| BAP | Duchefa | B0904 | |
| Beef extract | Lab Conda | 1700 | |
| Plant growing cabinet | Nuaire | ||
| Carbenicillin | Duchefa | C0109 | |
| Cefotaxime sodium | Duchefa | C0111 | |
| DMSO | Merck | 1029310161 | |
| Ecotron infors | HT | 29378 | |
| Ethanol | Merck | 1,009,831,011 | |
| Falcon tube | Control tecnica | CFT011500 | |
| Ferricyanate | Sigma | 101001081 | |
| Ferrocyanate | Sigma | 100979088 | |
| Flask (8.06 cm diameter and 11.3 cm height) and plastic lid for in vitro culture | Apiglass | ref16 | |
| GA3 | Sigma | G7645 | |
| Gamborg B5 media | Duchefa | G0210 | |
| Gelrite | Duchefa | G1101 | |
| Glucosa | Sigma | G5767 | |
| Kanamycin | Sigma | K1377 | |
| Leukopor tape | BSN Leukopor | BDF47467 | |
| Lupe | Wild-Heerbrugg | M420 | |
| Magnetic shaker | Agimatic | 7000243 | |
| MES hydrate | Sigma | M2933-25G | |
MgSO4 | Panreac | 131404 | |
| Microscope | Olympus | ||
| Minufugue centrifugue 5415R | Eppendorf | ||
| Murashige and Skoog media | Duchefa | M0254.0050 | |
Na2HPO4 | Panreac | 131679 | |
| NAA | Duchefa | N0903 | |
| NaCl | Panreac | 131659 | |
NaH2PO4 | Sigma | 58282 | |
| NightSea Stereo | SFA Moonting Adapter | ||
| Parafilm | Anorsa | PRFL-001-001 | |
| Peptone | Lab Conda | 1616 | |
| Petri dishes (90 x 14) | Anorsa | 200200 | |
| pHmetre | Crison | ||
| Phytotron | Inkoa | RFTI-R5485 | |
| Plant Agar | Duchefa | P1001 | |
| Refrigeratot | Liebherr Medline | ||
| Rifampicin | Duchefa | R0146 | |
| Spectinomycin | Sigma | 59007 | |
| Spectrophotometer | Shimadzu | ||
| Square plates (120 x 120) | Deltalab | 200204 | |
| Streptomycin | Sigma | S6501 | |
| Sucrose | Panreac | 131621 | |
| Surgical blades | Swann-Morton | 201 | |
| Surgical needle | NIPRO | 015/0204 | |
| Triptone | Lab Conda | 1612 | |
| Triton | Serva | 37240 | |
| Unimax 1010 shaker | Heidolph | ||
| Vacuum | Dinko | ||
| x-GlcA (5-Bromo-4-chloro-3-indoxyl-beta-D-glucuronic acid, sodium salt anhydrous) | Biosynth | B-7398 | |
| Yeast extract | Lab Conda | 1702.00 | |
| Zeatin riboside | Sigma | 1001042850 |
Ссылки
- Gelvin, S. B. Traversing the Cell: Agrobacterium T-DNA's journey to the host genome. Frontiers in Plant Science. 3, 1-11 (2012).
- Lacroix, B., Citovsky, V. The roles of bacterial and host plant factors in Agrobacterium-mediated genetic transformation. The International Journal of Developmental Biology. 57 (6-8), 467-481 (2013).
- Lee, L. Y., Gelvin, S. B. T-DNA binary vectors and systems. Plant Physiology. 146 (2), 325-332 (2008).
- Ishida, Y., et al. High efficiency transformation of maize (Zea mays L.) mediated by Agrobacteriumtumefaciens. Nature Biotechnology. 14 (6), 745-750 (1996).
- White, F. F., Taylor, B. H., Huffman, G. A., Gordon, M. P., Nester, E. W. Molecular and genetic analysis of the transferred DNA regions of the root-inducing plasmid of Agrobacterium rhizogenes. Journal of Bacteriology. 164 (1), 33-44 (1985).
- Dinh, P. T. Y., Brown, C. R., Elling, A. A. RNA Interference of effector gene Mc16D10L confers resistance against Meloidogyne chitwoodi in Arabidopsis and Potato. Phytopathology. 104 (10), 1098-1106 (2014).
- Horn, P., et al. Composite potato plants with transgenic roots on non-transgenic shoots: a model system for studying gene silencing in roots. Plant Cell Reports. 33 (12), 1977-1992 (2014).
- Plasencia, A., et al. Eucalyptus hairy roots, a fast, efficient and versatile tool to explore function and expression of genes involved in wood formation. Plant Biotechnology Journal. 14 (6), 1381-1393 (2015).
- Ron, M., et al. Hairy root transformation using Agrobacteriumrhizogenes as a tool for exploring cell type-specific gene expression and function using tomato as a model. Plant Physiology. 166 (2), 455-469 (2014).
- Zhang, W., et al. Development and application of a universal and simplified multiplex RT-PCR assay to detect five potato viruses. Journal of General Plant Pathology. 83 (1), 33-45 (2017).
- Almasia, N. I., et al. Successful production of the potato antimicrobial peptide Snakin-1 in baculovirus-infected insect cells and development of specific antibodies. BMC Biotechnology. 17 (1), 1-11 (2017).
- Serra, O., et al. Silencing of StKCS6 in potato periderm leads to reduced chain lengths of suberin and wax compounds and increased peridermal transpiration. Journal of Experimental Botany. 60 (2), 697-707 (2009).
- Serra, O., et al. CYP86A33-Targeted gene silencing in potato tuber alters suberin composition, distorts suberin lamellae, and impairs the periderm's water barrier function. Plant Physiology. 149 (2), 1050-1060 (2008).
- Serra, O., et al. A feruloyl transferase involved in the biosynthesis of suberin and suberin-associated wax is required for maturation and sealing properties of potato periderm. The Plant Journal. 62 (2), 277-290 (2010).
- Boher, P., Serra, O., Soler, M., Molinas, M., Figueras, M. The potato suberin feruloyl transferase FHT which accumulates in the phellogen is induced by wounding and regulated by abscisic and salicylic acids. Journal of Experimental Botany. 64 (11), 3225-3236 (2013).
- Serra, O., Chatterjee, S., Figueras, M., Molinas, M., Stark, R. E. Deconstructing a plant macromolecular assembly: chemical architecture, molecular flexibility, and mechanical performance of natural and engineered potato suberins. Biomacromolecules. 15 (3), 799-811 (2014).
- Vulavala, V. K. R., et al. Identification of genes related to skin development in potato. Plant Molecular Biology. 94 (4-5), 481-494 (2017).
- Landgraf, R., et al. The ABC transporter ABCG1 is required for suberin formation in potato tuber periderm. The Plant Cell. 26 (8), 3403-3415 (2014).
- Verdaguer, R., et al. Silencing of the potato StNAC103 gene enhances the accumulation of suberin polyester and associated wax in tuber skin. Journal of Experimental Botany. 67 (18), 5415-5427 (2016).
- Molina, I., Li-Beisson, Y., Beisson, F., Ohlrogge, J. B., Pollard, M. Identification of an Arabidopsis feruloyl-coenzyme A transferase required for suberin synthesis. Plant Physiology. 151 (3), 1317-1328 (2009).
- Gou, J. Y., Yu, X. -. H., Liu, C. J. A hydroxycinnamoyltransferase responsible for synthesizing suberin aromatics in Arabidopsis. Proceedings of the National Academy of Sciences of the United States of America. 106 (44), 18855-18860 (2009).
- Banerjee, A. K., Prat, S., Hannapel, D. J. Efficient production of transgenic potato (S. tuberosum L. ssp. andigena) plants via Agrobacterium tumefaciens-mediated transformation. Plant Science. 170 (4), 732-738 (2006).
- Sunil Kumar, G. B., Ganapathi, T. R., Srinivas, L., Revathi, C. J., Bapat, V. a. Expression of hepatitis B surface antigen in potato hairy roots. Plant Science. 170 (5), 918-925 (2006).
- Schmidt, J. F., Moore, M. D., Pelcher, L. E., Covello, P. S. High efficiency Agrobacteriumrhizogenes-mediated transformation of Saponariavaccaria L. (Caryophyllaceae) using fluorescence selection. Plant Cell Reports. 26 (9), 1547-1554 (2007).
- Petti, C., Wendt, T., Meade, C., Mullins, E. Evidence of genotype dependency within Agrobacteriumtumefaciens in relation to the integration of vector backbone sequence in transgenic Phytophthorainfestans-tolerant potato. Journal of Bioscience and Bioengineering. 107 (3), 301-306 (2009).
- Gaudin, V., Vrain, T., Jouanin, L. Bacterial genes modifying hormonal balances in plants. Plant Physiology and Biochemistry. 32 (1), 11-29 (1994).
- Nemoto, K., et al. Function of the aux and rol genes of the Ri plasmid in plant cell division in vitro. Plant Signaling &. Behavior. 4 (12), 1145-1147 (2009).
- Visser, R. G. F., et al. Expression and inheritance of inserted markers in binary vector carrying Agrobacteriumrhizogenes-transformed potato (Solanumtuberosum L.). Theoretical and Applied Genetics. 78 (5), 705-714 (1989).
- Guillon, S., Trémouillaux-Guiller, J., Pati, P. K., Rideau, M., Gantet, P. Hairy root research: recent scenario and exciting prospects. Current Opinion in Plant Biology. 9 (3), 341-346 (2006).
- Georgiev, M. I., Agostini, E., Ludwig-Müller, J., Xu, J. Genetically transformed roots: from plant disease to biotechnological resource. Trends in Biotechnology. 30 (10), 528-537 (2012).
- Ooms, G., Lenton, J. R. T-DNA genes to study plant development: precocious tuberisation and enhanced cytokinins in A. tumefaciens transformed potato. Plant Molecular Biology. 5 (4), 205-212 (1985).
- de Vries-Uijtewaal, E., et al. Fate of introduced genetic markers in transformed root clones and regenerated plants of monohaploid and diploid potato genotypes. TAG. Theoretical and applied genetics. 78 (2), 185-193 (1989).
- Bird, D., et al. Characterization of Arabidopsis ABCG11/WBC11, an ATP binding cassette (ABC) transporter that is required for cuticular lipid secretion. The Plant Journal: For Cell and Molecular Biology. 52 (3), 485-498 (2007).
- Luo, B., Xue, X. Y., Hu, W. L., Wang, L. J., Chen, X. Y. An ABC transporter gene of Arabidopsis thaliana, AtWBC11, is involved in cuticle development and prevention of organ fusion. Plant and Cell Physiology. 48 (12), 1780-1802 (2007).
- Panikashvili, D., et al. The Arabidopsis DESPERADO/AtWBC11 transporter is required for cutin and wax secretion. Plant Physiology. 145 (4), 1345-1360 (2007).
- Panikashvili, D., et al. The Arabidopsis DSO/ABCG11 transporter affects cutin metabolism in reproductive organs and suberin in roots. Molecular Plant. 3 (3), 563-575 (2010).
- Bjelica, A., et al. Fatty acid ω-hydroxylases from Solanum tuberosum. Plant Cell Reports. 35 (12), 2435-2448 (2016).
- Ding, Y., et al. Abscisic acid coordinates nod factor and cytokinin signaling during the regulation of nodulation in Medicago truncatula. The Plant Cell. 20 (10), 2681-2695 (2008).
- Isayenkov, S., Mrosk, C., Stenzel, I., Strack, D., Hause, B. Suppression of allene oxide cyclase in hairy roots of Medicagotruncatula reduces jasmonate levels and the degree of mycorrhization with glomus intraradices 1[w]. Plant Physiology. 139 (3), 1401-1410 (2005).
- Dalton, D. A., et al. Physiological roles of glutathione S-Transferases in soybean root Nodules 1[C][W][OA]. Plant Physiology. 150 (1), 521-530 (2009).
- Limpens, E., et al. RNA interference in Agrobacteriumrhizogenes-transformed roots of Arabidopsis and Medicago truncatula. Journal of Experimental Botany. 55 (399), 983-992 (2004).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены