Method Article
При содействии Deep последовательности, спонтанное подавитель экран в деления дрожжевой Делящиеся дрожжи
В этой статье
Резюме
Мы представляем протокол простого супрессор экрана в деления дрожжей. Этот метод является эффективным, мутагены бесплатно и селективного мутаций, которые часто происходят в одном локусе геномной. Протокол подходит для изоляции перенапряжения, которые облегчить роста дефектов в жидких культуры, которые вызваны мутации или наркотиков.
Аннотация
Генетических экран для мутантных аллелей, которые подавляют фенотипические дефекты, вызванные мутация представляет собой мощный подход к идентификации генов, которые принадлежат к тесно связанных биохимические пути. Предыдущие методы, такие как синтетические генетических массив (SGA), методам анализа и случайных мутагенеза с помощью ультрафиолетового (УФ) или химических веществ, как этиловый метансульфонат (EMS) или N-этил N-Нитрозомочевина (ENU), широко используется, но часто являются дорогостоящими и кропотливая. Кроме того эти методы на основе мутаген скрининга, часто связаны с серьезных побочных эффектов на организм, вызывая несколько мутаций, которые добавить сложности изоляции супрессоров. Здесь мы представляем простой и эффективный протокол для выявления подавитель мутации в мутантов, которые наделяют рост дефекта в Делящиеся дрожжи. Для восстановления с использованием автоматизированных 96-луночных пластины читателя в течение продолжительного периода может контролироваться фитнес клеток с роста дефицита в стандартной жидкости мультимедиа или синтетических жидких сред. Когда ячейка приобретает подавитель мутации в культуре, его потомки переиграть родительских клеток. Восстановленные клетки, которые имеют преимущество конкурентной роста над родительской клетки можно затем изолированные и backcrossed с родительской ячейки. Подавитель мутации затем идентифицируются с помощью всего генома. Используя этот подход, мы успешно изолированы несколько перенапряжения, которые смягчить серьезный рост дефекты, вызванные потерей Elf1, семейству AAA + АТФазы, что важно в ядерный транспорт мРНК и поддержание геномной стабильности. Есть в настоящее время над 400 генами в S. pombe с мутантами, присвоении рост дефекта. Как многие из этих генов uncharacterized, мы предлагаем, что наш метод будет ускорить выявление Роман функционального взаимодействия с этой удобной, высок объём подходом.
Введение
Основы понимания функциональных связей между генов опирается на способность определить молекулярных механизма(ов), в которой сложных генетических признаков расходятся производить разнообразные фенотипов1. В деления дрожжи, Делящиеся дрожжи (S. pombe), большинство белков кодирование генов являются необязательным для жизнеспособности2. Этот результат не говорю незначительность этих генов, а скорее замысловатые компенсаторные механизмы, лежащие в основе биохимические пути, к которым принадлежат такие гены. Пройдя эти компенсаторные механизмы вызвала Эпистаз карты, которые обнаружили всеобъемлющей генетических взаимодействий и расширить наше понимание функциональных биохимические пути3,4.
Разработаны методы высокой пропускной способностью (например, синтетические генетических массив анализа или SGA) для выявления генетических взаимодействий генома общесистемной в многообещающий дрожжей и были расширены для использования в деления дрожжевой5,6. Такие подходы часто полагаются на Библиотека штаммов, содержащий все жизнеспособные одного белка кодирование гена удаления (около 3300 гаплоидным удаления мутантов охватывающих свыше 92% генома деления дрожжей) и требуют робот-манипулятор для выполнения генетических кресты между штамм интерес и все возможные штаммов в library6. Кроме того SGA методов зависит от способности библиотека штаммов для надлежащего и эффективного спаривания, фенотип, что является ненормальным на 444 в настоящее время характеризуется генов в S. pombe2.
Несмотря на сложности генетических взаимодействий, сравнивая фенотип штамм, перевозящих мутации в двух генов к фенотипу двух штаммов, перевозящих отдельные мутации каждого гена может иметь один из двух заметных результатов: 1) является двойной фенотипом мутанта хуже, чем ожидаемый мультипликативной родителей фенотипы в форме болезни или, в самых крайних случая, летальность. Это называется негативных генетических взаимодействия и обычно является признаком того, что два гены действуют в параллельных биологические пути. 2 двойной фенотипом мутанта лучше чем ожидаемый сочетание родительского фенотипов, также известный как позитивного взаимодействия генетические. Позитивное взаимодействие генетических особенно интересно, потому что она показывает, что эти гены работают в том же процессе. Два взаимодействующих положительно гены имеют три возможных отношений: мутантный ген может вверх регулировать экспрессии гена, в параллельные пути, двух генов может работать согласованно в рамках же путь вниз по течению друг друга или два гены кодировать белки, которые взаимодействуют непосредственно друг с другом. Таким образом позитивные генетических взаимодействий может использоваться для сопоставления гена регулирующих узлов и классифицировать uncharacterized генов в биохимические пути7,,8.
Подавитель это мутации, которые могут облегчить болезни фенотип мутации гена другой, обычно представляющий позитивного генетических взаимодействия между двумя генами9,10. Подавитель мутации на различных локус, мутации, которые они подавляют известны как extragenic супрессоров. Они особенно ценны в изучении нежизнеспособных генетические мутации, синтетически спасать смертоносных фенотип (также известный как эффект Лазаря)11. Они также имеют потенциал терапевтического применения в лечении наследственных заболеваний12,13.
По всем этим причинам выявление подавитель мутаций в различных модельных организмов широко использовались для облегчения нашего понимания различных биохимических pathways14,,1516. Скрининг для перенапряжения обычно основывается на фенотип мутации в вопрос и требует проведения случайных мутагенеза изолировать мутации, которые облегчат фенотипа. Почти все модели организмов создали методы случайного мутагенеза. Например N-этил N-Нитрозомочевина (ENU) и ethylmethanesulfonate (EMS), два мутагенов, которые способны индуцировать точечные мутации в ДНК, широко используются в различных моделях мышей17,18,19 от бактерий . Кроме того хлорид марганца уже давно используется в дрожжи для марганца катиона способностью ингибировать ДНК ремонт пути20. Другой распространенный подход — УФ индуцированного мутагенеза, который генерирует генома общесистемной мутагенных пиримидина димеры21,22.
Хотя использование химического мутагенеза для выявления мутаций подавитель был популярен, метод имеет много недостатков, в том числе использование опасных химических веществ, крайне непостоянны успех ставки и введение дополнительных смешанных переменных представлено негативные побочные эффекты мутаген несколько клеточных процессов23,24. Кроме того химический мутагенез часто вызывает несколько мутаций в геном, который добавляет сложности использования генетических и последовательности методов для определения точного мутации, которая наделяет подавитель фенотип организма25.
Для устранения недостатков нынешних подходов мутагенеза, мы представляем метод экран для спонтанного подавитель мутации в деления дрожжей, которые не полагаться на любой мутагены или удаление библиотеки. Этот метод изолирует Подавители через пробирного позитивного выбора. Принцип этого метода на основе роста преимущество мутировавших супрессорной субпопуляции в жидкой культуры, который может контролироваться читатель автоматизированной пластины. Спаривание и мейоз используются только если хотите очистить генетический фон или подтвердить наличие Моногенные аллели супрессоров до всего генома. Если подавление фенотип вызвана одной мутации, подавитель фенотип будет отделять 2:2 после Опылив с родительского штаммов. Подавитель мутации могут быть определены с помощью всего генома. Мы предлагаем, что этот метод применим для скрининга перенапряжения в всех микроорганизмов, которые могут расти в большой численностью населения в жидком культуры.
протокол
1. штамм строительство и подготовка
- Генерировать мутации или удаления гена (yfm, ваши любимые мутации) с использованием стандартного сайта Направленный мутагенез (SDM), как описано ранее,26.
- Перед началом экрана, (оптимально) backcross мутантных штаммов дикого штамма очистить генетический фон и генерировать свежие родился мутантные клетки как родительский штаммов. Полоска родительский сорт для отдельных колоний на стандартных богатых СМИ пластины. Случайным образом выбрать восьми до шестнадцати независимых колоний (биологические реплицирует) с желаемой мутации для assay читатель пластины (см. 3.1).
Примечание: Этот протокол является эффективным только тогда, когда родительский штаммов у рост дефектов в жидких средах (минимальная или богатым, с или без наркотиков или с изменениями температуры, которые вызывают рост дефекта). Все штаммы родителей должны быть гаплоидным и таким образом может быть генетически пересекается с другими гаплоидным штаммы с типом взаимодополняющих спаривания.
2. плита читателя пробирного
- С стерильных аппликатор взять небольшое количество каждого из колоний, подготовленную на этапе 1.1 (нет точной суммы, необходимой для инокуляции начиная культуры) и место в полистирола 96-луночных микропланшетов. Приостановите каждый из колоний в 200 мкл соответствующего жидких сред (богатых или минимальным, с или без наркотиков). Включать пустые хорошо для каждой строки на табличке, содержащий 200 мкл же СМИ (без клетки).
- Выполнить следующий протокол на тарелку читателя обнаружения программного обеспечения подключен к автоматической Считыватель микропланшетов: задать кинетическая программу для 24 h и температуры в 30 ° C, с непрерывной быстро орбитальных встряхивания (425 cpm, амплитуда 3 мм). Установите оптический читает для измерения рассеяние света на длине волны 600nm для оптической плотности и свет для чтения снизу пластины с частотой чтение 2 мин (721 всего читает в течение 24-х за хорошо).
- После 24 часов, записать окончательный пустыми оптической плотности чтений (пустыми OD600) и используйте следующую формулу для определения объема необходимых для разбавления каждого из образцов до O.D. = 0.1:
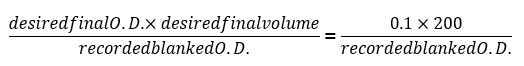
Примечание: Экспортируйте данные из программ чтения пластины и использовать программное обеспечение электронной таблицы для вставки указанной выше формулы как функция пакетной обработки разрежения тома для использования из каждой экспериментальной скважины. - Каждые 24 ч, развести каждого из образцов с использованием тех же СМИ как день 0 O.D. = 0.1 (около 1,5 х 106 клеток/мл) с использованием формулы указывается на шаге 2.3. Сохранить все роста кривых генерируется ежедневно и отметить любые отдельные колонии, которая показывает увеличение прироста, судить окончательный O.D., что значительно выше, чем остальная часть когорты с же генетический фон или кривой роста, которая аналогична одичал типа колоний.
Примечание: Этот assay обычно занимает около 7-14 дней. Выполните все шаги в стерильных условиях.
3. Подбор подавитель колоний и подтверждения фенотип.
- От последнего дня пробирного читатель пластины (шаг 2.4) Сохраните жидкость культур, которые предположительно имеют заметно восстановленные прирост, получая подавитель мутации, которые могут облегчить фенотип родительских мутации. Передача и смешивать 250 мкл жидкого культуры cryotube, содержащий 250 мкл 50% глицерина. Вспышки заморозить клетки в жидком азоте и сохраните штаммов в - 80oC на неопределенный срок.
- Для подтверждения, что мутация супрессорной является генетически наследуемое элемент, используйте методы стандартных генетических пересечения пересечь yfm P (для родителей, штамм используется в начале пробирного читатель пластины) с yfm S (для супрессор, штамм, сохраненные в конце пластина читатель анализа). Если мутация подавитель действительно является генетически наследуемого элемента, yfm P × yfm S должна принести тетрад в которых две колонии имеют болезни фенотип штамма родителей и две колонии восстановленные прирост супрессорной штамм.
- От Креста шаг 3.2, выбрать три колонии с фенотипом супрессор (штамм S) и три колонии с родительского фенотипу (P штамм) из того же генетического крест (3 биологических репликация для каждого) и приступить к экстракции геномной ДНК и последовательность шагов ниже.
Примечание: Шаги 3.2 и 3.3 настоятельно рекомендуется, но не требуются. Кроме того один можно распространения восстановленные культур в жидкой среде с 3.1 на богатые среднего собраны в единый колоний, а затем случайным образом выбрать три колонии как биологические triplicates для всего генома без дальнейших генетических подтверждения. В этом случае три биологических triplicates родителей штамма должно использоваться для сравнения геномные последовательности.
4. геномной ДНК добыча, производство библиотеки и последовательности.
- Для извлечения ДНК, Библиотека подготовки и последовательности, случайным образом выбрать три биологических реплицирует на штамм yfm P , и три биологических реплицирует каждого индивидуально возникшие yfm S штаммов из генетических кресты (шаг 3.2) или пластины, которые были распространены для получения одной колонии штамма S (Примечание шагу 3.3).
- Расти штаммов в 10 мл культур в богатых средств массовой информации к середине журнала фазе (O.D. = 0,5 – 0,8, о 0,75-1,2 х 107 кл/мл) и использовать пожимая инкубатор расти жидкого культур при 30 ° C с постоянно тряски на 250 об/мин. Соберите клетки центрифугированием при 4 ° C за 5 мин на 1000 x g.
- Приостановить гранулированных клетки в 400 мкл буфера экстракции ДНК (2% Тритон X-100, 1% SDS, 100 мм NaCl, 10 мм трис-Cl (рН 8,0), 1 мм Na2-ЭДТА), затем добавить 400 мкл стеклянные бусы и 400 мкл 25:24:1 фенола: хлороформ: изоамилового спирта. Вихревой энергично за 2 мин при 4 ° C.
- Добавьте дополнительные 200 мкл буфера экстракции ДНК и микс, переворачивать несколько раз. Центрифуги для 5 мин при температуре 4 ° C на 20000 x g.
- Передать трубу чистой водной фазе, добавить 20 мкг смеси РНКазы A/T1 и инкубировать при 37 ° C 15 мин.
- Добавить равное количество 25:24:1 фенола: хлороформ: изоамилового спирта, спина за 5 мин при температуре 4 ° C на 20000 x g, затем передать водяной участок чистой трубки.
- Добавить равное количество метилхлороформа, mix переворачивать несколько раз, затем спина за 5 мин при температуре 4 ° C на 20000 x g, затем передать трубу чистой водной фазе.
- Осадок ДНК с два тома 100% этанола плюс 10% объем 3 M NaOAC (рН 4,3) при-20 ° C для по крайней мере 2 часа, затем спина за 5 мин при 4 ° C на 20000 x g и собирать гранулы.
- Помыть лепешка (осажденный ДНК) дважды с охлажденной 70% этанола (центрифуги на 20000 x g, 5 мин., 4 ° C) и приостановить гранулы в 50 мкл 10 мм трис-буфере (рН 7,4).
- Использование библиотеки приготовительная комплекта (см. Таблицу материалы) за рекомендациями изготовителя подготовить в целом-генома библиотеку.
Примечание: Мы рекомендуем комплект, перечисленные в Таблице материалы , потому что она позволяет строительство геномные библиотеки без амплификации PCR, который минимизирует ошибки мутации, созданные во время ПЦР-амплификации. Кроме того, в ходе подготовки геномная Библиотека, не позволяют бусины в полностью сухой, сокращая шарик, время высыхания до 1 – 2 мин. - Для сдвига параметров во время подготовки библиотеки, используйте сосредоточены sonicator (см. Таблицу материалы) и установить коэффициент до 20%, Пиковая мощность до 175 Вт, с 200 циклов в лопнул, и частоты радикальных режим в 5.5oC до 6 ° C на 45 s. Альтернативно, используйте ДНК и chomatin сдвига системы (см. Таблицу материалы) со следующими параметрами: 50% амплитуды при 4 ° C с импульсный режим, 15 s на и 15 s покинуть за 10 мин, общее время обработки 20 мин.
- Это важно для обработки опасных материалов, используемые на этом шаге с осторожностью. Консультироваться соответствующие листы данных безопасности материалов и санитарного состояния окружающей среды и безопасности бюро Института для обработки NaOAC, этанол, 25:24:1 фенола: хлороформ: изоамилового спирта и хлороформе.
- Последовательность результате геномная библиотек. Читает весь последовательности должен охватывать по крайней мере три раза всего генома с разрешением в диапазоне единичных нуклеотидных. Рекомендуется в паре закончился последовательность (или новейших технологий).
5. Биоинформатика анализ для выявления мутаций супрессор
- Биоинформатика анализ сосредоточиться на геномных изменений, которые определяются последовательно между родительской и подавленные yfm штаммов в всех биологических реплицирует.
Примечание: Полное трубопровода процесс описан ниже, но, Кроме того, два-текстовые файлы BASH-сценариев, fastq_to_vcf.sh и vcfprocess.sh, включены в качестве дополнительных материалов в примерах рабочего процесса обработки операций чтения в VCF вариант файлы и обработки и пересечение VCF файлы, соответственно. - Трим короткий читает с помощью СДВИГА (https://github.com/jbpease/shear) следующие командные строки (все другие параметры по умолчанию):
Shear.py--fq1 $FASTQ1--fq2 $FASTQ2--out1 $OUTFQ1--out2 $OUTFQ2 \
--barcodes1 $BARCODE--платформы TruSeq--trimqual 20:20 \
--trimpolyat 0--trimambig--filterlength 50--filterunpaired - Карта читает v2.30 геном S. pombe ссылки, полученные от PomBase (ftp://ftp.ebi.ac.uk/pub/databases/pombase/pombe/Chromosome_Dumps/fasta/) с помощью BWA v0.7.1527. Используйте следующую командную строку (все другие параметры по умолчанию):
ВСБ мем -t 8 $GENOME $OUTFQ1 $OUTFQ2 > $SAM1 - Поместить файлы выравнивание Сэм через GATK наилучшей практики газопровода28 для варианта вызова с помощью GATK v3.629, PicardTools v2.5.0 (http://broadinstitute.github.io/picard) и SAMtools v1.3.130. Используйте следующие параметры (все другие параметры по умолчанию) и командные строки:
Java-Xmx30g-банку picard.jar AddOrReplaceReadGroups ввода = $SAM1 \
ВЫХОД = $BAMMARKED RGID = 1 RGLB = lib01 RGPL = illumina \
РГПУ = $BARCODE RGSM = $SAMPLENUMBER
SAMtools fixmate - O bam $BAMMARKED $BAMFIXED
SAMtools сортировка - O bam -o $BAMSORTED -T /home/peasejb/tmp $BAMFIXED
SAMtools индекс $BAMSORTED
Java-Xmx30g-банку GenomeAnalysisTK.jar -T HaplotypeCaller \
-R $GENOME-я $BAMSORTED--genotyping_mode обнаружения \
-stand_emit_conf 10 - stand_call_conf 30 -o $VCFRAW - Сжатие и индекс VCF файлы с помощью tabix:
bgzip $VCFRAW.vcf
tabix $VCFRAW.vcf.gz - Сравните файлы VCF среди родителей и подавитель штаммов реплицирует виртуализации с помощью BCFtools v1.3.127. Используйте следующие параметры (все другие опции слева по умолчанию) и командные строки:
bcftools isec - n + 1 $VCFPARENTAL1.gz $VCFPARENTAL2.gz $VCFPARENTAL3.gz \
$VCFMUTANT1.gz $VCFMUTANT2.gz $VCFMUTANT3.gz > common_variants.list
Примечание: Эта команда принесли файл, закодированный бинарные шаблоны где последовательность вариантов, появляются в первых мутанта только бы двоичной кодировке «000100», второго мутанта только как «000010», все три мутантов как «000111,» и др. Эти файлы были созданы для каждого набора родителей и мутанта реплицировать VCF файлы. - Скомпилируйте вариант пересечения список файлов вместе с имя файла для каждой строки, используя команду UNIX grep:
grep». «*.list > all.list - Перекрестные ссылки на полный вариант списка с текущим файлом аннотации GFF3 (ftp://ftp.ebi.ac.uk/pub/databases/pombase/pombe/Chromosome_Dumps/gff3/schizosacchar omyces_pombe.chr.gff3) с помощью пользовательского скрипта Python (variant_characterize.py) для определения последовательного SNP сайтов в кодирвоания протеина регионов (синонимами и не являются синонимами), 5′ и 3′ необычных и ncRNA.
python3 variant_characterize.py — список common_variants.list \
schizosaccharomyces_pombe.chr.gff3--gff \
--fasta Schizosaccharomyces_pombe. ASM294v2.30.DNA.genome.FA \
--шаблон 000100--из all.list.filter.000100
Повторите этот сценарий изменения шаблон и суффиксом выходного файла (--out) с использованием двоичного файла
шаблоны: 000010, 000001, 000110, 000011, 000101 и 000111 - Сочетают в себе выход из всех этих работает скрипт в файле, разделенные табуляцией, следует рассматривать как таблицу. Аннотированный таблица вариантов включает в себя те, которые появляются в одной или обеих мутантов strain(s) относительно фона. Поле двоичный флаг обозначает либо появление в одном мутантный штамм (000100 000010, 000001), два мутантных штаммов (000011, 000101, 000110), или все три мутантных штаммов (000111).
- Анализ вывода аннотированные списки вариантов не найден в родительский образцы, но в один, два или все три черепашки образцы. Аннотация обозначает геномной расположение и класс вариант (синонимом/не синоним кодирования региона, 3/5' УТР, без кодирования, и т.д.). Из этого списка кандидатов мутаций примером сильно соответствующих кандидатов может быть не синонимами вариант кодирования последовательно появляются в всех трех штаммов. Другой тип сильного кандидата будет накопление различных не являются синонимами или предполагаемым регулирующих мутаций в мутантных штаммов, появляются близко друг к другу или же гена.
Результаты
Медленно растущих мутантов Показать фенотипические восстановления в жидком культуре
Мы выбрали три мутантов участвует в различных биологических пути с больным, медленно растущих, фенотип: AAA семьи АТФазы Elf1, Clr6 деацетилаз гистонов и экзона Junction сложный компонент Fal1. Одичал тип деформации и штаммов, перевозящих мутаций этих трех генов, которые были backcrossed с одичал тип штаммы были прожилками отдельных колоний, и 16 одной колонии были случайно выбранных быть культивировали в богатых жидких сред с использованием пластину 96-луночных как описано выше. Кривые роста отдельных колоний были записаны на первоначальном этапе (день 0) и на 6 дней с непрерывный мониторинг с помощью пластины читателя. Как и ожидалось, одичал типа колоний показывают без заметных изменений в их кривых роста на протяжении всего эксперимента31 (рис. 1). Примечательно четыре колонии с elf1∆ фоном и одна колония fal1∆ показывают резкое смещение в росте от медленно растущих на некоторые различные уровни роста аналогичные или близка к одичал типа колоний. Резко все clr6-1 мутантов показывают последовательное фенотипические восстановления, растет более быстрыми темпами в конце пробирного31 (рис. 1). Характеризовать разные фенотипы, мы ссылаемся оригинальных штаммов, которые медленно растут как «P штаммов» (или родительский штаммы) и штаммов, показаны фенотипические восстановления как «S штаммов» (или подавлены штаммы). Пожалуйста, обратите внимание, что Рисунок 1 является примером одного раунда обследования эксперимента и не представляют всего не дополнительные супрессоры выявлены и последовательного в следующих представитель результаты.
Фенотипические восстановления приписывается наследственные черты
S. pombe может расти как Пептон в богатых средств массовой информации, но два гаплоидным штаммы с взаимодополняющими сопрягая типы мат под азота голода. Мейоз в деления дрожжевой влечет за собой серию дублирования, следуют два раунда клеточного деления. Полового цикла приводит к образованию четырех гаплоидным споры, перевозящих генетический материал родительский сорт с 2:2 сегрегации генетических признаков согласно правилам классической менделевской генетики (рисунок 2A). При выращивании на пластину же за такое же количество времени, мы подтвердили 2:2 сегрегации, когда обратно пересечение всех подавил штаммы (S штаммы) с их родительских штаммов (P штаммы), которые привели к 2 маленьких (рост дефекта) и 2 больших (подавитель фенотип) колонии. Отдельные примеры для подавлены elf1∆, clr6-1 и fal1∆ клетки показаны на рисунке 2B. Мы подтвердили, что все изолированные штаммы S нести Моногенные генетический элемент, который подавляет медленно растущих фенотип их штаммами P (данные не показаны).
Целом-генома успешно определяет подавитель мутации
В качестве примера мы использовали в паре конец всего генома для выявления генетических элементов, ответственных за фенотипические подъема в elf1∆ S штаммов. Более полное описание анализа данных — доступны онлайн31. Вкратце мы использовали биологические triplicates двух самостоятельно сгенерированный elf1∆ P штаммов и биологических дубликаты пяти без дополнительных групп штаммов elf1∆ S , каждый из которых содержит различные супрессоров. После того, как мы получили список аннотированного варианта от анализа биоинформатики (6.1-10), мы приоритеты определенные классы вариантов, которые имеют отношение к нашему анализу. Мы сосредоточили внимание на выявление последовательной геномных изменений, которые были идентичны во всех биологических реплицирует отдельных штаммов elf1∆ S , по сравнению с их родителей штаммами elf1∆ P (рис. 3 и дополнительных таблицах 1-4 ). Мы определили пять nonsynonymous изменения в регионах компакт-диски всех пяти различных штаммов elf1∆ S , включая rli1 +, SPBPJ4664.02, cue2 + и rpl2702 +. S-A1 и S A2 содержат мутировавших SPBPJ4664.02, хотя мутации происходят в различных аминокислот. Потому что SPBPJ4664.02 долго ген (11,916 нуклеотидов) с сотнями повторяется, мутации не смогли быть подтверждена ПЦР, следуют последовательности выполнения. S-A3 содержит удаления мутант в rli1 , которое согласуется в обоих биологических дубликаты. Однако мутант сделал совместно не отделять с фенотипом S elf1∆ фоне. Мы определили cue2 мутанта (cue2-1) в S-B1, с аминокислоты 396-400 пропавших без вести. S-B2 содержит rpl2702 мутант (rpl2702-1), который изменяет аминокислоты в позиции 45 от глицина аспартат31. Cue2-1 и rpl2702-1 были подтверждены как супрессоры elf1∆ , как показано ниже.
Генетическое подтверждение выявленных подавитель мутаций проверяет наследуемость фенотипом восстановления
Два из выявленных изменений, nonsynonymous, cue2-1 и rpl2702-1, были реконструированы в лаборатории с использованием стандартных протоколов для сайта Направленный мутагенез. Двойной мутантных штаммов cue2-1 elf1∆ P и rpl2702-1 elf1∆ P были скрещены с бесплатными elf1∆ P штамм31 (рис. 4). Если nonsynonymous мутации, выявленных через этот экран, были достаточными для пресечения elf1∆ P, затем результирующая тетрад показали бы 2:2 малых к большим соотношением в результате 4 споры в каждом тетраде колониях. Действительно генетических пересечения показали, что выявленных подавитель мутаций являются успешными в подавлении медленно растущих фенотипа elf1∆ P и наследственным.

Рисунок 1: фенотипические восстановления может контролироваться путем записи кривых роста на тарелку читателя. Шестнадцать одной колонии одичал типа (WT), elf1∆, clr6-1и fal1∆ были помещены в 96-луночных пластины. Кривые роста были зарегистрированы в течение 24-h и колонии были повторно разреженных ежедневно в богатых средств массовой информации. Рост Дефект проявляется необольшой (ОД) в конце периода 24 часа в день 0. Фенотипически восстановленные штаммы являются те, которые отображают кривая роста, аналогичные, или почти, что одичал типа в течение 24-h, на 6 день. Четыре колонии elf1∆, одна колония fal1∆, и все колонии clr6 - 1 показали различные уровни фенотипические восстановления после 6 дней. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
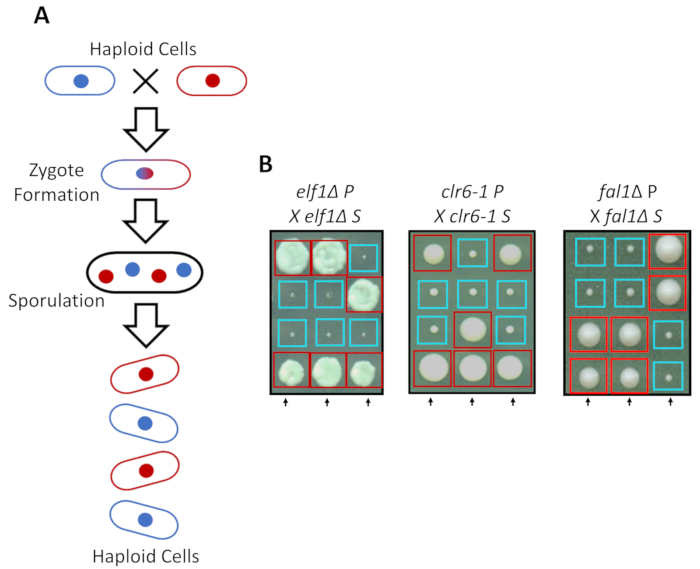
Рисунок 2: генетические пересечение может подтвердить, что Фенотипическая восстановления приписывается один наследственные аллеля. (A) когда деления дрожжевой клетки подвергаются азота голода, два haploid клетки с типом взаимодополняющих спаривания может генерировать зиготы, которая sporulates для генерации тетраде 4 споры. Родительский генетические материалы будут отделять во время мейоза согласно правилам менделевской генетики. (B) фенотипически восстановлены колоний (помечены S, для подавлены) с указывается родительский генотипов были задней пересеклись с их бесплатными родителей колонии (который показывает не фенотипические восстановления, обозначены P, для родителей). Генетическая кресты, показаны 2:2 малых (плохой фитнес) колонии большие (восстановленные фитнес) показывают, что Фенотипическая восстановления наследственные и можно отнести к одному элементу генетических. Красные коробки колоний, перевозящих подавитель аллеля, и синие колоний, перевозящих родительский аллеля. Эта цифра была изменена от Marayati et al., 2018 года31. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
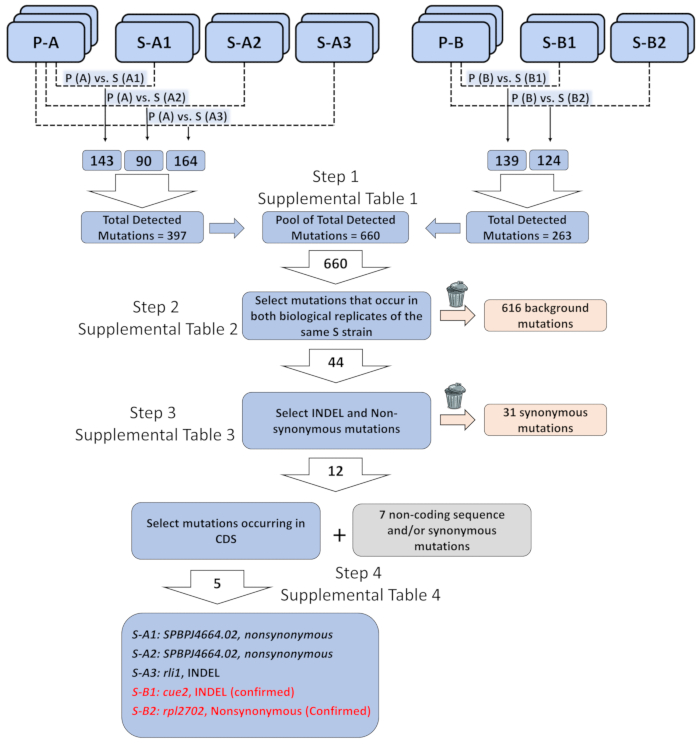
Рисунок 3: Анализ генома общесистемной последовательности данных для выявления генетических элементов ответственного фенотипические восстановления. Три биологических реплицирует штаммов двух родителей «P» (P-A и P-B), и два биологических реплицирует пяти фенотипически восстановлены перешли «S» штаммы (S-A1, S-A2 и S - A3 оправился от P-A; S-B1 и S-B2 из P-B), были упорядочены и мутации были организованы как список каждого мутации в восстановленных нагрузку по сравнению с геном родительский сорт, он является производным от (например, P-A против S-A1, и т.д.). Общее количество обнаруженных мутаций через весь геном всех таких попарных сравнений было 660. В общей сложности 44 мутации были определены, когда были отобраны только мутации, которые происходят в обоих биологических реплицирует же штамма «S». Из 44 мутации 12 мутации были вставки/удаления (INDEL) или не - синоним перегласовок. Из 12 INDEL или не синоним мутации, пять произошли в кодирования последовательности белка. Пяти мутации потенциально коррелируют с генетическим одноэлементных ответственных за фенотипически восстановленные штаммов: не синонимами мутации в SPBPJ4664.02 найденных в S-A1 и S-A2, INDEL в rli1 S-A3, INDEL в cue2 в S-B1 и не являются синонимами мутации в rpl2702 нашли в S-B2. Детальная последовательность информации о мутации и отфильтрованных фон входит в дополнительных таблицах 1-4. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
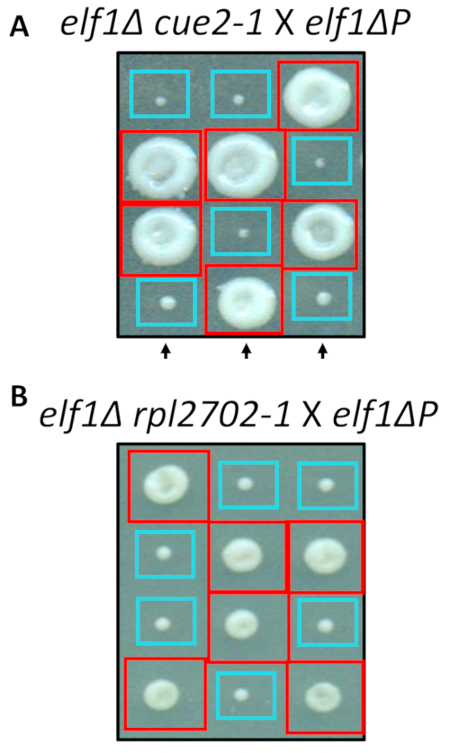
Рисунок 4: подтверждение супрессоров, выявленных с помощью всего генома. Результаты от всего генома, были подтверждены самостоятельно генерации мутации и выполнение генетических пересекает подтвердить фенотипические восстановления путем скрещивания штамма с штамм elf1∆ P и elf1∆ elf1∆ cue2-1 rpl2702-1 с elf1∆ P штамма. Три представителя вертикальных тетрад показываются. Красные поля являются двойной мутант колоний (elf1 cue2-1, или elf1 rpl2702-1); синие ящики являются elf1∆ колоний. Эта цифра была изменена от Marayati et al., 2018 года31. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Справочная таблица 1. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Справочная таблица 2 . Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Справочная таблица 3 . Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Справочная таблица 4 . Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Дополнительное кодирование файлов . Пожалуйста, нажмите здесь, чтобы загрузить файлы.
Обсуждение
Протокол, описанные здесь представляет Роман и простой экран для спонтанного подавитель мутации обнаруживаемой через фенотипические восстановления мутаций, присвоении медленный рост дрожжей деления, фенотип, характерные для более чем 400 генов в S. pombe, функции многих из которых остается неизвестным2,32. Предыдущие методы взяли другие подходы к экран для подавитель мутации в микроорганизмов, включая использование мутагенов21, или применение изменения температуры в чувствительных к температуре мутант стола33. Напротив этот протокол показывает, что Фенотипическая восстановления происходит без дополнительного вмешательства экологических химической и подчеркивается преимущество фитнес подъем подавления мутаций со временем принимая за ресурсы, имеющиеся в жидкости культуры. Этот экран позволяет изоляции объездной Подавители или взаимодействия супрессоров, потому что он является эффективным для обеих функция потерь мутации, например elf1∆ или fal1∆ и точечные мутации как clr6-1, покуда мутантов продемонстрировать фитнес дефектов в жидких культуры.
Пока все восстановленные S штаммов, которые мы исследовали продемонстрировали различной степени фенотипические восстановления. Как обнаружил через генетических, восстановленные фенотип объясняется до одноэлементных генетических и является наследственным (примеры показаны на рисунке 2). Это один из наиболее значительных преимуществ этого метода по сравнению с химической основе или на основе УФ подавитель экраны, которые часто ориентированы на нескольких локусов генома. Это часто можно наблюдать одну или две колонии, восстановленные из 16 колоний в штамм (около 10%) в течение недели. Однако мы заметили, что некоторые мутантов, такие как потеря функции Rrp6, exosome конкретного подразделения, никогда не восстановить темпы роста почти одичал типа наблюдается в elf1Δ клетки31. Вполне вероятно, что функция Rrp6 может только частично компенсируется супрессоров, в отличие от функции других мутантов испытания, включая fal1∆, который был показан причинять серьезный дефект meiotic через свою важную функцию регулирования сплайсинга34. Мы считаем, что альтернативные супрессор, методы фильтрации будет зависеть от той же проблемой, когда yfg имеет уникальный, несъемными ролей в рост клеток.
Перед выполнением геномные последовательности, является оптимальным для обратно крест фенотипически восстановленные колоний, определены от плиты читателя, с родительского штаммов очистить генетический фон и получения биологических реплицирует. Кроме того глубоко всего генома определяет сотни единичных нуклеотидных изменений, большинство из которых не являются идентичными между биологической реплицирует, которые имеют мало интереса для скрининга. Например мы обнаружили в общей сложности 660 геномных изменений во всех трех хромосом между двумя elf1Δ P и пять различных штаммов S (Рисунок 3). Мы не наблюдали часто идентичны мутаций между виртуализированного биологического реплицирует каждого штамма, предполагая, что новые мутации могут возникать во время культивирования клеток elf1Δ до строительства геномная библиотека или случайные ошибки могут быть представил во время строительства библиотеки и последовательности. Следовательно изолируя мутации, которые согласуются через биологические реплицирует является важным аспектом в успешной идентификации супрессоров, используя всего генома.
Мы определили и подтвердил два перенапряжения в регионах компакт-диски в пяти виртуализированного S штаммов. Хотя в S-A1 и S-A2 штаммы были обнаружены мутации в SPBPJ4664.02 , маловероятно, что SPBPJ4664.02 является допустимым супрессор, потому что S-A1 и S-A2 не содержит супрессорной на же ген, как они не дополняют друг друга ( данные не показаны). Мы также не подтвердить rli1 в S-A3, который сделал не совместного разделения с фенотипом S при backcrossed с elf1Δ. Кроме того мы нашли специфических мутаций в регионах-кодирования в S-A1, S-A2 и S-А3. Вполне возможно, что эти измененные некодирующих геномной регионов облегчить elf1Δ фенотип, который будет рассматриваться в наших будущих исследований. По сравнению с традиционными методами например пробирного связь, которая может занять годы для сопоставления генетической мутации, мы определили два перенапряжения в течение двух месяцев после подтверждения, что Моногенные элемент вызвал S фенотип. С быстрым развитием технологии всего генома мы настроены оптимистично, что этот метод будет более эффективным для определения последовательного генетические мутации в обозримом будущем.
Таким образом этот протокол предоставляет пошаговые инструкции для успешного выявления мутации подавитель для любого гена интереса с дефектом медленно растущих в жидком культуры. Простота этот assay позволяет для крупномасштабных показ нескольких генетический фон интерес с мало практической подготовки. Есть комната для дальнейшей автоматизации процесса с помощью робота жидкого обработки для выполнения ежедневных разведениях. Так как лаборатория манипуляция микроорганизмов неизбежно требует роста культур в жидкой среде, процесс, который по своей сути селективный для фитнеса, мы предлагаем, что этот протокол может широко применяется для других организмов модель большого населения, таких как бактерии и другие виды дрожжей.
Раскрытие информации
Авторы заявляют не утвержденных производителей инструментов, используемых в этот метод, а не конкурирующих финансовых интересов.
Благодарности
Эта работа была поддержана, Национальный институт Генеральной медицинских наук, гранты 1R15GM119105-01 для К.Ж Мы благодарим всех рецензентов для проницательные комментарии. Мы также благодарим Джеймса Такер, Алисия Андерсон, Элизабет Black и Глен Маррс для обсуждения и комментариев на этой рукописи.
Материалы
| Name | Company | Catalog Number | Comments |
| Adenine, Powder | Acros Organics | 147441000 | Use at 75 mg/L to make liquid and solid rich media (YEA) |
| Bacteriology Petri Dish | Corning, Falcon | C351029 | 100 ×15 mm, use to grow strains to single colonies on solid rich media |
| D-Glucose Anhydrous, Powder | Fisher Chemical | D16-1 | Use at 30 g/L to make liquid and solid rich media (YEA) |
| Difco Agar, Granuated | Becton, Dickinson and Co. | 214530 | Use at 20 g/L to make solid rich media (YEA) |
| DNA extraction buffer | 2% Triton X-100, 1% SDS, 100 mM NaCl, 10 mM Tris-Cl (pH 8.0), 1mM Na2-EDTA | ||
| Focused-ultrasonicator | Covaris Inc. | S220 | Alternatively, use QSonica Q800R sonicator/DNA and chromatin shearing system |
| Gen5 Data Collection and Analysis Software | Biotek, Inc. | GEN5SECURE | Or equivalent, must be compatible with the micro-plate reader, use to export data readings from the micro-plate reader |
| Hydrochloric Acid 1N, Liquid | Fisher Chemical | SA48-4 | Use to adjust pH to 5.5 in liquid and solid rich media |
| Liquid Rich Media (liquid YEA) | 30 g/L D-Glucose, 5 g/L Yeast Extract, 75 mg/L Adenine, pH adjusted to 5.5 with 1 M HCl | ||
| Microplate Reader, Synergy H1 Hybrid Multi-Mode Reader | Biotek, Inc. | BTH1MG | Or equivalent, must read visible light at 600 nm wavelength range |
| Rich Media agar plates (YEA plates) | 30 g/L D-Glucose, 5 g/L Yeast Extract, 75 mg/L Adenine, 20 g/L Agar, pH adjusted to 5.5 with 1 M HCl. | ||
| RNase A/T1 mix | Thermo Fisher Scientific | EN0551 | Use according to manufacturer recommendation |
| Sterile Polystyrene Inoculating Loop | Corning, Inc. | OS101 | Or equivalent, use to transfer colonies from agar plates to 96-well plate |
| Sterile workspace and burners | |||
| Tissue Culture Plate, 96-well Optical Flat Bottom with Low Evaporation Lid | Corning, Falcon | C353072 | Or equivalent, must have optical flat bottom for micro-plate ready |
| TruSeq DNA PCR-Free LT/HT Library Prep Kit | Illumina, Inc. | 20015962 | Use to prepare the whole-genome sequencing library |
| Yeast Extract, Powder | Fisher Chemical | BP1422-500 | Use at 5 g/L to make liquid and solid rich media (YEA) |
Ссылки
- McKay, J. K., Latta, R. G. Adaptive population divergence: Markers, QTL and traits. Trends in Ecology and Evolution. 17 (6), 285-291 (2002).
- Wood, V., Harris, M. A., et al. PomBase: A comprehensive online resource for fission yeast. Nucleic Acids Research. 40 (D1), (2012).
- de Visser, J. A. G. M., Cooper, T. F., Elena, S. F. The causes of epistasis. Proceedings of the Royal Society B: Biological Sciences. 278 (1725), 3617-3624 (2011).
- Sailer, Z. R., Harms, M. J. Detecting high-order epistasis in nonlinear genotype-phenotype maps. Genetics. 205 (3), 107911088(2017).
- Kuzmin, E., Costanzo, M., Andrews, B., Boone, C. Synthetic genetic arrays: Automation of yeast genetics. Cold Spring Harbor Protocols. 2016 (4), 326-332 (2016).
- Tong, A. H. Y., Boone, C. Synthetic genetic array analysis in Saccharomyces cerevisiae. Methods in Molecular Biology. 313 (1), 171-192 (2006).
- Dixon, S. J., Costanzo, M., Baryshnikova, A., Andrews, B., Boone, C. Systematic Mapping of Genetic Interaction Networks. Annual Review of Genetics. 43 (1), 601-625 (2009).
- Boone, C., Bussey, H., Andrews, B. J. Exploring genetic interactions and networks with yeast. Nature Reviews Genetics. 8 (6), 437-449 (2007).
- Bai, X., Yang, Z., Jiang, H., Lin, S., Zon, L. I. Genetic suppressor screens in haploids. Methods in Cell Biology. , 129-136 (2011).
- Manson, M. D. Allele-specific suppression as a tool to study protein-protein interactions in bacteria. Methods. 20 (1), 18-34 (2000).
- Motter, A. E., Gulbahce, N., Almaas, E., Barabási, A. L. Predicting synthetic rescues in metabolic networks. Molecular Systems Biology. 4, 168(2008).
- Peterson, R. T., Shaw, S. Y., et al. Chemical suppression of a genetic mutation in a zebrafish model of aortic coarctation. Nature Biotechnology. 22 (5), 595-599 (2004).
- Giorgini, F., Guidetti, P., Nguyen, Q., Bennett, S. C., Muchowski, P. J. A genomic screen in yeast implicates kynurenine 3-monooxygenase as a therapeutic target for Huntington disease. Nature Genetics. 37 (5), 526-531 (2005).
- Forsburg, S. L., Patton, E., et al. The art and design of genetic screens. Nature reviews. Genetics. 2 (9), 659-668 (2001).
- Johnston, D. S. The art and design of genetic screens. Genetics. 3 (March), 176-188 (2002).
- Jorgensen, E. M., Mango, S. E. The art and design of genetic screens: Caenorhabditis elegans. Nature Reviews Genetics. 3 (5), 356-369 (2002).
- Gocke, E., Müller, L. In vivo studies in the mouse to define a threshold for the genotoxicity of EMS and ENU. Mutation Research - Genetic Toxicology and Environmental Mutagenesis. 678 (2), 101-107 (2009).
- Suzuki, T., Hayashi, M., et al. A comparison of the genotoxicity of ethylnitrosourea and ethyl methanesulfonate in lacZ transgenic mice (Muta(TM)Mouse). Mutation Research - Genetic Toxicology and Environmental Mutagenesis. 395 (1), 75-82 (1997).
- Uttam, J., Alberico, C., De Stasio, E. ENU Mutagenesis. International C. elegans Meeting. , (1995).
- Putrament, A., Baranowska, H., Ejchart, A., Prazmo, W. Manganese Mutagenesis in Yeast. Methods in Cell Biology. 20, 25-34 (1978).
- Bose, J. L. Chemical and UV mutagenesis. Methods in Molecular Biology. 1373, 111-115 (2016).
- Ikehata, H., Ono, T. The Mechanisms of UV Mutagenesis. Journal of Radiation Research. 52 (2), 115-125 (2011).
- Shrivastav, N., Li, D., Essigmann, J. M. Chemical biology of mutagenesis and DNA repair: cellular responses to DNA alkylation. Carcinogenesis. 31 (1), 59-70 (2010).
- De Stasio, E. A., Dorman, S. Optimization of ENU mutagenesis of Caenorhabditis elegans. Mutation Research - Genetic Toxicology and Environmental Mutagenesis. 495 (1-2), 81-88 (2001).
- Probst, F. J., Justice, M. J. Mouse mutagenesis with the chemical supermutagen ENU. Methods in Enzymology. 477 (C), 297-312 (2010).
- Bähler, J., Wu, J. Q., et al. Heterologous modules for efficient and versatile PCR-based gene targeting in Schizosaccharomyces pombe. Yeast. 14 (10), 943-951 (1998).
- Li, H., Durbin, R. Fast and accurate short read alignment with Burrows – Wheeler transform. Bioinformatics. 25 (14), 1754-1760 (2009).
- Van der Auwera, G. A., Carneiro, M. O., et al. From fastQ data to high-confidence variant calls: The genome analysis toolkit best practices pipeline. Current Protocols in Bioinformatics. 43, 11.10.1-11.10.33 (2013).
- Mckenna, A., Hanna, M., et al. The Genome Analysis Toolkit: A MapReduce framework for analyzing next-generation DNA sequencing data. Genome Research. 20, 1297-1303 (2010).
- Li, H., Handsaker, B., et al. The Sequence Alignment/Map format and SAMtools. Bioinformatics. 25 (16), 2078-2079 (2009).
- Marayati, B. F., Drayton, A. L., et al. Loss of Elongation-Like Factor 1 Spontaneously Induces Diverse, RNase H-Related Suppressor Mutations in Schizosaccharomyces pombe. Genetics. 209 (4), 967-981 (2018).
- Harris, M. A., Lock, A., Bähler, J., Oliver, S. G., Wood, V. FYPO: The fission yeast phenotype ontology. Bioinformatics. 29 (13), 1671-1678 (2013).
- Xu, X., Wang, L., Yanagida, M. Whole-Genome Sequencing of Suppressor DNA Mixtures Identifies Pathways That Compensate for Chromosome Segregation Defects in Schizosaccharomyces pombe. G3: Genes|Genomes|Genetics. 8 (3), 1031-1038 (2018).
- Marayati, B. F., Hoskins, V., et al. The fission yeast MTREC and EJC orthologs ensure the maturation of meiotic transcripts during meiosis. RNA. 22 (9), 1349-1359 (2016).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены