Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Метод подготовки образцов сканирующего и трансмиссионного электронного микроскопа для придатков woodboring Beetle
В этой статье
Резюме
Для наблюдения за ультраструктурой сенсильи насекомых в исследовании были представлены протокол подготовки образцов сканирующего и трансмиссионной электронной микроскопии (SEM и TEM, соответственно). Tween 20 был добавлен в фиксатор, чтобы избежать деформации образца в SEM. Флуоресценция микроскопия была полезна для повышения точности нарезки в TEM.
Аннотация
В этом докладе описаны методы подготовки образцов, которые сканируют и передают электронный микроскоп наблюдений, продемонстрировали путем подготовки придатков древесного жука, Chlorophorus caragana Xie и Wang (2012), для обоих типов электронной микроскопии. Протокол подготовки сканирующего электронной микроскопии (SEM) был основан на химической фиксации образцов, обезвоживании в серии этаноловых ванн, сушке и распылении покрытия. Добавляя Tween 20 (Polyoxyethylene sorbitan laurate) в фиксатор и раствор для мытья, поверхность тела насекомого древесного жука промывают более чисто в SEM. Препарат образца электронной микроскопии передачи этого исследования (TEM) включал в себя ряд шагов, включая фиксацию, обезвоживание этанола, встраивание в мелину, позиционирование с помощью флуоресцентной микроскопии, секционирование и окрашивание. Фиксациациация с Tween 20 включена проникнуть в стену тела насекомых древесного жука легче, чем это было бы без Tween 20, и впоследствии лучше фиксированной ткани и органы в организме, таким образом, дали четкую передачу электронного микроскопа наблюдения насекомых sensilla ультраструктур. Следующим шагом этого препарата было определение положения сенсиллы насекомых в образце, встроенном в блок есинов с помощью флуоресценционной микроскопии для повышения точности позиционирования сенсилки цели. Это улучшило точность нарезки.
Введение
Сканирование электронной микроскопии является важным инструментом во многих исследованиях морфологии, что SEM показывает поверхностные структуры1,2. Привлекательность электронной микроскопии передачи является то, что она может быть использована для изучения широкого спектра биологических структур в нанометровом масштабе, от архитектуры клеток и ультраструктуры органелл до структуры макромолекулярных комплексов и белков. TEM показывает внутренние структуры3,4,5.
Колеоптера является самой большой группой насекомых, в том числе около 182 семейств и 350 000 видов. Большинство кооптеранских насекомых, в частности жуков- древесных пород, питаются растениями, многие из которых являются важными вредителями лесов и фруктовых деревьев, нанося разрушительный ущерб деревьям6. В настоящее время все большее внимание уделяется профилактикеи борьбе с популяцией вредителей на основе теории химической экологии. Эффективные, низкотоксичные, без загрязнения методы борьбы с феромонами стали эффективным способом8. Изучение сенсиллы морфологии и ультраструктуры насекомых является важной частью исследований в области химической экологии насекомых. Сканирующая и трансмиссионная электронная микроскопия (SEM и TEM, соответственно) используется для изучения их морфологии и внутренней анатомии. Однако при подготовке образцов насекомых к электронной микроскопии (ЭМ) на объективность и подлинность места наблюдения может повлиять9. В целом, SEM подготовки образцов насекомых требует очистки, фиксации тканей, обезвоживание, метатез, сушка, и распыление покрытие10. Из-за сложной среды, в которой живут древесные жуки, поверхность тела часто имеет различные загрязняющие вещества и их придатки часто имеют много штрафа долго сенсиллы или щетины. В частности, некоторые древесные бороды не доступны из лабораторных повышения, которые собираются непосредственно в поле, а затем положить в фиксирующую жидкость для обеспечения свежести и впоследствии мыть в лаборатории. Если образец сначала фиксируется, а затем промывается, очевидно, что гораздо труднее удалить мусор, потому что глютаральдегид сильно фиксирует его в образец. Tween 20 является сурфактант11,12,13,14, который играет важную роль в процессе стирки, в том числе снижение поверхностного натяжения воды и улучшения влажности воды на поверхности прачечной. В этом исследовании, Tween 20 был добавлен в решение фиксации и PBS очистки решение для уменьшения поверхностного натяжения жидкости, и предотвратить грязь от отложений на поверхности тела древесного жука, который сделал поверхность тела чище в SEM.
Используя TEM, сенсилла на различных органах насекомых может быть нарезана, чтобы выявить четкие структуры внутри них, тем самым обеспечивая основу для анализа функций сенсиллы. Когда субъект насекомого, таких как древесный жук, большой, и его стенка тела имеет значительную степень склеротизации, так что фиксатор не может полностью насытить ткани органа внутри тела насекомого. Tween 20 может повысить дисперсию и способность подвески грязи. В этом исследовании, Tween 20 был добавлен в фиксатор для повышения фиксации проникновения жидкости в стену тела насекомых древесного жука, избегая деформации и коллапса эпидермии11,12,13. Кроме того, используя технологию общей нарезки, трудно точно найти различные типы сенсиллы, в частности для некоторых небольших sensilla15. На основе традиционной подготовки образца TEM, это исследование объединило флуоресценцию микроскопии и SEM, чтобы определить положение насекомых сенсиллы во встроенном блоке, тем самым повышая точность нарезки.
протокол
ВНИМАНИЕ: Проконсультируйтесь с листами данных о безопасности материалов реагентов перед их использованием. Некоторые из химических веществ, используемых при подготовке образцов, являются токсичными, мутагенными, канцерогенными и/или репротоксическими. Используйте индивидуальное защитное оборудование (перчатки, лабораторное пальто, брюки в полный рост и обувь с закрытыми ностями) и работайте под капотом дыма при обращении с образцом.
1. SEM Подготовка образцов и визуализации
- Исправление и очистка образцов
- Работая в районе, где C. caragana происходят, привлечь взрослых в полевые ловушки заманили с растительными аттракторами, таких как изофорон16. Сохранить чистые тела взрослого C. caragana в 0,1 мол Л-1 фосфат-буферный солен (PBS, рН 7.2), 2,5% (wt/vol) глутаральдегид (Anhydrous EM Grad), и 0,06% (vol/vol) Tween 20. Исправить образец на 4 кв. C в выходные дни.
- Удалите тела из консервной жидкости и промыть в фосфатном буфере. Используя стереомикроскоп, удалите придатки и очистите их ультрасонически (40 кГц) в 0,1 мол L-1 фосфат-буферный солен (pH 7.2) с 0.06% (vol/vol) Tween 20 (PBST). После очистки на 100 с, передать образец в микроскоп, чтобы проверить, если он был чистым. При нормальных обстоятельствах, чистый для 400s, чтобы убедиться, что образец был достаточно чистым, чтобы наблюдать и не повреждены.
- Образец обезвоживания, монтажа и сушки
- Обезвоживать образцы, используя 20 мин последовательных методов лечения в 50%, 60%, 70%, 80%, 85%, 90%, 95%, 100%, и 100% (все vol/vol) этанола. Под стереомикроскопом используйте углеродную двустороннюю клеевую ленту, чтобы отдельно зафиксировать 3 поверхности наблюдения (дорсальный вентральный и боковой) на заглушки. Обратите внимание, что все смотровые поверхности должны быть чистыми и свободными от загрязнения. Поместите образец этапе в чашку Петри, содержащий кремнезема гель desiccant для 48 ч.
- Распыление пальто и вставка образца
- Используя ионный инструмент для распыления Hitachi Koki (E-1010), поверните MAIN VALVE в положение OPEN, снимите крышку камеры образца и положите образец в камеру. Включите POWER, и READY свет был включен. Установите время распыления в 45 секунд, а толщина покрытия как 70.875. Как только механический индекс вакуумного циферблата насоса упал ниже 7, нажмите РАЗРЯДить и начать распыление платины. В конце эксперимента выключите блок питания и вытащайте образец из камеры. Спрей толщина пленки: d q KIVt ("d" является толщиной пленки в блоке "Я "; " K" является константой, в зависимости от распыленного металла и газа. Например, K воздуха 0,07; "Я" - это единица мА плазменного потока; "V" - это напряжение, применяемое в блоке "КВ". "t" - это время в секундах.
- Вставьте заглушку, содержащую образец, на сцену SEM. Убедитесь, что этап образца с образцом заглушки имел достаточную высоту, чтобы обеспечить хорошее изображение. Откройте программное обеспечение SEM и выберите желаемое рабочее напряжение, начиная с 20 кВ.
2. TEM Подготовка образцов и визуализации
- Получить и исправить образец как в шагах 1.1.1 и 1.1.2.
- Очистка, вторичная фиксация и обезвоживание
- Удалить взрослых C. caragana из консервации жидкости. Используя стереомикроскоп, удалите придатки, вымойте образцы в PBST в течение 3 ч, а затем пост-исправить их в 1% (Wt/vol) тетроксид осмия в PBS для 1h при 25 градусах Цельсия. Обезвоживать образцы, используя 20 мин последовательных процедур в 50%, 60%, 70%, 80%, 85%, 90%, 95%, 100%, и 100% (все vol/vol) этанола при комнатной температуре.
- Встраивание и полимеризация осилина
- Встраивай образцы в мелиссовую форму. Образец находился в нижней части пластины и был помещен как можно ближе к краю утопленного паза. Поместите этикетку в пустоту, затем инкубировать пластину, содержащую образец на 60 градусов по Цельсию в течение 72 ч. Удалить капсулу из инкубатора и убедиться, что мизер была полимеризованной.
- Примеры секции и окрашивания
- После того, как убедитесь, что образец был затвердев, поместите каждый блок мисинки под флуоресцентным микроскопом и сфотографируйте их под синим светом. Переместите флуоресцентный источник света микроскопа, чтобы он облучил образец сверху. Включите сенсиллу в блоке мисы, чтобы быть четко соблюдены. Фотографируется и измеряет расстояния для целевой sensilla (Рисунок 1).
- Ссылайтесь на SEM изображение palps(Рисунок 2A), и вырезать примерно блок мелины с лезвием бритвы, чтобы закрыть целевой рецептор (Рисунок 2B).
- Далее, используя сине-свет флуоресценции микроскопии, сфотографировать грубо сократить блок мисы, регулировка источника света сверху так, что сенсилла была отмечена четко. Зеленый свет, возбужденный синим светом, создал благоприятное наблюдение. При визуализации объективный микрометр (DIV 0.01 мм) был добавлен к стадии флуоресценционного микроскопа, а затем расстояние цели было измерено программным обеспечением ImageJ (Национальный институт здравоохранения США)(рисунок 2C). Правитель изображения был сделан Adobe Photoshop CS5 (Adobe Systems, Inc., Сан-Хосе, Калифорния, США). Затем, для нарезки ультрамикротома, установите расстояние резки, используя толщину ломтиков 50-60 нм, пока не будет достигнуто целевое положение. Используйте флуоресцентную микроскопию, чтобы определить целевой рецептор.
- Смонтировать участки на Formvar покрытием, 100-сетки медных сеток, дважды окрашенные с уранил ацетат и свинца цитрат.
- Во-первых, добавьте 3,75 г ацетата уранила до 50 мл 50% метанола. Пятно сетки с фильтрованным (0,45 мкм) шприц насыщенного раствора уранила ацетата при комнатной температуре в течение 10 мин. Обложка разделов во время окрашивания, чтобы блокировать свет индуцированных осадков. Промыть 2x в 50% метанола; 2x фильтрованная дегазированная вода.
- Во-вторых, добавьте 0,02 г свинцового цитрата до 10 мл дегазированной дистиллированной воды в центрифужную трубку. Добавить 0,1 мл 10 N гидроксида натрия, печать и встряхнуть, чтобы растворить. Пятно сетки с раствором свинца цитрат для 8 мин. Центрифуга перед использованием. Окрашивание должно быть сделано в среде, свободной от двуокиси углерода, чтобы предотвратить образование свинцового карбоната осадок. Место капли пятна на квадраты пластиковых посуды Петри. Промыть в дегазированной фильтрованной воде и высушить17. Наблюдать за ними через TEM, работающий при 80 кВ.
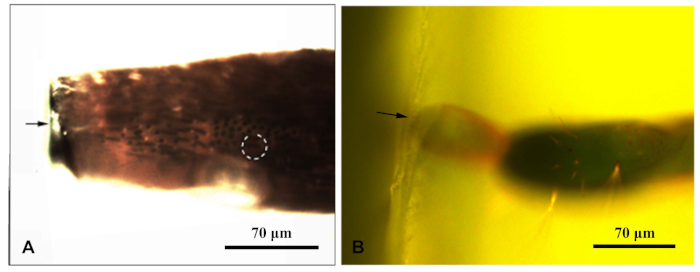
Рисунок 1: флуоресцентный микроскоп сфотографировал блок смолы, охватывающий придаток караганы хлорофора. (A) Блок венки антенны; (B) Блок ресины в конце ovipositor. Стрелка указала край блока мисы; пунктирный круг указывает на цель sensilla. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
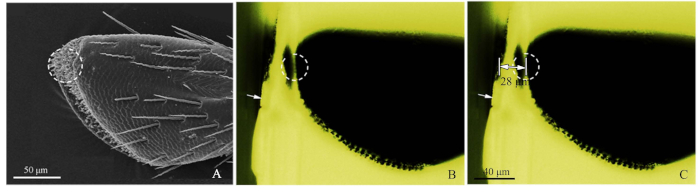
Рисунок 2: Процедуры точного метода определения местоположения сенсиллы. ()4-й подсегмент челюстно-лицевой пальп Chlorophorus caragana, пунктирный круг показал сенсиллу мишенью SEM. (B) 4-й подсегмент верхнечелюстного пальп C. caragana рассматривается флуоресценции микроскопии. Белая стрелка показала примерно вырезанный край блока с госленой, а пунктирный круг показал точное местоположение. (C) Заметное расстояние от края блока восспых до верхнечелюстного пальп целевого местоположения (28 мкм в этом образце). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Результаты
Использование очистки и фиксаторного решения с Tween 20, чище SEM изображение наблюдалось, чем без Tween 20(Рисунок 3). Прим. 20 крепячий раствор проник в глютаральдегид, фиксируя раствор в ткани. Микротрубная структура была хорошо видна. TEM изображение внутренней...
Обсуждение
В этой статье мы представили схему подготовки образцов для сканирования и передачи электронной микроскопии для древесного жука. Используя придаток насекомых в качестве репрезентативного предмета исследования, мы продемонстрировали несколько улучшений по сравнению с традиционными ?...
Раскрытие информации
У нас нет конфликта интересов, чтобы раскрыть.
Благодарности
Мы высоко ценим щедрую помощь Пекинского профессионального колледжа сельского хозяйства, Института применения атомной энергии (Китайская академия сельскохозяйственных наук), Биоисследовательского центра Пекинского лесного университета и профессора Шань-гана Чжан из Института зоологии Китайской академии наук. Это исследование было поддержано Национальной программой исследований и разработок Китая (2017YFD0600103), Национальным фондом естественных наук Китая (Грант No 315706443, 81774015), Лесными научными исследованиями в области общественного благосостояния Китая (201504304), Внутренней Монголии Сельскохозяйственный университет высокого уровня таланта научно-исследовательский план стартапа (203206038), и Внутренняя Монголия автономного региона высшего образования научно-исследовательский проект (NJ '18047), Внутренняя Монголия автономного района Linxue "Двойной первого класса" Строительный проект (170001).
Материалы
| Name | Company | Catalog Number | Comments |
| Anatomical lens | Chongqing Auto Optical limited liability company | 1425277 | |
| Carbon adhesive tape | SPI Supplies, Division of Structure Probes, Inc. | 7311 | |
| Carbon tetrachloride | Sigma | 56-23-5 | |
| Copper grids | GilderGrids | G300 | |
| Disodium hydrogen phosphate | Sinopharm group chemical reagent co., LTD | 10039-32-4 | |
| Ethanol | J.T. Baker | 64-17-5 | |
| Flat embedding molds | Hyde Venture (Beijing) Biotechnology Co., Ltd. | 70900 | |
| Fluorescence microscope | LEICA | DM2500 | |
| Glutaraldehyde | Sigma-Aldrich | 111-30-8 | Anhydrous EM Grade |
| Isophorone | Sigma | 78-59-1 | |
| Lead citrate | Sigma | 512-26-5 | |
| Methanol | Sigma | 67-56-1 | |
| Monobasic sodium phosphate | Its group chemical reagent co., LTD | 7558-80-7 | |
| Objective micrometer | Olympus | 0-001-034 | |
| Osmium tetroxide | Sigma | 541-09-3 | |
| Petri dish | Aldrich | 1998 | |
| Razor blade | Gillette | ||
| Resin | Spurr | ERL4221 | |
| Scalpel | Lianhui | GB/T19001-2008 | |
| SEM | Hitachi | S-3400 | |
| Silica gel desiccant | Suzhou Longhui Desiccant Co., Ltd. | 112926-00-8 | |
| Small brush | Martol | G1220 | |
| Sodium hydroxide | Sigma | 1310-73-2 | |
| Sputter ion instrument | Hitachi Koki Co. Ltd., Tokyo, Japan | E-1010 | |
| Stereo microscope | Leica | EZ4 HD | |
| TEM | Hitachi | H-7500 | |
| Tween 20 | Tianjin Damao Chemical Reagent | 9005-64-5 | |
| Ultramicrotome | Leica | UC6 | |
| Ultrasonic cleaner | GT Sonic | GT-X1 | |
| Uranyl acetate | Sigma | 6159-44-0 |
Ссылки
- Song, Y. Q., Dong, J. F., Sun, H. Z. Scanning Electron Microscope Technology of Insect Material. Hubei Agricultural Sciences. 52, 1064-1065 (2013).
- Liu, C. The development of the scanning electron microscopy (sem) and its application in polymer materials research. Journal of the Graduates Sun Yat-Sen University (Natural Sciences Medicine). 34, 7-12 (2008).
- Gan, L., Jensen, G. J. Electron tomography of cells. Quarterly Reviews of Biophysics. 45, 27-56 (2011).
- Lucic, V., Rigort, A., Baumeister, W. Cryo-electron tomography: the challenge of doing structural biology in situ. The Journal of Cell Biology. 202, 407-419 (2013).
- Trepout, S., Bastin, P., Marco, S. Preparation and Observation of Thick Biological Samples by Scanning Transmission Electron Tomography. Journal of Visualized Experiments. (121), e55215 (2017).
- Zhang, X. J., Sun, W., Zhang, J., Zuo, T. T., Wang, Z. Q., Zhao, H. W. Research progress of coleopteran insect species antennal sensilla. Journal of Anhui Agricultural Sciences. 41, 2932-2935 (2013).
- Aldrich, J. R., Bartelt, R. J., Dickens, J. C., Knight, A. L., Light, D. M., Tumlinson, J. H. Insect chemical ecology research in the United States Department of Agriculture-Agricultural Research Service. Pest Management Science. 59, 777-787 (2003).
- Thomas, C. B., Marlin, E. R. Pheromone mating disruption: Novel, non-toxic control of the European corn borer. Leopold Center. 8, 57-60 (1999).
- Chen, X. F., Hu, M. Y. Studies on the specimen preparation techniques of scanning electron microscope of Ficus simplicissima Lour. Journal of Zhongkai Agrotechnical College. 14, 68-70 (2001).
- Zhou, W., Apkarian, R., Wang, Z. L., Joy, D. Fundamentals of Scanning Electron Microscopy (SEM). Scanning Microscopy for Nanotechnology. , 1-40 (2006).
- Kothekar, S. C., Ware, A. M., Waghmare, J. T., Momin, S. A. Comparative Analysis of the Properties of Tween-20, Tween-60, Tween-80, Arlacel-60, and Arlacel-80. Journal of Dispersion Science and Technology. 28, 477-484 (2007).
- Chai, J. L., Liu, N., Bai, T. T., Zhang, H. M., Liu, N. N., Wang, D. D. Compositions and Physicochemical Properties of Tween Type Surfactants-Based Microemulsions. Journal of Dispersion Science and Technology. 35, 441-447 (2014).
- Zhang, L. D., Zhao, L., Han, F., Xu, B. C. Performance and applications of surfactants (XV) Detergency of surfactants and its applications. China Surfactant Detergent and Cosmetics. 45, 132-137 (2015).
- Waghmare, P. R., Das, S., Mitra, S. K. Under-water superoleophobic glass: unexplored role of the surfactant-rich solvent. Scientific Reports. 3, 1-25 (2013).
- Zhang, Y. R., Ren, L. L., Luo, Y. Q. Microtomy of insect sensilla embedded in resin blocks for transmission electronic microscopy. Chinese Journal of Applied Entomology. 50, 1479-1483 (2013).
- Zong, S. X., Liu, X. H., Cao, C. J., Luo, Y. Q., Ren, L. L., Zhang, H. Development of semiochemical attractants for monitoring and controlling Chlorophorus caragana. Zeitschrift für Naturforschung. 68, 243-252 (2013).
- Sumner, M. J. Epoxy resins for light and transmission electron microscopy. Plant Microtechniques and Protocols. , 83-101 (2015).
- Schneider, D. Insect antennae. Annual Review of Entomology. 9, 103-122 (1964).
- Zacharuk, R. Antennae and sensilla. Comprehensive Insect Physiology, Biochemistry and Pharmacology. 6, 1-69 (1985).
- Zacharuk, R., Albert, P., Bellamy, F. Ultrastructure and function of digitiform sensilla on the labial palp of a larval elaterid (Coleoptera). Canadian Journal of Zoology. 55, 569-578 (1977).
- Shanbhag, S., Müller, B., Steinbrecht, R. Atlas of olfactory organs of Drosophila melanogaster: 1, Types, external organization, innervation and distribution of olfactory sensilla. International Journal of Insect Morphology and Embryology. 28, 377-397 (1999).
- Tarumingkeng, R. C., Coppel, H. C., Matsumura, F. Morphology and ultrastructure of the antennal chemoreceptors and mechanoreceptors of worker Coptotermes formosanus Shiraki. Cell Tissue Res. 173, 173-178 (1976).
- Zacharuk, R. Y. Ultrastructure and function of insect chemosensilla. Annual Review of Entomology. 25, 27-47 (1980).
- Li, Y. Z., Zhong, G. Q. Screening of detergents and floating carriers for treating potato golden nematode cysts to improve the original appearance of electron microscopy. Plant quarantine. 8, 72-75 (1994).
- Marzio, L. D., Marianecci, C., Petrone, M., Rinaldi, F., Carafa, M. Novel pH-sensitive non-ionic surfactant vesicles: comparison between tween 21 and tween 20. Colloids and Surfaces B: Biointerfaces. 82, 18-24 (2011).
- Ren, L. L., Wu, Y., Shi, J., Zhang, L., Luo, Y. Q. Antenna morphology and sensilla ultrastructure of Tetrigus lewisi Candèze (Coleoptera: Elateridae). Micron. 60, 29-38 (2014).
- Ren, L., Shi, J., Zhang, Y., Luo, Y. Antennal morphology and sensillar ultrastructure of Dastarcus helophoroides (Fairmaire) (Coleoptera: Bothrideridae). Micron. 43, 921-928 (2012).
- Teng, X. H., Liu, X. L., Xie, G. Y., Tang, Q. B., Li, W. Z., Zhao, X. C. Morphology and distribution of ovipositor sensilla of female Helicoverpa armigera (Lepidoptera: Noctuidae). The 11th Henan Plant Protection Society, the 10th Henan Insect Society, and the 5th Member Congress and Academic Symposium of Henan Plant Pathology Society. , 138-142 (2017).
- Yang, R., Zhang, L. N., Fan, J. W., Wang, J. L., Fang, K. F., Yu, T. Q., Wang, S. H., Du, Y. L. Insect specimens for scanning electron microscopy. Journal of Beijing University of Agriculture. 29, 33-36 (2014).
- Zhang, Y. R., Ren, L. L., Zhang, L., Wang, R., Yu, Y., Lu, P. F., Luo, Y. Q. Ultrastructure and distribution of sensilla on the maxillary and labial palps of Chlorophorus caragana (Coleoptera: Cerambycidae). Journal of Morphology. 279, 574-588 (2018).
- Harrison, J. D. G. Cleaning and preparing adult beetles (Coleoptera) for light and scanning electron microscopy. African Entomology. 20, 395-401 (2012).
- Xiao, Y., Liu, W., Wang, Y., Zuo, Y. X., Hu, R., Li, T. T., Cui, Z. B. Drying methods of biological sample preparation for scanning electron microscope. Research and Exploration Laboratory. 32, 46-53 (2013).
- Graef, M. D. . Introduction to Conventional Transmission Electron Microscopy. , 1 (2003).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены