Method Article
Извлечение aqueous Метаболитов из культовых клеток присоединения для метаболомического анализа капиллярной электрофорез-масс-спектрометрии
В этой статье
Резюме
Целью данной статьи является описание протокола для извлечения вакантных метаболитов из культивированных клеток адептов для метаболомического анализа, в частности, капиллярного электрофореза-масс-спектрометрии.
Аннотация
Метаболомический анализ является перспективным подходом омики не только понять конкретные метаболические регуляции в раковых клетках по сравнению с нормальными клетками, но и определить биомаркеры для раннего выявления рака на ранней стадии и прогнозирования ответных мер химиотерапии в онкологических больных. Подготовка единых образцов для метаболомического анализа является важнейшим вопросом, который еще предстоит решить. Здесь мы представляем простой и надежный протокол для извлечения вакантных метаболитов из культивированных клеток адептов для метаболомического анализа с использованием капиллярной электрофорезно-массовой спектрометрии (CE-MS). Aqueous метаболиты из культивируемых клеток анализируются путем культивирования и мытья клеток, лечения клеток метанолом, извлечения метаболитов, а также удаления белков и макромолекулсов с спиновыми столбцов для ce-MS анализа. Представитель результаты с использованием линий клеток рака легких, обработанных диамидом, окислительный реагент, иллюстрируют четко наблюдаемый метаболический сдвиг клеток под окислительным стрессом. Эта статья будет особенно ценной для студентов и исследователей, участвующих в исследованиях метаболомики, которые являются новыми для сбора метаболитов из клеточных линий для анализа CE-MS.
Введение
Отто Варбург отметил, что раковые клетки приобретают необычную способность принимать глюкозу и брожение его производить лактат в присутствии адекватного кислорода-явление, названное как эффект Варбурга или аэробного гликолиза1,2. Митохондриальные дефекты дыхания спекулируются как основа аэробного гликолиза в раковых клетках3. Действительно, эффект Варбурга является основой для визуализации опухоли флуородеоксиглюкозой (FDG)-позитронно-позитронно-эмиссионной томографии (ПЭТ), которая широко используется в клинической практике4,5. Высокий уровень аэробного гликолиза считается ключевой особенностью рака и недавно был принят в качестве одного из известных "признаков рака", как описано Д. Ханахан и Б. Вайнберг6. Соматические мутации в онкогенах и генах супрессоров опухолей, таких как HRAS/KRAS/NRAS, EGFR, BRAF, MYC, TP53, изоцитрат дегидрогеназы (IDH), и фумхарат гидратазы (FH ) были связаны с конкретными метаболическими изменениями в раковых клетках, как полагают, в результате эффекта Варбурга7.
Метаболомический анализ является перспективным подходом не только для понимания метаболической регуляции в раковых клетках, но и для выявления биомаркеров рака на ранних стадиях и прогнозирования ответных мер на химиотерапию. После обработки чувствительных или устойчивых раковых клеток с противораковыми соединениями, отслеживание их метаболических реакций облегчает идентификацию метаболических биомаркеров для прогнозирования эффективности специфических противораковых методов лечения у онкологических больных8 ,9,10,11. В этой статье, раковые клетки линии, полученные из аденокарциномы легких с egFR мутации, обработанной с диамидом, который вызывает окислительный стресс,были использованы в качестве моделей для метаболомического анализа. Преимуществом этого аналитического метода с использованием капиллярной электрофорезно-массовой спектрометрии (CE-MS) является его комплексное измерение заряженных метаболитов с массовым диапазоном м/з 50-100012,13. Целью данной статьи является предоставление новичкам подробного пошагового визуального протокола для подготовки водных метаболитов из культивированных раковых клеток и последующего метаболомического анализа, в частности CE-MS.
протокол
1. Культура клеток на 1 день
ПРИМЕЧАНИЕ ПРИМЕЧАНИЕ ПРИМЕЧАНИЕ ОДНОКРАТное для извлечения метаболита должно быть подготовлено из одного 100-мм блюда культуры тканей, которое умеренно, но не полностью священно (содержащее примерно 2-5 миллионов клеток). Рассчитайте количество блюд, необходимых для проведения асссеа, и подготовьте их соответствующим образом.
- Культура HCC827 и PC-9 клеток в 5% CO2 при 37 КС в RPMI-1640 среды дополнены 10% плода крупного рогатого скота сыворотки (FBS).
- Аспирируй средства культуры клетки от тарелок культуры 100 mm.
- Вымойте клетки на каждой тарелке с помощью 2 мл фосфатного буферного соленого раствора (PBS) без кальция и магния. Аккуратно раскачивать каждое блюдо так, чтобы раствор PBS полностью покрывал поверхность блюда.
- Аспирируй буфер для мытья из культурных блюд.
- Теплый раствор для трипсина-ЭДТА на 0,25% до 37 градусов по Цельсию и добавляйте 2 мл раствора трипсин-ЭДТА с серологической пипеткой 5 мл. Аккуратно раскачивать каждое блюдо так, чтобы трипсин полностью покрывал поверхность блюда.
- Инкубировать блюда культуры при 37 градусах по Цельсию в течение примерно 5 мин.
- Добавьте 4 мл предварительно разогретого среднего роста на блюдо. Resuspend клетки в среде, мягко pipetting несколько раз.
- Перенесите каждую подвеску ячейки в отдельную коническую трубку 15 мл и центрифугу на 800 г в течение 5 минут.
- Приостановите каждую клетку гранулы в 2 мл предварительно разогретых полной среды роста.
- Определите общее количество и процент жизнеспособность клеток с помощью автоматизированного счетчика клеток и 0,4% trypan blue solution.
- Смешайте 10 зл клеточной суспензии и 10 зл 0,4% пробивного синего раствора.
- Загрузите 10 зл и выпадок образца в камеру подсчета клеток, проскользнуть через капиллярное действие.
- Вставьте камеру слайд в автоматизированный счетчик ячейки. Передаваемый свет автоматически освещает и инструмент автоматически фокусируется на ячейке.
- Нажмите кнопку захвата, чтобы захватить изображение и отобразить результаты.
- При необходимости добавьте дополнительную среду роста, чтобы получить нужную концентрацию клеток.
- Семя примерно 1-2,5 миллиона клеток на 100 мм клеточной культуры блюдо.
ПРИМЕЧАНИЕ ПРИМЕЧАНИЕ ПРИМЕЧАНИЕ, концентрации метаболита, определенные анализом CE-MS, будут нормализованы на основе количества жизнеспособных клеток. Для подсчета клеток необходимо подготовить для каждой группы хотя бы одно дополнительное блюдо с семенами культуры. - Инкубировать культурные блюда в 5% CO2 при 37 градусах по Цельсию на 18 ч.
2. Подготовка реагентов
- Разбавить коммерческий внутренний стандартный раствор, включая L-метионин сульфон и d-camphor-10-сульфонической кислоты 1000 раз в ультрачистой воде.
ПРИМЕЧАНИЕ ПРИМЕЧАНИЕ Яхнуть, просто смешайте 50 qL внутреннего стандартного решения 1 и 45 мл ультрачистой воды в 50 мл объемной колбы, а затем довести раствор до 50 мл с ультрачистой водой. - Приготовьте раствор маннитол 0,05 г/мл в ультрачистой воде в качестве буфера для мытья.
ПРИМЕЧАНИЕ ПРИМЕЧАНИЕ, менее чем за 30 образцов, просто растворить 25 г маннитола в 500 мл ультрачистой воды. Приблизительно 15 мл буфера для мытья требуется на 100 мм культуры блюдо, так что подготовить достаточный объем мытья буфера в зависимости от количества образцов.
3. Предотмывка центробежных фильтров
- Пипетка 250 л ультрачистой воды в фильтровальную чашку каждого центробежного фильтра (см. таблицуматериалов).
ПРИМЕЧАНИЕ ПРИМЕЧАНИЕ ТРЕБУЕТся два единицы фильтра на образец. - Крышка фильтр единиц плотно и центрифуга на 9100 г при 4 КК в течение 5 мин.
- Проверьте объем каждого фильтрата, если значительный фильтрат накопился во время первого короткого вращения, блок фильтра может быть дефектным. В этом случае отбросьте блок фильтра и вместо этого используйте новый блок фильтра.
- Закройте крышки фильтра единиц плотно и центрифуга снова на 9100 г г при 4 c в течение 30 минут.
- Убедитесь, что ни в одной из фильтровных чашек не останется ультрачистой воды; удалить отфильтрованную ультрачистую воду в каждой трубке коллекции с помощью пипетки и отбросить.
ПРИМЕЧАНИЕ ПРИМЕЧАНИЕ ПРИМЕЧАНИЕ одноразовая попытка удалить остаточную воду в фильтровальной чашке с помощью пипетки, так как это может повредить фильтр. - Замените фильтрованные чашки в их коллекционные трубки.
ПРИМЕЧАНИЕ ПРИМЕЧАНИЕ ПРИМЕЧАНИЕ- Используйте центробежные фильтры в течение часа, так как фильтры могут быть повреждены при сушке.
4. Культура клетки на день 2
-
Вынизвините из инкубатора блюда из культуры калибра 100 мм.
ПРИМЕЧАНИЕ ПРИМЕЧАНИЕ, Рекомендуемая продолжительность культуры клеток составляет 18 ч. - Аспирируй среду клеточной культуры с каждой 100-мм культуры блюдо.
- Добавьте 10 мл среды клеточной культуры, которая включает в себя соответствующие концентрации соединений или препаратов к каждому блюду, заботясь, чтобы не нарушить клеточный слой.
ПРИМЕЧАНИЕ ПРИМЕЧАНИЕ- Для демонстрационных целей, мы добавили 10 юл диамида 250 мМ, растворенного в PBS (окончательная концентрация 250 мкм) в этом эксперименте. - Инкубировать культурные блюда при 37 градусах по Цельсию в течение 30 минут в присутствии диамида или PBS в качестве контроля.
- Аспирируй среду клеточной культуры с каждой 100-мм культуры блюдо.
- Вымойте клетки, аккуратно добавив 2 мл 5% маннитола раствор к краю каждого блюда, заботясь, чтобы не беспокоить клеточный слой, затем слегка наклонить блюдо.
ПРИМЕЧАНИЕ ПРИМЕЧАНИЕ, PBS или солен решение мешает CE-MS основе метаболомический анализ и отрицательно влияет на результаты измерений, и, таким образом, не должны использоваться в качестве буфера для мытья. - Аспирировать буфер мыть из каждой культуры блюдо, а затем мыть клетки снова, аккуратно добавив 10 мл мыть буфера на блюдо и слегка наклоняя блюдо.
- Полностью аспирируй буфер стирки от края каждого блюда культуры.
ПРИМЕЧАНИЕ ПРИМЕЧАНИЕ. Аспирировать как можно больше буфера мыть, как это возможно, обращая внимание, чтобы не аспирировать клетки. Остаточный маннитол может помешать анализу CE-MS; аспирация клеток уменьшит количество ячеек и, таким образом, станет источником ошибок в нормализации данных.
5. Извлечение метаболитов из культивированных клеток
- Добавьте 800 л из 99,7% метанола на блюдо из культуры. Аккуратно раскачивать каждое блюдо культуры взад и вперед, чтобы покрыть всю его поверхность. Оставьте посуду при комнатной температуре на 30 с.
- Медленно добавьте 550 л разбавленного внутреннего стандартного раствора на блюдо, погрузив кончик пипетки в метанол и аккуратно пополняя вверх и вниз несколько раз.
- Аккуратно раскачивать каждое блюдо культуры взад и вперед, чтобы покрыть всю его поверхность.
- Оставьте посуду при комнатной температуре на 30 с.
6. Ультрафильтрация клеточных экстрактов
- Перенесите извлеченный раствор из каждого блюда культуры в отдельную микроцентрифуговую трубку мощностью 1,5 мл.
- Центрифуга труб на 2300 й г при 4 кв КС в течение 5 мин.
- Перенесите 350 л каждого супернатанта в два центробежных фильтра на образец.
ПРИМЕЧАНИЕ ПРИМЕЧАНИЕ- Из каждого блюда культуры, в общей сложности 700 л извлеченного раствора передается в две фильтрованные трубки (350 л/трубка). - Centrifuge фильтровальных труб при 9100 г при 4 градусах по Цельсию в течение примерно 2 ч, пока в чашках фильтра не останется жидкости.
- Снимите фильтрованные чашки и плотно закройте крышки коллекторских трубок.
7. Испарение образцов
- Подготовка центробежного испарителя, как правило, она состоит из испарителя, холодной ловушки и вакуумного насоса.
- Поместите трубки коллекции в центробежный испаритель.
ПРИМЕЧАНИЕ ПРИМЕЧАНИЕ ПРИкрытие. - Испаряйте извлеченные образцы растворов в вакуумных условиях при комнатной температуре.
ПРИМЕЧАНИЕ ПРИМЕЧАНИЕ ПРИМЕЧАНИЕ, Типичные конфигурации для количества вращений и давления 1500 об/мин и 1000 Па, соответственно, и это обычно занимает около 3 ч, чтобы полностью испариться образцов. - Подтвердите, что ни в одной из коллекторских труб окнул не осталось жидкости, и плотно закройте крышки трубок.
- Храните трубки для сбора в ультра-низкой температуре (80 градусов по Цельсию) глубокой морозильной камере до метаболомического анализа.
8. Метаболомический анализ CE-MS
- Приостановите фильтрацию в 50 л ультрачистой воды непосредственно перед анализом CE-MS.
- Выполните анализ CE-MS методами, описанными ранее12,13 с использованием системы капиллярного электрофореза и системы масс-спектрометра во время полета, оснащенной изократическим насосом, адаптером CE-MS и распылителем CE-ESI-MS.
ПРИМЕЧАНИЕ ПРИМЕЧАНИЕ ПРИМЕЧАНИЕ, обе системы могут управляться программным обеспечением поставщиков системы и соединены срастоном капилляром кремнезема (50 мкм внутреннего диаметра и 80 см в длину).- Настроили приборы и пробные флаконы, подготовьте капилляр с капиллярной кассетой, пополните оболочки жидкостей и соответствующие буферы электрофорексиса в зависимости от режима анализа аниона или катуляции, а затем нанесите напряжение.
ПРИМЕЧАНИЕ ПРИМЕЧАНИЕ, Инструменты и аналитические условия подробно описаны в другом месте12,13. - Откройте программное обеспечение и подготовьте рабочий список, содержащий методы сбора данных и информацию о образцах.
- Запустите тестовый запуск и проверьте такие данные, как интенсивность сигнала и пиковая форма внутренних стандартов и пиковое разрешение других стандартных соединений.
- При необходимости доработать аналитические условия.
- Введите образец растворов при 50 мбар на 3 с и напряжение 30 кВ.
ПРИМЕЧАНИЕ ПРИМЕЧАНИЕ, CE-MS проводился либо в положительном, либо в отрицательном ионном режиме. Установите спектрометр для сканирования диапазона массы м/з 50-1000. Напряжение капилляров было установлено на уровне 4 кВ; скорость потока азотного газа (температура нагревателя 300 градусов по Цельсию). Для положительного режима, фрагментор, скиммер и OCT RFV напряжение было установлено на 75, 50 и 125 V, соответственно. Для отрицательного ионного режима, фрагментор, скиммер, и OCT RFV напряжение было установлено на 100, 50 и 200 В, соответственно.
- Настроили приборы и пробные флаконы, подготовьте капилляр с капиллярной кассетой, пополните оболочки жидкостей и соответствующие буферы электрофорексиса в зависимости от режима анализа аниона или катуляции, а затем нанесите напряжение.
- Анализ данных спектра.
- Извлекайте пики из масс-спектральных данных с помощью программного обеспечения автоматической интеграции для получения пиковой информации, включая м/з,пиковую зону и время миграции (MT).
ПРИМЕЧАНИЕ ПРИМЕЧАНИЕ ПРИМЕЧАНИЕ, Метод подробно описан в другом месте14. - Исключите пики сигнала, соответствующие изотопомерам, ионам аддука и другим ионам известных метаболитов.
- Аннотировать оставшиеся пики с информацией из базы метаболитов HMT в соответствии с значениями м/з и МТ.
- Нормализация областей аннотированных пиков до внутренних стандартных уровней и количества клеток на выборку.
- Оцените концентрацию каждого метаболита в культивированных клетках (пмол/106 клеток) с помощью стандартных кривых, подготовленных для каждого метаболита.
- Используйте количественные концентрации метаболита для последующего статистического анализа и биологических интерпретаций14.
- Извлекайте пики из масс-спектральных данных с помощью программного обеспечения автоматической интеграции для получения пиковой информации, включая м/з,пиковую зону и время миграции (MT).
Результаты
Поскольку концентрации метаболита в раковых клетках (pmol/106 клеток) нормализуются до количества жизнеспособных клеток, экспериментальные условия должны быть созданы с осторожностью, с тем чтобы свести к минимуму различия в количестве жизнеспособных клеток между условиями. Например, лечение диамидов было в относительно высокой концентрации (250 мкм), но в течение короткого времени, чтобы все клетки расти как можно более равномерно, тем самым выравнивая количество жизнеспособных клеток проанализированы. В этих экспериментальных условиях, HCC827 и PC-9 клетки выросли в равной степени на 3 ч(Рисунок 1). CE-MS анализ диамид-обработанных клеток по сравнению с PBS-обработанных (контрольных) клеток показали 175 и 150 дифференциальных метаболитов в HCC827 и PC-9 клеток, соответственно. Среди них, несколько промежуточных в пентоза фосфат пути (PPP) и в верхнем гликолизиза были значительно выше в диамид-обработанных условиях в обеих клеточных линий, в то время как несколько трикарбоксилевой кислоты (TCA) цикл промежуточных были ниже в обработанных условия(Рисунок 2 и Рисунок3).
PPP генерирует сокращение эквивалентов в виде уменьшенного никотинамида аденин динуклеотид фосфат (NADPH), который используется для содержания редокс гомеостаза и биосинтеза жирных кислот15. После лечения диамидом уровень глюкониновой кислоты – окисленной глюкозы – увеличился в 12 раз в клетках HCC827 и в 10 раз в клетках ПК-9; аналогичным образом, после лечения диамидом, уровень глюкозы 6-фосфат (G6P)-фосфорилированной глюкозы и первый гексокиназ-катализированный гликолиз продукт- также увеличилось в 6,3- и 3,5 раза в HCC827 и PC-9 клеток, соответственно(рисунок 4). Кроме того, после лечения диамидов, уровни 6-фосфоглуковата (6PG) - первый промежуточный в ППС-значительно увеличился в 89 раз в клетках HCC827 и 231-кратном в клетках PC-9 по сравнению с уровнями, наблюдаемыми в контроле PBS(рисунок 4). В отличие от этого, уровни других гликолитов промежуточных, таких как фруктоза 6-фосфат (F6P) и фруктоза 1,6-бисфосфат (F1,6P), не изменилась в диамид экспериментальное состояние(рисунок 4). Всего никотинамид аденин динуклеотид фосфат (NADP)уровни были почти эквивалентно между диамид лечения и PBS условий контроля (Рисунок4), предполагая, что глюкоза была в основном катаболизированы через ППС.
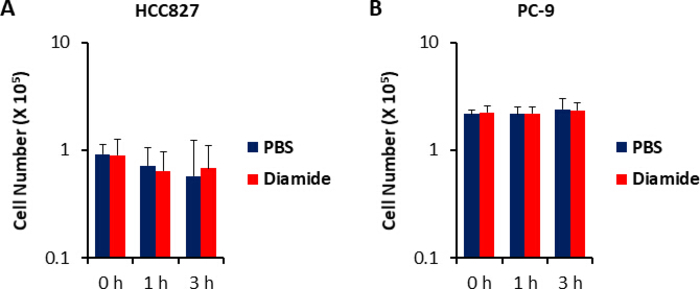
Рисунок 1. Неизменные номера клеток при лечении диамидом. Реакции роста клеток до 250 мкм диамида были измерены с помощью trypan синий окрашивания. Показаны номера клеток (A) HCC827 и (B) PC-9, обработанные PBS(синим)или диамидом (красный; 250 мкм) для 1 или 3 ч. Данные отображаются в виде среднего значения sD (n No 6). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
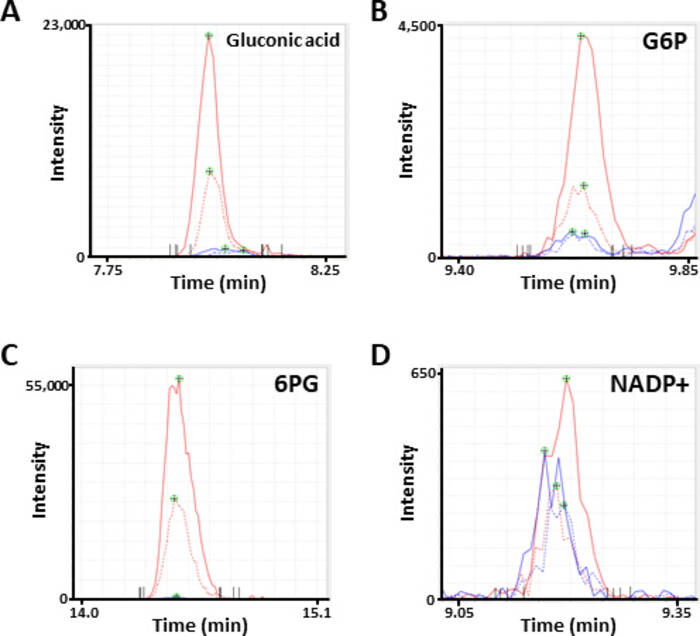
Рисунок 2. Представитель MS пики метаболитов. Электроферограммы аннотированы как (A) глюкониновая кислота, (B) глюкоза 6-фосфат (G6P), (C) 6-фосфоглуконат (6PG), и (D) никотинамид аденин динуклеотид фосфат (NADP)полученные CE-MS анализа. Каждая линия указывает на линию клеток (твердая, HCC827; пунктирная, PC-9) и лечение (синий, PBS; красный, диамид) используется. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
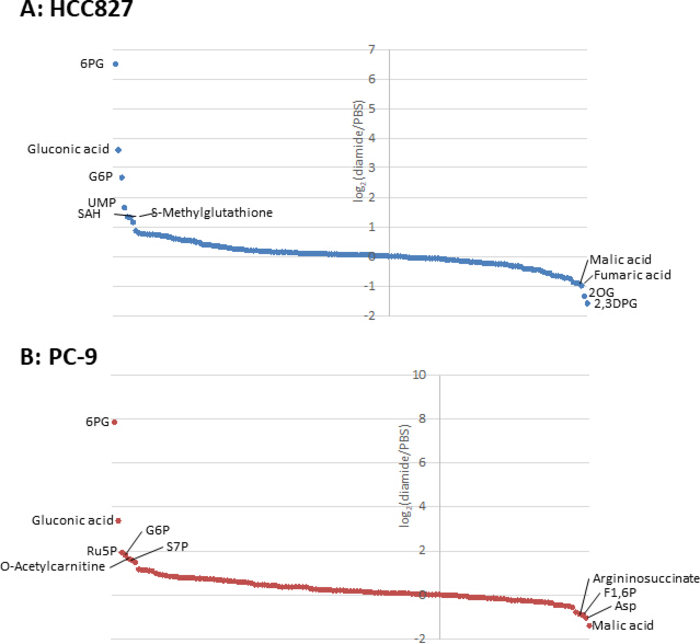
Рисунок 3. Метаболомовые профили внутриклеточных метаболитов. Сложите изменения метаболитов в (A) HCC827 и (B) КЛЕТКи PC-9 обработанные с диамидом показаны как журнал2(диамид/PBS). В общей сложности 175 и 150 метаболитов были аннотированы в клетках HCC827 и PC-9, соответственно. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
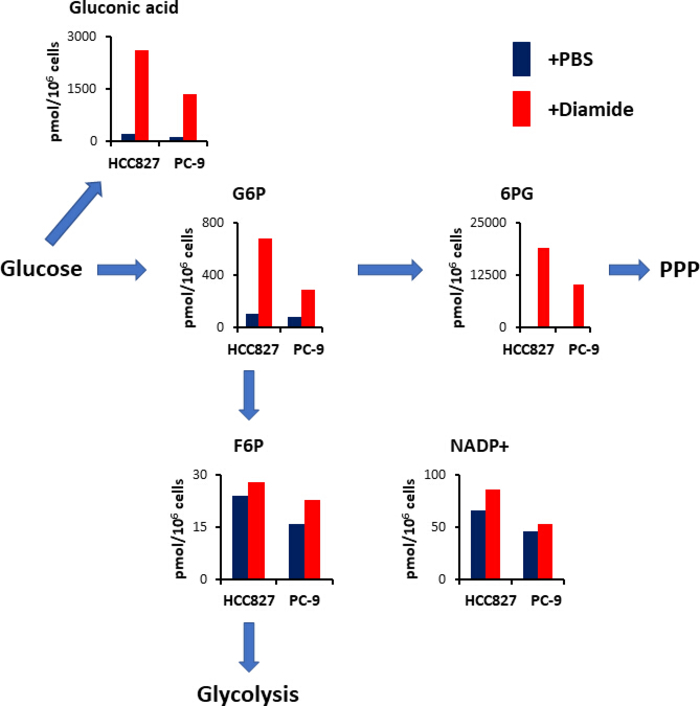
Рисунок 4. Up-регулирование ППС при лечении диамидом. Показаны внутриклеточные концентрации (пмол/106 клеток) ключевых метаболитов, участвующих в гликолизе и пентоза фосфатных путей(ППС) после лечения диамидом. Метаболиты были извлечены из HCC827 и PC-9 клеток, обработанных PBS(синий) или диамид(красный,250 мкм) в течение 30 мин. Представитель метаболитов, таких как глюкониновая кислота, глюкоза 6-фосфат (G6P) , фруктоза 6-фосфат (F6P), 6 -фосфоглуконат (6PG), и никотинамид аденин динуклеотид фосфат (NADP)) показаны. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Обсуждение
Здесь мы описываем широко доступную методологию подготовки метаболитов из культивированных раковых клеток для метаболомического анализа на основе CE-MS. Одной из наиболее важных моментов в этом протоколе является надлежащая подготовка раковых клеток, поскольку измеренные концентрации метаболитов нормализуются до количества жизнеспособных клеток. Для точной оценки количества клеток необходимо подготовить хотя бы одно дополнительное блюдо культуры на экспериментальную группу для подсчета количества жизнеспособных клеток параллельно с извлечением метаболитов для метаболомического анализа. Кроме того, одинаковое количество клеток должно быть посеяно в каждом блюде для репликации и в блюде для подсчета; в будущем этому будет способствовать быстрый и без стрессоров (например, без трипсина) протокол подсчета клеток, который позволяет использовать одно и то же блюдо как для подсчета жизнеспособных клеток, так и для извлечения метаболитов. Следует принимать меры во время стиха, чтобы клетки не отсоединялись от поверхности посуды. Тяжелые тесты цитотоксичности и другие эксперименты, которые уменьшают сливки клеток, могут быть непригодны для этого протокола экстракции из-за потенциальной потери клеток во время процедуры стирки.
Важно использовать 5% маннитол решение в качестве буфера для мытья для извлечения метаболитов из культивируемых клеток для CE-MS основе метаболомического анализа, потому что соли на основе буферов, таких как PBS, вмешиваться в метаболомический анализ и отрицательно влияют измерения.
Два или три блюда можно комбинировать в единую выборку путем индивидуального извлечения метаболитов из каждого блюда, а затем объединения образцов; однако, комбинирование нескольких блюд часто увеличивает остаточный маннитол в извлеченном растворе метаболита. Это также может помешать метаболомическому анализу CE-MS. Таким образом, рекомендуется не использовать несколько блюд или колодцев в качестве одного образца.
Этот метод метаболомического анализа с использованием CE-MS был разработан для всестороннего измерения заряженных молекул с молекулярными весами от 50 до 1000 Da; таким образом, этот протокол оптимизирован для извлечения вавных, низкомолекулярных соединений веса. Таким образом, этот протокол не подходит для извлечения гидрофобных метаболитов, таких как липиды или макромолекулы, такие как белки и нуклеиновые кислоты. Поскольку растет спрос на комплексный анализ липидов или липидоми культивированных образцов клеток, необходимо разработать простой и эффективный протокол одновременной извлечения как гидрофильных, так и гидрофобных метаболитов.
Первый шаг извлечения метаболита – аспирирующие средние и стиральные клетки с маннитолом – следует проводить как можно быстрее, чтобы свести к минимуму изменения метаболического профиля клеток. Лечение клеток метанолом после мытья маннитолом предполагается денатурировать белки и тем самым предотвратить ферменты от катализирующих дальнейшие метаболические реакции. Однако, даже после обработки метанола, неэнзиматические химические реакции, такие как реакции редокса, некоторые процессы декарбоксиляции, и тиол связи-может иметь место. Таким образом, любые концентрации метаболитов, участвующих в этих реакциях, измеренных этим протоколом, следует интерпретировать с осторожностью. В отличие от генома или транскриптома, метаболом состоит из молекул с широким спектром химических свойств; следовательно, ни один протокол не может извлечь все метаболиты без каких-либо потерь или нарушений. Для более точных измерений таких высокореактивных метаболитов следует проконсультироваться с протоколом, специально предназначенным для извлечения определенных групп метаболитов, что требует фракционирования и произвлечения. Протокол, представленный здесь, однако, описывает простой и быстрый извлечение ваковых метаболитов из культивированных образцов клеток для метаболомического анализа CE-MS. В этой статье мы не могли подробно описать, как настроить CE-MS, потому что фокус настоящей рукописи отличается, однако, описывая подробные шаги по настройке CE-MS может потребовать отдельной выделенной статьи.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Мы благодарим всех членов Shonai региональный центр продвижения промышленности за их помощь. Эта работа была частично поддержана научно-исследовательскими фондами из префектуры Ямагата и города Цуруока, Национальным фондом исследований и развития онкологического центра «Грант номер 28-А-9» и Японским обществом содействия науке (JSPS) KAKENHI (грантномер 17K07189 " до HM.
Материалы
| Name | Company | Catalog Number | Comments |
| Automated cell counter | Thermo Scientific | AMQAX1000 | Countess II automated cell counter |
| Automatic integration software | Agilent Technologies | MassHunter G3335-60041 | version B.02.00 |
| CE system | Agilent Technologies | Agilent 7100 CE system | |
| CE/MS adapter kit | Agilent Technologies | G1603A | |
| CE-ESI-MS Sprayer kit | Agilent Technologies | G1607A | |
| Cell counting chamber slide | Thermo Scientific | C10282 | Countess cell counting chamber slides |
| Centrifugal filter device, 5 kDa | Human Metabolome Technologies | ULTRAFREE MC PLHCC, UFC3LCCNB-HMT | |
| Conical sterile polypropylene tube, 15 ml | Thermo Scientific | N339651 | |
| Conical sterile polypropylene tube, 50 ml | Thermo Scientific | N339653 | |
| Costar stripette, 10 ml | Corning | 4488 | |
| Costar stripette, 5 ml | Corning | 4487 | |
| D(-)-Mannitol | Wako | 133-00845 | 500 g |
| Dulbecco's phosphate buffered saline (DPBS) | Sigma-Aldrich | D8537-500ML | |
| Electrophoresis buffer | Human Metabolome Technologies | H3301-1001 | for cation analysis |
| Electrophoresis buffer | Human Metabolome Technologies | H3302-1021 | for anion analysis |
| Fetal bovine serum | Biowest | S1780 | |
| Filter tip, 1000 μl | Watson | 124P-1000S | |
| Filter tip, 20 μl | Watson | 124P-20S | |
| Filter tip, 200 μl | Watson | 1252-703CS | |
| Fused silica capillary | Polymicro Technologies | TSP050375 | 50 μm i.d. × 80 cm total length |
| HCC827 | American Type Culture Collection | CRL-2868 | |
| Internal standard solution | Human Metabolome Technologies | H3304-1002 | |
| Isocratic pump | Agilent Technologies | Agilent 1100 Series Isocratic Pump | |
| Methanol | Wako | 138-14521 | 1 L, LC/MS grade |
| Microtube, 1.5 ml | Watson | 131-415C | |
| Operating Software | Agilent Technologies | ChemStation G2201AA | version B.03.01 for CE |
| PC-9 | RIKEN Bio Resource Center | RCB4455 | |
| RPMI-1640 | Sigma-Aldrich | R8758-500ML | |
| Sterile tissue culture dish, 100 mm | Corning | 430167 | |
| Time-of-flight mass spectrometer | Agilent Technologies | Agilent G1969A Time-of-Flight LC/MS | |
| Trypan blue solution, 0.4% | Thermo Scientific | T10282 | |
| Trypsin-EDTA solution | Sigma-Aldrich | T4049-100ML | |
| Ultrapure water | Merck | Milli-Q water | 18.2 MΩ·cm pure water |
| Volumetric flask, 50 ml | Iwaki | 5640FK50E | TE-32 |
Ссылки
- Lunt, S. Y., Vander Heiden, M. G. Aerobic glycolysis: meeting the metabolic requirements of cell proliferation. Annual Review Cell and Developmental Biology. 27, 441-464 (2011).
- Soga, T. Cancer metabolism: key players in metabolic reprogramming. Cancer Science. 104 (3), 275-281 (2013).
- Zong, W. X., Rabinowitz, J. D., White, E. Mitochondria and Cancer. Molecular Cell. 61 (5), 667-676 (2016).
- Fukuda, H., et al. Experimental study for cancer diagnosis with positron-labeled fluorinated glucose analogs: [18F]-2-fluoro-2-deoxy-D-mannose: a new tracer for cancer detection. European Journal of Nuclear Meddicine and Molecular Imaging. 7 (7), 294-297 (1982).
- Miles, K. A., Williams, R. E. Warburg revisited: imaging tumour blood flow and metabolism. Cancer Imaging. 8, 81-86 (2008).
- Hanahan, D., Weinberg, R. A. Hallmarks of cancer: the next generation. Cell. 144 (5), 646-674 (2011).
- Levine, A. J., Puzio-Kuter, A. M. The control of the metabolic switch in cancers by oncogenes and tumor suppressor genes. Science. 330 (6009), 1340-1344 (2010).
- Makinoshima, H., et al. Epidermal growth factor receptor (EGFR) signaling regulates global metabolic pathways in EGFR-mutated lung adenocarcinoma. The Journal of Biological Chemistry. 289 (30), 20813-20823 (2014).
- Makinoshima, H., et al. Signaling through the Phosphatidylinositol 3-Kinase (PI3K)/Mammalian Target of Rapamycin (mTOR) Axis Is Responsible for Aerobic Glycolysis mediated by Glucose Transporter in Epidermal Growth Factor Receptor (EGFR)-mutated Lung Adenocarcinoma. The Journal of Biological Chemistry. 290 (28), 17495-17504 (2015).
- Makinoshima, H., et al. Metabolic Determinants of Sensitivity to Phosphatidylinositol 3-Kinase Pathway Inhibitor in Small-Cell Lung Carcinoma. Cancer Research. 78 (9), 2179-2190 (2018).
- Sato, Y., et al. Metabolic Characterization of Antifolate Responsiveness and Non-responsiveness in Malignant Pleural Mesothelioma Cells. Frontiers in Pharmacology. 9, 1129 (2018).
- Ohashi, Y., et al. Depiction of metabolome changes in histidine-starved Escherichia coli by CE-TOFMS. Molecular BioSystems. 4 (2), 135-147 (2008).
- Ooga, T., et al. Metabolomic anatomy of an animal model revealing homeostatic imbalances in dyslipidaemia. Molecular BioSystems. 7 (4), 1217-1223 (2011).
- Sugimoto, M., Wong, D. T., Hirayama, A., Soga, T., Tomita, M. Capillary electrophoresis mass spectrometry-based saliva metabolomics identified oral, breast and pancreatic cancer-specific profiles. Metabolomics. 6 (1), 78-95 (2010).
- Patra, K. C., Hay, N. The pentose phosphate pathway and cancer. Trends in Biochemical Sciences. 39 (8), 347-354 (2014).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены