Method Article
Трансплантация хемогенетически инженерии Кортикальный интернерерон прародителей в начале послеродовой мозг мыши
В этой статье
Резюме
Здесь мы представляем протокол, предназначенный для использования хемогенетических инструментов для манипулирования активностью корковых интернереронных прародителей, пересаженных в кору ранних послеродовых мышей.
Аннотация
Развитие нейронов регулируется сложным сочетанием экологических и генетических факторов. Оценка относительного вклада каждого компонента является сложной задачей, что особенно трудно в том, что касается развития аманиномасляной кислоты (ГАМК) эргических интернейронов (КИ). CIs являются основными ингибирующими нейронами в коре головного мозга, и они играют ключевую роль в нейронных сетях, регулируя как активность отдельных пирамидальных нейронов, а также колеблющееся поведение нейронных ансамблей. Они генерируются в переходных эмбриональных структурах (медианных и каудальных ганглионных вывешней - MGE и CGE), которые очень трудно эффективно ориентировать с использованием в подходах к электропорации матки. Интернероновые прародители мигрируют на большие расстояния во время нормального эмбрионального развития, прежде чем они интегрируются в корковую цепь. Эта замечательная способность рассеиваться и интегрироваться в развивающуюся сеть может быть захвачена путем пересадки эмбриональных прекурсоров интернеровва в ранние послеродовые кортики хозяина. Здесь мы представляем протокол, который позволяет генетическую модификацию эмбриональных интернеровосных прародителей с помощью фокусной электропорации ex vivo. Эти инженерные предшественники интернеровона затем пересаживаются в ранние послеродовые кортики хозяина, где они созреют в легко идентифицируемые CIs. Этот протокол позволяет использовать несколько генетически закодированных инструментов, или способность регулировать экспрессию конкретных генов у поротелей интернереутона, для того, чтобы исследовать влияние генетических или экологических переменных на созревание и интеграции CIs.
Введение
Функция нейронных сетей зависит от наличия сбалансированного дополнения возбуждающих проекционных нейронов и ингибирующих интернейронов. Хотя корковые интернейроны (CIs) составляют только 20% всех нейронов в кортики млекопитающих, дефицит их числа или функции, как полагают, играют ключевую роль в патогенеза нейроразвития расстройств1,2. Изучение развития CI является сложной задачей, поскольку CIs генерируются в переходных эмбриональных структурах, которые труднодоступны, и они следуют за длительной тангенциальной миграцией, прежде чем они достигнут паллия и развивают свои зрелые анатомические и физиологические свойства3. Как генетические, так и экологические механизмы известны, которые регулируют развитие CI4, но оказалось трудно изучить относительный вклад нескольких факторов.
Много идей в развитии CI были получены с помощью систем культуры in vitro после изоляции прародителей от ганглионных вывесок5,6. Одним из больших преимуществ этих методов является возможность маркировать и генетически модифицировать изолированных прародителей и детально следить за их дифференциацией, чтобы обнаружить изменения, автономные клетки. Однако эти методы не могут предоставить информацию о взаимодействии между развивающимися интернейронами и активной сетью. Мы адаптировали эти протоколы, путем трансплантации модифицированных прекурсоров в раннюю послеродовую кору. Интернероновые прародители, изолированные от эмбриональных ганглионных возвышенностей, способны выжить, разогнаться и интегрироваться в сеть хозяина при трансплантации в кору7,8. Этот метод был использован для уменьшения тяжести эпилептических припадков в генетических моделях мыши, и был предложен в качестве возможной новой терапии для различных нейроразвития расстройств9,10. Предыдущий протокол описывает процедуру, чтобы преобразовать эти прекурсоры с вирусными переносчиками до трансплантации11. Протокол, который мы описываем здесь, также допускает генетическую модификацию интернейронов, но не требует создания вирусного вектора, требующего только плазмидной ДНК, что значительно повышает ее гибкость. Некоторые исследования сообщили об успехе в использовании в утробе электропорации генетически модифицировать интернерон прародителей в caudal ганглионных вывешнов (CGE)12, но этот метод оказался очень трудно размножаться.
В разделе репрезентативных результатов, мы иллюстрируем использование этого метода, чтобы выразить дизайнер рецепторов исключительно активируется дизайнер наркотиков (DREADDs13) в пересаженных CIs, метод, который мы использовали в недавней публикации14. Мы выразили hM3D (Gq), инженерии рецептора на основе человеческого холинергического рецептора CHRM3, который не влияет на функцию нейронов, если он связывает его конкретные лиганд ызапин-N-оксид (CNO). Администрация CNO выборочно запускает активацию hM3D (Gq), выражающих клетки. Мы использовали этот метод, чтобы показать, что точечная автономная и преходящая деполяризация достаточна для предотвращения апоптоза CIs во время разработки14. В сочетании с различными генетически закодированными инструментами, этот протокол имеет потенциал для вверх или вниз-регулировать экспрессию генов, и визуализировать или манипулировать активностью клеток на различных стадиях дифференциации интернеров.
протокол
В соответствии с Законом Соединенного Королевства о животных (научные процедуры) (1986 год) животные были выведены и размещены в соответствии с Законом Соединенного Королевства о животных (научные процедуры).
ПРИМЕЧАНИЕ: Для генерации конструкции pCAGGs-hM3D (Gq)-IRES-RFP фрагмент SalI-StuI, содержащий последовательность hM3D (Gq), был выделен из плазмида 50463 (Addgene) и вставлен в вектор выражения pCAGGs-RFP (подарок от F. Guillemot) XhoI-EcoRV.
1. Подготовка мышь эмбриона кортикальные фрагменты
- Стерилизовать лабораторное оборудование (например, стерео микроскопы) и поверхности (например, скамейки) с соответствующим моющим средством и 70% раствора этанола (EtOH) в воде (H2O).
- Используйте инструменты вскрытия, которые были autoclaved и держать их все время в 100% EtOH.
- Приготовьте три аликоты по 20 мл с 4% низкой гелеобразующей температурой агарозы в 1x фосфатном буферном растворе (PBS), в трубках 50 мл, и держите их при температуре 55 градусов по Цельсию.
- Пожертвование беременных мышей путем вывиха шейки матки на 13,5 или 14,5 дней беременности (эмбриональный день E13.5-E14.5).
- С парой ножниц вскрытия, открыть живот беременных мышей, удалить рога матки (с эмбрионами) и поместить их в ледяной кребс решение (Таблица 1), в 90 мм Петри блюдо.
- С парой прямых студентов штрафа щипцы, открыть амниотические мешки, удалить эмбрионы и передать их в свежий ледяной Кребс раствор, в новом 90 мм Петри блюдо. Вскрыть мозг эмбриона мыши (предмозг, средний мозг, задний мозг) от остальной части тела эмбриона.
- Держа расчлененные мозги из заднего мозга, перенесите их в ледяной раствор Кребса в новой 90-мм чашке Петри, и держите их на льду.
- С водонепроницаемой ручкой нарисуйте прямую линию на внешней поверхности, в середине нижней части из шести 35 мм посуды Петри.
- Поместите один 4% низкогелящий агароз/PBS 20 мл аликот на 37 градусов по Цельсию в течение 5 мин. Сразу же после этого бедные 10 мл в двух 35 мм Петри блюда и вставлять расчлененные мозги.
ПРИМЕЧАНИЕ: Обонятельные луковицы должны лицом вниз (внизу чашки Петри). Вставлять 3-4 мозга на чашку Петри, выравнивать их по ранее нарисованной прямой линии. Оставьте пространство размером 3,5 мм между каждыми двумя мозгами. - Повторите шаги 1.8 и 1.9 до тех пор, пока все расчлененные мозги не будут встроены.
- Поместите встроенные мозги при 4 градусах Цельсия, чтобы агароза затвердела, а затем вырезать три мозга в один блок соответствующего размера и ориентации.
ПРИМЕЧАНИЕ: Оставьте примерно 3 мм по краям образцов мозга. Измените ориентацию мозга, с обонятельными луковицами на верхней части. - Клей блок на поверхности базы микротомов и с помощью хирургического лезвия вырезать весь путь через дно блока, между каждым и двумя мозгами, для того, чтобы создать 3 независимых блоков (каждый мини-блок, содержащий один мозг).
- Раздел и блоки, в ледяном растворе Кребса, на 250 мкм толщиной ломтиков, используя вибрирующий микротом лезвия.
- С изгибом плоский конец микро-шпатула собирать только ломтики, содержащие медиаль или каудальной ганглиятической выдавливания (MGE или CGE; Рисунок 1) и индивидуально переносите их на фильтровальные мембраны (диаметр 13 мкм, размер пор ы 8,0 мкм), плавающие на минимальной необходимой среде (MEM, Таблица 1) в полистирола центр-хорошо орган культуры блюда (60 мм х 15 мм).
- Поместите блюда в инкубатор культуры культуры CO 2, при 37 градусах По Цельсию, на 1 ч, и приготовьте для фокусного электропорирования.
2. Острый мозг фрагмент электропорации
- Перед началом процедуры электропорации приготовьте 50 мл 1% агарозного геля в 100 мм чашке Петри. Оставьте гель агарозы затвердеть при комнатной температуре (RT) в течение примерно 30 мин.
- Приготовьте крошечные агарозные колонны (1 мм в диаметре и 10 мм в длину), пронизывали стеклянным пипеткой (длина 225 мм; емкость 2 мл) и переносите их в ледяные решения Кребса.
ПРИМЕЧАНИЕ: К пипетке крепится резиновая капельница, подходящая для 2 мл пипетки, и при нажатии на нее колонна может быть выпущена из стеклянной пипетки к раствору Кребса. - С помощью хирургического лезвия вырежьте небольшие агарозные блоки двух размеров: небольшой, который будет укладываться на поверхности электрода (см. ниже) и более крупный, который будет использоваться в качестве основы для выполнения фокусных инъекций ДНК в ломтики мозга. Перенесите блоки агарозы в ледяной раствор Кребс, а также.
- Подготовьте настройку для фокусных инъекций и острой электропорации(рисунок2).
ПРИМЕЧАНИЕ: Для инъекций необходимо следующее оборудование: 1) яркое поле рассечение стерео-микроскопа, 2) пневматический инжектор пико-насоса, 3) микроманипулятор, 4) магнитная подстилка, и 5) стальная базовая пластина. Для электропорации острого среза необходимо следующее оборудование: 1) 1 квадратная платина 10 мм петри блюдо электрод, 2) один квадратный платиновый 10 мм крышка электрода, 3) микроманипулятор, и 4) электропоратор. -
Фокусные инъекции ДНК
- Подготовьте ДНК-смесь векторов экспрессии: pCAGGs-IRES-GFP (контрольный вектор) - pCAGGs-hM3D (Gq)-IRES-RFP, в концентрации 1 мкг/л для каждого вектора и добавьте быстрый зеленый раствор (запас 25 мг/мл) в 1/10 разбавления.
- Заполните вытянутый стеклянный микропипет (0,5 мм внутреннего диаметра и 1 мм внешнего диаметра) с 10 зл и l смеси ДНК и вводить небольшие количества (на 25-50 nL диапазона) в выбранной области (MGE / CGE) ломтика(Рисунок 1 и Рисунок 2).
-
Острая электропорация
ПРИМЕЧАНИЕ: Электропорация должна быть выполнена сразу после фокусной инъекции ДНК.- Поместите небольшой блок агарозы на электроде чашки Петри и прикрепите колонку агарозы к мобильному электроду крышки с помощью плоского микро-шпатулы.
- Перенесите срез с его поддерживающей мембраной на блок агарозы и поместите верхний электрод с столбцом агарозы поверх выбранной области (MGE/CGE) среза.
ПРИМЕЧАНИЕ: Зарядка напряжения 125 V (два импульса по 5 мс каждый, интервал 500 мс) даст успешную электропорацию(рисунок 3).
- После электропорации поместите ломтик с его поддерживающей мембраной в блюдо и перенесите блюдо в инкубатор культуры культуры CO2 при 37 градусах Цельсия.
- После 1 ч, обмен MEM среды для базовой среды подходит для первичных нейронных культур (нейрон основной среде; Таблица 1) и инкубировать ломтики на ночь, примерно 18-24 ч.
3. Подготовка клеточных трансплантатов
- Проверьте эффективность электропорации во всех ломтиках. Выберите только ломтики, где наблюдается приемлемое количество флуоресцентных клеток(рисунок3).
ПРИМЕЧАНИЕ: Электропорат примерно 30 ломтиков/за эксперимент для того, чтобы приобрести соответствующее количество клеток для прививки (см. ниже). - Рассекать выбранную область (MGE/CGE) с каждого ломтика и разрезать ткань на мелкие кусочки в ледяном растворе Кребса, под флуоресцентным рассеиванием стерео-микроскопа.
- Между тем, поместите трубку 1,5 мл с 900 мл нейронов основной среде в водяной бане при 37 градусов по Цельсию.
- Перенесите кусочки ткани с микропипеттером P1000 в трубку 1,5 мл, содержащую 500 л средней l15/DNase, приготовленную путем добавления 100 кЛ 1 мг/мЛ DNase в DMEM/F12 среды в 900 л среды L15. Вымойте части ткани, нажав.
- Добавьте 100 кЛ DNase (запас 1 мг/мл в среде DMEM/F12) в базовую среду нейронов 900 л.
- Откажитесь от среды L15/DNase и переприостановите части ткани в 200 nn l basic/DNase среды, подготовленной в шаге 3.5.
- Установите микропипеттор P200 до 180 л и механически разъединяйте части ткани, плавно подняв и очем вниз, 20-30 раз, пока не будет получена гладкая и «сливочная» подвеска.
- Добавьте 200 зЛ нейронов базового/DNase среднего (окончательный общий объем 400 qL) и resuspend.
- Возьмите 4 qL аликот клеток, разбавить надлежащим образом и установить на гемоцитометр.
- Под ярким полевым микроскопом проверьте эффективность диссоциации и подсчитайте количество клеток.
ПРИМЕЧАНИЕ: Если диссоциация успешна, будут наблюдаться яркие (живые) одиночные клетки, а не клеточные агрегаты. - Суспензия центрифуг и свыше 3,8, при 1000 об/мин, на РТ, в течение 5 мин, а затем, удалить супернатант из трубки и добавить соответствующие L15/DNase среды (обычно 5-7 Л), так что окончательная концентрация клеток будет 8 х 105-1,2 х 106 клетки/Л.
ПРИМЕЧАНИЕ: Во время повторной приостановки, это чрезвычайно важно, чтобы избежать пузырьков воздуха. - Поместите аликот клетки на лед и дополнительные L15/DNase среды для инъекций.
4. Внутричерепные инъекции
ПРИМЕЧАНИЕ: Следующие процедуры проводятся в процедурном зале в комплексе Animal House. Так как клетки будут введены непосредственно в мозг новорожденных щенков, не подвергая мозга, асептические условия сохраняются путем стерилизации рабочего пространства с 70% EtOH раствор и с помощью автоклавированных стеклянных игл. Для внутричерепных инъекций требуется следующее оборудование: 1) яркое полерастительное рассечение стерео-микроскопа, 2) микро-инжектор и 3) грелка для восстановления мыши.
- Подготовка стеклянной иглы, потянув иглы в соответствии с рекомендациями производителя. Стеклянные иглы с 80 мкм внешнего диаметра, 40 мкм внутреннего диаметра, и 30 "скобы используются в этом протоколе.
ПРИМЕЧАНИЕ: Как уже упоминалось выше, иглы должны быть autoclaved перед использованием. - Заполните вручную иглу с биологически инертным маслом с помощью 30 G, 2-дюймовой иглы и шприца.
- Соберите и вставьте иглу в блок инжектора в соответствии с инструкциями производителя.
- Определите параметры впрыска при максимальном объеме (69 нл) и относительно медленной скорости (23 нл/с).
- Опустошите иглу до тех пор, пока поршень не будет полностью расширен.
-
Заполните иглу.
- Вырежьте небольшой кусочек из прививной ленты и поместите ее под яркое поле вскрытия стерео-микроскопа. С помощью микропипетты P10 перенесите 5 qL из образца (клеточного аликота) на ленту, так что образуется сферическая капля.
- Поместите кончик иглы в образец и заполните иглу (плунжер втягивается и рисует образец с ним).
ПРИМЕЧАНИЕ: Так как образец должен быть довольно вязким, заполните иглу небольшими шагами, чтобы образец уравновешизм, и с медленными темпами, что предотвращает образование пузырьков. Образец должен быть гладким и однородным внутри иглы. Если образец слишком вязкий и не представляется возможным заполнить иглу, добавьте столько L15/DNase среды, как это требуется для получения правильной вязкости. Тем не менее, это изменит концентрацию образца, и в идеале следует избегать.
- Анестезия новорожденных щенков (послеродовой день 0-2 «P0-P2») на льду в течение 2-5 мин.
ПРИМЕЧАНИЕ: Убедитесь, что щенка не движется. - Поместите обезопподданного щенка под ярким полем вскрытия стерео-микроскопа.
- Выполните 3-4 инъекции по 69 нл каждый в каждом полушарии.
ПРИМЕЧАНИЕ: Участки для инъекций расположены примерно на 1 мм боковой к средней линии, и между 1 мм каудал до брегмы и 1 мм ростральной к межрегиональной линии. Кончик иглы должен быть помещен примерно на 1 мм глубоко к поверхности пиала. После каждой инъекции, игла остается на месте в течение примерно 30 с и сняты в периоды. - Сразу же после инъекций поместите щенка на грелку с нагревом в самом низком месте (37 градусов по Цельсию). Когда щенок восстанавливается передать его в клетку с матерью.
ПРИМЕЧАНИЕ: Никогда не оставляйте мать без щенков в клетке. Вся процедура (от удаления щенка из его littermates, пока он не будет возвращен) должна длиться менее 10 минут.
5. Инъекции клозапин-Н-оксида
- Приготовьте лиганд DREADD, скусиный раствор CNO, разбавив 1 мг CNO в 50 л диметилсульксида (DMSO) до тех пор, пока раствор не будет полупрозрачным. Пополнить до 10 мл сольным раствором, так что конечная концентрация CNO составляет 0,1 мг/мл.
ПРИМЕЧАНИЕ: ДМСО токсичен. Избегайте использования его с концентрацией выше 0,1%. Используйте в качестве элемента контроля соленом, содержащий ту же концентрацию DMSO, что и cNO, содержащий раствор. - С постнатального дня 14 и в течение 3 constitutively дней (P14-P16), в каждой мыши выполнять две интраперитонеальные (I.P.) инъекции CNO (концентрация CNO: 1 мг/кг) или 0,05% DMSO в сольников, в день, 12 ч друг от друга.
- В последний день (P17), выполнить одну инъекцию и жертвовать мышей шейки матки дислокации в течение времени окно 30 мин-1 ч.
Результаты
Используя представленную здесь процедуру, мы проверили, регулируется ли выживаемость корковых интернейронов на ранних послеродовых стадиях активностью в клеточной автономной манере. Мы провели 3 эксперименты по электропорации семков мозга (12-16 эмбрионов (E14.5 эмбрионов) за эксперимент) с pCAGGs-IRES-GFP (контроль) и pCAGGs-hM3D (Gq)-IRES-RFP-физторы выражения, при концентрации 1 мкг/мл для каждой конструкции. В наших экспериментах по электропорации, только часть (приблизительно 50%; Рисунок 3) из GFP- нейронов, совместно выраженных hM3D (Gq) (RFP)и, следовательно, GFPиRFP- население служило внутренним контролем за эффектом лигандов DREADD. Трансинфицированные корычные эмбриональные интернейроны были механически разобщены, а полученная клеточная подвеска (8 х 105 клеток/Л) привиталась в коре мышей дикого типа P0-P1. Мы провели 6 инъекций на мозг. В каждом эксперименте вводилось как минимум 6 новорожденных щенков. Администрация CNO выборочно увеличила активность транс-инфицированных клеток RFP, о чем свидетельствует экспрессия зависимого от активности белка cFos (рисунок4). Лечение CNO в соответствии с описанным протоколом (администрирование дважды в день P14-P17) привело к увеличению доли GFPиRFPпо отношению к GFPиRFP- клеткам, по сравнению с транспортным средством (0,5% DMSO в сольном) вводимых littermates(Рисунок 5).
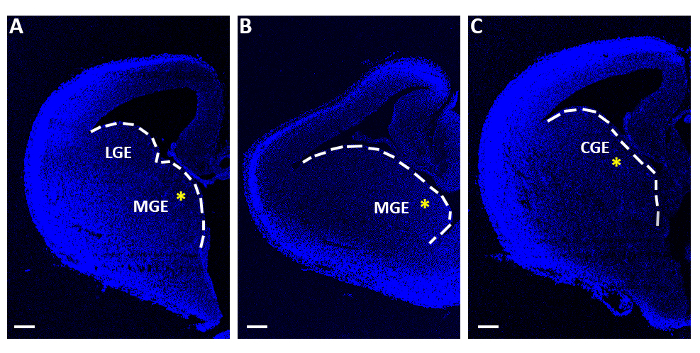
Рисунок 1: Репрезенцефалические ломтики, используемые для острых экспериментов электропорации. (A-C) Теленцефалические ломтики, полученные на трех различных последовательных ростро-каудадальных уровнях, окрашенных 4 ",6-диамидино-2-фенилинол (DAPI). LGE: боковое ганглионическое превосходство; MGE: медиальное ганглионическое превосходство; CGE: каудальный ганглионный выдавчивость. Шкала баров 200 мкм. Желтые звездочки указывают на место электропорации в каждом ломтике. Белая линия знаменует край ганглионного выдавства. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
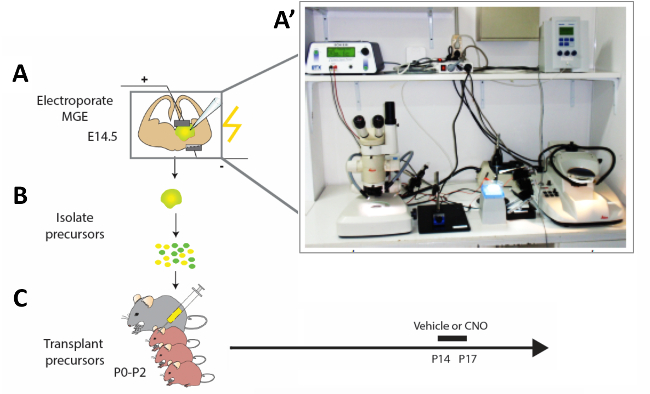
Рисунок 2: Схематическое представление экспериментального рабочего процесса. (A) Мышь мозг ломтики электропорангаются с соответствующими конструкциями, и (B) после 12 ч модифицированных корковых интернеров (CI) прекурсоры изолированы и (C) пересаживаются в паллии новорожденных щенков мыши (P0'P2). Для того, чтобы изменить активность незрелых CIs, P14 щенки, которые получили пересадки клеток были введены с CNO или транспортного средства в течение четырех constitutive дней в соответствии с представленным протоколом. (A') Фотография острой мыши мозга ломтик электропорации настройки. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
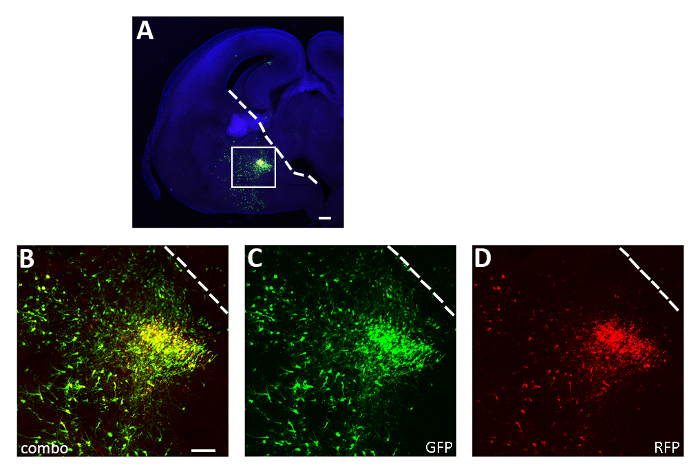
Рисунок 3: Представитель успешного эксперимента по электропорации острых ломтиков. (A) Представитель коронального раздела из E14.5 эмбриона мозга транссексуалов в КГЭ с обеих pCAGGs-IRES-GFP (GFP) и pCAGGs-hM3D (Gq)-IRES-RFP (RFP) плазмиды и культивируется в течение 12 ч. Раздел был иммунозапятнан для GFP (A, B, C) и RFP (A, B, D). Коробочная область в панели А увеличена, чтобы показать выражение обоихфлуоресцентных репортеров (B), GFP (C) и RFP только (D ). Белая линия знаменует край ганглионного выдавства. B-D: одно и то же фото, разные каналы или сочетание двух различных каналов. Шкала баров 200 мкм (A), 100 мкм (B-D). Эта цифра была изменена от Denaxa и др.14. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
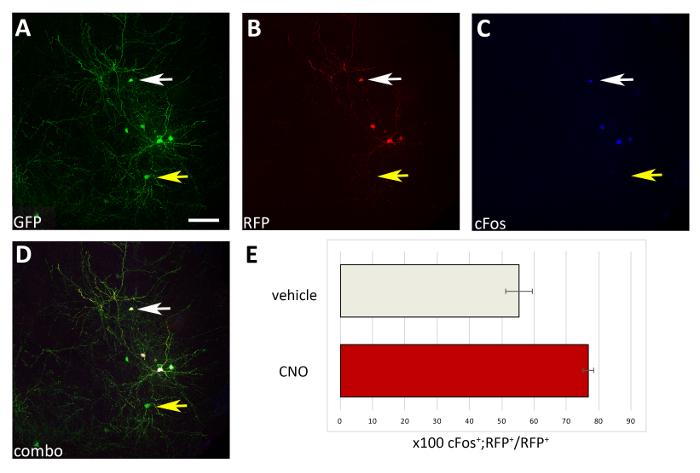
Рисунок 4: Автономное увеличение активности M3D (Gq)-выражение пересаженных CIs на администрации CNO. (A-D) Представитель confocal изображения корональной части мыши P17 пересажены на P1 с прекурсорами CI трансфицируется как pCAGGs-IRES-GFP (GFP) и pCAGGs-hM3D (Gq)-IRES-RFP (RFP) plasmids и лечение CNO. Раздел был иммунозапятнаны для GFP (A), RFP (B), и cFos (C). (D) Комбинированное изображение иммунофлуоресценции A, B и C (комбо). Обратите внимание, что только CIs, выражающие обе плазмиды (белые стрелки в A-D), также являются cFos- по сравнению с CIs, выражающими только плазмид управления GFP (желтые стрелки в A-D). (E) Количественная оценка cFosиRFP- клеток, найденных в паллиуме мышей P17, пересаженных в P1 (нормализованных для общейпопуляции RfP) и обработанных с помощью транспортного средства или CNO (N No 2). A-D: одно и то же фото, различные каналы или комбинация трех различных каналов. Шкала баров 50 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
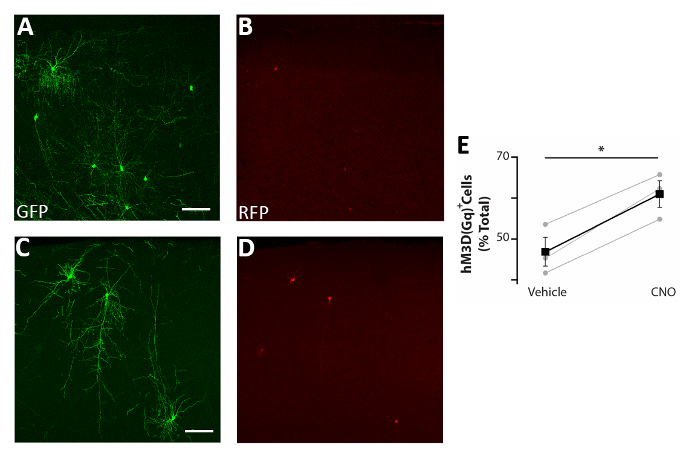
Рисунок 5: Автономное увеличение активности CIs повышает выживаемость . (A-D) Представитель confocal изображения соматосенсорной коры корональных ломтиков P17 мышей пересажены на P0-P2 с прекурсорами CI трансфицируется как pCAGGs-IRES-GFP (GFP) и pCAGGs-hM3D (Gq)-IRES-RFP (RFP) plasmids и лечение с помощью транспортного средства (A-B) (C-D). (E) Количественная оценка RFP- клеток, найденных в предмозгне мышей P17, пересаженных на P0-P2 (нормализованы для общей популяции GFP). RfP(транспортное средство) - 47% - 3%, CNO - 61% - 3%, р- 0,01, Парный образец студента t тест, n - 3 транспортного средства и 3 CNO, минимум 150 клеток, насчитанных на мозг. A и B: одно и то же фото, разные каналы. C и D: одно и то же фото, разные каналы. Шкала баров 50 мкм. Эта цифра была изменена от Denaxa и др.14. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
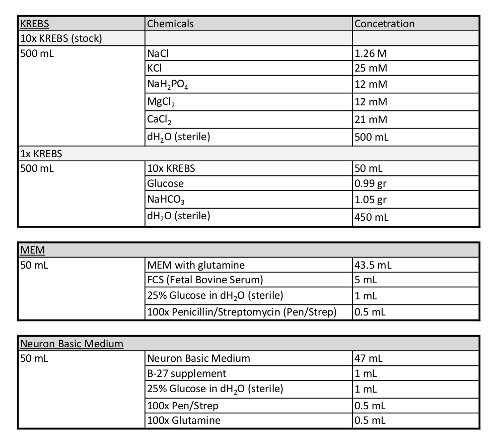
Таблица 1: Дополнительная информация о носителях, используемых в этом протоколе.
Обсуждение
Здесь мы описываем широко доступную методологию для генетический модификации активности прекурсоров КИ для изучения влияния внутренней активности на созревание КИ и/или влияния активности, модулированной CIs на сборку/функцию интегрированной корковой Цепи.
В прошлом, несколько лабораторий, в том числе наша, выполнили в утробе электропорации эксперименты для того, чтобы генетически модифицировать проекционные нейроны6. Тем не менее, в утробе электропорации в ганглияиных выдохов, которые включают CI прародителей очень трудно, из-за проблем электрической проводимости пути. Для того, чтобы решить эту проблему, небольшое количество лабораторий выполняют ультразвуковые управляемые инъекции с последующим электропорированием, что является требовательной техникой, требующей дорогостоящего оборудования. Этот протокол является альтернативой этим методологиям, которая доступна для большинства научных кругов.
Одним из наиболее сложных аспектов этого протокола является максимизация количества клеток, которые выживают в коре хозяина до зрелых стадий, когда фенотипический анализ обычно выполняется (очень зависит от дизайна эксперимента, но обычно старше P17). Есть три ключевых шага, на которые следователь должен обратить внимание: (1) Эффективность электропорации. Это может быть максимально путем обеспечения чистоты плазмидов ДНК. Для этой процедуры следует использовать только высококачественные плазмиды ДНК (коэффициент A260/A280 1,9-2.0). Мы получаем такие высококачественные препараты ДНК, используя очистку ДНК хлорида цезия. Другим важным фактором является промоутер, который управляет выражением гена интереса. Мы обнаружили, что вектор pCAGGs, который состоит из куриного b-актина промотор, является чрезвычайно мощным и может значительно увеличить эффективность электропорации. (2) Количество стартовых эмбрионов донора. Важно убедиться, что большое количество (12-16) эмбрионов той же стадии электропоративаются. Это число может быть увеличено, если больше экспериментаторов выполняют вскрытие эмбрионов и секции вместе, так как важно, чтобы эмбриональные корковые ломтики получены, электропоразаить и передать в инкубатор как можно скорее. (3) Важно, чтобы убедиться, что большое количество клеток вводят в каждого щенка, чтобы обеспечить высокий шанс пересаженной клетки выживания до зрелых стадий. Кроме того, это значительно повысит вероятность успешной трансплантации, так как препараты клеток низкой плотности приведут к неравномерному смешиванию клеток со средой, что приведет к значительной изменчивости пересаженных мозгов15 .
Описанный здесь протокол был разработан для изучения роли деятельности в регулировании выживания КИ в автономном порядке. P14-P17 время окна для выполнения инъекций CNO был специально выбран в соответствии с опубликованными данными, которые показывают, что пик трансплантации CI смерти клеток происходит в течение этого периода16. Таким образом, этот срок или частота инъекций CNO не может иметь право на другие типы клеток или области мозга, и исследователь должен настроить эти параметры в соответствии с конкретными экспериментальными целями. Наконец, методология, описанная здесь для внутричерепных инъекций CIs, осуществима только для p0-P5 pups (в зависимости также от фона линии мыши). В принципе, любые инъекции более P5 потребует истончения или удаления черепа15.
Одним из ключевых преимуществ этого протокола является возможность использования новых генетически закодированных инструментов для визуализации или манипулирования активностью CIs на различных стадиях дифференциации по мере их интеграции в развивающуюся сеть. С темпами открытия новых генетически закодированных датчиков напряжения и кальция, а также новых хемогенетических и оптогенетических инструментов, этот протокол позволяет исследователям использовать их в течение нескольких недель после выпуска в плазмидных репозиториях, таких как Addgene.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Эта работа была поддержана ERC Starter Грант (282047), Wellcome Trust Investigator Award (095589 / q/11 /) грант FP7 EC DESIRE, и Листер институт премии JB. Работа в лаборатории В.П. поддерживается BBSRC (BB/L022974/1), Британским советом медицинских исследований (MRC) и Институтом Фрэнсиса Крика (который получает финансирование от MRC, Cancer Research UK и Wellcome Trust). Исследование в лаборатории m.D. стало по возможности через дар от учредительства Stavros Niarchos к B.S.R.C. Александр Fleming, как часть инициативы учредительства для того чтобы поддержать греческие исследования.
Материалы
| Name | Company | Catalog Number | Comments |
| Medium/Supplements | |||
| B-27 | GIBCO (ThermoFisher Scientific) | 175040-044 | |
| DMEM/F12 | GIBCO (ThermoFisher Scientific) | 21331-020 | |
| DNAse | SIGMA | DN15-100MG | |
| FBS | GIBCO (ThermoFisher Scientific) | 10270-098 | |
| 100x Glutamine | GIBCO (ThermoFisher Scientific) | 35050-061 | |
| L15 | GIBCO (ThermoFisher Scientific) | 11415-049 | |
| MEM alpha, GlutaMAX | GIBCO (ThermoFisher Scientific) | 32561-029 | |
| Neurobasal medium | GIBCO (ThermoFisher Scientific) | 21103-049 | Neuron basic medium |
| 100x P/S | GIBCO (ThermoFisher Scientific) | 15140-122 | |
| Equipment | |||
| Electroporator | BTX | ECM 830 generator | |
| Injector for acute slice electroporation | Eppendorf | FemtoJet Microinjector | |
| Injector for cell transplantation (I) | Visual Sonics | Vevo Injector System | |
| Injector for cell transplantation (II) | WPI | NANOLITER2010 | |
| Magnetic Stand | WPI | M10L Magnetic Stand | |
| Kite Manual Micromanipulator | WPI | KITE-M3-R | |
| Platinum Elecrode (I) | Protech International Inc. | CUY-700-1 | |
| Platinum Elecrode (II) | Protech International Inc. | CUY-700-2 | |
| Steel Base Plate | WPI | 5479 | |
| Vibratome | Leica | VT1200S | |
| Other Material | |||
| Glass capillaries for electroporation | VWR | 1B100-4 | |
| Glass capillaries for cell transplantation | Visual Sonics | provided by Visual Sonics | |
| Nuclepore 8 µm whatman membrane | SLS | 110414 | |
| Organ tissue culture dishes | BD Biosciences (Falcon) | 353037 |
Ссылки
- Marin, O. Interneuron dysfunction in psychiatric disorders. Nature Review Neuroscience. 13 (2), 107-120 (2012).
- Glausier, J. R., Lewis, D. A. GABA and schizophrenia: Where we stand and where we need to go. Schizophrenia Research. 181, 2-3 (2017).
- Fishell, G., Rudy, B. Mechanisms of inhibition within the telencephalon: "where the wild things are". Annual Review Neuroscience. 34, 535-567 (2011).
- Wamsley, B., Fishell, G. Genetic and activity-dependent mechanisms underlying interneuron diversity. Nature Review Neuroscience. 18 (5), 299-309 (2017).
- Xu, Q., Cobos, I., De La Cruz, E., Rubenstein, J. L., Anderson, S. A. Origins of cortical interneuron subtypes. Journal of Neuroscience. 24 (11), 2612-2622 (2004).
- Denaxa, M., et al. Maturation-promoting activity of SATB1 in MGE-derived cortical interneurons. Cell Reports. 2 (5), 1351-1362 (2012).
- Wichterle, H., Garcia-Verdugo, J. M., Herrera, D. G., Alvarez-Buylla, A. Young neurons from medial ganglionic eminence disperse in adult and embryonic brain. Nature Neuroscience. 2 (5), 461-466 (1999).
- Alvarez-Dolado, M., et al. Cortical inhibition modified by embryonic neural precursors grafted into the postnatal brain. Journal of Neuroscience. 26 (28), 7380-7389 (2006).
- Baraban, S. C., et al. Reduction of seizures by transplantation of cortical GABAergic interneuron precursors into Kv1.1 mutant mice. Proccedings of the National Academy of Sciences of the United States of America. 106 (36), 15472-15477 (2009).
- Southwell, D. G., et al. Interneurons from embryonic development to cell-based therapy. Science. 344 (6180), 1240622 (2014).
- Vogt, D., et al. Viral-mediated Labeling and Transplantation of Medial Ganglionic Eminence (MGE) Cells for In Vivo Studies. Journal of Visualized Experiments. (98), e52740 (2015).
- De Marco Garcia, N. V., Karayannis, T., Fishell, G. Neuronal activity is required for the development of specific cortical interneuron subtypes. Nature. 472 (7343), 351-355 (2011).
- Urban, D. J., Roth, B. L. DREADDs (designer receptors exclusively activated by designer drugs): chemogenetic tools with therapeutic utility. Annual Review of Pharmacology and Toxicology. 55, 399-417 (2015).
- Denaxa, M., et al. Modulation of Apoptosis Controls Inhibitory Interneuron Number in the Cortex. Cell Reports. 22 (7), 1710-1721 (2018).
- Quatrocolo, G., et al. Homochronic Transplatation of Interneuron Precursors into Early Postnatal Mouse Brains. Journal of Visualized Experiments. (136), e57723 (2018).
- Southwell, D. G., et al. Intrinsically determined cell death of developning cortical interneurons. Nature. 491 (7422), 103-113 (2012).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены